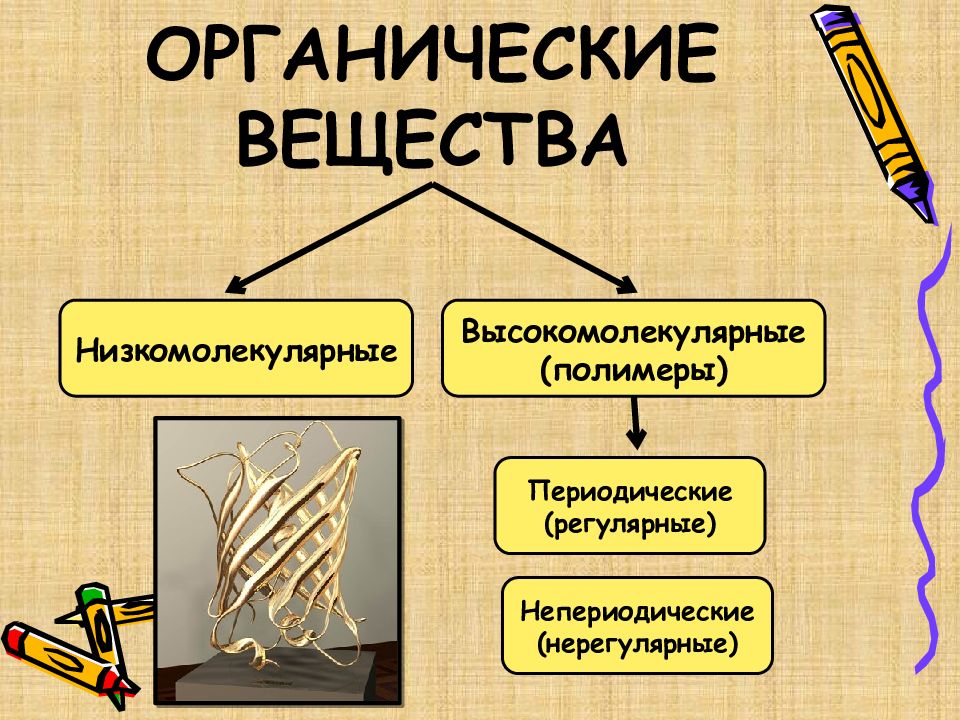
Слайд 2: ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
Низкомолекулярные Высокомолекулярные (полимеры) Периодические (регулярные) Непериодические (нерегулярные)
Слайд 3
Белки (протеины) – это высо - комолекулярные непериоди - ческие полимерные соединения мономерами которых служат аминокислоты. В организмах – 170 видов аминокислот В составе белков – 20 видов аминокислот
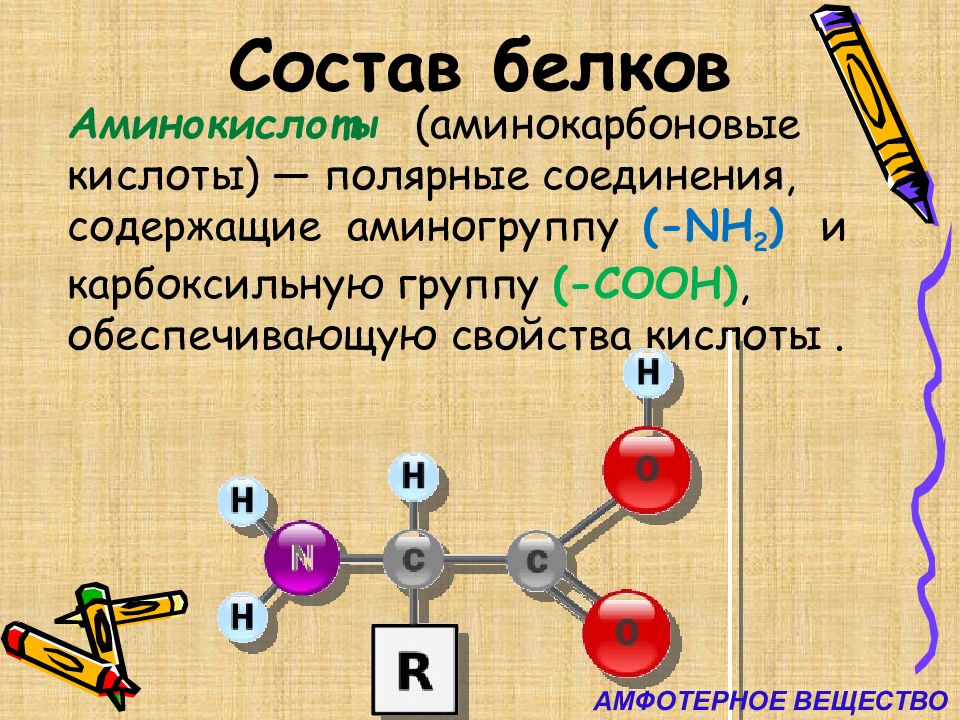
Слайд 4: Состав белков
Аминокислоты (аминокарбоновые кислоты) — полярные соединения, содержащие аминогруппу ( - NH 2 ) и карбоксильную группу ( - COOH), обеспечивающую свойства кислоты. АМФОТЕРНОЕ ВЕЩЕСТВО
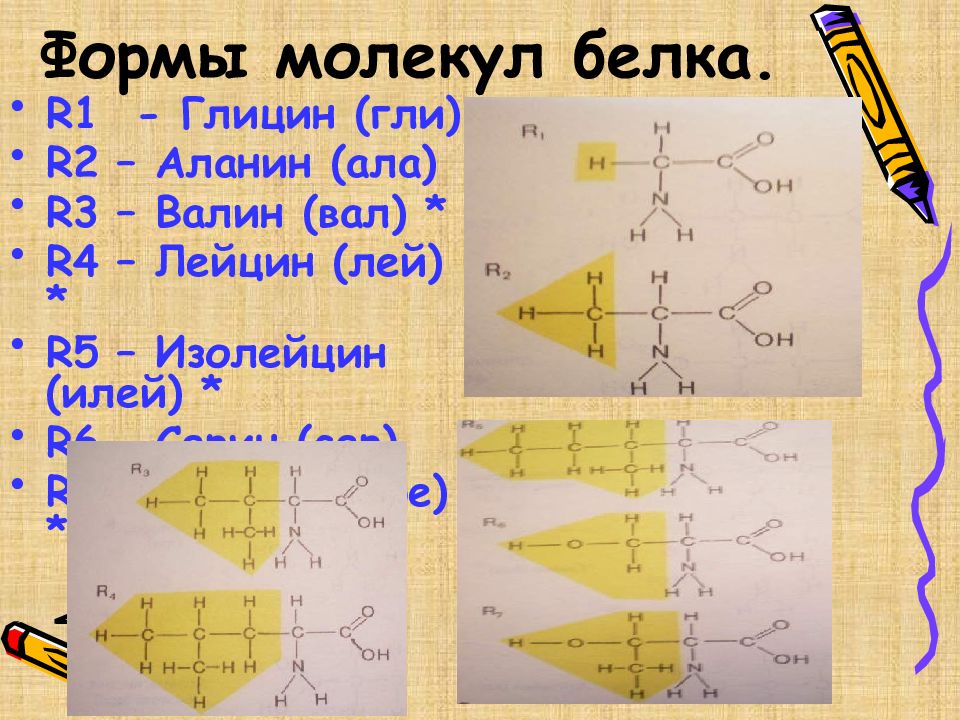
Слайд 5: Формы молекул белка
R1 - Глицин (гли) R2 – Аланин (ала) R3 – Валин (вал) * R4 – Лейцин (лей) * R5 – Изолейцин (илей) * R6 – Серин (сер) R7 – Треонин (тре) *
Слайд 6
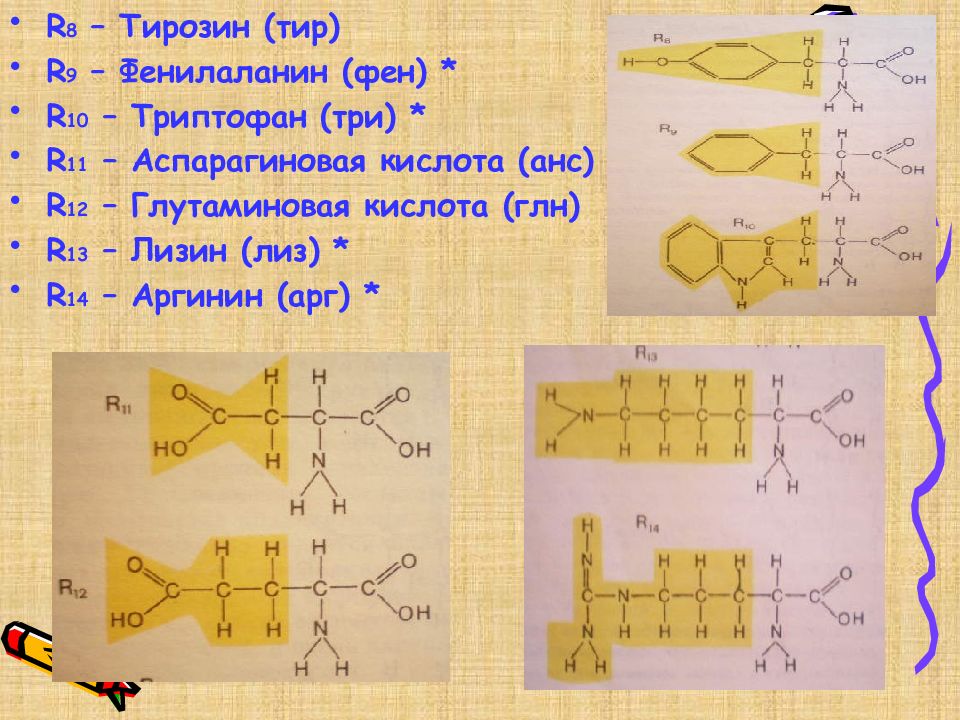
R 8 – Тирозин ( тир ) R 9 – Фенилаланин (фен) * R 10 – Триптофан (три) * R 11 – Аспарагиновая кислота (анс) R 12 – Глутаминовая кислота (глн) R 13 – Лизин (лиз) * R 14 – Аргинин (арг) *
Слайд 7
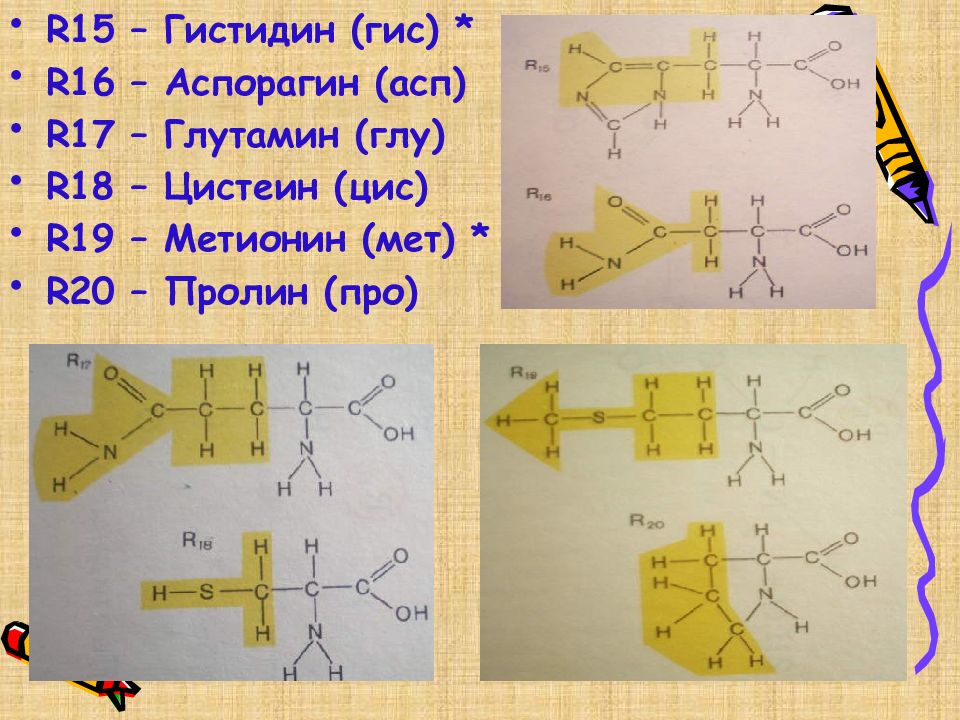
R15 – Гистидин (гис) * R16 – Аспорагин (асп) R17 – Глутамин (глу) R18 – Цистеин (цис) R19 – Метионин (мет) * R20 – Пролин (про)
Слайд 8: Виды радикалов:
гидрофобные (глицин, аланин, валин, изолейцин, лейцин, фенилаланин, тирозин, метионин) гидрофильные (остальные 12) кислотные (аспарагиновая кислота, глутаминовая кислота) основные (лизин, аргинин, гистидин)
Слайд 9
В зависимости от аминокислотного состава, белки бывают: 1. Полноценными – белки, содержащие весь набор аминокислот (20 разных аминокислот); 2. Неполноценными – белки, в составе которых какие-то аминокислоты отсутствуют. Аминокислоты Заменимые синтезируются в организме (10) Незаменимые в организме не синтезируются (10)
Слайд 10
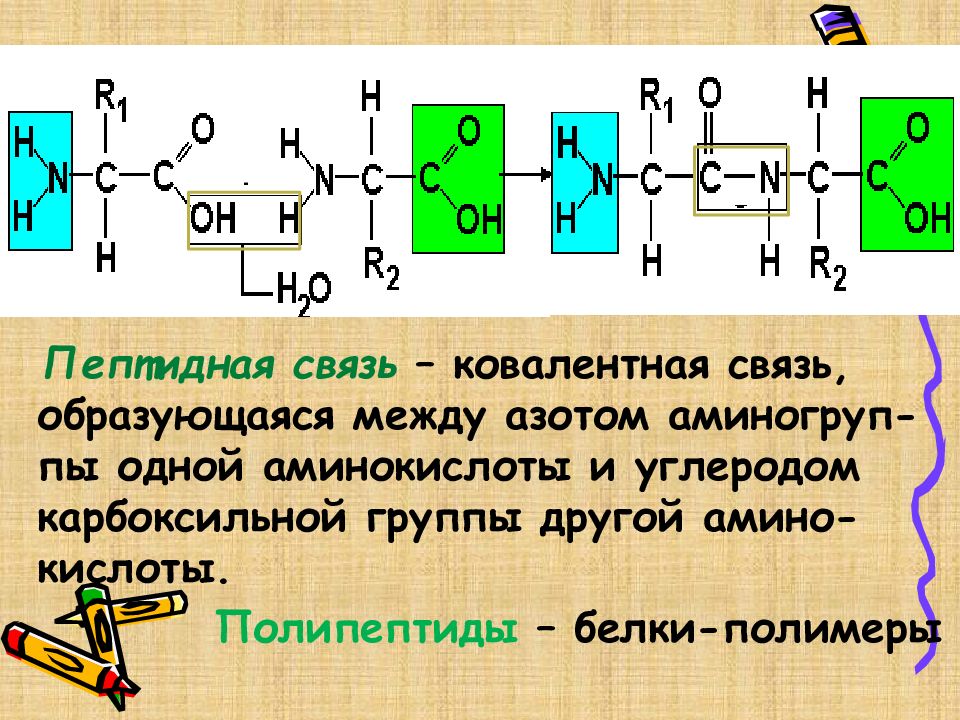
Пептидная связь – ковалентная связь, образующаяся между азотом аминогруп- пы одной аминокислоты и углеродом карбоксильной группы другой амино- кислоты. Полипептиды – белки-полимеры
Слайд 11: Структуры белка
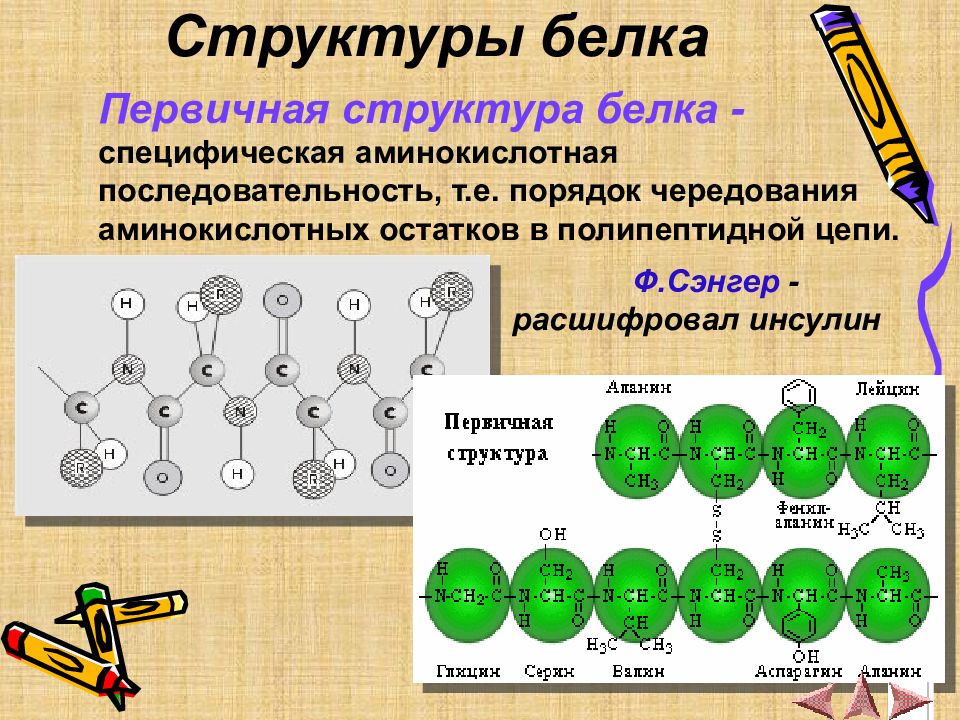
Первичная структура белка - специфическая аминокислотная последовательность, т.е. порядок чередования аминокислотных остатков в полипептидной цепи. Ф.Сэнгер - расшифровал инсулин
Слайд 12
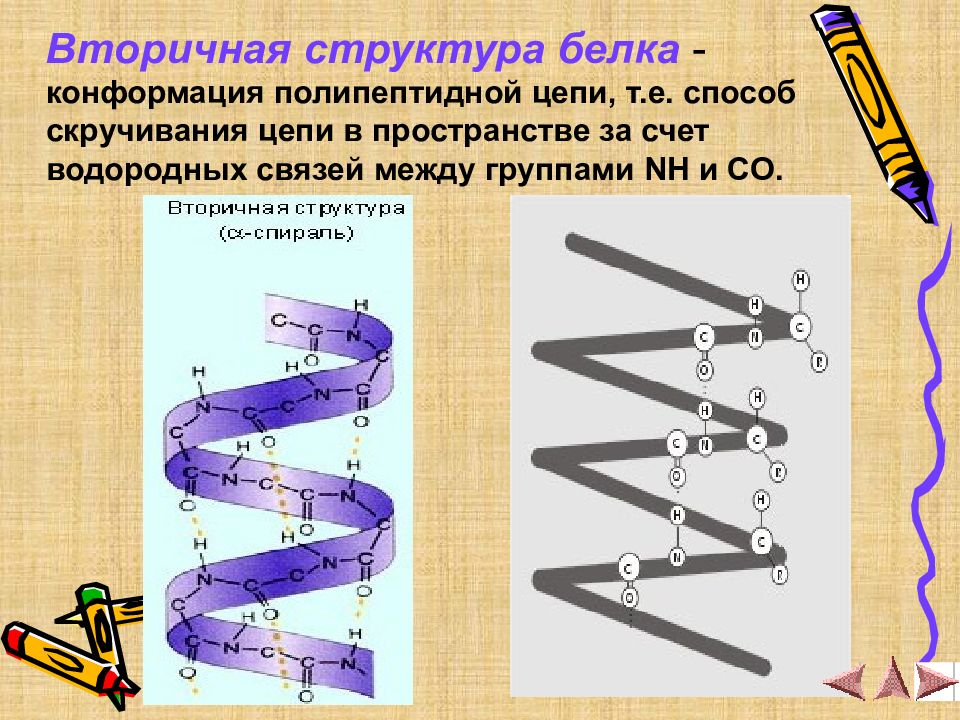
Вторичная структура белка - конформация полипептидной цепи, т.е. способ скручивания цепи в пространстве за счет водородных связей между группами NH и CO.
Слайд 13
Третичная структура белка - форма закрученной спирали в пространстве, образованная главным образом за счет дисульфидных мостиков -S-S-, водородных связей, гидрофобных и ионных взаимодействий.
Слайд 14
Четвертичная структура белка – агрегаты нескольких белковых макромолекул (белковые комплексы), образованные за счет взаимодействия разных полипептидных цепей Глобулы удерживаются вместе благодаря ионным, гидрофильно-гидрофобным и электростатическим взаимодействиям.
Слайд 16: Свойства белков
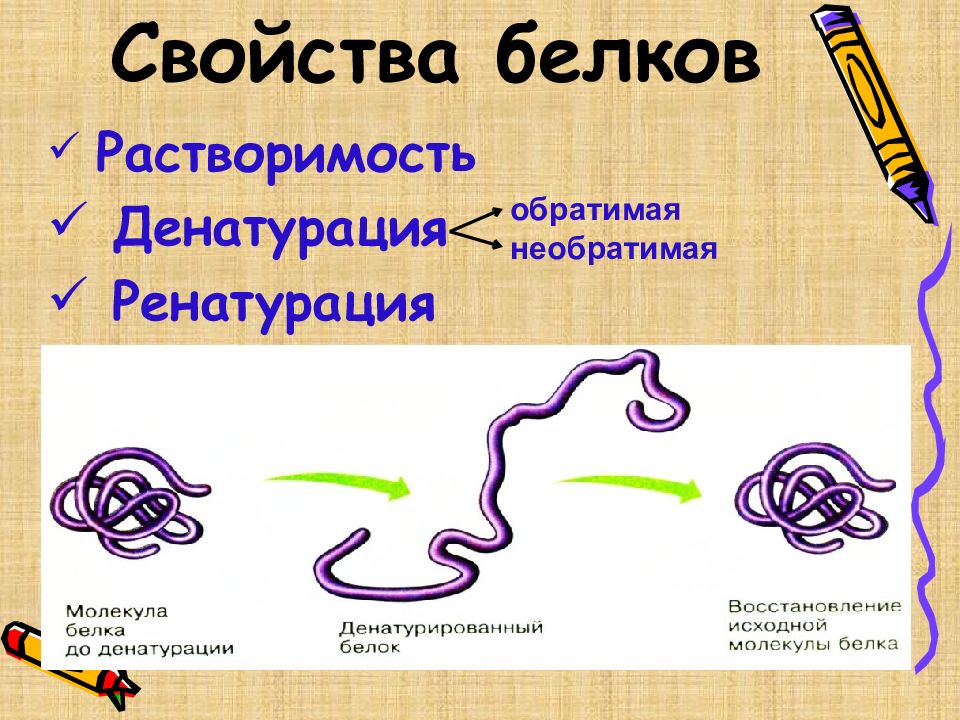
Растворимость Денатурация Ренатурация обратимая необратимая
Слайд 17: Виды белков
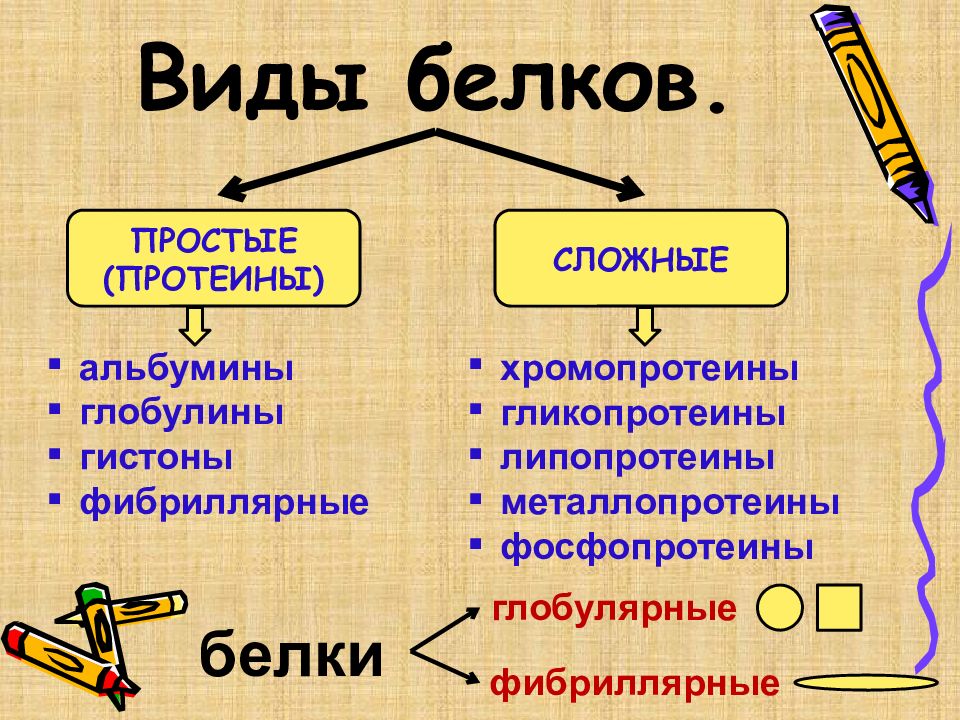
ПРОСТЫЕ (ПРОТЕИНЫ) СЛОЖНЫЕ альбумины глобулины гистоны фибриллярные хромопротеины гликопротеины липопротеины металлопротеины фосфопротеины белки глобулярные фибриллярные
Слайд 19
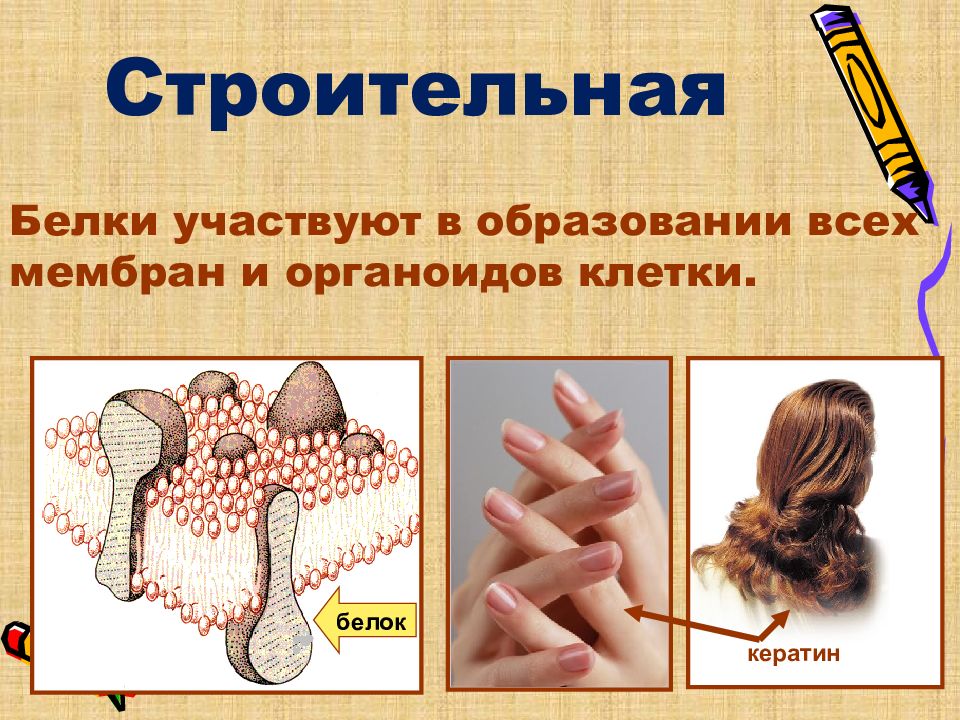
Строительная Белки участвуют в образовании всех мембран и органоидов клетки. белок кератин
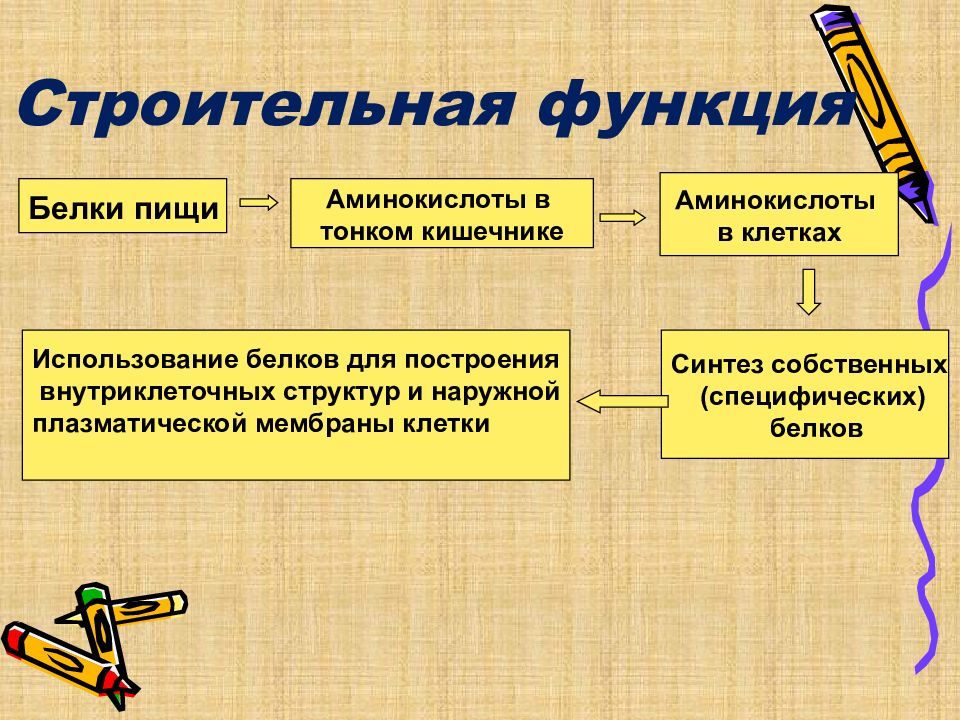
Слайд 20: Строительная функция
Белки пищи Аминокислоты в тонком кишечнике Аминокислоты в клетках Использование белков для построения внутриклеточных структур и наружной плазматической мембраны клетки Синтез собственных (специфических) белков
Слайд 21
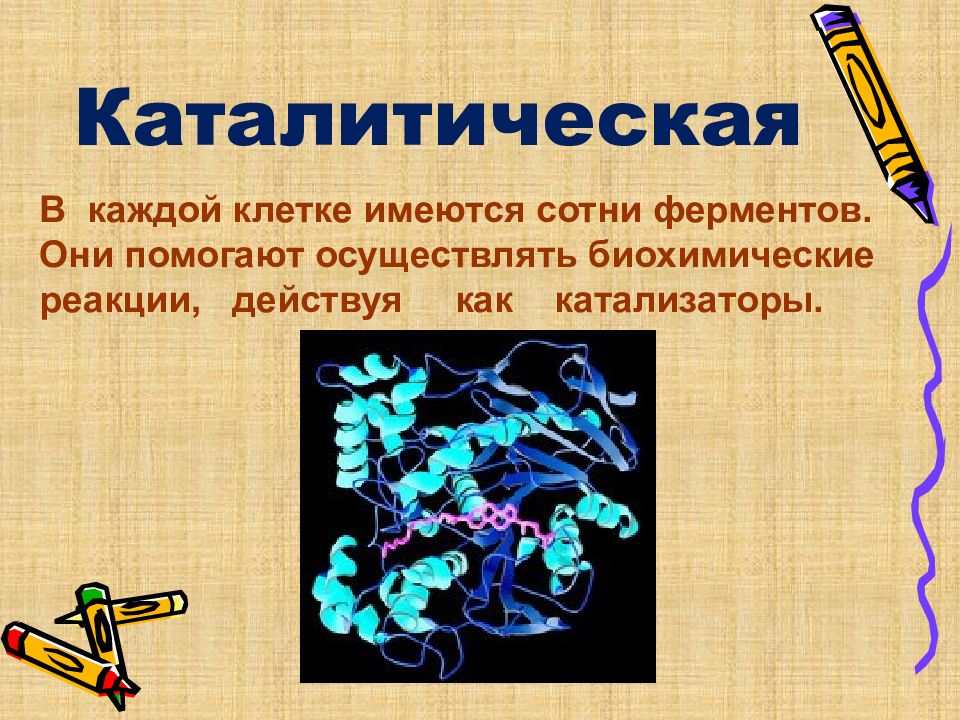
Каталитическая В каждой клетке имеются сотни ферментов. Они помогают осуществлять биохимические реакции, действуя как катализаторы.
Слайд 22
Транспортная Белки связывают и переносят различные вещества и внутри клетки, и по всему организму. Например, г е м о г л о б и н крови переносит кислород.
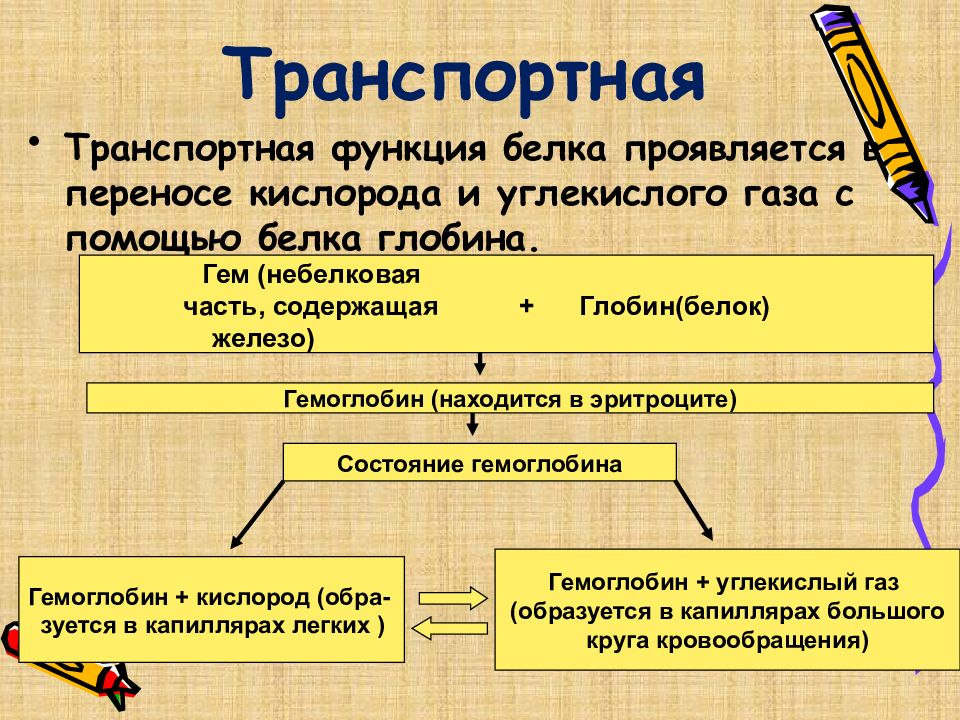
Слайд 23: Транспортная
Транспортная функция белка проявляется в перенос e кислорода и углекислого газа с помощью белка глобина. Гем (небелковая часть, содержащая + Глобин(белок) железо) Гемоглобин (находится в эритроците) Состояние гемоглобина Гемоглобин + кислород (обра- зуется в капиллярах легких ) Гемоглобин + углекислый газ (образуется в капиллярах большого круга кровообращения)
Слайд 24
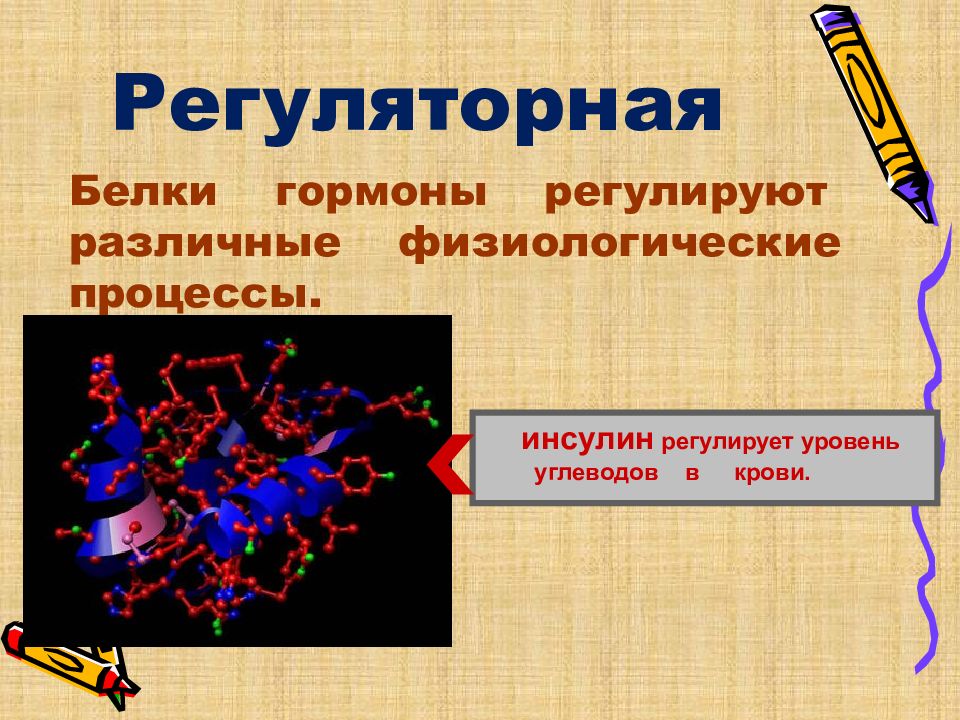
Регуляторная Белки гормоны регулируют различные физиологические процессы. инсулин регулирует уровень углеводов в крови.
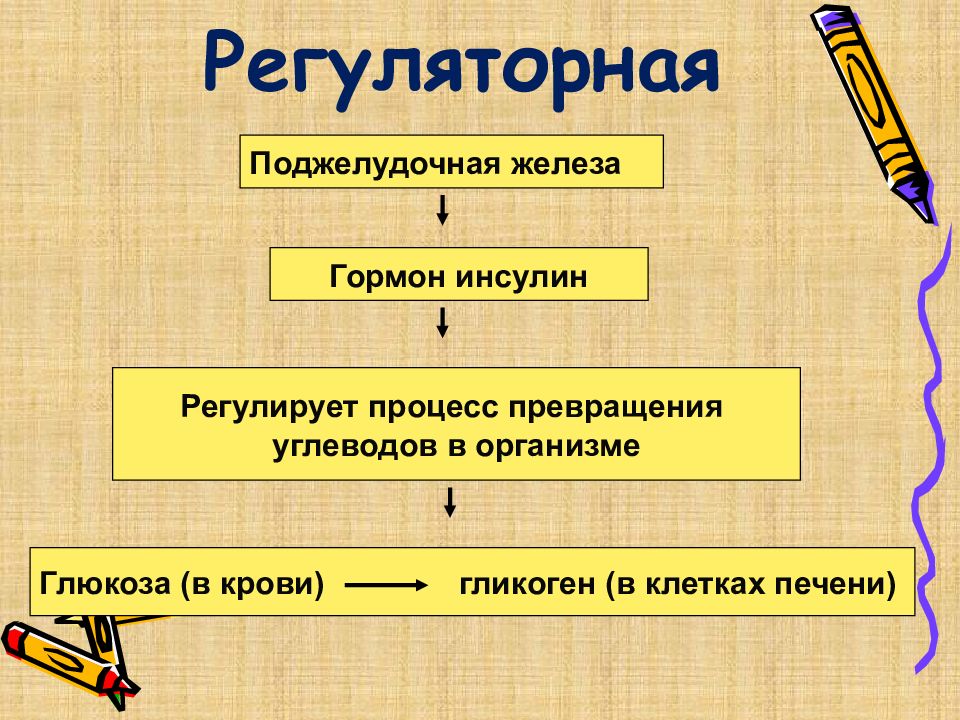
Слайд 25: Регуляторная
Поджелудочная железа Гормон инсулин Регулирует процесс превращения углеводов в организме Глюкоза (в крови) гликоген (в клетках печени)
Слайд 26
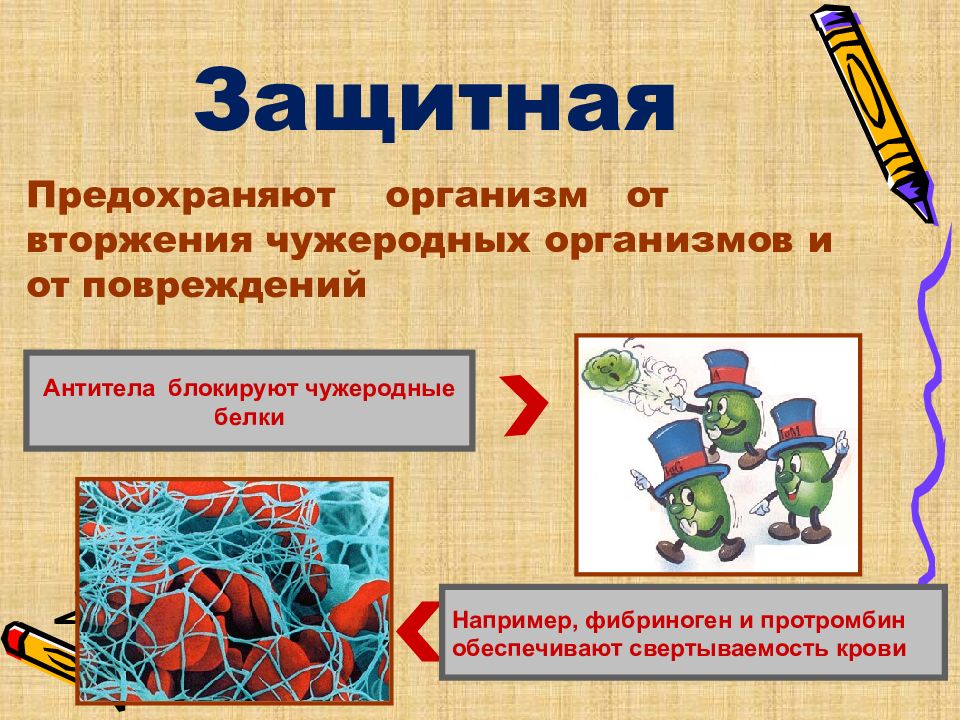
Защитная Например, фибриноген и протромбин обеспечивают свертываемость крови Антитела блокируют чужеродные белки Предохраняют организм от вторжения чужеродных организмов и от повреждений
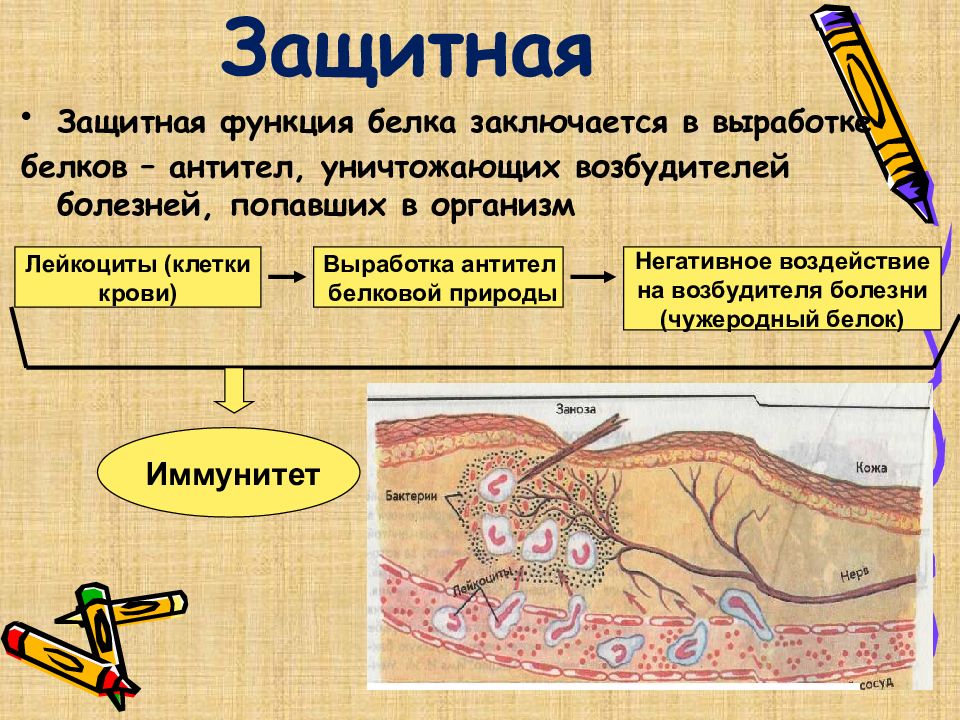
Слайд 27: Защитная
Защитная функция белка заключается в выработке белков – антител, уничтожающих возбудителей болезней, попавших в организм Лейкоциты (клетки крови) Выработка антител белковой природы Негативное воздействие на возбудителя болезни (чужеродный белок) Иммунитет
Слайд 28
Сократительная Белки - участвуют в сокращении мышечных волокон. Актин и миозин – белки мышц
Слайд 29
Сигнальная (рецепторная) Белки способны реагировать на изменение условий среды. Обеспечивают организму свойство РАЗДРАЖИМОСТИ
Слайд 30
Энергетическая 1г белка - 17.6 кДж При недостатке углеводов или жиров окисляются молекулы аминокислот. При полном расщеплении белка до конечных продуктов выделяется энергия: Но в качестве источника энергии белки используются крайне редко. !!!
Слайд 31
Определите функции белков: Коллаген сухожилий Яичный альбумин Инсулин Кератин волос Тромбин крови Родопсин сетчатки Альбумин крови Интерферон
Слайд 33
Ферменты - от латинского fermentum – закваска Ферменты - энзимы Ферменты - белковые специфические катализаторы Ферменты стимулируют обмен веществ Субстрат – вещество, связывающееся с ферментом для осуществления реакции
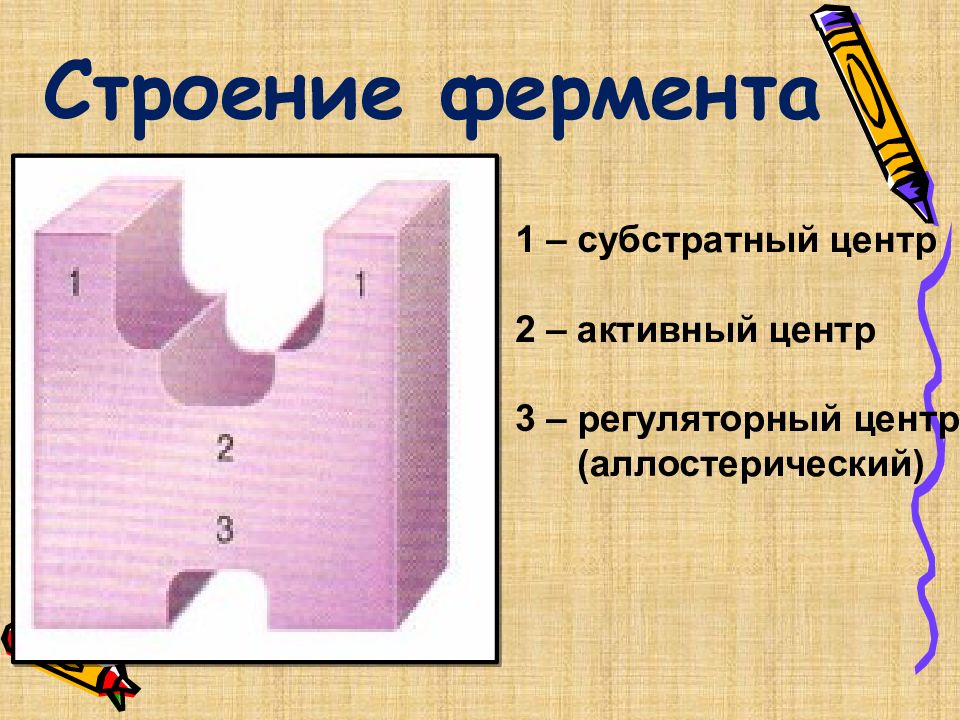
Слайд 34: Строение фермента
1 – субстратный центр 2 – активный центр 3 – регуляторный центр (аллостерический)
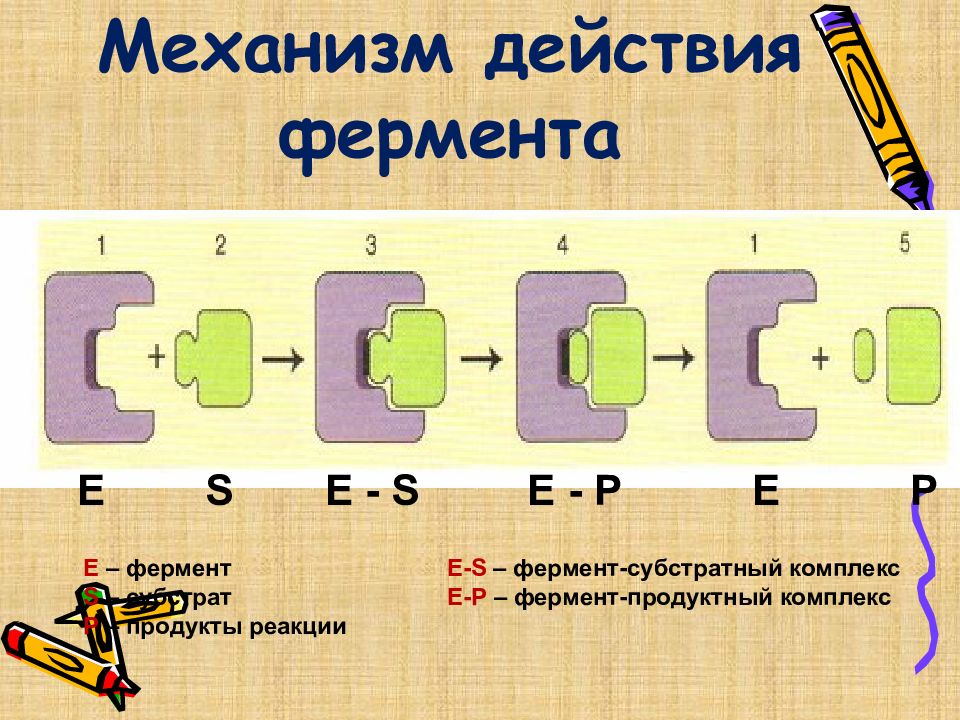
Слайд 35: Механизм действия фермента
Е S E - S E - P Е P E – фермент Е- S – фермент-субстратный комплекс S – субстрат E- Р – фермент-продуктный комплекс Р – продукты реакции