Слайд 3: НЕОБХОДИМЫЕ ДЛЯ РАБОТЫ
ПОПОВА Л.Ф. ЛАБОРАТОРНЫЙ ПРАКТИКУМ ПО АНАЛИТИЧЕСКОЙ ХИМИИ (издание третье): http://rucont.ru/efd/208392
Слайд 4: ЧТО ТАКОЕ АНАЛИТИЧЕСКАЯ ХИМИЯ?
АХ – это наука, развивающая теоретические основы анализа химического состава веществ, разрабатывающая методы идентификации и обнаружения, определения и разделения химических элементов, их соединений, а также методы установления химического строения соединений (Алимарин И.П.). АХ – наука о методах определения химического состава вещества и его структуры. Предмет аналитической химии – теория и практика химического анализа. Химический анализ – это совокупность действий, которые имеют своей целью получение информации о химическом составе анализируемого объекта.
Слайд 5: ЗАДАЧИ АНАЛИТИЧЕСКОЙ ХИМИИ
Разработка новых более чувствительных, точных, быстрых и специфических методов анализа; Совершенствование существующих методов; Глубокое изучение строения и химических свойств веществ, теории и практики химического анализа; Синтез новых реагентов; Автоматизация и компьютеризация методов анализа. Главная задача химика-аналитика – получение правильной информации. Это обеспечивается созданием оптимальных условий проведения анализа. АХ – это наука о методах и средствах химического анализа.
Слайд 6: ЗНАЧЕНИЕ АХ
Все основные химические законы открыты с помощью методов этой науки. Состав различных материалов, руд, минералов был установлен методами АХ. Методами АХ открыт ряд элементов ПС (аргон, германий и др.). Современные химические исследования (синтез новых веществ, разработка технологий)широко применяют методы АХ. Контроль технологических процессов и производств. Экологический контроль. Сельское хозяйство, медицина, биология невозможны без АХ. Геология, фармацевтическая, лакокрасочная, нефтехимическая и др. отрасли промышленности опираются на методы АХ.
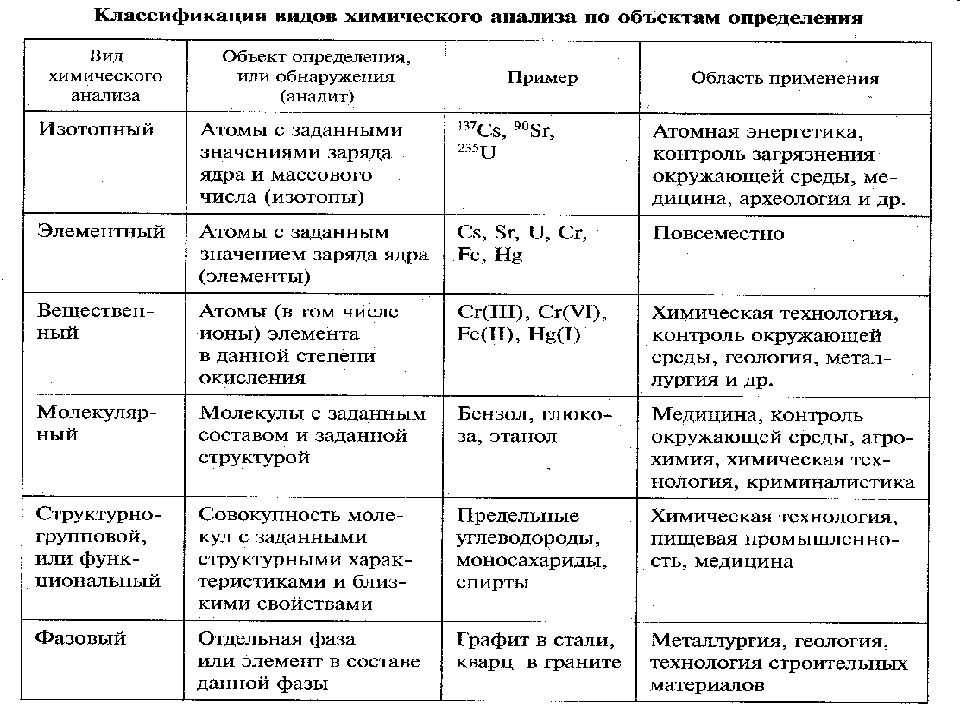
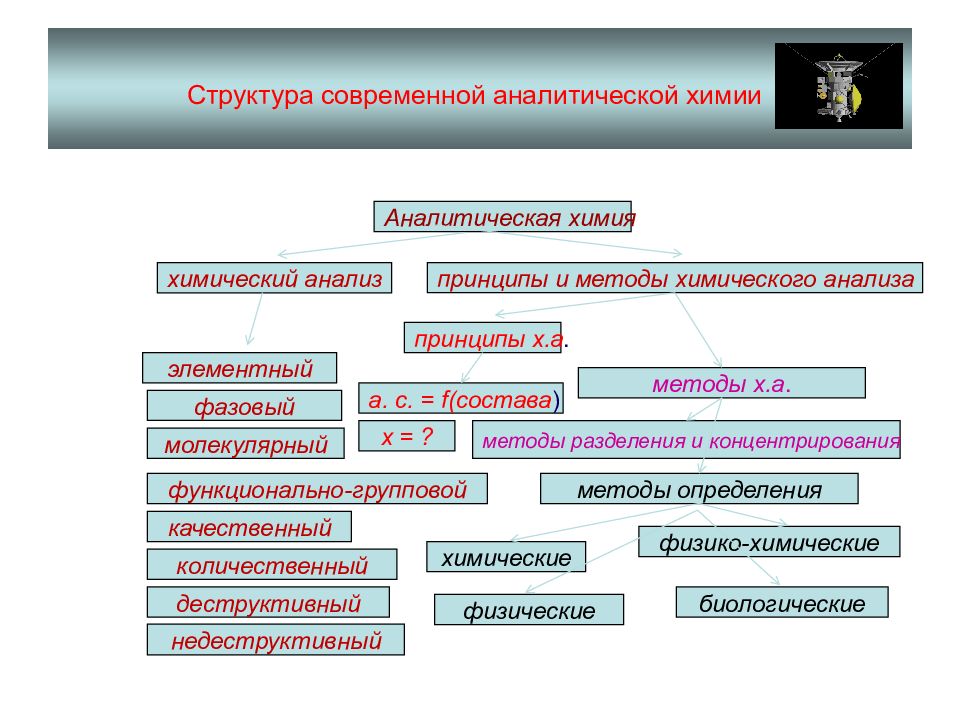
По характеру получения информации: качественный, количественный (валовый, локальный), структурный. По объектам анализа: технический, агрохимический, криминалистический, гидрохимический, клинический, фармацевтический и др.. По объектам определения: аналитный, элементный, вещественный, молекулярный, функциональный, фазовый. По точности, продолжительности и стоимости анализа: экспресс, тест, арбитражный, рутинный.
Слайд 10: СТРУКТУРА СОВРЕМЕННОЙ АХ
Качественный анализ – установление химического состава анализируемого объекта (включает идентификацию объекта и обнаружение отдельных компонентов). Количественный анализ – определение содержания (концентрации) отдельных компонентов в анализируемом объекте. Структурный анализ – определение структуры соединения (взаимного расположения и связей элементарных составных частей в молекулах). Другие анализы – локально-распределительный, кинетический и др.
Слайд 11: ОСНОВНЫЕ ПОНЯТИЯ АХ
Идентификация – установление тождества исследуемого соединения с уже известным веществом путем сравнения их физических и химических свойств. Обнаружение – проверка присутствия в анализируемом объекте отдельных компонентов. Метод анализа – это совокупность принципов, положенных в основу анализа вещества. Принцип анализа определяется явлениями природы, лежащими в основе физического или химического процесса. Вид анализа – это способ или специальный прием выполнения определения. Методика – это подробное описание всех условий и операций проведения анализа конкретного объекта.
Слайд 12: СТАДИИ АНАЛИТИЧЕСКОГО ПРОЦЕССА
Анализ – это процедура получения опытным путем данных о химическом составе вещества. Основные стадии: Пробоотбор. Пробоподготовка (разложение, маскирование и разделение компонентов) Собственно анализ (измерение аналитического сигнала) Оценка результатов измерения.
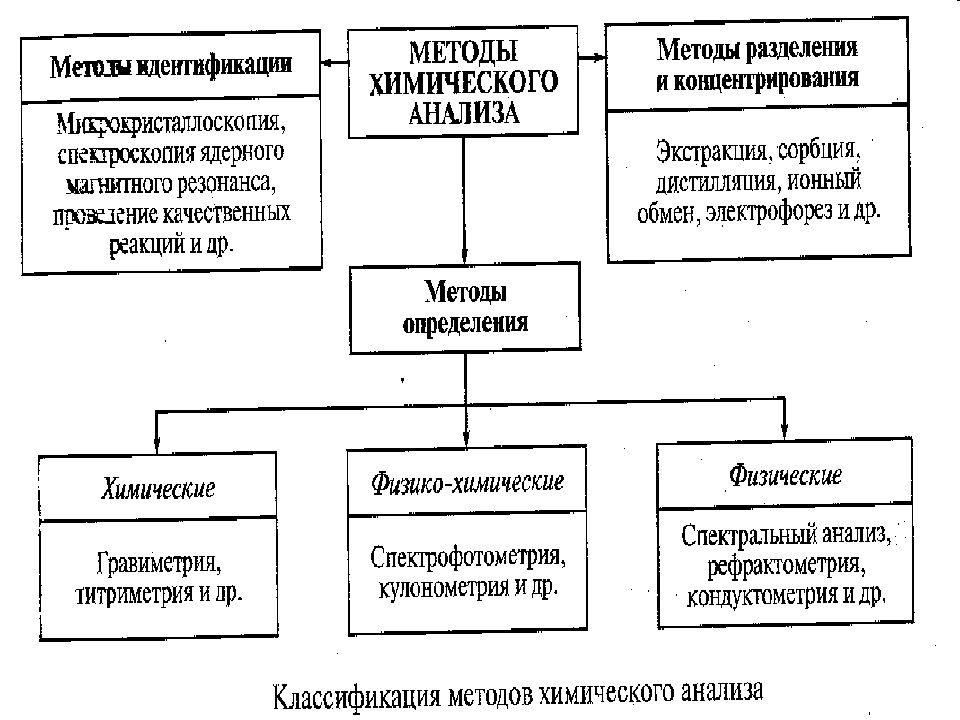
Слайд 14: МЕТОДЫ ОБНАРУЖЕНИЯ И ОПРЕДЕЛЕНИЯ
Инструментальные (требуют использование приборов): Физические (основаны на физических явлениях и процессах); Физико-химические (основаны на химических реакциях, аналитический эффект которых фиксируется приборами). Химические (основаны на химических реакциях, аналитический эффект которых фиксируется органолептически). Биологические (основаны на явлении жизни).
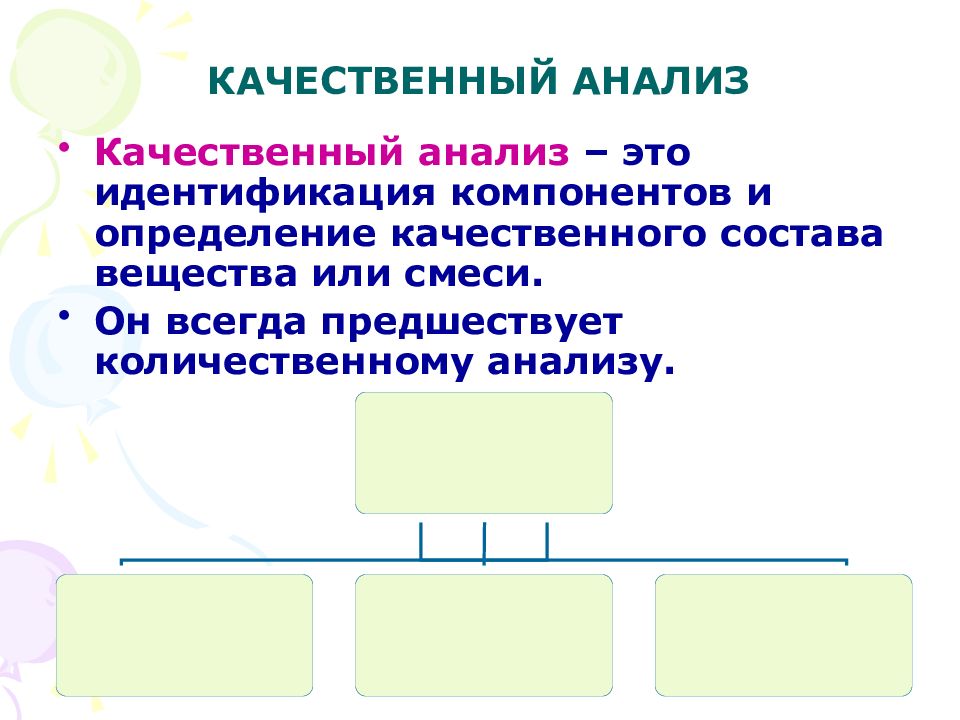
Слайд 15: КАЧЕСТВЕННЫЙ АНАЛИЗ
Качественный анализ – это идентификация компонентов и определение качественного состава вещества или смеси. Он всегда предшествует количественному анализу.
Слайд 16: ХИМИЧЕСКИЕ МЕТОДЫ КАЧЕСТВЕННОГО АНАЛИЗА
В зависимости от способа выполнения бывают двух видов сухие и мокрые: Сухие – проводятся без перевода твердого вещества в раствор. Анализируемый раствор предварительно выпаривается. Мокрые – анализируемое вещество предварительно растворяется в подходящем растворителе и затем полученный раствор подвергается анализу.
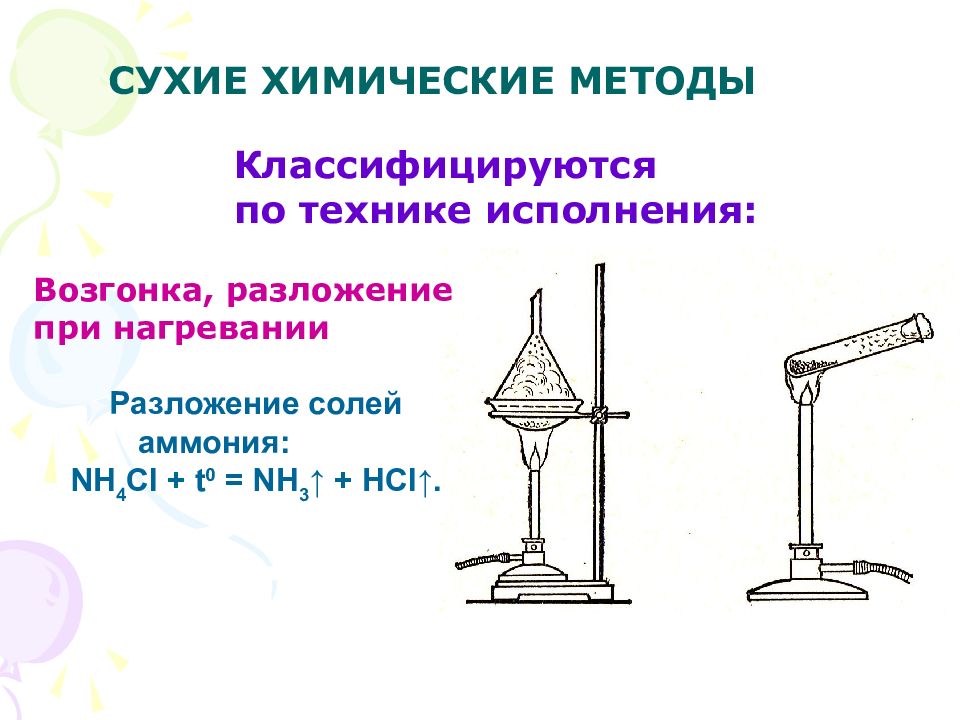
Слайд 17: СУХИЕ ХИМИЧЕСКИЕ МЕТОДЫ
Возгонка, разложение при нагревании Классифицируются по технике исполнения: Разложение солей аммония: NH 4 Cl + t 0 = NH 3 ↑ + HCl ↑.
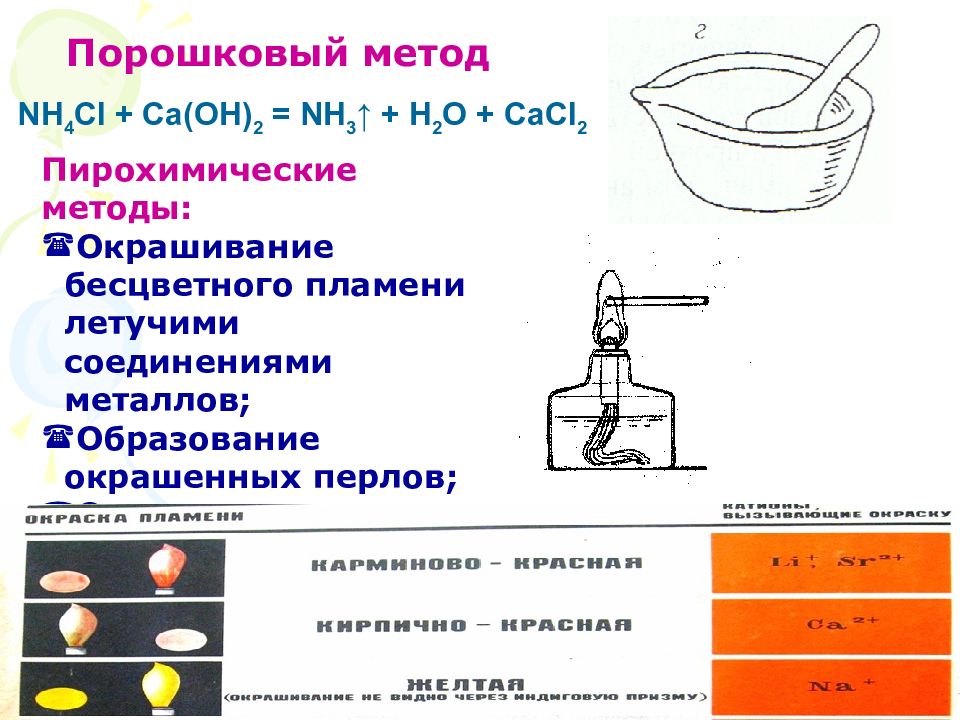
Слайд 18
Порошковый метод Пирохимические методы: Окрашивание бесцветного пламени летучими соединениями металлов; Образование окрашенных перлов; Окраска пепла. NH 4 Cl + Ca( OH ) 2 = NH 3 ↑ + H 2 O + CaCl 2
Слайд 19: МОКРЫЕ ХИМИЧЕСКИЕ МЕТОДЫ
Классифицируются в зависимости от массы анализируемого вещества и объема раствора: Макроанализ – m = 10 -1 – 1,0 г ; v = 10 – 100 мл. Полумикроанализ – m = 10 -1 - 10 -2 г ; v = 10 -1 – 10 мл. Микроанализ – m = 10 -2 - 10 -3 г ; v = 10 -1 – 10 -2 мл. Ультрамикроанализ – m = 10 -6 - 10 -9 г ; v = 10 -3 – 10 -4 мл. Субмикроанализ – m = 10 -9 - 10 -12 г ; v = 10 -5 – 10 -7 мл.
Слайд 20: МЕТОДИЧЕСКИЕ ПРИЕМЫ МОКРЫХ МЕТОДОВ
ПОЛУМИКРОАНАЛИЗ: Пробирочный – опыты проводят в пробирках, осадок отделяют центрифугированием; Экстракционный – определяемый компонент взаимодействует с реагентом в водной фазе, продукт реакции извлекается в другой (органический) растворитель. Опыт проводят в пробирках с притертыми пробками. Экстракция осуществляется при сильном встряхивании смеси. Каталитический – опыт проводят в пробирках, для ускорения реакции используют катализаторы.
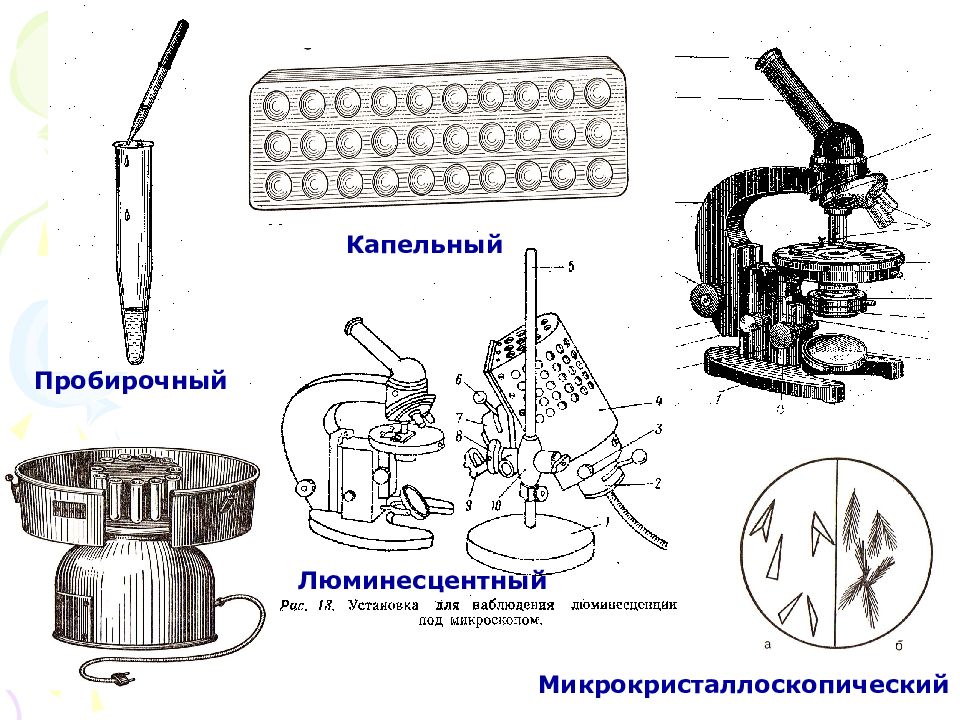
Слайд 21: МЕТОДИЧЕСКИЕ ПРИЕМЫ МОКРЫХ МЕТОДОВ
МИКРОАНАЛИЗ: Капельный – реакция проводится на капельной пластинке-палетке, предметном стекле или фильтровальной бумаге. Вещества добавляются по каплям. Люминесцентный – реакция проводится капельно на предметном стекле или фильтровальной бумаге. Влажное пятно высушивается на воздухе и облучается УФ-светом. При этом наблюдается свечение (люминесценция). Требуется контрольный опыт. Микрокристаллоскопический – реакция проводится капельно на предметном стекле. Полученный осадок рассматривается под микроскопом.
Слайд 23: АНАЛИТИЧЕСКАЯ ХИМИЧЕСКАЯ РЕАКЦИЯ, ЕЕ ХАРАКТЕРИСТИКИ
Химическая реакция, сопровождающаяся аналитическим эффектом, по которому можно судить о наличии определяемого компонента, называется аналитической реакцией. Качественные аналитические реакции проводят добавляя к раствору неизвестного вещества (анализируемому раствору) другое известное вещество, называемое реагентом (реактивом). В АХ выделяют четыре типа аналитических реакций: кислотно-основные, осадительные, окислительно-восстановительные, реакции комплексообразования.
Слайд 24: АНАЛИТИЧЕСКАЯ ХИМИЧЕСКАЯ РЕАКЦИЯ, ЕЕ ХАРАКТЕРИСТИКИ
Аналитические реакции должны удовлетворять следующим требованиям: Сопровождаться аналитическим эффектом (внешним признаком); Иметь высокую чувствительность (низкий предел обнаружения); Иметь достаточную избирательность.
Слайд 25: АНАЛИТИЧЕСКИЙ ЭФФЕКТ РЕАКЦИИ
Образование осадка с определенными свойствами. Получение окрашенного растворимого соединения. Выделение газа с известными свойствами. Изменение окраски индикаторов (для кислот и щелочей).
Слайд 26: ЧУВСТВИТЕЛЬНОСТЬ РЕАКЦИИ
Это возможность открывать какой-то компонент в определенной его концентрации. Реакция тем более чувствительна, чем меньшую концентрацию иона с ее помощью можно обнаружить. Количественная характеристика чувствительности – открываемый минимум (m). Это наименьшая масса компонента, содержащаяся в анализируемом растворе и открываемая данным реагентом при определенных условиях проведения реакции. Измеряется в микрограммах (мкг): 1 мкг = 10 -6 г. Реакция считается аналитической, если m ≤ 50 мкг.
Слайд 27: ИЗБИРАТЕЛЬНОСТЬ РЕАКЦИИ
Это возможность открывать один или несколько компонентов в присутствии других (в сложных смесях). Реакция тем более избирательна, чем с меньшим числом компонентов она протекает. По избирательности аналитические реакции и реагенты делятся: Групповые – позволяют открывать целую группу компонентов (ионов): HCl открывает 2-я группу катионов. Селективные – позволяет открывать несколько ионов, принадлежащих разным аналитическим группам: KSCN открывает ионы кобальта и железа (Ш). Специфические – открывают один ион в присутствии всех других ионов: щелочь при нагревании позволяет обнаружить ионы аммония.
Слайд 28: УСЛОВИЯ ВЫПОЛНЕНИЯ АНАЛИТИЧЕСКИХ РЕАКЦИЙ
Реакция среды раствора. Температурный режим проведения реакции. Концентрация определяемого иона и используемого реагента.
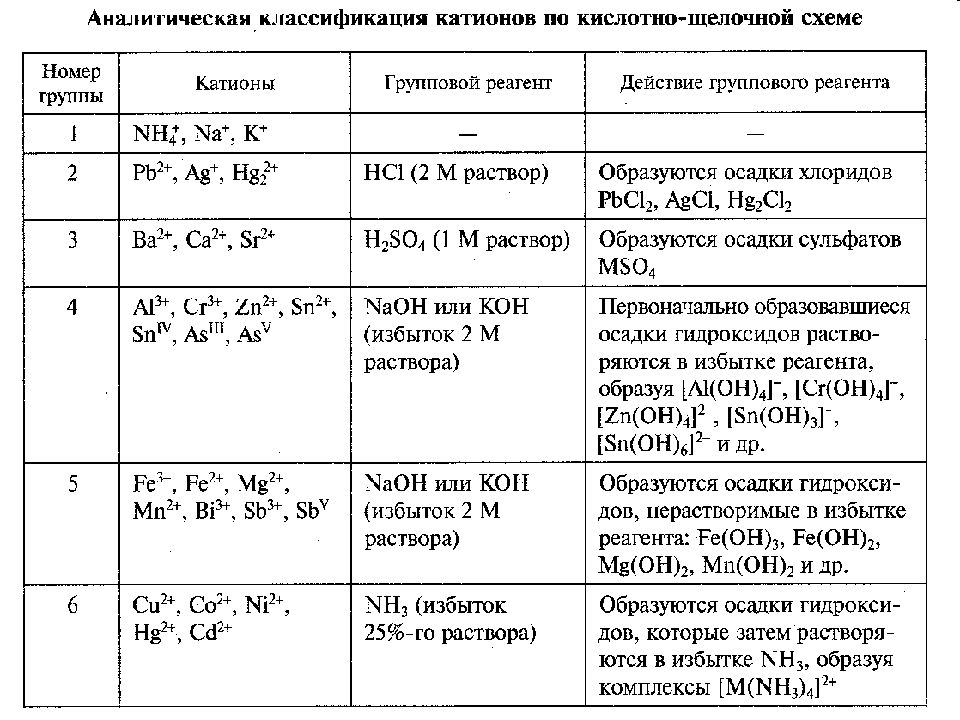
Слайд 29: АНАЛИТИЧЕСКАЯ КЛАССИФИКАЦИЯ ИОНОВ
Все катионы и анионы объединяются в определенные аналитические группы со сходными аналитическими свойствами. Классификации катионов: Сульфидная Аммиачно-фосфатная. Кислотно-основная. Классификации анионов: Основана на их окислительно-восстановительных свойствах. Основана на образовании малорастворимых солей бария и серебра.
Слайд 32: ДРОБНЫЙ И СИСТЕМАТИЧЕСКИЙ АНАЛИЗ
Дробный анализ (Тананаев) – путем проведения дробных реакций из отдельных порций задачи с помощью специфических или селективных реагентов. Строгого порядка открытия ионов нет. Систематический анализ (Бергман, Тенар) – путем последовательного выделения из задачи отдельных аналитических групп и последующего открытия всех ионов каждой группы, соблюдая строгую последовательность проведения реакций.
Последний слайд презентации: АНАЛИТИЧЕСКАЯ ХИМИЯ: Буферные растворы
Это индивидуальное соединение или смесь соединений, поддерживающие определенное значение рН раствора. Примеры буферных растворов: Ацетатный буфер – pH 4-6 (СН 3 СООН+СН 3 СОО Na) Аммонийный буфер – рН 8-10 ( NH 3 *H 2 O+NH 4 Cl) Концентрированные кислоты и щелочи.