Первый слайд презентации
Аналитическая химия II. Инструментальные методы анализа Майстренко В.Н. Башкирский государственный университет Кафедра аналитической химии V_maystrenko@mail.ru Тел: 229-97-12
Слайд 2
Аналитическая химия – наука об определении химического состава веществ и отчасти их химического строения Химические методы анализа Физико-химические методы анализа Физические методы анализа Инструментальные методы анализа
Слайд 3
Инструментальные методы анализа — методы аналитической химии, для выполнения которых требуется электрохимическая, оптическая, радио-химическая и иная аппаратура. К инструментальным методам анализа относятся: электрохимические методы - потенциометрия (ионометрия), кулонометрия, вольтамперометрия, кондуктометрия и др.; методы, основанные на испускании или погло-щении электромагнитного излучения – эмиссионная, абсорбционная, флуоресцентная атомная и молеку-лярная спектроскопия, фотометрические методы, рентгеноспектральный анализ и др.; масс-спектральный анализ; ЯМР, ЭПР, методы, основанные на измерении радиоактивности и др.
Слайд 5: Дефиниция
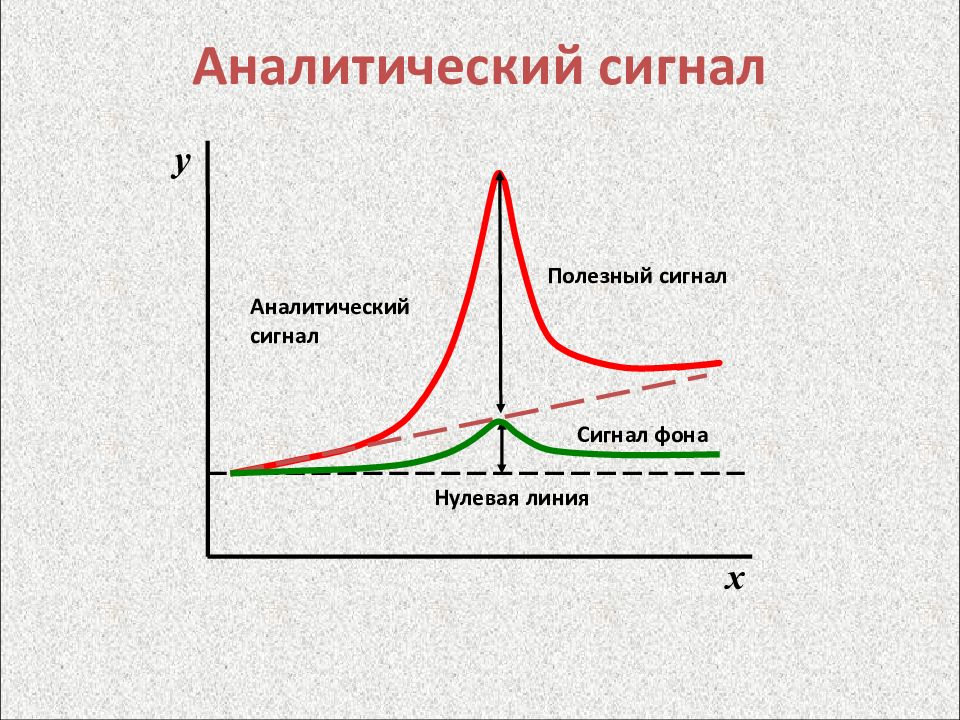
Аналитический сигнал y = f ( x ) y "Контроль объекта аналитический. Термины и определения." ГОСТ Р 52361–2005. Сигнал, содержащий количественную информацию о величине, функционально связанной с содержанием определяемого компонента, и регистрируемый в ходе анализа вещества или материала х
Слайд 6: Аналитический сигнал
Аналитический сигнал Сигнал фона Полезный сигнал Нулевая линия y x
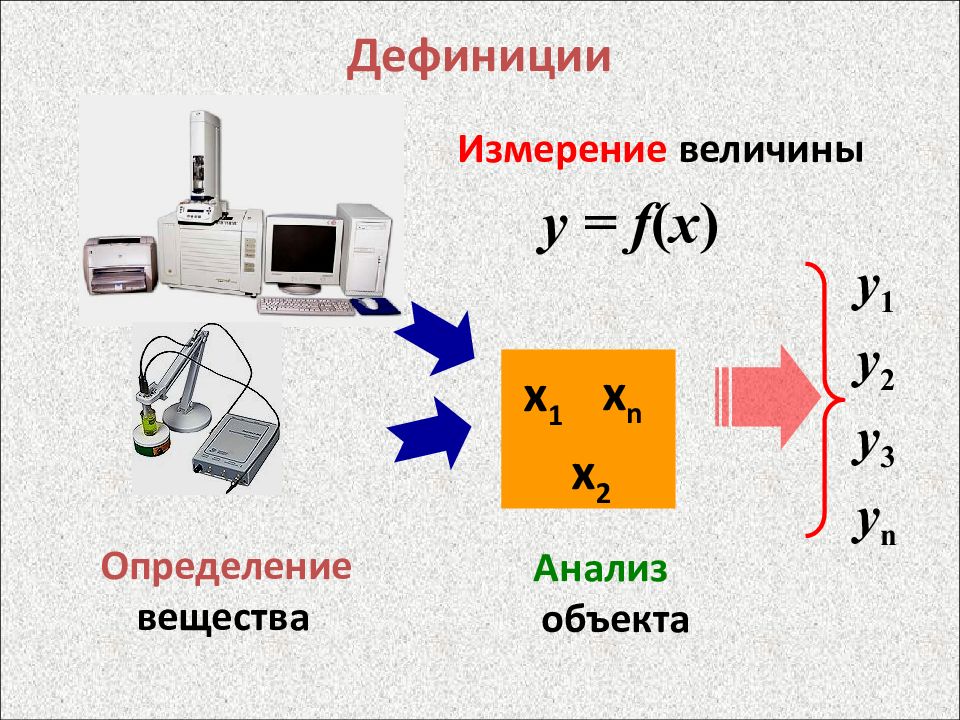
Слайд 7: Дефиниции
Измерение величины Определение вещества y = f ( x ) Анализ объекта х 1 х 2 х n y 1 y 2 y 3 y n
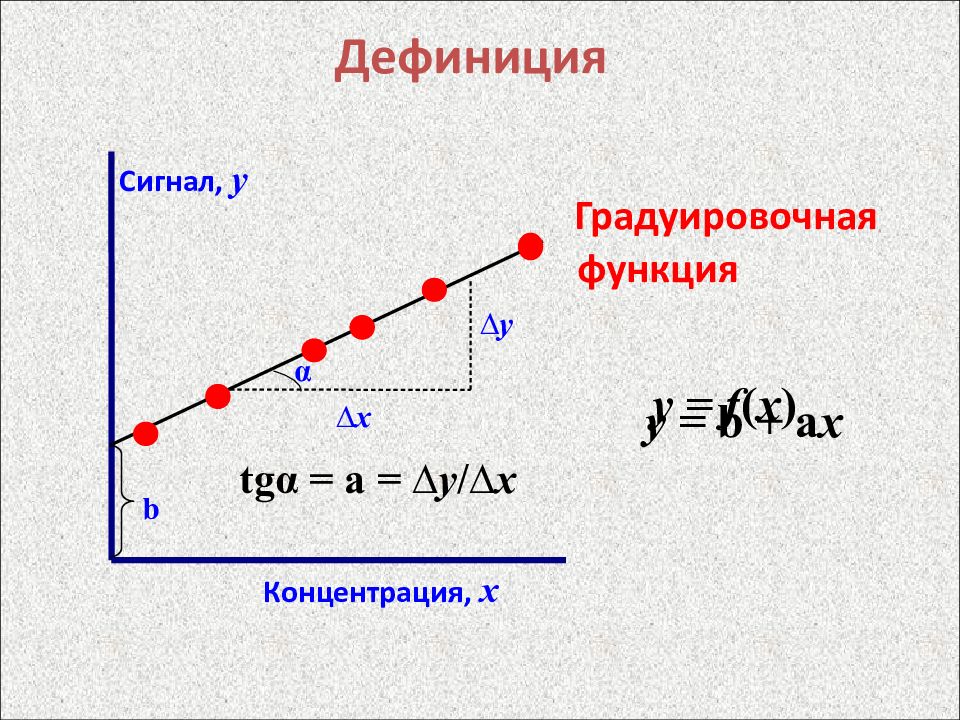
Слайд 8: Дефиниция
Градуировочная функция y = b + а x Дефиниция y = f ( x ) Сигнал, y Концентрация, х ∆х ∆ y b tgα = а = ∆ y / ∆х α
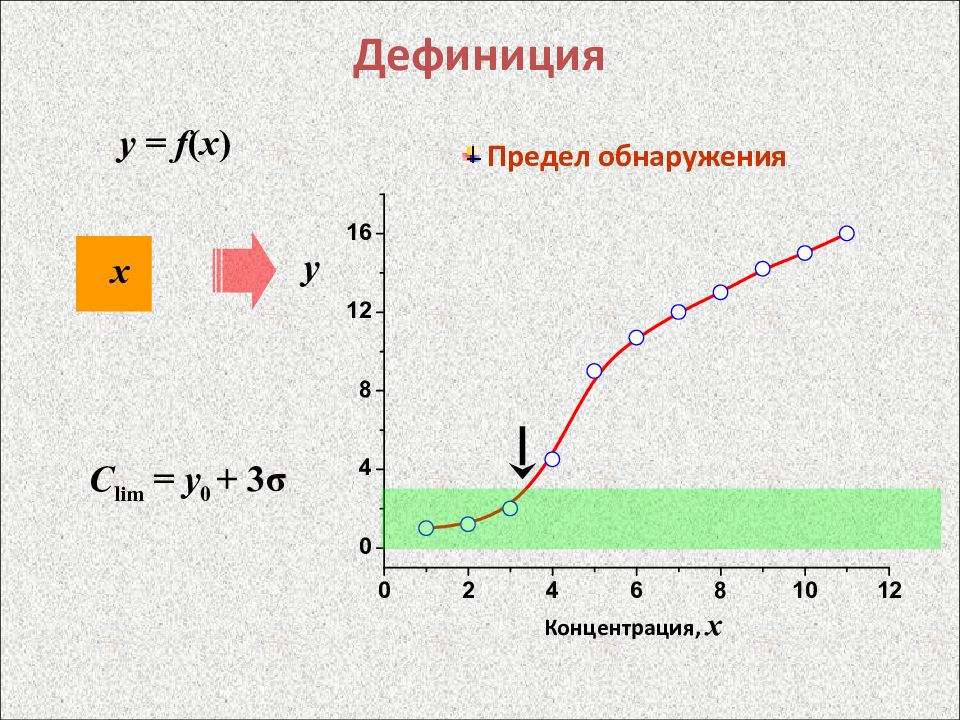
Слайд 9: Дефиниция
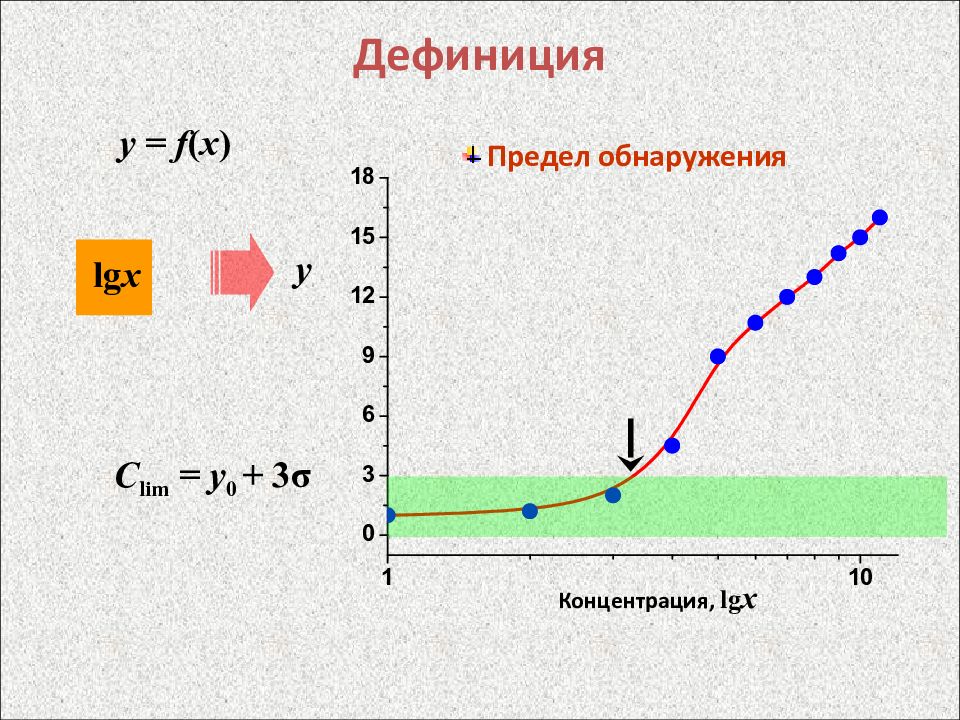
y = f ( x ) х y Предел обнаружения С lim = y 0 + 3 σ Концентрация, x
Слайд 10: Дефиниция
y = f ( x ) lg х y Предел обнаружения С lim = y 0 + 3 σ Концентрация, lg x
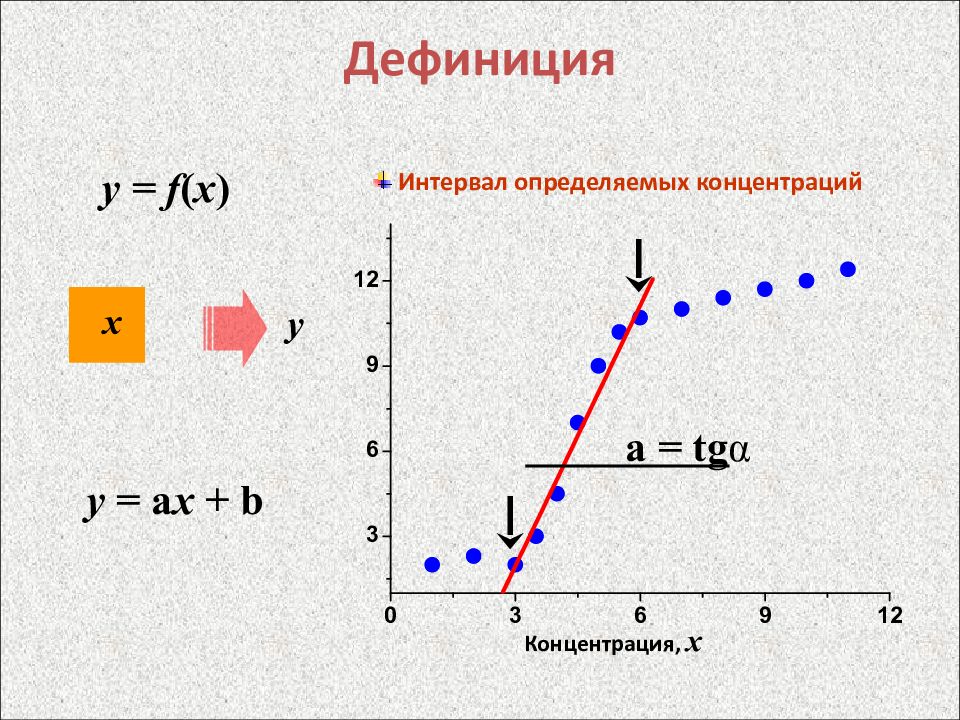
Слайд 11: Дефиниция
y = f ( x ) х y Интервал определяемых концентраций y = a x + b a = tg α Концентрация, x
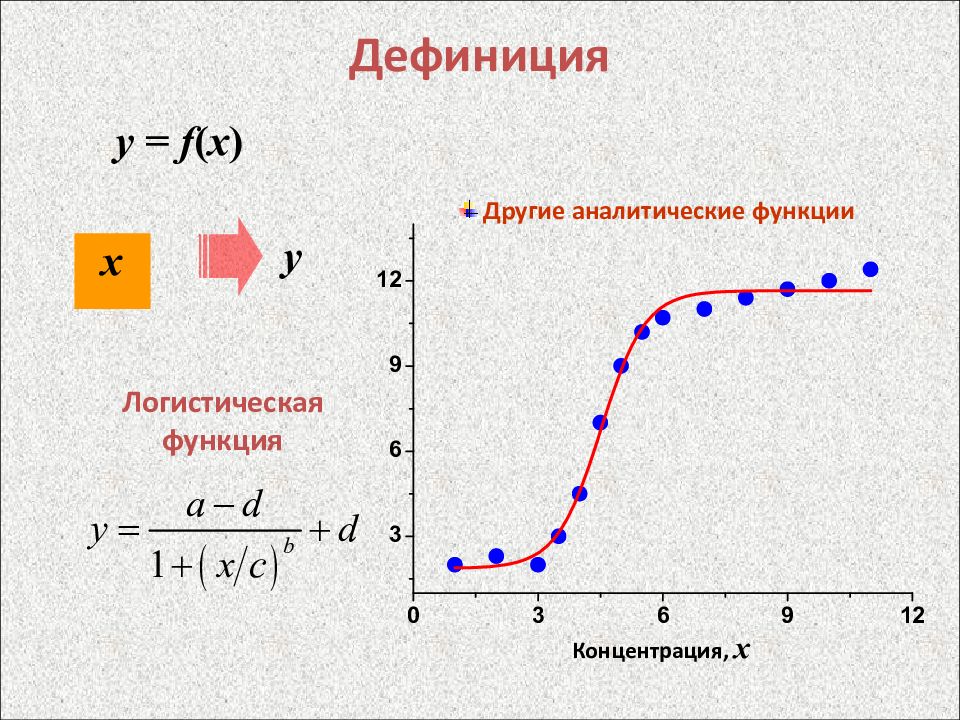
Слайд 12: Дефиниция
y = f ( x ) х y Другие аналитические функции Логистическая функция Концентрация, x
Слайд 13
Метод и методика анализа "Контроль объекта аналитический. Термины и определения." ГОСТ Р 52361–2005. Метод анализа – достаточно универсальный и теоретически обоснованный способ определения состава безотносительно к определяемому компоненту и (обычно) к анализируемому объекту. Методика анализа – подробное описание анализа данного объекта с использованием выбранного метода.
Слайд 14: Методы аналитической химии
Методы отбора проб (пробоотбора) Методы разложения проб Методы разделения компонентов Методы концентрирования Методы обнаружения (идентификации) Методы определения
Слайд 15
Проба – или образец – предмет исследования аналитика, объект, взятый для анализа. По ГОСТ: проба - часть вещества (материала), являющегося объектом аналитического контроля, отобранная для анализа и/или исследования его структуры, и/или определе-ния свойств, отражающая его химический состав и/или структуру, и/или свойства. Представительная проба вещества или материала - объекта аналитического контроля – проба, которая по химическому составу и/или свойствам, и/или структуре идентична объекту аналитического контроля, от которого она отобрана. Проба
Слайд 16
В зависимости от способа получения: разовая, точечная (единичная, частная), мгновенная, суточная и т. п. Классификация проб В зависимости от стадии первичной обработки: исходная, промежуточная, объединенная, средняя, сокращенная, лабораторная, аналитическая и др. В зависимости от назначения: контрольная, рабочая, резервная, арбитражная и др.
Абсолютные методы – не требуют градуировки и стандартных образцов (гравиметрия, кулонометрия и т. д.). Относительные методы – параметры градуировочной функции определяют экспериментально (потенциометрия, вольтамперометрия и т. д.) с использованием стандартных образцов.
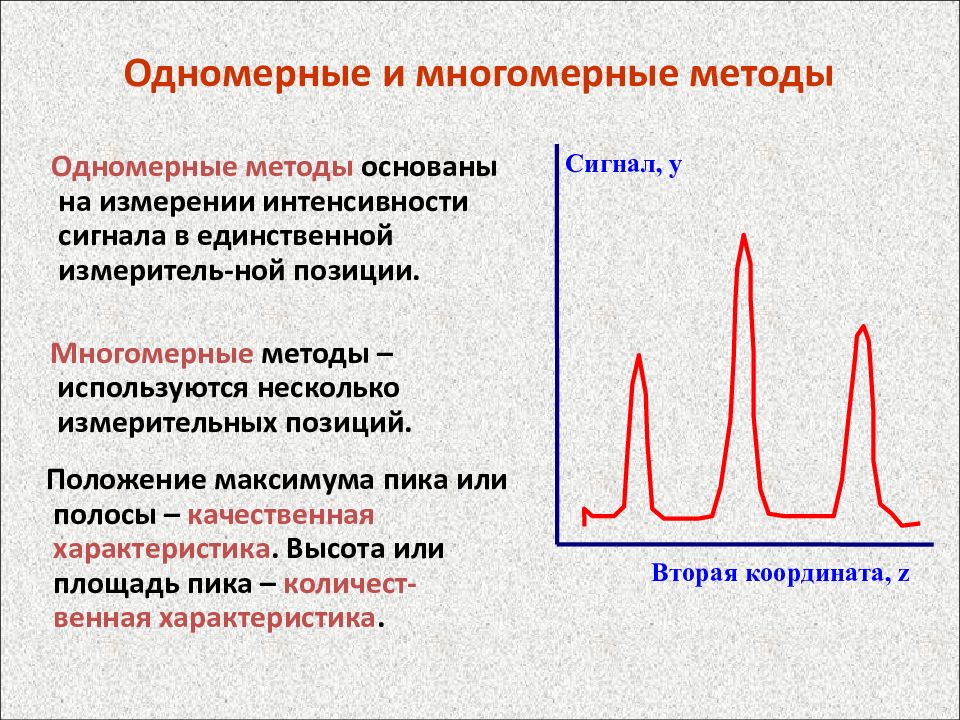
Слайд 18: Одномерные и многомерные методы
Одномерные методы основаны на измерении интенсивности сигнала в единственной измеритель-ной позиции. Сигнал, y Вторая координата, z Многомерные методы – используются несколько измерительных позиций. Положение максимума пика или полосы – качественная характеристика. Высота или площадь пика – количест-венная характеристика.
Слайд 19: Классификация методов анализа
по способу регистрации по способу измерения по объекту общая классификация
Слайд 20: Классификация методов анализа
Общая классификация качественный / количественный элементный / изотопный / молекулярный / структурно-групповой валовый / распределительный (локальный) / вещественный / фазовый контактный / дистанционный деструктивный / недеструктив-ный макро- / полумикро- / микро- / ультрамикро- / субмикро- макро- > 0. 1 г полумикро- 0.1 - 0.01 г микро- 0.01 – 0.001 г ультрамикро- 10 -6 г субмикро- 10 -9 г
Слайд 21: Классификация методов анализа
По способу регистрации сигнала Химические Гравиметрия Титриметрия Электрохимические Биохимические Химические (погрешность < 0.1 - 0.2 %) Физические (погрешность 2 - 5 %) Биологические
Слайд 22: Классификация методов анализа
По способу регистрации сигнала Физические Спектральные Масс-спектральные Основанные на измерении радиоактивности Термический анализ Химические (погрешность < 0.1 - 0.2 %) Физические (погрешность 2 - 5 %) Биологические
Слайд 23: Классификация методов анализа
По способу регистрации сигнала Биологические Биотестирование Биоиндикация Микробиологический анализ Биосенсоры Химические (погрешность < 0.1 - 0.2 %) Физические (погрешность 2 - 5 %) Биологические
Слайд 24: Классификация методов анализа
По способу регистрации сигнала Химические Физические Биологические Физико-химические Спектроскопические Масс-спектральные Основанные на радиоактивности Электрохимические Биохимические Термические
Слайд 25
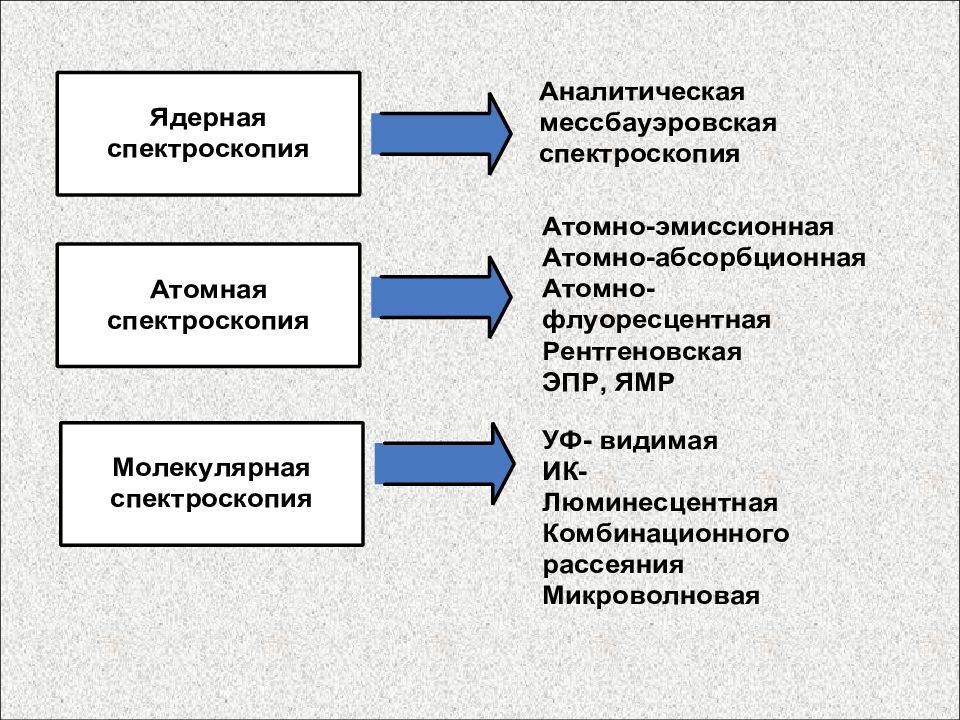
Спектроскопия Молекулярная Атомная Ядерная Электрохимические методы Вольтамперометрия Потенциометрия Кондуктометрия Кулонометрия Хронопотенциометрия, хроноамперометрия По способу измерения сигнала
Слайд 27: Классификация
По объекту анализа Классификация х по агрегатному состоянию по химической природе по происхождению объекта по степени распространенности и важности по степени чистоты
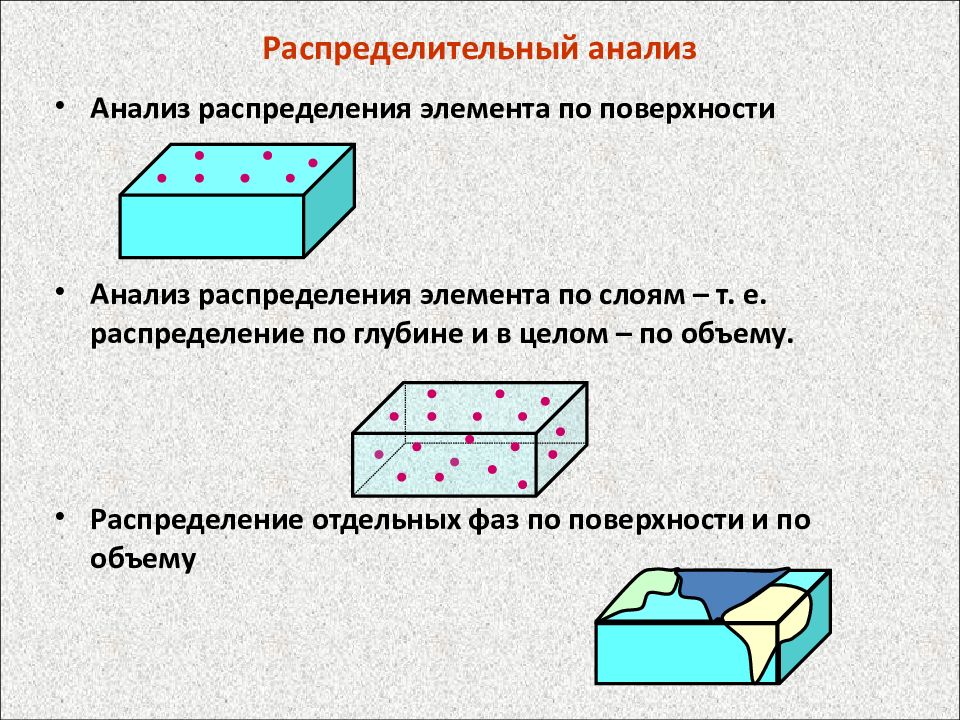
Слайд 28: Распределительный анализ
Анализ распределения элемента по поверхности Анализ распределения элемента по слоям – т. е. распределение по глубине и в целом – по объему. Распределение отдельных фаз по поверхности и по объему
Слайд 29: Критерии сравнения
Аналитические характеристики Метрологические характеристики Требования к пробоподготовке Особенности приборного оснащения Специальные требования, связанные с природой объекта контроля Экономические характеристики
Слайд 30
Литература Основы аналитической химии. Кн. 2. Методы химического анализа. / Под ред. Ю. А. Золотова. 2-е изд. М.: Высшая школа, 2004. Аналитическая химия. Физические и физико-химические методы анализа. Под ред. О. М. Петрухина. М.: Химия, 2001. Васильев В. П. Аналитическая химия. Кн. 2. Физико-химические методы анализа. М.: Дрофа, 2004. Дополнительная литература Кристиан Г. Аналитическая химия. В 2-х т. М.: БИНОМ, 2009. Аналитическая химия. Проблемы и подходы: В 2-х т. / Под ред. Р. Кельнера, Ж-М. Мерме, М. Отто, Н. Видмера. М.: Мир, 2004. Отто М. Современные методы аналитической химии. В 2 т. М.: Техносфера, 2003.
Слайд 31
Инструментальные методы анализа: спектры атомов и молекул Майстренко В.Н. Башкирский государственный университет Кафедра аналитической химии V_maystrenko@mail.ru Тел: 229-97-12
Слайд 32
В арсенале современной аналитической химии важнейшее место занимают методы атомной оптической спектроскопии, основанные на измерении интенсивности электромагнитного излучения, испускаемого или поглощаемого атомами элементов, которые находятся в газо- или парообразном состоянии. Эти методы являются многоэлементными и широко используются для установления состава различных объектов – сплавов, минералов, руд, пищевых продуктов, объектов окружающей среды и др.
Слайд 34
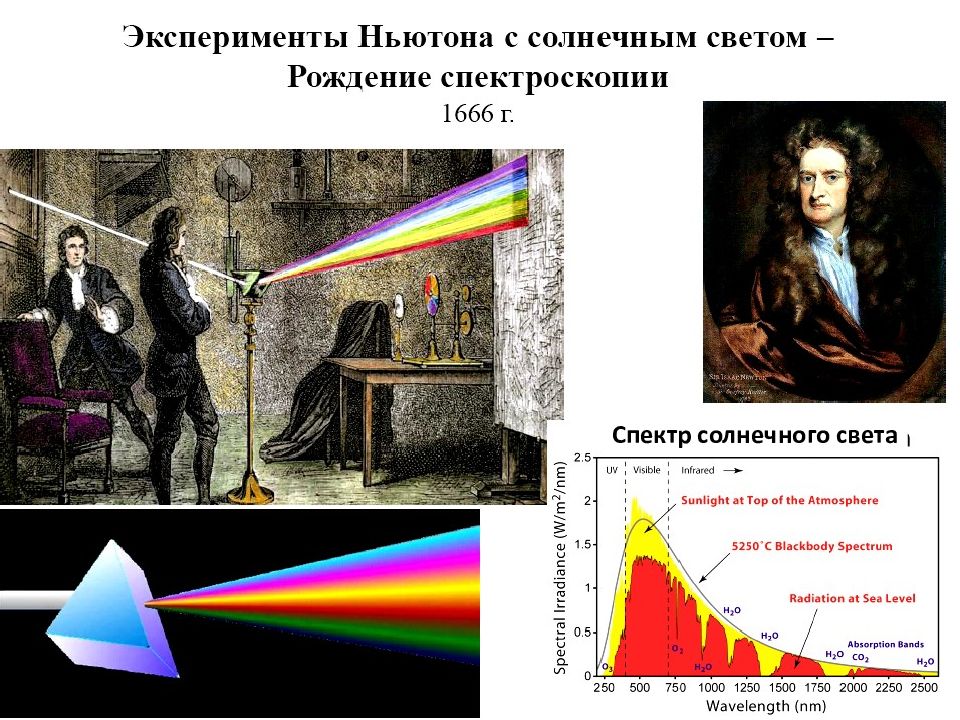
История атомного спектрального анализа началась с опытов Исаака Ньютона (1666 г) по разложению света в спектр. Первые атомные спектры наблюдали в начале XIX века в ходе астрономических исследований. Возникновение спектрального анализа как метода определения химичес-кого состава вещества относят к 1859 г., когда немецкие ученые Г. Кирхгоф и Р. Бунзен, исследуя поведение солей металлов в пламени, наблюдали появление линий в спектрах элементов. Густав Кирхгоф (слева) и Роберт Бунзен (справа) Спектроскоп Кирхгофа и Бунзена
Слайд 36
Эксперимент Бунзена-Кирхгофа А – сигарный ящик, B – часть подзорной трубы, С – подзорная труба, D – газовая горелка Бунзена, E – штатив с солью натрия, F – призма из стекла с CS 2, G – зеркало, H – поворотное устройство
Слайд 37
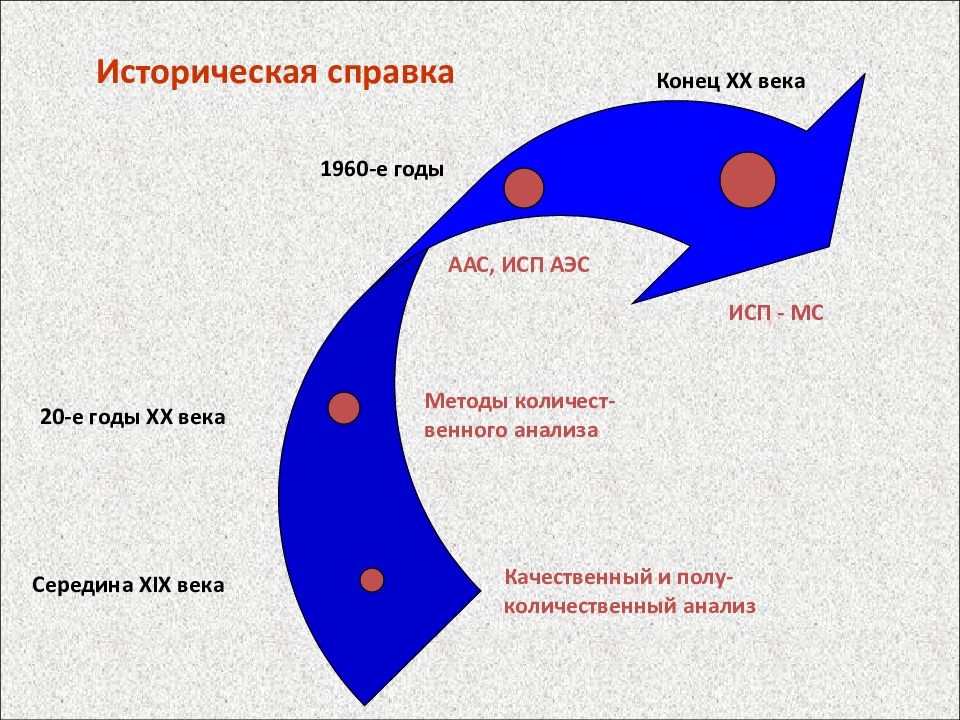
Историческая справка Качественный и полу-количественный анализ Методы количест-венного анализа Середина XIX века 20-е годы XX века 1960-е годы ААС, ИСП АЭС Конец XX века ИСП - МС
Слайд 38
Атомы химических элементов имеют строго определённые частоты, на которых они излучают или поглощают свет. При этом на спектрах элементов наблюдаются светлые или темные линии в определённых местах, характерные для каждого элемента. Атомарные спектры получают переведением веществ в парообраз-ное состояние путём нагревания до 1000—10000 °C. В качестве источни-ков возбуждения атомов применяют искру, дугу переменного тока, пламя или плазму различных газов, лазеры и др. Спектры поглощения и испускания атомов натрия Спектры атомов
Слайд 39
Сплошной спектр Спектр испускания (эмиссионный) Спектр поглощения (абсорбционный)
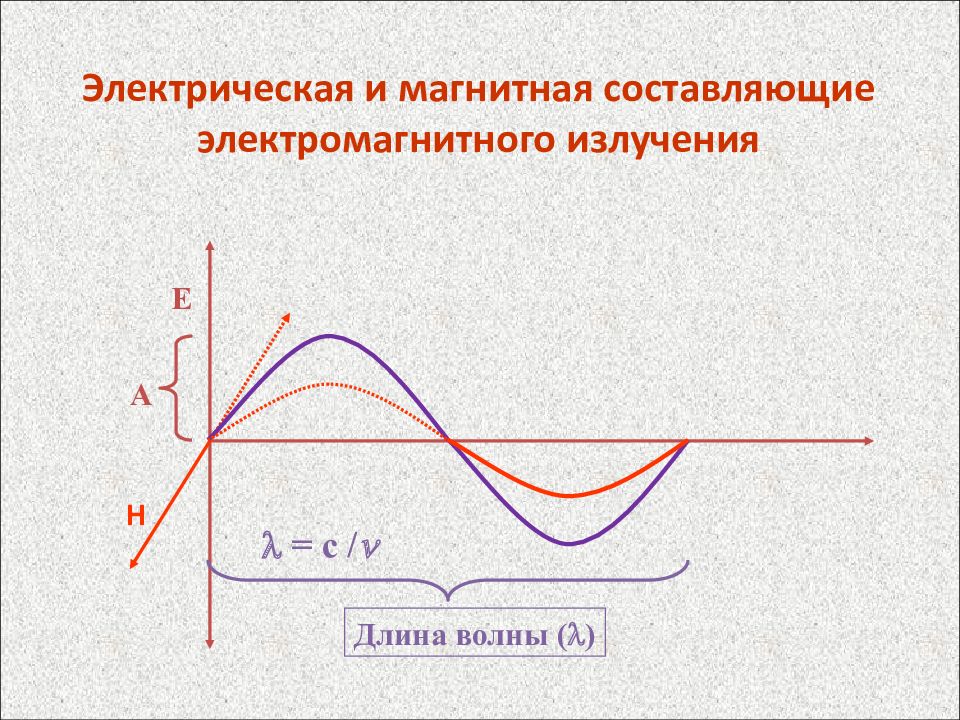
Слайд 41: Электрическая и магнитная составляющие электромагнитного излучения
E H A Длина волны () = с /
Слайд 42
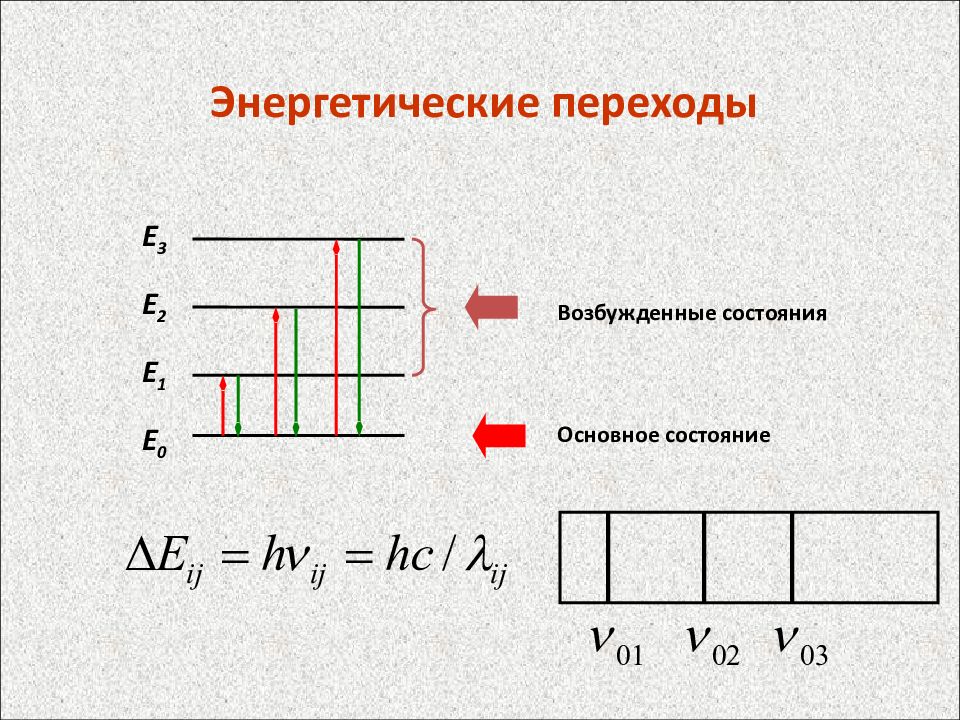
Спектральные линии характеризуют частотой излучения , которая соответствует квантовому переходу между уровнями энергии Е i и Е k атома согласно соотношению h = Е i - Е k, где h – постоянная Планка, а также длиной волны = с / (с – скорость света), волновым числом ’ = 1/ и энергией фотона h. Частоты спектральных линий выражают в обратных секундах ( с -1 ), длины волн – в нм, мкм и ангстремах, волновые числа – в обратных сантиметрах (см -1 ), энергию фотонов в электрон-вольтах (эВ). Спектры испускания (эмиссионные) получают при возбуждении атомов различными способами. Время жизни возбужденного состояния 10 -7 – 10 -8 с. В течение этого времени атом испускает квант электро-магнитного излучения и переходит в состояние с более низкой энергией. Спектры поглощения (абсорбционные) наблюдаются при прохож-дении электромагнитного излучения, имеющего непрерывный спектр, через пары или газы атомов. Возникновение оптических спектров и их характер определяет система электронов атома, которые характеризуются четыремя квантовыми числами: главным квантовым числом (уровни K, L, M, N…Q), орбитальным квантовым числом (подуровни s, p, d, f…), магнитным и спиновым квантовыми числами.
Слайд 43
Энергетические переходы Е 3 Е 2 Е 1 Е 0 Возбужденные состояния Основное состояние
Слайд 44
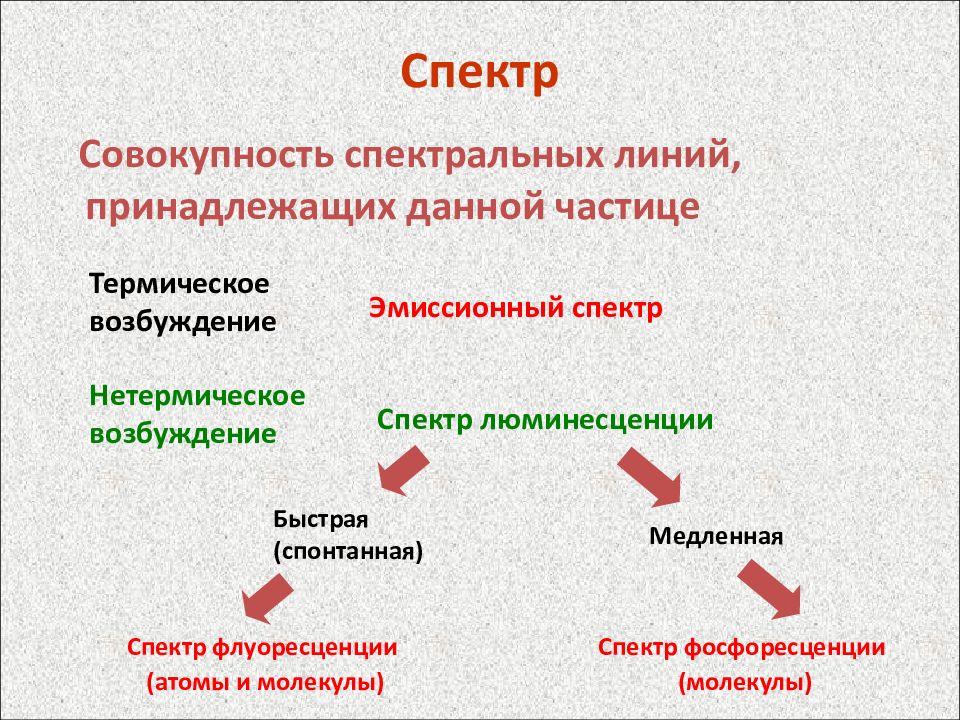
Спектр Совокупность спектральных линий, принадлежащих данной частице Термическое возбуждение Нетермическое возбуждение Эмиссионный спектр Спектр люминесценции Быстрая (спонтанная) Медленная Спектр флуоресценции (атомы и молекулы) Спектр фосфоресценции (молекулы)
Слайд 46
Спектры атомов с малым числом валентных электронов (щелочные металлы, водород) имеют относительно мало линий (менее 100) в диапазоне 200 - 800 нм. Атомы с более сложными электронными оболочками (элементы побочных групп) имеют спектры с большим числом линий ( Cu – более 500, Fe – более 3000, U – несколько тысяч). Линии, обусловленные переходом электронов на основной энергетический уровень, называются резонансными. Вследствие высокой интенсивности они обеспечивают наибольшую чувствитель-ность определений и используются для аналитических целей. Для возбуждения резонансных линий щелочных металлов необхо-дима небольшая энергия, тогда как для неметаллов она высокая и спектры из видимой области смещаются в труднодоступную ультра-фиолетовую область: для Na – 589 нм, Mg – 285 нм, Si – 251 нм, P – 176 нм. Основная область применения атомной спектроскопии – опреде-ление элементов с металлическими и полуметаллическими свойствами. Для получения количественной информации измеряют интенсив-ность одной из спектральных линий определяемого элемента. Процессы, происходящие с атомом при поглощении или испускании фотона, описывают с помощью спектральных термов, характеризующих энергетическое состояние поглощающего или испускающего атома. Спектральные термы получают путем векторного сложения орбитальных моментов и спинов всех электронов атома.
Слайд 47
Спектральные термы Серия Лаймана n = 1 Серия Бальмера: n = 2 Серия Пашена: n = 3 Серия Брэкетта: n = 4 Спектральный терм: R = 109 677 см −1 – постоянная Ридберга, m – целые числа. ( m > n ) Терм: Формула Бальмера
Слайд 49
Спектральные термы многоэлектронных атомов Учет заряда ядра: He +, Li 2+, Be 3+ Учет суммарного орбитального момента и суммарного спина
Слайд 51
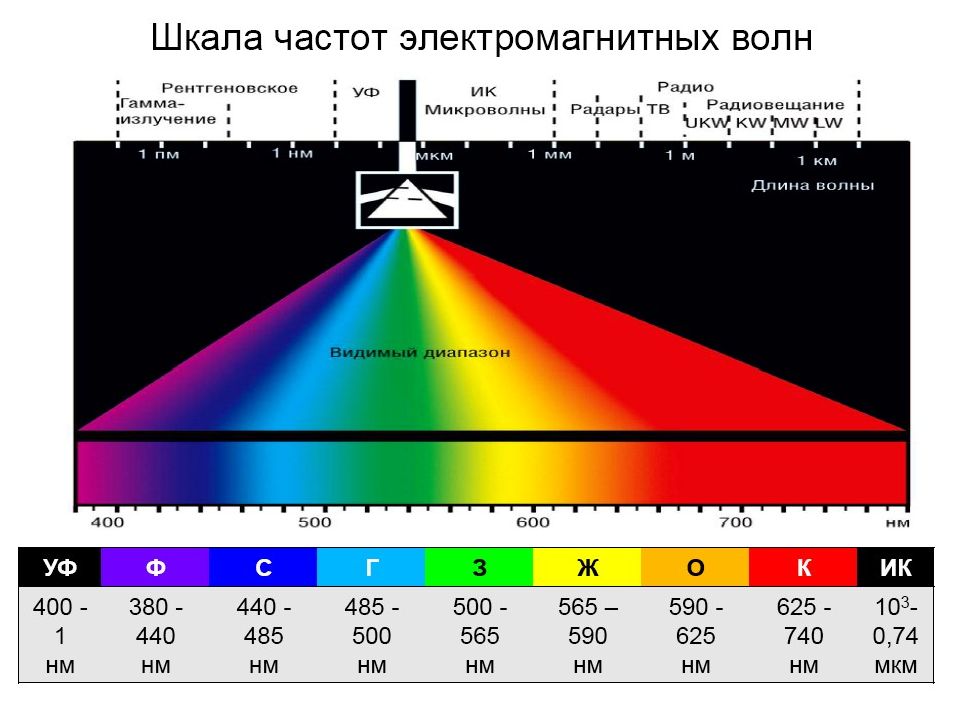
Интервал длин волн Участок спектра 10 -4 – 0, 1 нм γ - Излучение 0, 01 – 10 нм Рентгеновское излучение 10 – 400 нм Ультрафиолетовое излучение 400 – 760 нм Видимый свет 760 – 10 6 нм Инфракрасное излучение 10 -3 – 1 м Микроволновое (СВЧ) > 1 м Радиоволны Длины волн электромагнитного излучения
Слайд 52
Интенсивность спектральных линий Энергия, поглощаемая, излучаемая или рассеиваемая в единицу времени Спектр испускания: Спектр поглощения: Рентгеновская спектроскопия, АЭС, АФС ААС, UV-Vis, ИК, микроволновая и радиочастотная спектроскопия
Слайд 53
Ширина спектральных линий естественная тепловое движение ( допплеровское уширение ) соударение частиц ( лоренцево уширение ) расщепление энергетических уровней в магнитном поле ( эффект Зеемана ) УФ: 10 -5 нм УФ: 10 -3 -10 -2 нм
Слайд 54
МОЛЕКУЛЯРНЫЕ СПЕКТРЫ - спектры поглощения, испускания или рассеяния, возникающие при квантовых переходах молекул из одного энергетического состояния в другое. Молекулярные спектры определяются составом молекул, их структурой, характером химических связей и взаимодействием с окружающими атомами и молекулами. Наиболее характерными являются молекулярные спектры молекул разреженных газов, которые состоят из узких линий. Молекулярные спектры состоят из электронных, колебательных и вращательных спектров и лежат в диапазоне электромагнитных волн от радиочастот до рентгеновской области спектра. Частоты переходов между вращательными уровнями энергии обычно попадают в микроволновую область, частоты переходов между колебательными уровнями - в ИК-область, а частоты переходов между электронными уровнями - в видимую и УФ-области спектра. Часто вращательные переходы попадают в ИК-область, колебательные - в видимую область, электронные - в ИК-область. Электронные переходы сопровождаются изменением колебательной энергии молекул, а при колебательных переходах изменяется вращательная энергия. Поэтому электронные спектры обычно представляют собой электронно-колебательные полосы. При высоком разрешении обнаруживается и вращательная структура.
Слайд 55
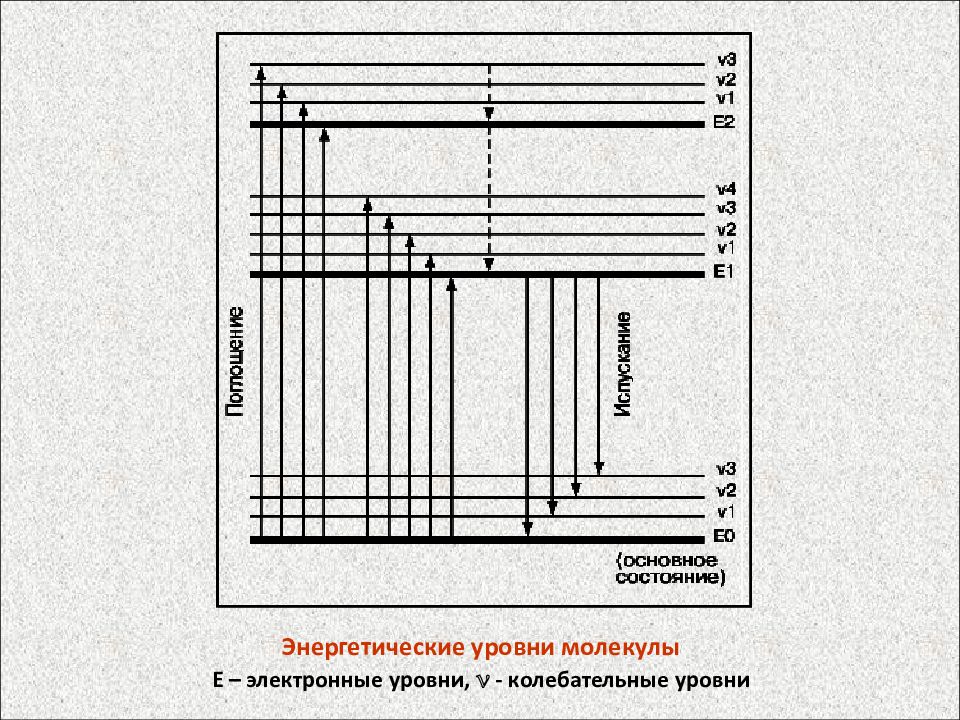
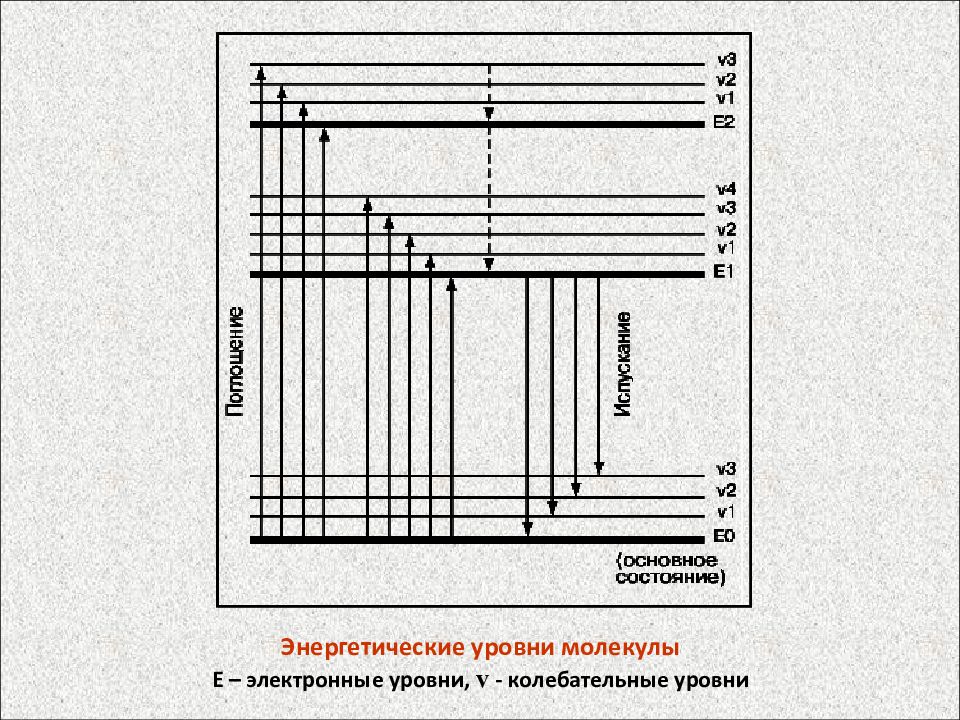
Энергетические уровни молекулы Е – электронные уровни, - колебательные уровни
Слайд 56
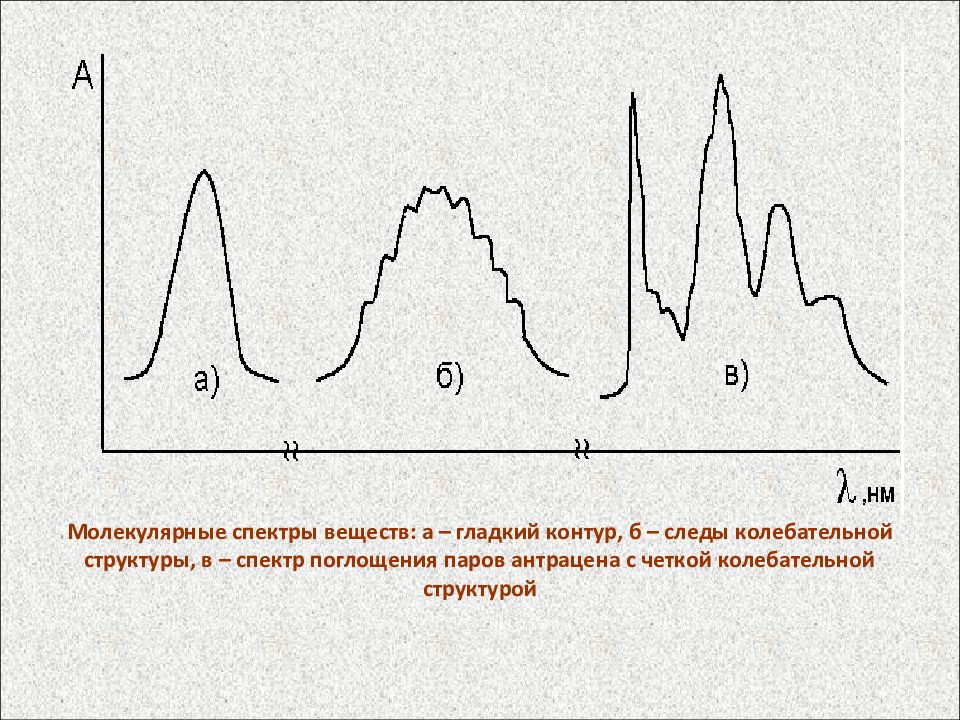
Молекулярные спектры веществ: а – гладкий контур, б – следы колебательной структуры, в – спектр поглощения паров антрацена с четкой колебательной структурой
Слайд 57: Электронные спектры молекул
Электронные спектры обусловлены переходами между электронными энергетическими уровнями. Чем определяются электронные спектры ? Для атомов электронной конфигурацией атомов Для молекул электронной конфигурацией молекул Электронные переходы в молекулах, как правило, имеют энергию, соответствующую УФ- и видимой областям электромагнитного спектра.
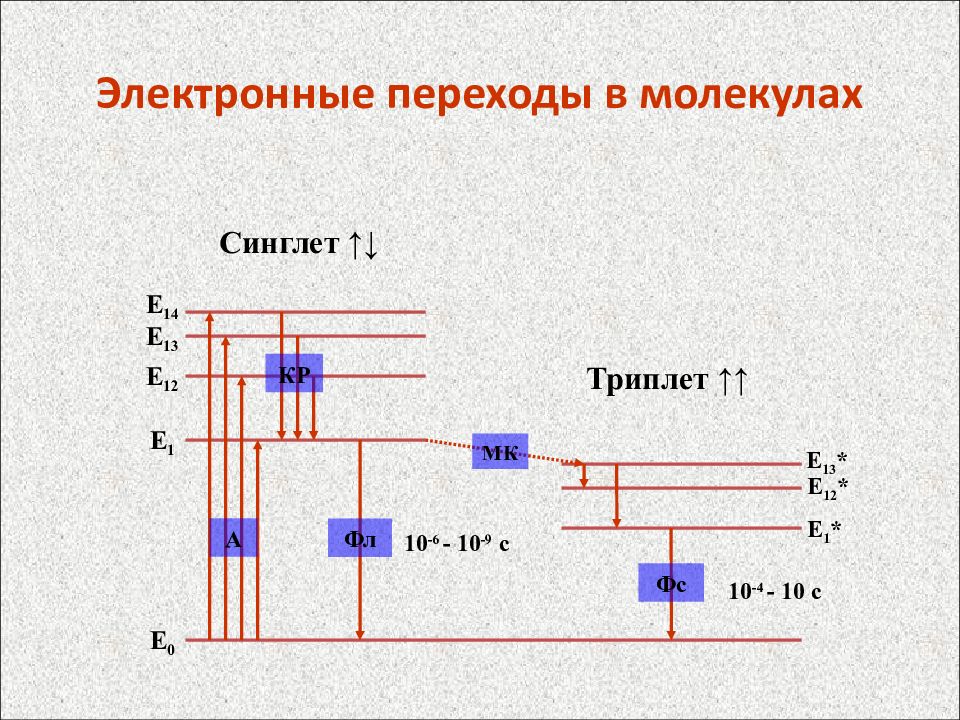
Слайд 58: Электронные переходы в молекулах
E 0 E 14 E 13 E 12 E 1 Синглет ↑↓ Триплет ↑↑ А МК Фс 10 -6 - 10 -9 с 10 -4 - 10 c КР Фл Е 1 * Е 12 * Е 13 *
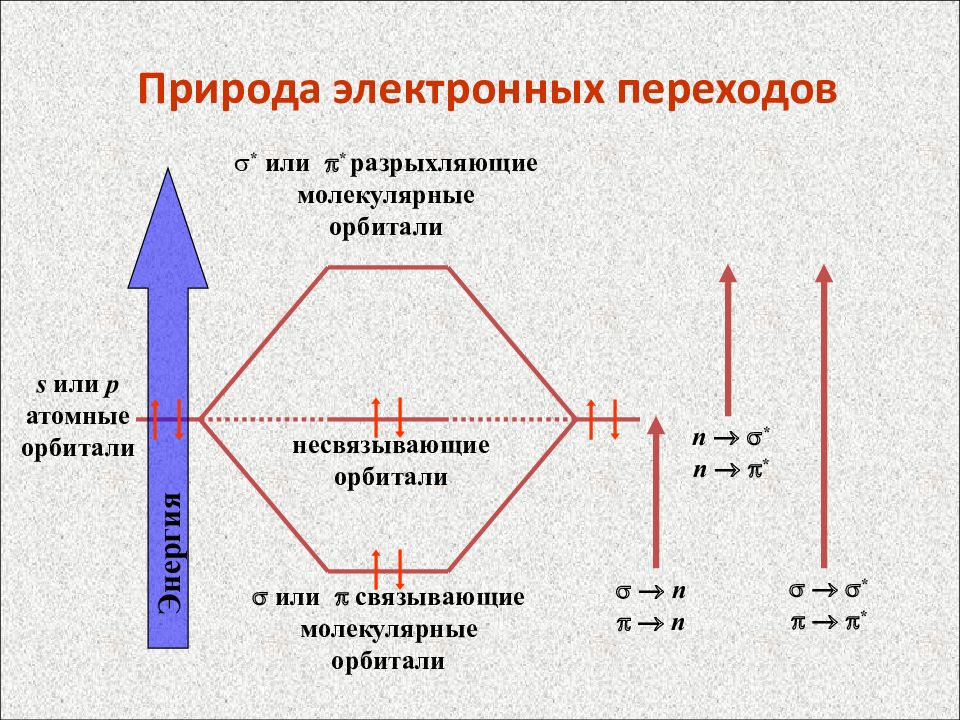
Слайд 59: Природа электронных переходов
или связывающие молекулярные орбитали s или p атомные орбитали * или * разрыхляющие молекулярные орбитали несвязывающие орбитали n n n * n * * * Энергия
Слайд 62
Энергетические уровни молекулы Е – электронные уровни, v - колебательные уровни
Слайд 63
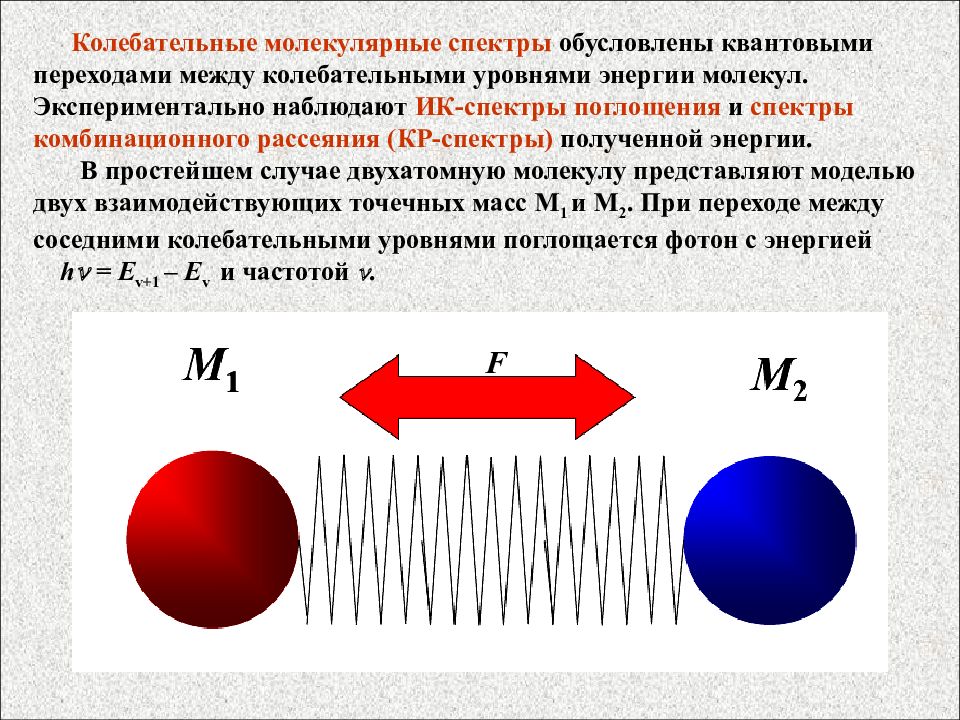
Колебательные молекулярные спектры обусловлены квантовыми переходами между колебательными уровнями энергии молекул. Экспериментально наблюдают ИК-спектры поглощения и спектры комбинационного рассеяния (КР-спектры) полученной энергии. В простейшем случае двухатомную молекулу представляют моделью двух взаимодействующих точечных масс M 1 и M 2. При переходе между соседними колебательными уровнями поглощается фотон с энергией h = E v +1 – E v и частотой . F
Слайд 64
Существуют два основных вида колебаний в молекулах: валентные (), при которых атомы совершают колебания вдоль связей, – связи попеременно то растягиваются, то укорачиваются ( симметричные и асимметричные колебания ); деформационные (), при которых происходит изменение валентных углов между связями одного атома ( ножничные, маятниковые, веерные, крутильные колебания ). Валентное симмет-ричное ( s ) Валентное антисим-метричное ( as ), ( a ) Деформационное симметричное ( s) (ножничное) Деформационное антисимметричное (а s) (маятниковое) Деформационное веерное ( ) Деформационное крутильное ( )
Слайд 65
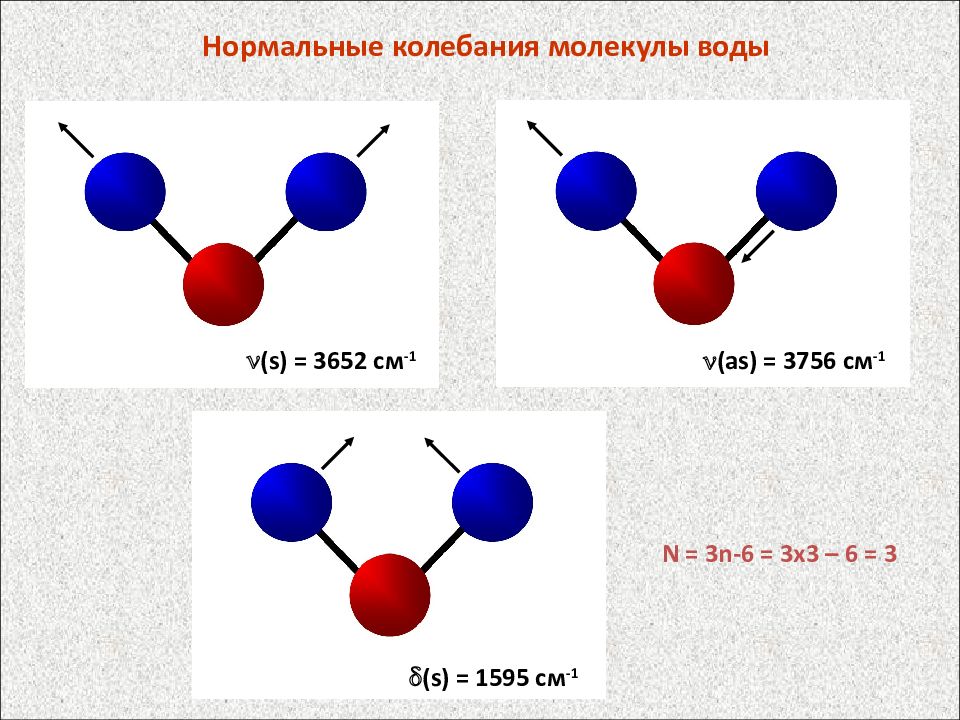
Нормальные колебания молекулы воды N = 3n-6 = 3 x3 – 6 = 3 ( s ) = 3652 см -1 ( s) = 1595 см -1 ( as ) = 3756 см -1
Слайд 66
Частота колебаний зависит от массы атомов (легче атом – выше частота) C – H 3000 см -1 C – D 2200 см -1 C – O 1100 см -1 C – Cl 700 см -1 Частота колебаний зависит от энергии связи (связь прочнее – выше частота) C С 2143 см -1 C = O 1715 см -1 C – O 1100 см -1
Слайд 67
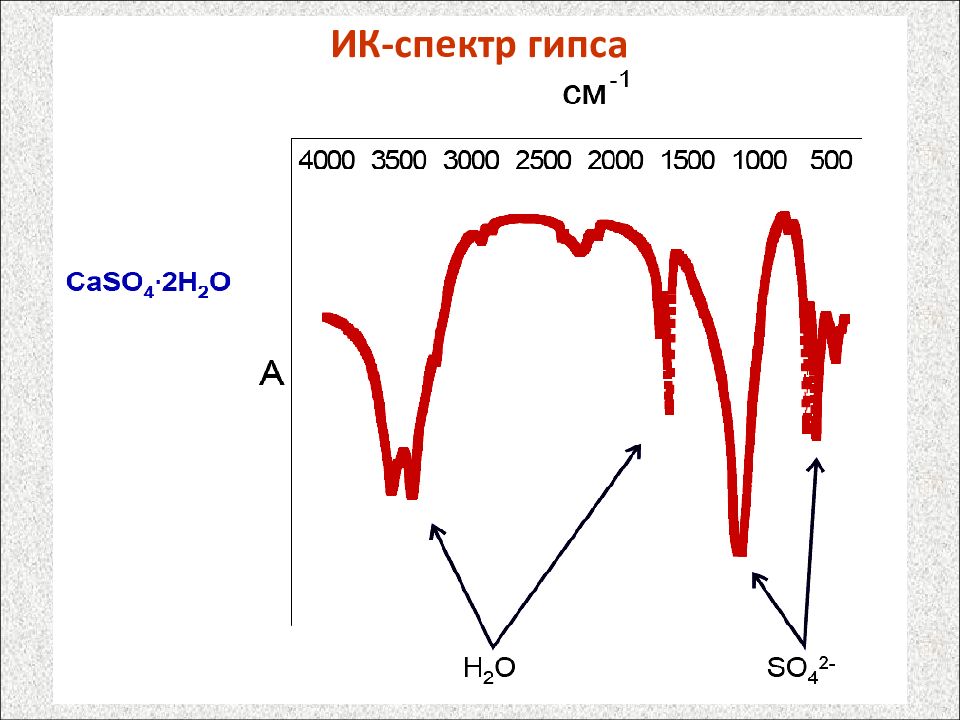
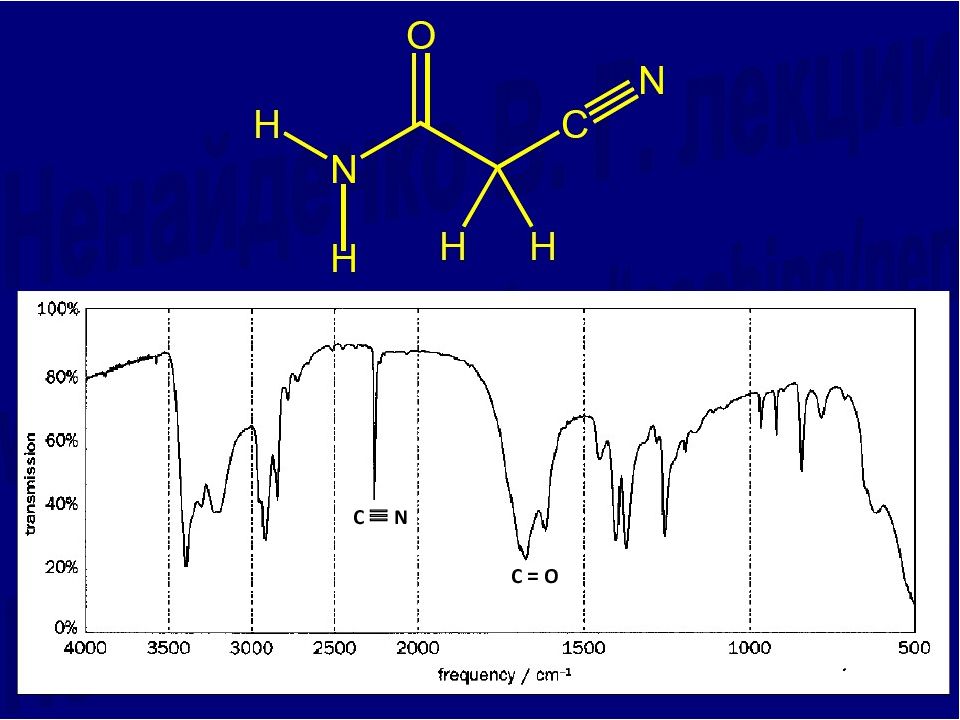
Группа Диапазон частот Группа Диапазон частот Валентные колебания Деформационные колебания ( O – H) 3600 – 3000 ( O – H), ( N – H) 1650 – 1550 ( C C), ( C N) 2400 – 2100 ( C – H) 1450 – 1250 ( P – H), ( C – H) 2250 – 2100 ( C – O), ( C – N) 1300 – 1000 ( C = O) 1850 – 1650 ( C – H), ( N – H) 950 – 800 ( C = C), ( N = O) 1750 - 1600 ( Si – O), ( P = O) 700 – 550 ( N = N) 1650 - 1450 ( S – O) 650 - 450 ( Si – O), ( P = O) 1300 - 1000 ( S – O) 1000 – 800 ( C – Cl) 750 - 690 Типичные частоты колебаний функциональных групп, см -1
Слайд 70
Литература Основы аналитической химии. Кн. 2. Методы химического анализа. / Под ред. Ю. А. Золотова. 2-е изд. М.: Высшая школа, 2004. Аналитическая химия. Физические и физико-химические методы анализа. Под ред. О. М. Петрухина. М.: Химия, 2001. Васильев В. П. Аналитическая химия. Кн. 2. Физико-химические методы анализа. М.: Дрофа, 2004. Дополнительная литература Кристиан Г. Аналитическая химия. В 2-х т. М.: БИНОМ, 2009. Аналитическая химия. Проблемы и подходы: В 2 т. / Под ред. Р. Кельнера, Ж-М. Мерме, М. Отто, Н. Видмера. М.: Мир, 2004. Отто М. Современные методы аналитической химии. В 2 т. М.: Техносфера, 2003. Кузяков Ю. Я., Семененко К. А., Зоров Н. Б. Методы спектрального анализа. М.: МГУ, 1990. Казицына Л. А., Куплетская Н. Б. Применение УФ-, ИК- и ЯМР- спектроскопии в органической химии. М.: Высшая школа, 1971.