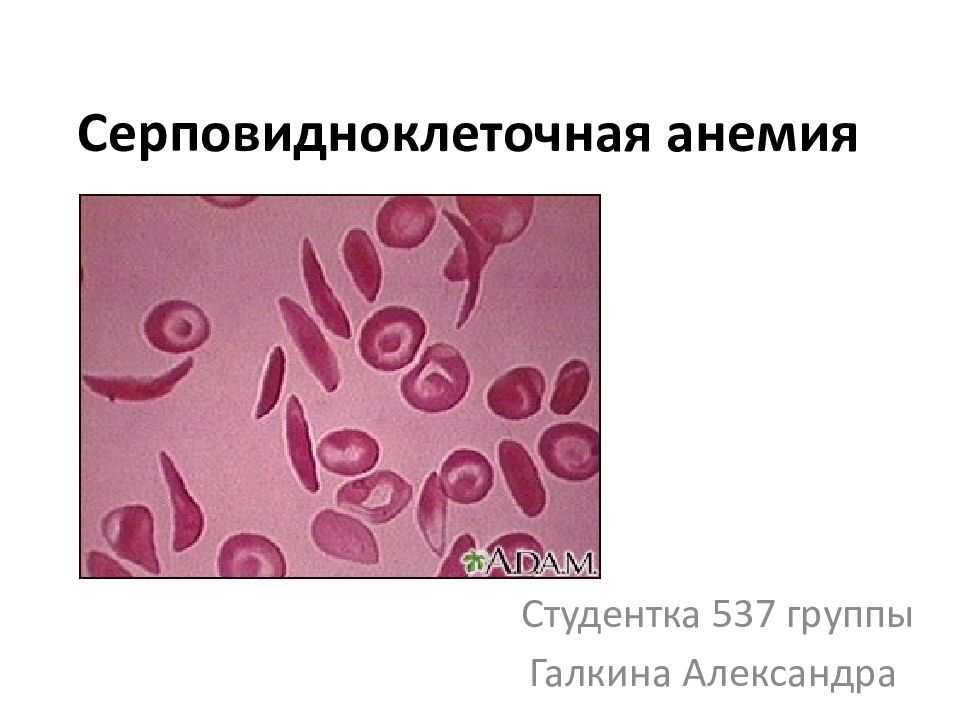
Первый слайд презентации: Анемия Даймонда -Блекфена. Синдром Швахмана - Даймонда
Подготовила: Саломатина Анастасия Сергеевна, РНИМУ им.Н.И. Пирогова Группа 2.6.05 2019 год Руководитель: д.м.н., профессор Румянцева Ю. В. СНК кафедры онкологии и гематологии педиатрического факультета
Слайд 2
Анемия Даймонда-Блекфена (АДБ) - редкая форма врожденной красноклеточной (эритроидной) аплазии кроветворения раннего и детского возраста, развивающаяся в результате апоптоза эритроидных предшественников в костном мозге вследствие дефекта биосинтеза рибосом.
Слайд 3: Распространенность
Регистр больных с АДБ - среднегодовой показатель в РФ - 6,3 ± 0,34 на 1000000 живых детей, рожденных за период с 2011 по 2018г Половой и этнической предрасположенности не выявлено
Слайд 4: Этиология и патогенез
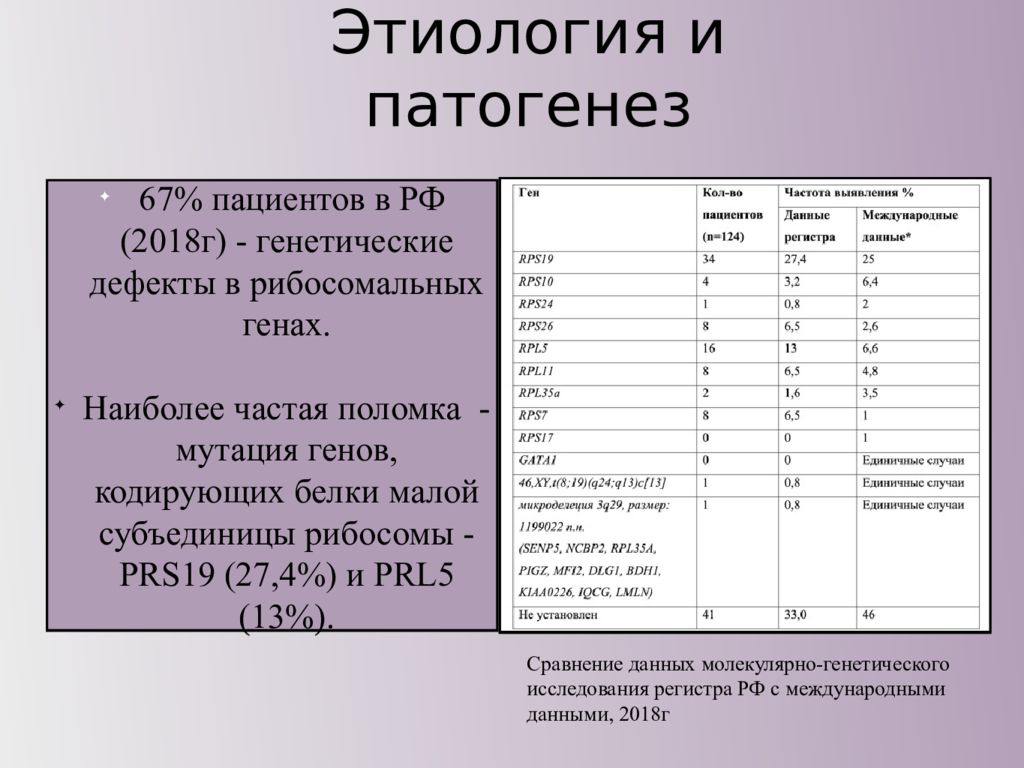
67% пациентов в РФ (2018г) - генетические дефекты в рибосомальных генах. Наиболее частая поломка - мутация генов, кодирующих белки малой субъединицы рибосомы - PRS19 (27,4%) и PRL5 (13%). Сравнение данных молекулярно-генетического исследования регистра РФ с международными данными, 2018г
Слайд 5: Общая характеристика заболевания
Угнетение эритропоэза Наличие врожденных пороков развития Предрасположенность к развитию злокачественных заболеваний
Слайд 6: Клиническая картина
Начало клинических проявлений – 2 месяца жизни Средний возраст установления диагноза – 3-4 месяца. В более 90% случаев манифестация заболевания на первом году жизни, крайне редко – в первые сутки жизни. Основная жалоба – бледность кожи и слизистых, слабость, утомляемость (особенно при кормлении). В дальнейшем - жалобы на отставание в физическом развитии.
Слайд 7: Клиническая картина
Пороки развития: - аномалии черепа и лицевого скелета (гипертелоризм, высокий выпуклый лоб, готическое небо, небная расщелина, плоская спинка носа, микрогнатия, микроцефалия, микротия, низко расположенные ушные раковины) – 50% - аномалии кистей рук (удвоенный, расщепленный, 3-фаланговый большой палец, синдактилия) – 38% - патология сердца (дефект межжелудочковой перегородки, дефект межпредсердной перегородки, коарктация аорты, тетрада Фалло) – 30% - патология мочеполовой системы (подковообразная почка, удвоение мочевыводящих путей, гипоспадия – 39% - сочетанные пороки развития - 21% случаев.
Слайд 8: Клиническая картина
Физическое развитие низкое. Низкий вес при рождении - в 10% случаев, в половине из этих случаев - отставание физического развития от гестационного возраста. Более 60% - рост менее 25 перцентиля. Риск развития всех злокачественных новообразований у больных АБД превышает общепопуляционный в 5,4 раза. Максимальный риск развития был отмечен для миелодиспластического синдрома, острого миелобластного лейкоза, аденокарциномы толстой кишки, остеогенной саркомы и злокачественных опухолей женских половых органов.
Слайд 9: Лабораторная диагностика
Диагноз АДБ рекомендовано устанавливать на основании клинических проявлений и данных лабораторного обследования Обязательные критерии: • Нормохромная, обычно макроцитарная, анемия в раннем возрасте без вовлечения других клеточных линий. • Ретикулоцитопения. • Нормоклеточный костный мозг с селективным уменьшением эритроидных предшественников (<6%). • Возраст <1 года. Дополнительные критерии: • Наличие мутаций в рибосомальных генах (RPS19, RPS10, RPS24, RPS26, RPL5, RPL11, RPL35a, RPS7, RPS17). • Семейный анамнез. • Врожденные аномалии развития, характерные для классической АДБ. • Повышение HbF (для пациентов старше 6 мес.). • Повышение активности эритроцитарной аденозин дезаминазы (eADA).
Слайд 10: Число тромбоцитов и лейкоцитов в основном в пределах нормы; редко может быть тромбоцитоз, тромбоцитопения и/или нейтропения
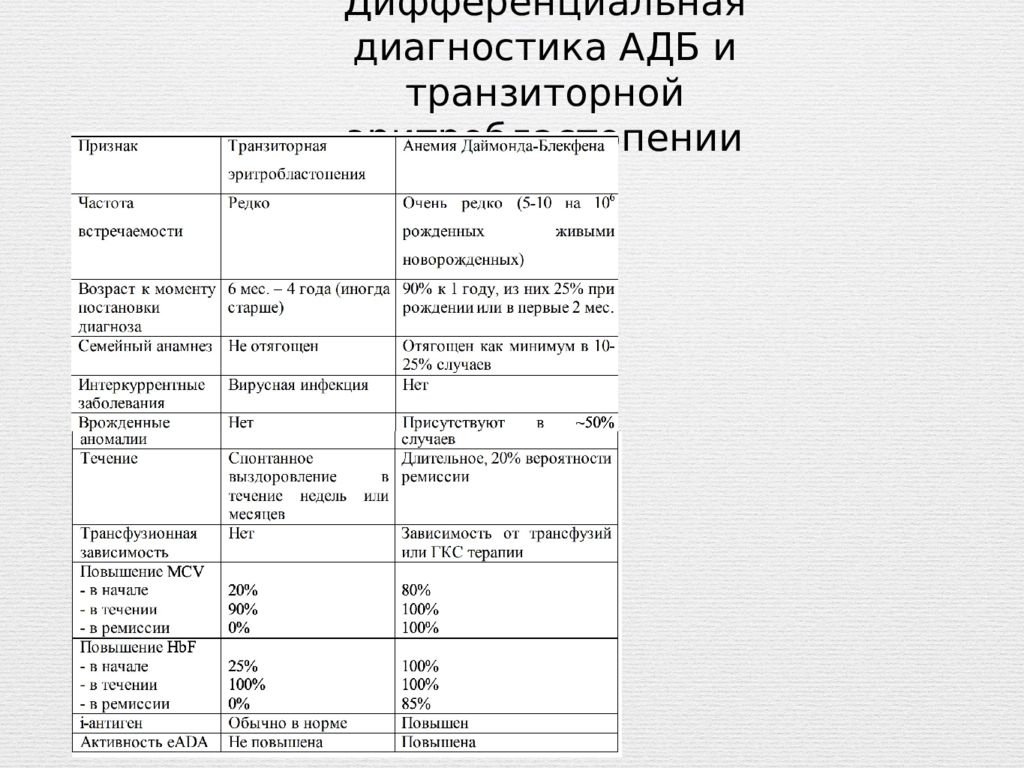
Слайд 11: Дифференциальная диагностика
АДБ дифференцируют со следующими состояниями: Поздняя гипорегенераторная анемия вследствие тяжелой гемолитической анемии новорожденного (Rh или АВО конфликт) - может сохраняться в течение нескольких месяцев. Транзиторная эритробластопения Врожденная гипопластическая анемия вследствие транспланцентарно переданной инфекции парвовирусом В19 (выявление с помощью ПЦР образца костного мозга) Синдром Пирсона - характеризуется рефрактерной арегенераторной макроцитарной сидеробластной анемией, нейтропенией, вакуолизацией предшественников в костном мозге, наличием сидеробластов (обычно кольцевых) в костном мозге, экзокринной дисфункцией поджелудочной железы и метаболическим ацидозом (лактат ацидозом). Анемия развивается в возрасте 1 месяца жизни в 25% случаев, в возрасте около 6 месяцев жизни в 70% случаев. У всех больных выявляется делеция митохондриальной ДНК.
Слайд 13: Лечение
Консервативное лечение Цель лечения : обеспечить нормальный рост и развитие ребенка, сохранить трудоспособность в подростковом и взрослом возрасте, обеспечить хорошее качество жизни пациента. 1–я линия терапии: Рекомендовано проведение глюкокортикостероидной терапии 1-й линии Препарат: преднизолон, метилпреднизолон - через 2 недели после проведенной трансфузии эритроцитарной массы в возрасте 12-15 мес.жизни. Стартовая доза - 2 мг/кг/сут в течение 2-4 недель При отсутствии ответа - отмена в течение 3 дней. Ответ есть (стабилизация Hb выше 90 г/л, ретикулоцитоз) -> снижаем дозу ГКС: по 0,5 мл/кг/сут каждые 2 недели, затем каждые 4 недели, каждые 8 недель. Максимально допустимая поддерживающая доза ГКС - <0,25 мг/кг/сут.
Слайд 14: Критерии гематологического ответа на ГКС: полный — Hb >100 г/л, нормальное число ретикулоцитов; частичный — Hb 85-100 г/л, наличие ретикулоцитов; отсутствие ответа — Hb <85 г/л, ретикулоцитопения
Эффективность терапии ГКС - в 60% случаев
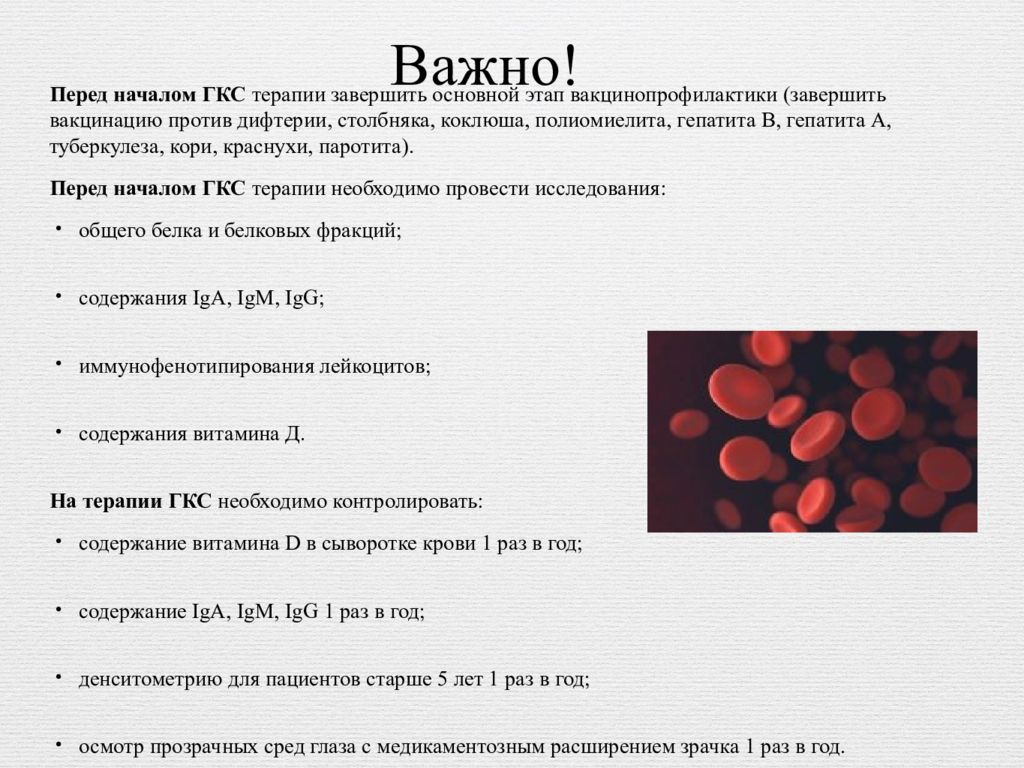
Слайд 15: Важно!
Перед началом ГКС терапии завершить основной этап вакцинопрофилактики (завершить вакцинацию против дифтерии, столбняка, коклюша, полиомиелита, гепатита В, гепатита А, туберкулеза, кори, краснухи, паротита). Перед началом ГКС терапии необходимо провести исследования: общего белка и белковых фракций; содержания IgA, IgM, IgG; иммунофенотипирования лейкоцитов; содержания витамина Д. На терапии ГКС необходимо контролировать: содержание витамина D в сыворотке крови 1 раз в год; содержание IgA, IgM, IgG 1 раз в год; денситометрию для пациентов старше 5 лет 1 раз в год; осмотр прозрачных сред глаза с медикаментозным расширением зрачка 1 раз в год.
Показания: дети младше 1 года и подростки (10-14 лет), и лица, не ответившие на терапию ГКС. Пороговое значение Hb для проведения гемотрансфузии: для детей первого года жизни 90-100 г/л; для пациентов старше 1 года 80-90 г/л. Рекомендуется нормотрансфузионный режим заместительной программной терапии эритроцитной массой, т.е. содержание НЬ после трансфузии должно составлять 115-120 г/л. Объем трансфузируемой эритроцитной массы 10-15 мл/кг, кратность — каждые 3 - 4 нед.
Слайд 17: Важно!
Перед первой трансфузией эритроцитной массы необходимо проведение фенотипирования эритроцитов пациента по системе АВ0, Rh- фактору и редким группам крови (Kell и др.). На фоне заместительной трансфузионной терапии необходимо контролировать общий анализ крови с подсчетом тромбоцитов перед каждой трансфузией ; антиэритроцитные антитела (непрямая проба Кумбса) перед каждой трансфузией ; иммунофенотипирование эритроцитов по системе АВ0, Rh-фактору и редким группам крови (Kell и др.) 1 раз в год; обмен железа (сывороточное железо, ОЖСС/НЖСС, НТЖ, ферритин сыворотки крови) 1 раз в 6-12 мес. Трансфузионную заместительную терапию эритроцитной массой не рекомендуется сочетать с ГКС терапией в связи высоким риском осложнений. Рекомендуется заместительную терапию эритроцитной массой сопровождать адекватной хелаторной терапией
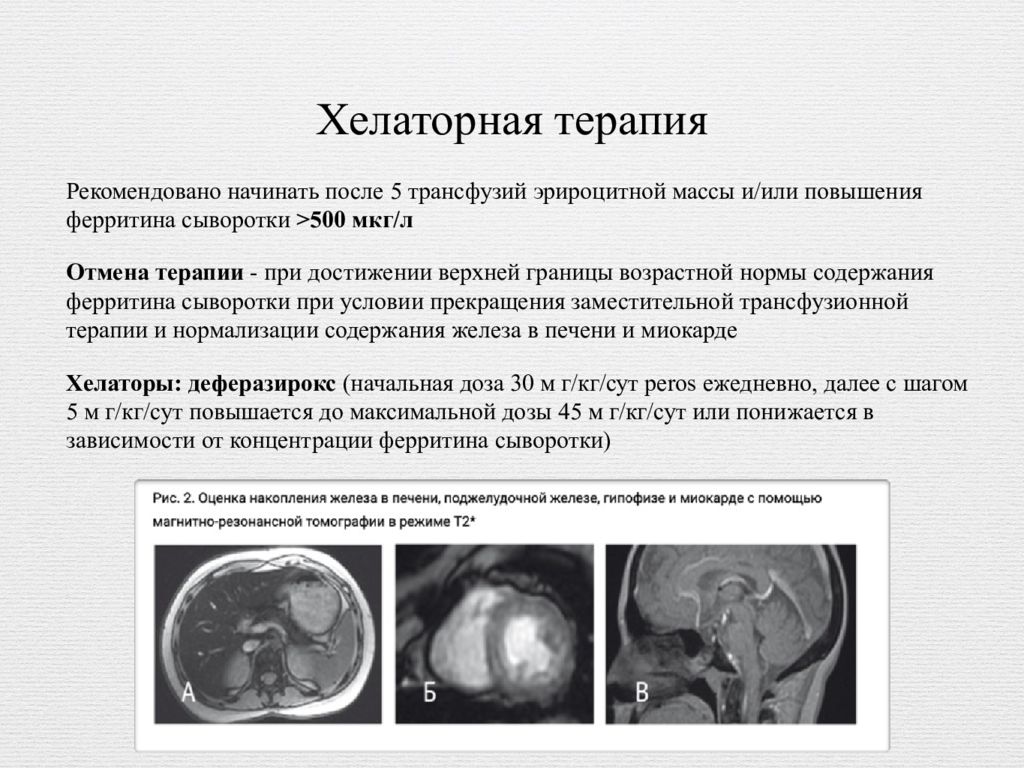
Слайд 18: Хелаторная терапия
Рекомендовано начинать после 5 трансфузий эрироцитной массы и/или повышения ферритина сыворотки >500 мкг/л Отмена терапии - при достижении верхней границы возрастной нормы содержания ферритина сыворотки при условии прекращения заместительной трансфузионной терапии и нормализации содержания железа в печени и миокарде Хелаторы: деферазирокс (начальная доза 30 м г/кг/сут peros ежедневно, далее с шагом 5 м г/кг/сут повышается до максимальной дозы 45 м г/кг/сут или понижается в зависимости от концентрации ферритина сыворотки)
Слайд 19: Важно!
При проведении хелаторной терапии необходимо контролировать: сывороточное железо, ОЖСС/НЖСС, НТЖ, сывороточный ферритин каждые 3 мес при подборе дозы хелатора, далее каждые 6 мес; клиренс эндогенного креатинина до начала хелаторной терапии, каждые 3 мес на этапе подбора дозы, далее каждые 6-12 мес; МРТ Т2* печени и миокарда 1 раз в год.
Слайд 20: Иное лечение
Трансплантация гемопоэтических стволовых клеток рассматривается в качестве радикальной терапии. При отсутствии эффекта на ГКС-терапию трансплантация гемопоэтических стволовых клеток (ТГСК) от родственного или неродственного HLA-совместимого донора рассматривается как альтернатива пожизненной заместительной терапии эритроцитной массой для пациентов младше 9 лет
Слайд 21: Прогноз
Прогноз благоприятный. Спонтанная ремиссия АДБ - примерно 20% случаев к 25 годам независимо от ранее проводимой терапии. Осложнение заместительной терапии эритроцитной массой – посттрансфузионная перегрузка железом – может существенно сокращать продолжительность жизни и ухудшать качество жизни больных. Продолжительность жизни больных: до 40 лет доживает 75,1±4,8% больных; в случае достижения ремиссии или медикаментозной ремиссии выживаемость составляет 85-100%; трансфузионно зависимые пациенты доживают до взрослого возраста в 60% случаев. Общая выживаемость после родственной совместимой ТГСК, если она проводилась до 9-летнего возраста, составляет 95%, после неродственной полностью совместимой ТГСК – 85%. Смертность пациентов с АДБ зависит от развития и степени тяжести осложнений от проводимой терапии (посттрансфузионная перегрузка железом, инфекции, осложнения после ТГСК) – 67%, связана с прогрессией заболевания (тяжелая аплазия кроветворения, злокачественные заболевания) – 22%, не установлена причинная связь – 11% случаев. При отсутствии ТГСК избегать профессий, связанных возможными травмами. При успешной ТГСК ограничений в выборе профессии нет. Без ТГСК детородная функция обычно не страдает, после проведенной ТГСК возможно бесплодие. Физиологические изменения, происходящие при беременности, могут вызвать повышение потребности как в ГКС, так и в трансфузиях эритроцитной массы. Во время беременности может быть возврат клинических проявлений и необходимость терапии у больных со спонтанной компенсацией АДБ.
Слайд 22: Синдром Швахмана -Даймонда
Слайд 23: Характеристика
Синдром Швахмана - Даймонда - это заболевание с аутосомно-рецессивным типом наследования, характеризующееся экзокринной недостаточностью поджелудочной железы, гематологическими нарушениями, задержкой роста и костными аномалиями. Причина - мутация в гене SBDS, который кодирует белок SBDS. Белок находится практически во всех органах (в большом количестве - в поджелудочной железе, костном мозге, костной ткани).
Слайд 24
Нарушение функции клеток поджелудочной железы Развитие ферментной недостаточности Первая жалоба - частый до 10-14 раз в сутки, жидкий, жирный стул
Слайд 25: Клиника
Синдром мальабсорбции: -плохая прибавка в весе -нарушение всасывания жирорастворимых витаминов А, D, E, K. -нарушение всасывания железа, кальция Гематологические изменения: -нейтропения, анемия, тромбоцитопения Костные аномалии: -низкий рост, аномалии развития грудной клетки -метафизарная дисхондроплазия, гипоплазия фаланг -остеопороз Патология печени: -50-70% - гепатомегалия в период новорожденности и повышение АЛТ, АСТ (синдром цитолиза)
Слайд 26: Диагностика
Золотой стандарт - ДНК-диагностика с определением мутаций в гене SBDS. Биохимический анализ крови - повышение активности АЛТ, АСТ, ЩФ, снижение ХС, панкреатической амилазы. Анализ кала на липидограмму - повышение всех фракций липидов + снижение панкреатической эластазы в кале. Клинический анализ крови - нейтропения, анемия.
Слайд 27: Дифференциальная диагностика
1)Муковисцидоз 2)Анемия Фанкони 3)Анемия Даймонда - Блэкфана
Слайд 28: Лечение
Высококалорийная диета Заместительная терапия препаратами панкреатина в высоких дозах пожизненно Длительная витаминотерапия, препараты железа, кальция Прогноз - благоприятный.