Первый слайд презентации: БИОХИМИЯ ПЕЧЕНИ
Слайд 2
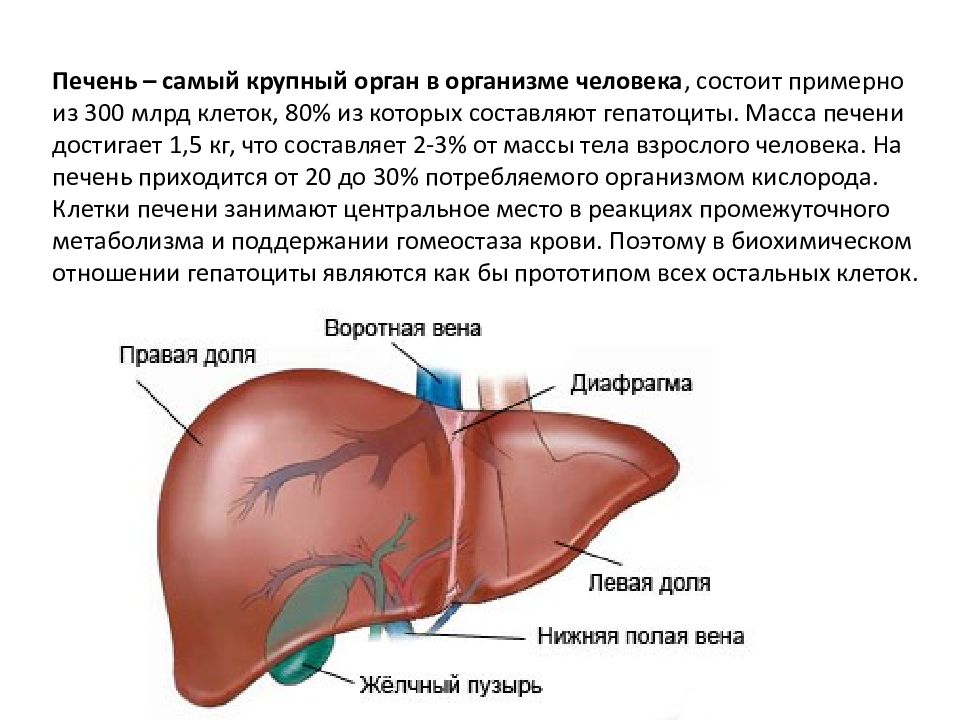
Печень – самый крупный орган в организме человека, состоит примерно из 300 млрд клеток, 80% из которых составляют гепатоциты. Масса печени достигает 1,5 кг, что составляет 2-3% от массы тела взрослого человека. На печень приходится от 20 до 30% потребляемого организмом кислорода. Клетки печени занимают центральное место в реакциях промежуточного метаболизма и поддержании гомеостаза крови. Поэтому в биохимическом отношении гепатоциты являются как бы прототипом всех остальных клеток.
Слайд 3
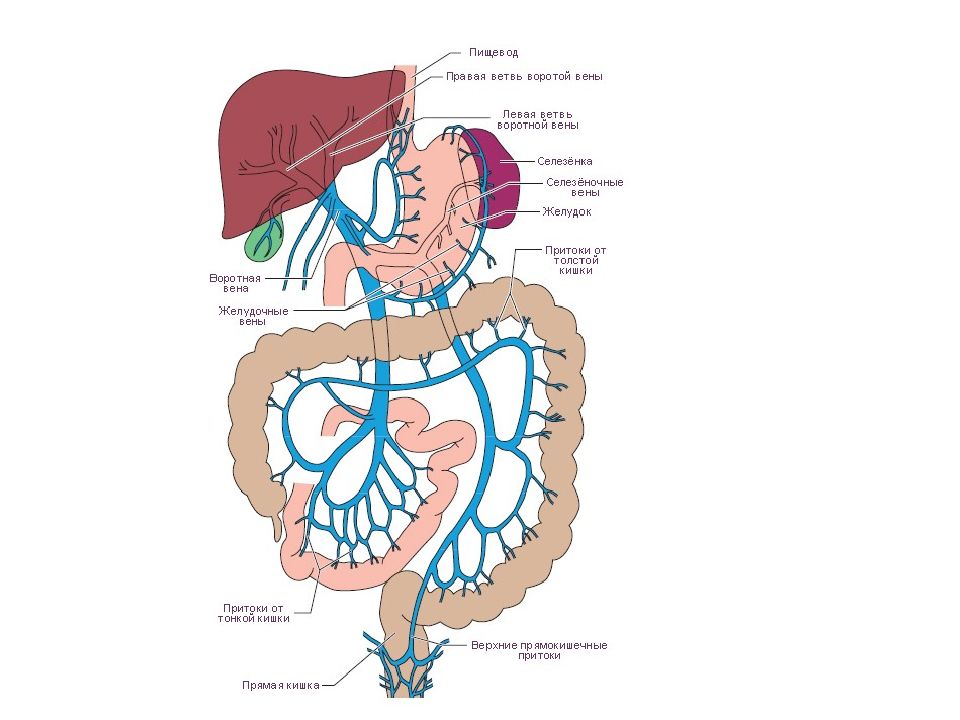
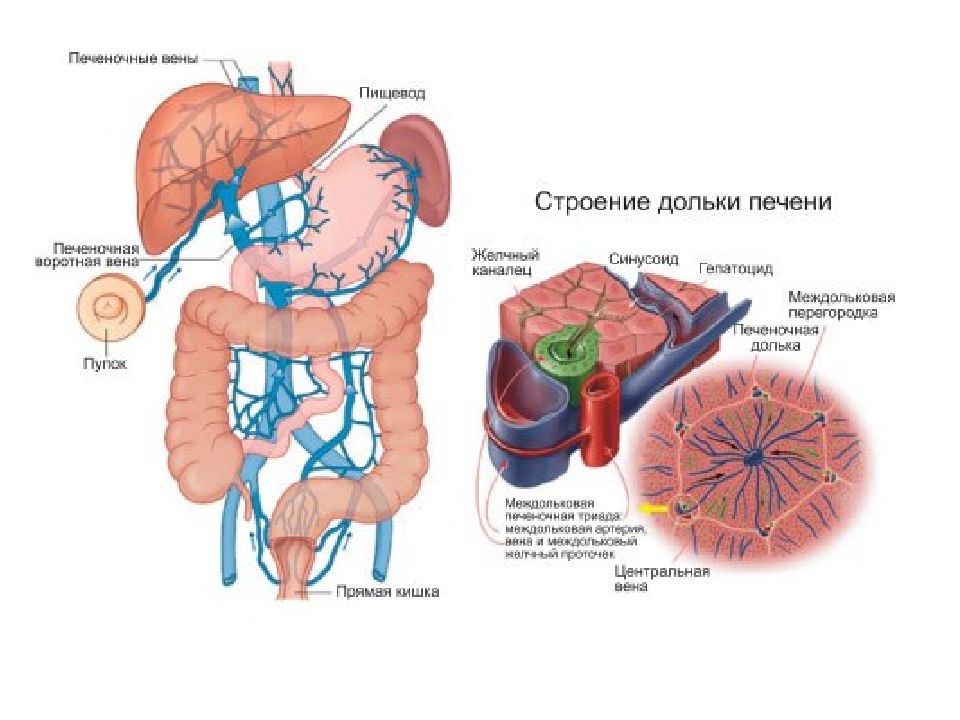
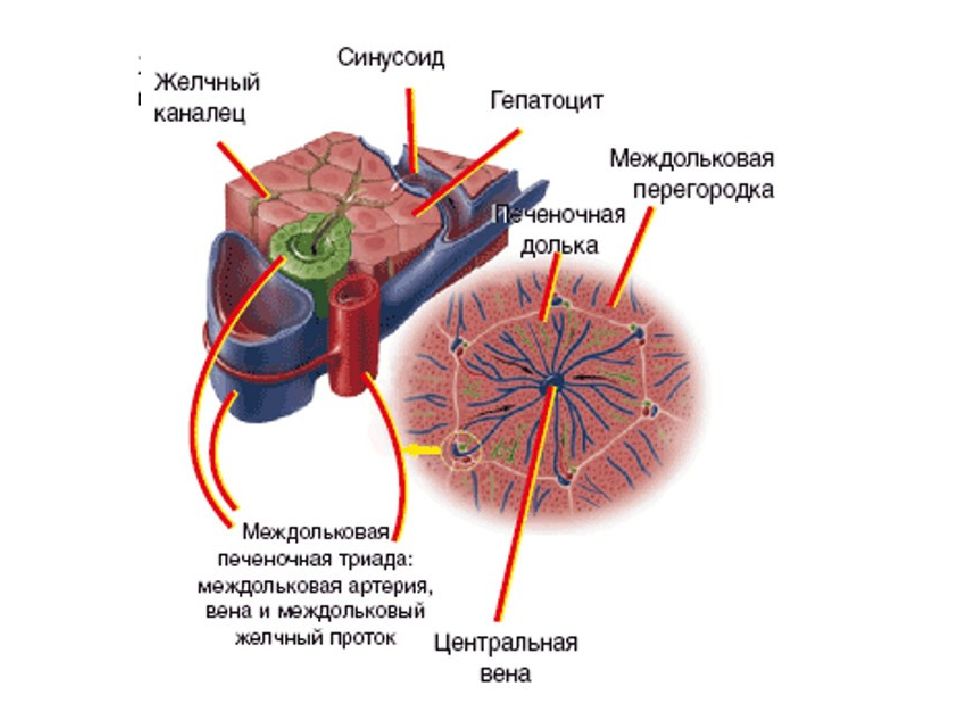
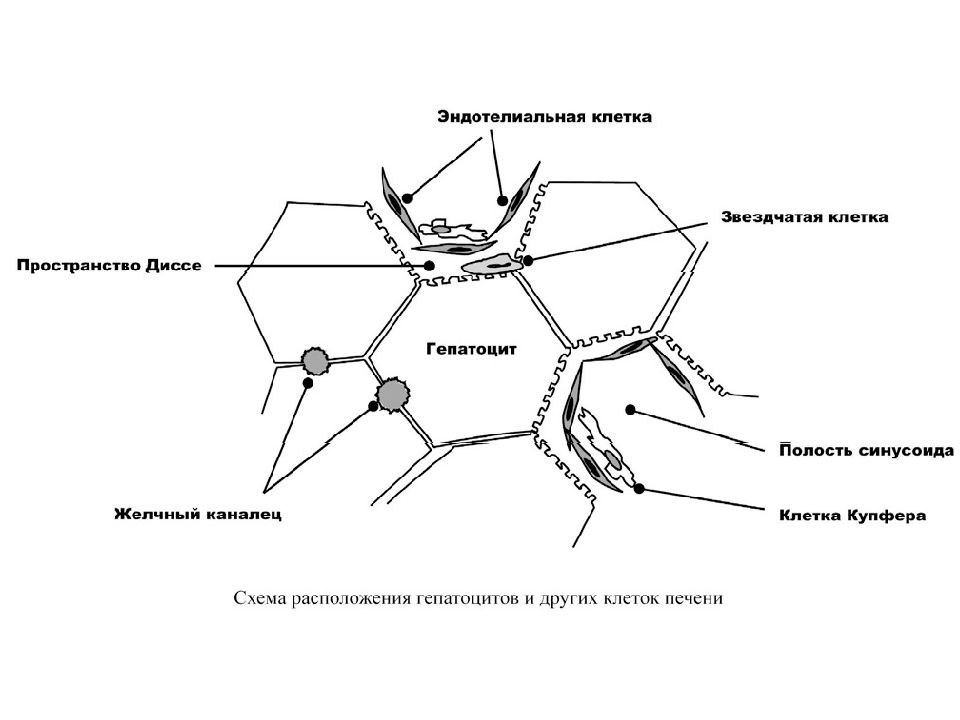
Артериальная кровь, поступающая по печёночной артерии, и кровь воротной вены от желудка, селезёнки, кишечника, поджелудочной железы и других органов брюшной полости, проходит к центру печеночной дольки по общей для них разветвленной сети капилляров между рядами гепатоцитов, называемой синусоидами. Синусоиды соприкасаются с каждым гепатоцитом. В отличие от капилляров других тканей синусоиды не имеют базальной мембраны, их стенка представлена только эндотелиальными клетками. Между эндотелием и гепатоцитами расположено перисинусоидальное пространство – пространство Диссе.
Слайд 7
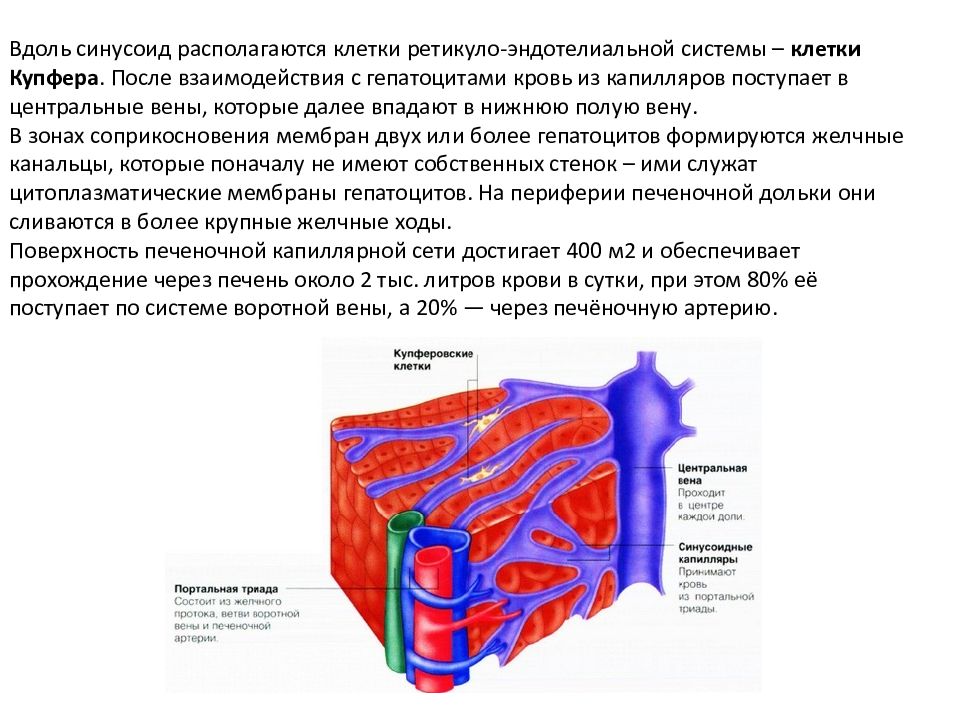
Вдоль синусоид располагаются клетки ретикуло-эндотелиальной системы – клетки Купфера. После взаимодействия с гепатоцитами кровь из капилляров поступает в центральные вены, которые далее впадают в нижнюю полую вену. В зонах соприкосновения мембран двух или более гепатоцитов формируются желчные канальцы, которые поначалу не имеют собственных стенок – ими служат цитоплазматические мембраны гепатоцитов. На периферии печеночной дольки они сливаются в более крупные желчные ходы. Поверхность печеночной капиллярной сети достигает 400 м2 и обеспечивает прохождение через печень около 2 тыс. литров крови в сутки, при этом 80% её поступает по системе воротной вены, а 20% — через печёночную артерию.
Слайд 9
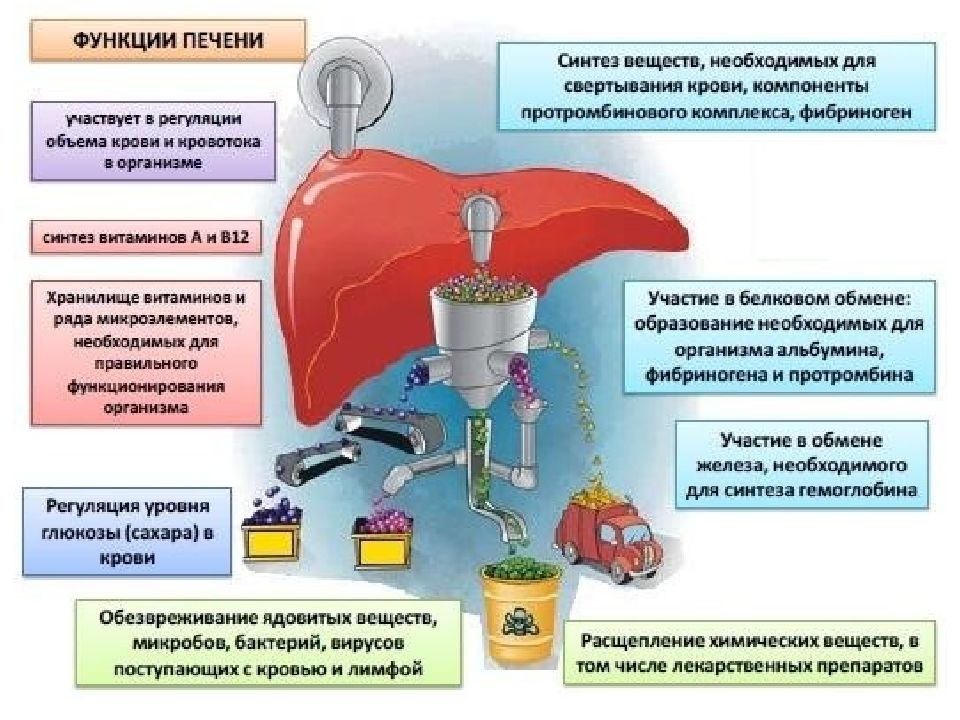
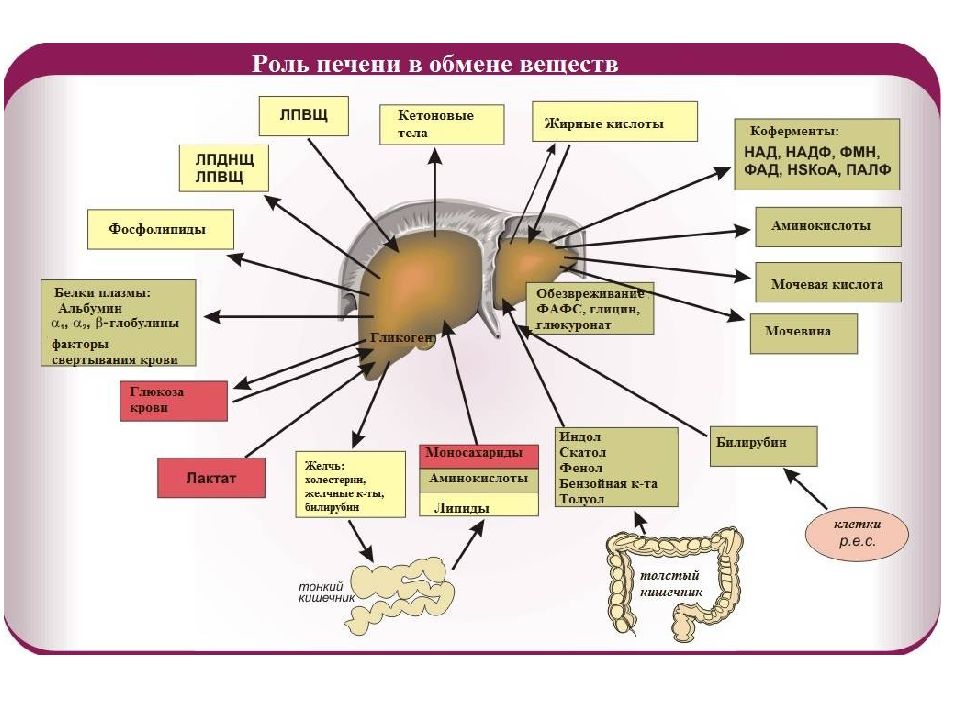
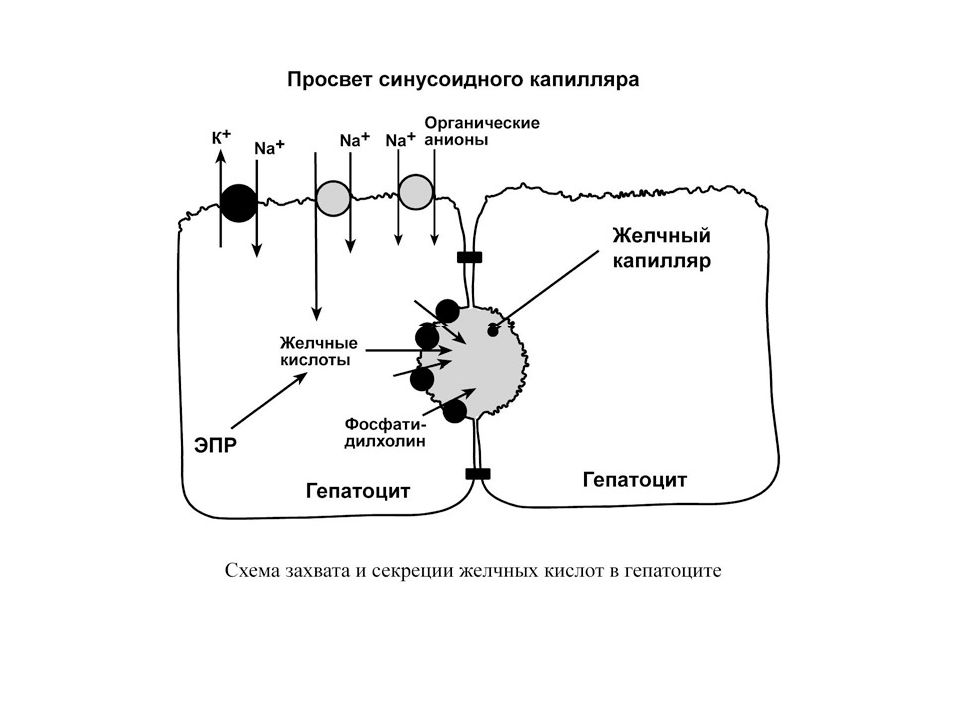
Ф У Н К Ц ИИ П Е Ч Е Н И 1. Пищеварительная – печень является крупнейшей пищеварительной железой. Она образует желчь, включающую воду (82%), желчные кислоты (12%), фосфатидилхолин (4 %), холестерол (0,7%), прямой билирубин, белки, продукты распада стероидных гормонов, электролиты, лекарственные средства и их метаболиты. Желчь обеспечивает эмульгирование и переваривание жиров пищи, стимулирует перистальтику кишечника. Из крови воротной вены желчные кислоты поглощаются симпортом с ионами Na +. В желчный капилляр синтезированные de novo и используемые вторично желчные кислоты секретируются АТФ-зависимым транспортом. 2.. Экскреторная функция, близка к пищеварительной – с помощью желчи выводятся билирубин, немного креатинина и мочевины, ксенобиотики и продукты их обезвреживания, холестерол. Последний выводится из организма только в составе желчи. 3. Секреторная – печень осуществляет биосинтез и секрецию в кровь альбумина и не- которых белков других фракций, белков свертывающей системы, липопротеинов, глюкозы, кетоновых тел, 25-оксикальциферола, креатина. 4. Депонирующая – здесь находится место депонирования энергетических резервов гликогена, накапливаются минеральные вещества, особенно железо, витамины A, D, K, B12 и фолиевая кислота. 5. Метаболическая функция (подробно см ниже) 6. Обезвреживающая функция (подробно см ниже)
Слайд 13
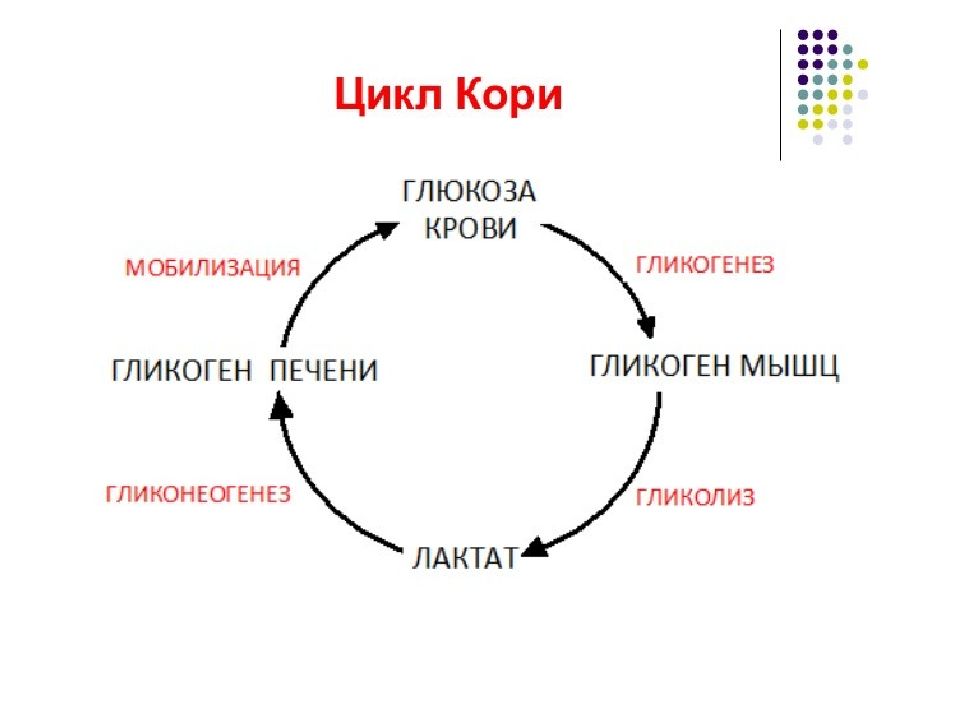
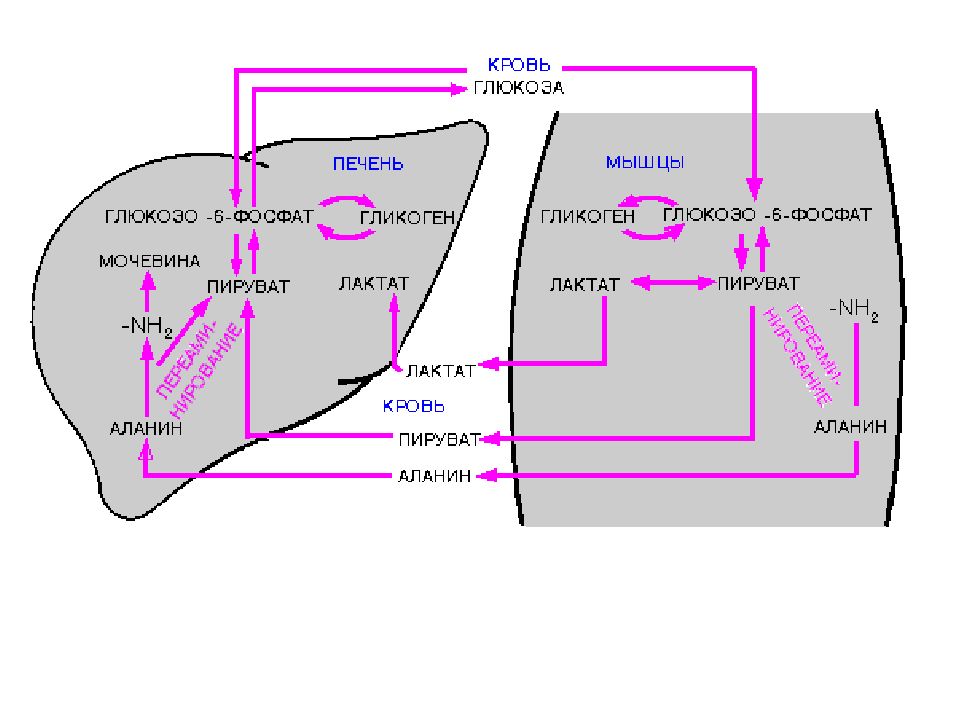
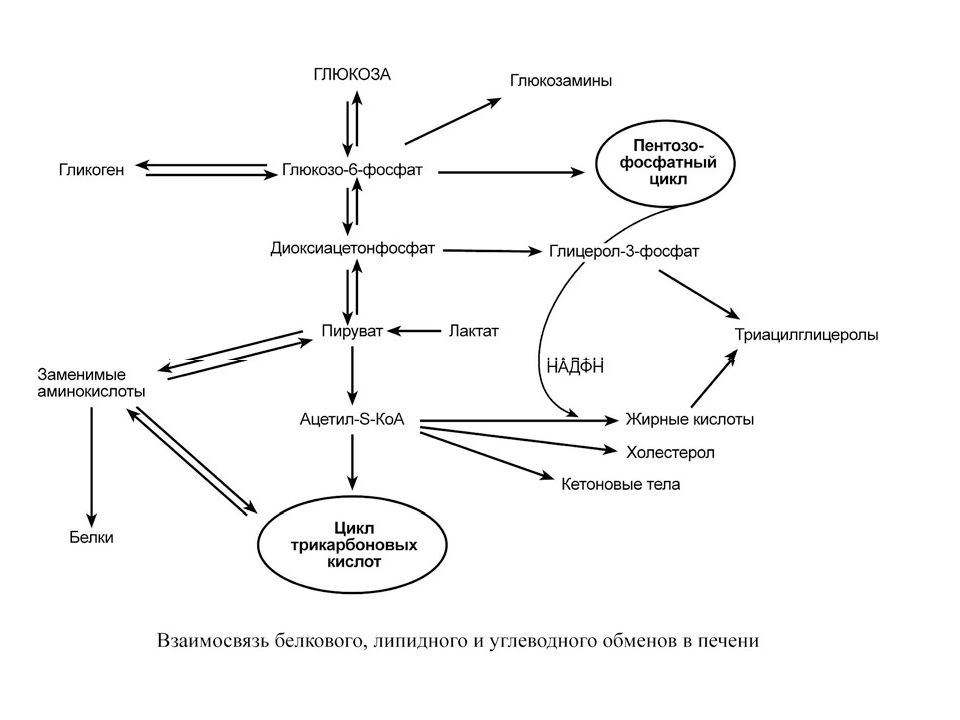
М Е Т А Б О Л И Ч Е С К А Я Ф У Н К Ц И Я Печень является центральным органом метаболизма. Углеводный обмен В гепатоцитах активно протекают процессы углеводного обмена. Благодаря синтезу и распаду гликогена печень поддерживает концентрацию глюкозы в крови. Активный синтез гликогена происходит после приема пищи, когда концентрация глюкозы в крови воротной вены достигает 20 ммоль /л. Запасы гликогена в печени составляют от 30 до 100 г. При кратковременном голодании происходит гликогенолиз, в случае длительного голодания основным источником глюкозы крови является глюконеогенез из аминокислот и глицерина. Печень осуществляет взаимопревращение сахаров, т.е. превращение гексоз ( фруктозы, галактозы) в глюкозу. Активные реакции пентозофосфатного пути обеспечивают наработку НАДФН, необходимого для микросомального окисления и синтеза жирных кислот из глюкозы.
Слайд 16
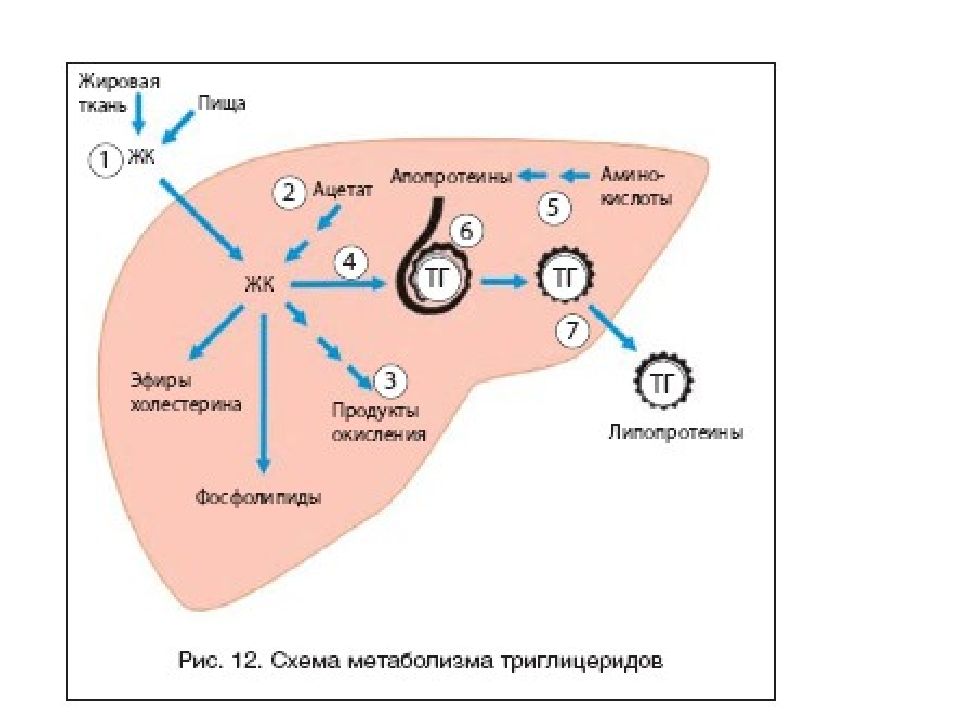
Липидный обмен Если во время приема пищи в печень поступает избыток глюкозы, который не используется для синтеза гликогена и других синтезов, то она превращается в липиды – холестерол и триацилглицеролы. Поскольку запасать ТАГ печень не может, то их удаление происходит при помощи липопротеинов очень низкой плотности ( ЛПОНП ). Холестерол используется, в первую очередь, для синтеза желчных кислот, также он включается в состав липопротеинов низкой плотности ( ЛПНП ) и ЛПОНП. При определенных условиях – голодание, длительная мышечная нагрузка, сахарный диабет I типа, богатая жирами диета – в печени активируется синтез кетоновых тел, используемых большинством тканей как альтернативный источник энергии.
Слайд 19
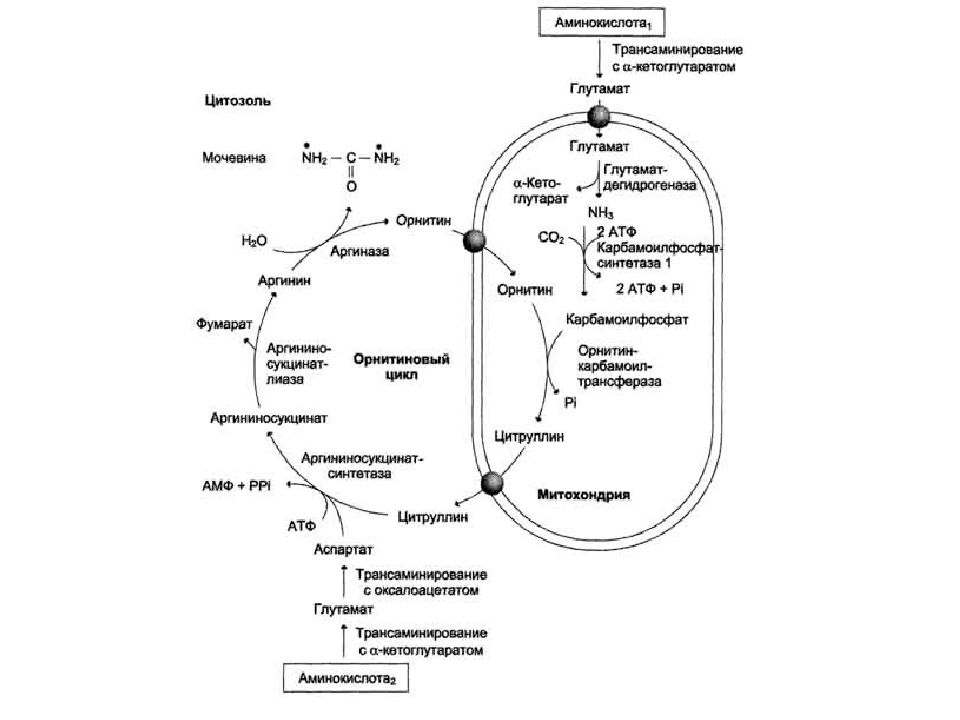
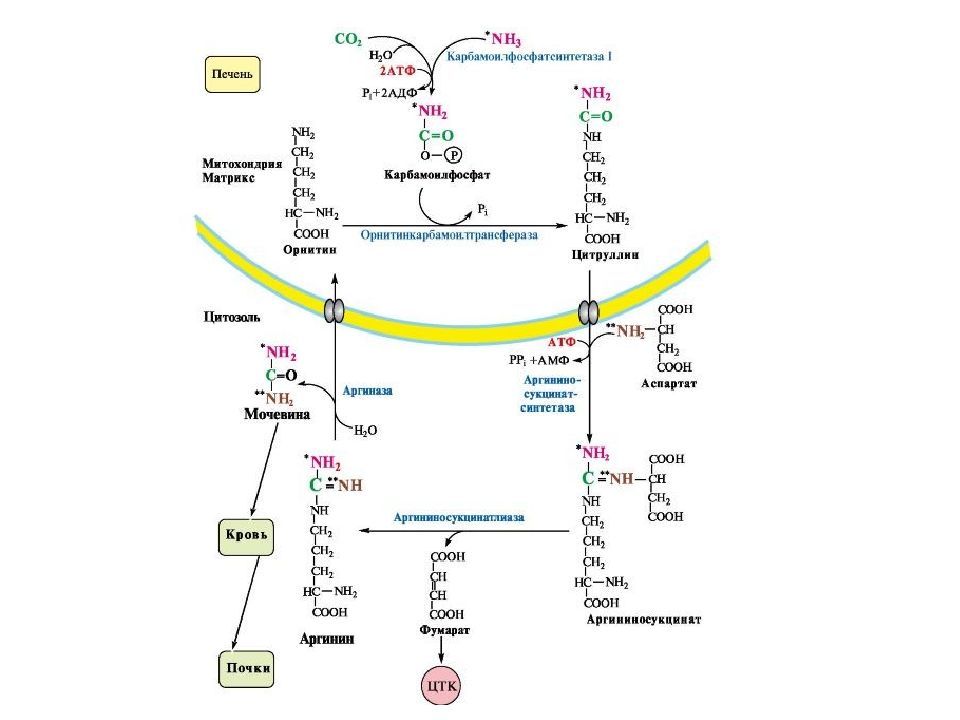
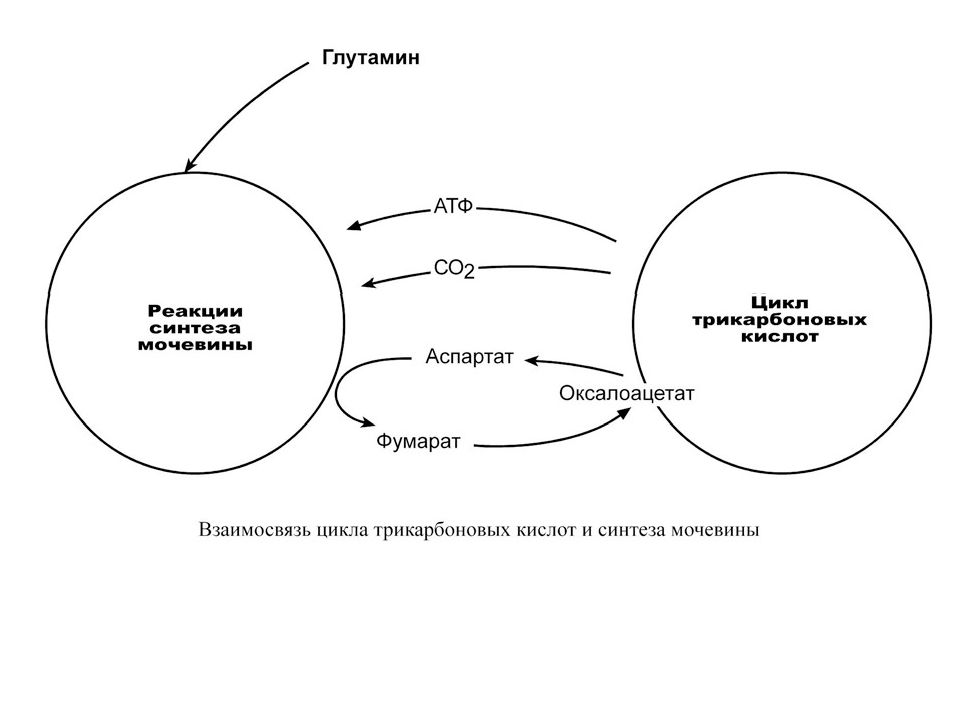
Белковый обмен Больше половины синтезируемого за сутки в организме белка приходится на печень. Скорость обновления всех белков печени составляет 7 суток, тогда как в других органах эта величина соответствует 17 суткам и более. К ним относятся не только белки собственно гепатоцитов, но и идущие на "экспорт" – альбумины, многие глобулины, ферменты крови, а также фибриноген и факторы свертывания крови. Аминокислоты подвергаются трансаминированию, дезаминированию, декарбоксилированию с образованием биогенных аминов. Происходят реакции синтеза холина и креатина благодаря переносу метильной группы от аденозилметионина. В печени идет утилизация избыточного азота и включение его в состав мочевины. Реакции синтеза мочевины теснейшим образом связаны с циклом трикарбоновых кислот.
Слайд 23
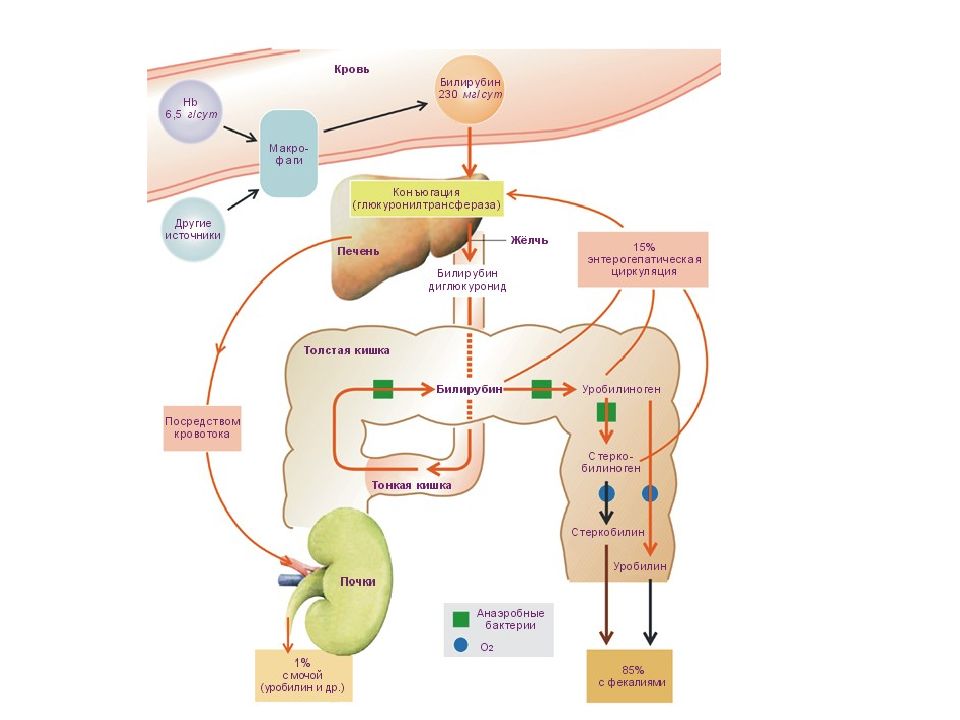
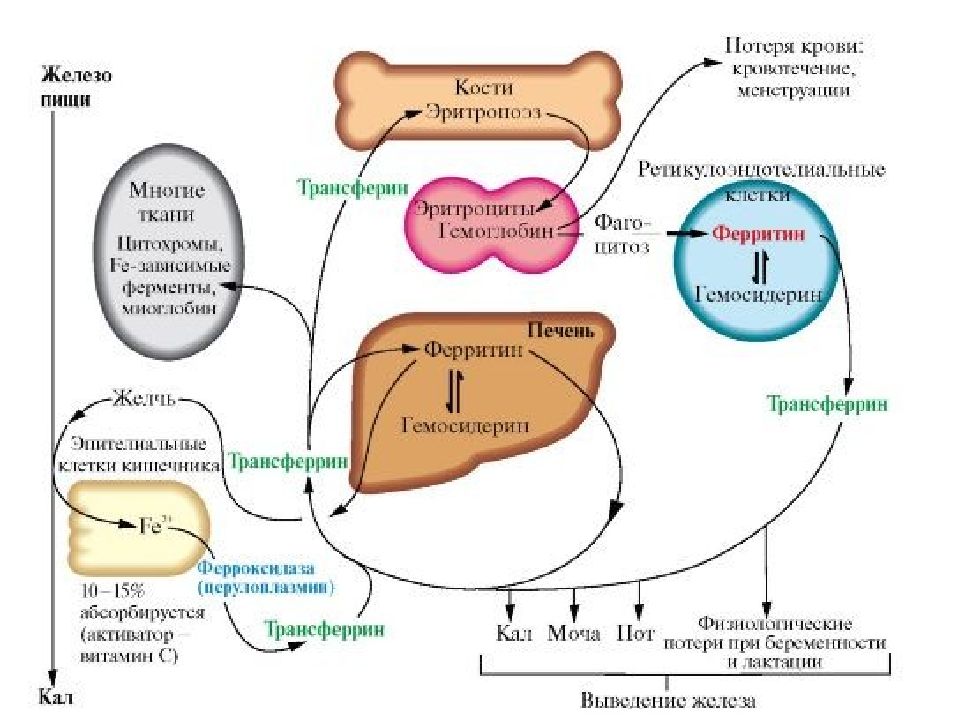
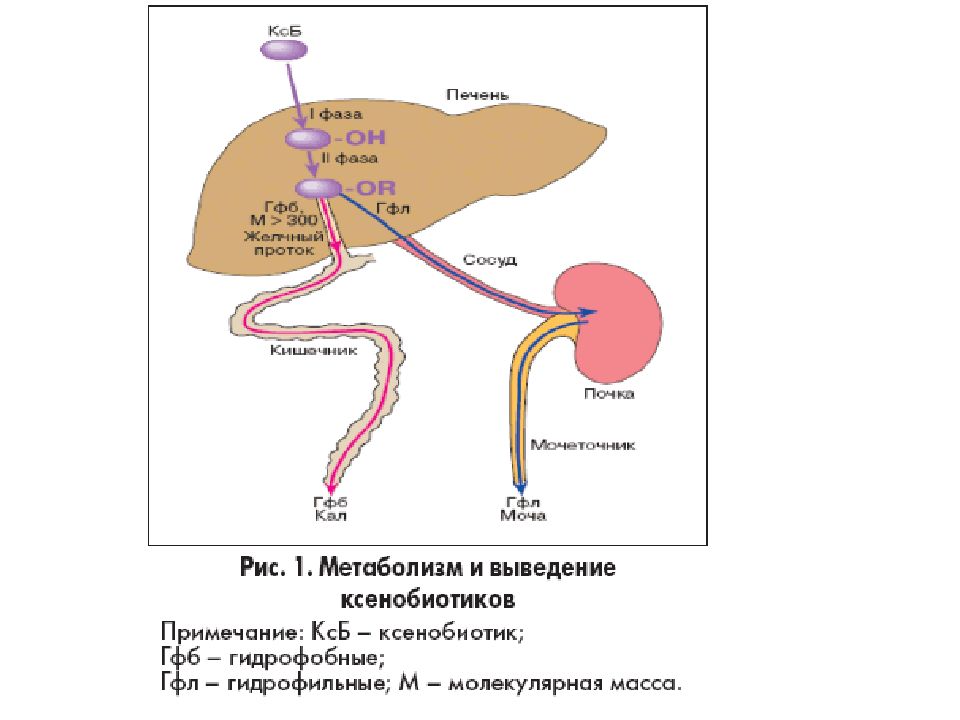
Пигментный обмен Участие печени в пигментном обмене заключается в превращении гидрофобного билирубина в гидрофильную форму и секреция его в желчь. Пигментный обмен, в свою очередь, играет важную роль в обмене железа в организме. в гепатоцитах находится железосодержащий белок ферритин.
Слайд 26
Оценка метаболической функции В клинической практике существуют приемы оценки той или иной функции: Участие в углеводном обмене оценивается: - по концентрации глюкозы крови, - по крутизне кривой теста толерантности к глюкозе, - по "сахарной" кривой после нагрузки галактозой, - по реакции печени на введение гормонов (адреналин). Роль в липидном обмене рассматривается: - по уровню в крови триацилглицеролов, холестерола, ЛПОНП, ЛПНП, ЛПВП, по коэффициенту атерогенности : Коэффициент атерогенности = ХолестеринЛПВП Общий холестерин - ХолестеринЛПВП
Слайд 27
Белковый обмен оценивается : - по концентрации общего белка и его фракций в сыворотке крови, - по показателям коагулограммы, - по уровню мочевины в крови и моче, - по активности ферментов АСТ и АЛТ, ЛДГ-4,5, щелочной фосфатазы, глутаматдегидрогеназы. Пигментный обмен оценивается: - по концентрации общего и прямого билирубина в сыворотке крови.
Слайд 28
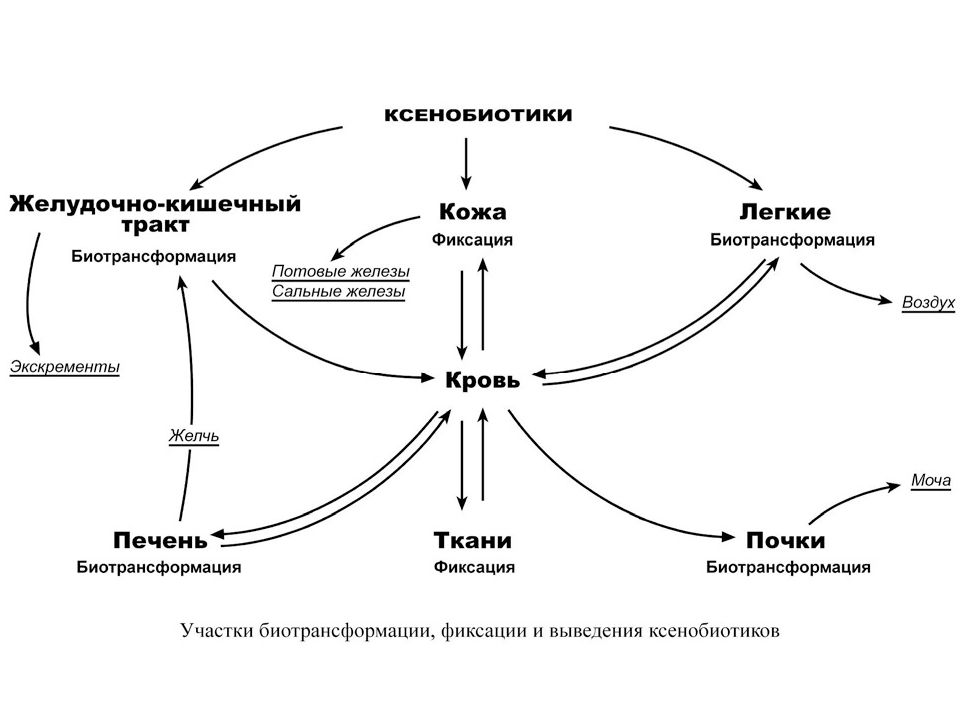
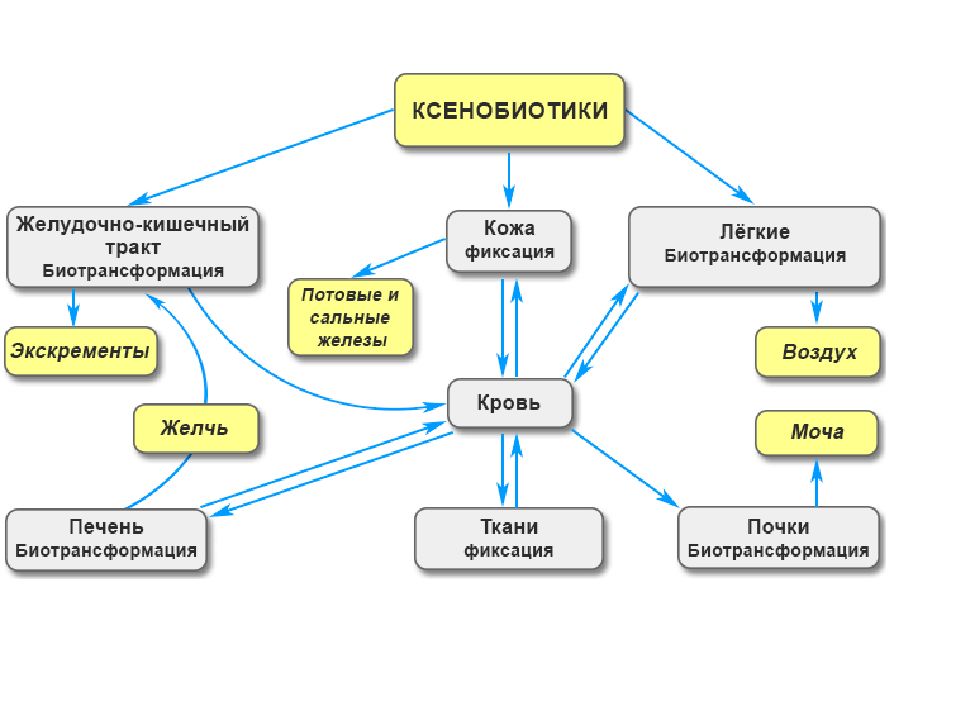
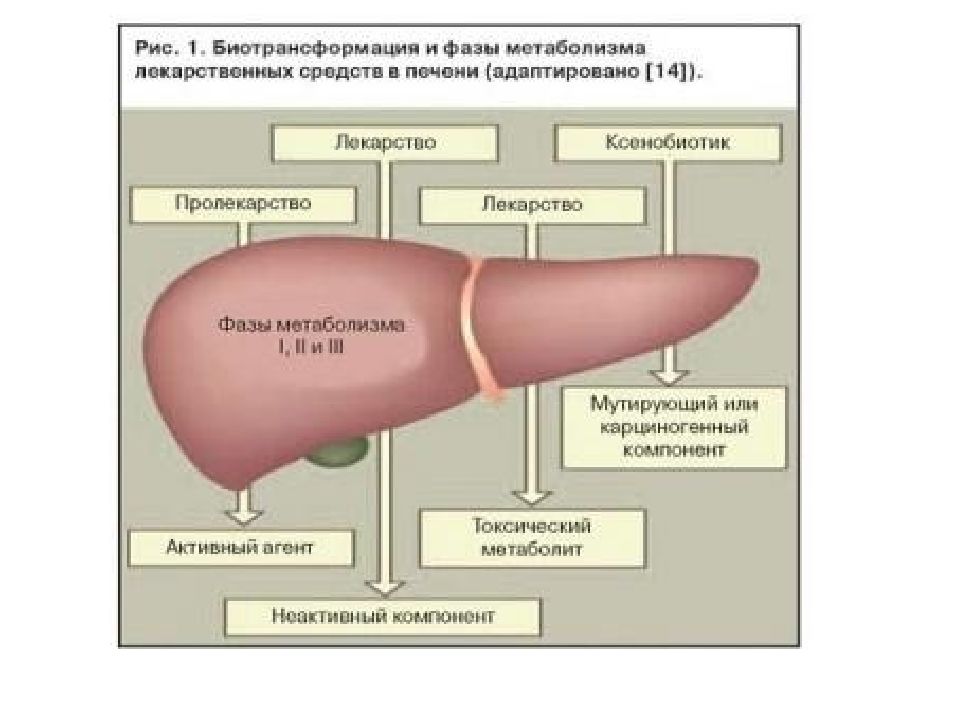
О Б Е З В Р Е Ж И В А Ю Щ А Я Ф У Н К Ц И Я П Е Ч Е Н И Детоксикация ( биотрансформация ) естественных метаболитов и чужеродных соединений ( ксенобиотиков ) протекает в гепатоцитах. Ксенобиотики – вещества, которые не используются как источник энергии, не встраиваются в структуры организма и не используются для пластических целей. Например биотрансформации подвергаются следующие вещества: - стероидные и тиреоидные гормоны, инсулин, адреналин, - продукты распада гемопротеинов (билирубин) и триптофана (индол), - продукты жизнедеятельности микрофлоры, всасывающихся из толстого кишечника – кадаверин (производное лизина), путресцин (производное аргинина), крезол и фенол ( производное фенилаланина и тирозина) и других токсинов, - ксенобиотики (токсины, лекарственные вещества и их метаболиты).
Слайд 31
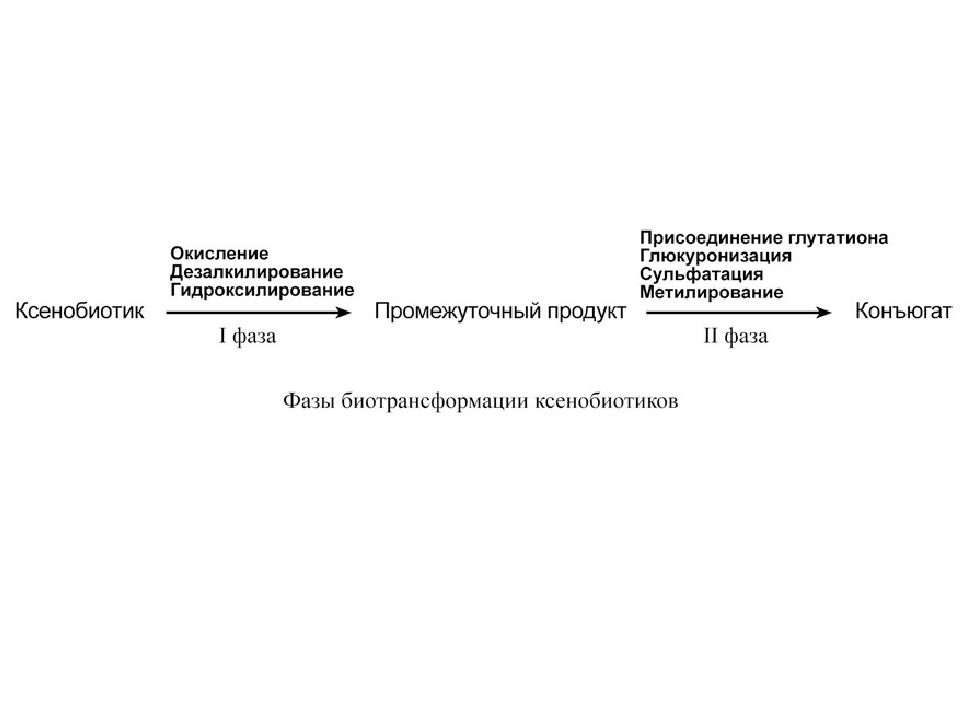
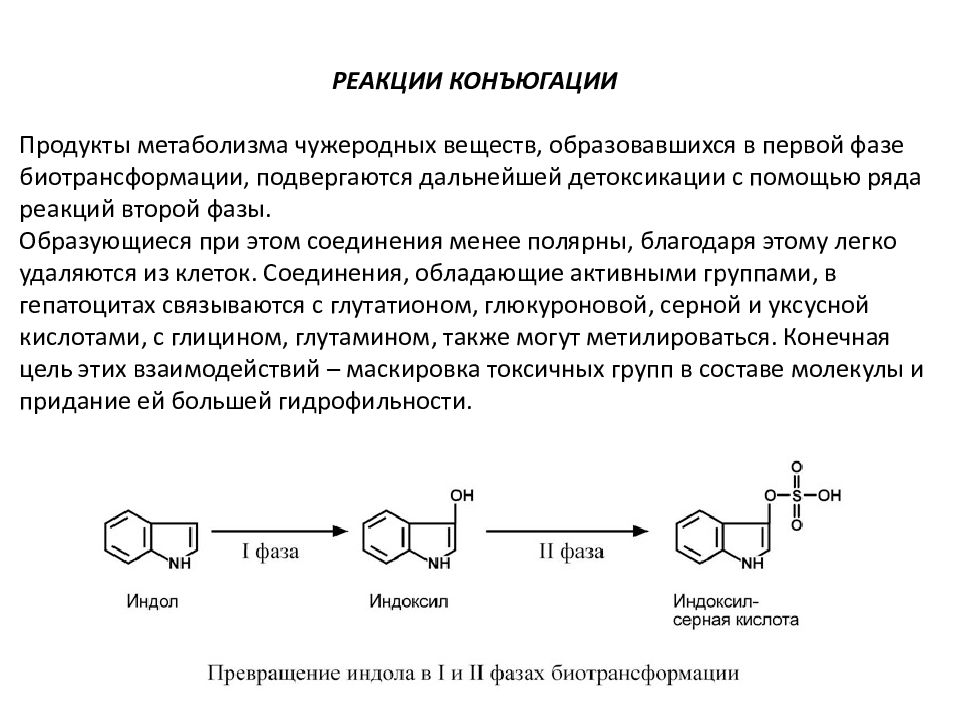
В целом все реакции биотрансформации делят на две группы или фазы: - реакции I фазы – реакции превращения исходного вещества в более полярный метаболит путем введения или раскрытия функциональной группы (-ОН, -NH2, -SH). Эти метаболиты часто неактивны, хотя в некоторых случаях активность не исчезает, а только изменяется. Если эти метаболиты достаточно полярны, они могут легко экскретироваться, - реакции II фазы – отличительным признаком этой фазы являются реакции конъюгации с глюкуроновой, серной, уксусной кислотами, с глутатионом или аминокислотами. Оба типа реакций совершенно самостоятельны и могут идти независимо друг от друга и в любом порядке. Для некоторых веществ после реакций I и II фазы вновь могут наступить реакции фазы I.
Слайд 34
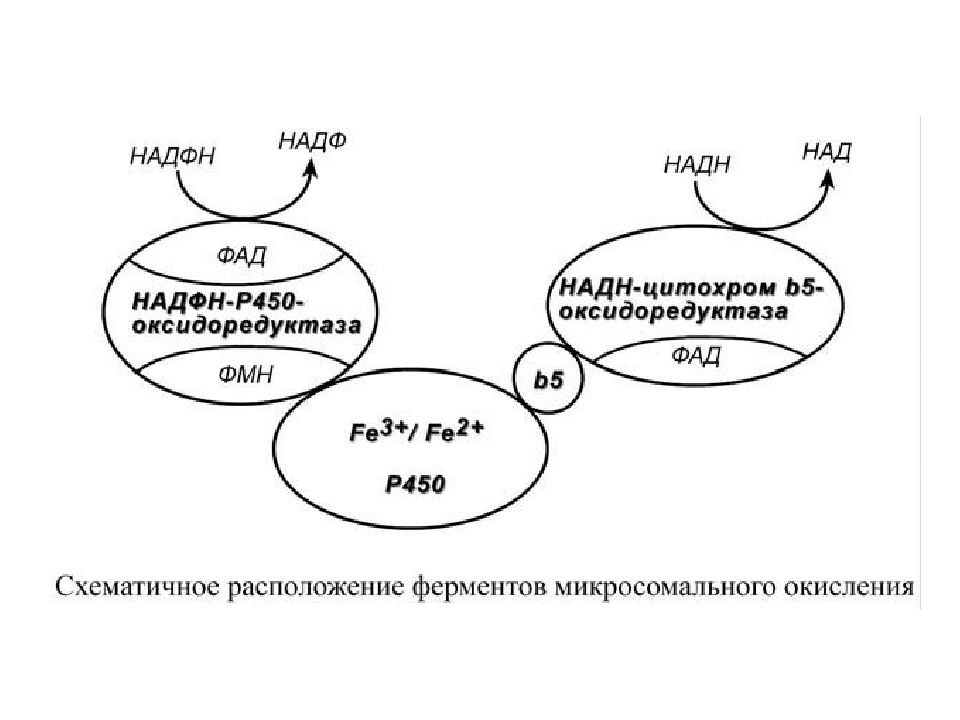
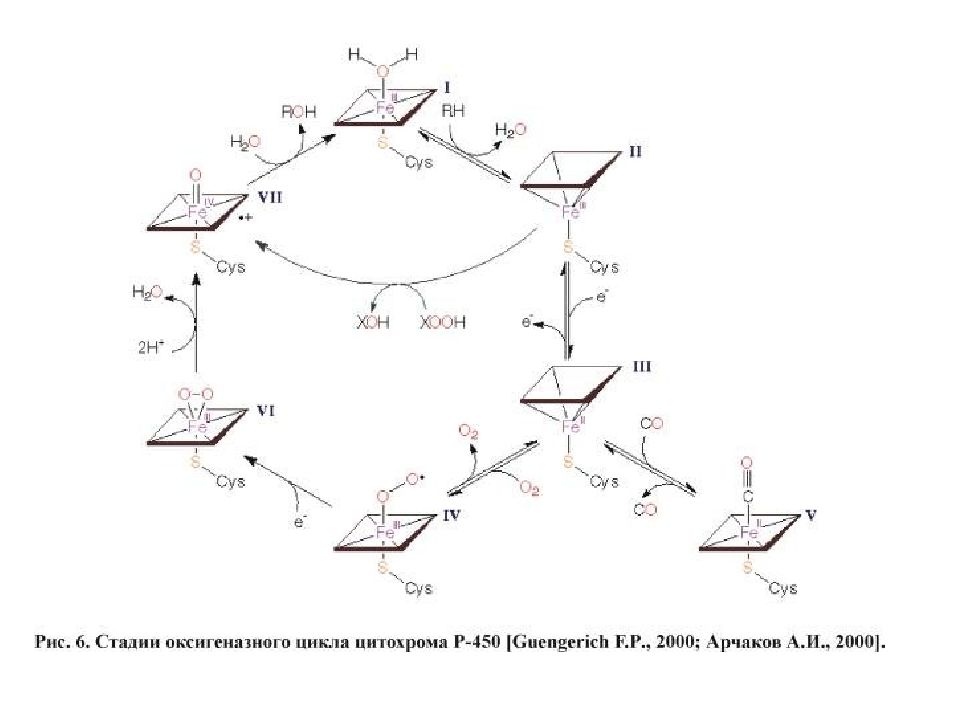
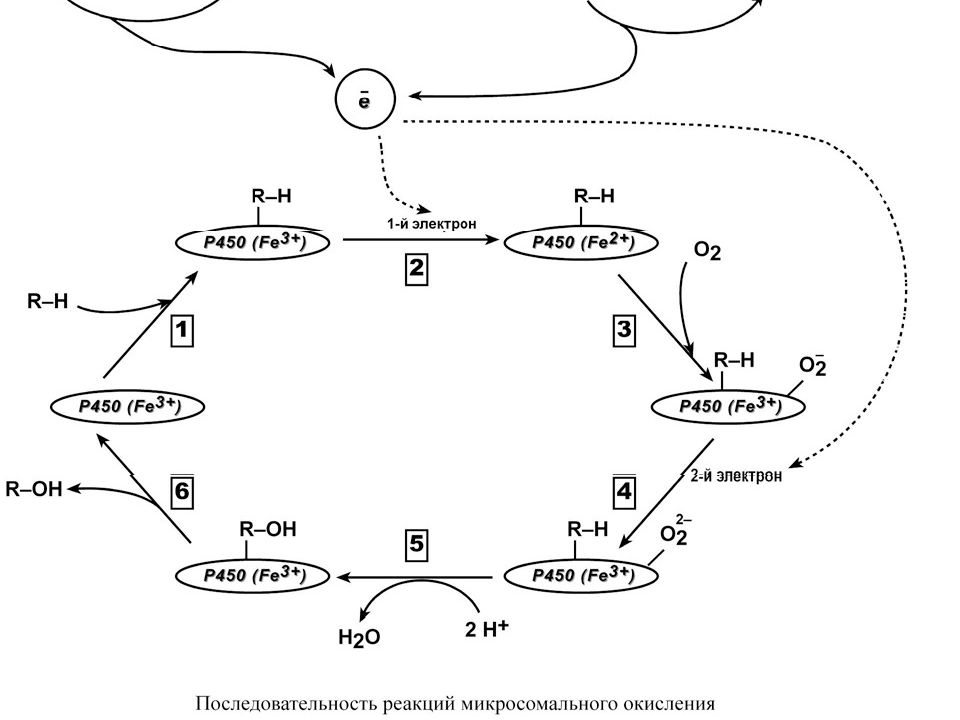
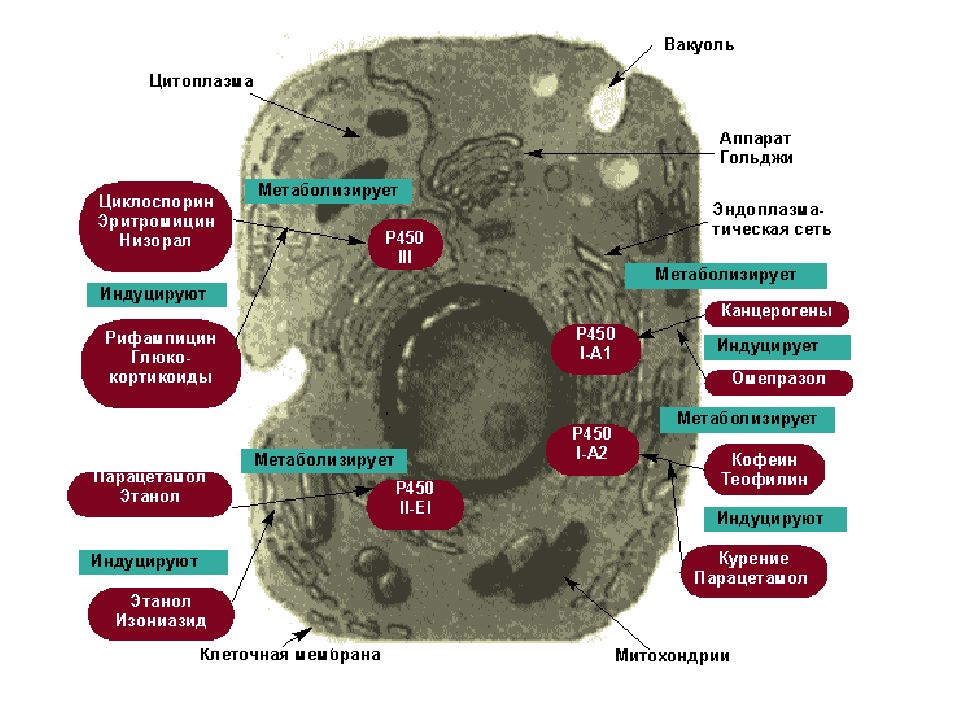
РЕАКЦИИ МИКРОСОМАЛЬНОГО ОКИСЛЕНИЯ Реакции микросомального окисления относятся к реакциям фазы I и предназначены для придания гидрофобной молекуле полярных свойств и/или повышения ее гидрофильности, усиления реакционной способности молекул для участия в реакциях II фазы. В реакциях окисления происходит образование или высвобождение гидроксильных, карбоксильных, тиоловых и аминогрупп, которые являются гидрофильными. Ферменты микросомального окисления располагаются в гладком эндоплазматическом ретикулуме и являются оксидазами со смешанной функцией ( монооксигеназами ). Основным белком этого процесса является гемопротеин – цитохром Р450. В природе существует до 150 изоформ этого белка, окисляющих около 3000 различных субстратов. У млекопитающих идентифицировано 13 подсемейств цитохрома Р450. Считается, что ферменты одних семейств участвуют в биотрансформации ксенобиотиков, других – метаболизируют эндогенные соединения (стероидные гормоны, простагландины, жирные кислоты и др.).
Слайд 35
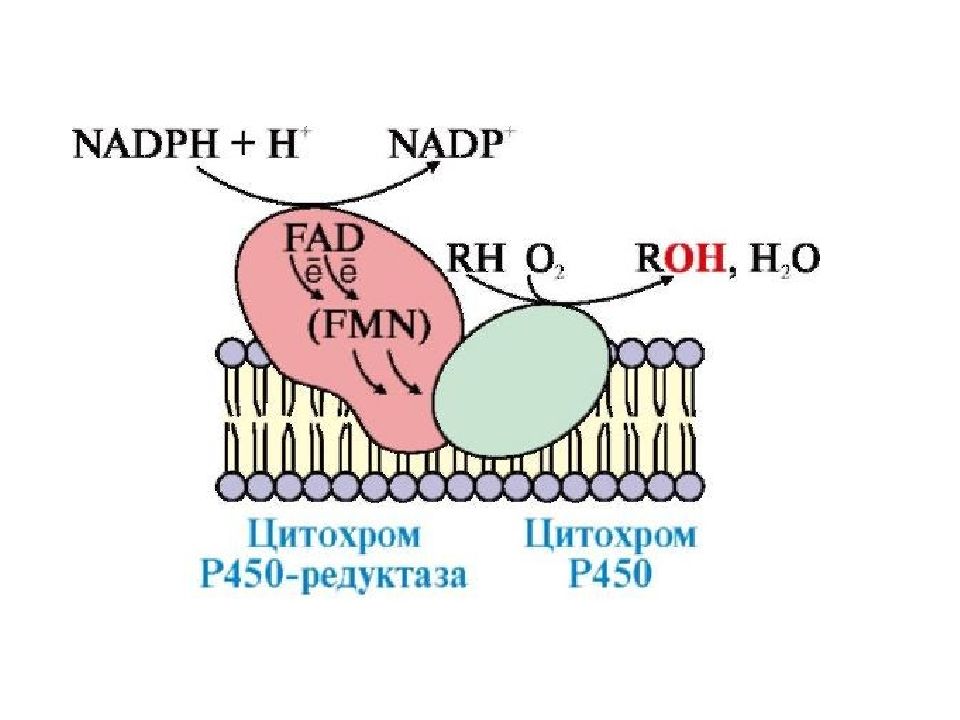
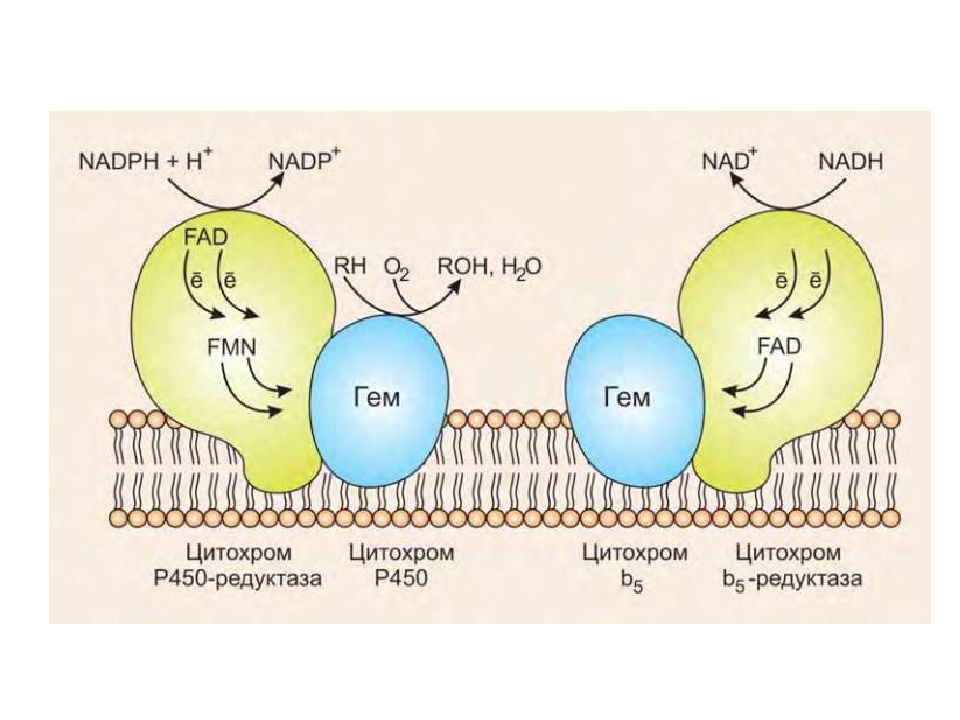
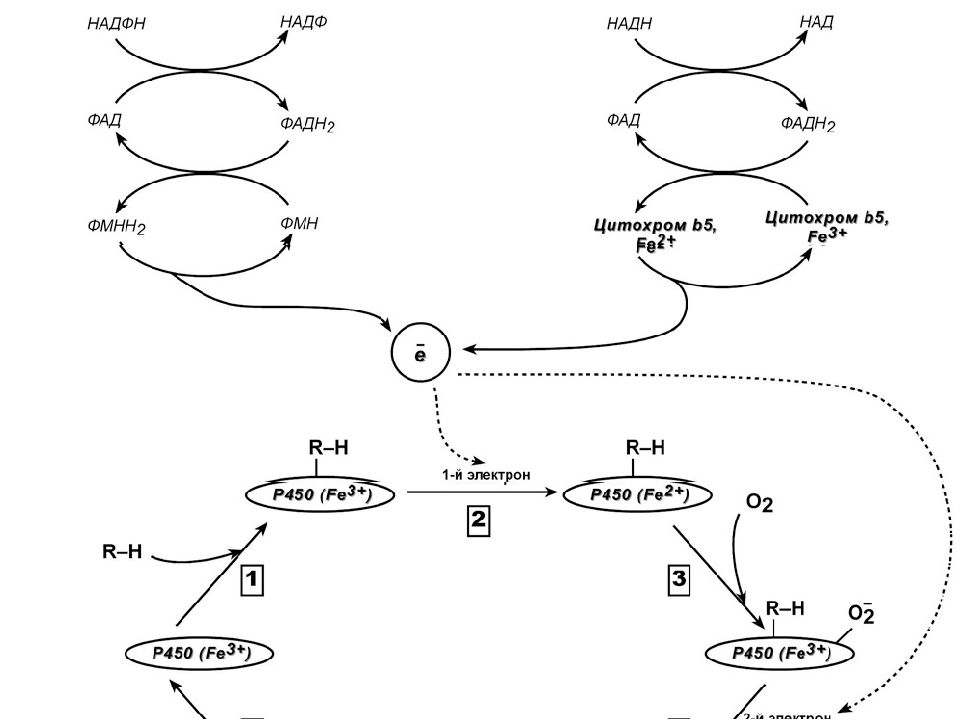
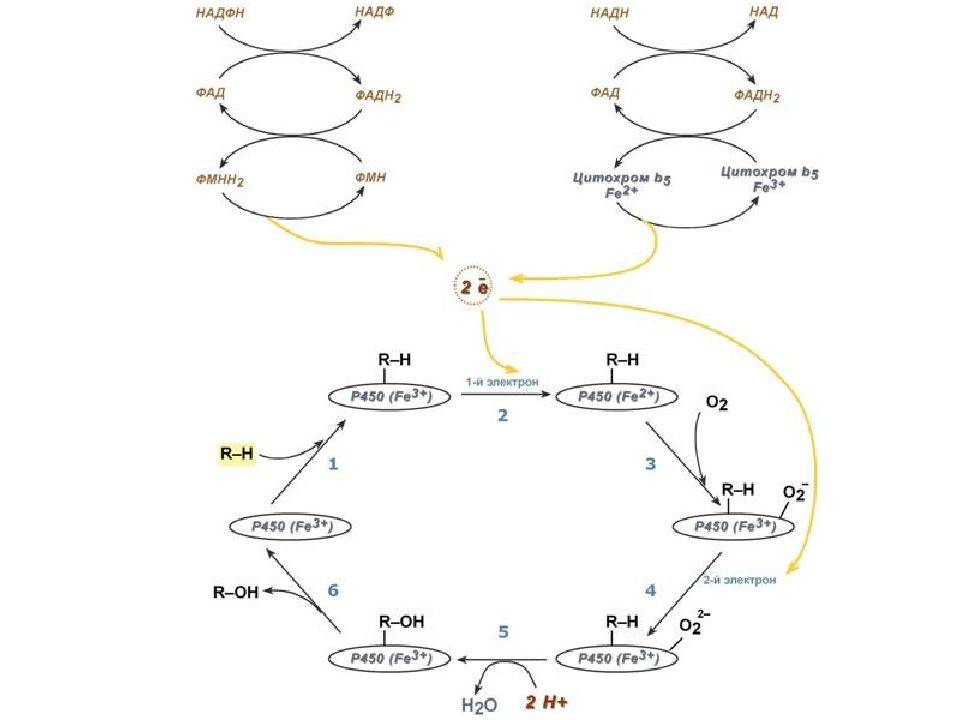
Работа цитохрома Р450 обеспечивается двумя ферментами : НАДН- цитохром b5-оксидоредуктаза, содержит ФАД, 2. НАДФН- цитохром Р450-оксидоредуктаза, содержит ФМН и ФАД. Оба фермента получают электроны от соответствующих восстановленных эквивалентов и передают их на цитохром Р450. Этот белок, предварительно присоединив молекулу восстановленного субстрата, связывается с молекулой кислорода. Получив еще один электрон, он осуществляет окисление субстрата и восстановление одного атома кислорода до воды. Второй атом кислорода включается в состав гидрофобного субстрата.
Слайд 43
Существенной особенностью микросомального окисления является способность к индукции, т.е. увеличению мощности процесса. Индукторами являются вещества, активирующие синтез цитохрома Р450 и транскрипцию соответствующих мРНК. Классическим индуктором считаются производные барбитуровой кислоты – барбитураты. Поскольку существует много изоформ цитохрома, то имеется избирательность среди индукторов. Ингибиторы микросомального окисления связываются с белковой частью цитохрома или с железом гема – спиронолактон, эритромицин. Оценку микросомального окисления можно проводить следующими способами: - определение активности микросомальных ферментов после биопсии, - по фармакокинетике препаратов, - с помощью метаболических маркеров (антипирин).
Слайд 45
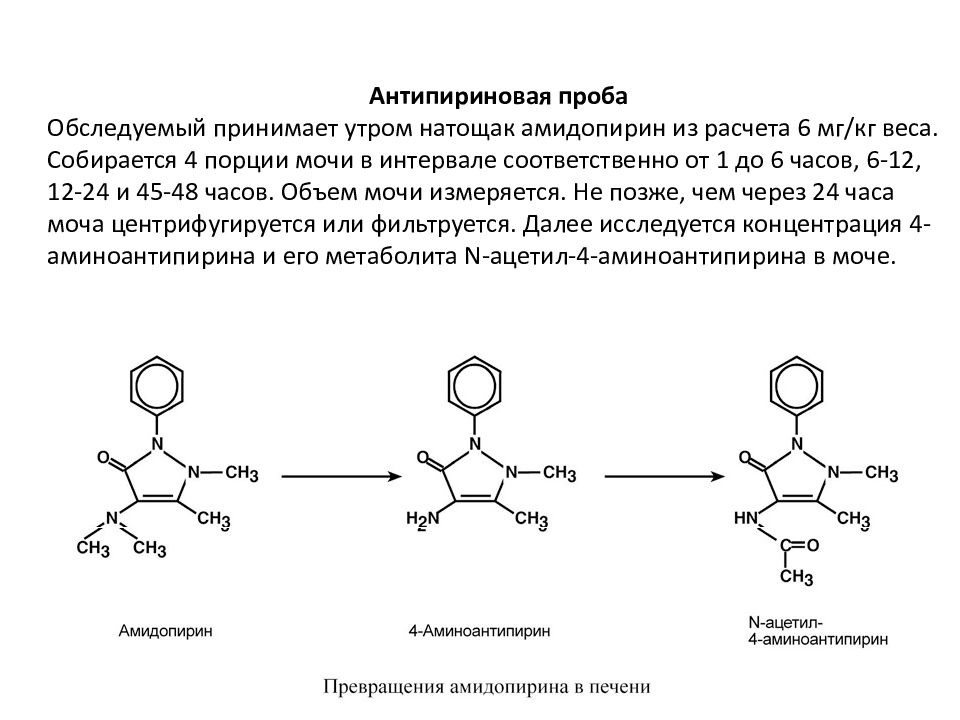
Антипириновая проба Обследуемый принимает утром натощак амидопирин из расчета 6 мг/кг веса. Собирается 4 порции мочи в интервале соответственно от 1 до 6 часов, 6-12, 12-24 и 45-48 часов. Объем мочи измеряется. Не позже, чем через 24 часа моча центрифугируется или фильтрует ся. Далее исследуется концентрация 4-аминоантипирина и его метаболита N-ацетил-4-аминоантипирина в моче.
Слайд 46
РЕАКЦИИ КОНЪЮГАЦИИ Продукты метаболизма чужеродных веществ, образовавшихся в первой фазе биотрансформации, подвергаются дальнейшей детоксикации с помощью ряда реакций второй фазы. Образующиеся при этом соединения менее полярны, благодаря этому легко удаляются из клеток. Соединения, обладающие активными группами, в гепатоцитах связываются с глутатионом, глюкуроновой, серной и уксусной кислотами, с глицином, глутамином, также могут метилироваться. Конечная цель этих взаимодействий – маскировка токсичных групп в составе молекулы и придание ей большей гидрофильности.
Слайд 47
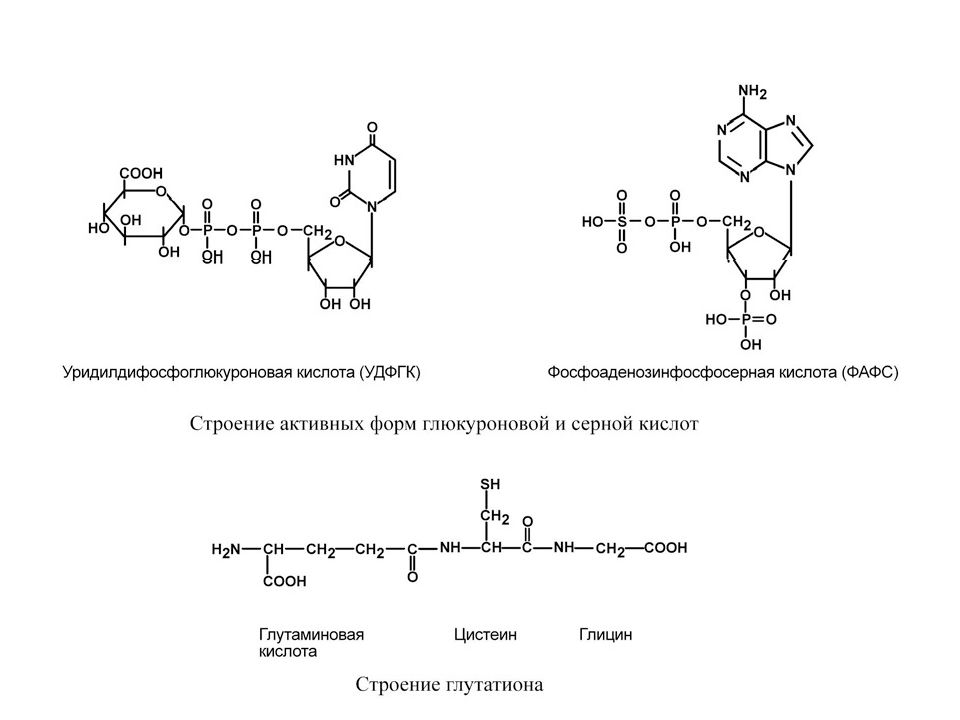
Наиболее активны в печени реакции конъюгации, катализируемые глутатион -S- трансферазой, сульфотрансферазой и УДФ- глюкуронилтрансферазой. Конъюгаты веществ с глутатионом, серной и глюкуроновой кислотами выводятся из организма преимущественно с мочой. Конъюгацию с глутатионом, приводящую к образованию меркаптуровых кислот, принято рассматривать в качестве основного механизма детоксикации. Глутатион представляет собой трипептид.
Слайд 49
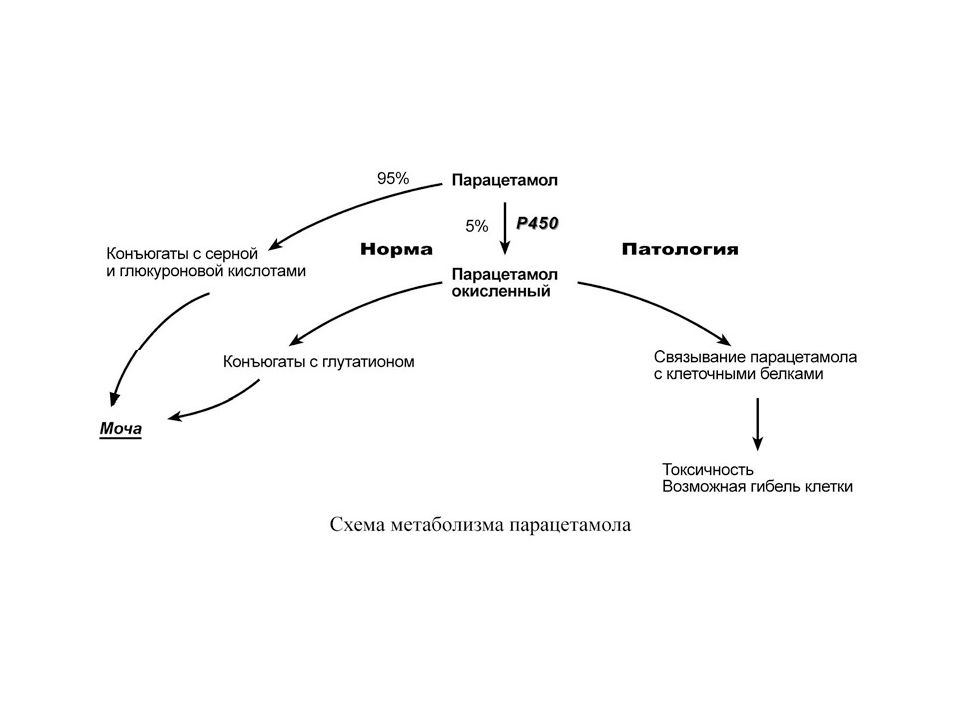
Б И О Т Р А Н С Ф О Р М А Ц И Я С О Б Р А З О В А Н И Е М Т О К С И Ч Н Ы Х П Р О Д У К Т О В Реакции биотрансформации обеспечивают превращение молекул в полярные, гидрофильные вещества, которые лучше удаляются с мочой. Но иногда такие соединения не детоксицируются, а наоборот, становятся более реакционно способными и являются более токсичными, чем их предшественники. В обычных условиях подобные ситуации встречаются редко и не выражены, т.к. мощности систем конъюгации и окисления достаточно. Однако при субстратной перегрузке этих систем, их истощении или при заболеваниях печени доля подобных реакций возрастает и может иметь клиническое значение, что выражается в органотоксичности и химическом канцерогенезе. Органотоксичность В качестве примера рассмотрим метаболизм парацетамола. Обычно парацетамол ( ацетаминофен ) большей частью конъюгирует с глюкуроновой и серной кислотами и небольшая его доля окисляется цитохромом Р450 и далее связывается с глутатионом. При неблагоприятных ситуациях доля окисленного парацетамола возрастает, и он начинает взаимодействовать с клеточными белками, ингибируя их и вызывая гибель клеток.
Слайд 51
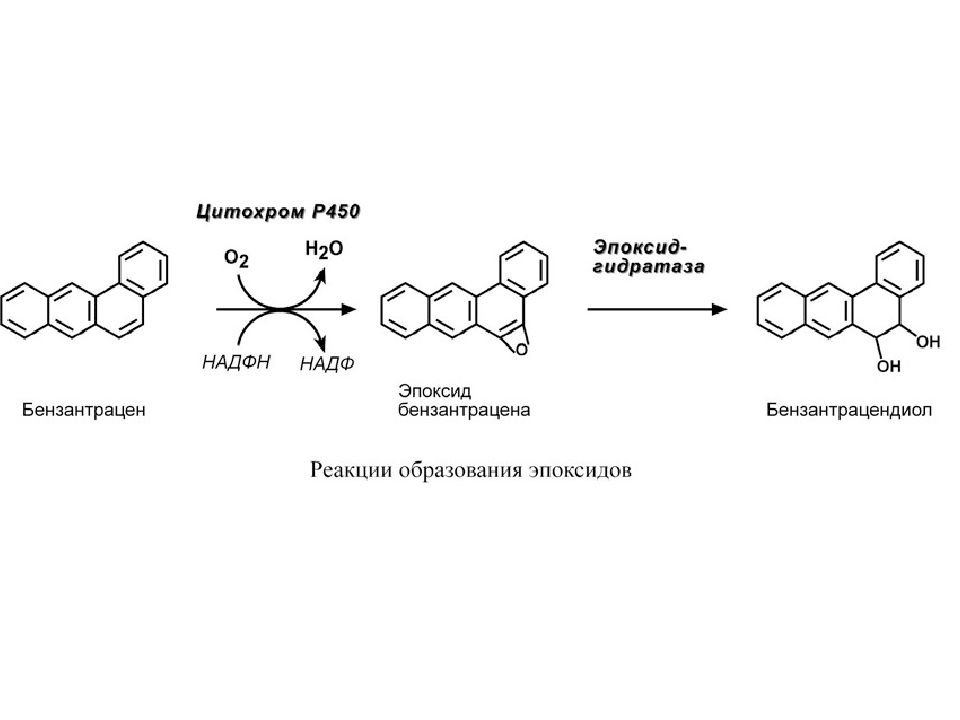
Химический канцерогенез В настоящее время насчитывают до 150 соединений, могущих вызвать онкологические заболевания, им приписывают от 5% до 20% случаев всех опухолей. Все канцерогены подразделяют на: o природные, например, вулканический дым и пепел, металлы (мышьяк, ртуть ), o антропогенные, например, тиомочевина, бензол. В промышленности широко используется около 20 канцерогенных веществ: это амины ( рак мочевого пузыря), соединения кадмия (рак простаты), хрома (рак легких), никеля ( рак носовой полости и легких). Канцерогены могут быть полные, которые вызывают опухоль в месте нанесения, и проканцерогены, когда безвредное соединение, подвергаясь превращениям, становится токсичным. По одной из теорий канцерогенеза, развитие раковых заболеваний стимулируют ароматические соединения, подвергающиеся микросомальному окислению. К примеру, находящийся в каменноугольной смоле бензантрацен после окисления цитохромом Р450 превращается в канцерогенные эпоксид и бензантрацендиол.