Первый слайд презентации: Электрофорез белков сыворотки крови
Слайд 2: Роль электрофоретического анализа
Определение типа электрофореграммы может подтвердить предполагаемый диагноз, выявить скрытую патологию, следить за ходом лечения Абсолютным показанием для исследования электрофореграммы является подозрение на миеломную болезнь, иммунодефицит. Может быть полезным -для диагностики заболеваний печени, нефротического синдрома, злокачественных новообразований, коллагенозов - при контроле течения заболеваний, при которых нарушается белковый состав сыворотки крови - при скрининге врожденного или приобретенного дефицита или аномалии белков - при снижении содержания общего белка < 60 г/л или повышении > 85 г/л, при снижении концентрации альбумина < 35 г/л и при увеличении СОЭ > 25 мм/час
Слайд 3: Электрофореграмма при бисальбуминемии
Выявляется двойная полоса в зоне альбумина Может быть генетически обусловленной или транзиторной Причины: присутствие препарата, связанного с альбумином, заболевания поджелудочной железы (лизис ферментами )
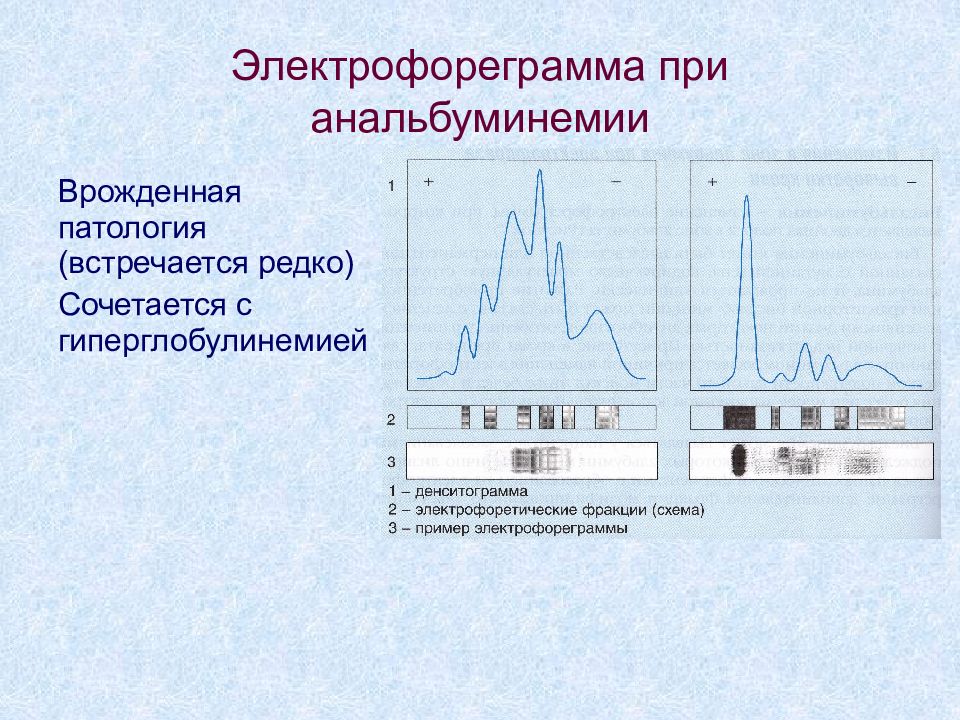
Слайд 4: Электрофореграмма при анальбуминемии
Врожденная патология (встречается редко) Сочетается с гиперглобулинемией
Слайд 5: Электрофореграмма при ожогах
Гипоальбуминемия Белковое голодание Нарушение всасывания в ЖКТ Нарушение синтеза белка Потери белка с мочой Повышение катаболизма белков
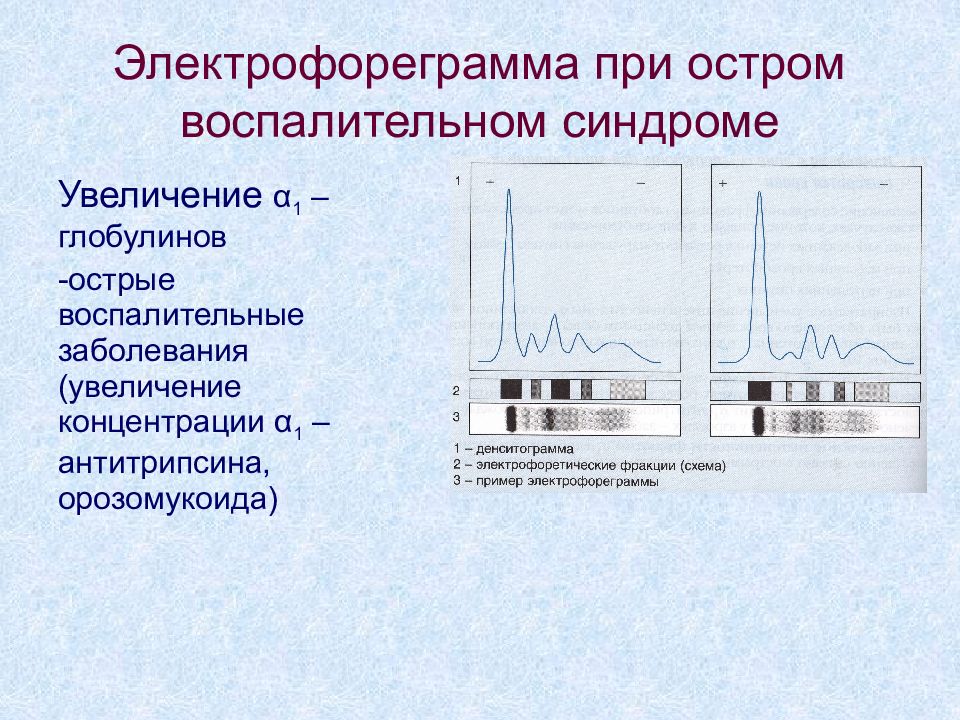
Слайд 6: Электрофореграмма при дефиците α 1 -антитрипсина
Снижение α 1 –глобулинов -заболевания печени -массивные кровопотери -нарушение питания дефиците α 1 –антитрипсина
Увеличение α 1 –глобулинов -острые воспалительные заболевания (увеличение концентрации α 1 –антитрипсина, орозомукоида)
Слайд 8: Электрофореграмма сыворотки крови при нефротическом синдроме
Снижение α 2 –глобулинов Нарушение питания Патология печени Внутрисосудистый гемолиз Увеличение α 2 –глобулинов (преимущественно за счет гаптоглобина и α 2 -макроглобулина) Воспаление (сочетается с увеличением α 1 -глобулинов) Нефротический синдром
Слайд 9: Электрофореграмма сыворотки крови и гипертрансферинемией при анемии
Уменьшение β - глобулинов -патология печени -дефицит С3-компонента комплемента Увеличение β - глобулинов Увеличение β - глобулинов -Гемолизированная сыворотка ЖДА (за счет трасферрина) повышение С3-компонента комплемента
Слайд 10: Электрофореграма сыворотки крови при алкогольном циррозе
Слияние β - и γ - фракции (за счет увеличения поликлонального Ig A )
Слайд 11: Электрофореграмма сыворотки крови при гипогаммаглобулинемии
Физиологическая – у новорожденных Первичный гуморальный иммунодефицит Вторичный – при лечении глюкокортикоидами, иммунодепрессантами, химиотерапии, радиотерапии
Слайд 12: Электрофореграмма сыворотки криви при поликлональной гипергаммаглобулинемии
Диффузное усиление зоны γ - глобулинов (инфекционные заболевания печени, СПИД, аутоиммунные заболевания)
Слайд 13: Электрофореграмма сыворотки крови при олигоклональной гипергаммаглобулинемии
Появление нескольких полос (синтез в организме одновременно нескольких типов антител к различным антигенам) Накопление антител при системных ревматических заболеваниях
Слайд 14: Электрофореграмма сыворотки крови пожилого пациента с моноклональным компонентом
Появление узкой гомогенной полосы У пожилых лиц обнаруживается бессимптомная гаммапатия Встречается миеломе, лимфоме, хроническом лимфолейкозе, болезни Вальденстрема
Слайд 15: Электрофореграмма сыворотки крови с дополнительной полосой, обусловленной присутствием фибриногена, и того же образца после обработки тромбином
Появление дополнительной полосы может в присутствии фибриногена (необходимо повторное проведение электрофореза после обработки тромбином)
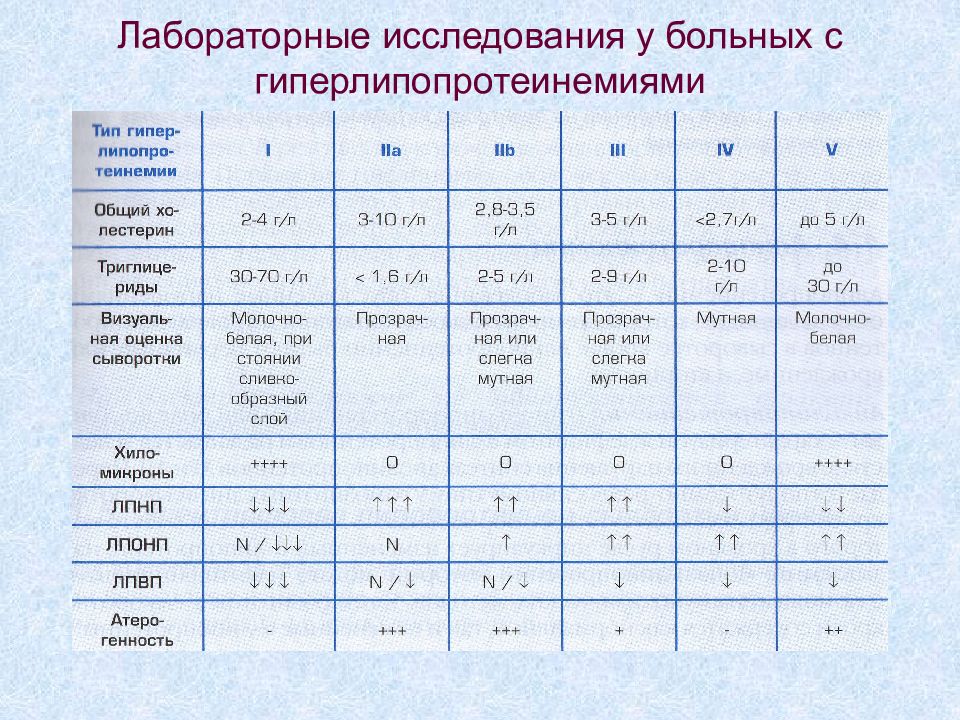
Слайд 17: Схема изменений на электрофореграмме при различных типах гиперлипопротеинемий
Слайд 18: Аполипопротеинемии
Заболевания, сопровождающиеся снижением уровня ЛП в сывортке крови: Ан- α -липопротеинемия (гипо- α -липопротеинемия) – врожденное нарушение синтеза апо ЛП А I и А II (у гомозиготов – вместо α -липопротеина – измененный – Тэнжи-ЛП, у гетерозиготов – нормальный и ихзмененный). При электрофорезе – вместо фракции пре- β - ЛП –широкая полоса β -ЛП А- β -липопротеинемия (гипо- β -липопротеинемия) – наследственное нарушение образования β -липопротеинов, пре- β -липопротеинов и ХМ, связанное с нарушением синтеза апо-ЛП В. В сывортке снижены уровни ХС, ФЛ, ТГ. При электрофорезе не обнаруживаются фракции β -липопротеинов и пре- β -липопротеинов
Слайд 20: Электрофорез ЛП сыворотки крови
В норме β -ЛП – 38,6-69,4% Пре- β -ЛП – 4,4-23,1% α - ЛП – 22,3-53,1% добавочная фракция, соответствующая Лп(а)
Слайд 21: Электрофоретическое исследование холестерина липидных фракций сыворотки крови
Для анализа использовать свежую сыворотку, сразу поместить в холодильник, хранить не более 3 суток при 4 º Нельзя использовать замороженные образцы и применять гепарин При хранении снижается уровень ЛПОНП и повышается ЛПНП Выявление холестерина
Слайд 22: Липопротеин (а)
Липопротеин (а) – липопротеинассоциированный антиген – обогащенная холестерином и белком частица, сходная с ЛПНП. Белковая часть содержит кроме Апо-100 Апо(а) –апапротеин, соединенный с ЛПНП дисульфидным мостиком Молекула ЛП(а) крупнее и имеет большую плотность, чем ЛПНП, имеет подвижность, близкую к пре- β -ЛП.
Слайд 23: Липопротеин (а)
подавляет фибринолиз, способствует тромбозу N – до 140 мг/дл у мужчин, до 150 – у женщин Не зависит об возраста, пола, факторов риска (курение, гипертензия, образ жизни) При повышении > 300 мг/дл - двукратное повышение риска ИБС Измерять следует : - при подозрении на атеросклероз, особенно при повышении хсЛПНП - при оценке риска ИБС у лиц среднего возраста - при назначении ггиполипидемической терапии - при отсутсвии эффекта от статинов - для оценки риска рестенозов при ангиопластике - для оценки риска развития сердечно-сосудистых осложнений при СД Липопротеин (а)
Слайд 24: Липопротеин (а)
Повышение уровня - при нефротическом синдроме - у больных на гемодиализе - при плохо контролируемом СД - при гипотиреозе - в острой стадии ИМ Понижение уровня - при гипертиреозе - у пациентов, принимающих эстрогены - при лечении неомицином
Слайд 25: Электрофоретическое исследование гемоглобинов
Основная форма – Hb А (две α –цепи и две – β - цепи) В незначительном количестве – Hb А 2 (две α –цепи и две – δ - цепи) и HbF (две α –цепи и две – γ - цепи) (У новорожденного 80% HbF, заменяется в течение 1 года жизни) Аномальные Hb HbS – остаток глу β - цепи заменен на вал Hb М – гис, связывающий Fe, заменен другими аминокислотами Hb С - остаток глу β - цепи заменен на лиз Другие формы
Слайд 26: Значение исследования Hb
Для диагностики некоторых форм анемий у взрослых Для скрининга наследственных анемий у новорожденных Для дифференциальной диагностики анемий с другими заболеваниями (печени и др.)
Слайд 27: Наследственные гемоглобинопатии
Количественные, или талассемии, связанные с уменьшением или полным отсутствием синтеза α – и β -цепей ( α - талассемия и β - талассемия) Структурные или качественные, обусловлены синтезом других разновидностей Hb ( S, C, E и др.) Смешанные ( HbE - β - талассемия, HbS - β - талассемия, HbS - β - талассемия )
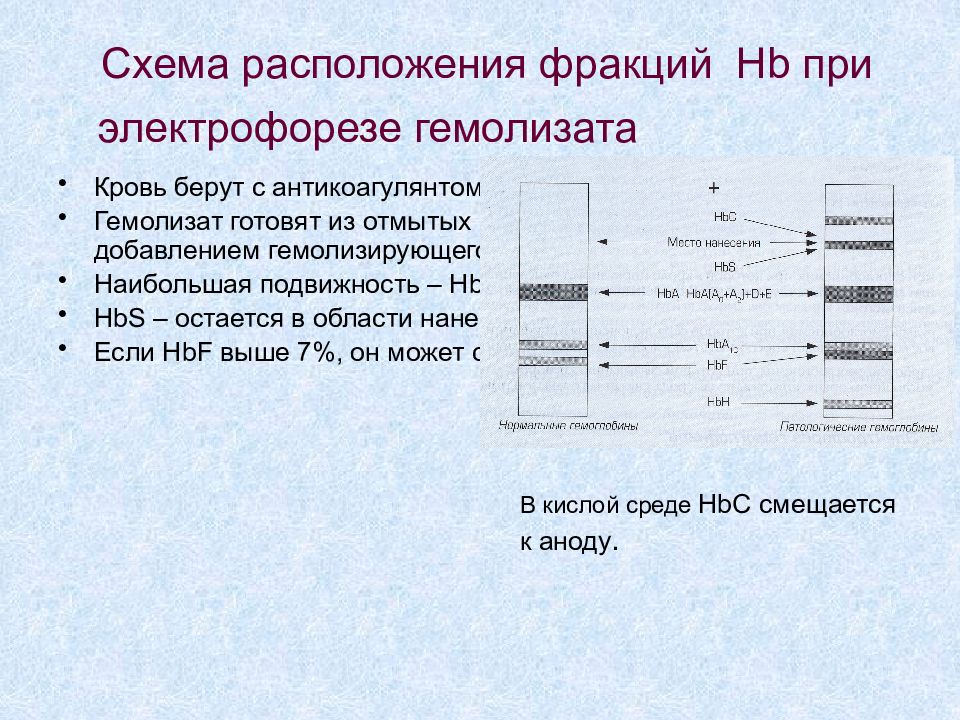
Слайд 29: Схема расположения фракций Hb при электрофорезе гемолизата
Кровь берут с антикоагулянтом Гемолизат готовят из отмытых физ р-ром эритроцитов добавлением гемолизирующего реактива Наибольшая подвижность – HbH, затем HbA и HbC HbS – остается в области нанесения Если HbF выше 7%, он может сливаться с гликированным Hb В кислой среде HbC смещается к аноду.
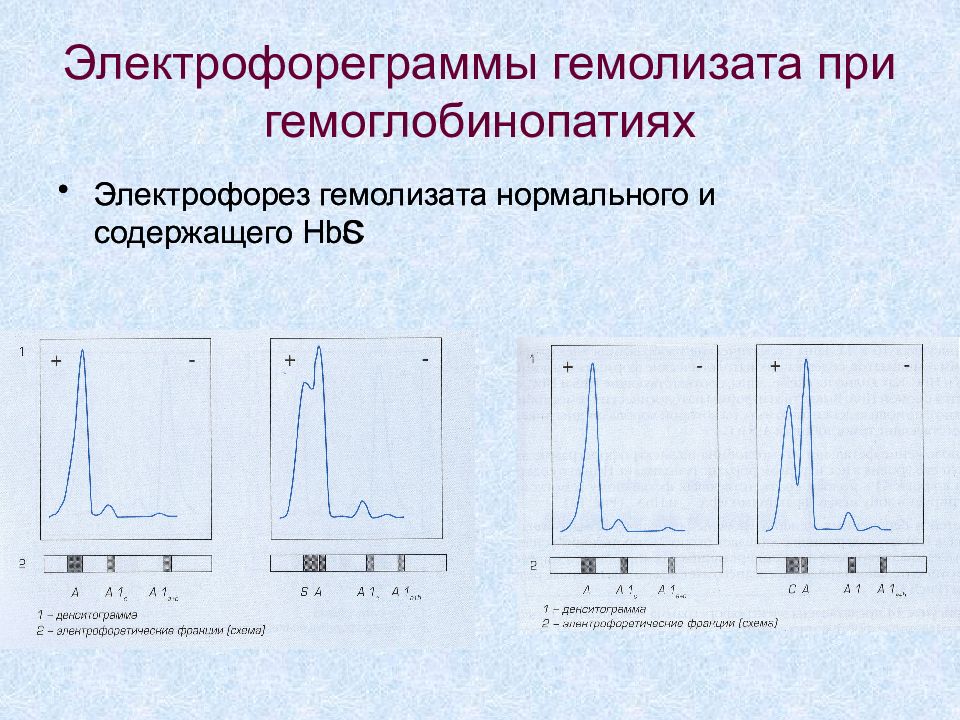
Слайд 30: Электрофореграммы гемолизата при гемоглобинопатиях
Электрофорез гемолизата нормального и содержащего HbS Электрофорез гемолизата нормального и содержащего HbC
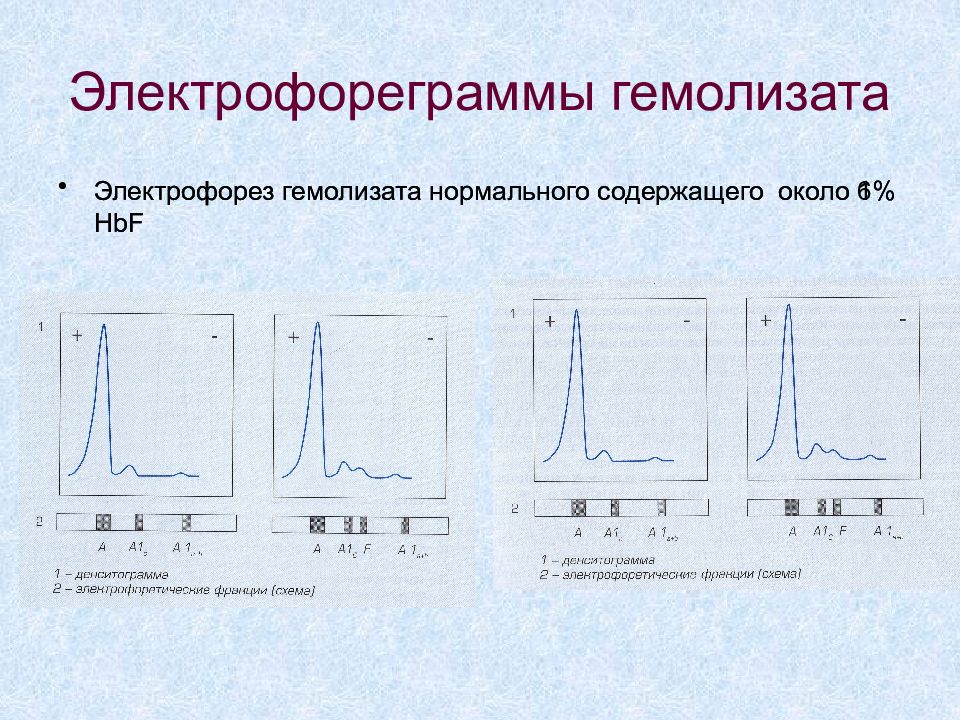
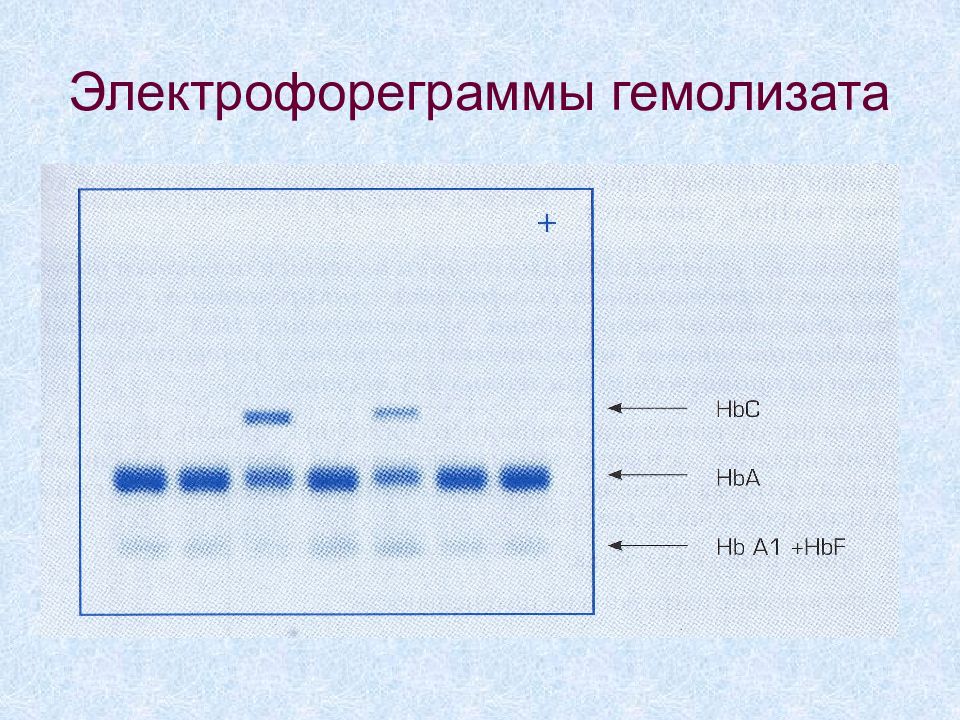
Слайд 31: Электрофореграммы гемолизата
Электрофорез гемолизата нормального содержащего около 1% HbF Электрофорез гемолизата нормального содержащего около 6 % HbF
Слайд 33: Гликированный гемоглобин
Гликированный Hb имеет большую катодную подвижность
Слайд 34: Гликированный гемоглобин
Ложно высокий уровень : - присутствие патологических форм Hb - при кровопотере в связи с большим содержанием молодых эритроцитов - при увеличении продолжительности жизни эритроцитов (гемолитическая анемия, полицитемии, спленэктомия)
Слайд 35: Изоферменты сыворотки крови
ЛДГ ЛДГ 1 – 16-30% ЛДГ 2 – 30-40% ЛДГ 3 – 20-26% ЛДГ 4 – 6-12% ЛДГ 5 – 3-6%
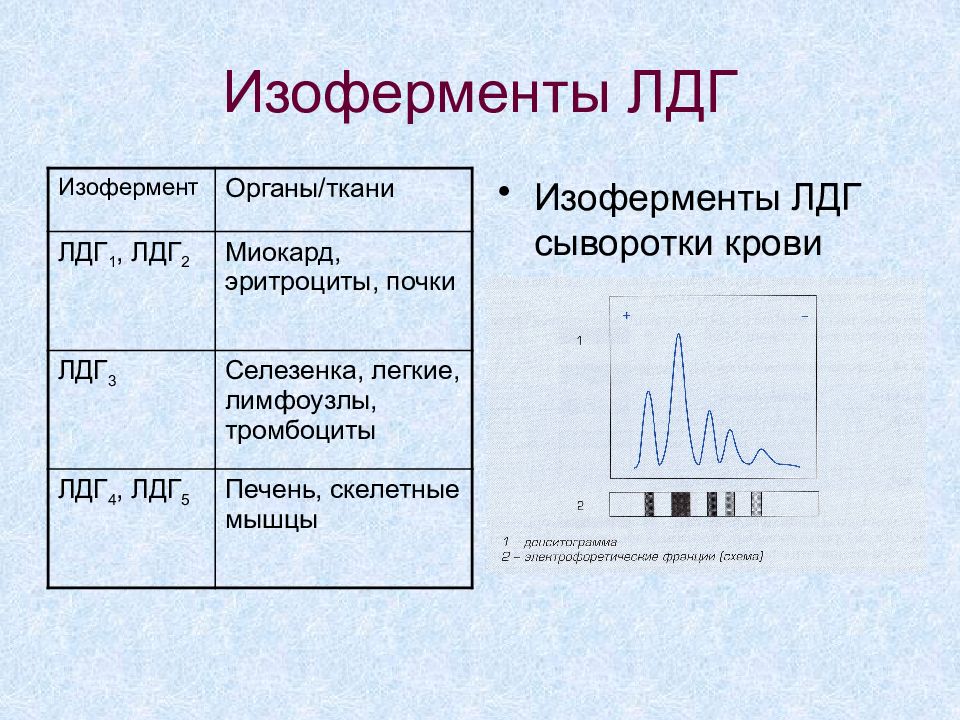
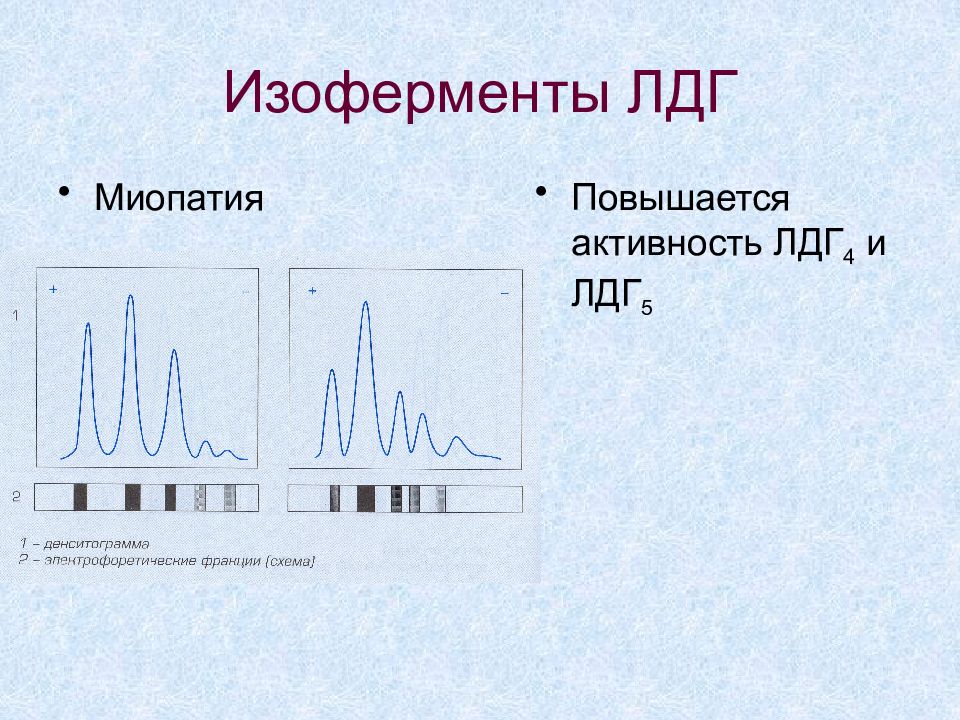
Слайд 36: Изоферменты ЛДГ
Изоферменты ЛДГ сыворотки крови Изофермент Органы/ткани ЛДГ 1, ЛДГ 2 Миокард, эритроциты, почки ЛДГ 3 Селезенка, легкие, лимфоузлы, тромбоциты ЛДГ 4, ЛДГ 5 Печень, скелетные мышцы
Слайд 37: Изоферменты ЛДГ
ОИМ Соотношение ЛДГ 1 / ЛДГ 2 > 1 (в норме - < 1) Активность ЛДГ 1 возрастает не ранее суток, в 2 и более раз На долю ЛДГ 1 при обширном инфаркте приходится > 45% общей активности
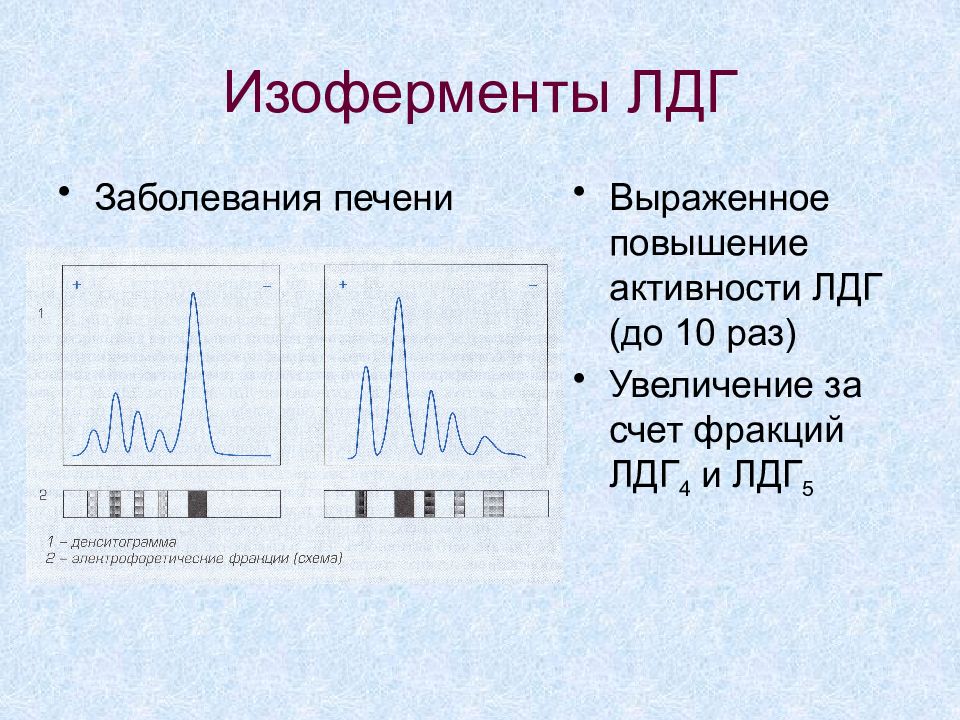
Слайд 39: Изоферменты ЛДГ
Заболевания печени Выраженное повышение активности ЛДГ (до 10 раз) Увеличение за счет фракций ЛДГ 4 и ЛДГ 5
Слайд 42: Изоферменты ЛДГ
Использовать свежесобранные образцы сыворотки или плазмы крови. Можно использовать сыворотку, хранившуюся при t 15-30 º не более недели Нельзя замораживать Нельзя использовать гемолизированную сыворотку
Слайд 43: Изоферменты щелочной фосфатазы
При электрофорезе получают: - печеночная (L 1 )+костная (В)+плацентарная (Р) - печеночная (L 2 ) -кишечные - плацентарная Для улучшения разделения образцы обрабатывают (нейроминидаза, антисыворотки, селективные ингибиторы)
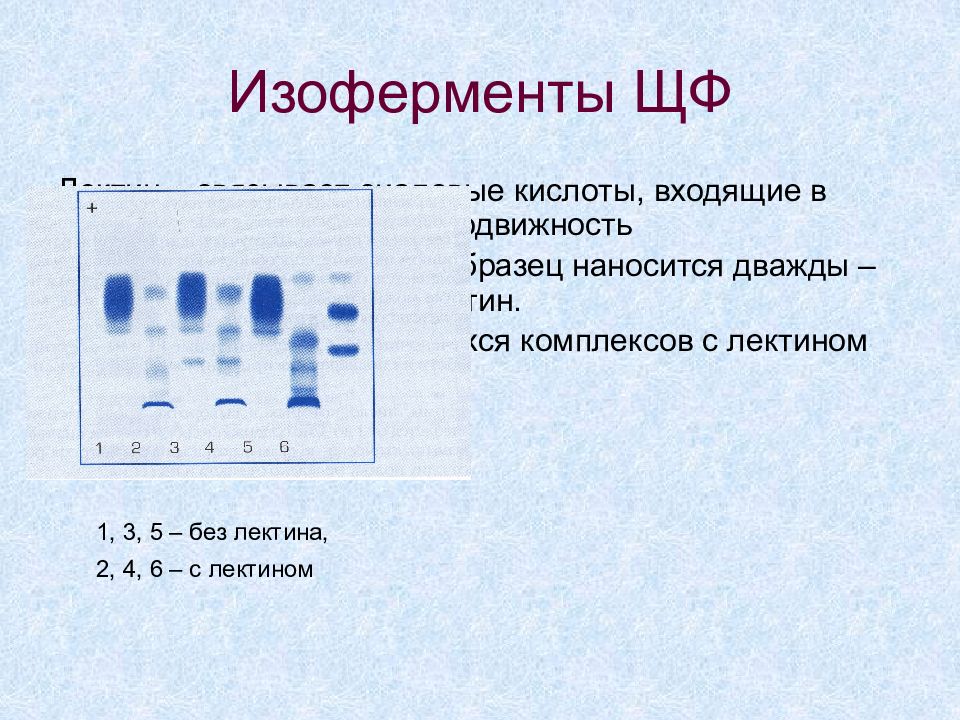
Слайд 44: Изоферменты ЩФ
Лектин – связывает сиаловые кислоты, входящие в состав ЩФ, замедляет подвижность При проведении анализа образец наносится дважды – один проходит через лектин. Подвижность образовавшихся комплексов с лектином снижается 1, 3, 5 – без лектина, 2, 4, 6 – с лектином
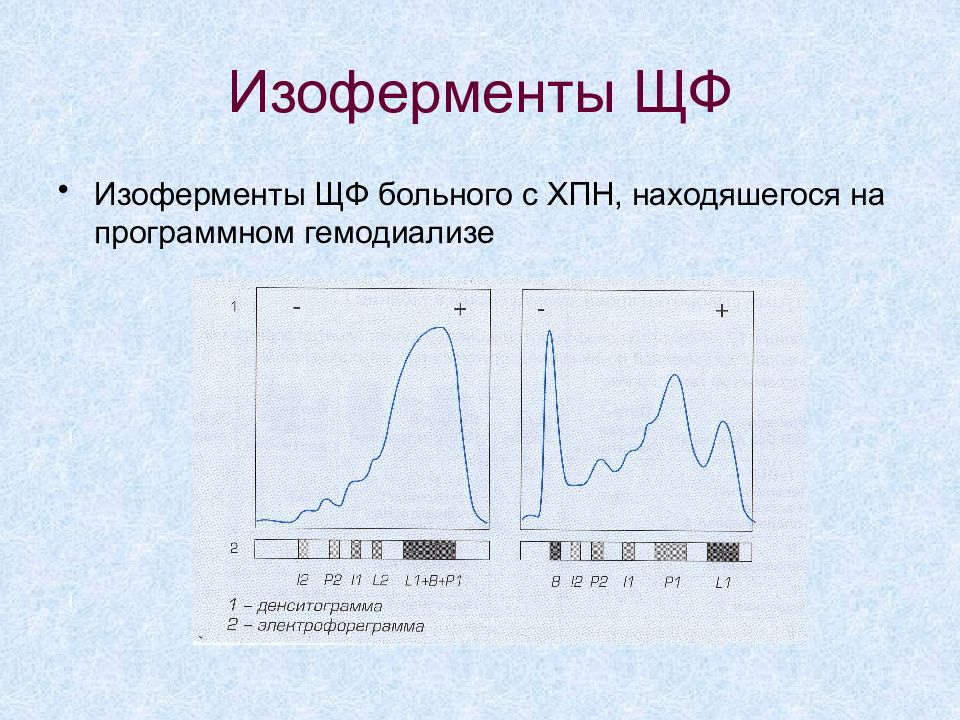
Слайд 45: Изоферменты ЩФ
Изоферменты ЩФ больного с ХПН, находяшегося на программном гемодиализе
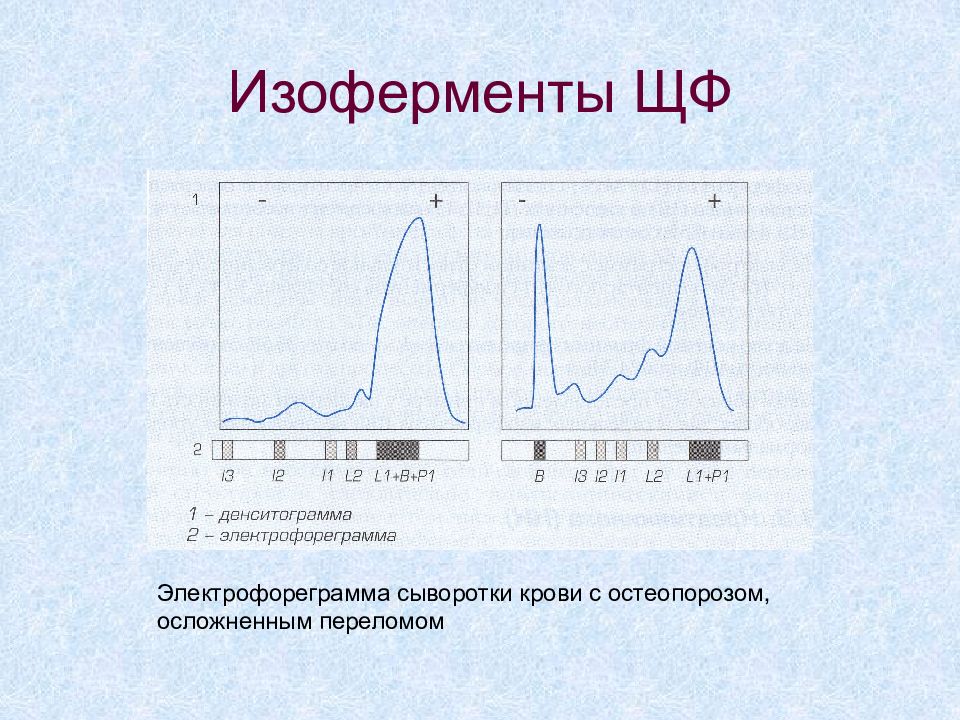
Слайд 46: Изоферменты ЩФ
Электрофореграмма сыворотки крови с остеопорозом, осложненным переломом
Слайд 47: Креатинкиназа
Находится в скелетных мышцах, миокарде, мозге Локализована в цитоплазме (40-45%), митохондриях (20-40%), 15-25% связана с миофибриллами, ЭР Изоферменты КК-ММ – 97-100% КК-МВ - 0-3% при активности 15-500 Е/л 0-4% при активности < 500 Е/л КК-ВВ – 0%
Слайд 48: Электрофорез изоферментов креатинкиназы сыворотки крови
Схема расположения изоферментов КК
Слайд 49: Белки ликвора
Содержание белка – 0,15-0,35 г/л 20% белков продуцируется клетками ЦНС, 80% - попадает из крови Через ГЭБ проходят в основном белки с небольшой молекулярной массой (альбумин, преальбумин, трансферрин), иммуноглобулинов – не более 3-5% СМЖ необходимо сконцентрировать При сравнении белкового спектра сыворотки крови и ликвора образцы нужно получить с интервалом не более 6 часов Сыворотку развести, чтобы концентрация белка стала одинаковой
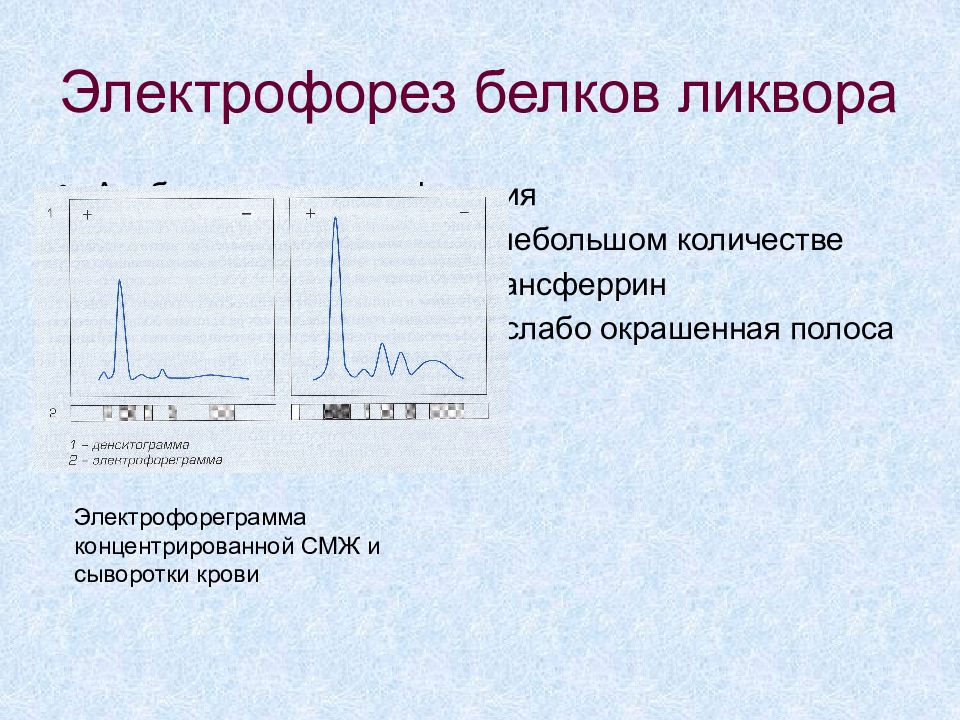
Слайд 50: Электрофорез белков ликвора
Альбумин- основная фракция α - глобулины содержатся в небольшом количестве β -глобулины – содержат трансферрин γ -глобулины – широкая, но слабо окрашенная полоса Электрофореграмма концентрированной СМЖ и сыворотки крови
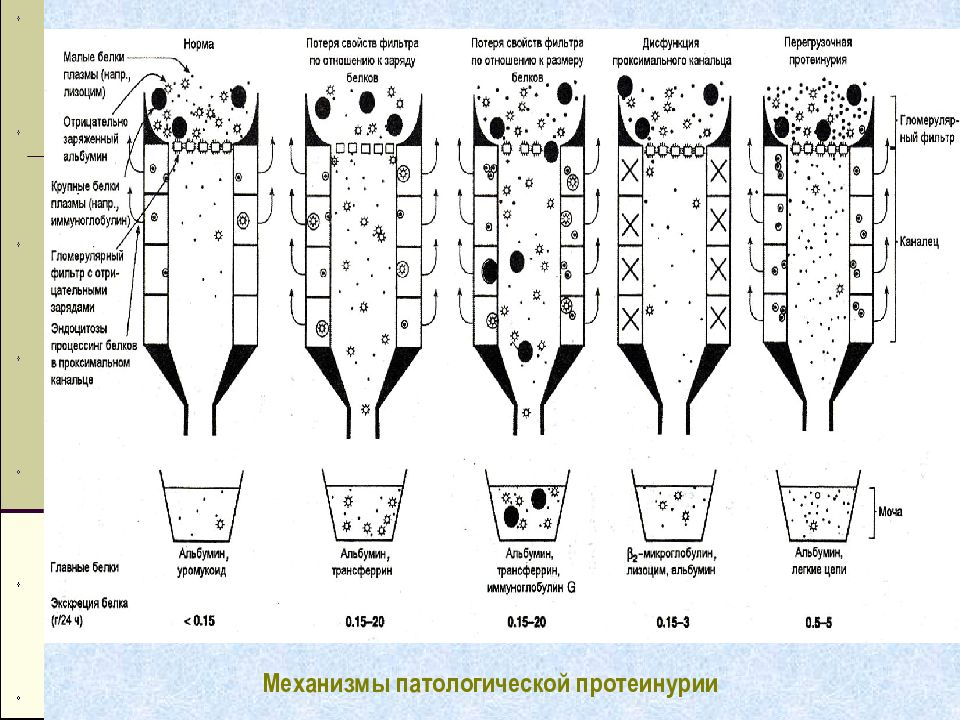
Слайд 52: Электрофорез белков мочи
Разделение в соответствии с электрофоретической подвижностью – не пригоден для характеристики протеинурии (подвижность α 1 - микроглобулина = подвижности орозомукоида, и т.д.) Разделение в соответствии с молекулярной массой – позволяет разделить белки низкомолекулярные ( <67 кДа) – канальцевого происхождения и высокомолекулярные – ( >67 кДа) – преимущественно клубочковые Метод основан на взаимодействии белков с детергентом додецилсульфатом натрия ( SDS ). В этих комплексах все белки приобретают одну и туже конформацию и одинаковый отрицательный заряд на единицу массы. Разделение зависит только от молекулярной массы
Слайд 54: Схема расположения белков при электрофорезе мочи
Электрофорез мочи в SDS -агарозе
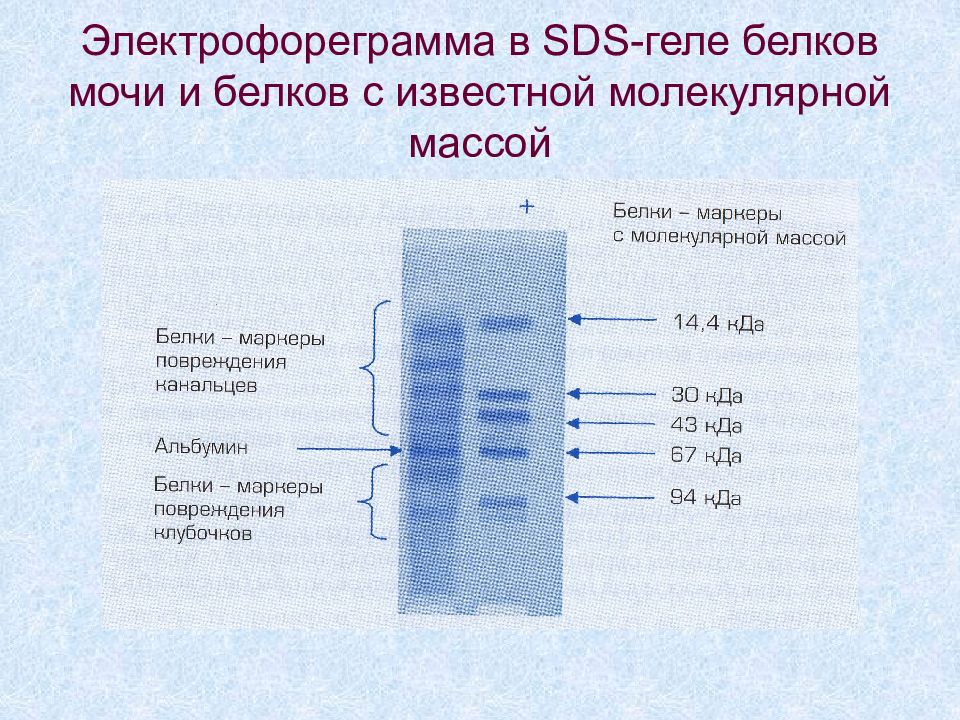
Слайд 55: Электрофореграмма в SDS -геле белков мочи и белков с известной молекулярной массой
Слайд 56: Физиологическая протеинурия
За сутки до 150 мг белка Четкая полоса альбумина, неразделенные фракции глобулинов
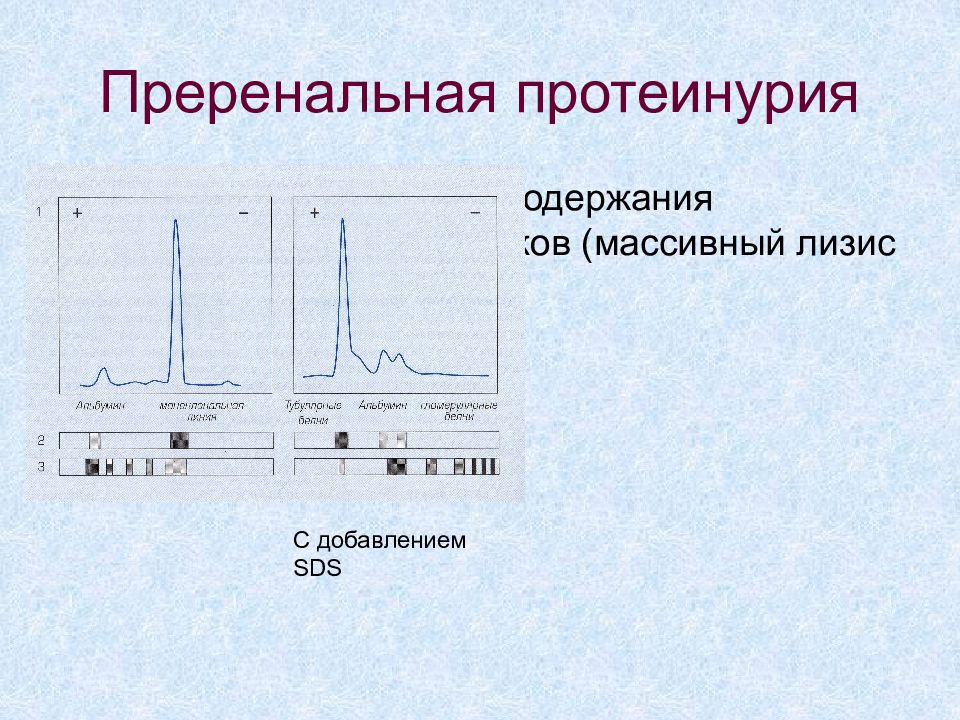
Слайд 57: Преренальная протеинурия
Следствие увеличения содержания низкомолекулярных белков (массивный лизис клеток) С добавлением SDS
Слайд 58: Гломерулярная протеинурия
Повреждение клубочков почки, через почечный барьер проходят белки с Мм > 67 кДа
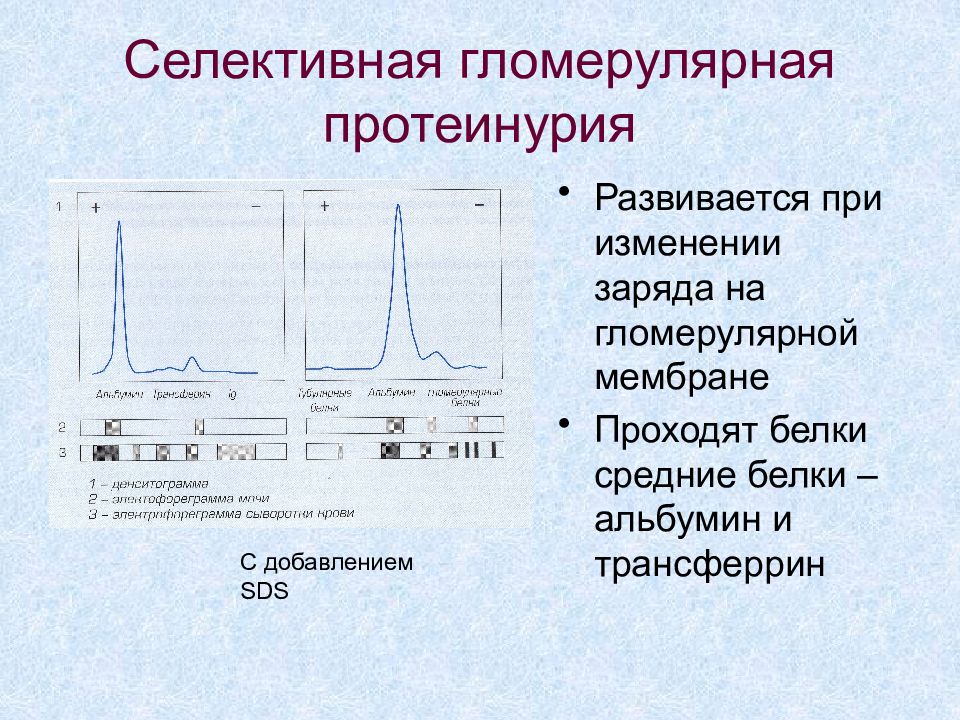
Слайд 59: Селективная гломерулярная протеинурия
Развивается при изменении заряда на гломерулярной мембране Проходят белки средние белки – альбумин и трансферрин С добавлением SDS
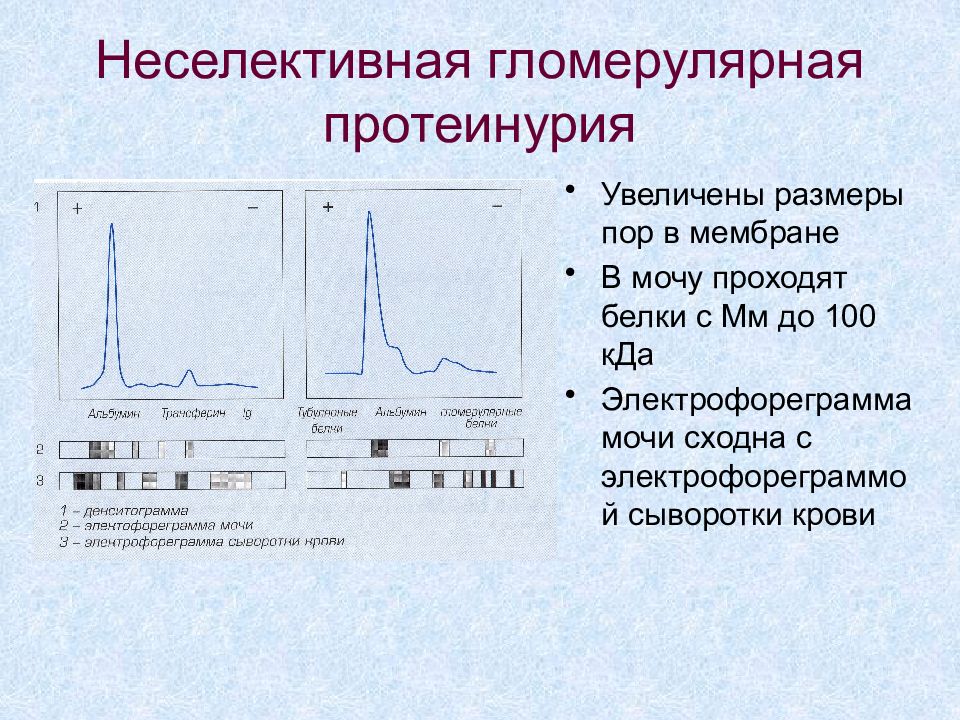
Слайд 60: Неселективная гломерулярная протеинурия
Увеличены размеры пор в мембране В мочу проходят белки с Мм до 100 кДа Электрофореграмма мочи сходна с электрофореграммой сыворотки крови
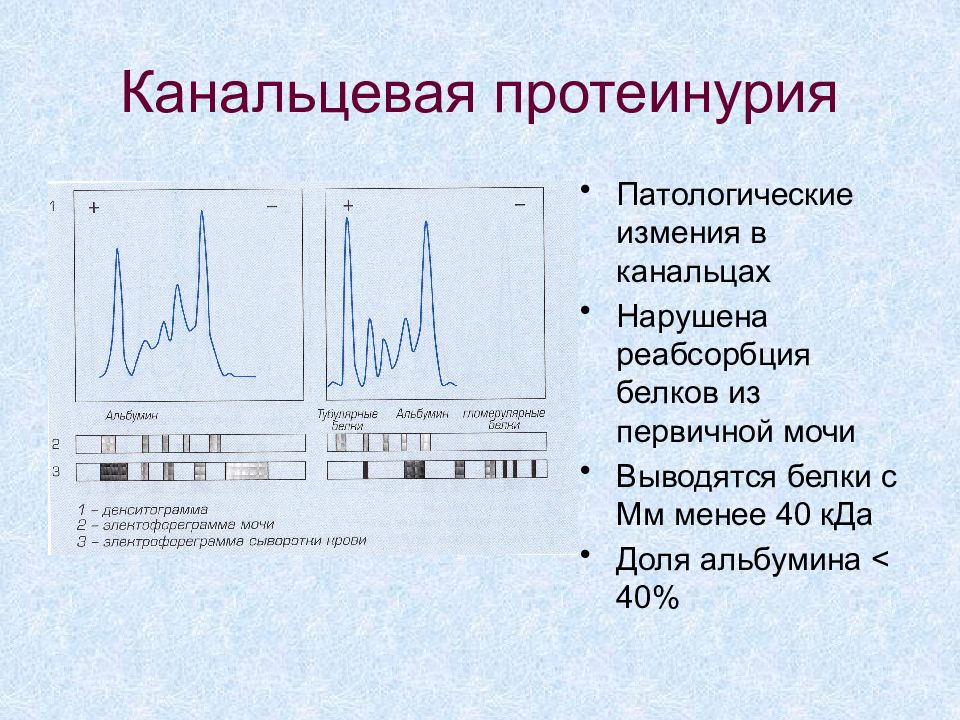
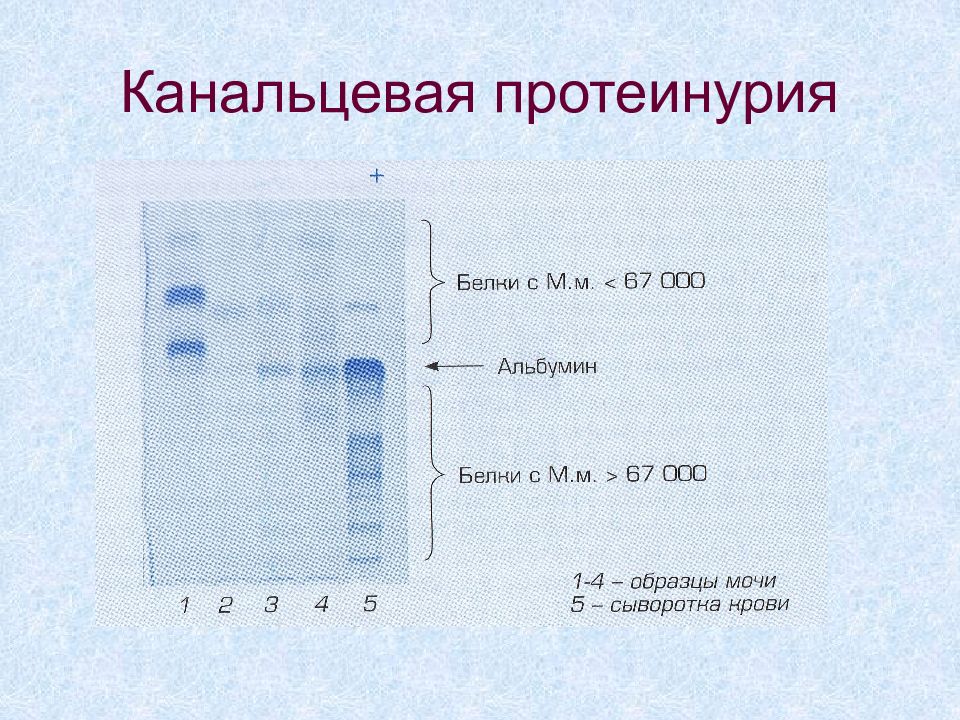
Слайд 61: Канальцевая протеинурия
Патологические измения в канальцах Нарушена реабсорбция белков из первичной мочи Выводятся белки с Мм менее 40 кДа Доля альбумина < 40%
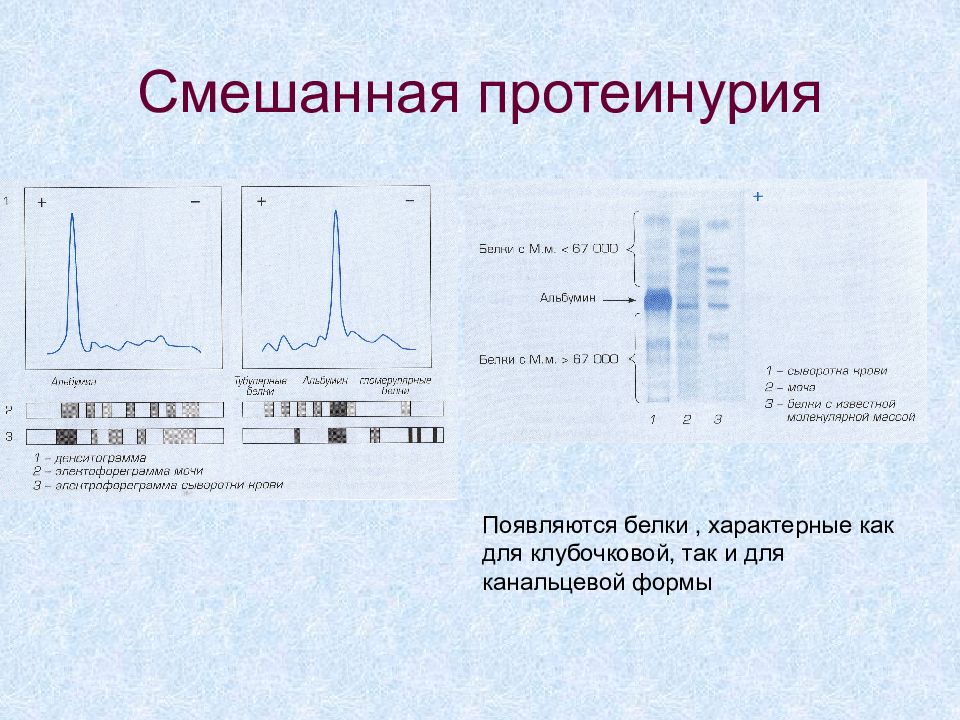
Слайд 63: Смешанная протеинурия
Появляются белки, характерные как для клубочковой, так и для канальцевой формы
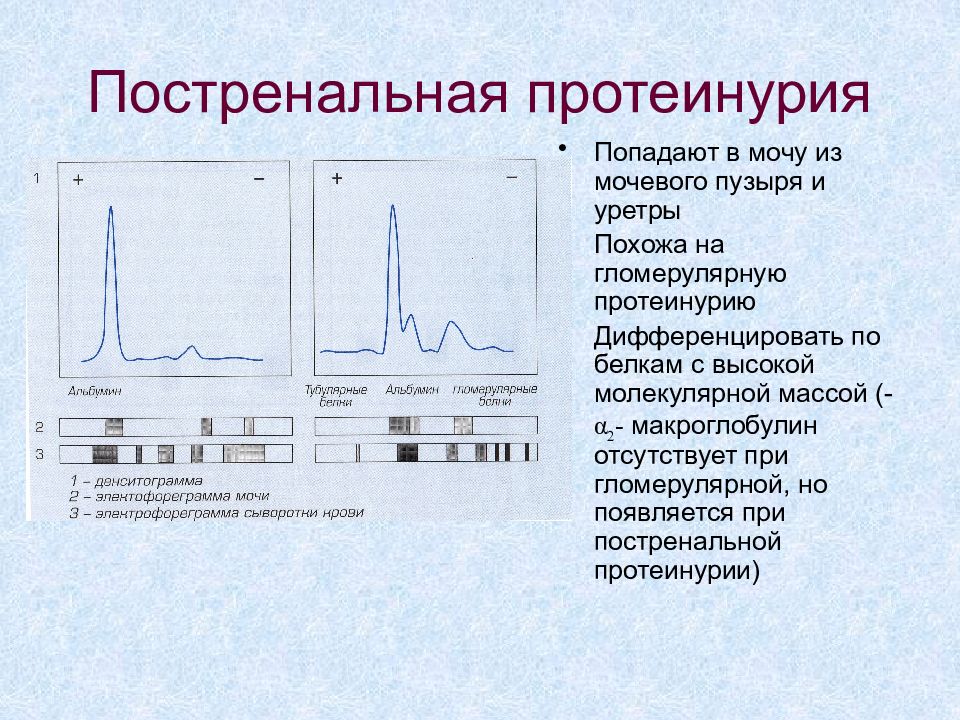
Слайд 64: Постренальная протеинурия
Попадают в мочу из мочевого пузыря и уретры Похожа на гломерулярную протеинурию Дифференцировать по белкам с высокой молекулярной массой (- α 2 - макроглобулин отсутствует при гломерулярной, но появляется при постренальной протеинурии)
Слайд 65
Иммунофиксация – качественный метод, позволяющий установить природу моноклонального компонента Методы определения – гелевый электрофорез на агарозе и капиллярный (иммунозамещение) Дополнительные полосы, которые обнаруживаются в гамма зонах, могут соответствовать моноклональным белкам, что указывает на наличие гаммапатий. В основе идентификации лежит реакция образования комплекса антиген-антитело, при добавлении к сыворотке пациента моноспецифических антител к IgG, IgM, IgA, и -легким цепям. Иммунофиксация
Слайд 66: IgG k
Выявление моноклональных гаммапатий Иммунофиксация в гелевом электрофорезе На агарозном геле разделение белков IFE в сыворотке происходит в соответствии с их зарядом. Затем белки инкубируют с моноклональными антисыворотками, промывают и окрашивают, проявившиеся иммунопреципитаты качественно интерпретируют. Выделение и выявление моноклональных гаммапатий методом гелевого электрофореза. IT
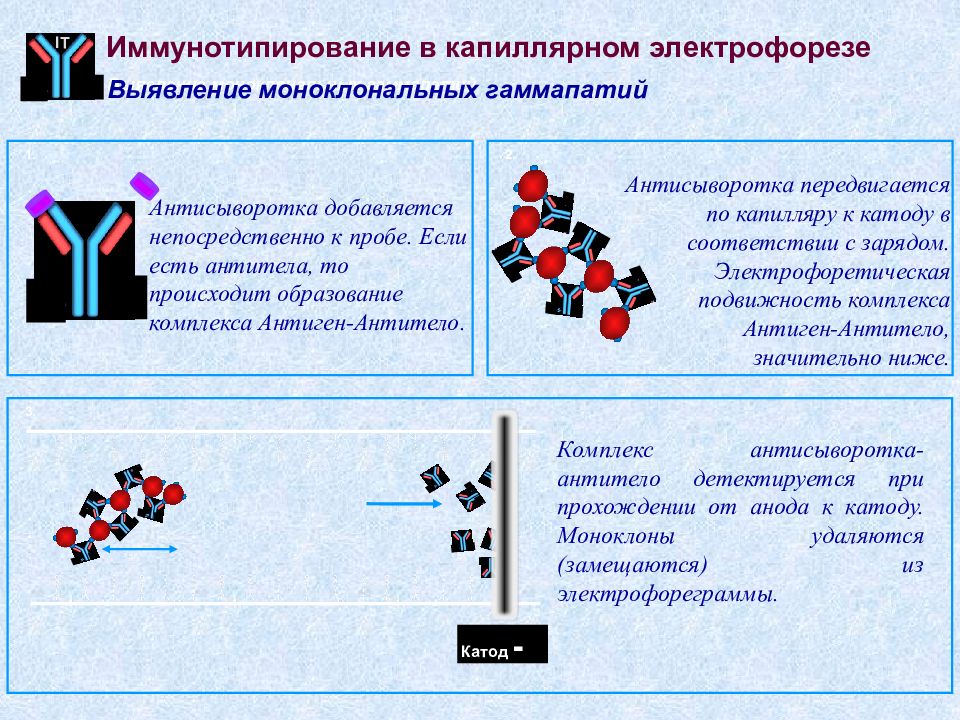
Слайд 67
IT 1. Антисыворотка добавляется непосредственно к пробе. Если есть антитела, то происходит образование комплекса Антиген-Антитело. 2. Антисыворотка передвигается по капилляру к катоду в соответствии с зарядом. Электрофоретическая подвижность комплекса Антиген-Антитело, значительно ниже. Комплекс антисыворотка-антитело детектируется при прохождении от анода к катоду. Моноклоны удаляются (замещаются) из электрофореграммы. Иммунотипирование в капиллярном электрофорезе Выявление моноклональных гаммапатий 3. Катод - Иммунотипирование в капиллярном электрофорезе Выявление моноклональных гаммапатий
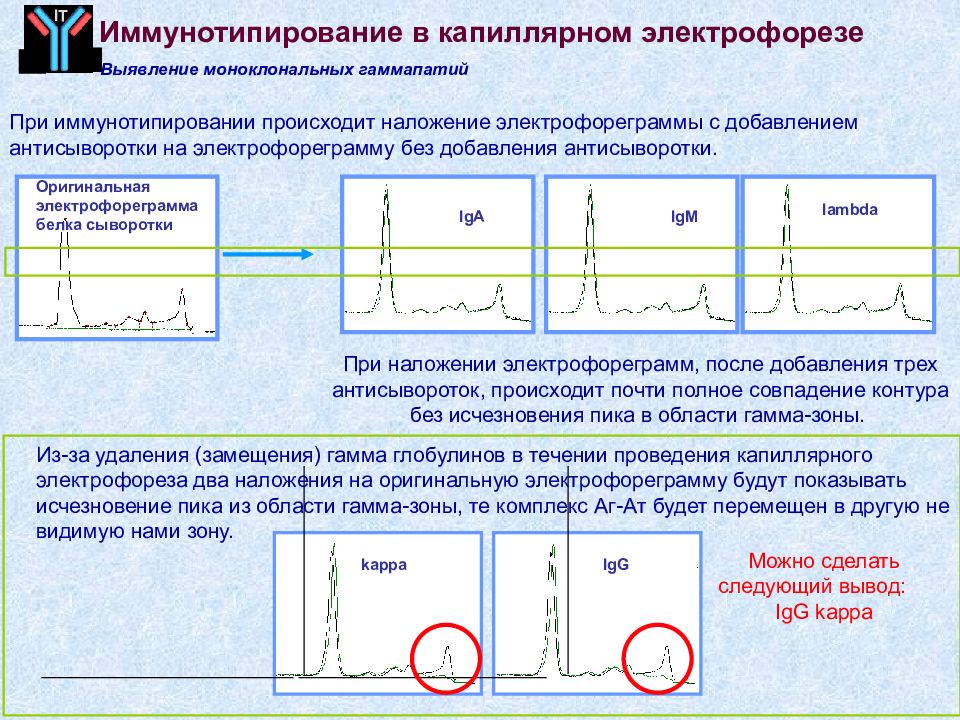
Слайд 68
IgG IgA IgM lambda Оригинальная электрофореграмма белка сыворотки kappa IT Можно сделать следующий вывод : IgG kappa При иммунотипировании происходит наложение электрофореграммы с добавлением антисыворотки на электрофореграмму без добавления антисыворотки. При наложении электрофореграмм, после добавления трех антисывороток, происходит почти полное совпадение контура без исчезновения пика в области гамма-зоны. Из-за удаления (замещения) гамма глобулинов в течении проведения капиллярного электрофореза два наложения на оригинальную электрофореграмму будут показывать исчезновение пика из области гамма-зоны, те комплекс Аг-Ат будет перемещен в другую не видимую нами зону. Выявление моноклональных гаммапатий Иммунотипирование в капиллярном электрофорезе
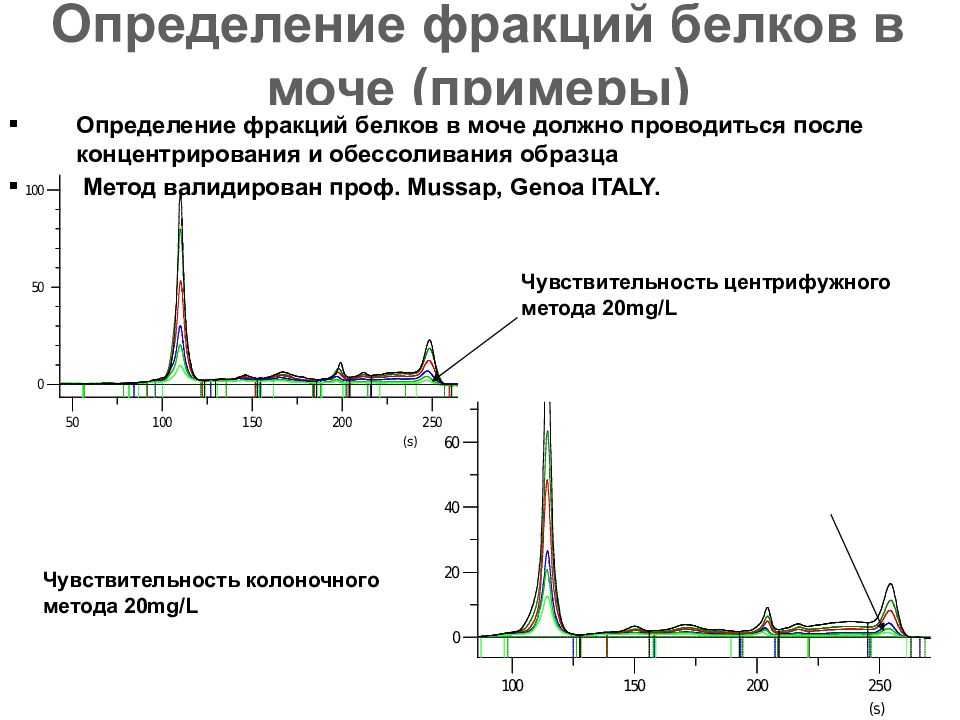
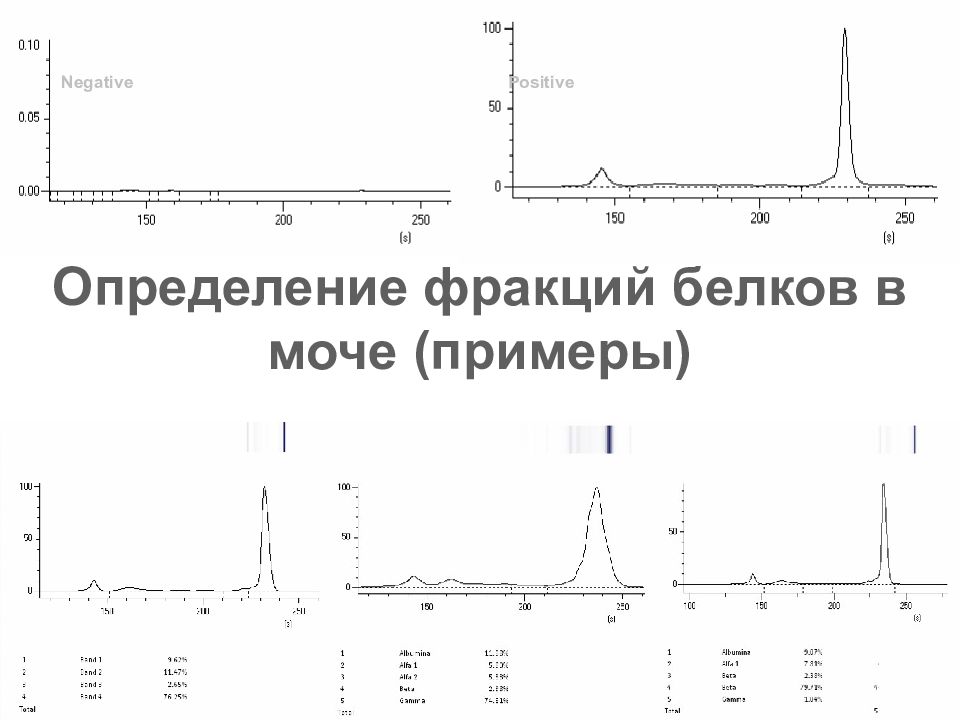
Слайд 73: Определение фракций белков в моче (примеры)
Определение фракций белков в моче должно проводиться после концентрирования и обессоливания образца Метод валидирован проф. Mussap, Genoa ITALY. Чувствительность центрифужного метода 20mg/L Чувствительность колоночного метода 20mg/L