Первый слайд презентации: ЭЛЕКТРООТРИЦАТЕЛЬНОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
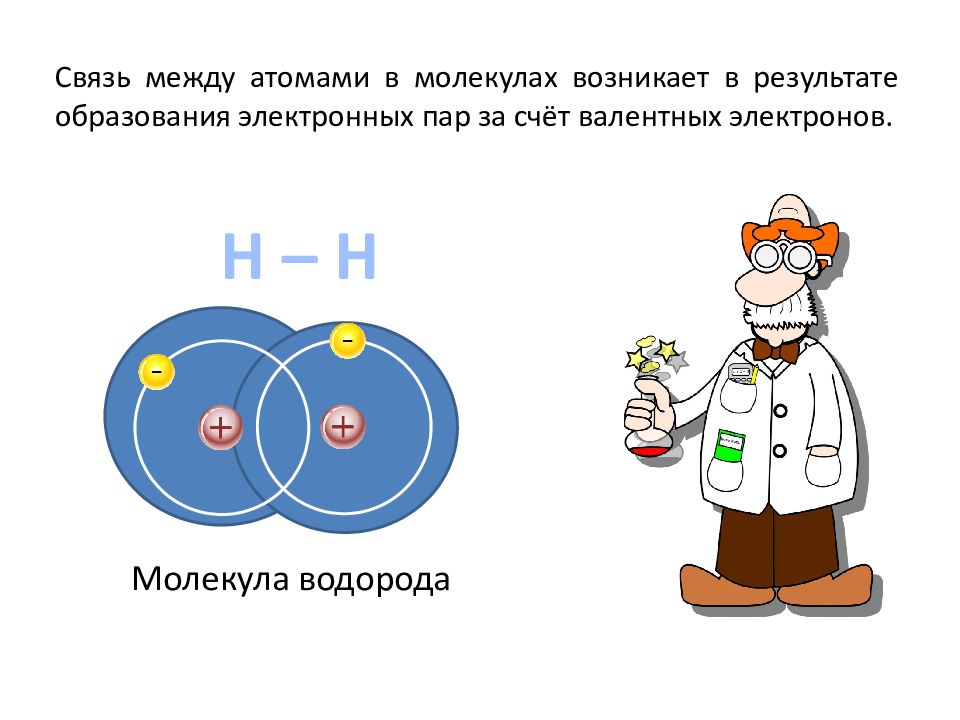
Н – Н Молекула водорода
Слайд 3: Проблемный вопрос:
Как определить, отдаёт или принимает электроны элемент при образовании химической связи?
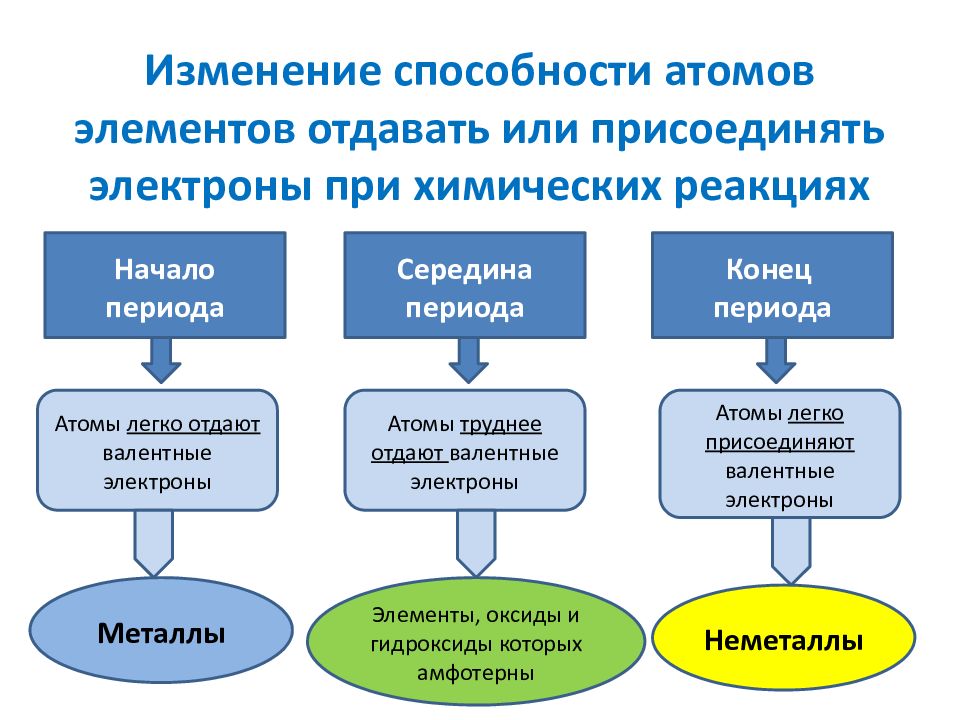
Слайд 4: Изменение способности атомов элементов отдавать или присоединять электроны при химических реакциях
Начало периода Середина периода Конец периода Атомы легко отдают валентные электроны Атомы труднее отдают валентные электроны Атомы легко присоединяют валентные электроны Металлы Элементы, оксиды и гидроксиды которых амфотерны Неметаллы
Слайд 5
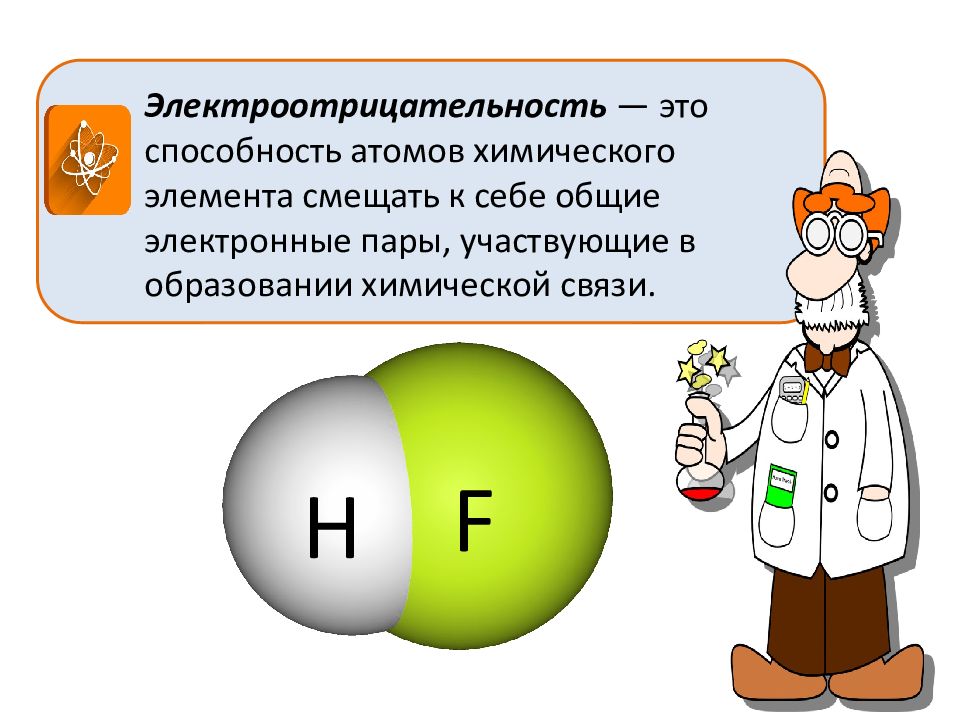
Электроотрицательность — это способность атомов химического элемента смещать к себе общие электронные пары, участвующие в образовании химической связи. Н F
Слайд 6
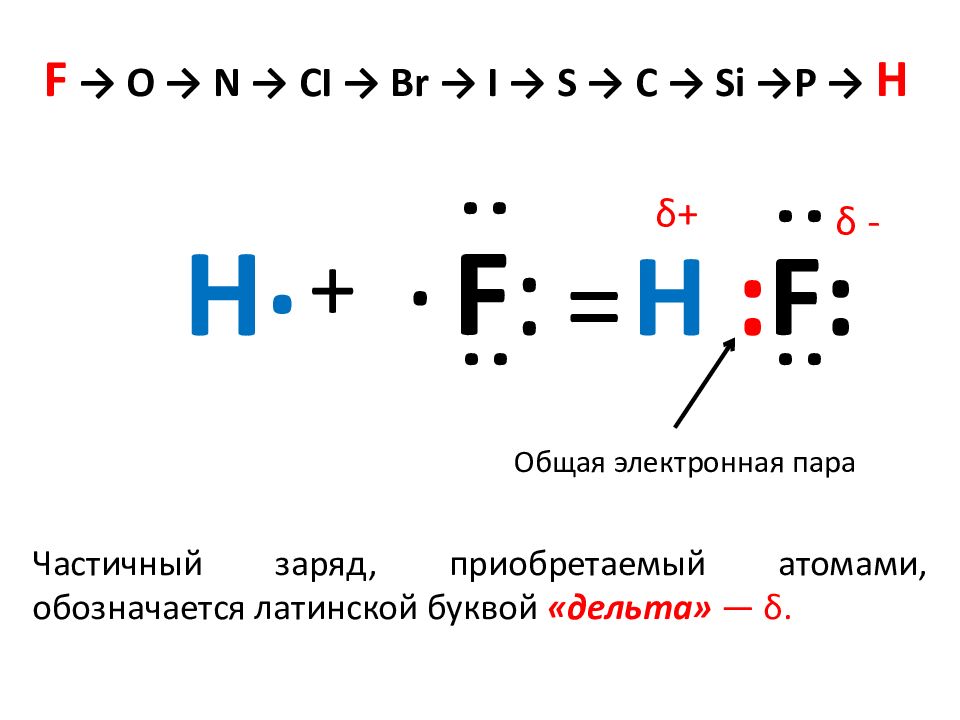
F → O → N → CI → Br → I → S → C → Si → P → H Ряд химических элементов, расположенных в соответствии с уменьшением их электроотрицательности (ЭО) С уменьшением электроотрицательности (ЭО) уменьшается и способность атома смещать общую электронную пару ближе к своему ядру.
Слайд 7
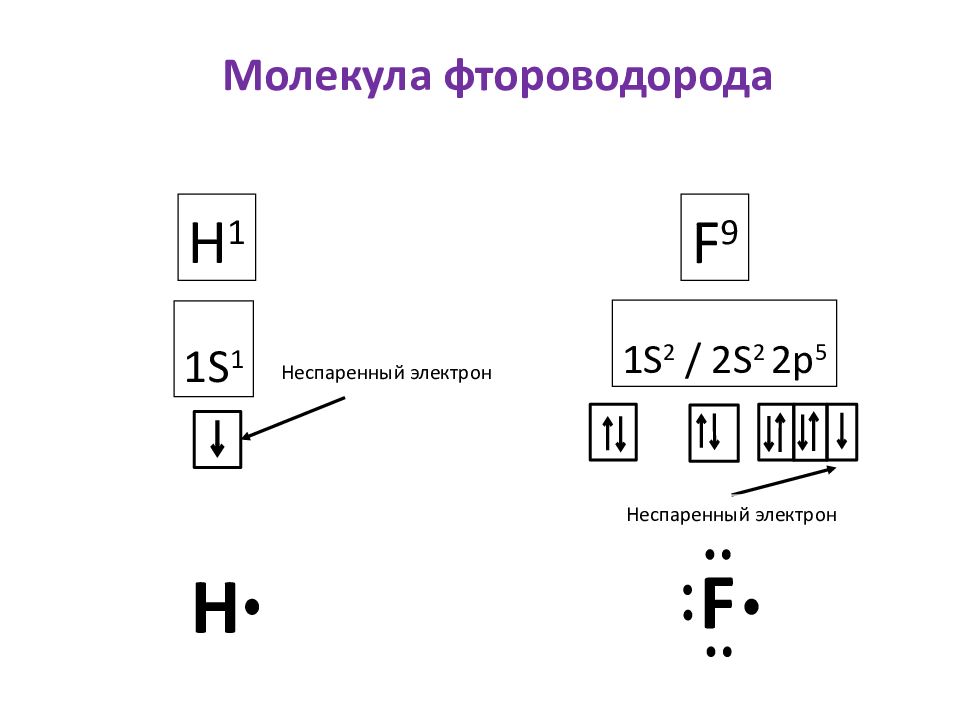
Молекула фтороводорода H 1 1S 1 F 9 1S 2 / 2S 2 2p 5 H F Неспаренный электрон Неспаренный электрон
Слайд 8
H . + F : . : : = H : F : : : Общая электронная пара F → O → N → CI → Br → I → S → C → Si → P → H Частичный заряд, приобретаемый атомами, обозначается латинской буквой «дельта» — δ. δ+ δ -
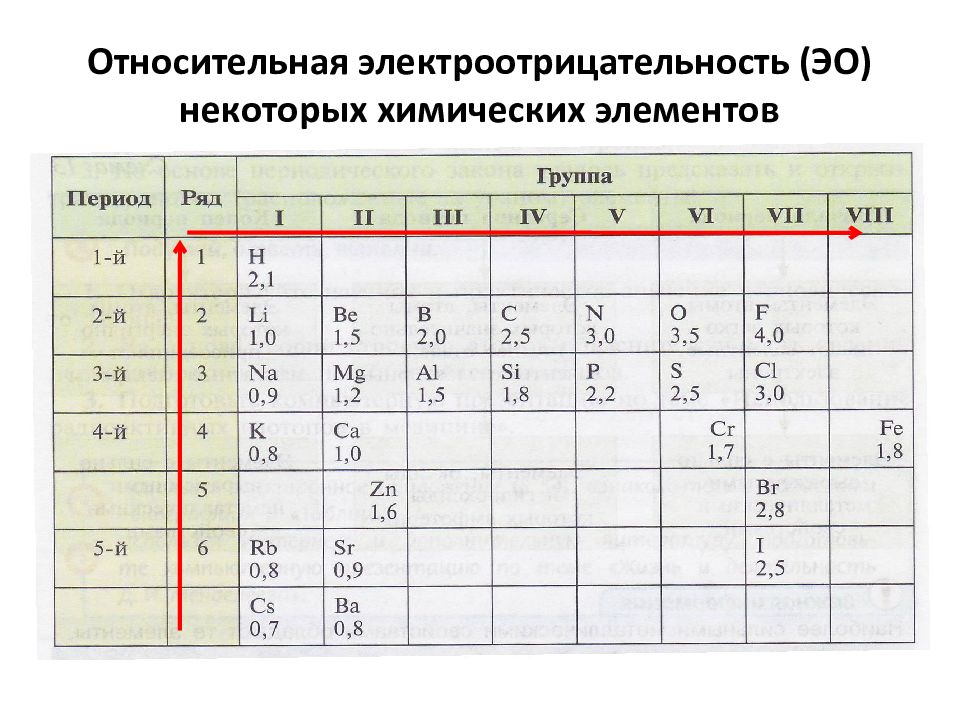
Слайд 10: Изменение электроотрицательности (ЭО) химических элементов:
В периодах электроотрицательность (ЭО) увеличивается слева направо. В главных подгруппах (А-группах) электроотрицательность (ЭО) увеличивается снизу вверх.
Слайд 11: Выводы:
Электроотрицательность (ЭО) – это важное свойство атомов химических элементов. Зная электроотрицательность (ЭО) элемента, можно определить его принадлежность к металлам или неметаллам. Зная положение элемента в периодической таблице можно определить, какой из элементов имеет большую или меньшую электроотрицательность (ЭО).
Слайд 12: Подумай и ответь:
А. Cs Б. H В. Br Г. F Д. O Какой из элементов имеет наименьшую электроотрицательность? Какой из элементов имеет наибольшую электроотрицательность? Какой элемент имеет на внешнем энергетическом уровне один электрон? Какой элемент имеет на внешнем энергетическом уровне семь электронов? Какой элемент является металлом?
Слайд 13
Проверь свои ответы: 1) А 2) Г 3) А, Б 4) В, Г 5) А Оцени свой ответ: За каждый правильный ответ поставь себе 1 балл. За каждый неполный ответ поставь себе 0,5 балла. За каждый неверный ответ поставь себе 0 баллов. Если ты набрал: 4,5-5 баллов – «5» 3,5 – 4 балла – «4» 2, 5 – 3 балла – «3»