Слайд 3
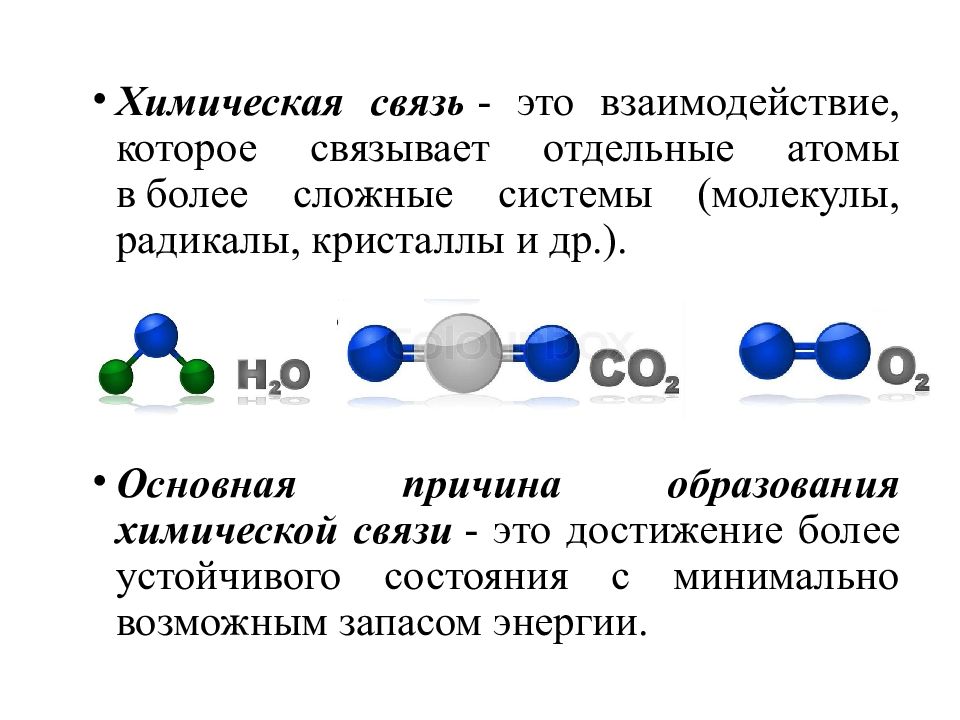
Основная причина образования химической связи - это достижение более устойчивого состояния с минимально возможным запасом энергии. Химическая связь - это взаимодействие, которое связывает отдельные атомы в более сложные системы (молекулы, радикалы, кристаллы и др.).
Слайд 4
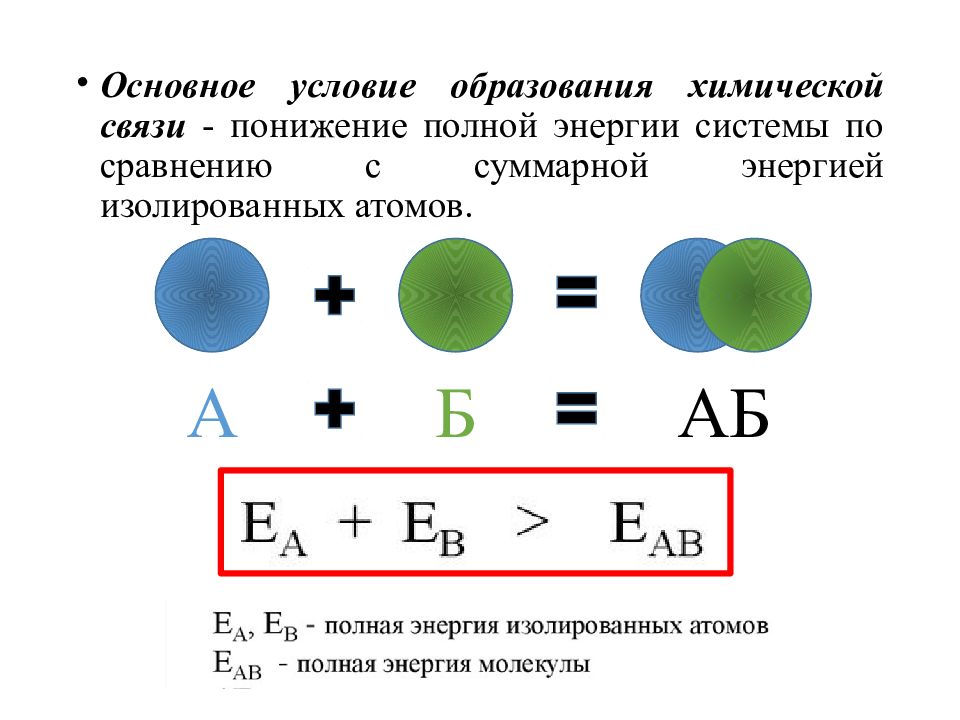
Основное условие образования химической связи - понижение полной энергии системы по сравнению с суммарной энергией изолированных атомов. А Б АБ
Слайд 5: Отличительные признаки химической связи :
Понижение энергии системы по сравнению с суммой энергий несвязанных атомов; Перераспределение электронной плотности в области образования химической связи.
Слайд 7
В образовании химической связи принимают участие валентные электроны. При образовании химической связи каждый атом хочет завершить свой внешний энергетический уровень.
Слайд 9: Характеристики химической связи
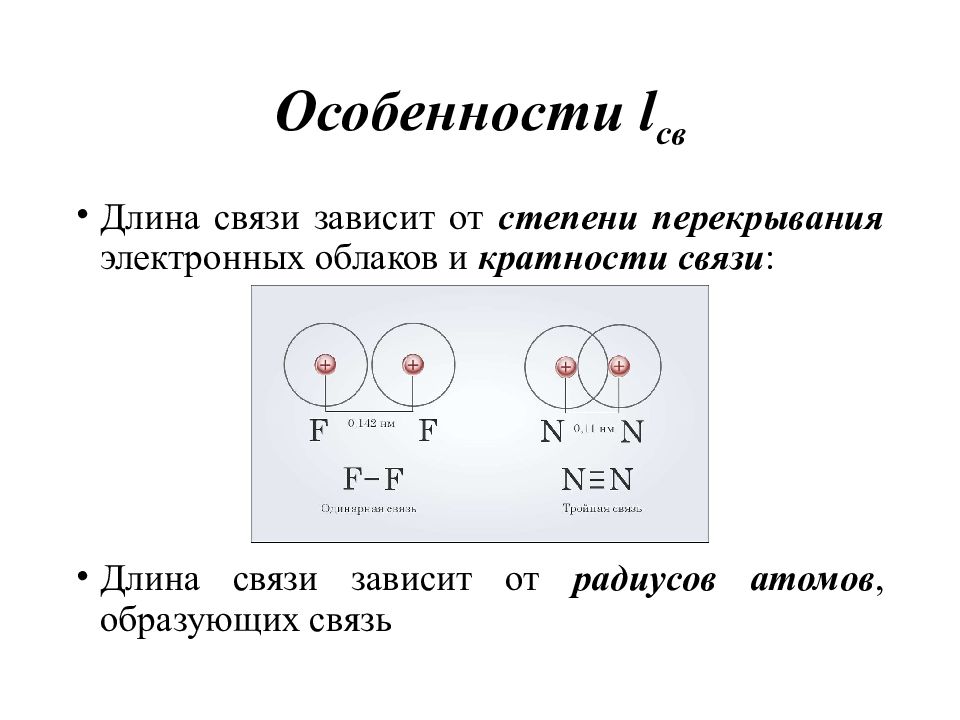
Длина химической связи ( l св ) – расстояние между ядрами соседних атомов в молекуле или кристалле [ нм ]. Химическая связь консервативна – каждый атом вносит всегда определенный вклад в длину химической связи, не зависимо от того, в состав какой молекулы он входит.
Слайд 10: Особенности l св
Длина связи зависит от степени перекрывания электронных облаков и кратности связи : Длина связи зависит от радиусов атомов, образующих связь
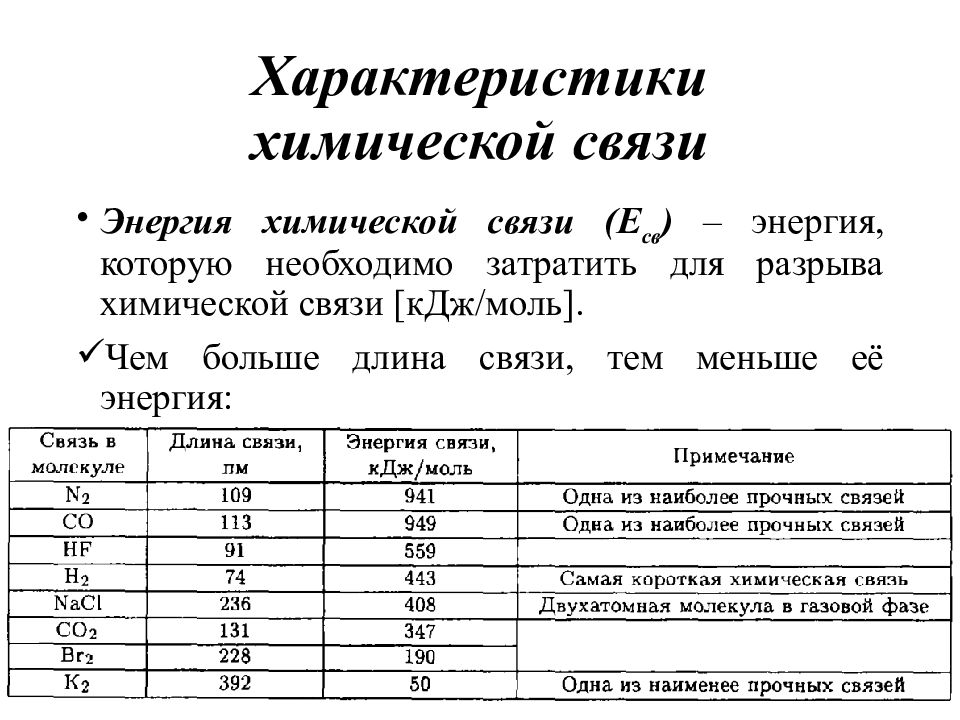
Слайд 11: Характеристики химической связи
Энергия химической связи ( Е св ) – энергия, которую необходимо затратить для разрыва химической связи [кДж/моль ]. Чем больше длина связи, тем меньше её энергия:
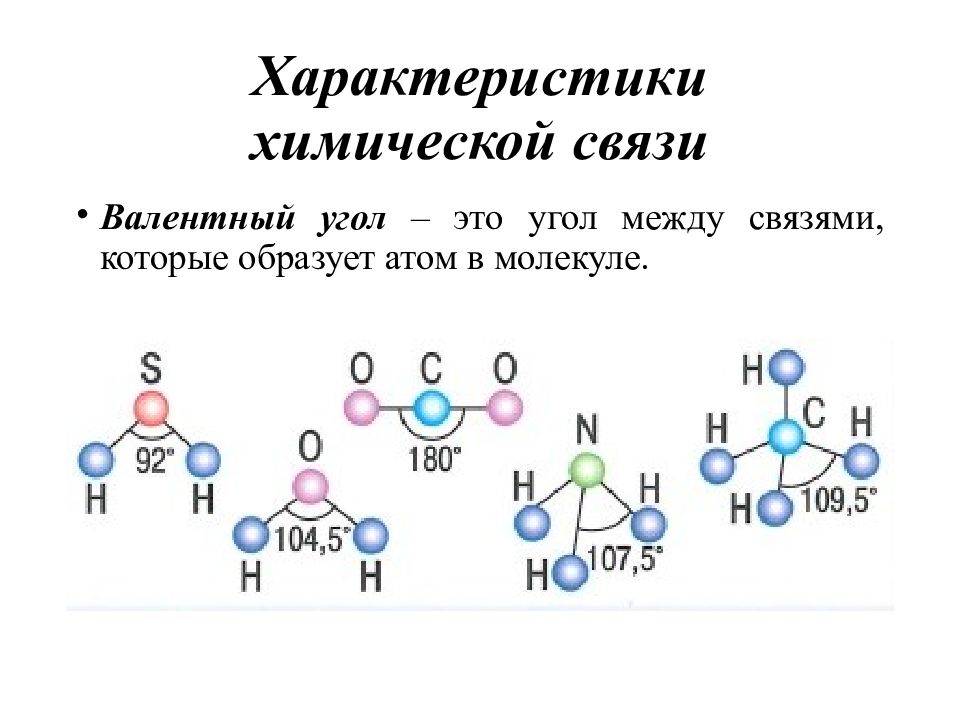
Слайд 12: Характеристики химической связи
Валентный угол – это угол между связями, которые образует атом в молекуле.
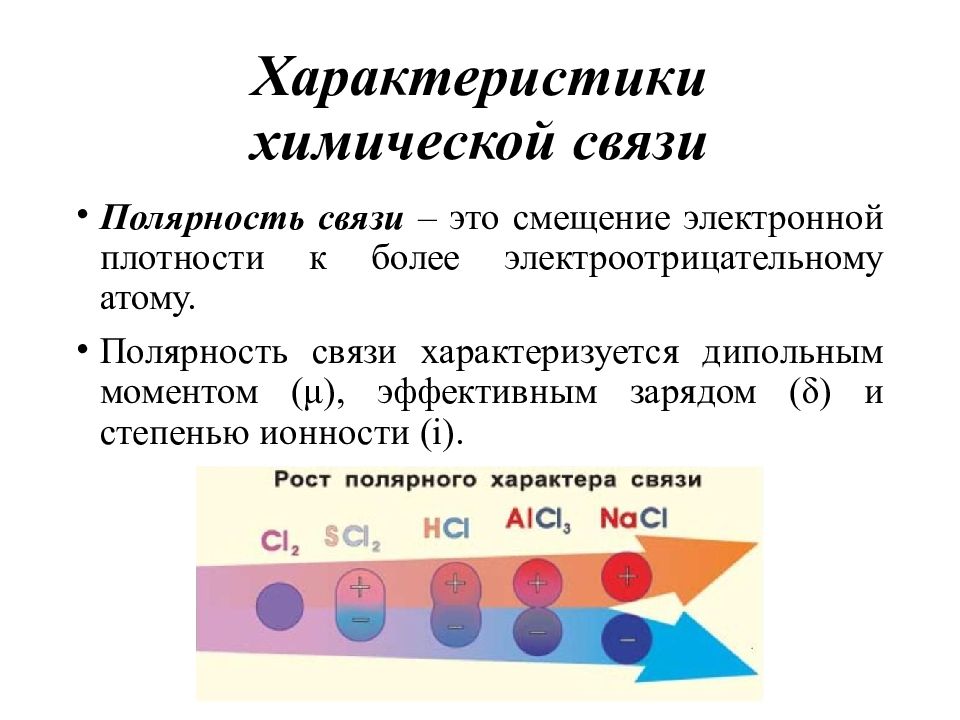
Слайд 13: Характеристики химической связи
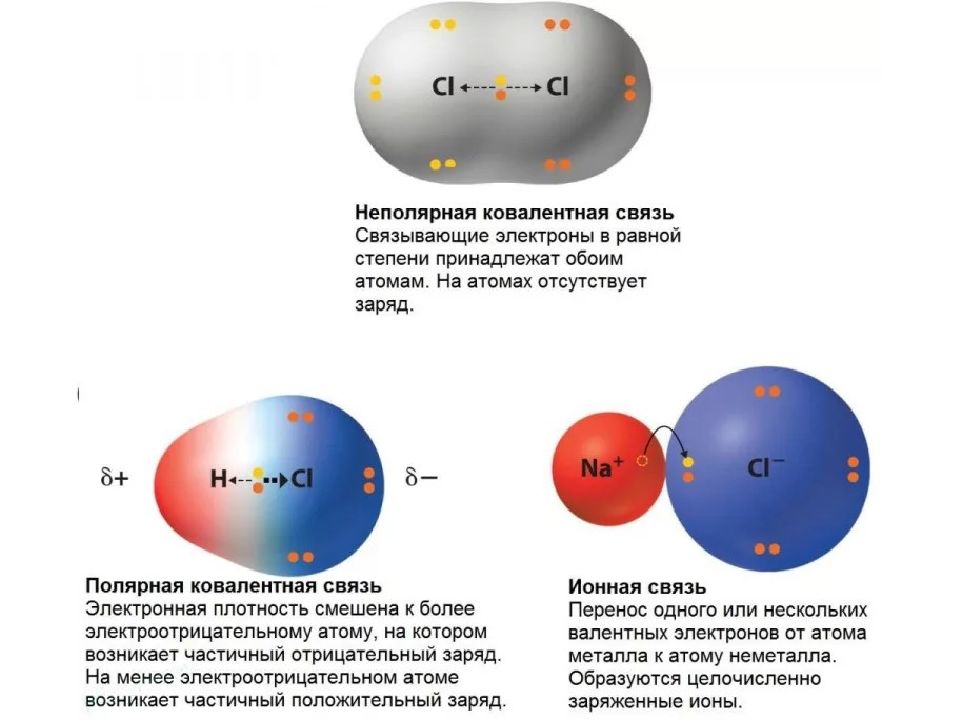
Полярность связи – это смещение электронной плотности к более электроотрицательному атому. Полярность связи характеризуется дипольным моментом ( μ ), эффективным зарядом ( δ ) и степенью ионности ( i ).
Слайд 14: Дипольный момент [ Кл·м ] = [D]
ℓ – длина диполя; q – абсолютная величина заряда в кулонах
Слайд 15
Эффективный заряд – безразмерная величина, определяемая отношением экспериментально найденного μ к теоретически рассчитанному. Степень ионности – реальный заряд иона в кристаллической структуре. Может быть, оценена по разности электроотрицательностей атомов.
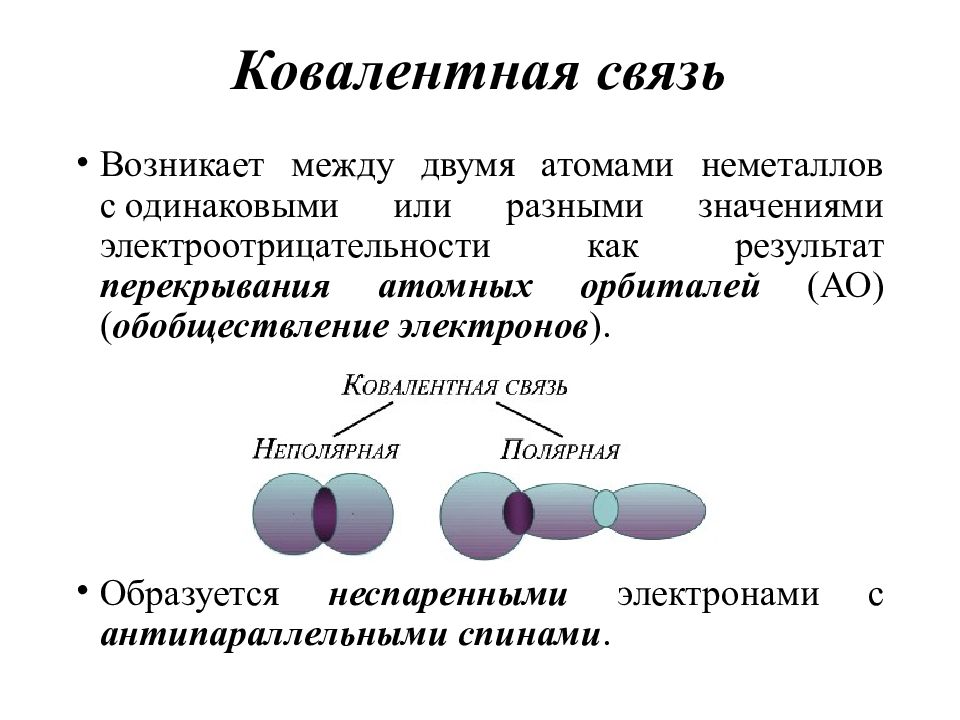
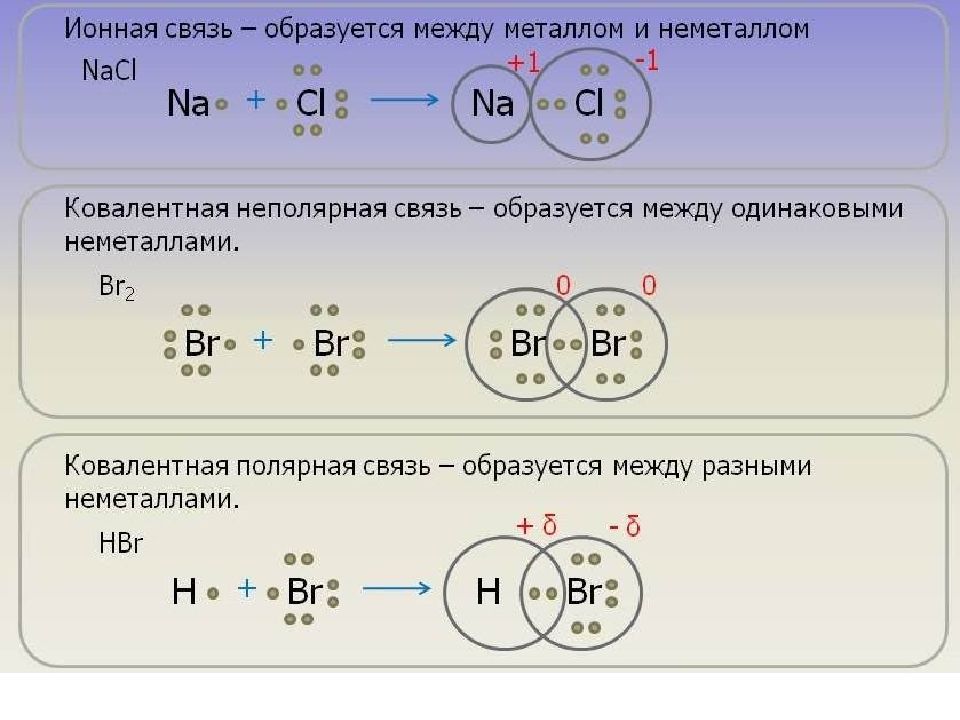
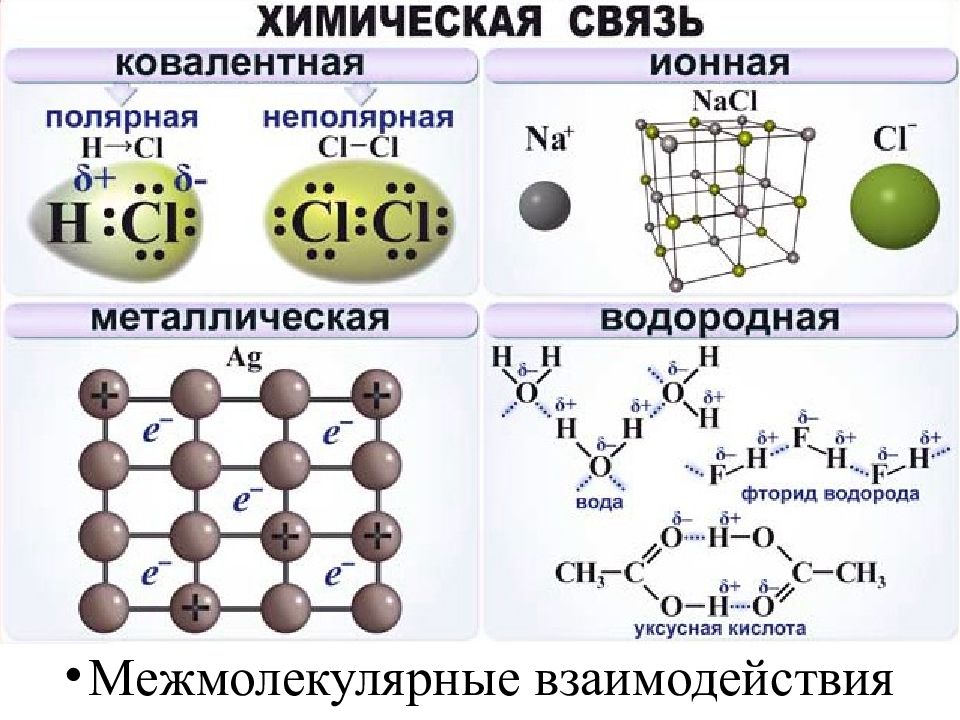
Слайд 16: Ковалентная связь
Возникает между двумя атомами неметаллов с одинаковыми или разными значениями электроотрицательности как результат перекрывания атомных орбиталей (АО) ( обобществление электронов ). Образуется неспаренными электронами с антипараллельными спинами.
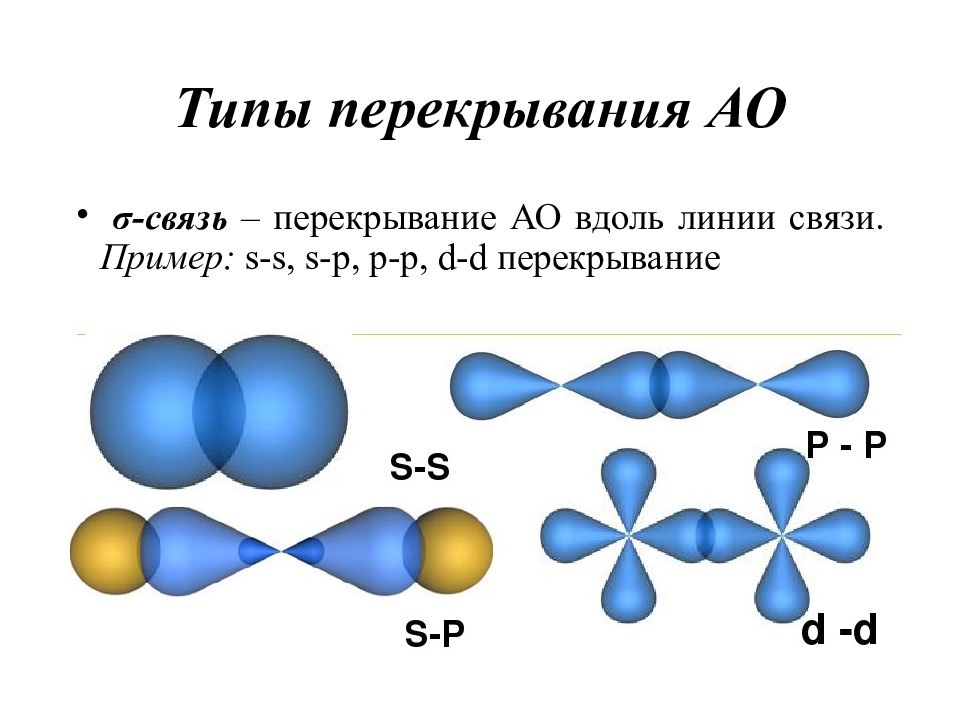
Слайд 17: Типы перекрывания АО
σ-связь – перекрывание АО вдоль линии связи. Пример : s-s, s-p, p-p, d-d перекрывание
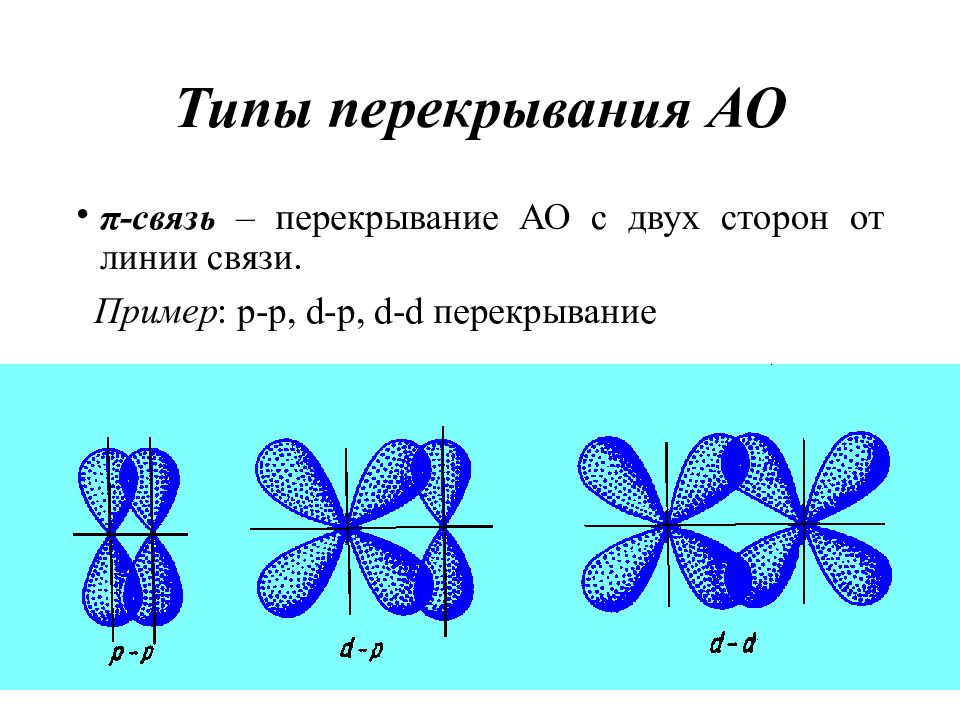
Слайд 18: Типы перекрывания АО
π- связь – перекрывание АО с двух сторон от линии связи. Пример : p-p, d-p, d-d перекрывание
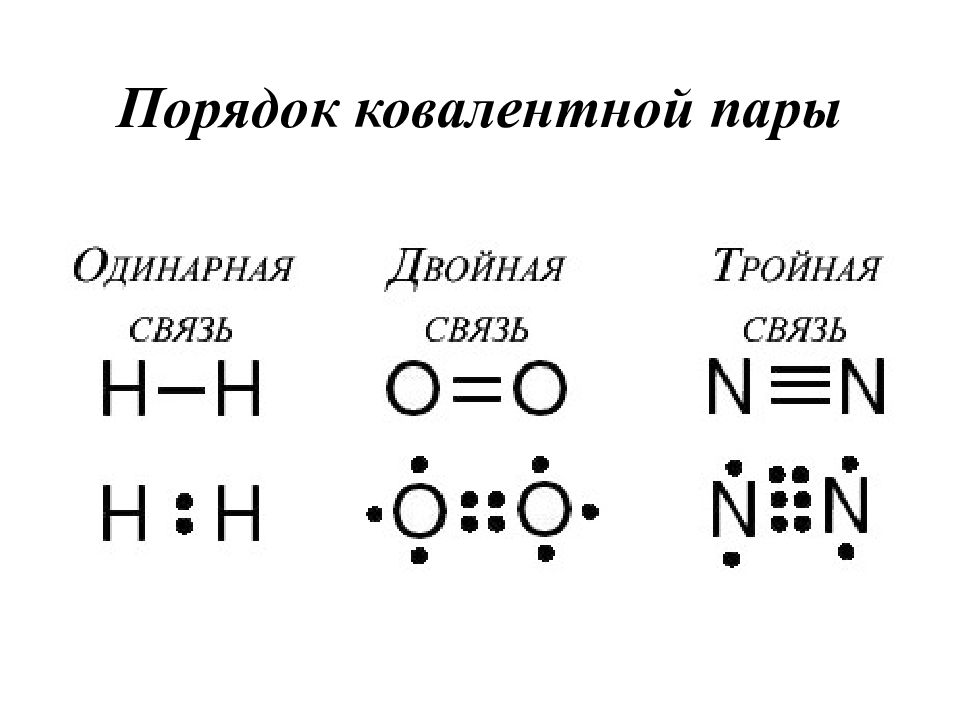
Слайд 19: Кратность связи
Это число общих электронных пар (количество связей) между взаимодействующими атомами
Слайд 20: Механизмы образования ковалентной связи
Обменный Донорно-акцепторный Дативный
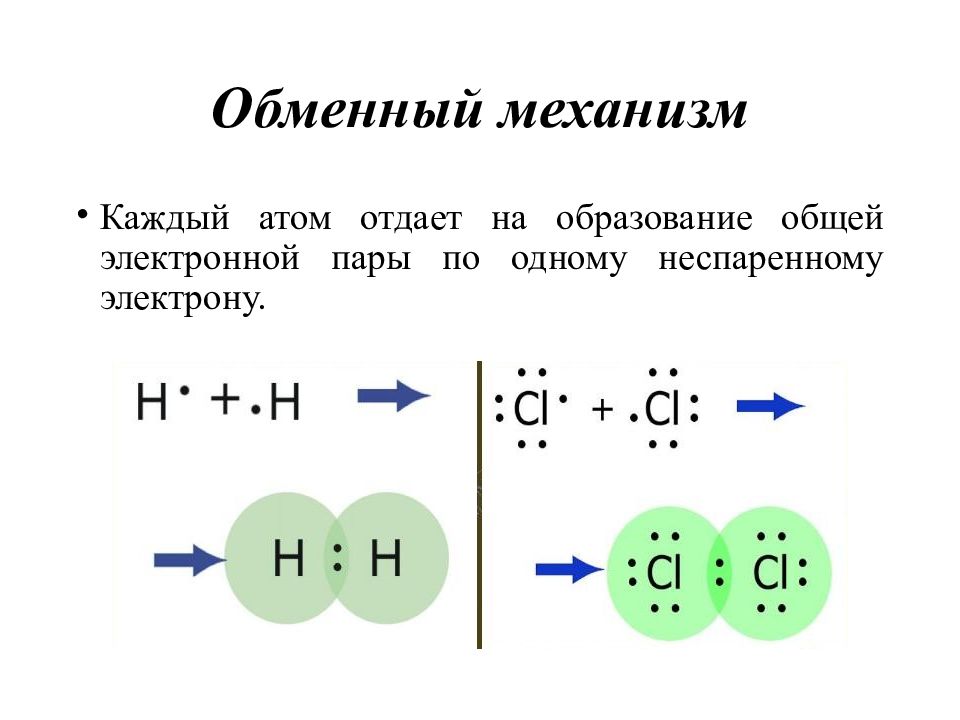
Слайд 21: Обменный механизм
Каждый атом отдает на образование общей электронной пары по одному неспаренному электрону.
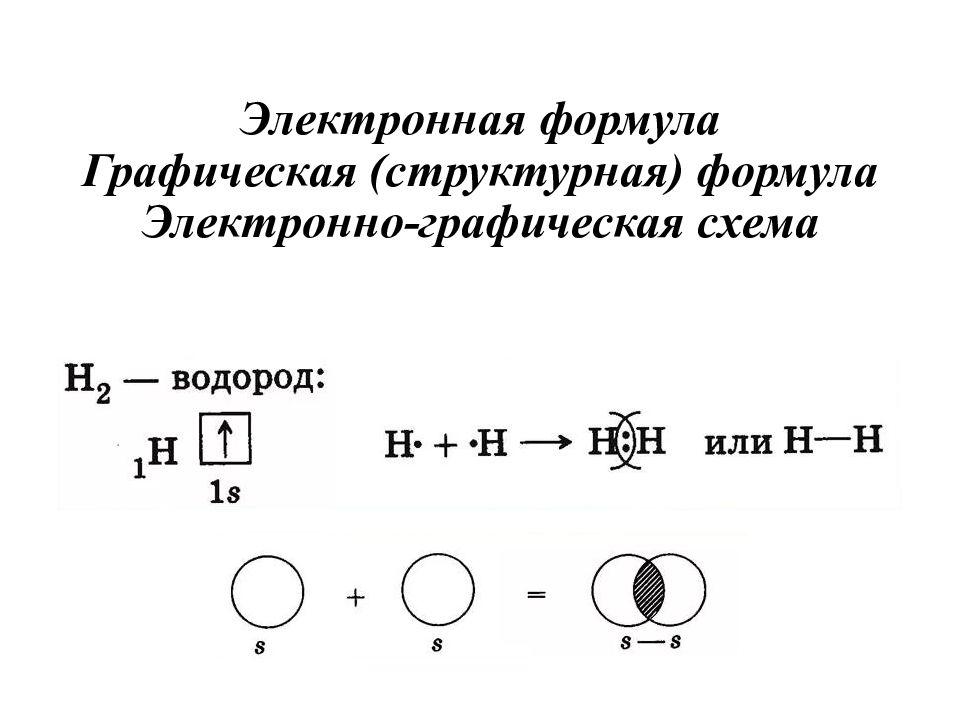
Слайд 22: Электронная формула Графическая (структурная) формула Электронно-графическая схема
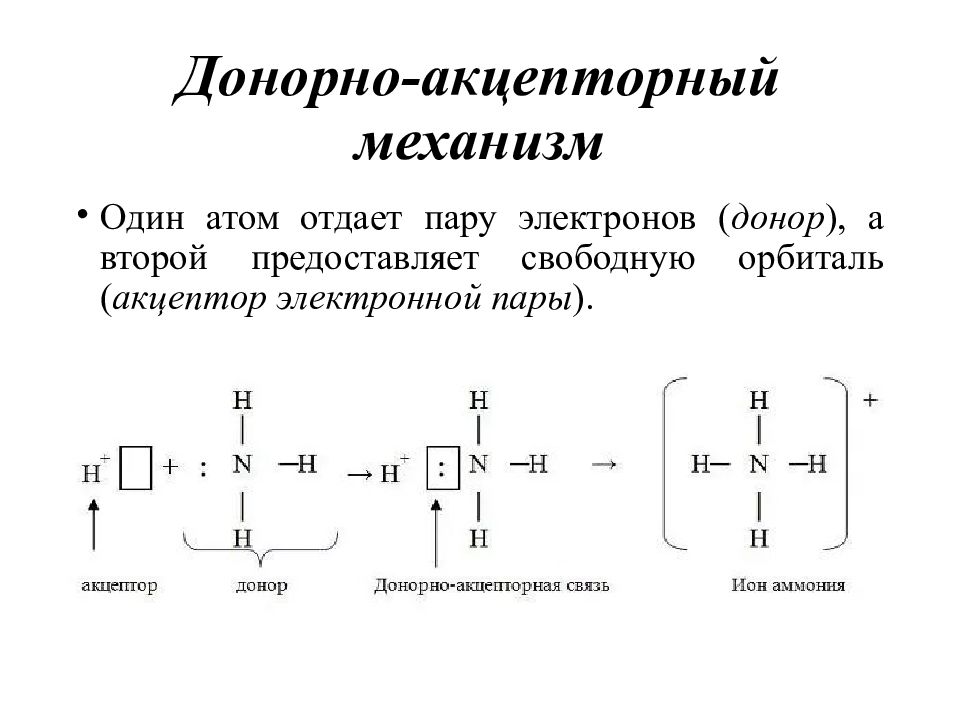
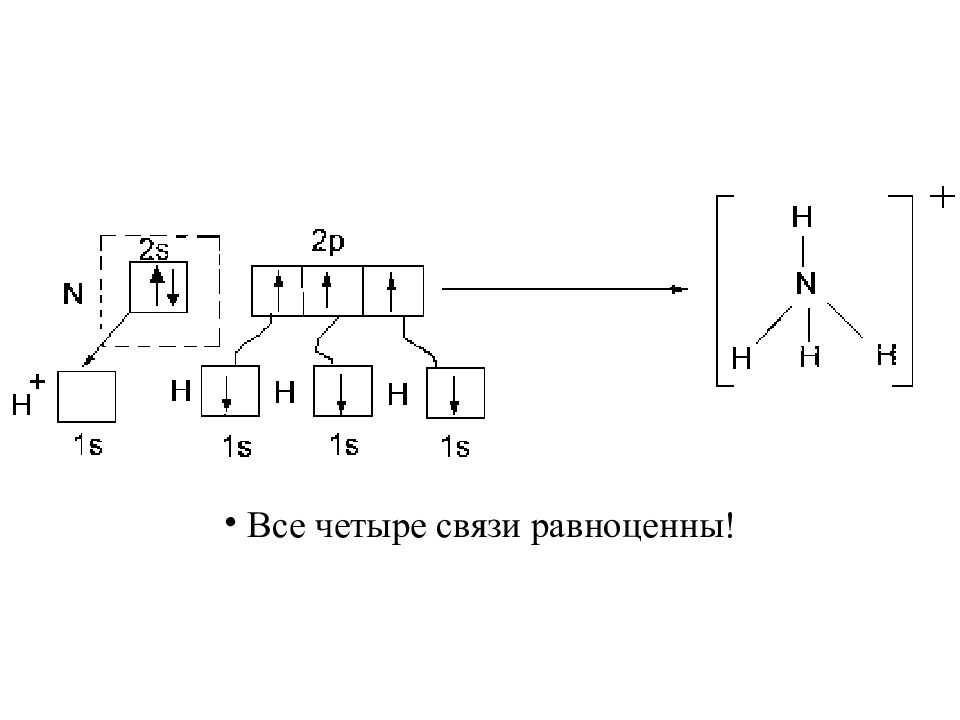
Слайд 24: Донорно-акцепторный механизм
Один атом отдает пару электронов ( донор ), а второй предоставляет свободную орбиталь ( акцептор электронной пары ).
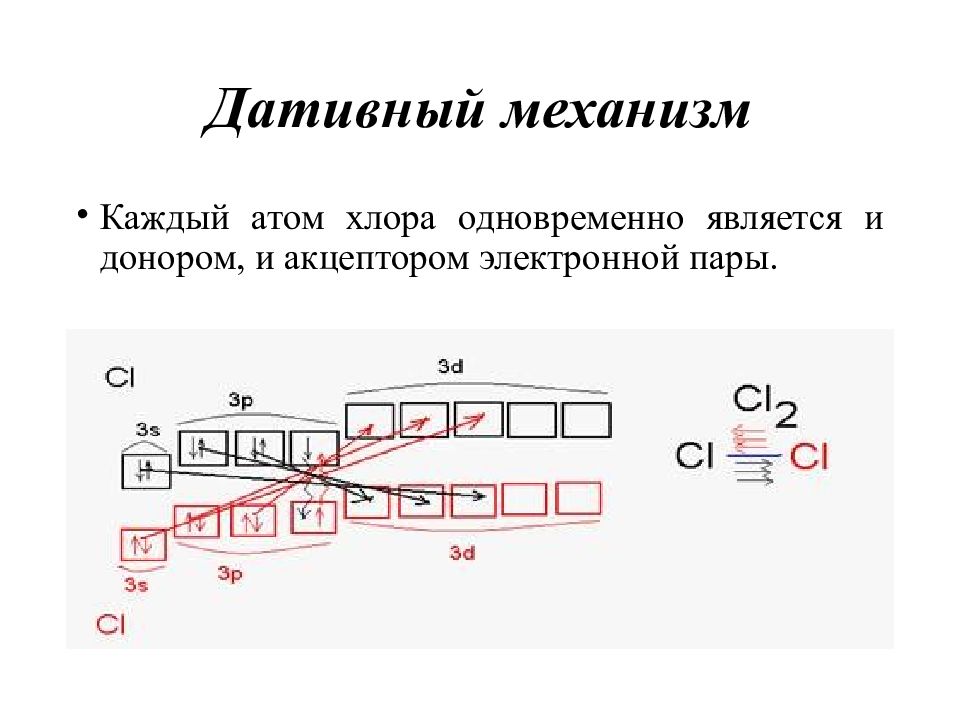
Слайд 26: Дативный механизм
Каждый атом хлора одновременно является и донором, и акцептором электронной пары.
Слайд 27: Свойства ковалентной связи
Полярность – смещение электронной плотности к более электроотрицательному атому. Ковалентная неполярная связь – образована атомами с одинаковыми значениями ЭО: Н-Н, О=О ( Δ ЭО = 0). Ковалентная полярная связь – образуется между атомами с разными значениями ЭО: H 2 O, NH 3.
Слайд 29: Свойства ковалентной связи
Насыщаемость – определенное число химических связей атома, вызванное ограниченным числом валентных связей и АО. Отсюда следует, что максимальная валентность ( ковалентность ) : элементов первого периода равна 1, второго – 4 (одна 2s-АО + три 2р-АО ), третьего – 9 (одна 3s-АО + три 3р-АО и + 5d-АО).
Слайд 30: Свойства ковалентной связи
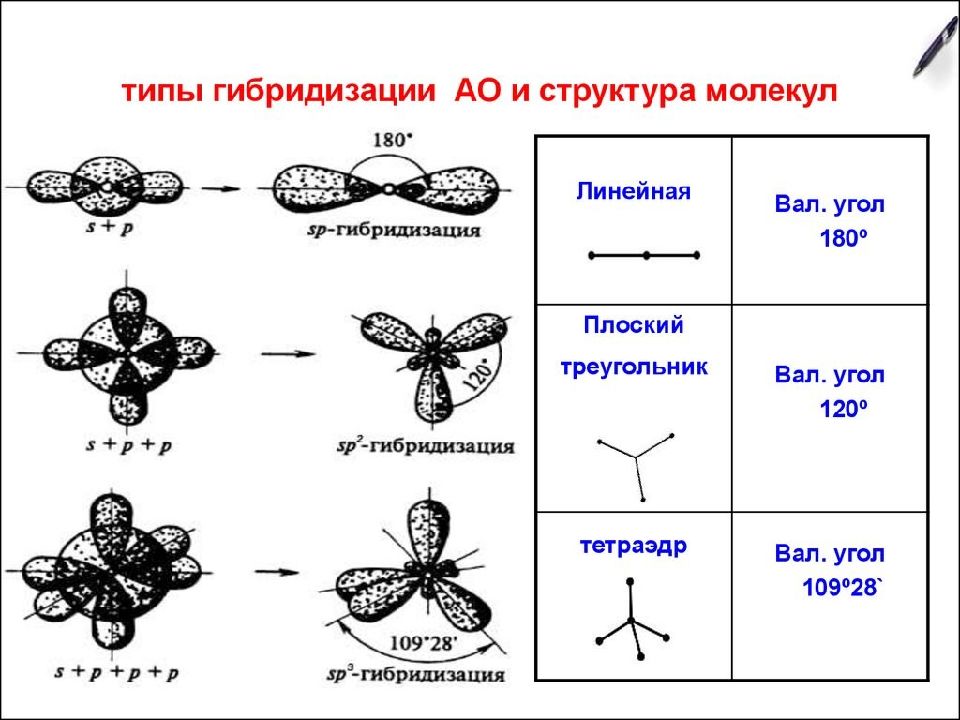
Направленность – молекулы и ионы с ковалентными связями имеют определённое геометрическое строение. Геометрическое строение молекул и ионов объясняется гибридизацией атомных орбиталей.
Слайд 31: Теория гибридизации
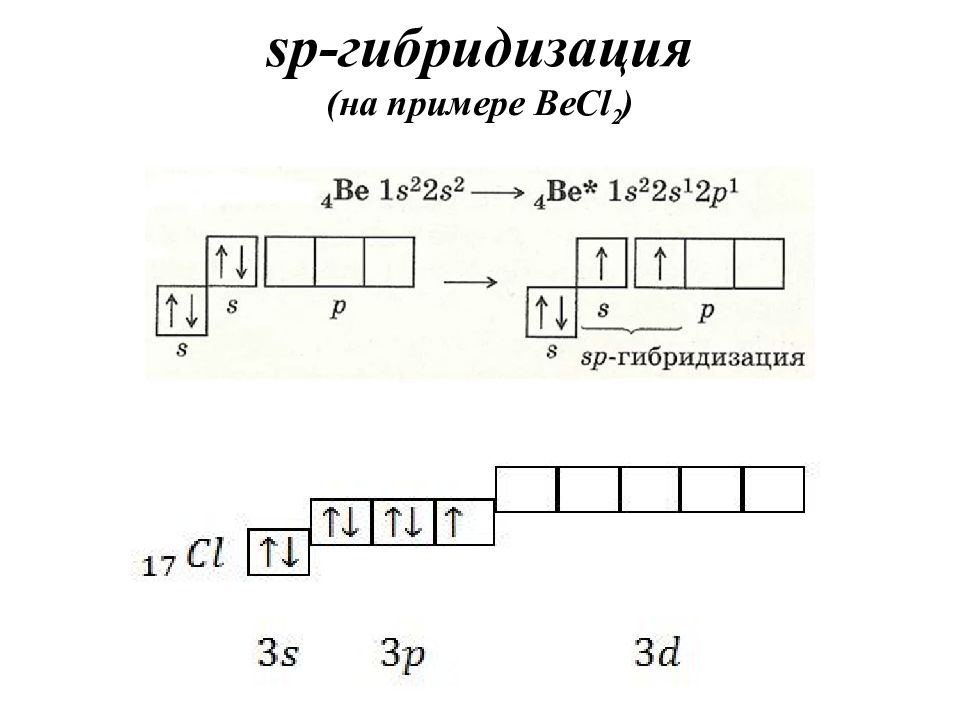
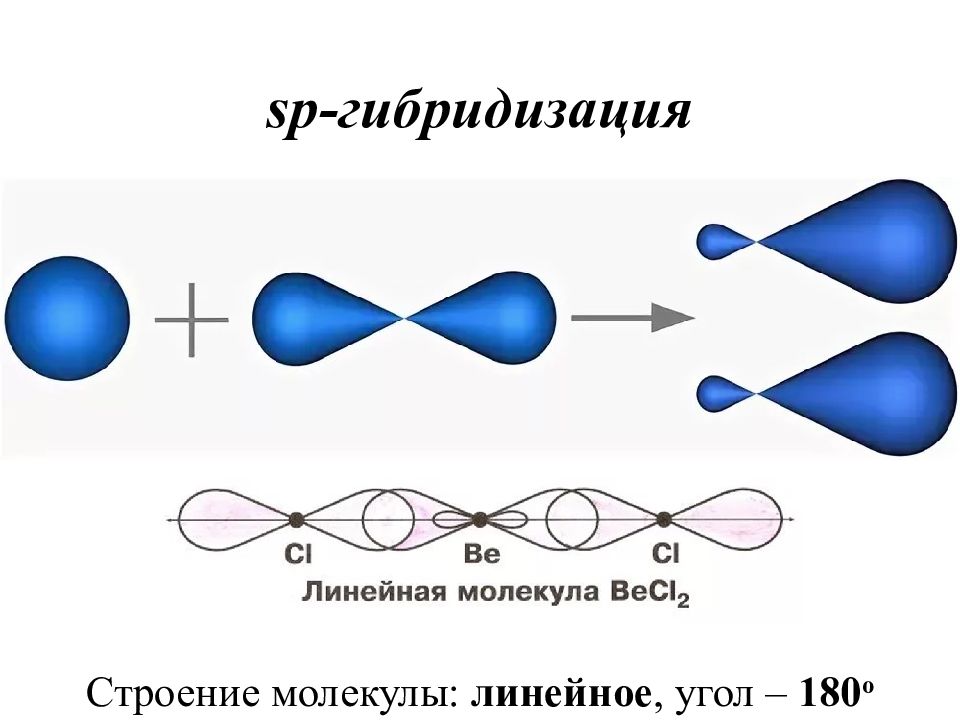
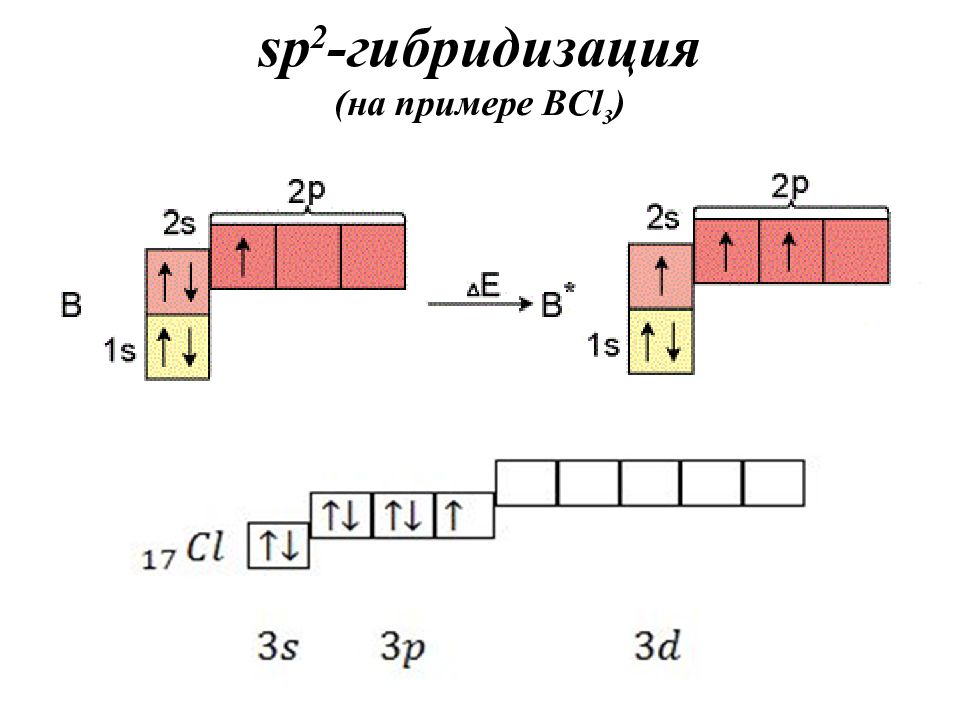
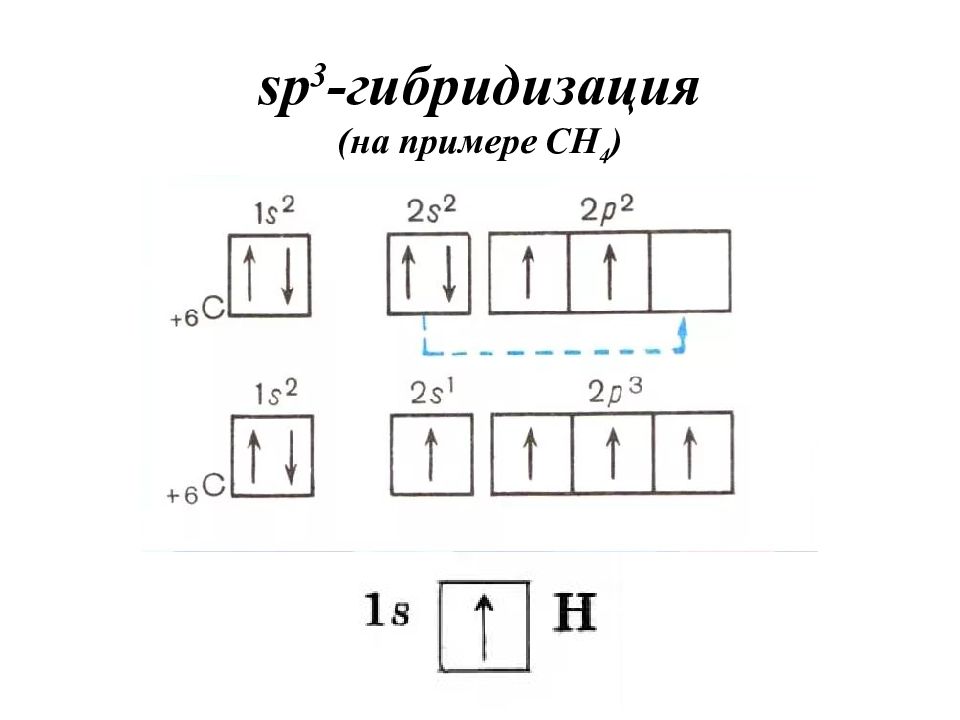
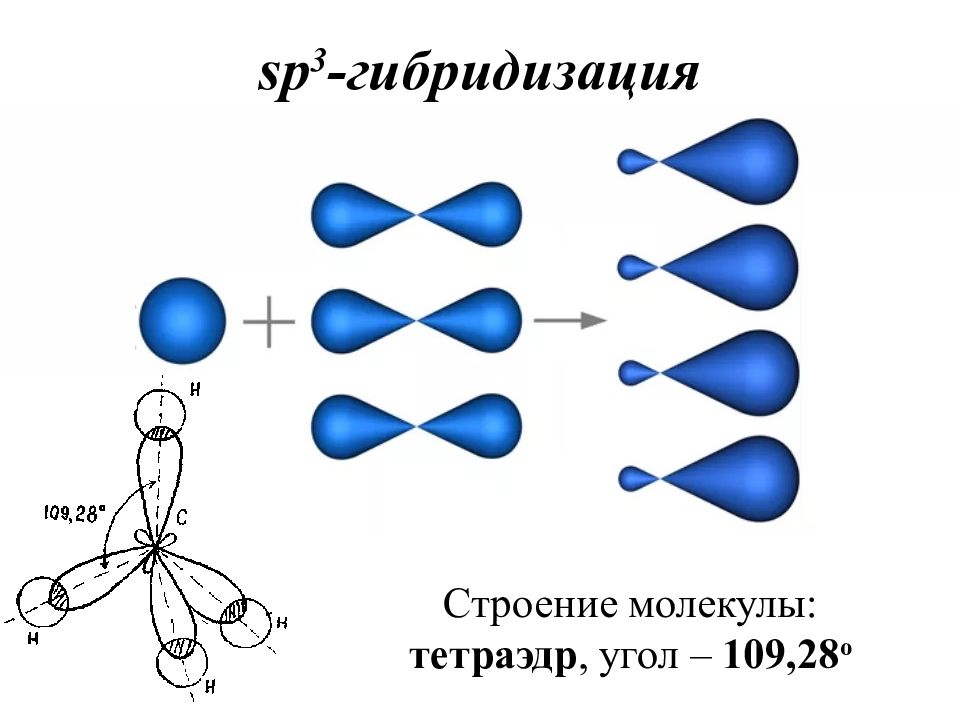
Гибридизация – это выравнивание атомных орбиталей по форме и энергии. Основные положения теории гибридизации : гибридизуются АО центрального атома гибридные АО имеют определённую форму, которая обеспечивает максимальное перекрывание гибридизуются АО с неспаренными электронами, а также занятые парой электронов гибридизуются АО, участвующие в сигма-связывании гибридные АО располагаются в пространстве таким образом, чтобы испытывать минимальное межэлектронное отталкивание Число АО = числу ГАО!
Слайд 32: Алгоритм определения типа гибридизации в молекулах
Записать электронно-графическую формулу для валентных электронов (участвуют в образовании химической связи). Записать электронно-графическую формулу центрального атома в возбужденном состоянии (если необходимо). По числу АО построить ГАО. Определить тип гибридизации по числу атомных орбиталей, участвующих в гибридизации.
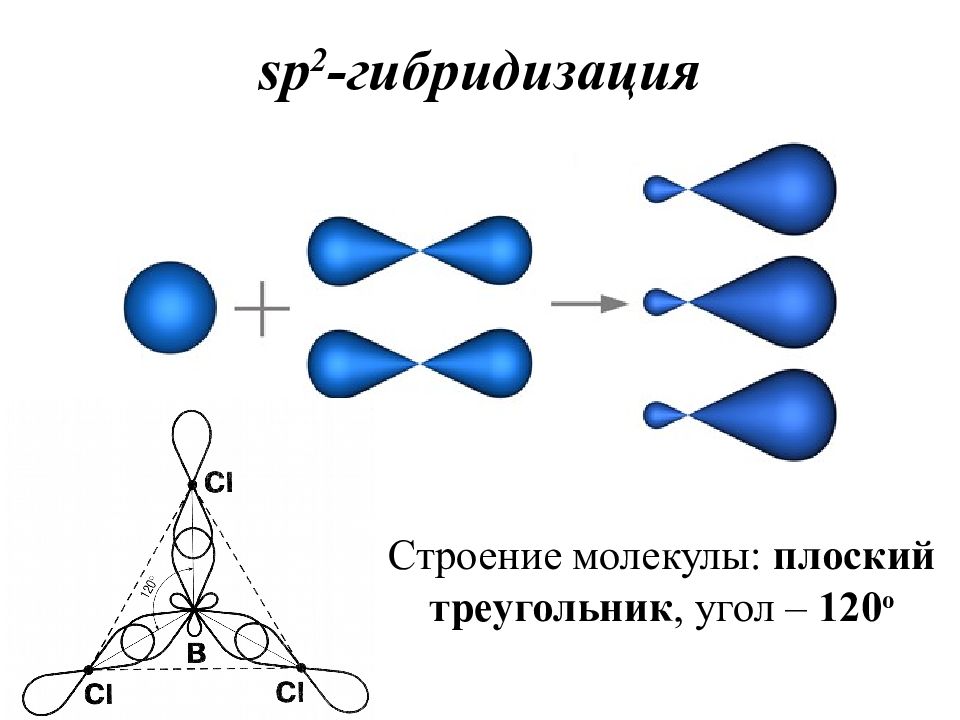
Слайд 36: sp 2 - гибридизация
Строение молекулы: плоский треугольник, угол – 120 о
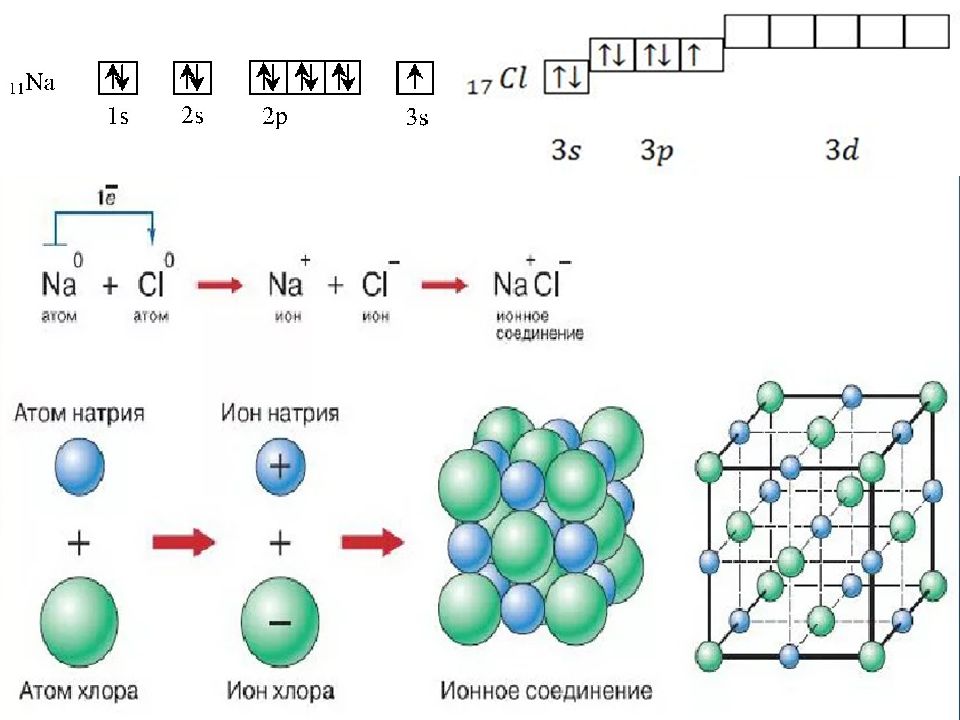
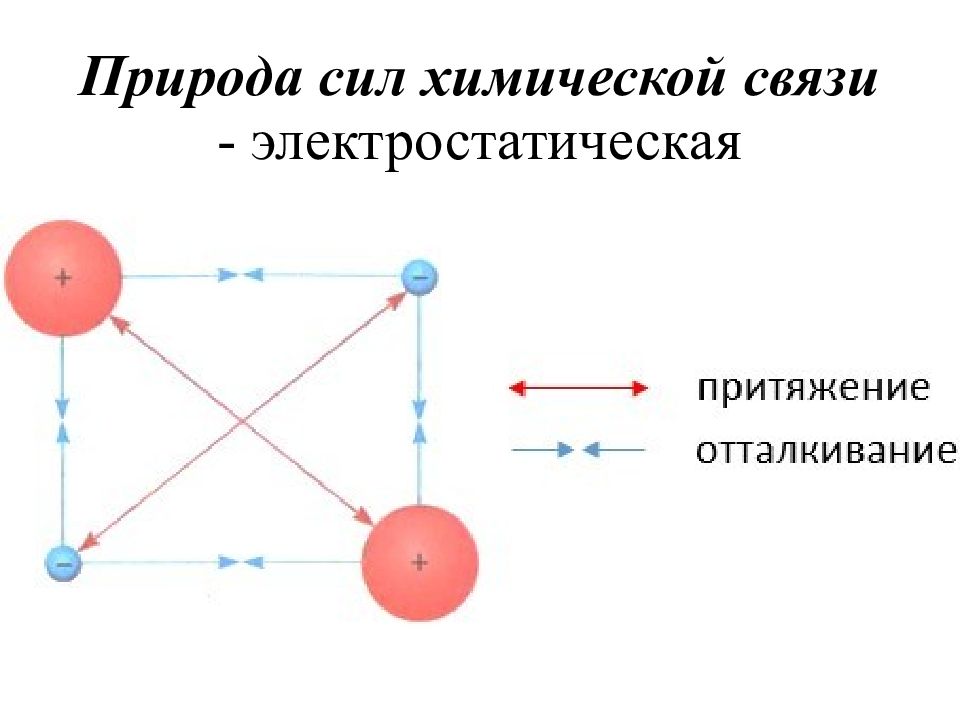
Слайд 40: Ионная связь
Осуществляется за счет электростатического взаимодействия противоположно заряженных ионов в химическом соединении. Возникает между катионами s- металлов I и II группы п.с. и анионами неметаллов VI и VII группы. Δ ЭО > 1,9 Пример : NaCl, LiF, K 2 O, MgO
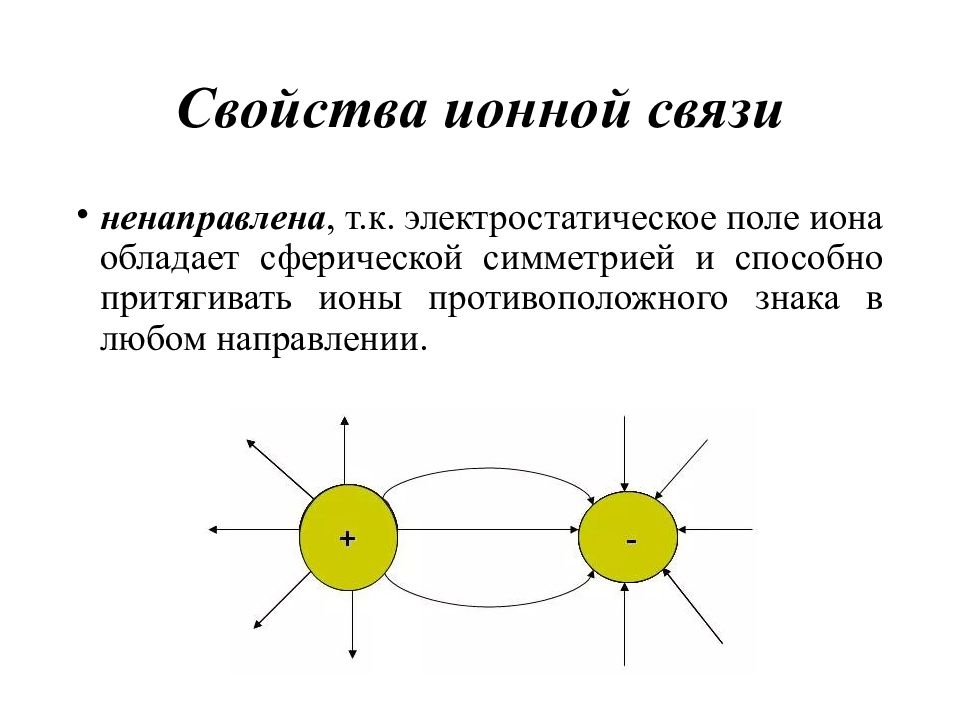
Слайд 42: Свойства ионной связи
ненаправлена, т.к. электростатическое поле иона обладает сферической симметрией и способно притягивать ионы противоположного знака в любом направлении.
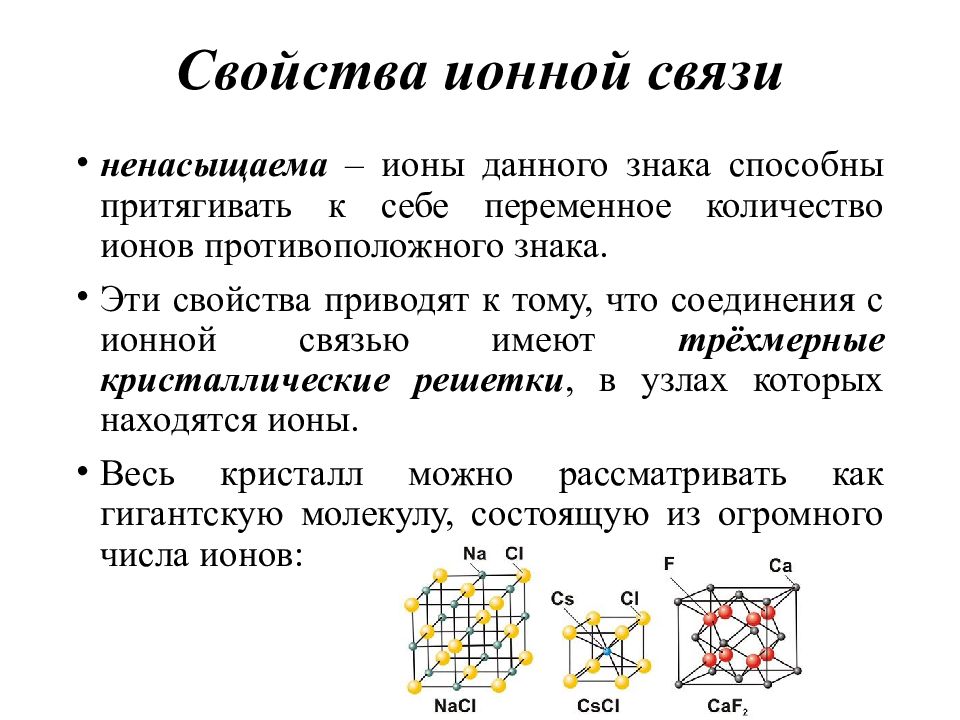
Слайд 43: Свойства ионной связи
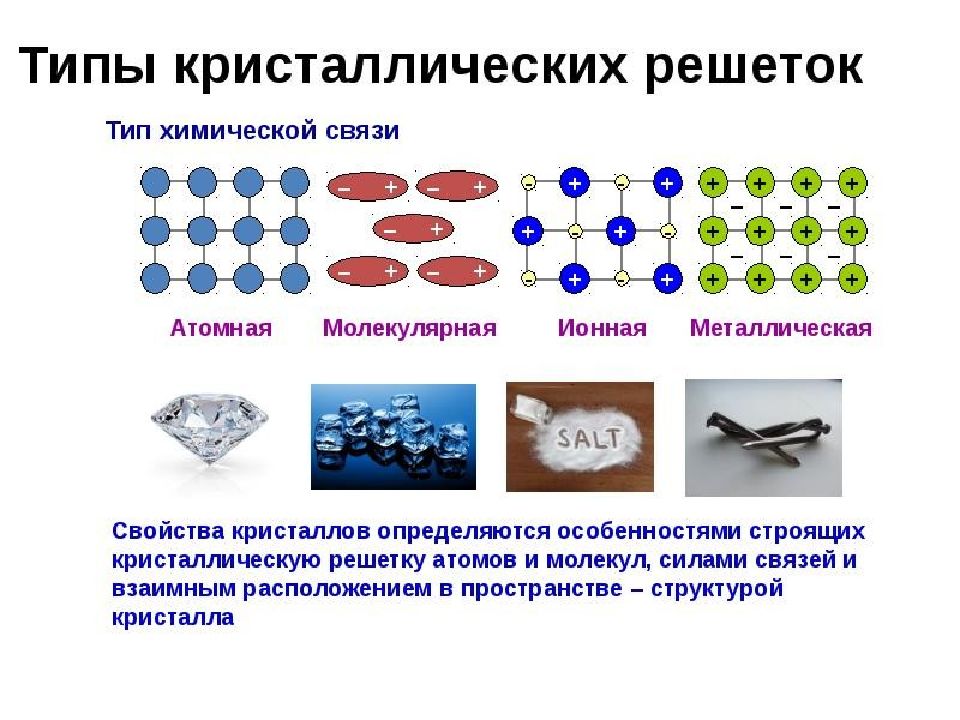
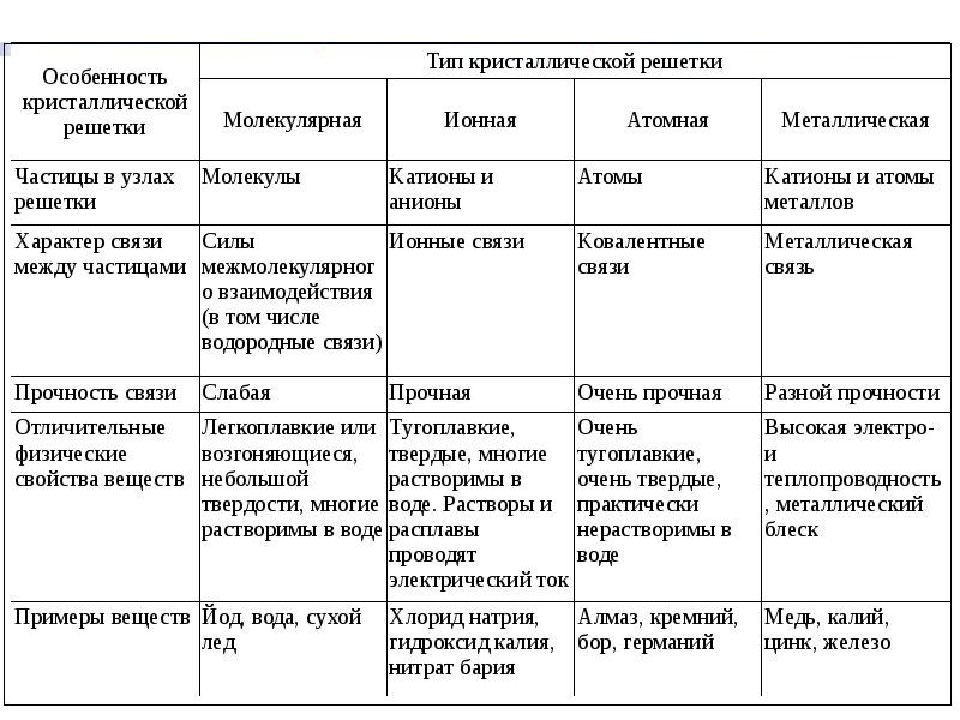
ненасыщаема – ионы данного знака способны притягивать к себе переменное количество ионов противоположного знака. Эти свойства приводят к тому, что соединения с ионной связью имеют трёхмерные кристаллические решетки, в узлах которых находятся ионы. Весь кристалл можно рассматривать как гигантскую молекулу, состоящую из огромного числа ионов :
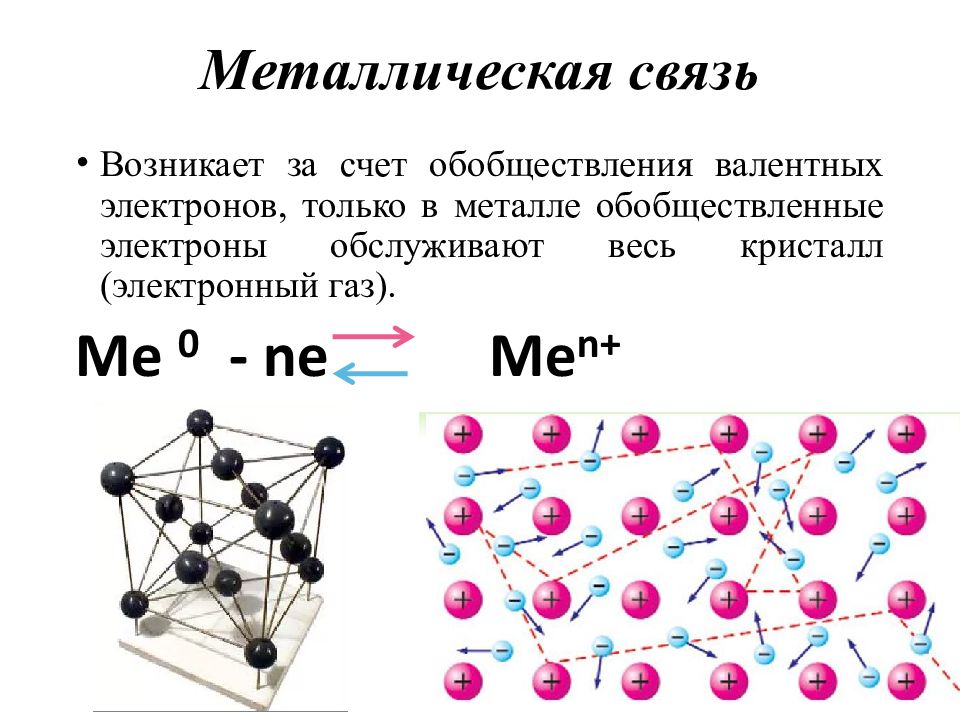
Слайд 45: Металлическая связь
Возникает за счет обобществления валентных электронов, только в металле обобществленные электроны обслуживают весь кристалл (электронный газ).
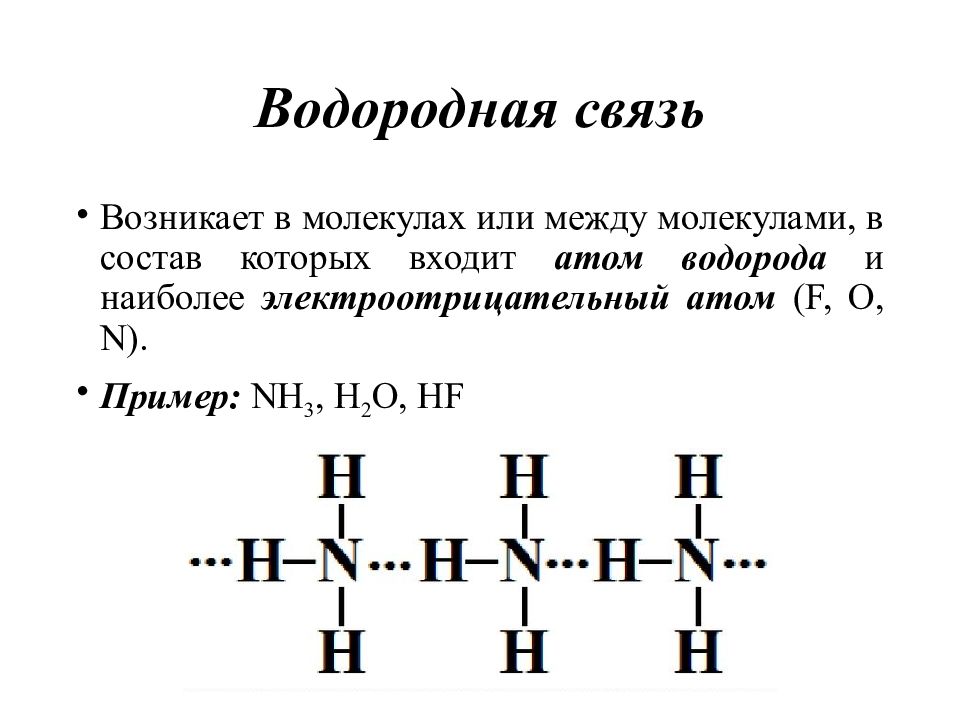
Слайд 46: Водородная связь
Возникает в молекулах или между молекулами, в состав которых входит атом водорода и наиболее электроотрицательный атом (F, O, N). Пример : NH 3, H 2 O, HF
Слайд 47
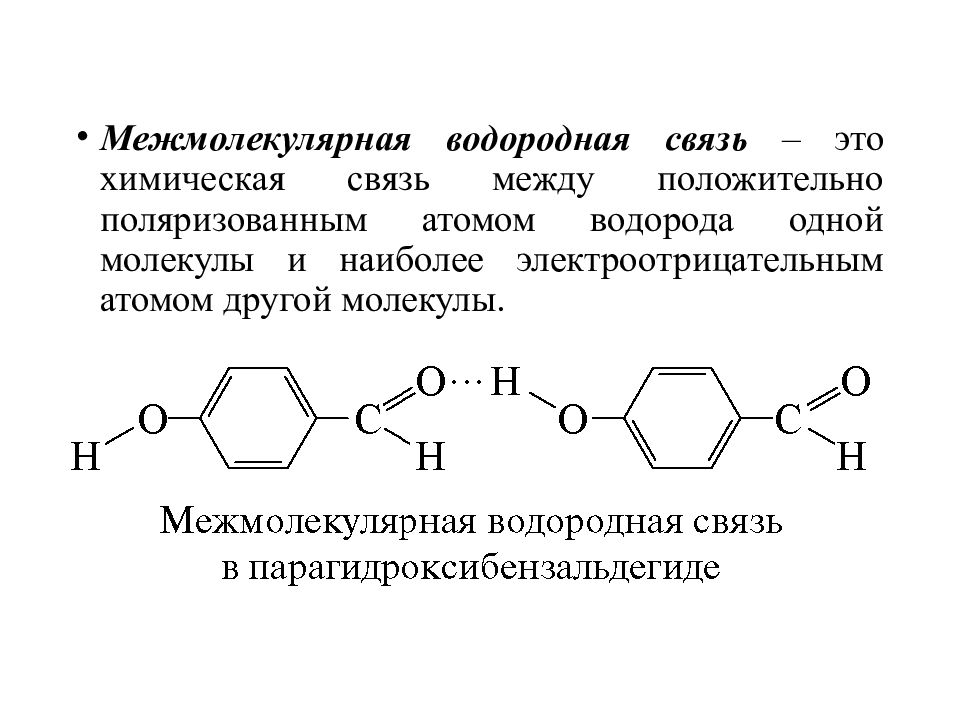
Межмолекулярная водородная связь – это химическая связь между положительно поляризованным атомом водорода одной молекулы и наиболее электроотрицательным атомом другой молекулы.
Слайд 48
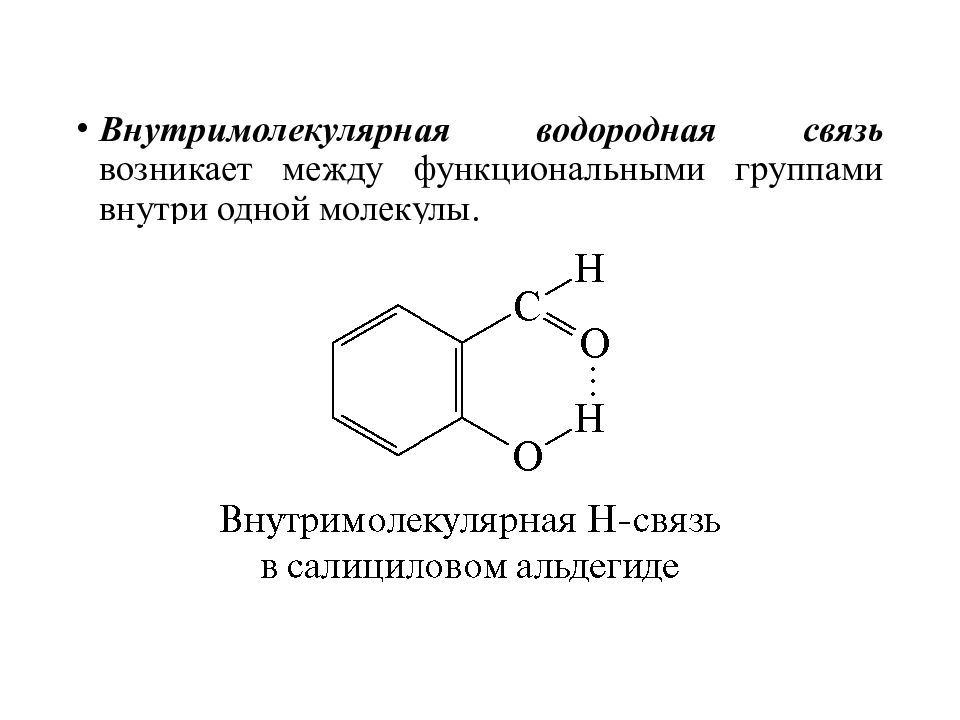
Внутримолекулярная водородная связь возникает между функциональными группами внутри одной молекулы.
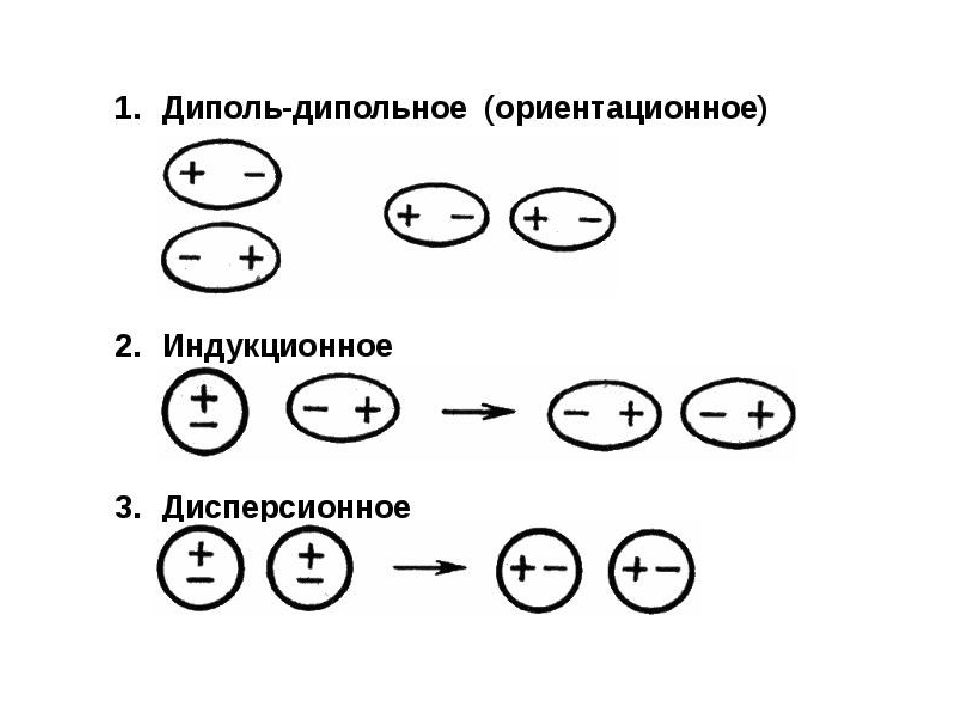
Слайд 49: Силы Ван-дер-Ваальса
Связи между молекулами, обусловленные электростатическим взаимодействием. Различают 3 типа сил : Ориентационное (диполь-дипольное) взаимодействие возникает между полярными молекулами ( HCl-HCl ). Индукционное взаимодействие возникает между полярными и неполярными молекулами (H 2 -HCl). Дисперсионное взаимодействие возникает между неполярными молекулами (H 2 -H 2 ).




![ХИМИЧЕСКАЯ СВЯЗЬ Дипольный момент [ Кл·м ] = [D]](https://s1.showslide.ru/s_slide/292382bd02cba907989082f1d6e2c2fb/8bd180be-6642-4911-8983-72d74f364d69.jpeg)