Слайд 2: План:
Определение и классификация Свойства коллойдно-дисперсных систем Способы получения и методы очистки коллоидных растворов Устойчивость коллоидных растворов и их коагуляция
Слайд 3
Дисперсными называются системы, состоящие из множества малых частиц, равномерно распределенных в жидкой, твердой и газообразной среде. Для всех дисперсных систем характерны 2 основных признака : Высокая раздробленность Гетерогенность Дисперсные системы изучает коллоидная химия
Слайд 4
Высокая дисперсность придает веществам новые качественные признаки: Повышенная реакционная способность; Интенсивное окрашивание и светорассеивание; Большой запас поверхностной энергии Гиббса, т.к. большая поверхность раздела. Коллоидные растворы термодинамически неустойчивы, реакционноспособны. Легко протекают самопроизвольные процессы (адсорбция, коагуляция, слипание частиц, седиментация дисперсной фазы)
Слайд 5
Классификация дисперсных систем По размеру частиц дисперсной фазы (или по степени дисперсности) Д = 1 / а а – размеры частиц, м; Д – степень дисперсности, м -1. а) Грубодисперсные системы – взвеси, суспензии, эмульсии, порошки (а = 10 -4 – 10 -7 м) ; б) Коллоидно-дисперсные системы – золи (а = 10 -7 – 10 -9 м) ; в) Молекулярные и ионные растворы - истинные растворы (а > 10 -9 м). Взвеси эритроцитов, кишечной палочки, вирус гриппа – дисперсные системы
Слайд 6
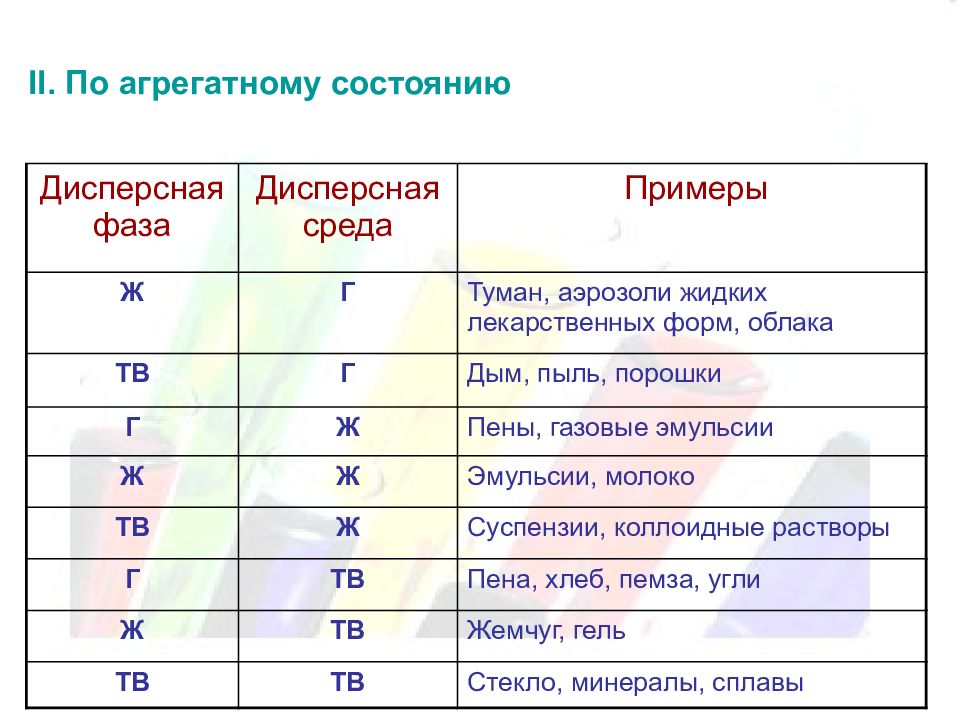
II. По агрегатному состоянию Дисперсная фаза Дисперсная среда Примеры Ж Г Туман, аэрозоли жидких лекарственных форм, облака ТВ Г Дым, пыль, порошки Г Ж Пены, газовые эмульсии Ж Ж Эмульсии, молоко ТВ Ж Суспензии, коллоидные растворы Г ТВ Пена, хлеб, пемза, угли Ж ТВ Жемчуг, гель ТВ ТВ Стекло, минералы, сплавы
Слайд 7
III. По отношению к дисперсионной среде а) свободно-дисперсные (аэрозоли, суспензии, эмульсии); б) связно-дисперсные (гели, студни, пены); в) лиофильные (сильное взаимодействие); г) лиофобные (слабое взаимодействие).
Слайд 8
Для коллоидно-дисперсных систем характерны свойства Молекулярно-кинетические Это броуновское движение, диффузия, осмотическое давление А. Эйнштейн и М. Смолуховский - среднее смещение частиц дисперсной фазы; r – радиус взвешенных частиц; - вязкость дисперсионной среды; t – время ; Т – температура; R и N A – константы.
Слайд 9
Чем крупнее частица дисперсной фазы, тем меньше величина ее смещения. С увеличением размера частиц прекращается поступательное броуновское движение, затем вращательное движение и остается только колебательное движение. Диффузия характерна и к коллоидно-дисперсным системам. Происходит для выравнивания концентрации частиц (закон Фика) (А. Эйнштейн) или, где Д – коэффициент диффузии
Слайд 10
Осмос менее характерен коллоидным растворам, чем истинным. Значение осмоса велико в физиологических процессах, т.к в любом организме каждая клетка снабжена полупроницаемой мембраной. , где - частичная концентрация частиц в единице объема. Концентрация золя меньше в 10 6 раз, чем в истинных растворах. В растворах ВМС (лиофильные системы) – осмометрия позволяет определять молярные массы полимеров (белки, полисахариды, каучуки и др.)
Слайд 11
II. Оптические Это рассеяние света, поглощение света. Явления – отражение, преломление, рассеяние и поглощение – зависят от соотношения между и r А. В грубодисперсных системах < r, поэтому отражение света. Б. В коллоидно-дисперсных системах r, поэтому преобладает рассеяние – опалесценция – матовое свечение голубоватых оттенков при боковом наблюдении. Это называется эффект Тиндаля. Появляется конус Тиндаля. По этому признаку можно определить коллоидные растворы.
Слайд 12
Д. Рэлей дал уравнение J 0 – интенсивность падающего света; J р – интенсивность рассеянного света; - длина волны падающего света; - частичная концентрация частиц; - объем одной частицы; k – константа. Нефелометрия – измерение рассеянного света; Турбодиметрия – измерение поглощенного света. В. В истинных растворах > r, поэтому только поглощение света.
Слайд 13
III. Электрокинетические Коллоидная частица состоит из мицелл и интермицеллярной жидкости. Строение мицеллы на примере йодида серебра. {mAgJ nJ - (n-x)K + } x- xK + агрегат адсорбционный слой диффузный слой
Слайд 14
Двойной электрический слой (ДЭС) возникает на границе твердое тело – жидкость за счет избирательной адсорбции ионов одного знака ( правило Панета – Фаянса ). Электрокинетический потенциал (дзета-потенциал) - потенциал поверхности скольжения. Это причина противодействия агрегации за счет взаимного отталкивания частиц дисперсной фазы. Электрокинетические явления (ЭКЯ) – эффекты, связанные с относительным движением дисперсной фазы или дисперсной среды под действием постоянного электрического поля, либо – возникновение разности потенциалов при относительном смещении дисперсной фазы и дисперсионной среды, на границе между которыми существует двойной электрический слой.
Слайд 17
Примеры FeCl 3 + 3H 2 O Fe(OH) 3 + 3HCl H 2 S + 0,5O 2 S + H 2 O 2KAuO 2 + 3HCOH + K 2 CO 3 2Au + 3HCOOK + KHCO 3 + H 2 O BaCl 2 + K 2 SO 4 BaSO 4 + 2KCl {mFe(OH) 3 nFeO + (n-x)Cl - } x+ xCl - - золь Fe(OH) 3 {mS nS 5 O 6 2- 2(n-x)H + } 2x- 2xH + {mAu nAuO 2 - (n-x)K + } x- xK + {mBaSO 4 nBa 2+ 2(n-x)Cl - } 2x+ 2xCl -
Слайд 18
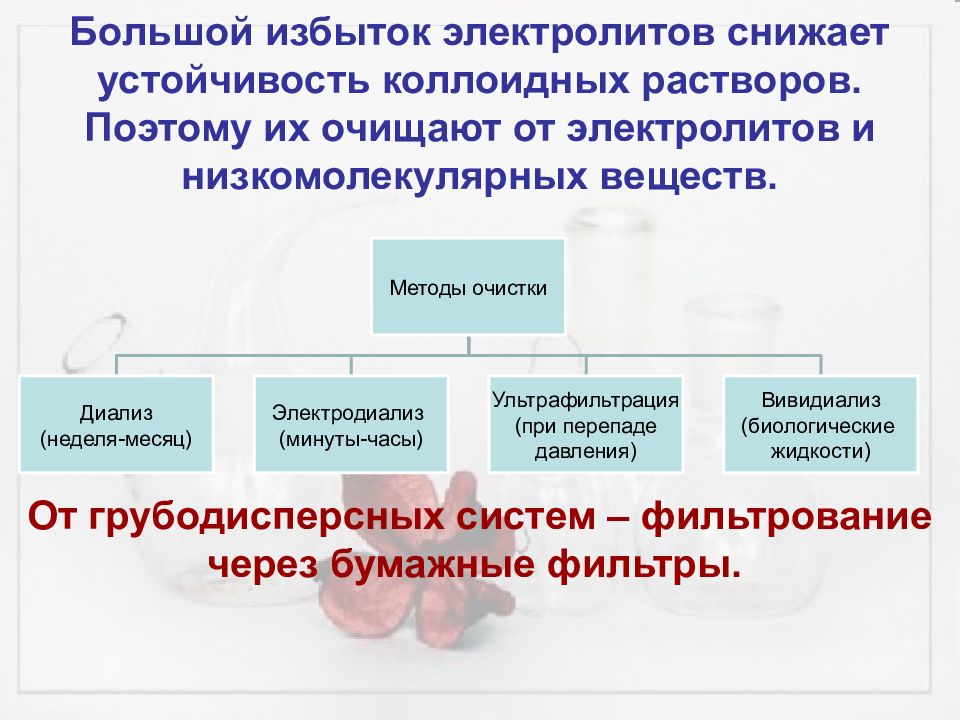
Большой избыток электролитов снижает устойчивость коллоидных растворов. Поэтому их очищают от электролитов и низкомолекулярных веществ. От грубодисперсных систем – фильтрование через бумажные фильтры.
Слайд 19
Устойчивость дисперсной системы – это постоянство во времени ее состояния и основных свойств. Лиофобные золи – термодинамически неустойчивы, склонны к коагуляции. Коагуляция – процесс слипания (слияния) частиц дисперсной фазы при потере агрегативной устойчивости. Устойчивость дисперсной системы – это постоянство во времени ее состояния и основных свойств. Лиофобные золи – термодинамически неустойчивы, склонны к коагуляции. Коагуляция – процесс слипания (слияния) частиц дисперсной фазы при потере агрегативной устойчивости.
Слайд 21
При коагуляции изменяются физико-химические свойства коллоидных растворов: Появляется мутность Снижается осмотическое давление Изменяется проводимость раствора Изменяется вязкость раствора
Слайд 22
Наиболее важный фактор – действие электролитов. Они быстро и резко влияют на толщину двойного электрического слоя. Дзета – потенциал является одним из главных факторов устойчивости гидрофобных золей.
Слайд 23
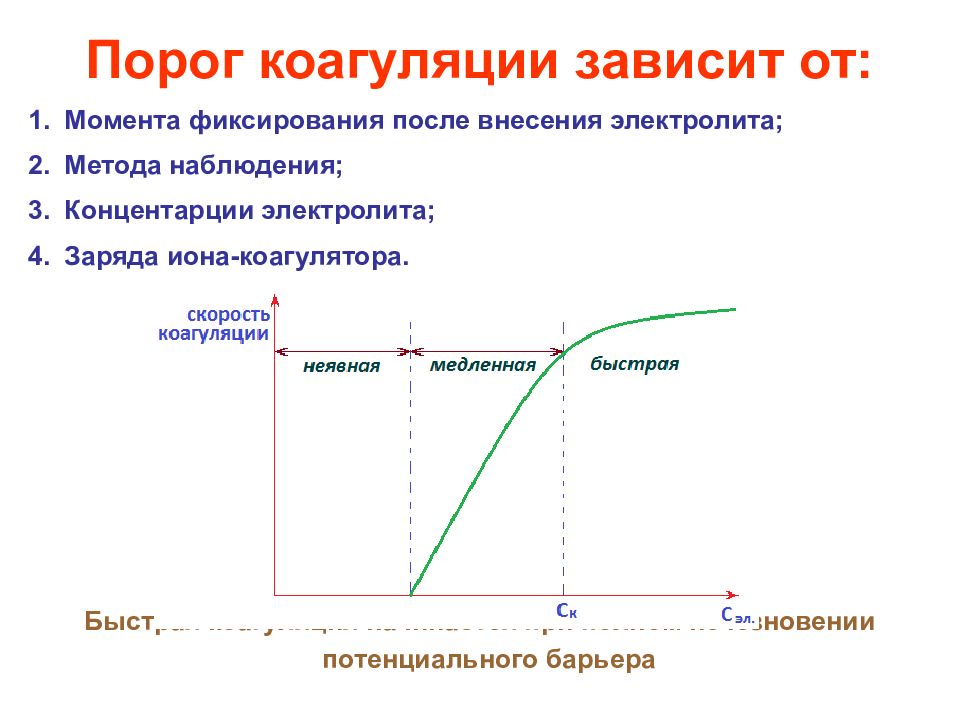
Правило Шульце-Гарди: коагулирующим действием обладает тот ион электролита, который имеет заряд, противоположный заряду гранулы; коагулирующее действие тем сильнее, чем выше заряд иона-коагулятора. Порог коагуляции – критическое значение концентрации, при которой данный электролит вызывает коагуляцию. Коагулирующая способность электролита
Слайд 24
Порог коагуляции зависит от: Момента фиксирования после внесения электролита; Метода наблюдения; Концентарции электролита; Заряда иона-коагулятора. Быстрая коагуляция начинается при полном исчезновении потенциального барьера
Слайд 25
По теории ДЛФО – 2 основных механизма: 1. концентрационная коагуляция за счет неэлектролитов; 2. нейтрализационная коагуляция за счет электролитов. Лиотропный ряд катионов Li + > Na + > K + > Pb + > Cs + порог коагуляции Чем больше гидратация иона, тем больше С к, или слабее коагулирующее действие.
Последний слайд презентации: ФИЗИКО-ХИМИЯ ДИСПЕРСНЫХ СИСТЕМ
Правило Дюкло-Траубе: С увеличением заряда иона-коагулянта порог коагуляции уменьшается, а коагулирующая способность возрастает. По коагулирующему действию ионы в зависимости от заряда располагаются в последовательности: 4 > 3 > 2 > 1 Согласно теории ДЛФО соотношение порогов коагуляции 1, 2 и 3 зарядных ионов имеет вид: