Первый слайд презентации: Лекция 2
Ультрамикрогетерогенные системы, их устойчивость. Коагуляция. 1
Слайд 2: Дисперсные системы
Дисперсные системы гетерогенны и состоят из двух фаз — раздробленной дисперсной фазы с размерами частиц от 10 –7 до 10 –2 см и сплошной фазы — дисперсионной среды. Системы с размерами частиц 10 –6 10 –7 см — коллоидные. 2
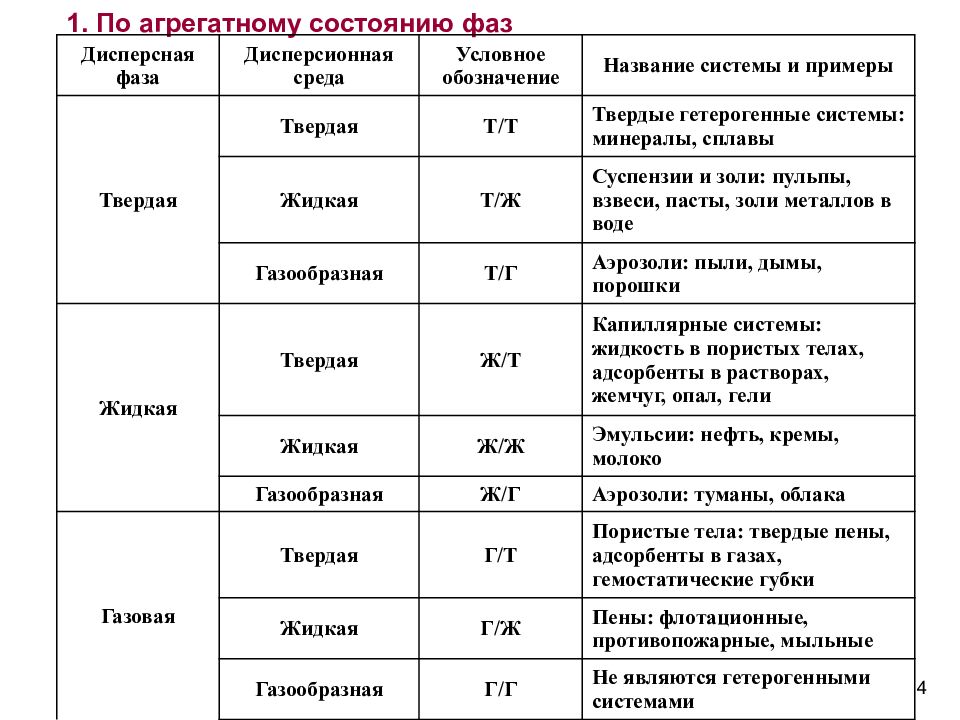
Слайд 4: 1. По агрегатному состоянию фаз
Дисперсная фаза Дисперсионная среда Условное обозначение Название системы и примеры Твердая Твердая Т/Т Твердые гетерогенные системы: минералы, сплавы Жидкая Т/Ж Суспензии и золи: пульпы, взвеси, пасты, золи металлов в воде Газообразная Т/Г Аэрозоли: пыли, дымы, порошки Жидкая Твердая Ж/Т Капиллярные системы: жидкость в пористых телах, адсорбенты в растворах, жемчуг, опал, гели Жидкая Ж/Ж Эмульсии: нефть, кремы, молоко Газообразная Ж/Г Аэрозоли: туманы, облака Газовая Твердая Г/Т Пористые тела: твердые пены, адсорбенты в газах, гемостатические губки Жидкая Г/Ж Пены: флотационные, противопожарные, мыльные Газообразная Г/Г Не являются гетерогенными системами 4
Слайд 5
2. По структуре ─ Свободнодисперсные системы (частицы дисперсной фазы или дисперсионной среды не связаны между собой): суспензии, эмульсии, золи, аэрозоли и др. ─ Связнодисперсные системы (одна из фаз не может перемещаться свободно): гели и студни, пены, твердые растворы (сплавы), пористые тела. 3. По дисперсности В зависимости от степени дисперсности частиц дисперсные системы подразделяются на: — грубодисперсные, с размером частиц от 10 –3 до 10 –2 см и более (грубые суспензии, порошки, пены); — микрогетерогенные, с размером частиц от 10 –5 до 10 –4 см (эмульсии, тонкие суспензии, аэрозоли); — ультрамикрогетерогенные системы, с размером частиц от 10 –7 до 10 –6 см (золи). 5
Слайд 6
4. По межфазному взаимодействию В зависимости от интенсивности взаимодействия дисперсной фазы с дисперсионной средой различают лиофильные и лиофобные системы. Если дисперсионной средой является вода, то соответствующие системы называются гидрофильными и гидрофобными. В гидрофильных системах дисперсная фаза интенсивно взаимодействует с водой (небольшое межфазовое поверхностное натяжение). Эти системы образуются самопроизвольно и термодинамически устойчивы ( мицеллярные системы в растворах коллоидных ПАВ, дисперсии глин в воде, золь парафина в жидком углеводороде). 6 Образование гидрофобных систем требует затраты энергии, а сами системы неустойчивы, поэтому необходимы специальные меры для гарантии их существования (присутствие стабилизатора ).
Слайд 7
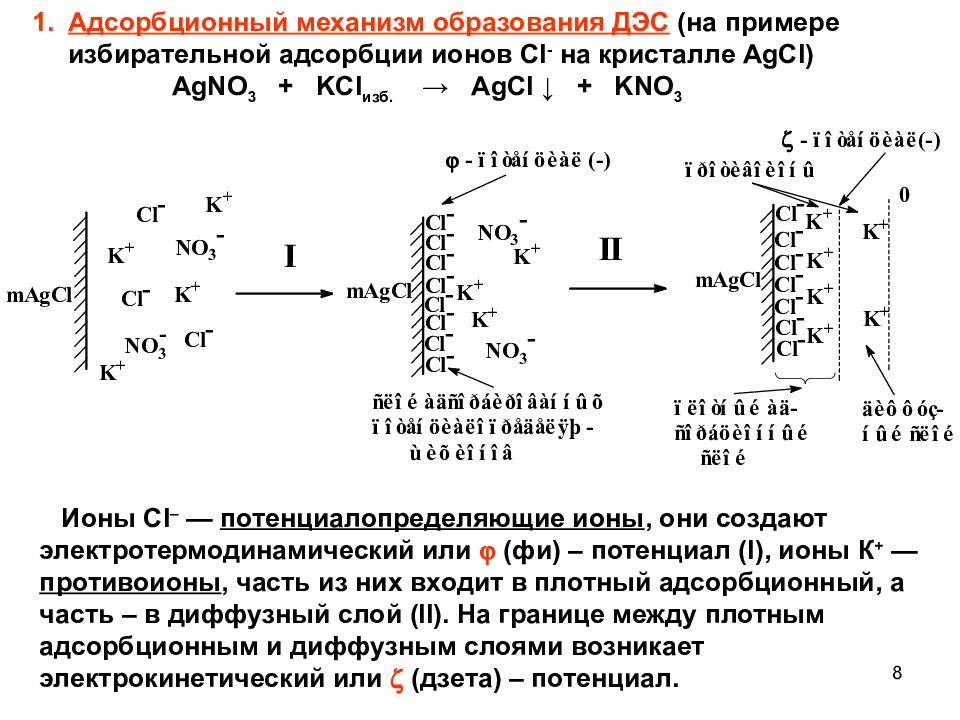
Поверхностные явления в коллоидных дисперсных системах Большая часть процессов, происходящих на поверхности раздела фаз в дисперсных системах, относится к адсорбционным процессам: образование двойных электрических слоев, пленок из молекул ПАВ или ВМС, образование адсорбционно-сольватных оболочек. Образование и строение двойного электрического слоя (ДЭС) Образование ДЭС — процесс самопроизвольный, снижающий поверхностную энергию коллоидных систем. Правило избирательной адсорбции (правило Фаянса – Панета): На поверхности вещества преимущественно адсорбируются ионы, которые или входят в состав вещества (способны достраивать кристаллическую решетку), или образуют с одним из ионов вещества труднорастворимое соединение. На поверхности вещества, несущей заряд, адсорбируются ионы, противоположные по знаку. 7
Слайд 8
Адсорбционный механизм образования ДЭС (на примере избирательной адсорбции ионов Cl - на кристалле AgCl ) AgNO 3 + KCl изб. → А g С l ↓ + KNO 3 Ионы Cl – — потенциалопределяющие ионы, они создают электротермодинамический или (фи) – потенциал ( I ), ионы К + — противоионы, часть из них входит в плотный адсорбционный, а часть – в диффузный слой ( II ). На границе между плотным адсорбционным и диффузным слоями возникает электрокинетический или (дзета) – потенциал. 8
Слайд 9
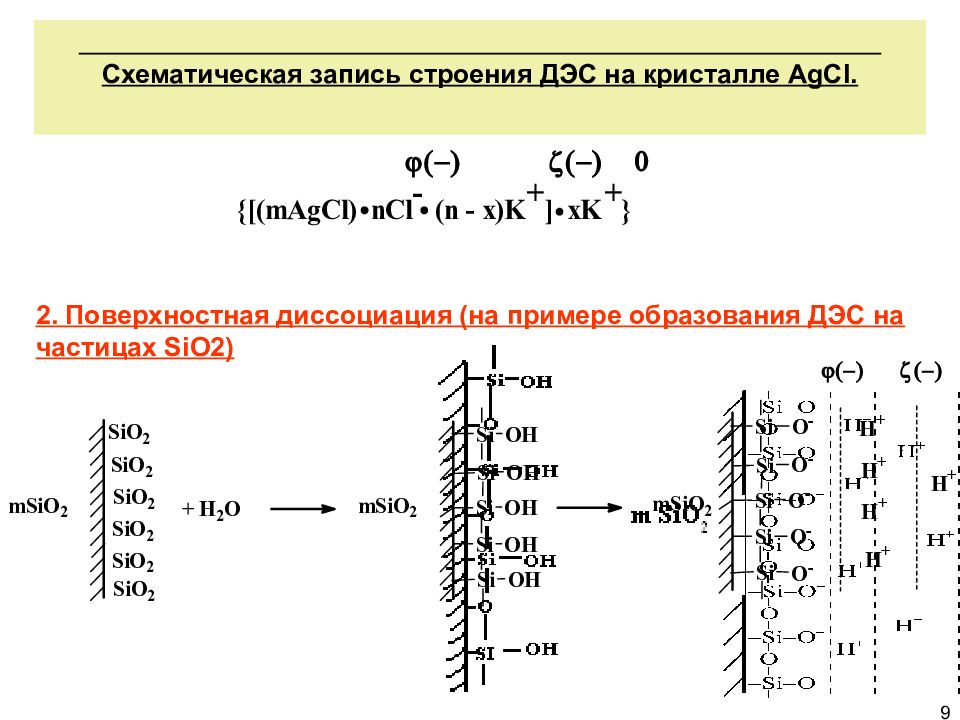
Схематическая запись строения ДЭС на кристалле AgCl. 2. Поверхностная диссоциация (на примере образования ДЭС на частицах SiO 2) 9
Слайд 10
Изменение поверхностной энергии коллоидной системы в процессе образования ДЭС где d — изменение поверхностного натяжения; d — изменение электротермодинамического потенциала, q s — поверхностная плотность заряда. Уравнение Липпмана 10 Если система стремится к равновесию вследствие самопроизвольного уменьшения поверхностной энергии без подвода извне электрической энергии, то обычно знаки заряда и потенциала ДЭС совпадают и увеличение абсолютного значения электрического потенциала сопровождается уменьшением поверхностной энергии.
Слайд 11
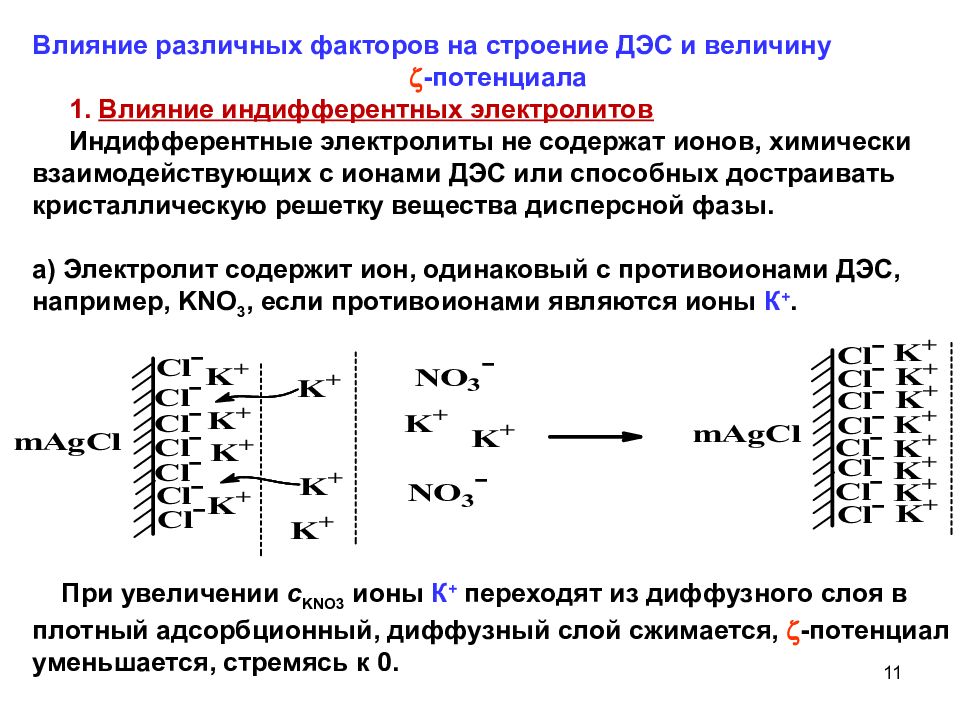
Влияние различных факторов на строение ДЭС и величину -потенциала 1. Влияние индифферентных электролитов Индифферентные электролиты не содержат ионов, химически взаимодействующих с ионами ДЭС или способных достраивать кристаллическую решетку вещества дисперсной фазы. а) Электролит содержит ион, одинаковый с противоионами ДЭС, например, KNO 3, если противоионами являются ионы К +. При увеличении с KNO 3 ионы К + переходят из диффузного слоя в плотный адсорбционный, диффузный слой сжимается, -потенциал уменьшается, стремясь к 0. 11
Слайд 12
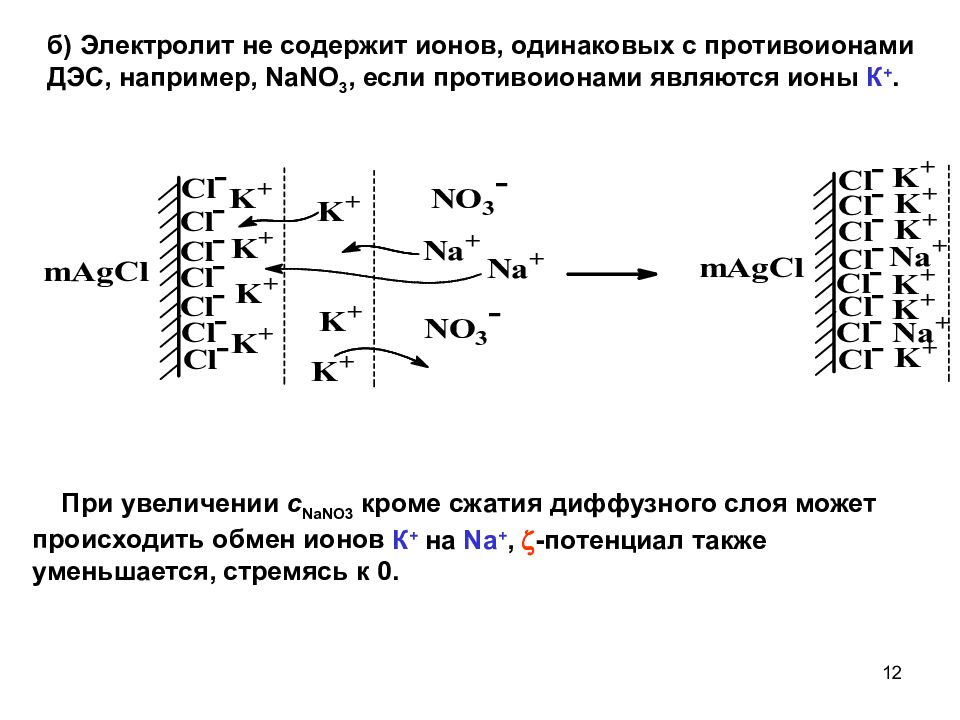
б) Электролит не содержит ионов, одинаковых с противоионами ДЭС, например, NaNO 3, если противоионами являются ионы К +. При увеличении с NaNO 3 кроме сжатия диффузного слоя может происходить обмен ионов К + на Na +, -потенциал также уменьшается, стремясь к 0. 12
Слайд 13
2. Влияние неиндифферентных электролитов Неиндифферентные электролиты содержат ионы, один из которых способен химически взаимодействовать с ионами ДЭС или достраивать кристаллическую решетку вещества. а) Электролит содержит ион, одинаковый с потенциалопределяющими ионами, например NaCl, если потенциалопределяющие ионы Cl –. При малых концентрациях NaCl за счет адсорбции ионов Cl - достраивается кристаллическая решетка А gCl, увеличиваются -потенциал и -потенциал. При больших концентрациях ионы Na + вызывают сжатие диффузного слоя, -потенциал падает. 13
Слайд 14
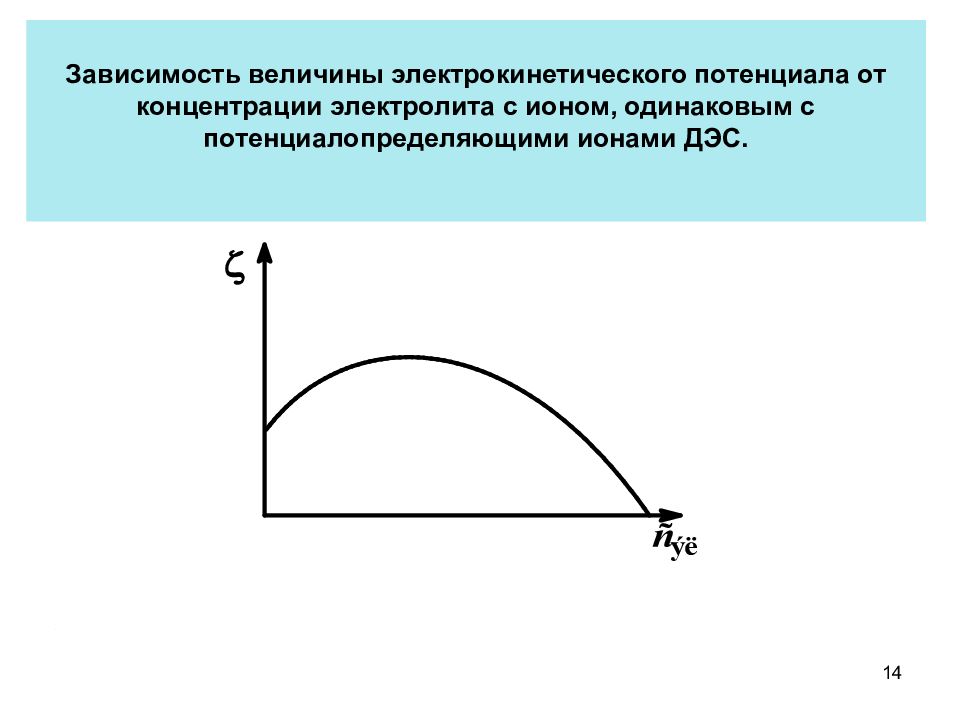
Зависимость величины электрокинетического потенциала от концентрации электролита с ионом, одинаковым с потенциалопределяющими ионами ДЭС. 14
Слайд 15
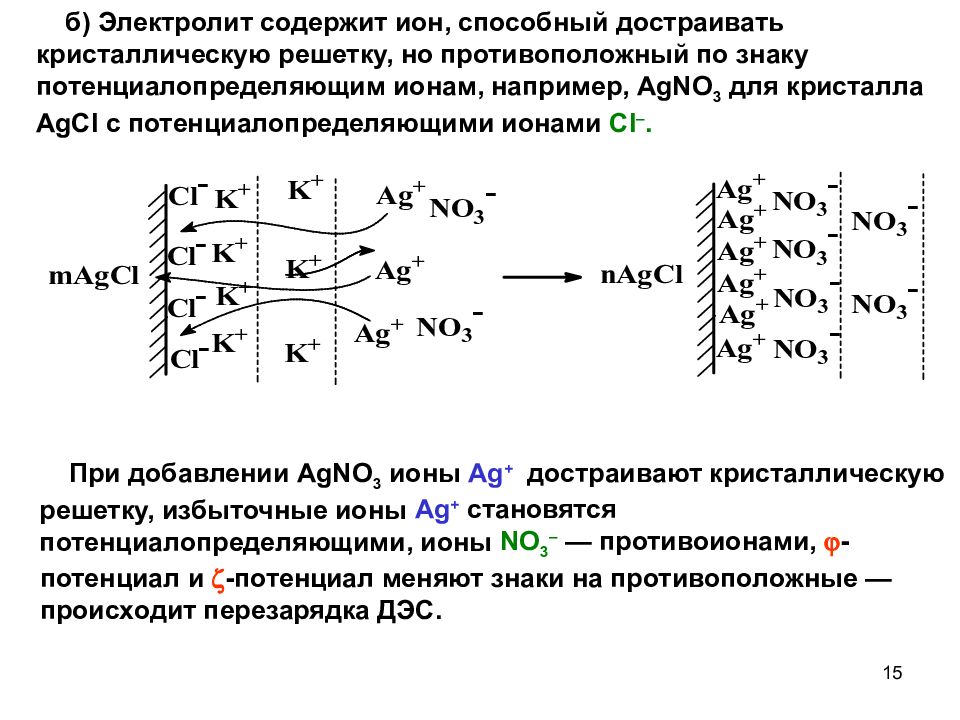
б) Электролит содержит ион, способный достраивать кристаллическую решетку, но противоположный по знаку потенциалопределяющим ионам, например, AgNO 3 для кристалла AgCl с потенциалопределяющими ионами Cl –. При добавлении AgNO 3 ионы Ag + достраивают кристаллическую решетку, избыточные ионы Ag + становятся потенциалопределяющими, ионы NO 3 – — противоионами, -потенциал и -потенциал меняют знаки на противоположные — происходит перезарядка ДЭС. 15
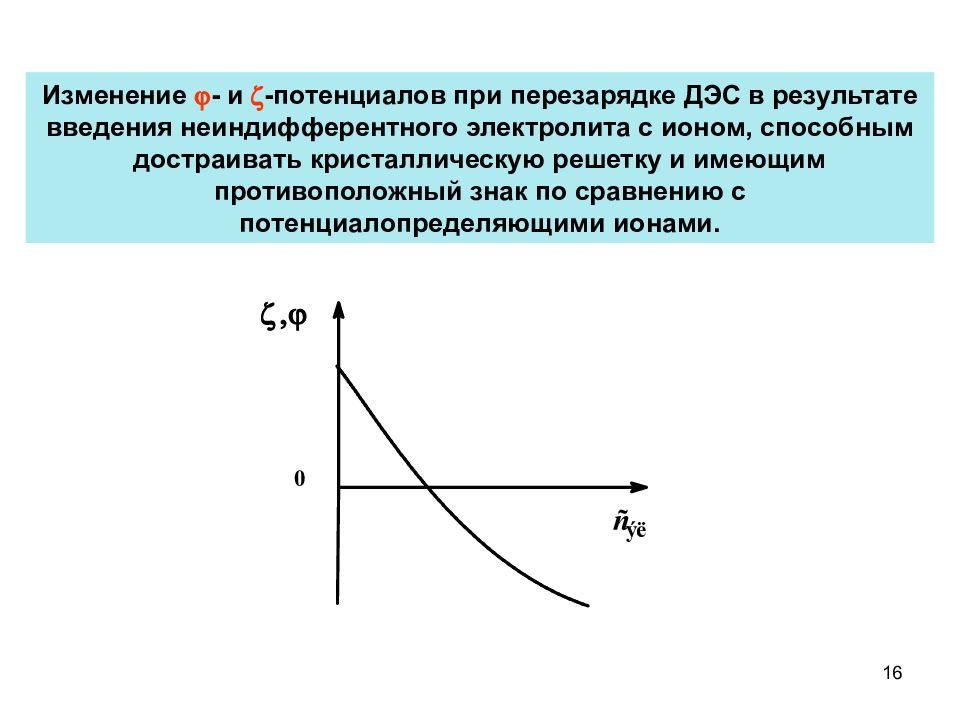
Слайд 16
Изменение - и -потенциалов при перезарядке ДЭС в результате введения неиндифферентного электролита с ионом, способным достраивать кристаллическую решетку и имеющим противоположный знак по сравнению с потенциалопределяющими ионами. 16
Слайд 17
3. Влияние разбавления и концентрирования. При разбавлении дисперсной системы -потенциал обычно увеличивается, а при увеличении концентрации уменьшается. 4. Влияние температуры и природы дисперсионной среды. С увеличением температуры вследствие интенсификации десорбции противоионов -потенциал увеличивается. При понижении температуры обычно уменьшается. Экспериментально было установлено: чем больше полярность среды, тем выше -потенциал; чем меньше полярность среды, тем он меньше. 17
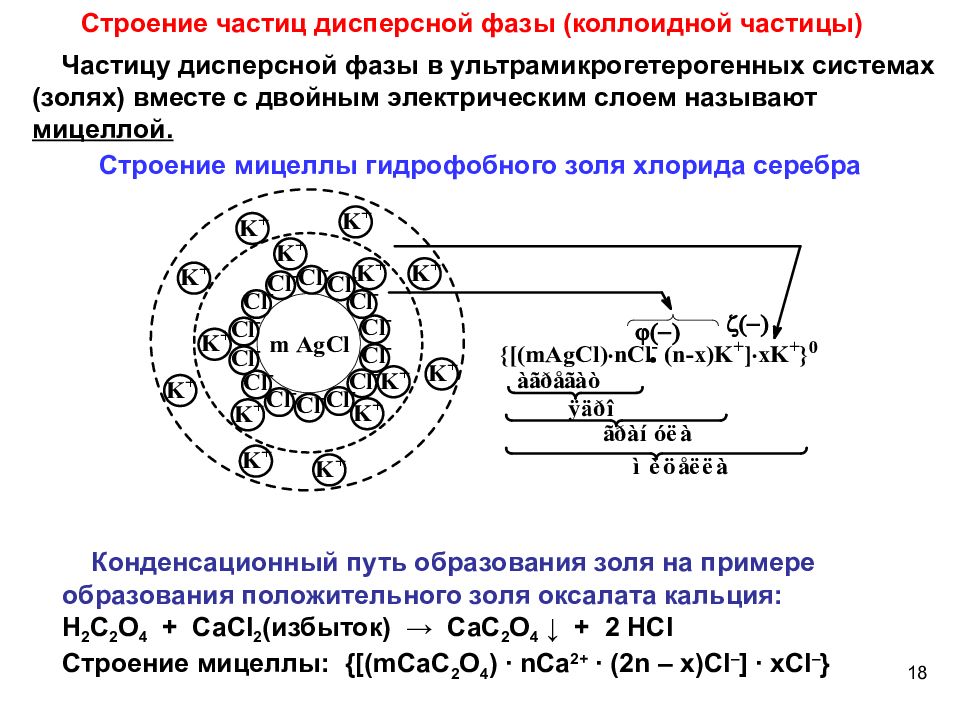
Слайд 18
Строение частиц дисперсной фазы (коллоидной частицы) Частицу дисперсной фазы в ультрамикрогетерогенных системах (золях) вместе с двойным электрическим слоем называют мицеллой. Строение мицеллы гидрофобного золя хлорида серебра Конденсационный путь образования золя на примере образования положительного золя оксалата кальция: H 2 C 2 O 4 + CaCl 2 (избыток) → С aC 2 O 4 ↓ + 2 HCl Строение мицеллы: {[( mCaC 2 O 4 ) ∙ nCa 2+ ∙ (2 n – x ) Cl – ] ∙ xCl – } 18
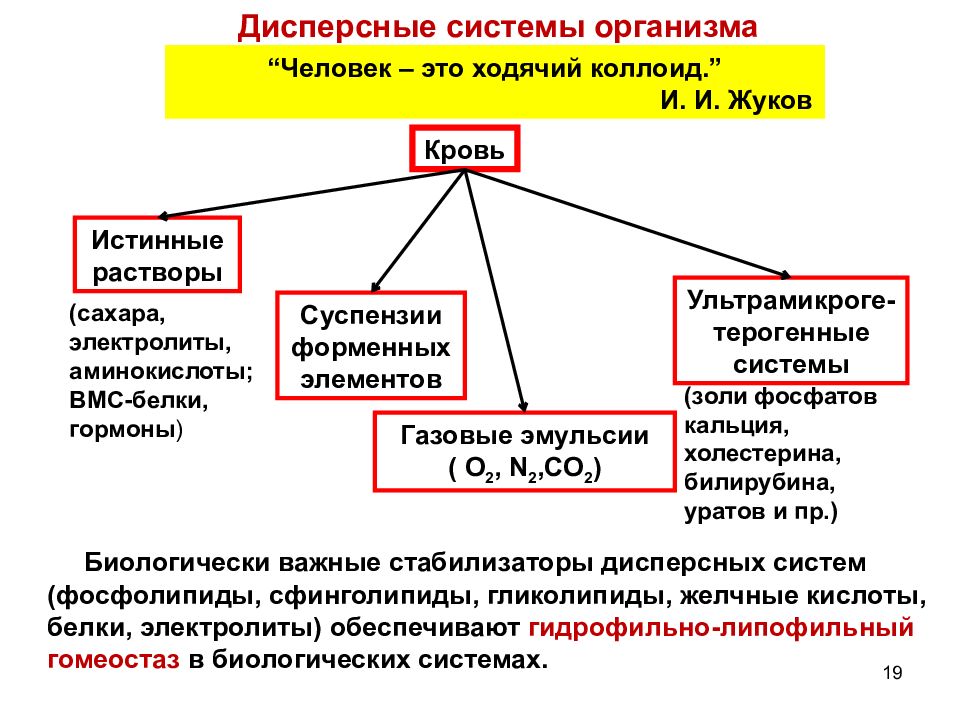
Слайд 19
19 Дисперсные системы организма “ Человек – это ходячий коллоид.” И. И. Жуков Кровь Истинные растворы Ультрамикроге-терогенные системы Суспензии форменных элементов Газовые эмульсии ( О 2, N 2,CO 2 ) (сахара, электролиты, аминокислоты; ВМС-белки, гормоны ) (золи фосфатов кальция, холестерина, билирубина, уратов и пр.) Биологически важные стабилизаторы дисперсных систем (фосфолипиды, сфинголипиды, гликолипиды, желчные кислоты, белки, электролиты) обеспечивают гидрофильно-липофильный гомеостаз в биологических системах.
Слайд 20
Устойчивость коллоидных дисперсных систем Устойчивость коллоидных дисперсных систем — это неизменность во времени их основных характеристик. Седиментационная устойчивость — устойчивость против оседания. Характерна для систем с размером частиц менее 0,1 мкм (золей). Если > 0 — оседание (седиментация); Если < 0 — обратная седиментация (характерна для пен и многих жидких эмульсий). Условие седиментационного равновесия — компенсация седиментационного потока диффузионным потоком. 20
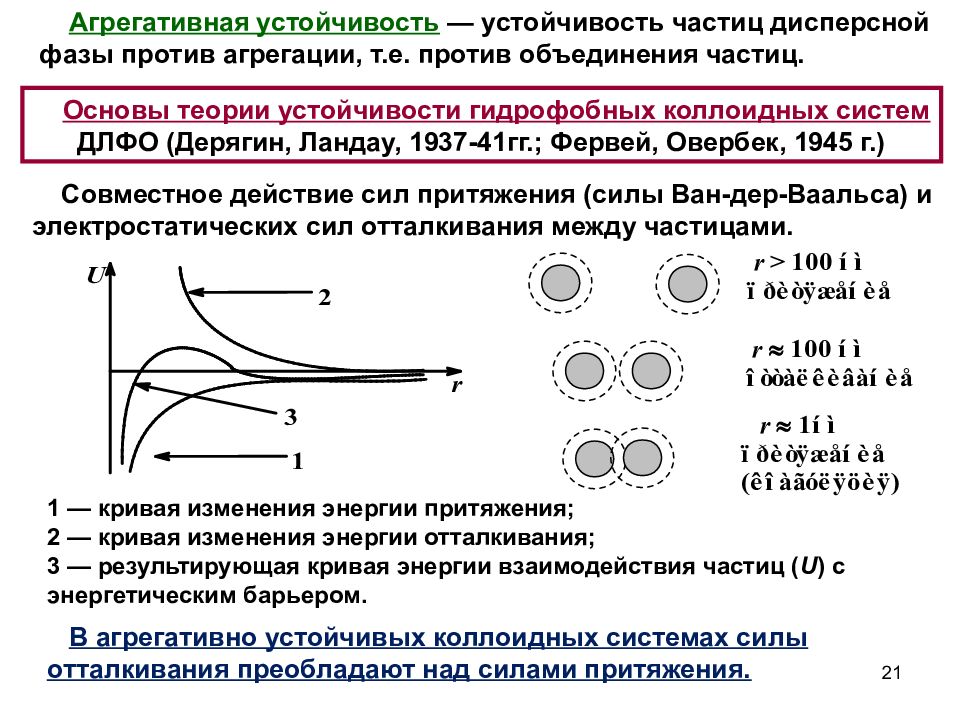
Слайд 21
Агрегативная устойчивость — устойчивость частиц дисперсной фазы против агрегации, т.е. против объединения частиц. Основы теории устойчивости гидрофобных коллоидных систем ДЛФО (Дерягин, Ландау, 1937-41гг.; Фервей, Овербек, 1945 г.) Совместное действие сил притяжения (силы Ван-дер-Ваальса) и электростатических сил отталкивания между частицами. 1 — кривая изменения энергии притяжения; 2 — кривая изменения энергии отталкивания; 3 — результирующая кривая энергии взаимодействия частиц ( U ) с энергетическим барьером. В агрегативно устойчивых коллоидных системах силы отталкивания преобладают над силами притяжения. 21
Слайд 22
Факторы агрегативной устойчивости Термодинамические : а) электростатический фактор — уменьшение и появление электрического потенциала ( -потенциал) вследствие возникновения двойного электрического слоя на поверхности частиц; б) адсорбционно-сольватный фактор — уменьшение при взаимодействии частиц со средой за счет адсорбции неэлектролитов ; в) энтропийный фактор — равномерное распределение частиц дисперсной фазы по всему объему системы приводит увеличению расстояния между частицами и к увеличению энтропии, а, следовательно, к уменьшению энергии Гиббса. Кинетические : а) структурно-механический фактор — на поверхности частиц образуются пленки, обладающие упругостью и механической прочностью; б) гидродинамический фактор — сближение частиц дисперсной фазы затрудняется вследствие увеличения вязкости и плотности прослоек среды между частицами. 22
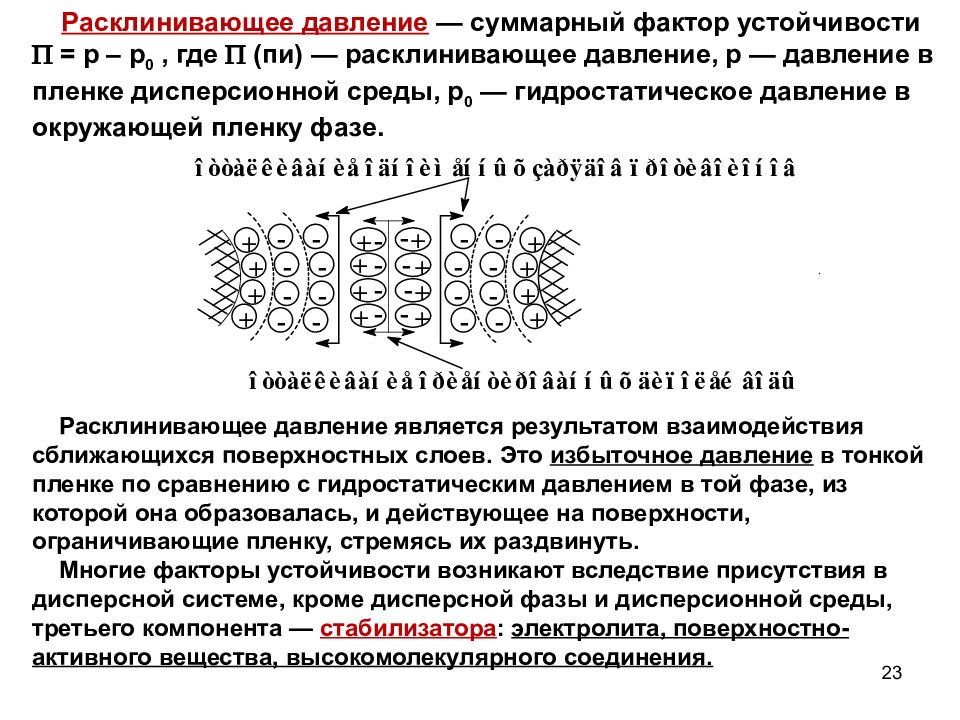
Слайд 23
Расклинивающее давление — суммарный фактор устойчивости = р – р 0, где (пи) — расклинивающее давление, р — давление в пленке дисперсионной среды, р 0 — гидростатическое давление в окружающей пленку фазе. Расклинивающее давление является результатом взаимодействия сближающихся поверхностных слоев. Это избыточное давление в тонкой пленке по сравнению с гидростатическим давлением в той фазе, из которой она образовалась, и действующее на поверхности, ограничивающие пленку, стремясь их раздвинуть. Многие факторы устойчивости возникают вследствие присутствия в дисперсной системе, кроме дисперсной фазы и дисперсионной среды, третьего компонента — стабилизатора : электролита, поверхностно-активного вещества, высокомолекулярного соединения. 23
Слайд 24
Коагуляция коллоидных дисперсных систем Коагуляция наступает вследствие нарушения агрегативной устойчивости, при этом частицы дисперсной фазы объединяются, укрупняются, нарушается седиментационная устойчивость и происходит разделение фаз. Коагуляция может происходить при старении коллоидных систем, при изменении температуры, механических воздействиях, действии света, ультразвука или проникающего излучения, а также под действием электролитов. Механизм электролитной коагуляции а) Нейтрализационная коагуляция вызывается электролитами с многозарядными ионами и неиндифферентными электролитами. Ионы электролитов за счет избирательной адсорбции нейтрализуют -потенциал и -потенциал коллоидных частиц; требуются малые количества электролитов. 24
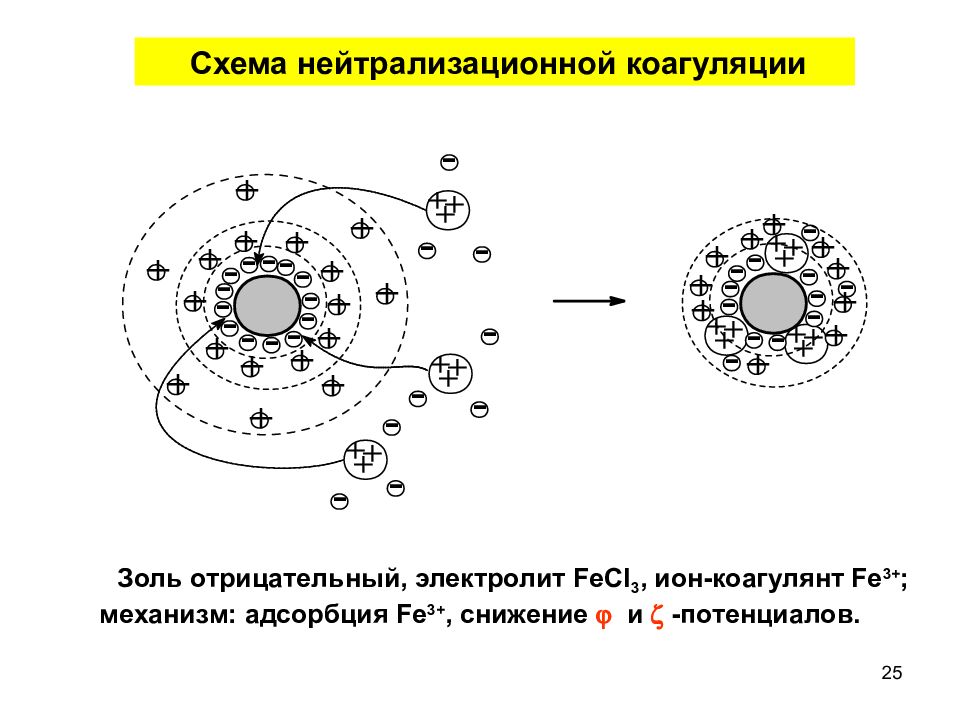
Слайд 25
Схема нейтрализационной коагуляции Золь отрицательный, электролит FeCl 3, ион-коагулянт Fe 3+ ; механизм: адсорбция Fe 3+, снижение и -потенциалов. 25
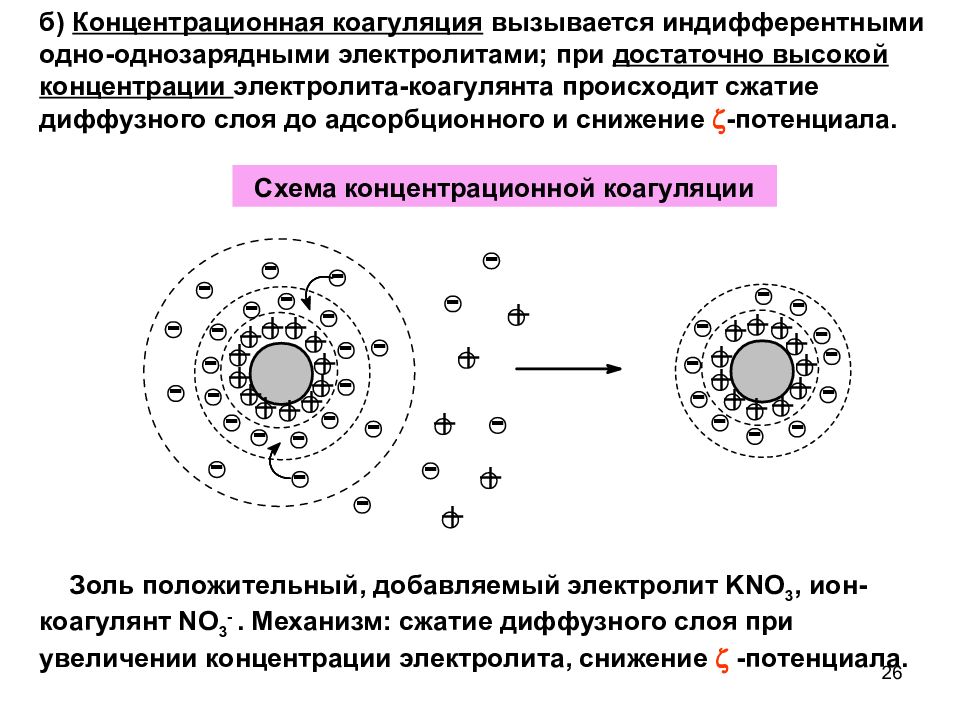
Слайд 26
б) Концентрационная коагуляция вызывается индифферентными одно-однозарядными электролитами; при достаточно высокой концентрации электролита-коагулянта происходит сжатие диффузного слоя до адсорбционного и снижение -потенциала. Золь положительный, добавляемый электролит KNO 3, ион-коагулянт N О 3 -. Механизм: сжатие диффузного слоя при увеличении концентрации электролита, снижение -потенциала. Схема концентрационной коагуляции 26
Слайд 27
График, характеризующий изменение энергетического барьера взаимодействия частиц при введении в коллоидную систему увеличивающихся количеств электролита-коагулянта: 1 — агрегативно устойчивая система; 2 — частично астабилизованная система; 3 — система коагулирует. 27
Слайд 28
Правило Шульце – Гарди : коагуляцию вызывают только те ионы, заряд которых противоположен заряду гранулы; коагулирующая способность ионов-коагулянтов приблизительно пропорциональна шестой степени их заряда. Процесс коагуляции зависит также от: – формы частиц — системы с анизодиаметрическими частицами коагулируют быстрее, чем со сферическими; – полидисперсности — полидисперсные коагулируют быстрее, чем монодисперсные; – концентрации частиц дисперсной фазы — чем выше концентрация, тем быстрее идет коагуляция; – температуры — при повышении температуры коагуляция усиливается: – концентрации электролита-коагулянта — увеличение концентрации усиливает коагуляцию. 28
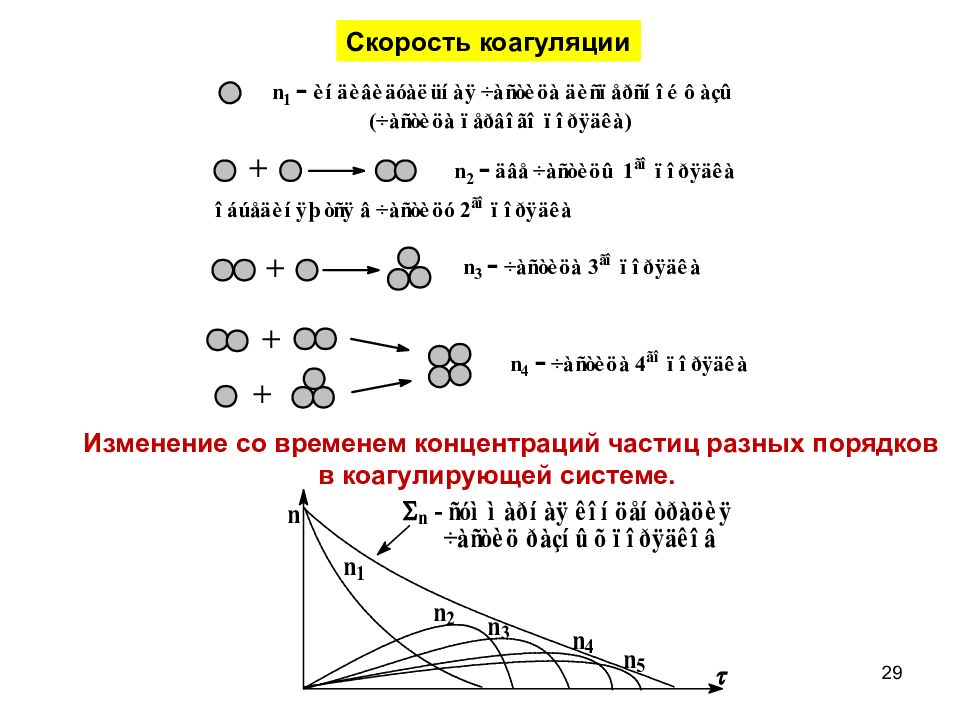
Слайд 29
Скорость коагуляции Изменение со временем концентраций частиц разных порядков в коагулирующей системе. 29
Слайд 30
Каждый элементарный акт коагуляции — объединение двух частиц одинаковых или разных порядков (бимолекулярный простой процесс). 30 Уравнение Смолуховского
Слайд 31
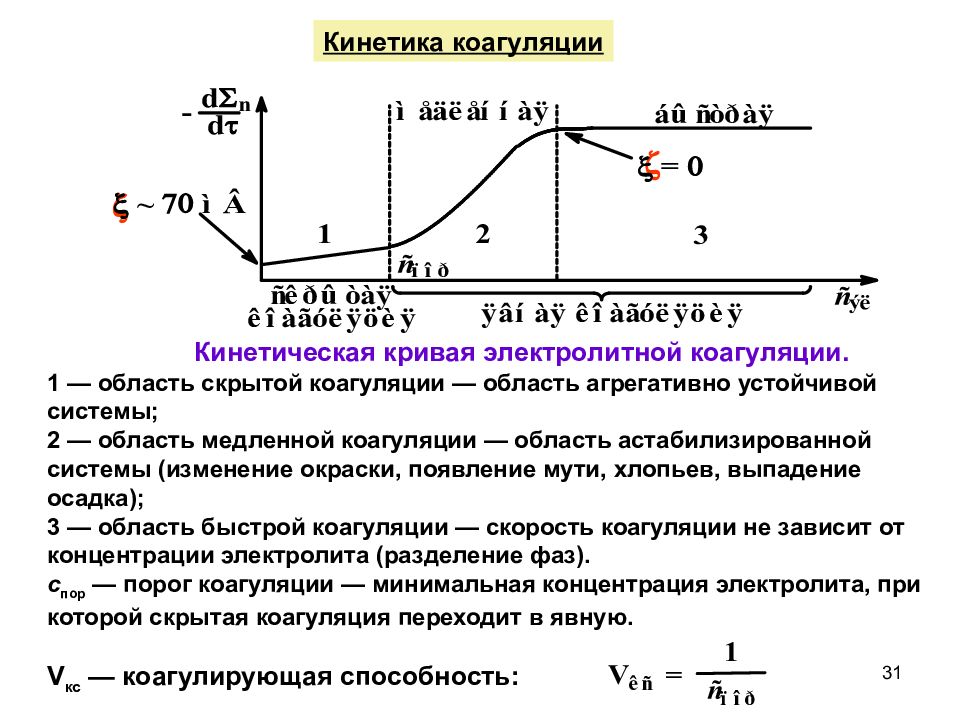
Кинетика коагуляции Кинетическая кривая электролитной коагуляции. 1 — область скрытой коагуляции — область агрегативно устойчивой системы; 2 — область медленной коагуляции — область астабилизированной системы (изменение окраски, появление мути, хлопьев, выпадение осадка); 3 — область быстрой коагуляции — скорость коагуляции не зависит от концентрации электролита (разделение фаз). с пор — порог коагуляции — минимальная концентрация электролита, при которой скрытая коагуляция переходит в явную. V кс — коагулирующая способность: 31
Слайд 32
Лиотропные ряды Гофмейстера Коагулирующая способность ионов с одинаковым зарядом возрастает с уменьшением их степени гидратации: 32
Слайд 33
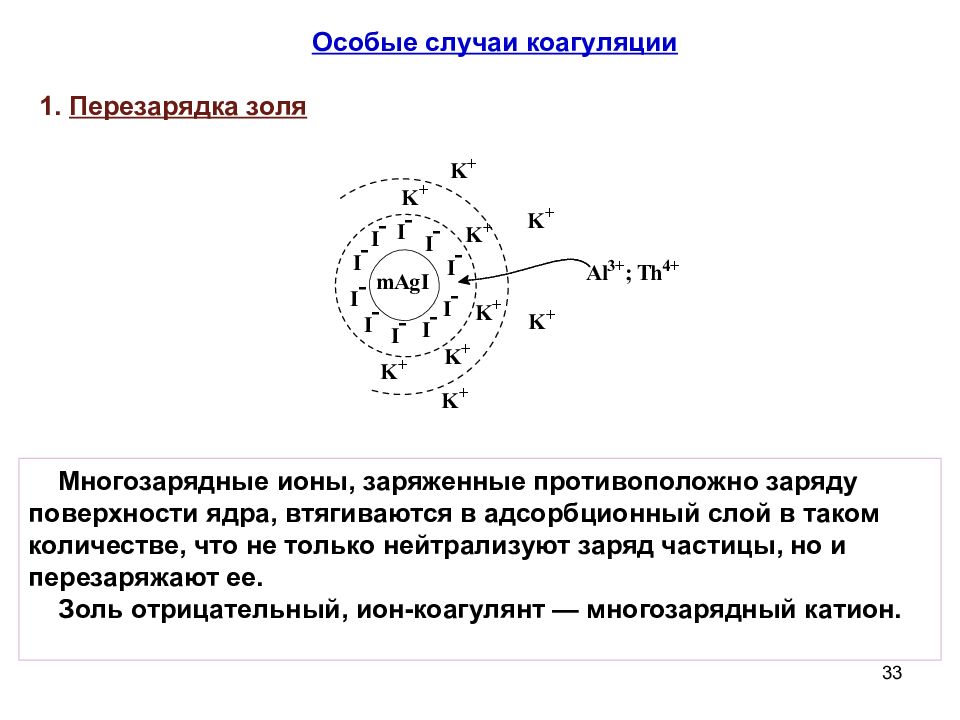
Особые случаи коагуляции 1. Перезарядка золя Многозарядные ионы, заряженные противоположно заряду поверхности ядра, втягиваются в адсорбционный слой в таком количестве, что не только нейтрализуют заряд частицы, но и перезаряжают ее. Золь отрицательный, ион-коагулянт — многозарядный катион. 33
Слайд 34
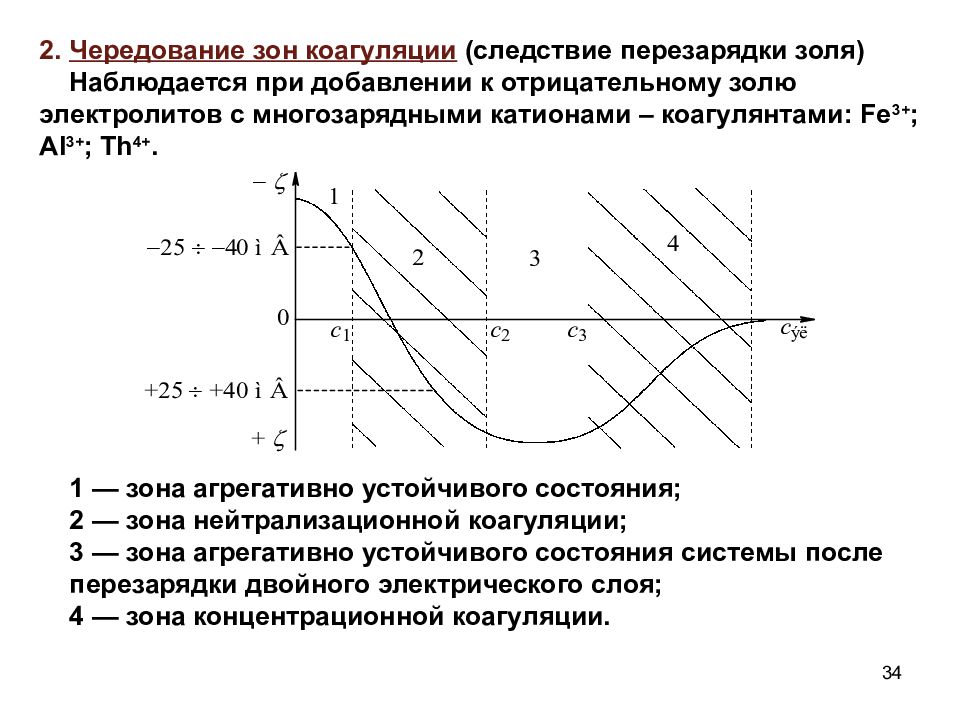
2. Чередование зон коагуляции (следствие перезарядки золя) Наблюдается при добавлении к отрицательному золю электролитов с многозарядными катионами – коагулянтами: Fe 3+ ; А l 3+ ; Th 4+. 1 — зона агрегативно устойчивого состояния; 2 — зона нейтрализационной коагуляции; 3 — зона агрегативно устойчивого состояния системы после перезарядки двойного электрического слоя; 4 — зона концентрационной коагуляции. 34
Слайд 35
3. Действие смесей электролитов 4. Взаимная коагуляция (гетерокоагуляция) Наблюдается при смешивании разнородных дисперсных систем. 1 — аддитивность (суммирование) коагулирующего действия электролитов; 2 — синергизм (взаимное усиление) коагулирующего действия электролитов; 3 — антагонизм (взаимное ослабление) коагулирующего действия электролитов. 35
Слайд 36
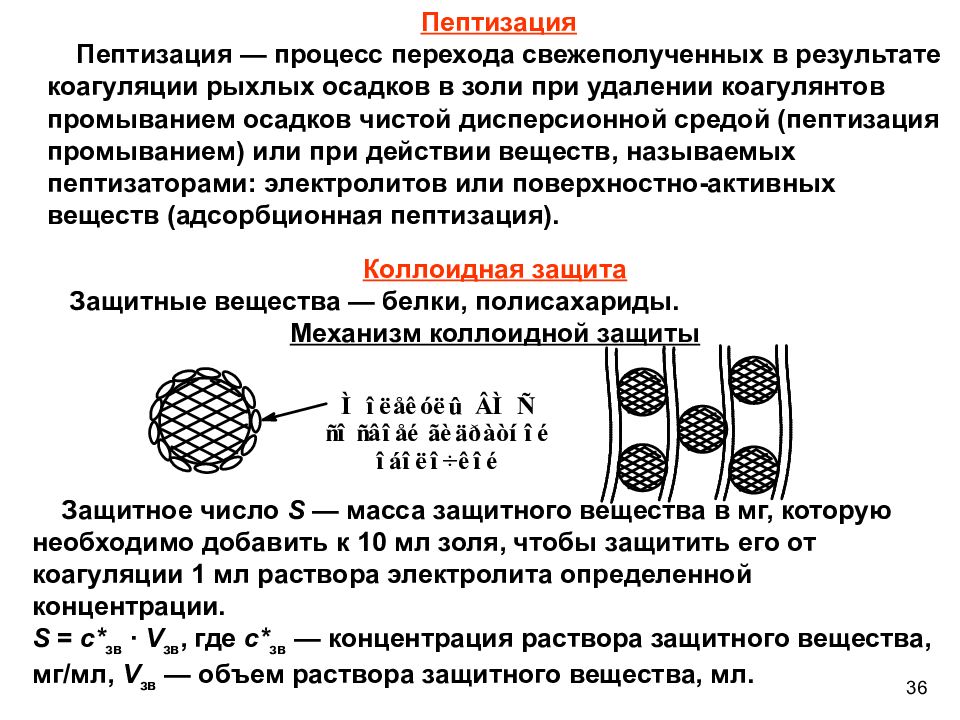
Коллоидная защита Защитные вещества — белки, полисахариды. Механизм коллоидной защиты Защитное число S — масса защитного вещества в мг, которую необходимо добавить к 10 мл золя, чтобы защитить его от коагуляции 1 мл раствора электролита определенной концентрации. S = с* зв ∙ V зв, где с* зв — концентрация раствора защитного вещества, мг/мл, V зв — объем раствора защитного вещества, мл. Пептизация Пептизация — процесс перехода свежеполученных в результате коагуляции рыхлых осадков в золи при удалении коагулянтов промыванием осадков чистой дисперсионной средой (пептизация промыванием) или при действии веществ, называемых пептизаторами: электролитов или поверхностно-активных веществ (адсорбционная пептизация). 36
Последний слайд презентации: Лекция 2
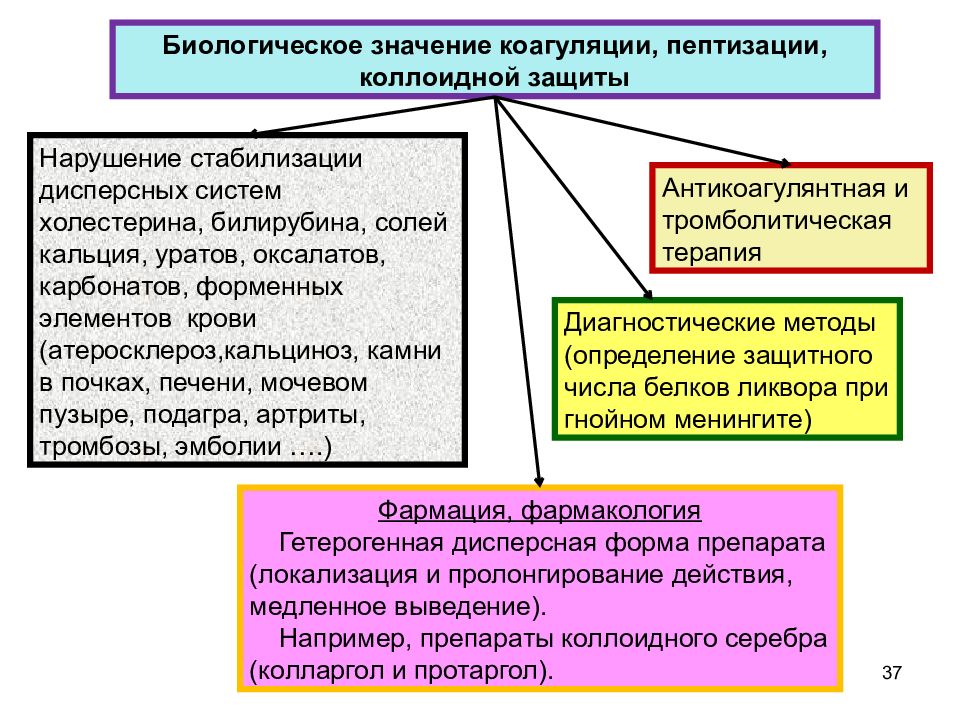
37 Биологическое значение коагуляции, пептизации, коллоидной защиты Антикоагулянтная и тромболитическая терапия Нарушение стабилизации дисперсных систем холестерина, билирубина, солей кальция, уратов, оксалатов, карбонатов, форменных элементов крови (атеросклероз,кальциноз, камни в почках, печени, мочевом пузыре, подагра, артриты, тромбозы, эмболии ….) Диагностические методы (определение защитного числа белков ликвора при гнойном менингите) Фармация, фармакология Гетерогенная дисперсная форма препарата (локализация и пролонгирование действия, медленное выведение). Например, препараты коллоидного серебра (колларгол и протаргол).