Первый слайд презентации: Гидролиз солей
КГБПОУ «Красноярский индустриально-металлургический техникум» Всё познаётся в сравнении. Преподаватель дисциплин естественнонаучного цикла высшей категории, Зыкова Анжелика Вячеславовна.
Слайд 2: Цели урока:
Ознакомиться с понятием гидролиза солей. Рассмотреть типы гидролиза. Научиться составлять ионные уравнения гидролиза солей. Научиться определять тип гидролиза соли по её формуле.
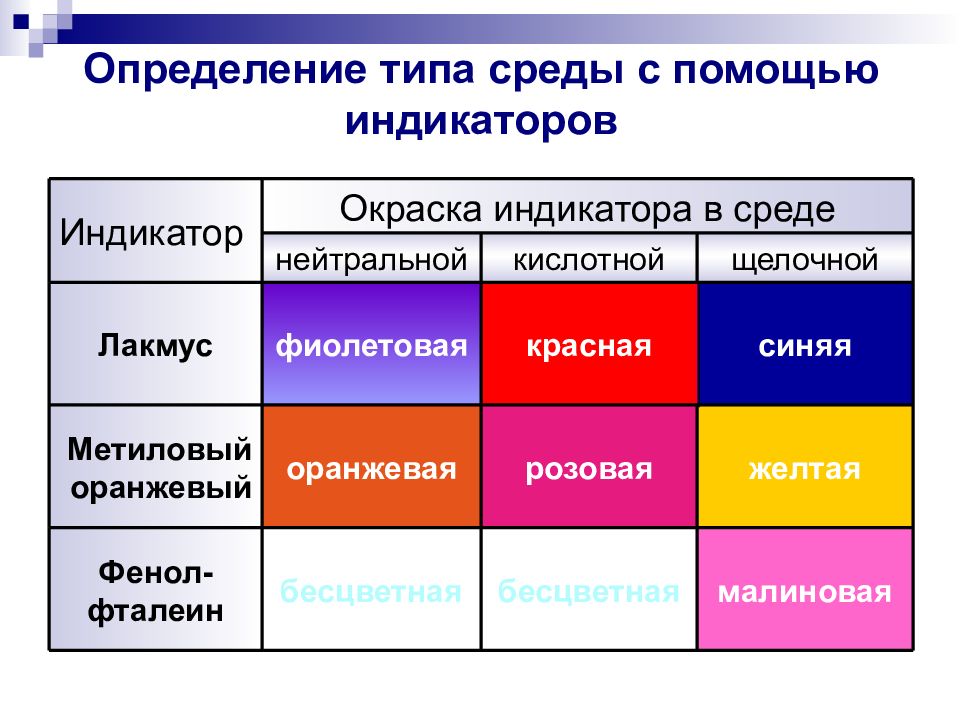
синяя красная фиолетовая Лакмус малиновая бесцветная бесцветная Фенол- фталеин желтая розовая оранжевая Метиловый оранжевый щелочной кислотной нейтральной Окраска индикатора в среде Индикатор
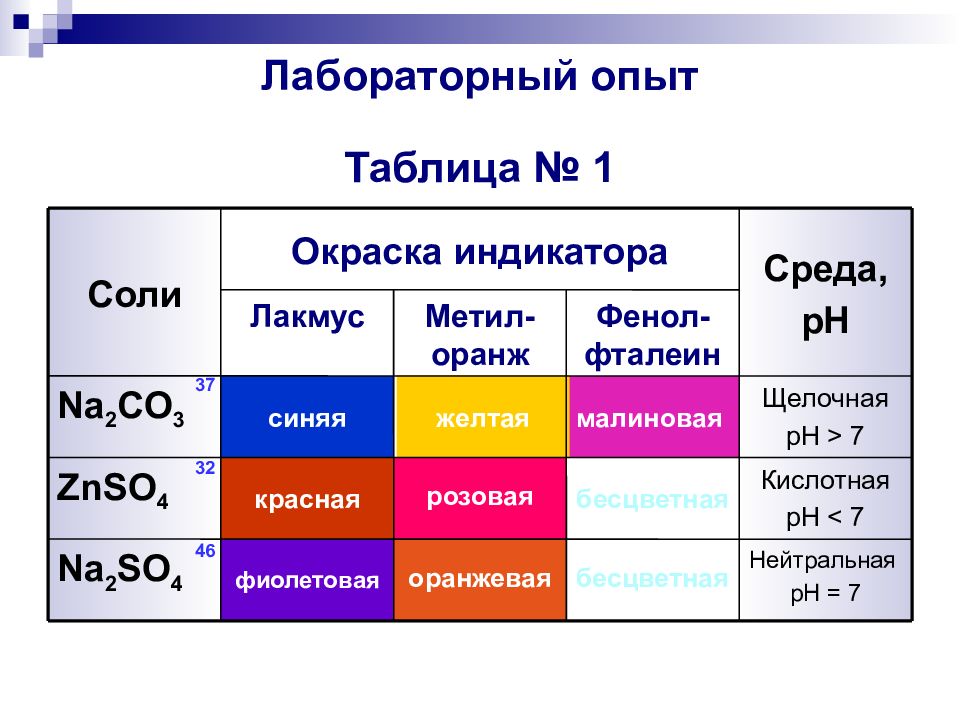
Слайд 6: Лабораторный опыт Таблица № 1
Нейтральная pH = 7 бесцветная оранжевая фиолетовая Na 2 SO 4 Кислотная pH < 7 бесцветная розовая красная ZnSO 4 Щелочная pH > 7 малиновая желтая синяя Na 2 CO 3 Фенол-фталеин Метил-оранж Лакмус Среда, pH Окраска индикатора Соли 37 32 46
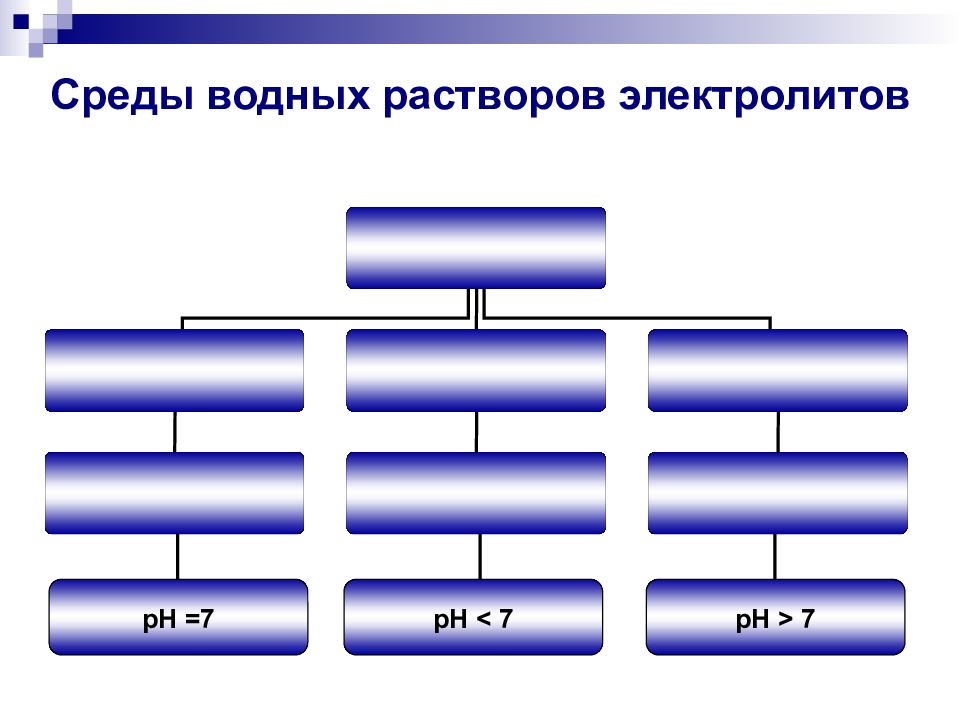
Слайд 7: Что такое гидролиз?
Гидролиз ( от греческого hydro – вода ; lysis – разложение )
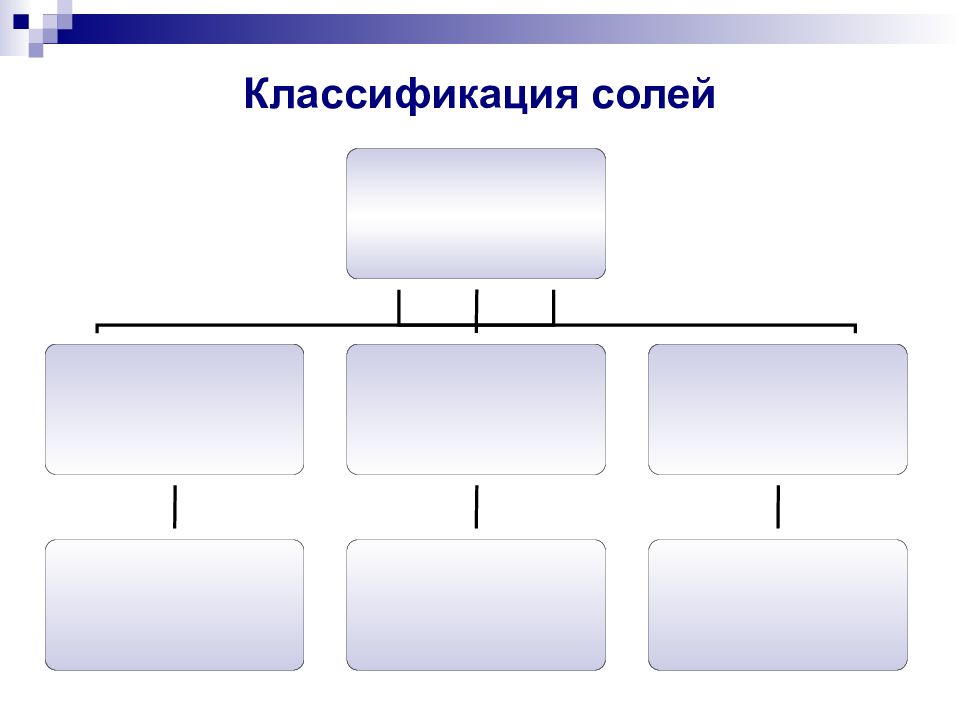
Слайд 8: Классификация солей
сильным основанием и слабой кислотой слабым основанием и сильной кислотой сильным основанием и сильной кислотой
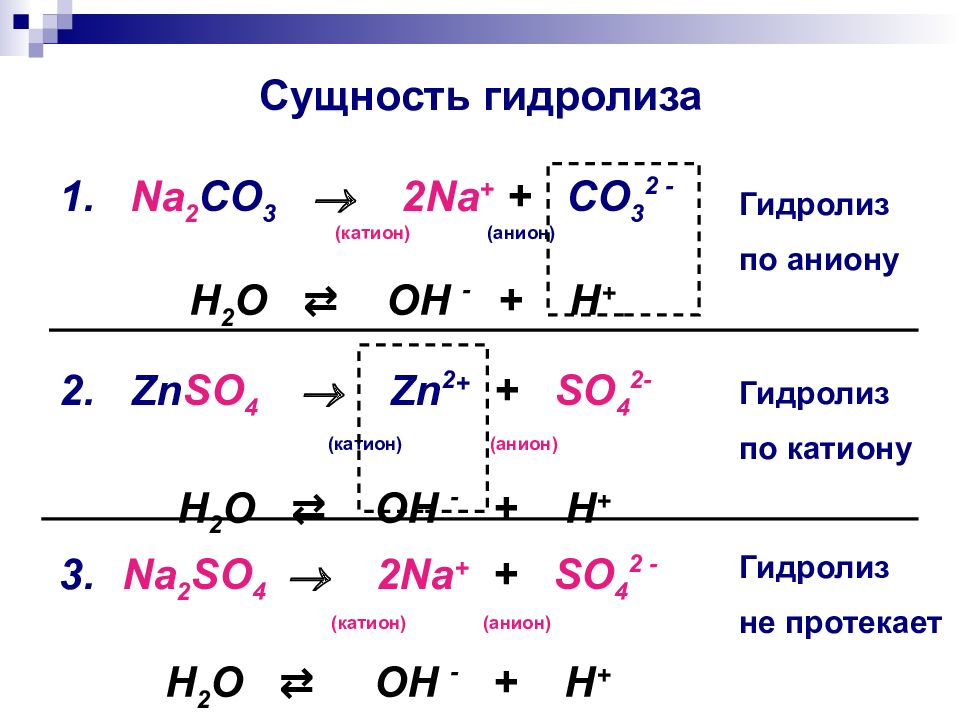
Слайд 9: Сущность гидролиза
1. Na 2 CO 3 2Na + + CO 3 2 - ( катион) (анион) H 2 O ⇄ OH - + H + 2. Zn SO 4 Zn 2 + + SO 4 2 - ( катион) (анион) H 2 O ⇄ OH - + H + 3. Na 2 SO 4 2Na + + SO 4 2 - ( катион) (анион) H 2 O ⇄ OH - + H + Гидролиз по аниону Гидролиз по катиону Гидролиз не протекает
Слайд 10: Определение гидролиза
Гидролиз соли – это химическая реакция обмена соли с водой, в результате которой ионы слабого электролита, входящие в состав соли, соединяются с составными частями воды : H + и OH -.
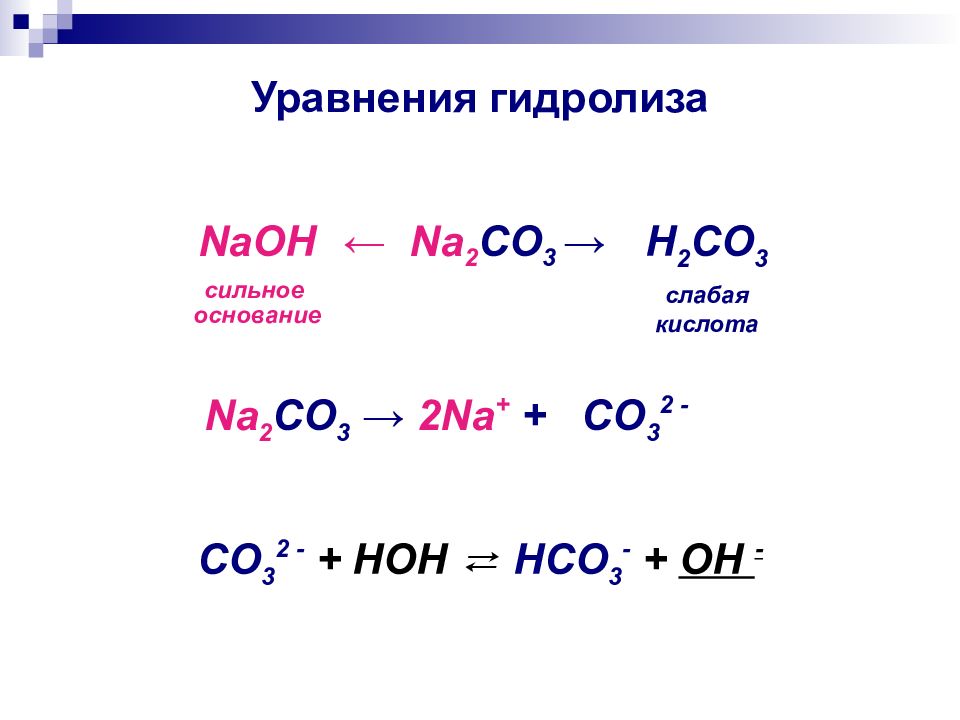
Слайд 11: Уравнения гидролиза
← Na 2 CO 3 → NaOH сильное основание H 2 CO 3 слабая кислота Na 2 CO 3 → 2Na + + CO 3 2 - CO 3 2 - + HOH ⇄ HCO 3 - + OH -
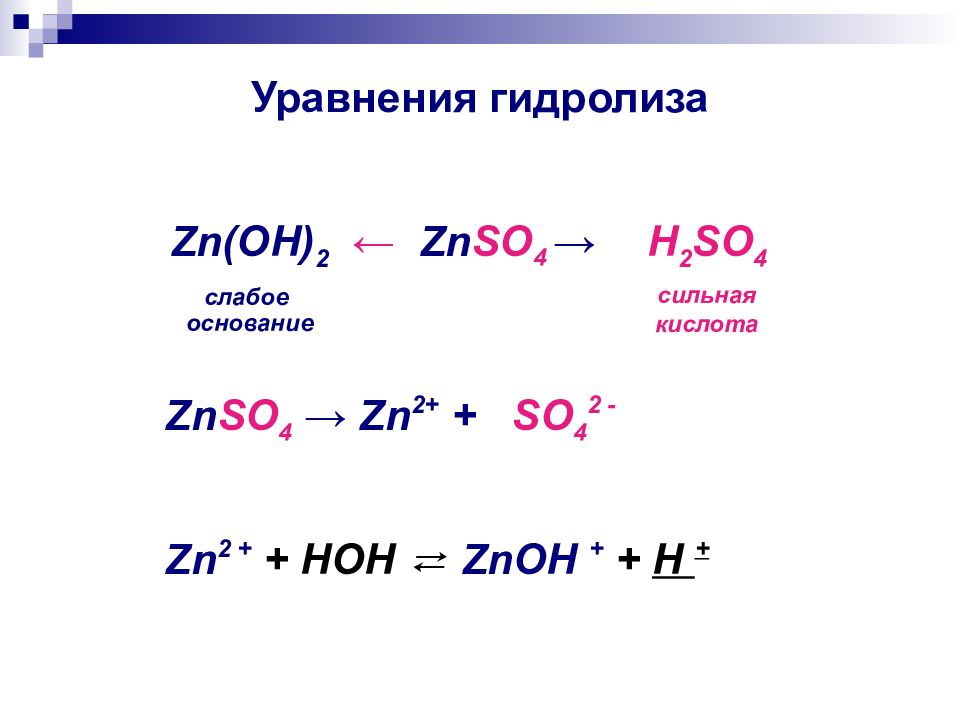
Слайд 12: Уравнения гидролиза
← Zn S O 4 → Zn (ОН) 2 слабое основание H 2 SO 4 сильная кислота Zn SO 4 → Zn 2+ + SO 4 2 - Zn 2 + + HOH ⇄ ZnOH + + H +
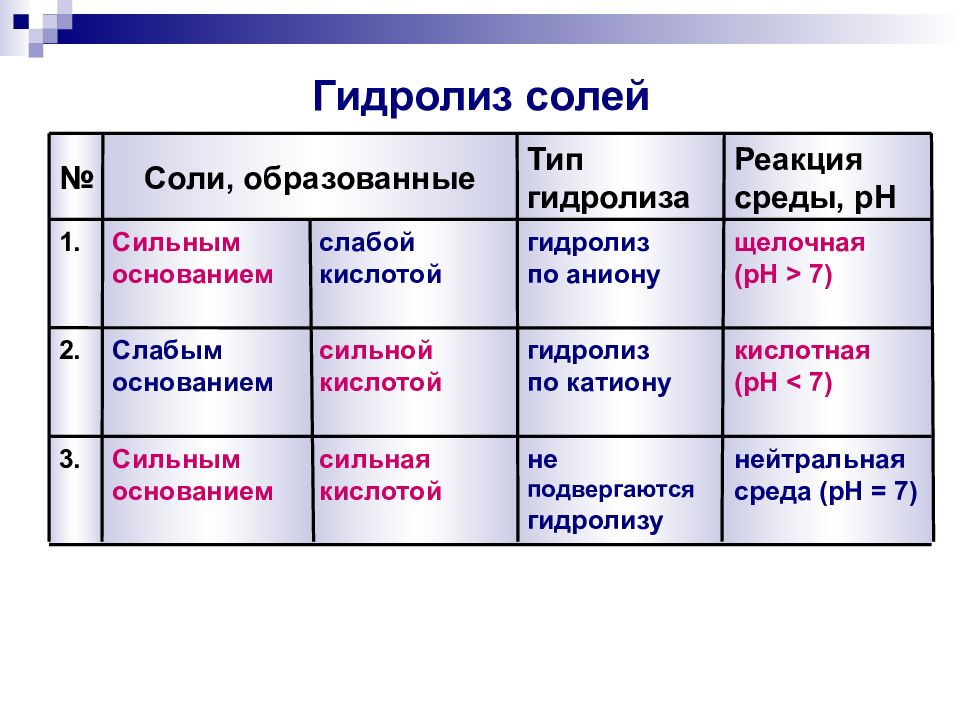
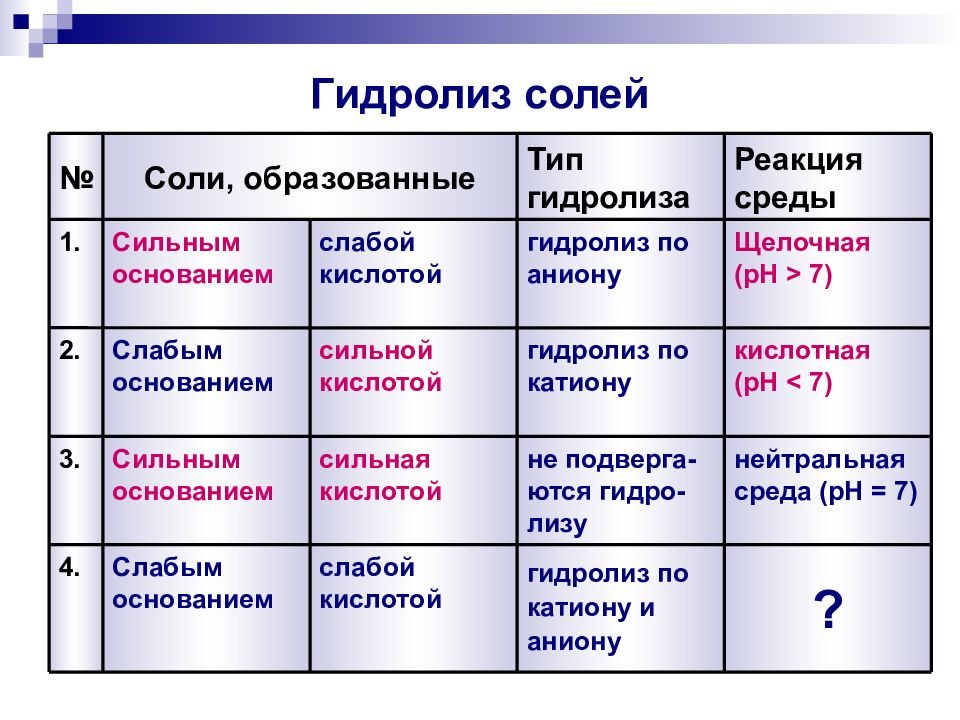
Слайд 13: Гидролиз солей
3. 2. 1. № Реакция среды, pH Тип гидролиза Соли, образованные нейтральная среда ( pH = 7) не подвергаются гидролизу сильная кислотой Сильным основанием кислотная ( pH < 7) гидролиз по катиону сильной кислотой Слабым основанием щелочная ( pH > 7) гидролиз по аниону слабой кислотой Сильным основанием
Слайд 14: Задание. Определите реакцию среды водных растворов солей. Таблица № 2
NaNO 3 K 2 S Na 2 SiO 3 5. NH 4 NO 3 LiNO 3 NaClO 4 4. KMnO 4 KI K 3 PO 4 3. Na 2 SO 3 FeCl 3 CuSO 4 2. KCl NaNO 2 Li 2 SO 4 1. III ряд II ряд I ряд № Н К Щ Н Щ Щ Н Н К Щ Н Щ Н К Н н -нейтральная; к – кислотная; щ - щелочная
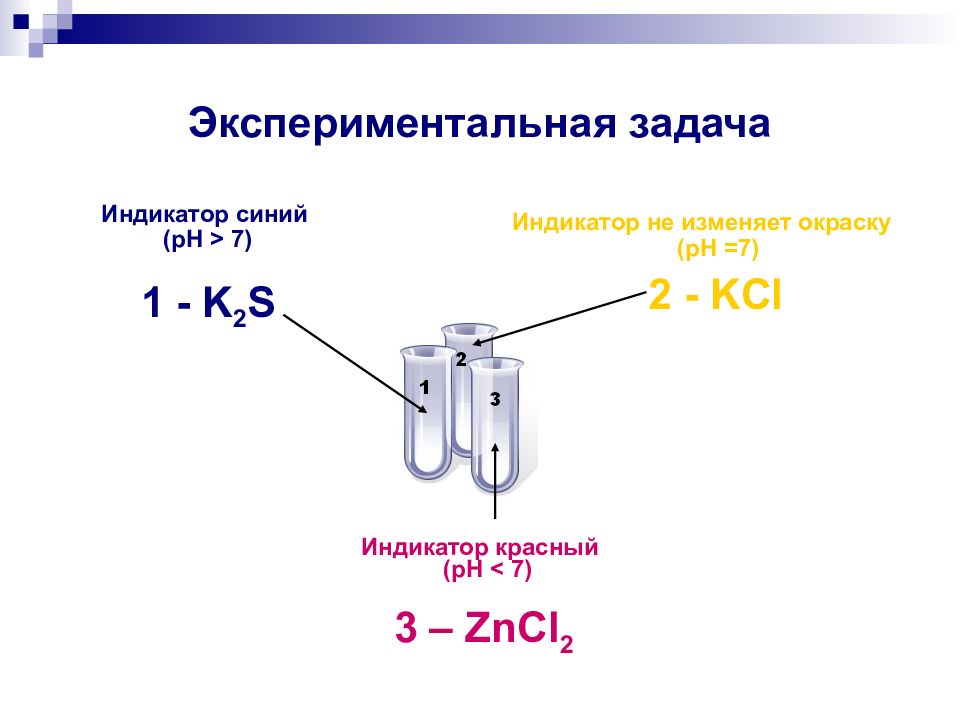
Слайд 15: Экспериментальная задача
В трех пронумерованных пробирках даны растворы солей : ZnCl 2, K 2 S, KCl. а) Исследуйте каждый из них универсальной индикаторной бумагой; б) распознайте данные вещества; в) укажите тип гидролиза; г) напишите ионные уравнения гидролиза.
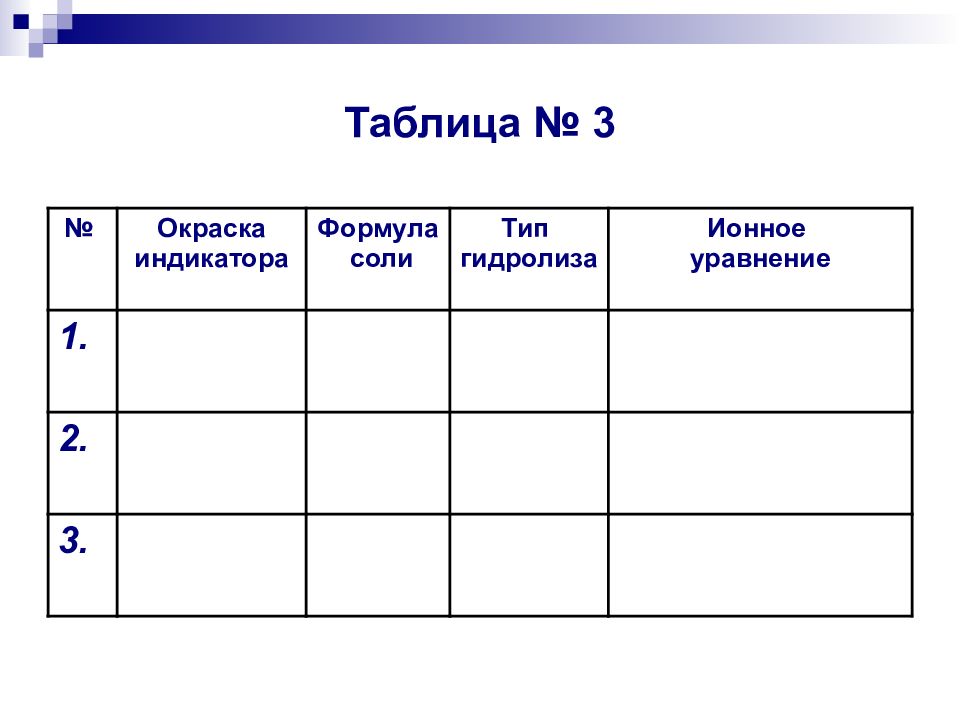
Слайд 16: Таблица № 3
№ Окраска индикатора Формула соли Тип гидролиза Ионное уравнение 1. 2. 3.
Слайд 17: Экспериментальная задача
Индикатор синий ( pH > 7) 1 - K 2 S Индикатор не изменяет окраску ( pH =7) 2 - KCl Индикатор красный ( pH < 7) 3 – ZnCl 2
Слайд 18: Гидролиз солей
4. 3. 2. 1. № Реакция среды Тип гидролиза Соли, образованные ? гидролиз по катиону и аниону слабой кислотой Слабым основанием нейтральная среда ( pH = 7) не подверга-ются гидро-лизу сильная кислотой Сильным основанием кислотная ( pH < 7) гидролиз по катиону сильной кислотой Слабым основанием Щелочная ( pH > 7) гидролиз по аниону слабой кислотой Сильным основанием