Первый слайд презентации
Капиллярный электрофорез и электрохроматография Аналитический Центр химического факультета МГУ Москва, Ленинские горы, ГСП-1. 939-35-14
Слайд 2: История и этапы развития метода
Электрофорез – движение заряженных частиц растворе под действием электрического поля История: Начало 19-го века – открытие электрофореза 1937 – Нобелевская премия (Тизелиус) 1981-1983 – первые аналитические приборы капиллярного электрофореза (Джоргенсон, Лукас) 1990-2003 Расшифровка генома человека
Слайд 3
Электрофоретическая подвижность = электрофоретическая подвижность q = заряд частицы = вязкость раствора r = радиус частицы ( см 2 В -1 сек -1 )
Слайд 4
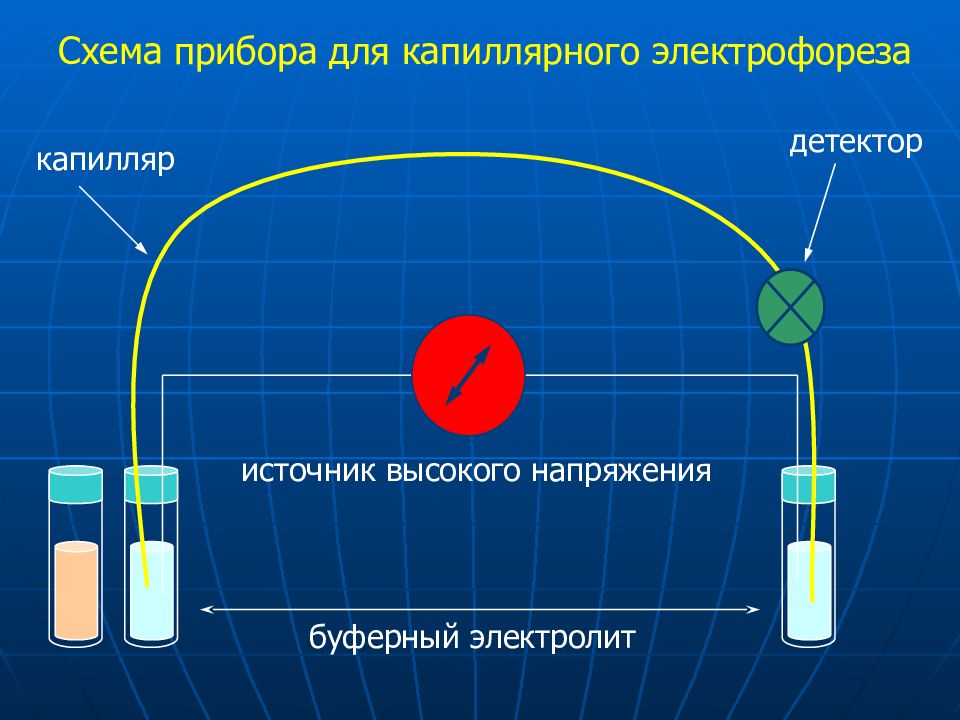
Схема прибора для капиллярного электрофореза буферный электролит капилляр источник высокого напряжения детектор
Слайд 5: Скорость миграции по капилляру
Скорость миграции : Где : v = скорость миграции ион а в элект р ическом поле ( см сек -1 ) ep = электрофоретическая подвижность ( см 2 В -1 сек -1 ) E = напряженность поля ( В см -1 ) V = приложенное напряжение ( В ) L = длина капилляра ( см )
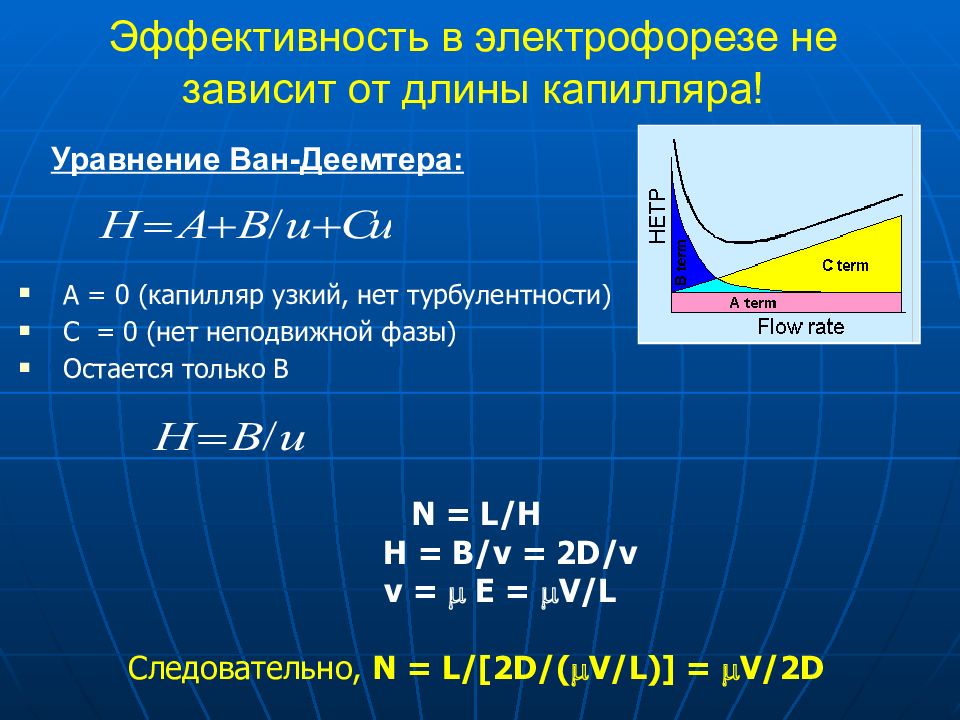
Уравнение Ван-Деемтера : A = 0 (капилляр узкий, нет турбулентности) C = 0 ( нет неподвижной фазы ) O стается только B N = L/H H = B/v = 2D/v v = E = V/L Следовательно, N = L/[2D/(V/L)] = V/2D
Слайд 7: Строение капилляра
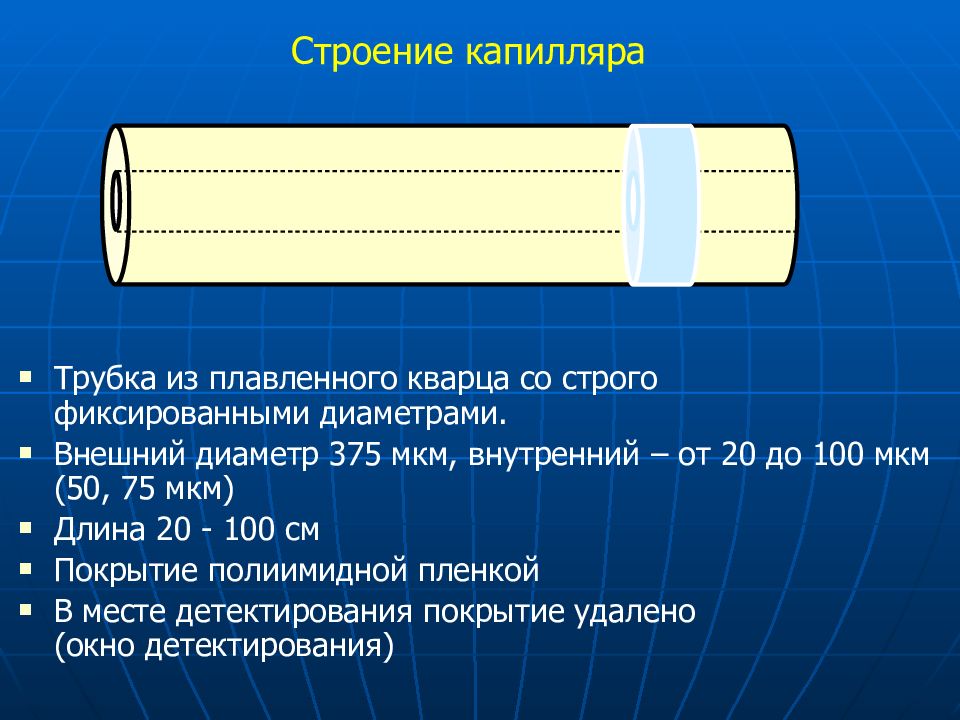
Трубка из плавленного кварца со строго фиксированными диаметрами. Внешний диаметр 375 мкм, внутренний – от 20 до 1 00 мкм (50, 75 мкм) Длина 20 - 100 см Покрытие полиимидной пленкой В месте детектирования покрытие удалено (окно детектирования)
Слайд 8
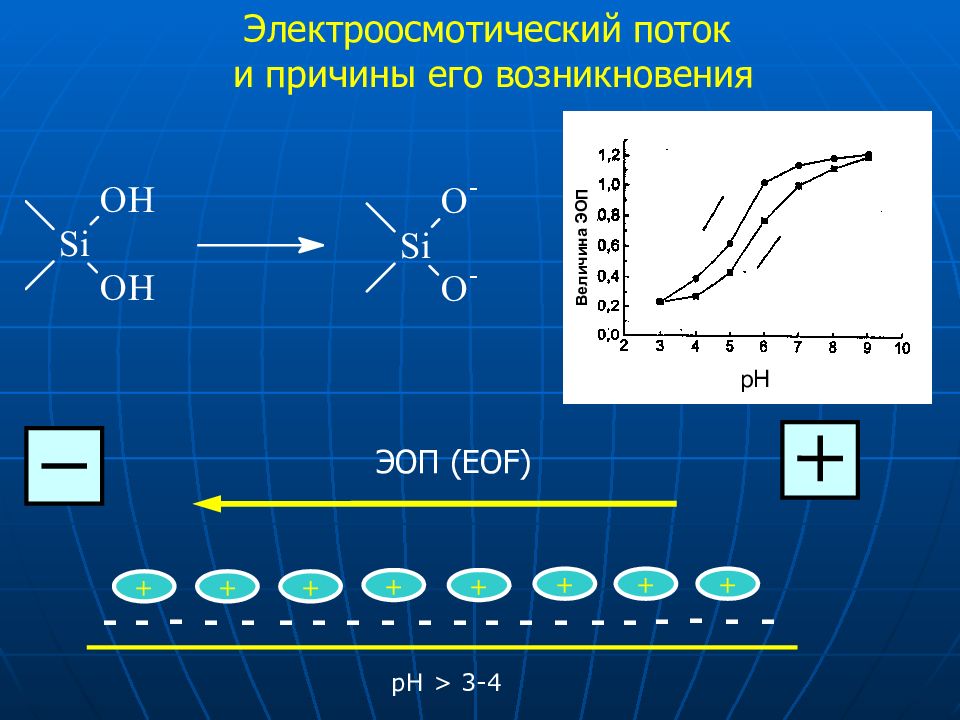
Электроосмотический поток и причины его возникновения - - - - - - - - - - - - - - - - - - - - рН > 3 -4 + + + + + + + + ЭОП ( EOF) pH Величина ЭОП
Слайд 9
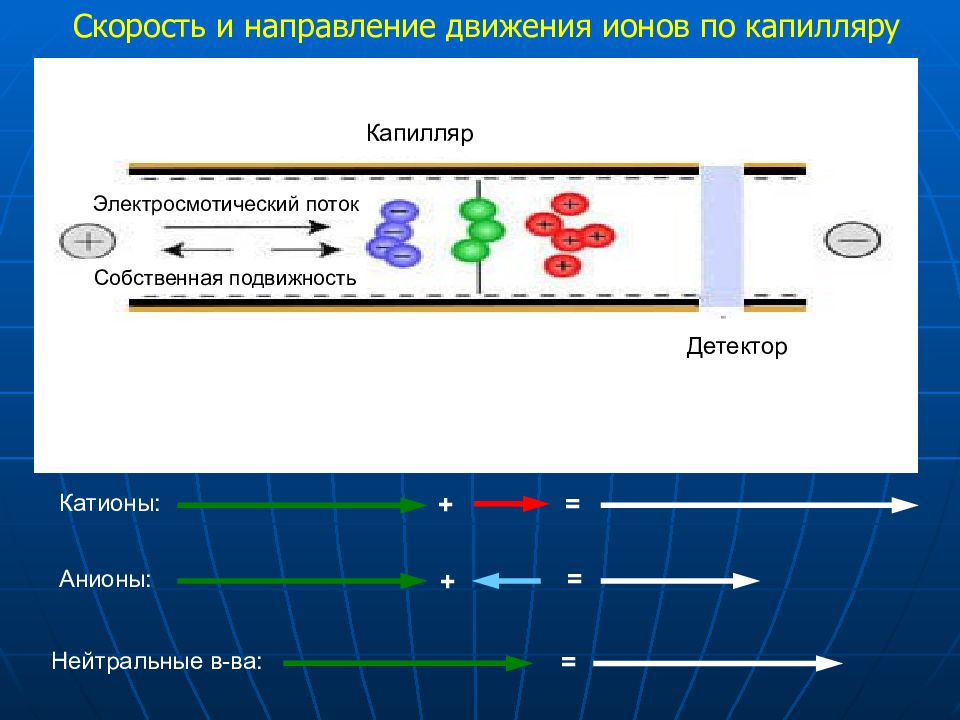
Детектор Капилляр Электросмотический поток Собственная подвижность Катионы: + = Анионы: + = Нейтральные в-ва: = Скорость и направление движения ионов по капилляру
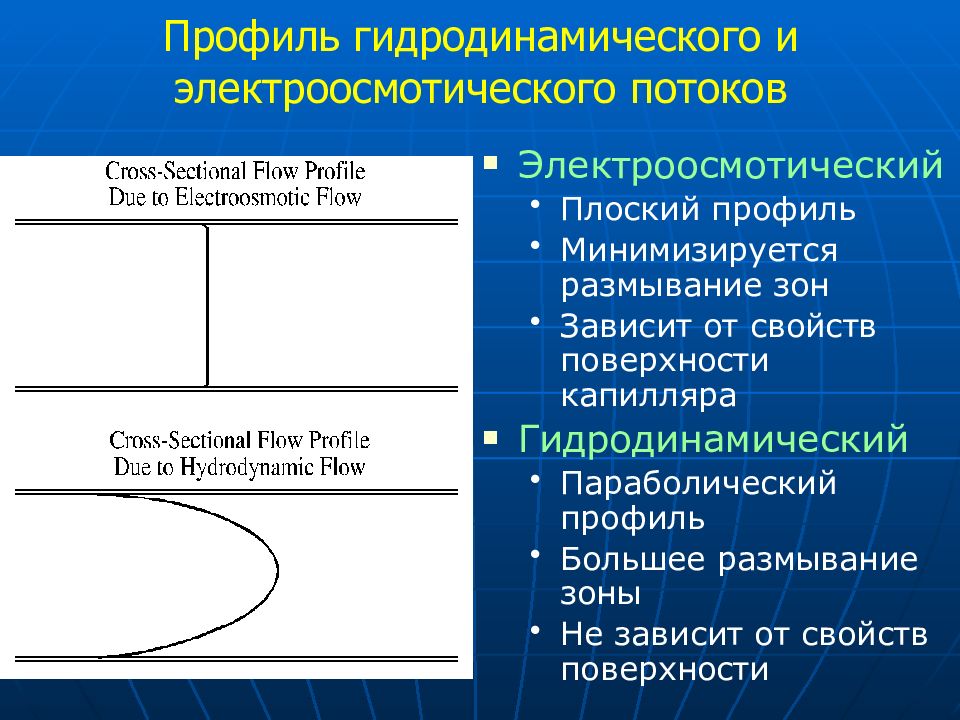
Электроосмотический Плоский профиль Минимизируется размывание зон Зависит от свойств поверхности капилляра Гидродинамический Параболический профиль Большее размывание зоны Не зависит от свойств поверхности
Слайд 11: Выделение тепла капилляром
Капилляр работает как сопротивление Чем больше ток, тем больше выделение тепла Зависимость силы тока от напряжения нелинейна Чем меньше диаметр капилляра, тем меньше ток Чем концентрация буферного электролита, тем меньше ток Желателен ток до <60 м A ( < 1 W)
Слайд 12: Ввод пробы в капилляр
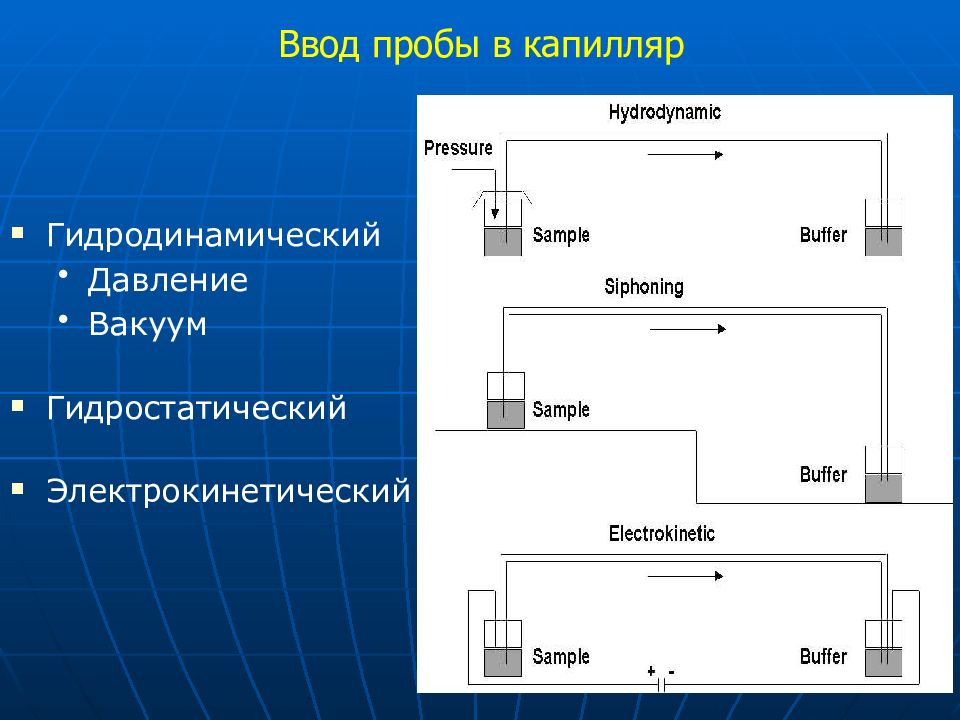
Гидродинамический Давление Вакуум Гидростатический Электрокинетический
Слайд 13: Детектирование в капиллярном электрофорезе
Капилляр имеет малый объем, следовательно объем вводимой пробы очень мал (нанолитры) Специальные приемы по минимизации мертвого объема Должна быть решена проблема высокого напряжения при анализе Обычно используемые детекторы UV/Vis – наиболее распространен LIF (laser-induced fluorescence) - наиболее чувствителен Mass spectrometry – наиболее перспективен Бесконтактная кондуктометрия
Слайд 14: Пределы обнаружения
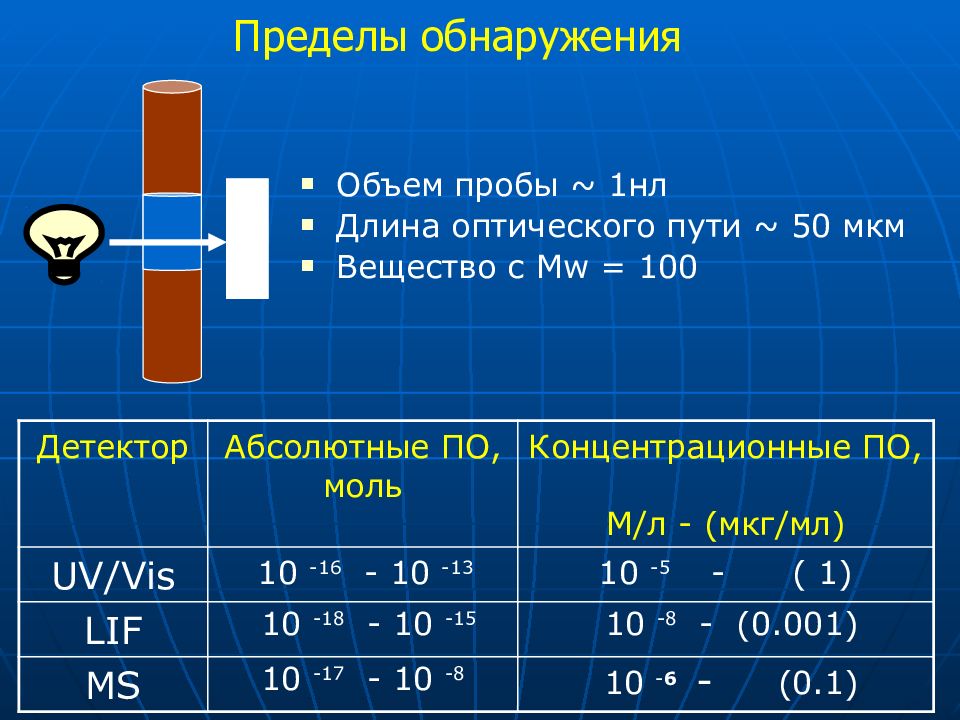
Объем пробы ~ 1 нл Длина оптического пути ~ 50 мкм Вещество с Mw = 100 Детектор Абсолютные ПО, моль Концентрационные ПО, М / л - (мкг / мл) UV/Vis 10 -16 - 10 -13 10 - 5 - ( 1) LIF 10 - 18 - 10 -1 5 10 - 8 - ( 0.001) MS 10 -17 - 10 -8 10 - 6 - (0.1)
Слайд 15: Оптимизация в капиллярном электрофорезе
pH Первое, что надо варьировать Влияет на ЭОП и подвижность (заряд) Органический растворитель Сольватация веществ Концентрация и природа добавок образование мицелл, ионных пар и т.п. Неводный электрофорез Сольватация, заряд (но проблемы с током !) Температура, напряжение Сольватация, хим. равновесие, подвижность
Слайд 16: Достоинства капиллярного электрофореза
Очень высокая эффективность (до 6 млн. тт) Требуемый объем пробы (1-10 мкл ) Быстрое разделение (1 - 30 мин ) Предсказуемая селективность Автоматизация «Ненужные» компоненты матрицы пробы можно легко удалить из капилляра промывкой Капилляр легко заменить Совместимость с масс-селективным детектором
Слайд 17: Недостатки капиллярного электрофореза
Часто недостаточная чувствительность Хуже воспроизводимость по сравнению с хроматографией Сложно контролировать величину ЭОП Свойства капилляров могут меняться от партии к партии Узкий динамический диапазон (1 порядок концентраций) Образование пузырьков газа в капилляре Форма пиков часто несимметрична
Слайд 18: Основные виды электрофореза
Кап и ллярный зонный электрофорез ( CZE ) Мице л лярная электрокинетическая хроматография ( MEKC ) Микроэмульсионная электрокинетическая хроматография ( MEEKC ) Капиллярная электрохроматография с заполненными капиллярами ( CEC ) Капиллярный гель-электрофорез ( CGE ) Изотахофорез ( ITP) Капиллярная изоэлектрическая фокусировка ( CIEF) Основные виды электрофореза
Слайд 21
Разделяются ТОЛЬКО заряженные соединения. Направления движения катионов и анио н ов различны. Подвижности ионов отличаются в зависимости от отношения их заряда к размеру, что обу с ловливает разделение. Общая подвижность зависит от направления и величины ЭОП Механизм разделения в капиллярном зонном электрофорезе
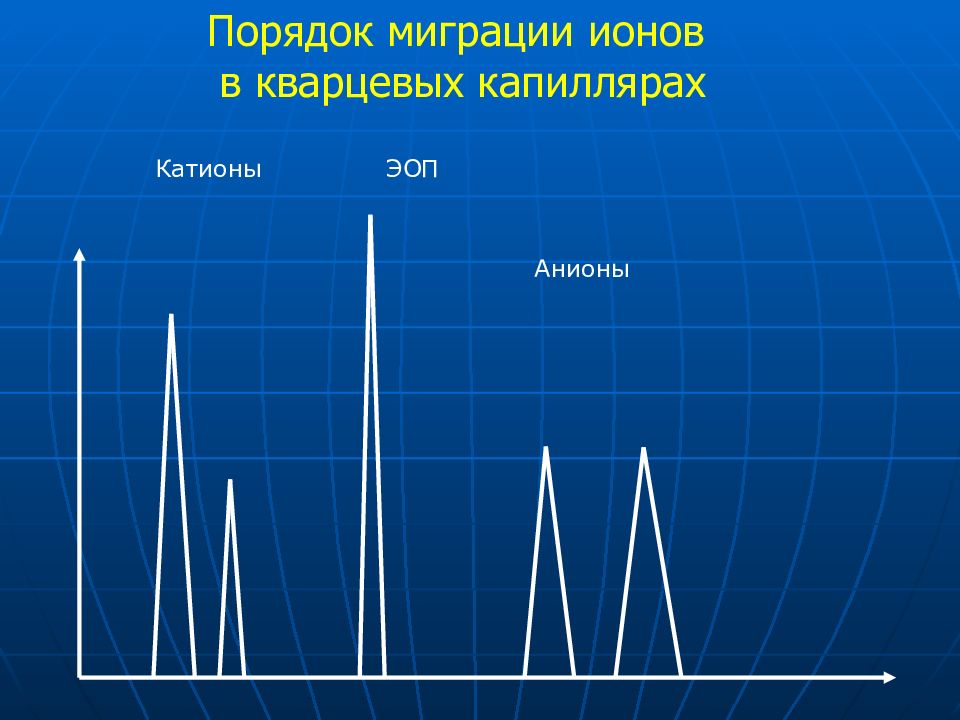
Слайд 22: Порядок миграции ионов в кварцевых капиллярах
Катионы ЭОП Анионы Порядок миграции ионов в кварцевых капиллярах
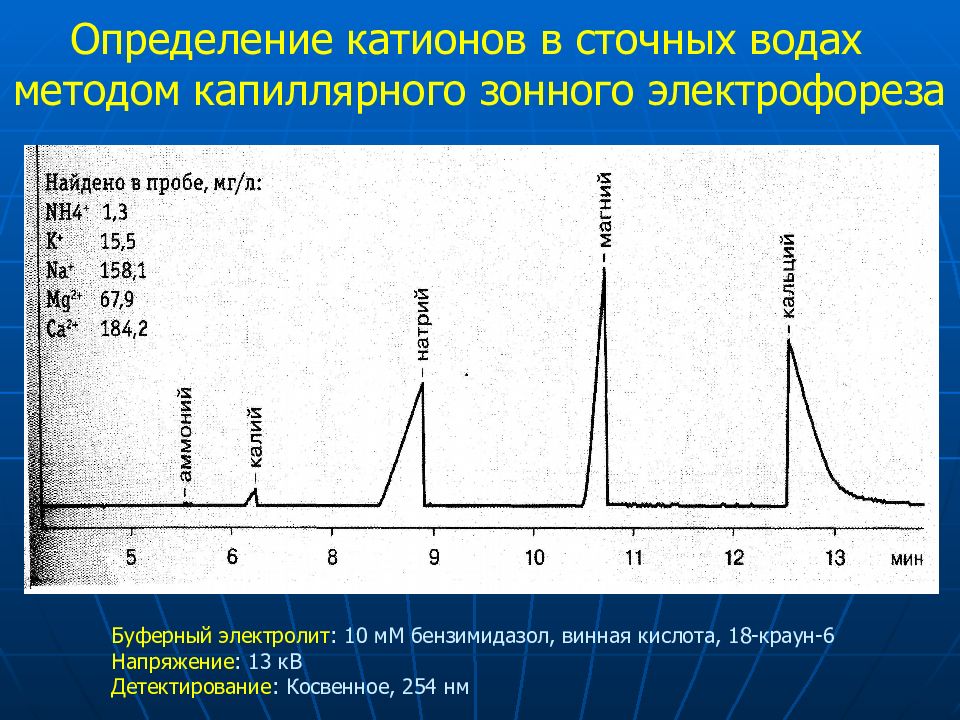
Слайд 23
Определение катионов в сточных водах методом капиллярного зонного электрофореза Буферный электролит : 10 мМ бензимидазол, винная кислота, 18-краун-6 Напряжение : 13 кВ Детектирование : Косвенное, 254 нм
Слайд 24
Хорошие начальные условия для КЗЭ : Капилляр : 75 мкм внутренний диаметр, 60 см длина Электролит : Фосфатный или боратный буферный раствор с концентрацией около 50 мМ Напряжение : +/- 20 kV ( так, чтобы ток не более 100 µA)
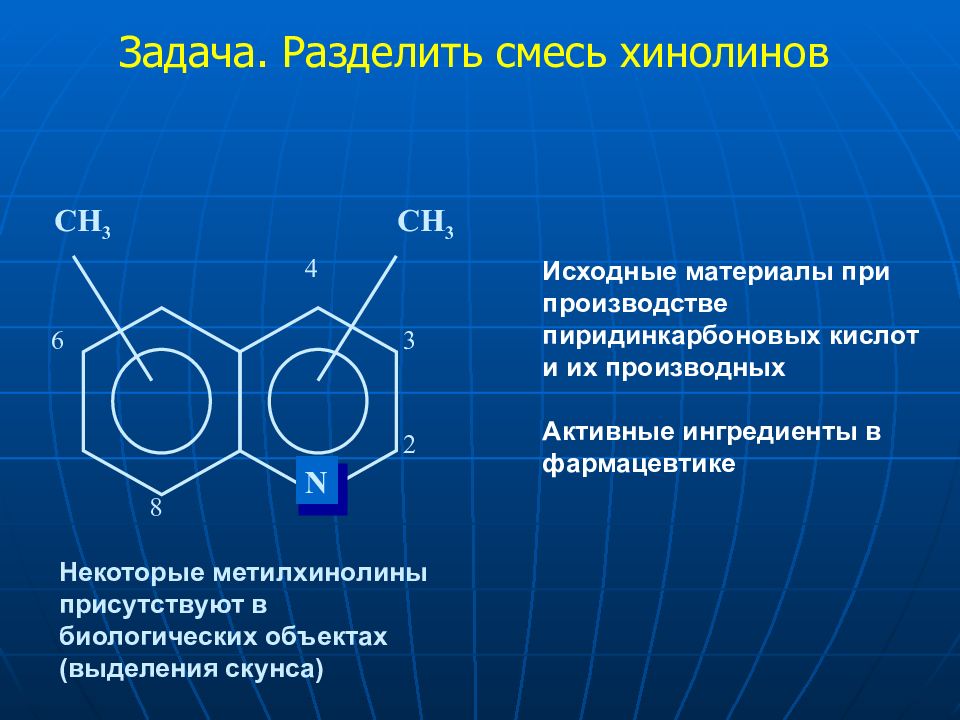
Слайд 25
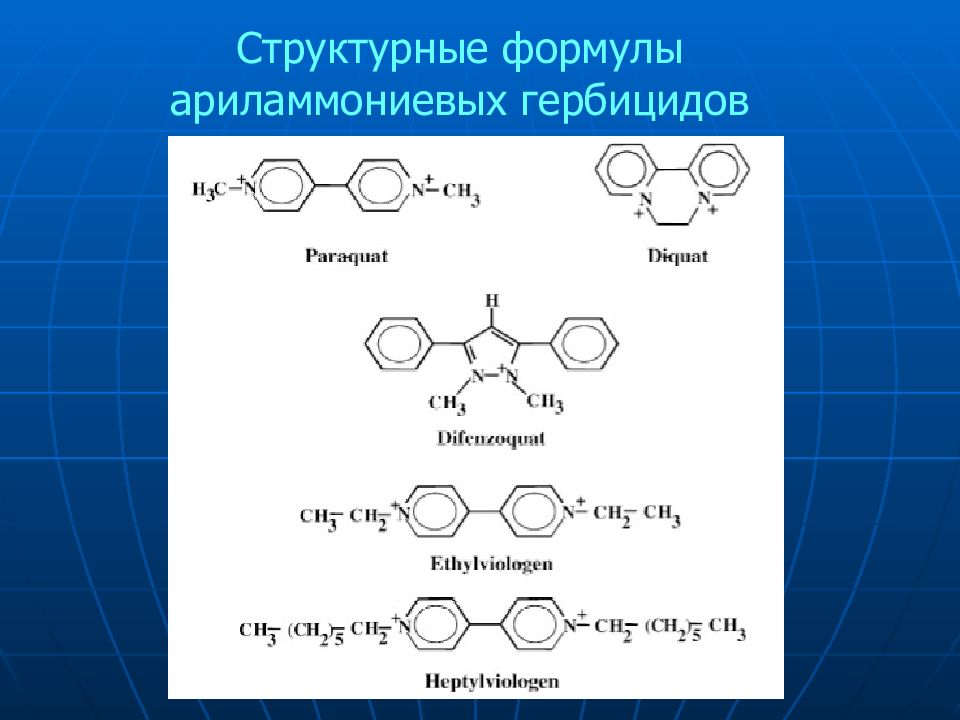
Задача. Разделить смесь хинолинов Исходные материалы при производстве пиридинкарбоновых кислот и их производных Активные ингредиенты в фармацевтике Некоторые метилхинолины присутствуют в биологических объектах (выделения скунса) N CH 3 CH 3 2 3 4 6 8
Слайд 26
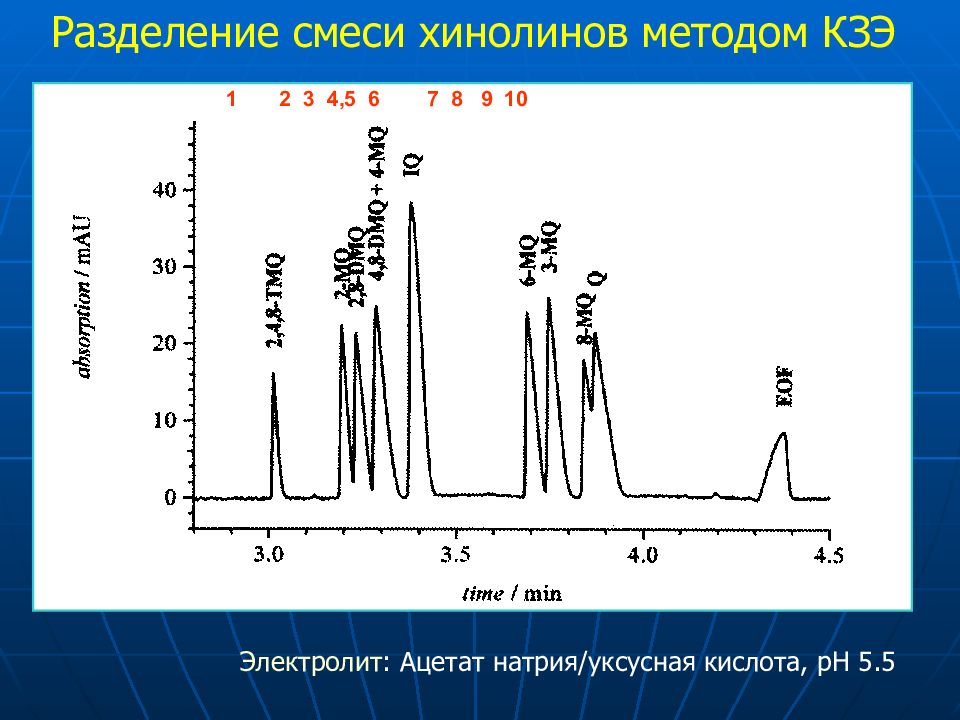
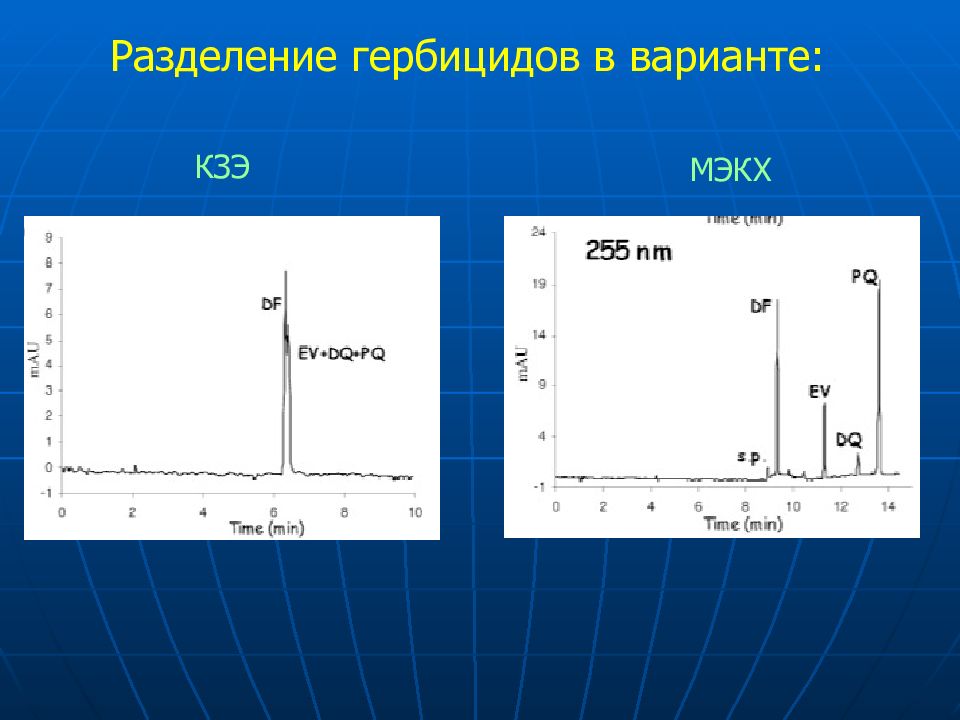
Разделение смеси хинолинов методом КЗЭ Электролит : Ацетат натрия / уксусная кислота, pH 5.5 1 2 3 4,5 6 7 8 9 10
Слайд 27
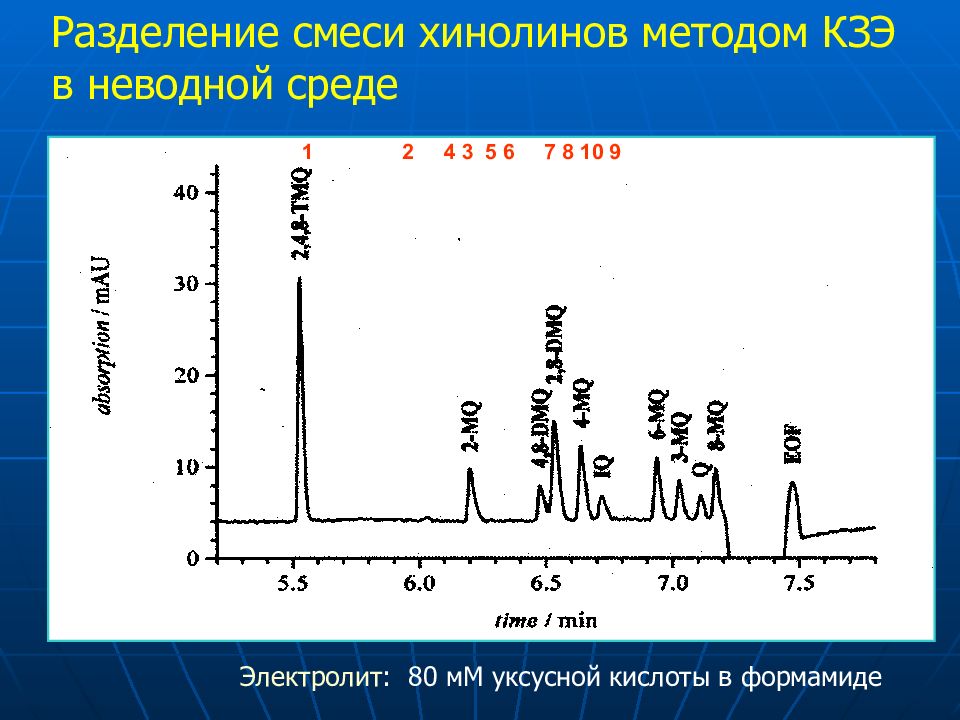
1 2 4 3 5 6 7 8 10 9 Разделение смеси хинолинов методом КЗЭ в неводной среде Электролит : 80 мМ уксусной кислоты в формамиде
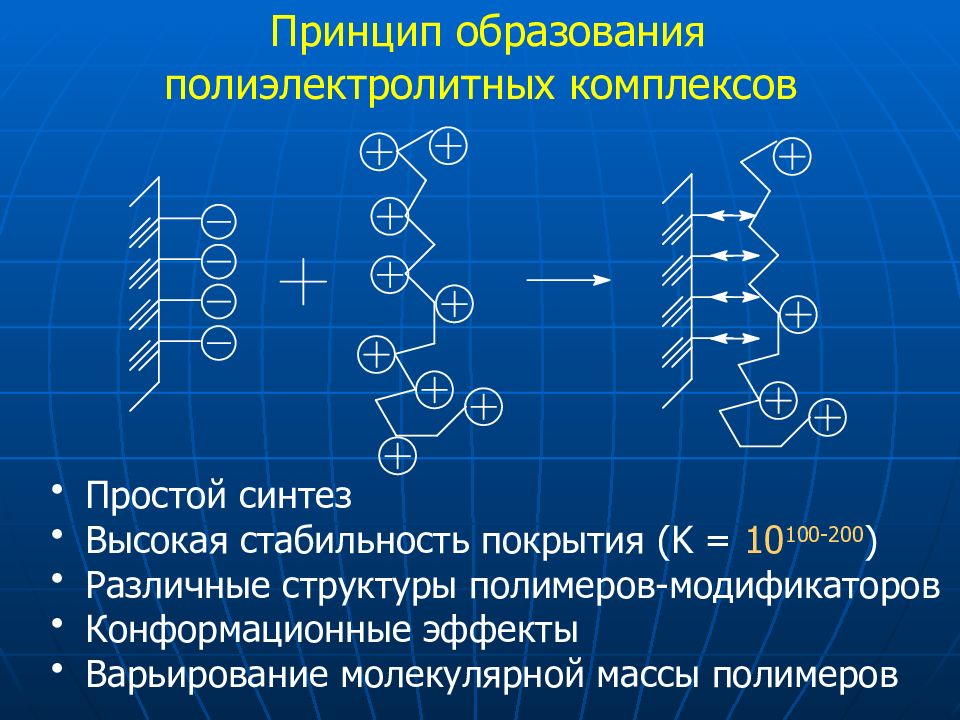
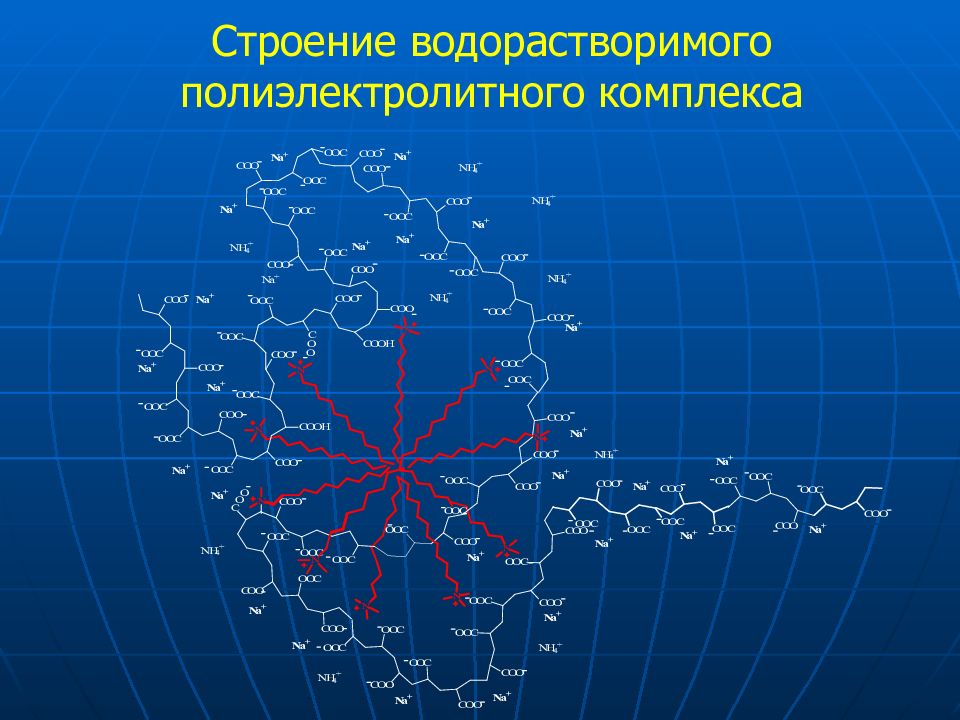
Слайд 28: Принцип образования полиэлектролитных комплексов
Простой синтез Высокая стабильность покрытия (K = 10 100-200 ) Различные структуры полимеров-модификаторов Конформационные эффекты Варьирование молекулярной массы полимеров
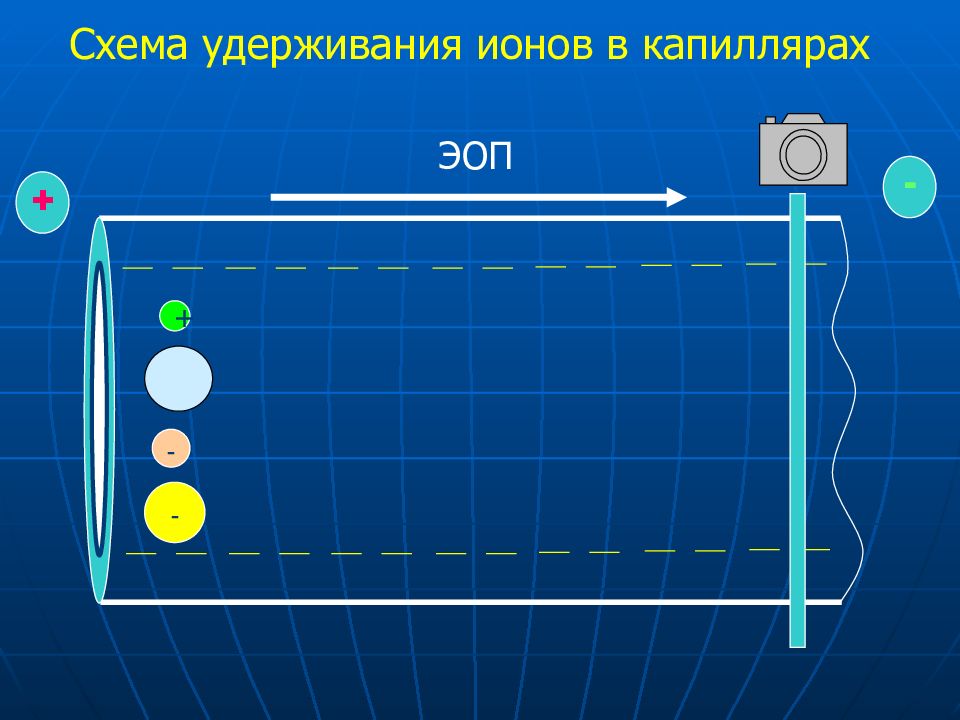
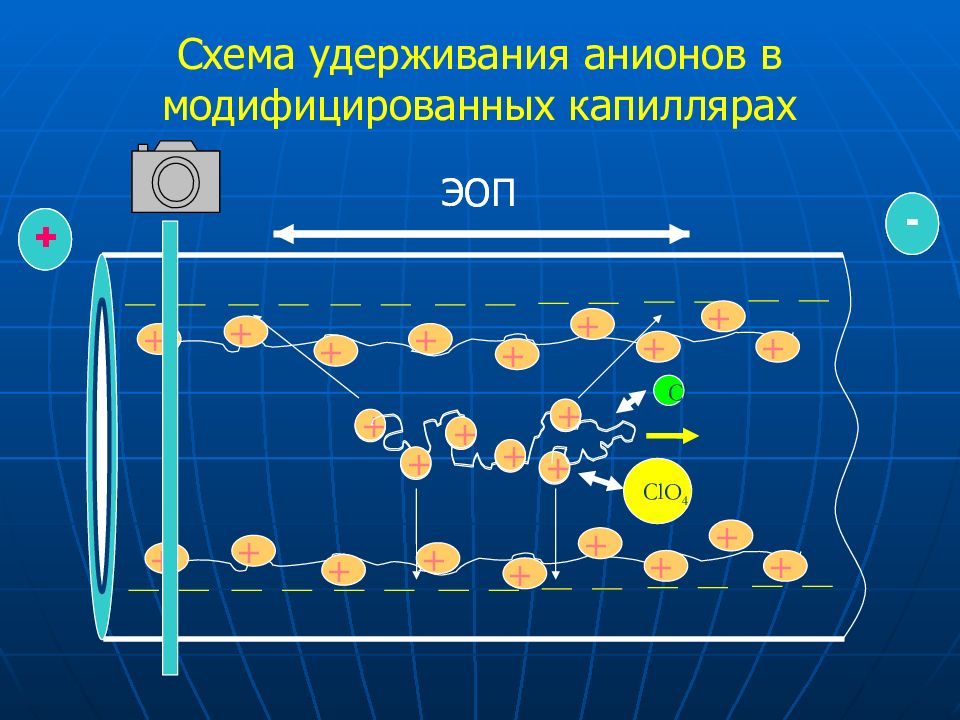
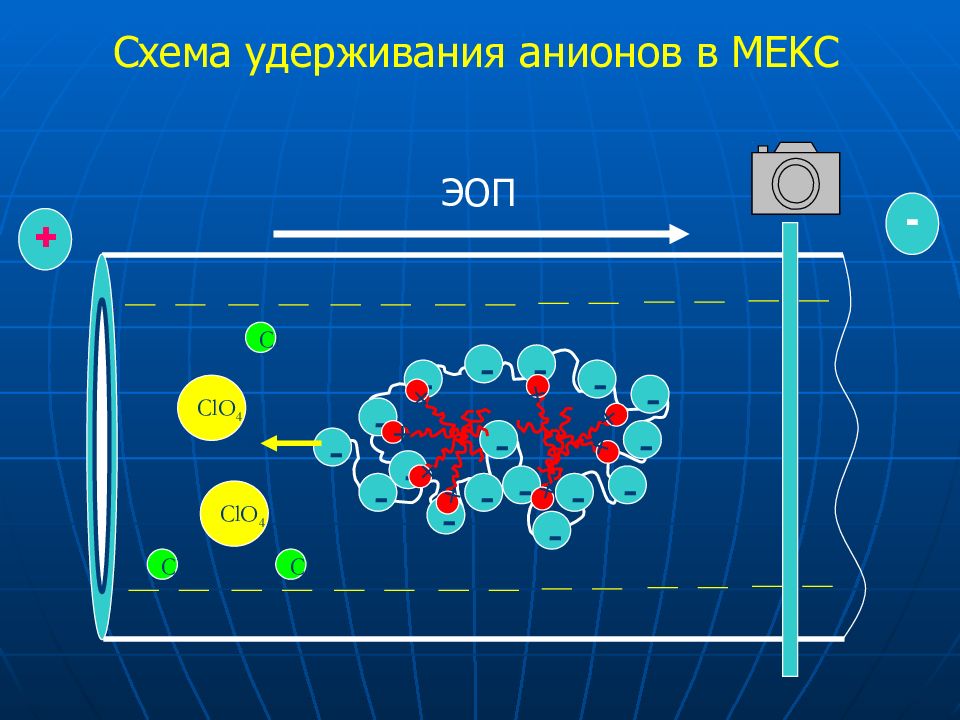
Слайд 29: Схем а удерживания анионов в модифицированных капиллярах
ЭОП + - + + + + + + + + + + + + + + + + + + + + + + + + ЭОП + - + + + + + + Cl ClO 4
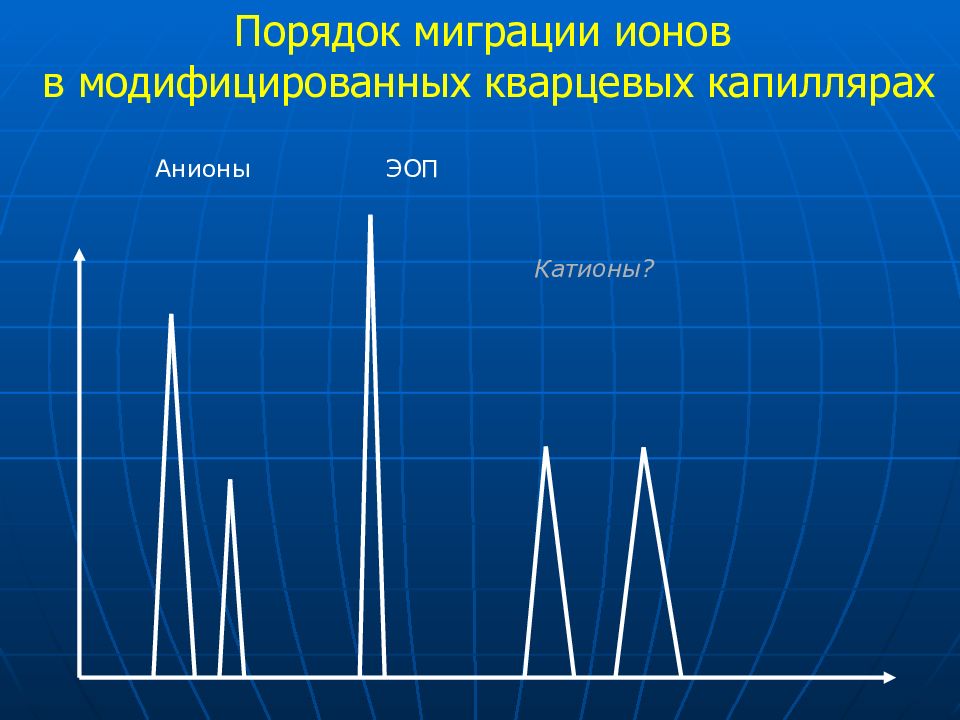
Слайд 30: Порядок миграции ионов в модифицированных кварцевых капиллярах
Анионы ЭОП Катионы ? Порядок миграции ионов в модифицированных кварцевых капиллярах
Слайд 31
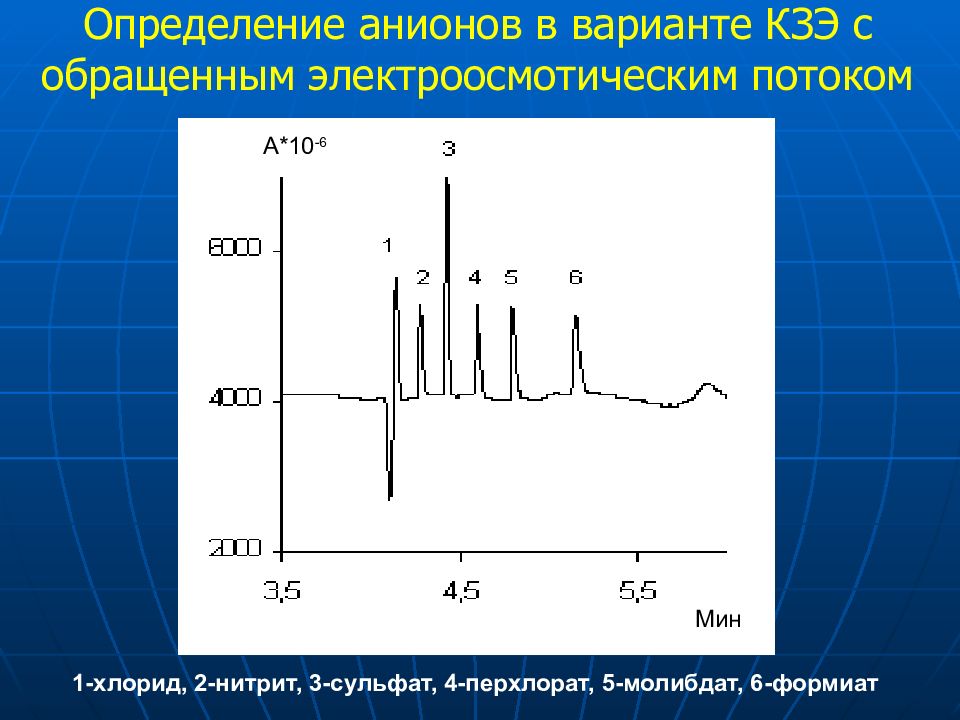
Определение анионов в варианте КЗЭ с обращенным электроосмотическим потоком 1-хлорид, 2-нитрит, 3-сульфат, 4-перхлорат, 5-молибдат, 6-формиат Мин А*10 -6
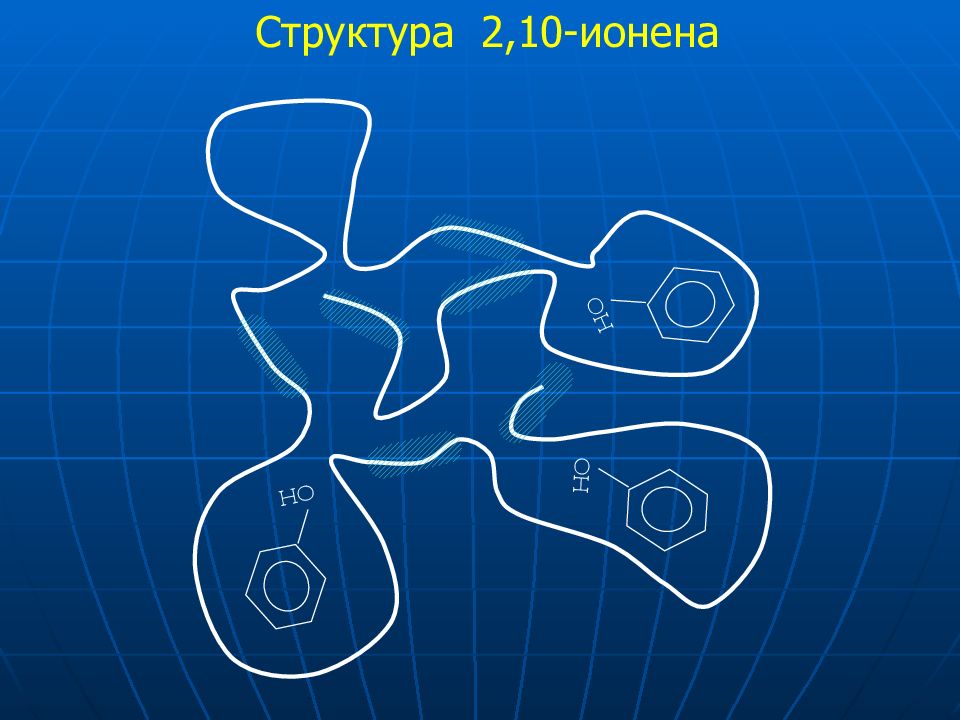
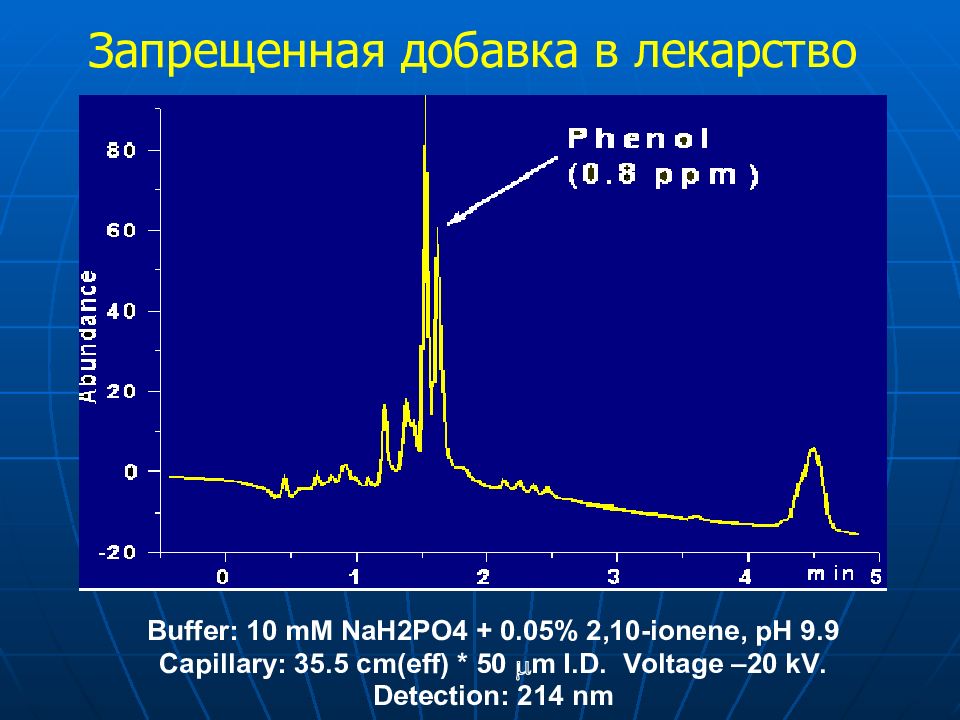
Слайд 34: Анализ лекарственных композиций
Церебролизин Высокое качество Аминокислоты Витамины Ароматические консерванты ПАВ Гетероциклы Гормоны другие вещества Церебролизат ? качество Фенол ?
Слайд 38
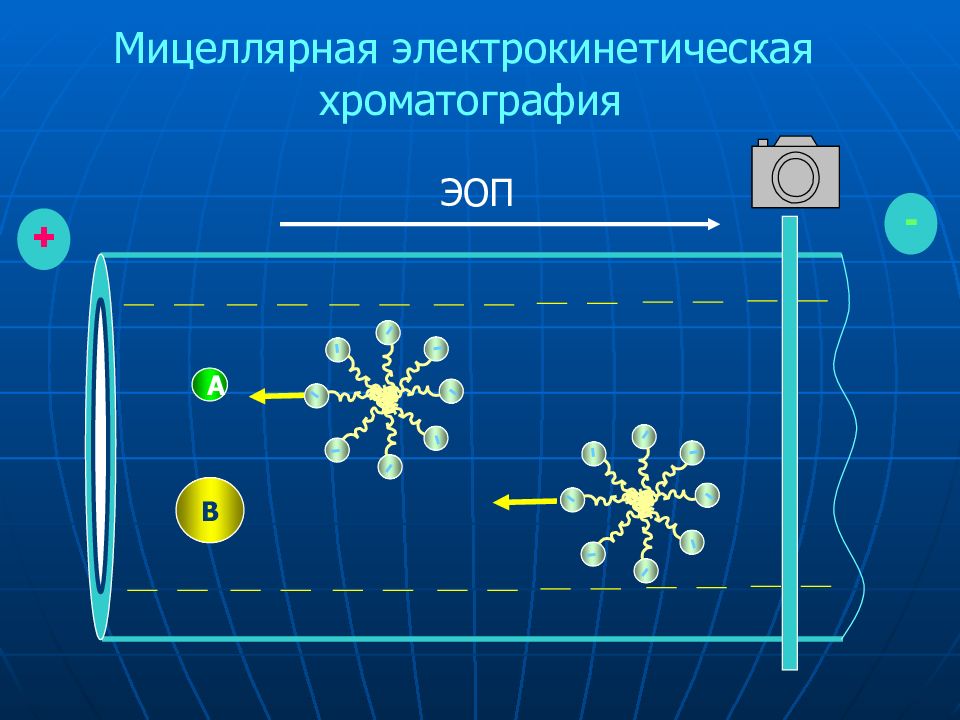
A B ЭОП + - - - - - - - - - - - - - - - - - Мицеллярная электрокинетическая хроматография
Слайд 39
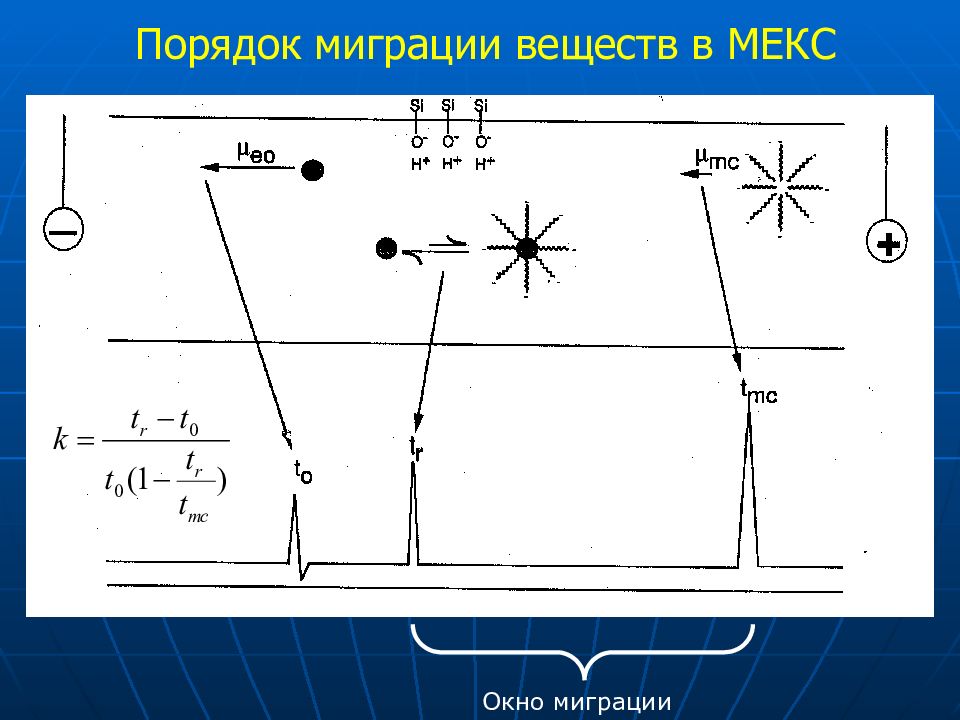
Два механизма разделения Электрофоретическая подвижность в свободном растворе электролита Распределение между аналитом и мицеллами Мицеллы Образуются в растворах при концентрации ПАВ выше ККМ Имеют заряженную поверхность и гидрофобное ядро Додецилсульфат натрия (SDS) наиболее распространен (ККМ ~ 15 мМ). Механизм разделения в мицеллярной электрокинетической хроматографии
Слайд 41: Факторы, влияющие на селективность в МЕКС
Природа ПАВ Длина гидрофобного «хвоста» и природа гидрофильных ионогенных групп Различное агрегатное число ( SDS = 16) Желчные кислоты Катионные ПАВ обращают направление ЭОП рК ионогенных групп Буферный электролит Добавки органических растворителей имеют большее влияние, чем в КЗЭ. Большое кол-во орг. растворителей разрушает мицеллы рН и рК аналитов Температура Сильное влияние на устойчивость и поведение мицелл Необходимо тщательное термостатирование ( 2 º C критично)
Слайд 42
Хорошие начальные условия для МЕКС : Капилляр : 5 0 мкм внутренний диаметр, 60 см длина Электролит : 20 мМ боратный буферный раствор с рН 9, содержащий 50…100 мМ додецилсульфата натрия (SDS) Напряжение : + 20 kV
Слайд 45
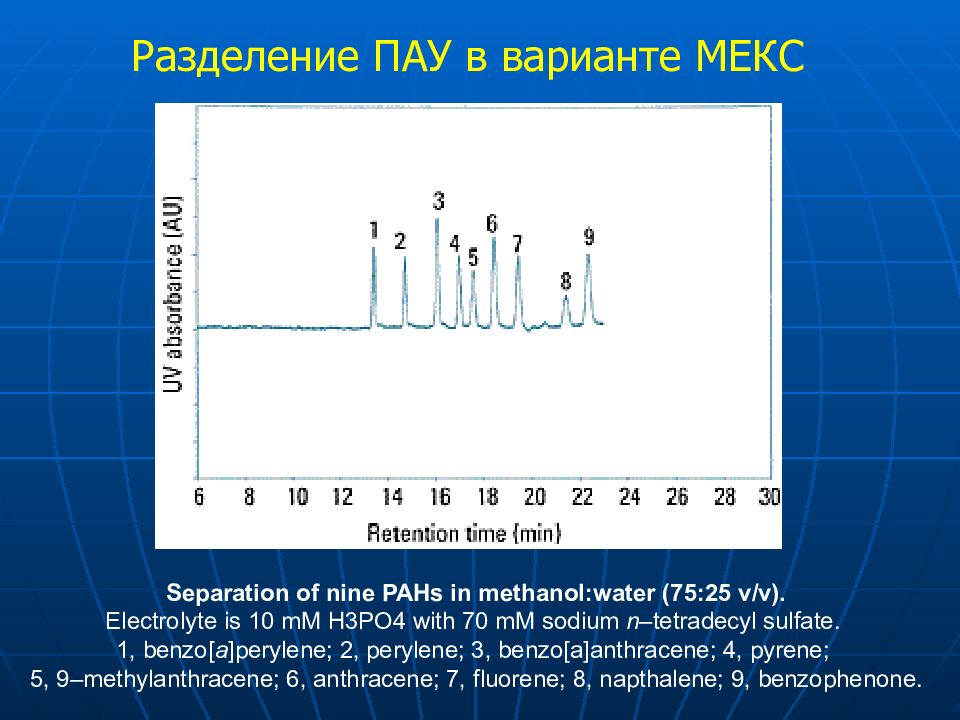
Separation of nine PAHs in methanol:water (75:25 v/v). Electrolyte is 10 mM H3PO4 with 70 mM sodium n –tetradecyl sulfate. 1, benzo[ a ]perylene; 2, perylene; 3, benzo[a]anthracene; 4, pyrene; 5, 9–methylanthracene; 6, anthracene; 7, fluorene; 8, napthalene; 9, benzophenone. Разделение ПАУ в варианте МЕКС
Слайд 46
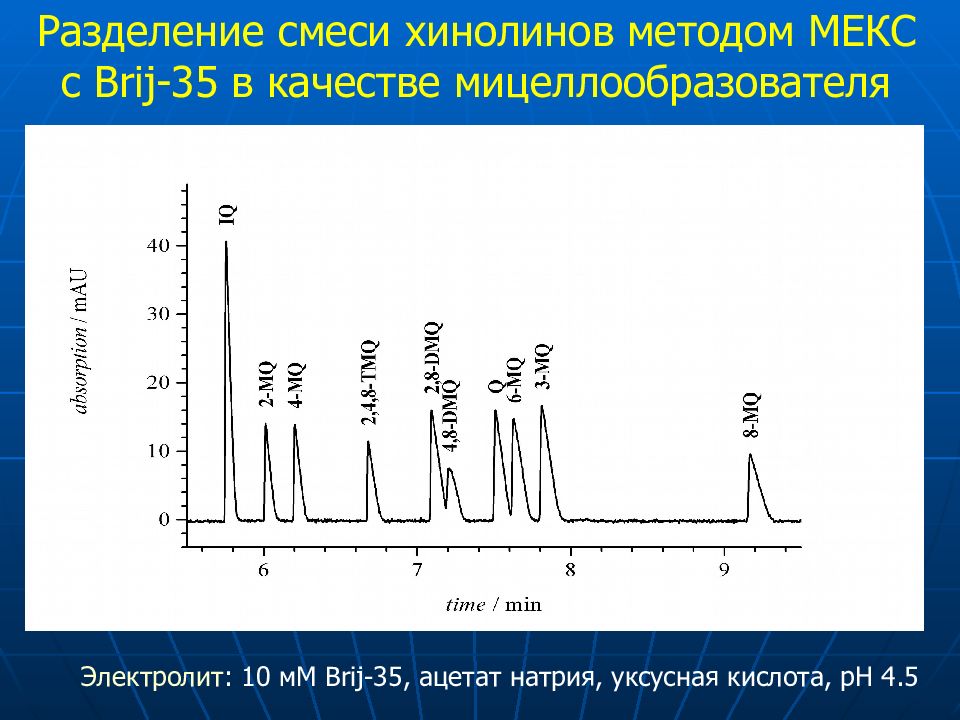
6 2 5 1 3 4 10 7 8 9 Brij35-MEKC pH 4.5 Разделение смеси хинолинов методом МЕКС с Brij-35 в качестве мицеллообразователя Электролит : 10 мМ Brij-35, ацетат натрия, уксусная кислота, pH 4.5
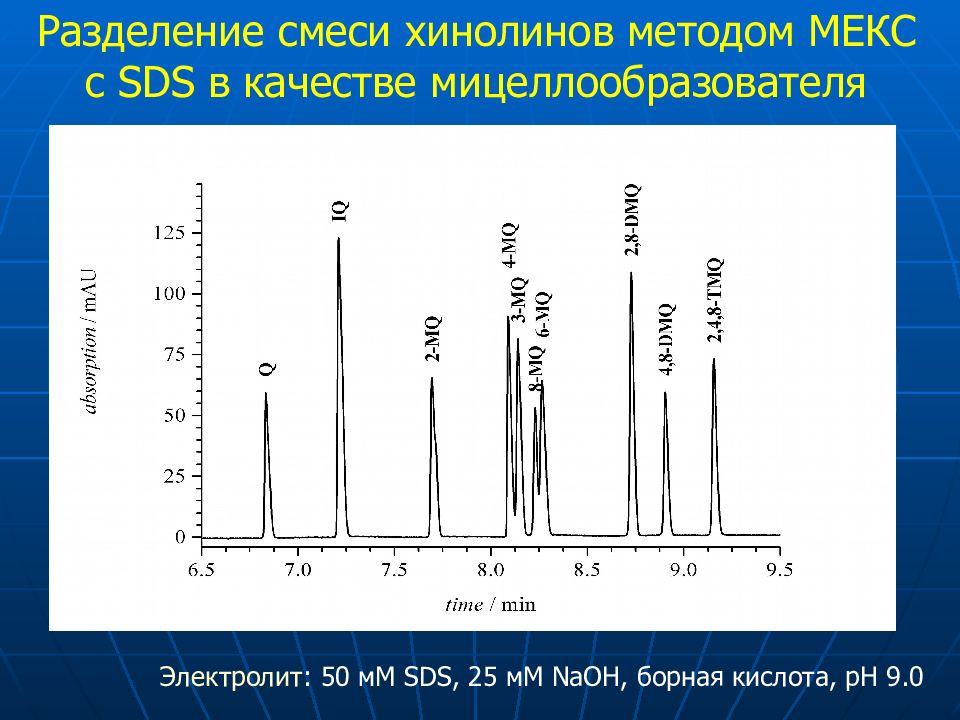
Слайд 47
10 6 2 5 8 9 7 3 4 1 SDS-MEKC pH 9.0 Разделение смеси хинолинов методом МЕКС с SDS в качестве мицеллообразователя Электролит : 50 мМ SDS, 25 мМ NaOH, борная кислота, pH 9.0
Слайд 49: Схем а удерживания анионов в М EKC
ЭОП + - Cl ClO 4 ClO 4 Cl Cl - - - - - - - - - - - - - - - - - + + + + + + + +
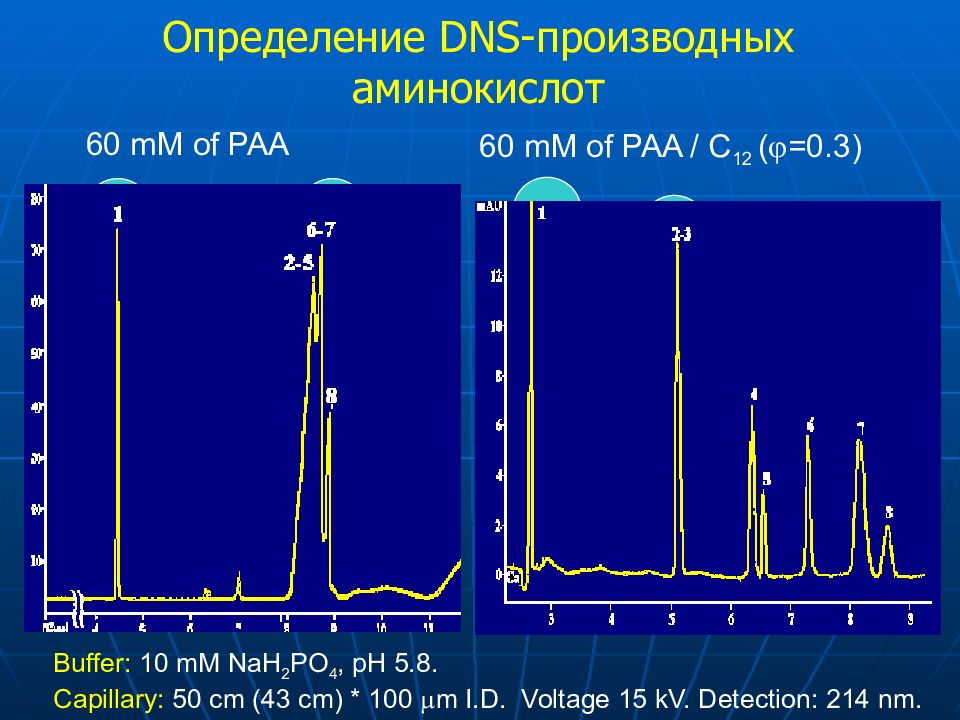
Слайд 50: Определение DNS-производных аминокислот
Buffer: 10 mM NaH 2 PO 4, pH 5.8. Capillary: 50 cm (43 cm) * 100 m I.D. Voltage 15 kV. Detection: 214 nm. 60 mM of PAA EOF Thr, Ser, Ile Leu, Phe Met 60 mM of PAA / C 12 ( =0.3) Thr EOF Met Phe Leu Ile Ser
Слайд 52: Принципы метода М EEKC
В капилляре создается устойчивая микроэмульсия несмешивающейся в водой жидкости (масло). Вещества разделяются с соответствии с коэффициентами распределения в системе масло-вода. Если они заряжены и не распределятся в масло, то двигаются в соответствии с их ионными подвижностями.
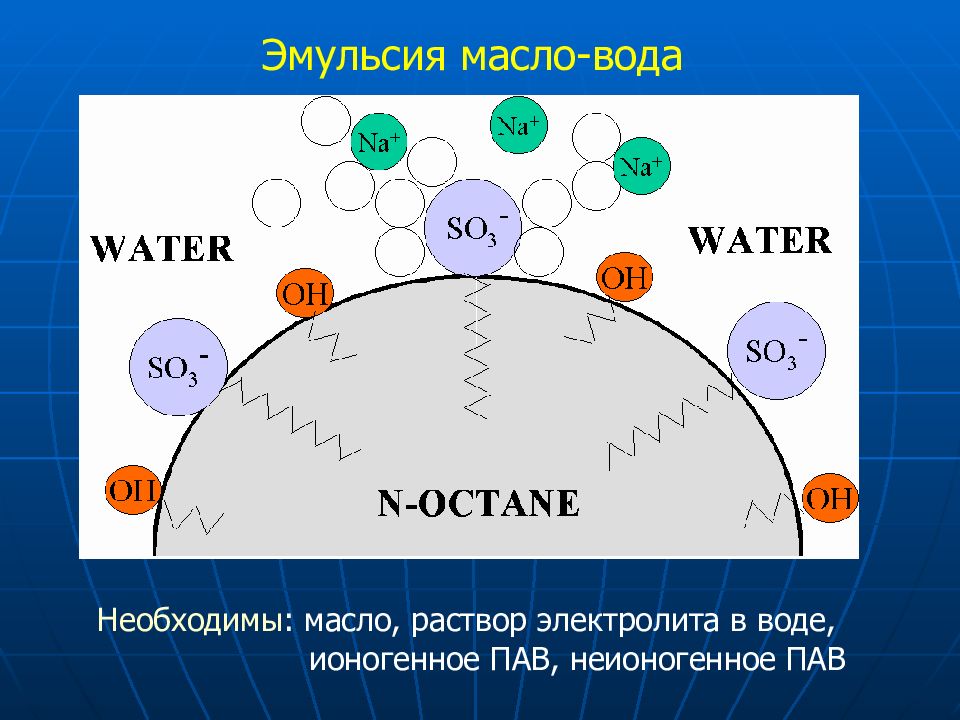
Слайд 53: Эмульсия масло-вода
Необходимы : масло, раствор электролита в воде, ионогенное ПАВ, неионогенное ПАВ
Слайд 54
Хорошие начальные условия для МЕЕКС : Капилляр : 5 0 мкм внутренний диаметр, 60 см длина Электролит : 0.81 g октана, 6.61 g н-бутанола, 3.31 g SDS, 89.27 g тетрабората натрия (ультразвук) Напряжение : + 20 kV www.ceandcec.com
Слайд 55
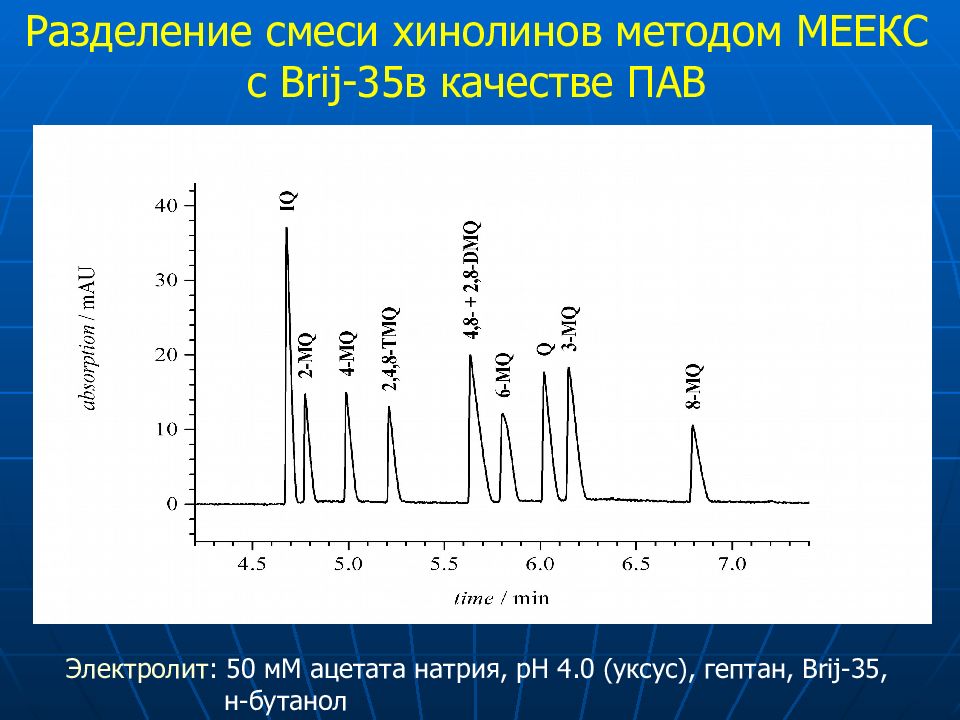
6 2 5 1 3+4 7 10 8 9 Brij35-MEEKC pH 4 Разделение смеси хинолинов методом МЕ E КС с Brij-35 в качестве ПАВ Электролит : 50 мМ ацетата натрия, рН 4.0 (уксус ), гептан, Brij-35, н-бутанол
Слайд 56
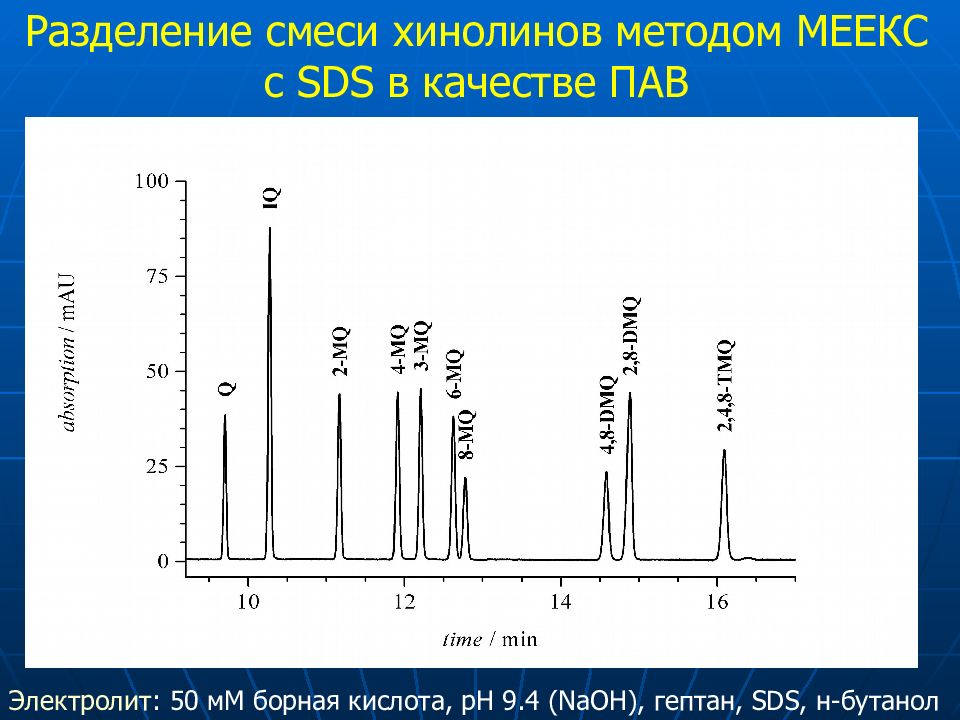
10 6 2 5 8 7 9 4 3 1 SDS-MEEKC pH 9.4 Разделение смеси хинолинов методом МЕ E КС с SDS в качестве ПАВ Электролит : 50 мМ борная кислота, рН 9.4 ( NaOH), гептан, SDS, н-бутанол
Слайд 58: Особенности С GE
Разделение основано на эксклюзии ЭОП подавлен или изменен Капилляры заполнены полимером Линейный полиакриламид Сшитые полимеры (3-х мерная структура) Смеси полимеров Целесообразен для больших молекул с подобными соотношениями m/z ДНК Белки
Слайд 59: Механизм CGE
Разделяемые вещества движутся по капилляру в зависимости от собственной подвижности и способности проникать в гель. Малые молекулы мигрируют первыми Большие молекулы мигрируют последними pH буферного электролита Необходимо ионизовать аналиты Оставить поверхность капилляра незаряженной ( нет ЭОП)
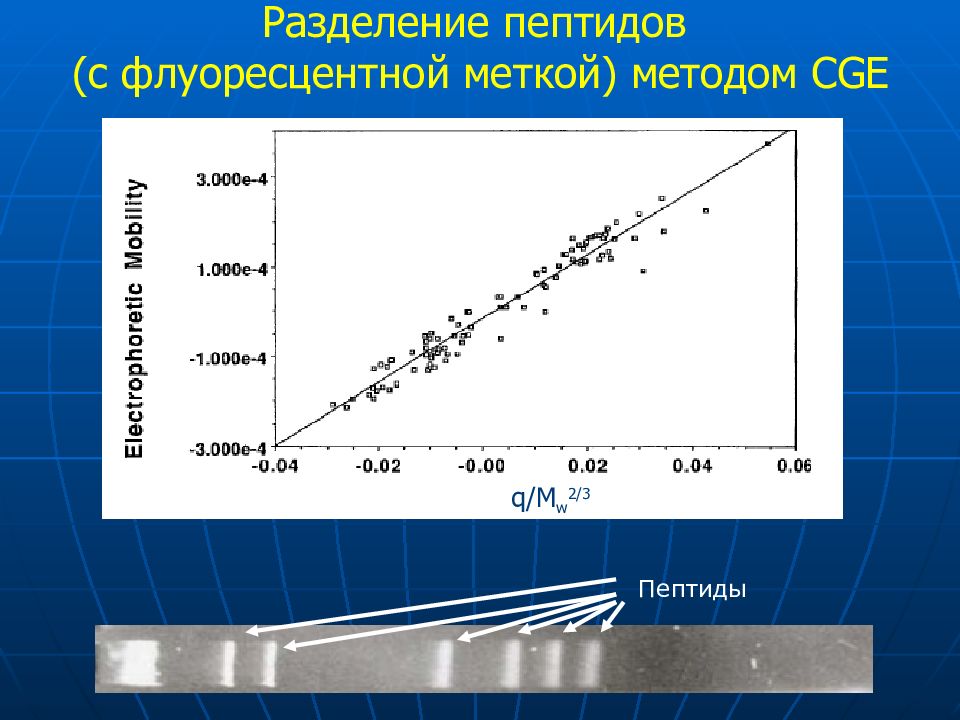
Слайд 60: Разделение пептидов (с флуоресцентной меткой) методом CGE
q/M w 2/3 Пептиды
Слайд 62
Принципы метода C ЕС CEC является гибридным методом Комбинация КЗЭ и ВЭЖХ Электрофоретическое движение подвижной фазы Неподвижные фазы от ВЭЖХ Цели Получить селективность от ВЭЖХ ( 1) Получить эффективность от КЗЭ ( N ~ 500 000)
Слайд 63
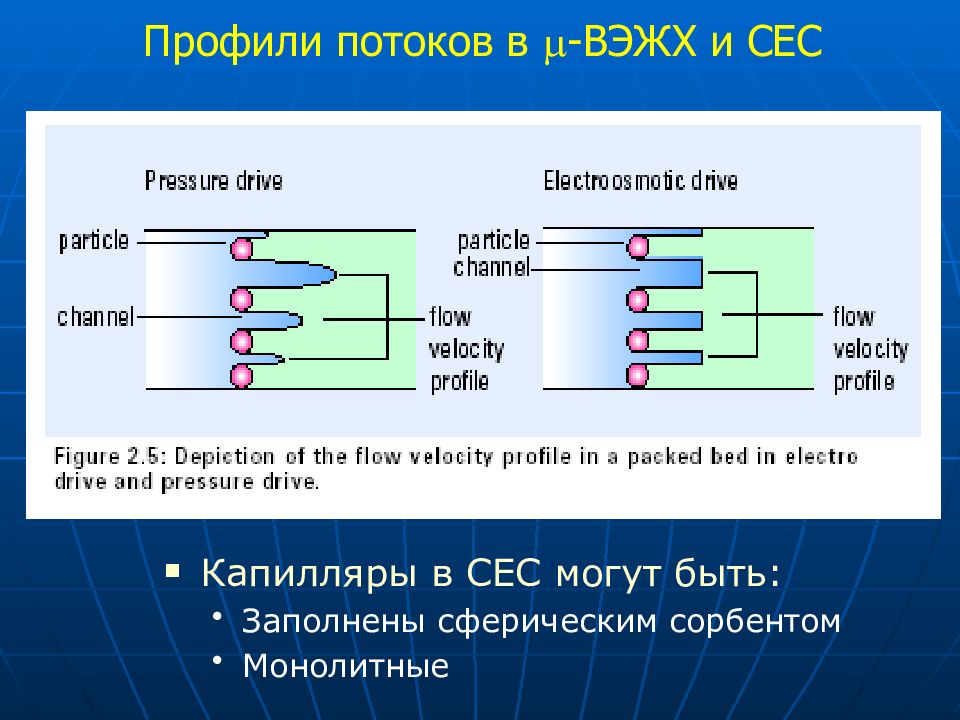
Пр о фили потоков в -ВЭЖХ и C ЕС Капилляры в СЕС могут быть: Заполнены сферическим сорбентом Монолитные
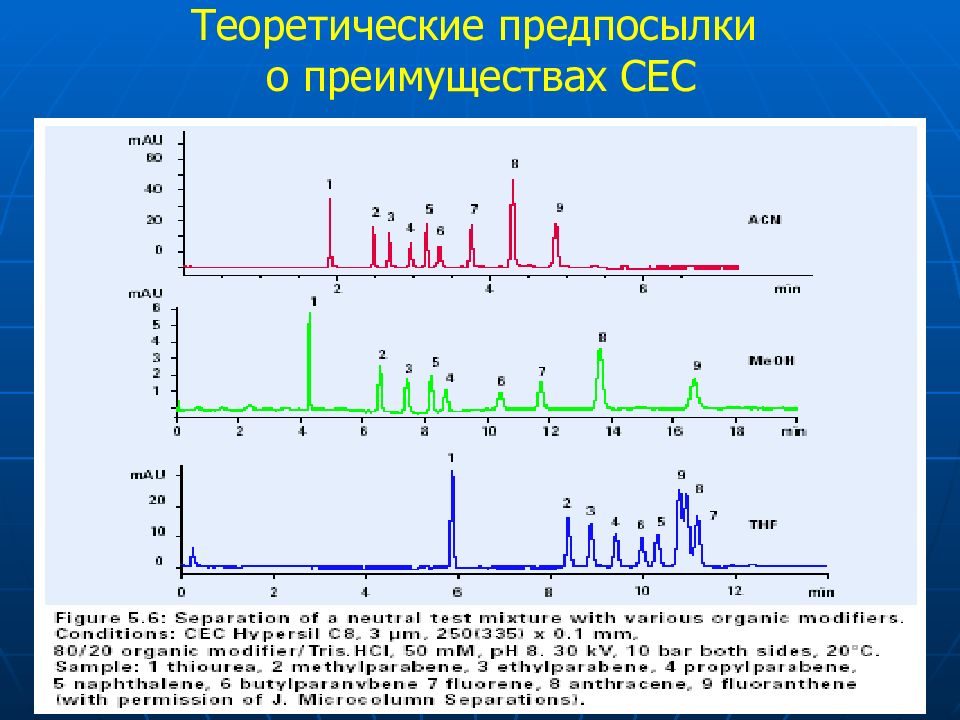
Слайд 64: Теоретические предпосылки о преимуществах СЕС
Плоский профиль потока подвижной фазы Размер частиц сорбента Нет ограничений по давлению Используют частицы размером < 1.5 мкм Экспрессность анализа Большая поверхность приводит к коротким колонкам Хорошо стыкуется с MS (можно использовать большие концентрации орг. растворителей для управления селективностью)
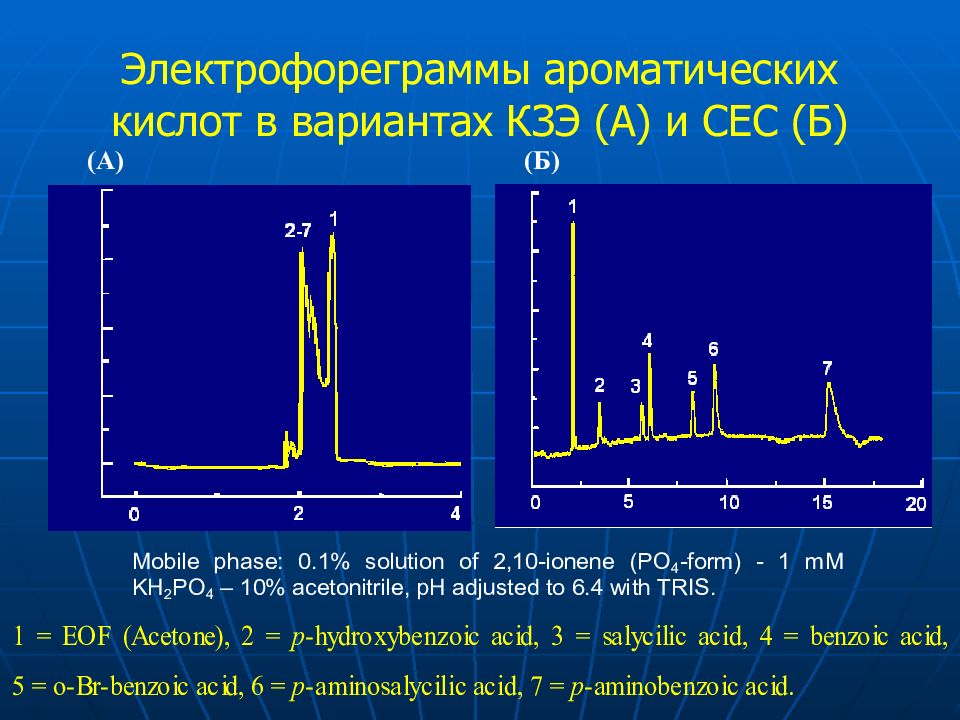
Слайд 66: Электрофореграммы ароматических кислот в вариант ах К З Э (A) и СЕС ( Б )
(A) ( Б )
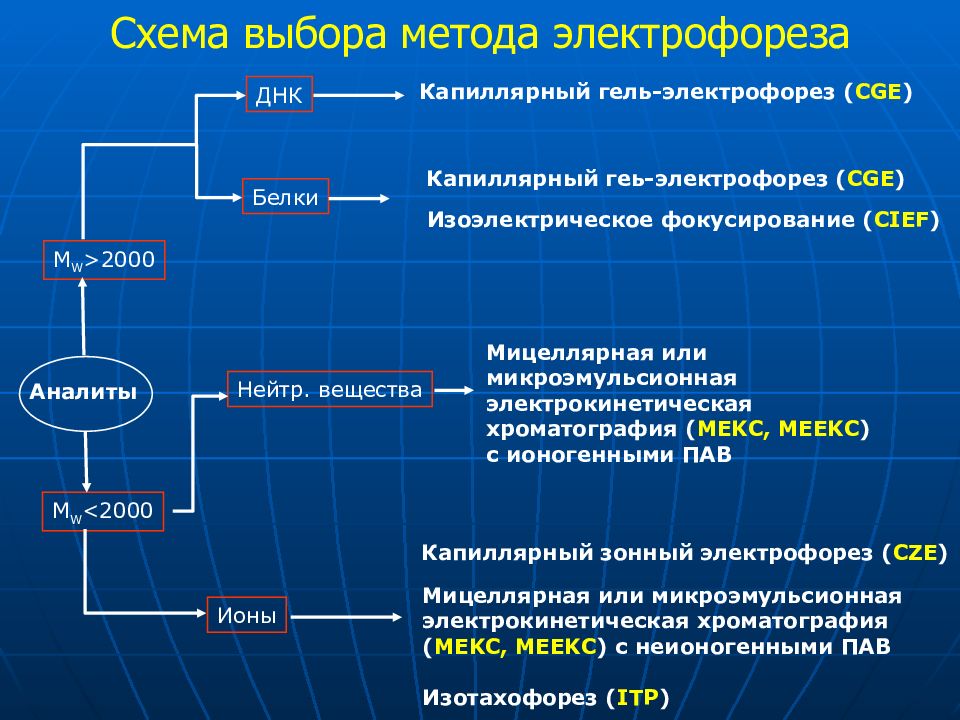
Слайд 67: Схема выбора метода электрофореза
Аналиты M W >2000 M W <2000 Капиллярный гель-электрофорез ( CGE ) Ионы Нейтр. вещества Мицеллярная или микроэмульсионная электрокинетическая хроматография ( MEKC, MEEKC ) с ионогенными ПАВ ДНК Белки Капиллярный геь-электрофорез ( CGE ) Изоэлектрическое фокусирование ( С IEF ) Капиллярный зонный электрофорез ( CZE ) Мицеллярная или микроэмульсионная электрокинетическая хроматография ( MEKC, MEEKC ) с неионогенными ПАВ Изотахофорез ( ITP ) Схема выбора метода электрофореза
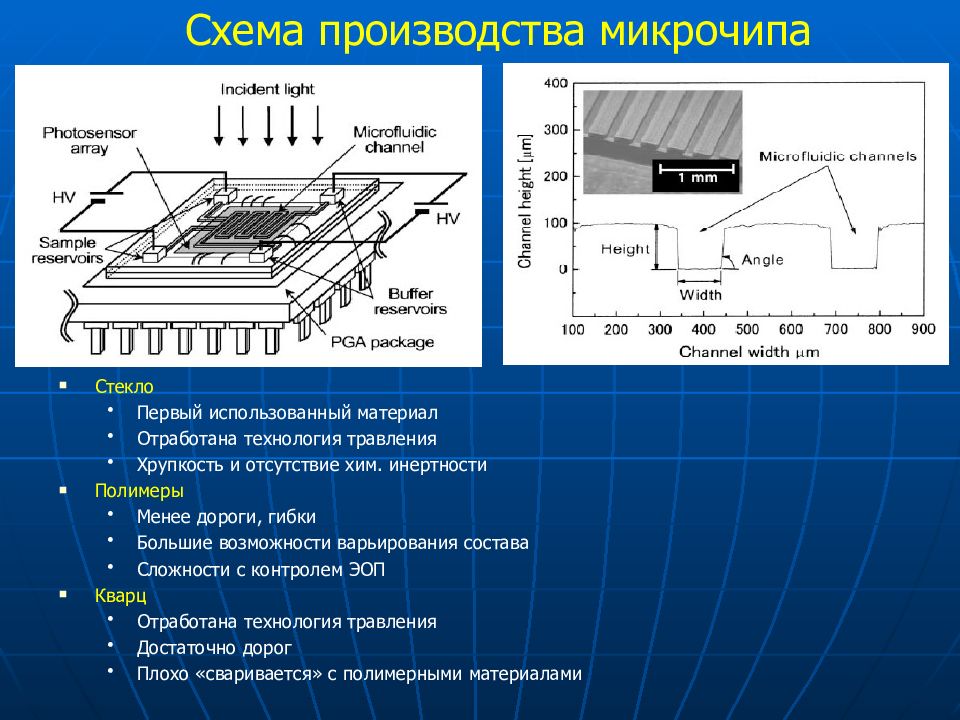
Слайд 69: Схема производства микрочипа
Стекло Первый использованный материал Отработана технология травления Хрупкость и отсутствие хим. инертности Полимеры Менее дороги, гибки Большие возможности варьирования состава Сложности с контролем ЭОП Кварц Отработана технология травления Достаточно дорог Плохо «сваривается» с полимерными материалами
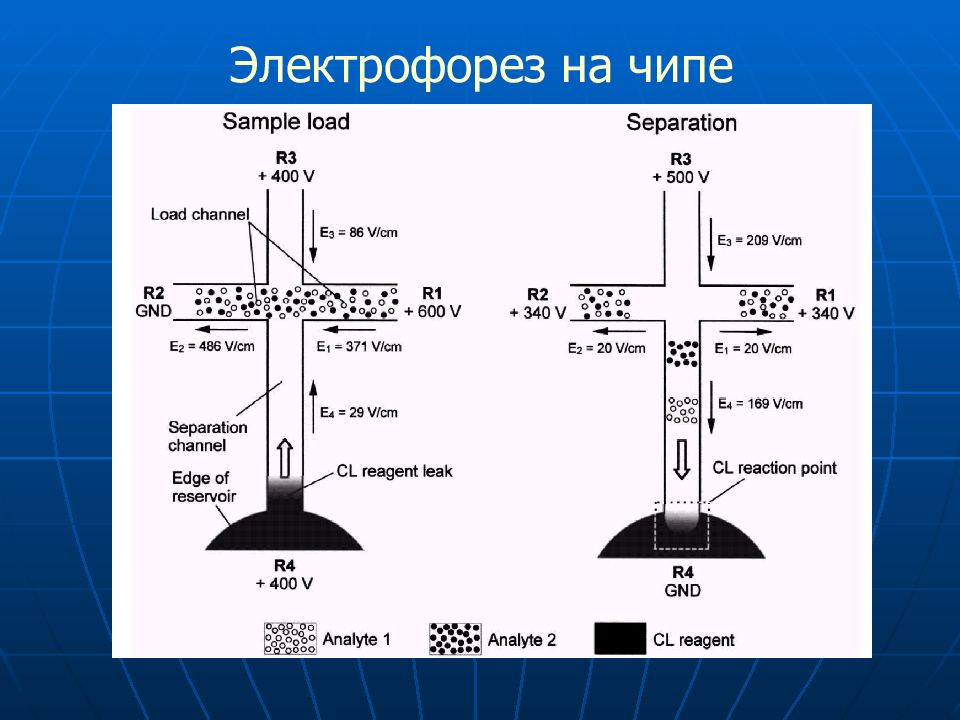
Слайд 71
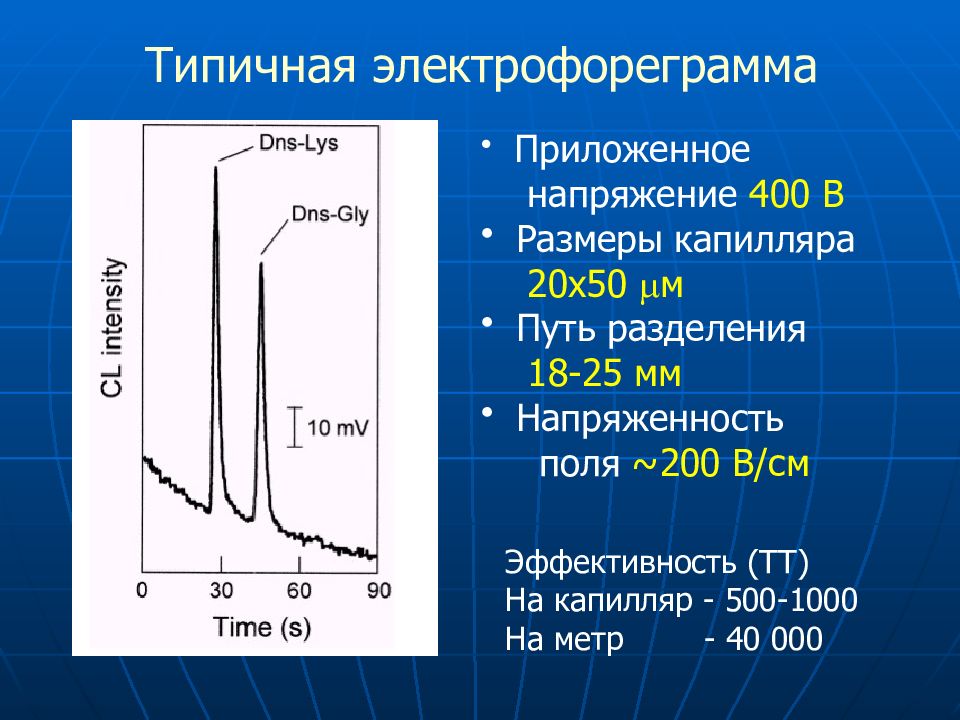
Типичная электрофореграмма Приложенное напряжение 400 В Размеры капилляра 20х50 м Путь разделения 18-25 мм Напряженность поля ~200 В/ см Эффективность (ТТ) На капилляр - 500-1000 На метр - 40 000
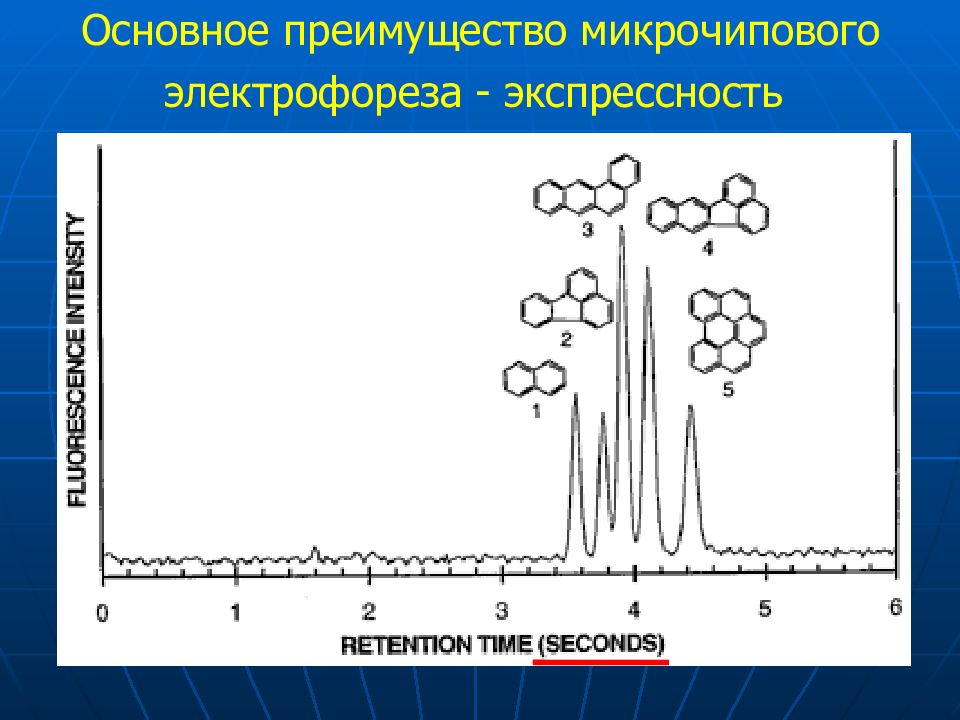
Слайд 72
Типичная структура капилляра «песочные часы» Длина пути «до разделения» 9 м Напряженность поля 100 кВ / см Скорость переноса 1.3 м/сек Время анализа 20 сек Приложенное напряжение 20 кВ
Слайд 73
Устройство для оттягивания микропипеток Контролируются Температура Скорость нагрева Зона нагрева Величина растягивания Получаемый диаметр (до 0.1 мкм ) Подача газа Влажность 10 встроенных программ
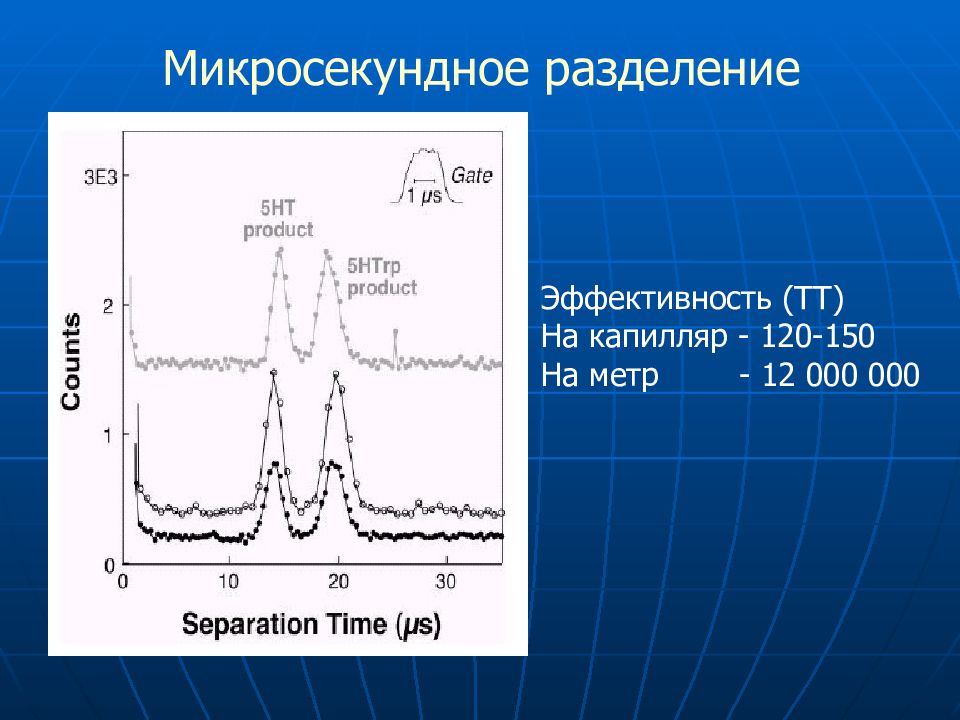
Слайд 75
Микросекундное разделение Эффективность (ТТ) На капилляр - 120-150 На метр - 12 000 000
Слайд 76
Уникальный метод контроля и анализа чрезвычайно нестойких и короткоживущих соединений ( новизна ) Стоимость оборудования / цена чипа Воспроизводимость Материал чипа Нет необходимости использовать при анализе обычных веществ