Первый слайд презентации
Лекция 4. ХИМИЧЕСКАЯ СВЯЗЬ И СТРОЕНИЕ МОЛЕКУЛ Химическая связь – это взаимодействие двух или нескольких атомов, в результате которого образуется химически устойчивая многоатомная микросистема (молекула, кристалл, комплекс и др.). Природа химической связи – электрическая ! Никаких особых сил химического взаимодействия, помимо электрических, не существует. Суть связи в кулоновском взаимодействии, в единстве противоположностей – притяжения и отталкивания. Современная теория химической связи базируется на квантово-механических представлениях, ее фундамент был заложен в 1927 году Гейтлером и Лондоном.
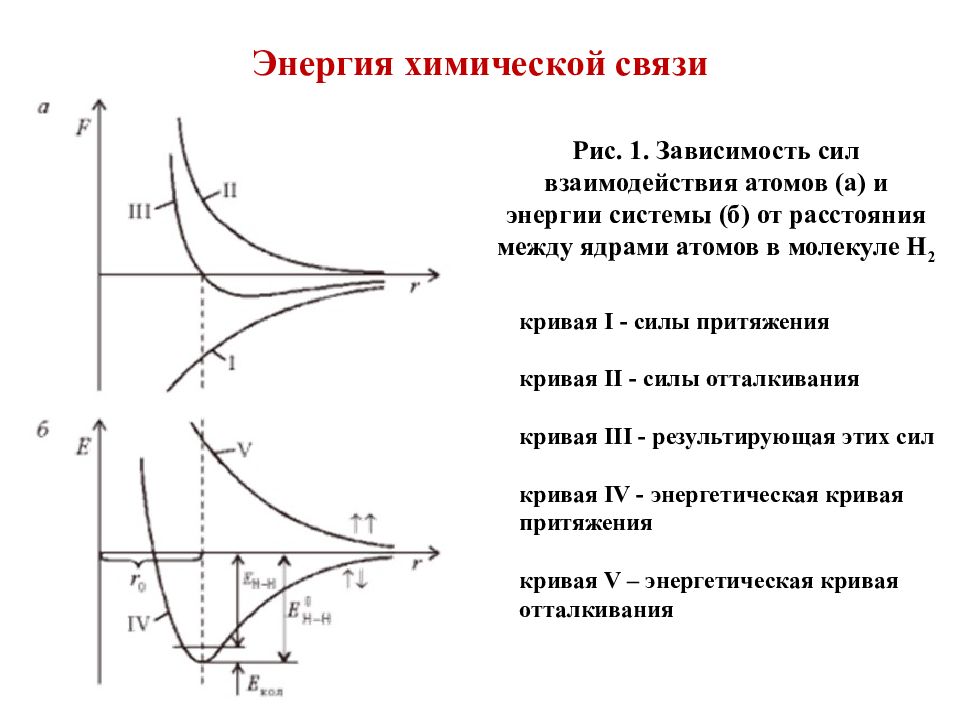
Слайд 2: Энергия химической связи
Рис. 1. Зависимость сил взаимодействия атомов (а) и энергии системы (б) от расстояния между ядрами атомов в молекуле Н 2 кривая I - силы притяжения кривая II - силы отталкивания кривая III - результирующая этих сил кривая І V - энергетическая кривая притяжения кривая V – энергетическая кривая отталкивания
Слайд 3: Энергия химической связи
Причиной связи является электростатическое взаимодействие ядер и электронов. Условием образования связи есть уменьшение полной энергии системы в сравнении с невзаимодействующими атомами. Для двухатомной молекулы: где Е св – энергия связи молекулы, Е мол – полная энергия молекулы, Е ат – полная энергия атома, входящего в состав молекулы. 3. Энергия связи всегда отрицательна.
Слайд 4: Типы химической связи:
Ковалентная Ионная Металлическая Водородная Ван-дер-ваальсовая
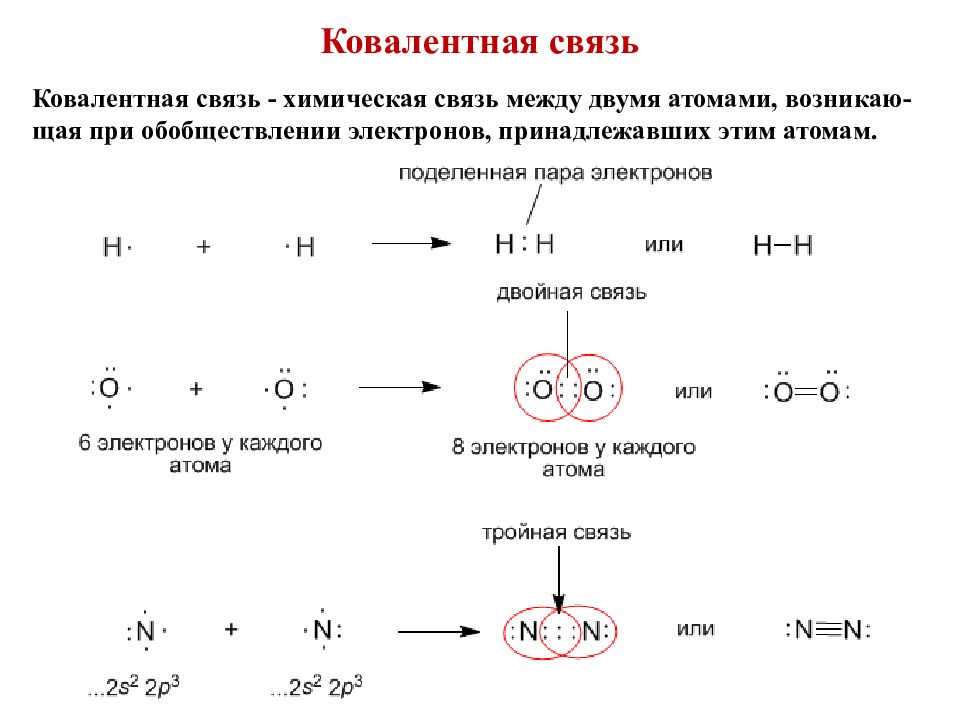
Слайд 5: Ковалентная связь
Ковалентная связь - химическая связь между двумя атомами, возникаю-щая при обобществлении электронов, принадлежавших этим атомам.
Слайд 6: Ковалентная связь. Полярность связи
Связь в молекуле оксида серы и воды – полярная ковалентная, а на атомах появляются частичные положительные и отрицательные заряды. Под электроотрицательностью (ЭО) понимают относительную способность атомов притягивать электроны при связывании с другими атомами. Электроотрицательность характеризует способность атома к поляризации химических связей. Ионную связь можно рассматривать как предельный случай полярной ковалентной связи
Слайд 7: Ковалентная связь. Кратность связи
Двойные и тройные связи имеют общее название – кратные связи. О молекуле азота говорят, что она имеет порядок связи, равный трем. В молекуле кислорода порядок связи равен двум. Порядок связи в молекулах водорода и хлора – один. У водорода и хлора уже не кратная, а простая связь. Порядок связи – это число обобществленных поделенных пар между двумя связанными атомами. Порядок связи выше трех не встречается. Чем выше порядок связи, тем прочнее связаны между собой атомы и тем короче сама связь.
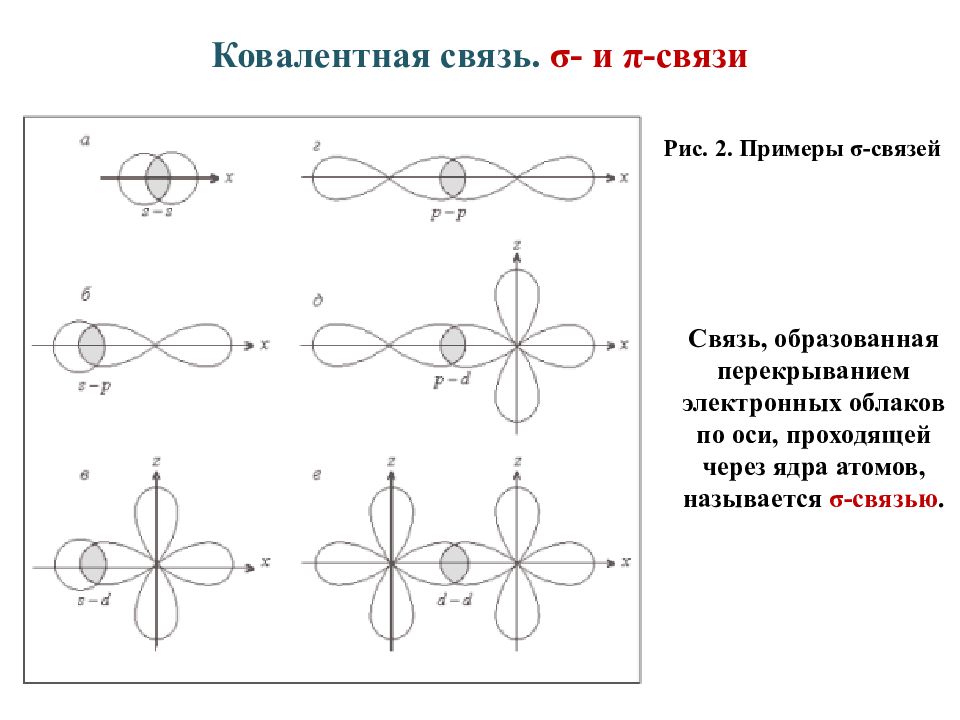
Слайд 8: Ковалентная связь. σ- и π-связи
Рис. 2. Примеры σ-связей Связь, образованная перекрыванием электронных облаков по оси, проходящей через ядра атомов, называется σ-связью.
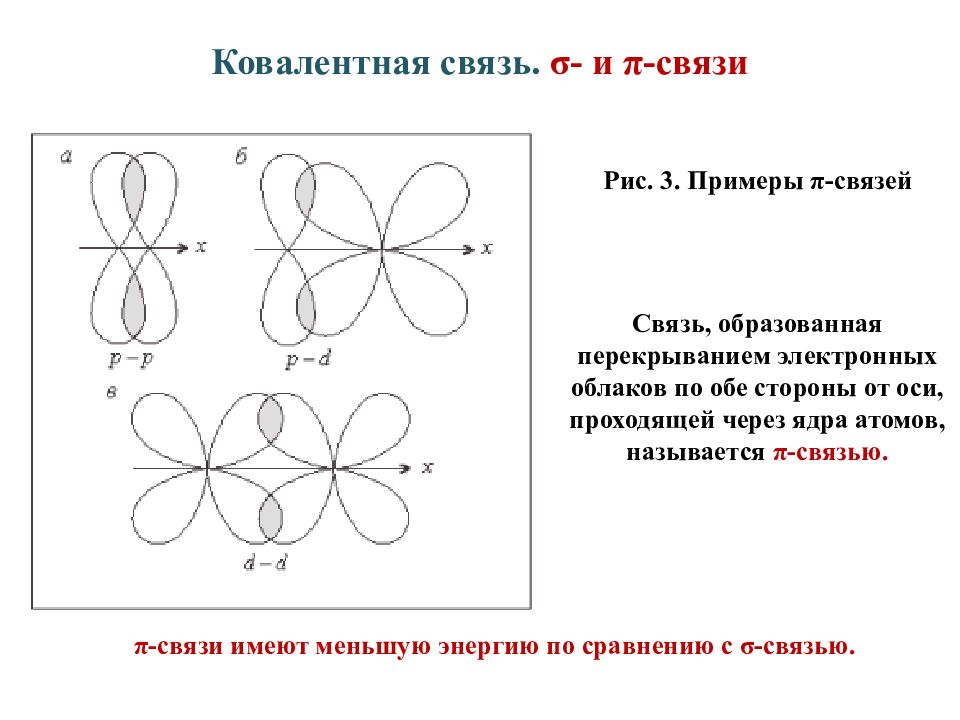
Слайд 9: Ковалентная связь. σ- и π-связи
Рис. 3. Примеры π-связей Связь, образованная перекрыванием электронных облаков по обе стороны от оси, проходящей через ядра атомов, называется π-связью. π-связи имеют меньшую энергию по сравнению с σ-связью.
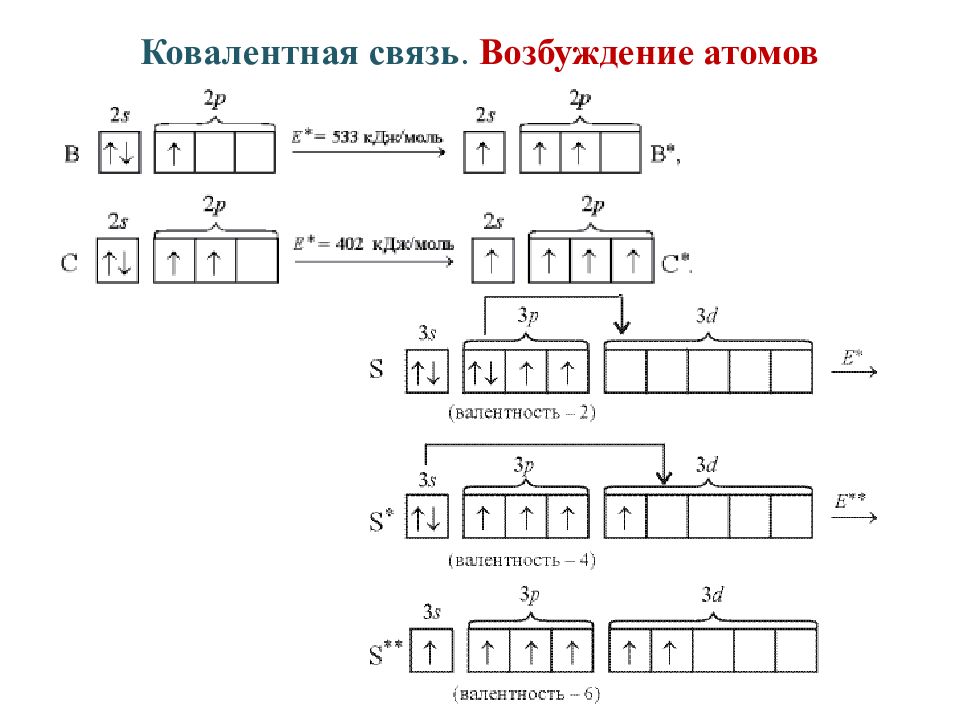
Слайд 10: Ковалентная связь. Валентность
Валентность атома – это его способность образовывать определенное число химических связей с другими атомами. Валентность определяется как число электронных пар, которыми данный атом связан с другими атомами. В квантовой химии валентность – это количество электронов ( в долях электронных облаков), которые атом делит с другими атомами посредством ковалентных связей.
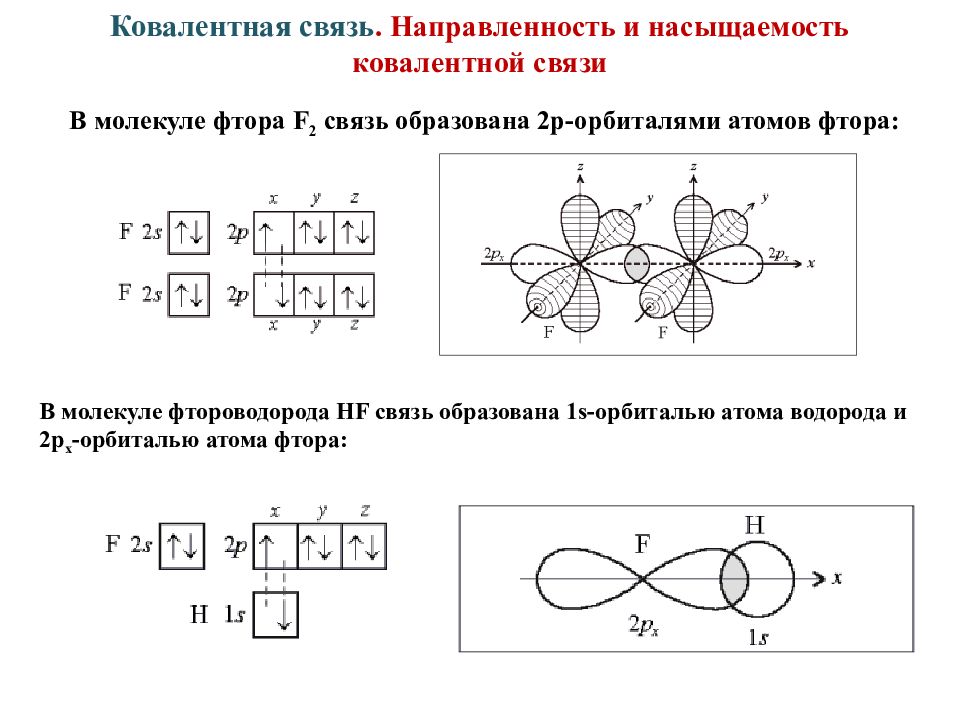
Слайд 11: Ковалентная связь. Направленность и насыщаемость ковалентной связи
В молекуле фтора F 2 связь образована 2р-орбиталями атомов фтора: В молекуле фтороводорода НF связь образована 1s-орбиталью атома водорода и 2р х -орбиталью атома фтора:
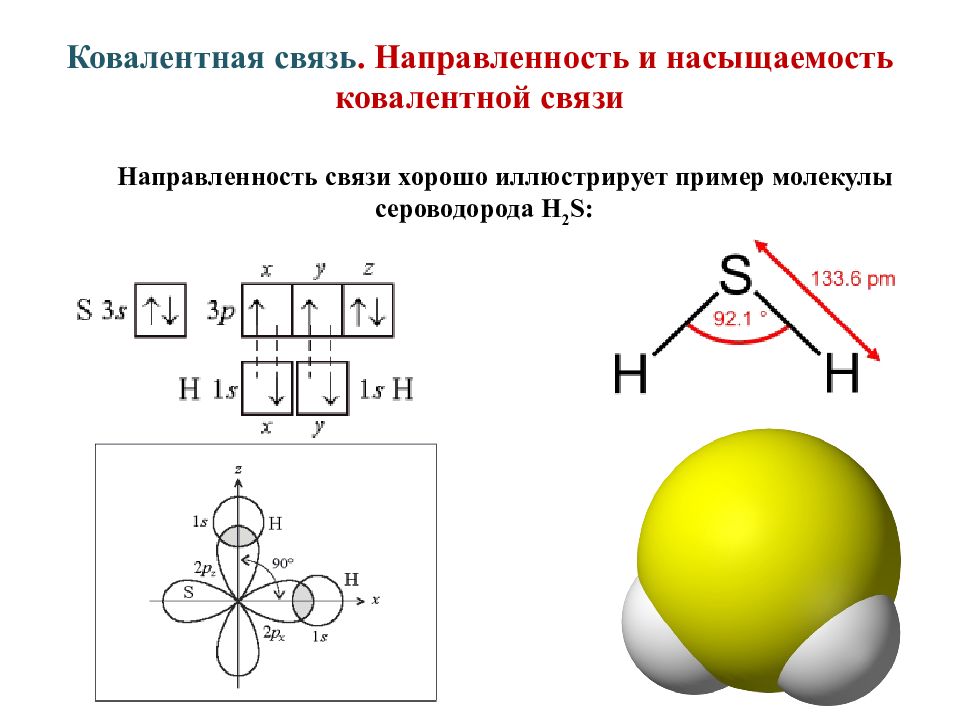
Слайд 12: Ковалентная связь. Направленность и насыщаемость ковалентной связи
Направленность связи хорошо иллюстрирует пример молекулы сероводорода Н 2 S:
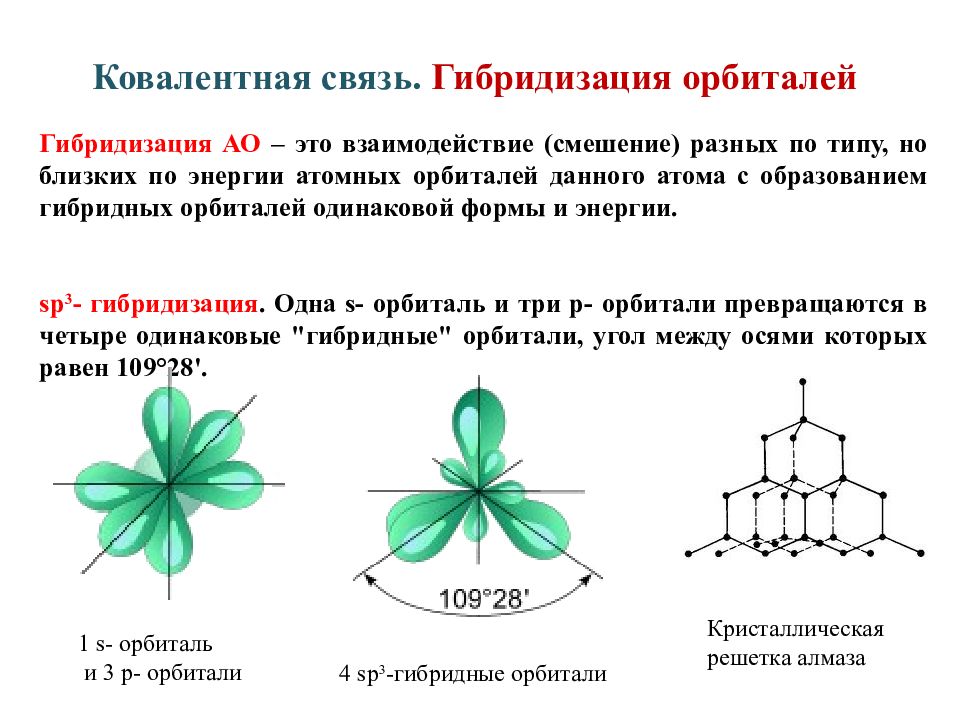
Слайд 14: Ковалентная связь. Гибридизация орбиталей
Гибридизация АО – это взаимодействие (смешение) разных по типу, но близких по энергии атомных орбиталей данного атома с образованием гибридных орбиталей одинаковой формы и энергии. sp 3 - гибридизация. Одна s - орбиталь и три p - орбитали превращаются в четыре одинаковые "гибридные" орбитали, угол между осями которых равен 109 ° 28'. 1 s - орбиталь и 3 p - орбитали 4 sp 3 - гибридные орбитали Кристаллическая решетка алмаза
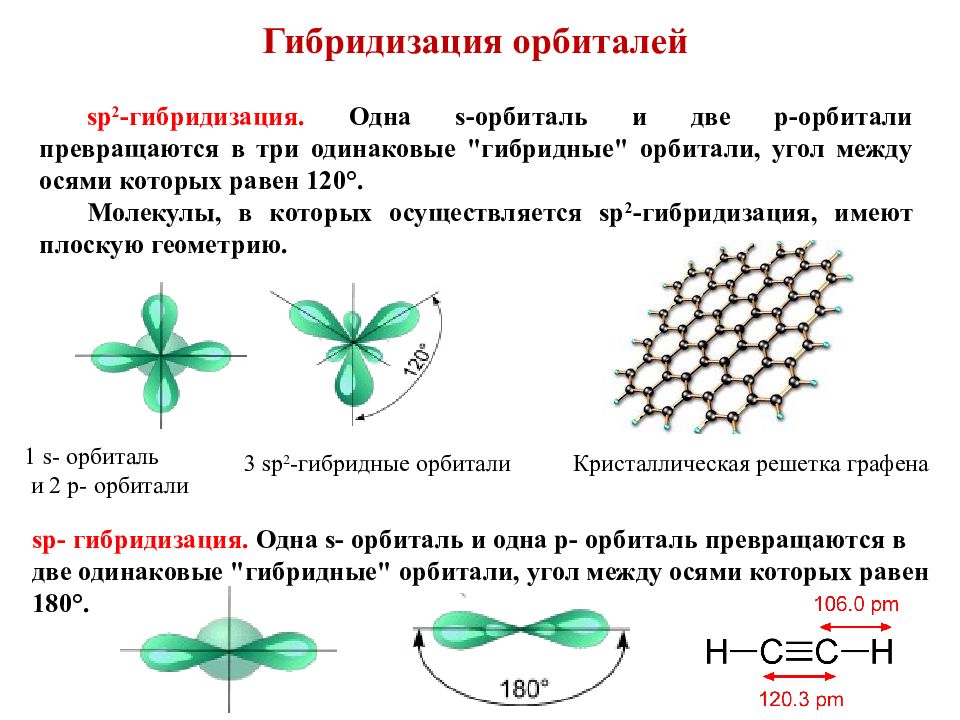
Слайд 15: Гибридизация орбиталей
sp 2 - г ибридизация. Одна s -орбиталь и две p -орбитали превращаются в три одинаковые "гибридные" орбитали, угол между осями которых равен 120 °. Молекулы, в которых осуществляется sp 2 -гибридизация, имеют плоскую геометрию. 1 s - орбиталь и 2 p - орбитали 3 sp 2 - гибридные орбитали Кристаллическая решетка графена sp - гибридизация. Одна s - орбиталь и одна p - орбиталь превращаются в две одинаковые "гибридные" орбитали, угол между осями которых равен 180 °.
Слайд 17: Ковалентная связь. Выводы
Связь образуется электронной парой с антипараллельными спинами. Насыщаемость связи обусловлена образованием электронных пар. Прочность связи пропорциональна степени перекрывания электронных облаков. Направленность связи обусловлена перекрыванием электронных облаков в области максимальной электронной плотности.
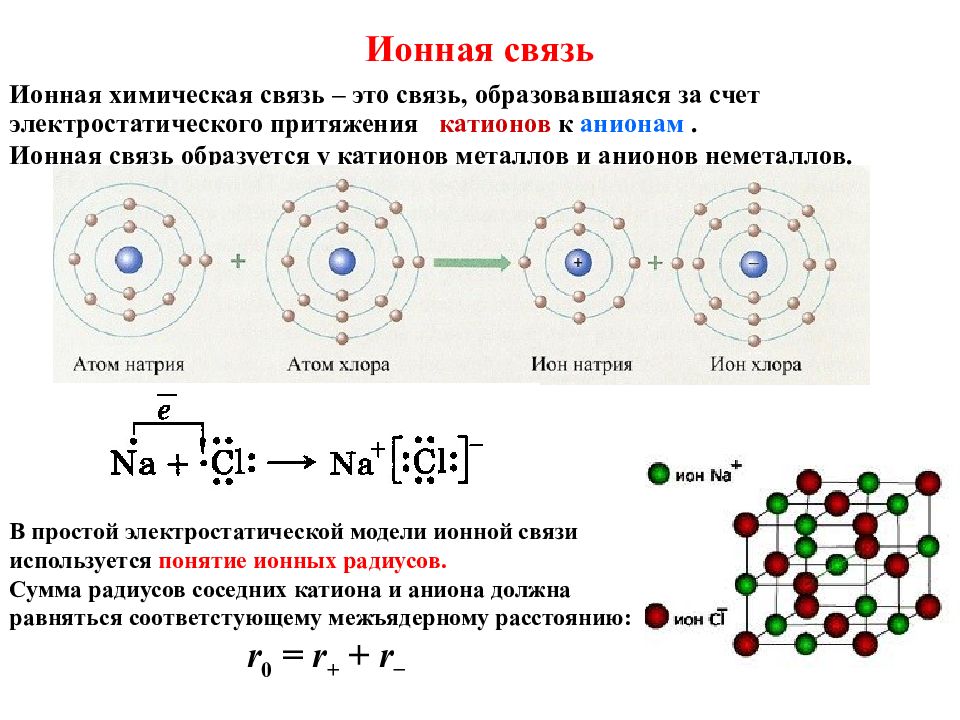
Слайд 18: Ионная связь
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам. Ионная связь образуется у катионов металлов и анионов неметаллов. В простой электростатической модели ионной связи используется понятие ионных радиусов. Сумма радиусов соседних катиона и аниона должна равняться соответстующему межъядерному расстоянию: r 0 = r + + r −
Слайд 19: Ионная связь
При возникновении ионной связи между двумя свободными ионами энергия их притяжения определяется законом Кулона: Энергия отталкивания ионов описывается уравнением Борна: где В - некоторая константа, n может принимать значения от 5 до 12 (зависит от размера ионов). Общая энергия определяется суммой энергий притяжения и отталкивания: Ее значение проходит через минимум. Координаты точки минимума отвечают равновесному расстоянию r 0 и равновесной энергии взаимодействия между ионами E 0.
Слайд 20: Металлическая связь
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность. Свободные электроны в кристаллической решетке металлов
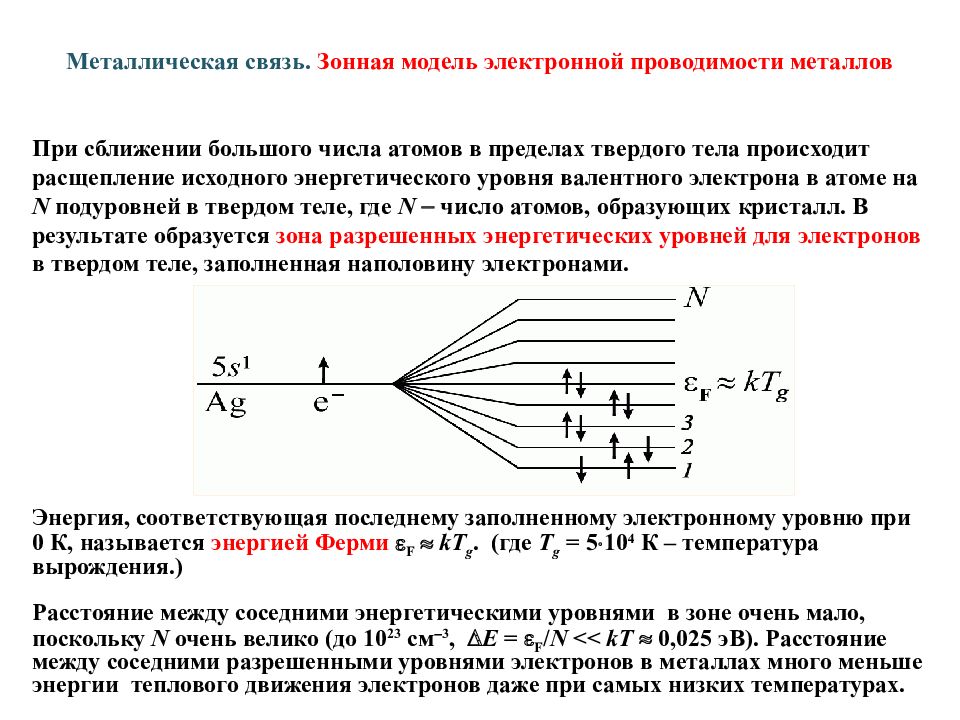
Слайд 21: Металлическая связь. Зонная модель электронной проводимости металлов
При сближении большого числа атомов в пределах твердого тела происходит расщепление исходного энергетического уровня валентного электрона в атоме на N подуровней в твердом теле, где N число атомов, образующих кристалл. В результате образуется зона разрешенных энергетических уровней для электронов в твердом теле, заполненная наполовину электронами. Энергия, соответствующая последнему заполненному электронному уровню при 0 К, называется энергией Ферми F kT g. (где T g = 5 10 4 К – температура вырождения.) Расстояние между соседними энергетическими уровнями в зоне очень мало, поскольку N очень велико (до 10 23 см 3, Е = F / N << kT 0,025 эВ). Расстояние между соседними разрешенными уровнями электронов в металлах много меньше энергии теплового движения электронов даже при самых низких температурах.
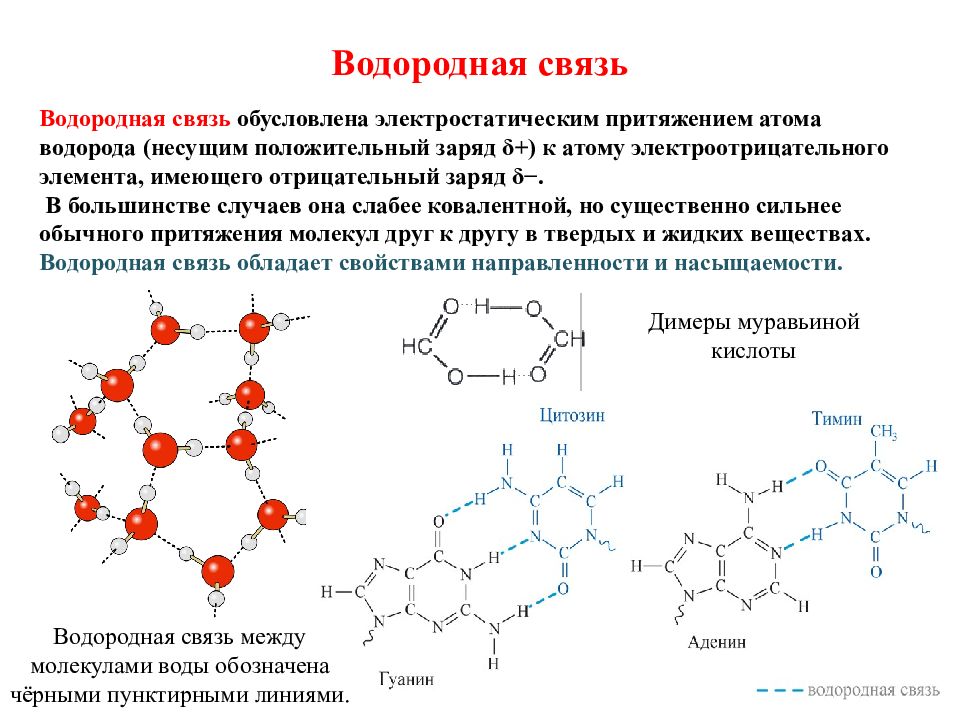
Слайд 22: Водородная связь
Водородная связь обусловлена электростатическим притяжением атома водорода (несущим положительный заряд δ +) к атому электроотрицательного элемента, имеющего отрицательный заряд δ −. В большинстве случаев она слабее ковалентной, но существенно сильнее обычного притяжения молекул друг к другу в твердых и жидких веществах. Водородная связь обладает свойствами направленности и насыщаемости. Димеры муравьиной кислоты Водородная связь между молекулами воды обозначена чёрными пунктирными линиями.
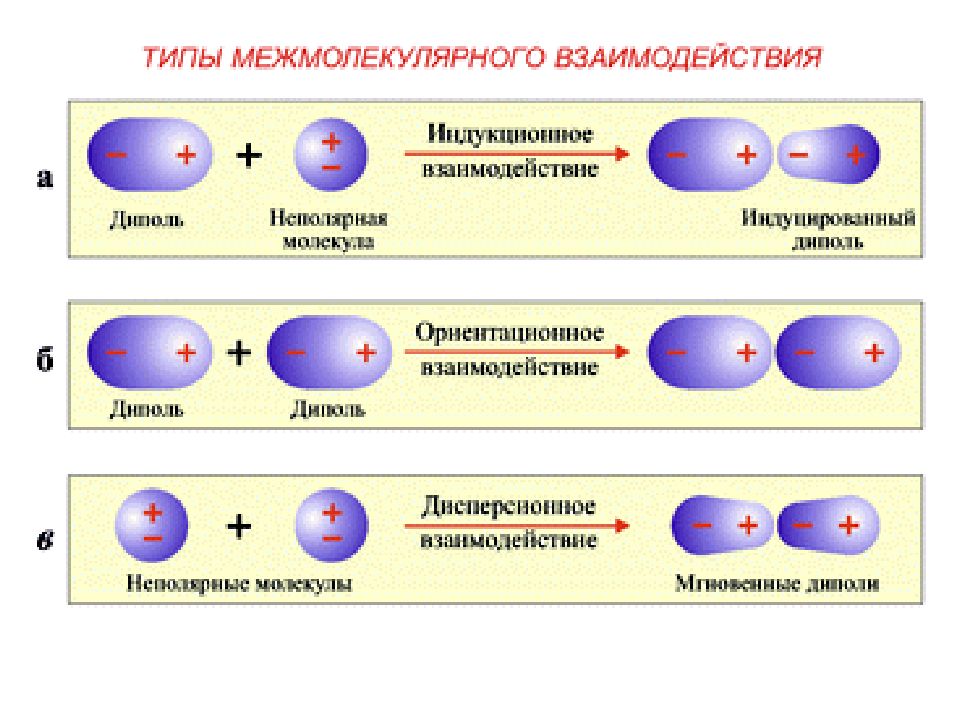
Слайд 23: Ван-дер-Ваальсоваясвязь
Ван-дер-ваальсова связь — тип химической связи, возникающей между поляризованными атомами или молекулами (электрическими диполями), является слабой связью и определяет строение некоторых кристаллов, например, молекулярных или инертных газов Различают 3 вида ван-дер-ваальсовых сил: силы ориентационные, возникающие вследствие взаимодействия дипольных моментов молекул и их взаимного ориентирования; силы индукционные, дополнительные к ориентационным силам, они возникают вследствие взаимного усиления или наведения дипольных моментов (напр., в результате воздействия полярных молекул на неполярные); силы дисперсионные - наиболее универсальные, возникающие как между атомами, так в молекулами на малом расстоянии и действующие только в сторону притяжения. Природа их состоит в синхронизации движения электронов и смещения ядер атомов, что ведет к возникновению меняющихся диполей. У благородных газов и некоторых молекул это единственные силы связи. Диполь-дипольное взаимодействие между молекулами