Первый слайд презентации: Лекция № 7. Химическая связь
Химическая связь – это взаимодействие атомов, приводящее к образованию молекул и кристаллов простых и сложных веществ и обеспечивающее их устойчивость.
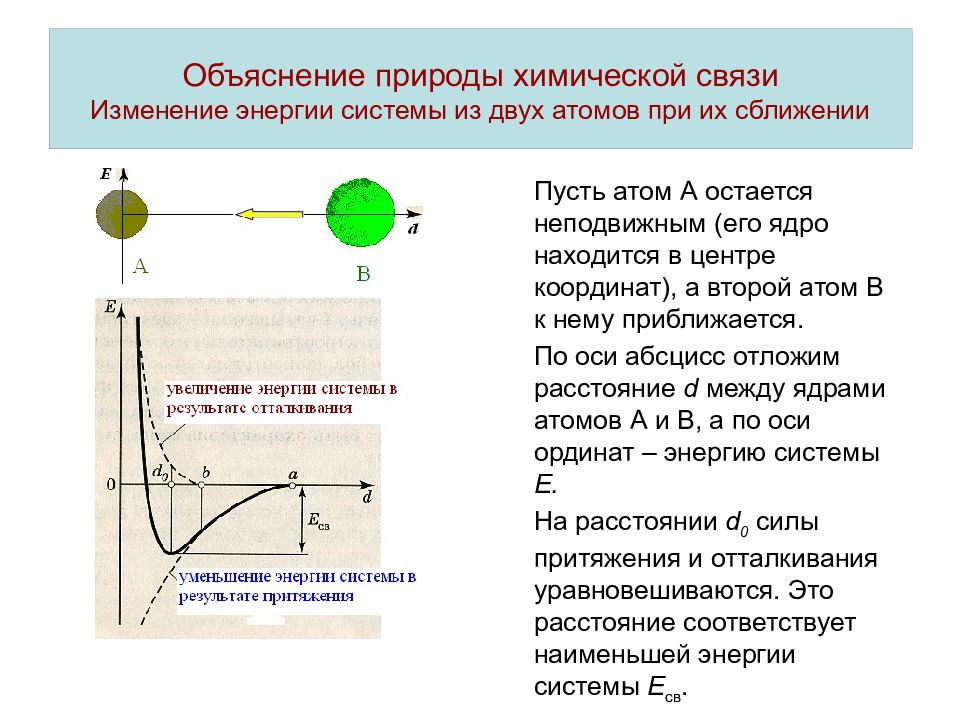
Слайд 2: Объяснение природы химической связи Изменение энергии системы из двух атомов при их сближении
Пусть атом А остается неподвижным (его ядро находится в центре координат), а второй атом В к нему приближается. По оси абсцисс отложим расстояние d между ядрами атомов А и В, а по оси ординат – энергию системы Е. На расстоянии d 0 силы притяжения и отталкивания уравновешиваются. Это расстояние соответствует наименьшей энергии системы Е св.
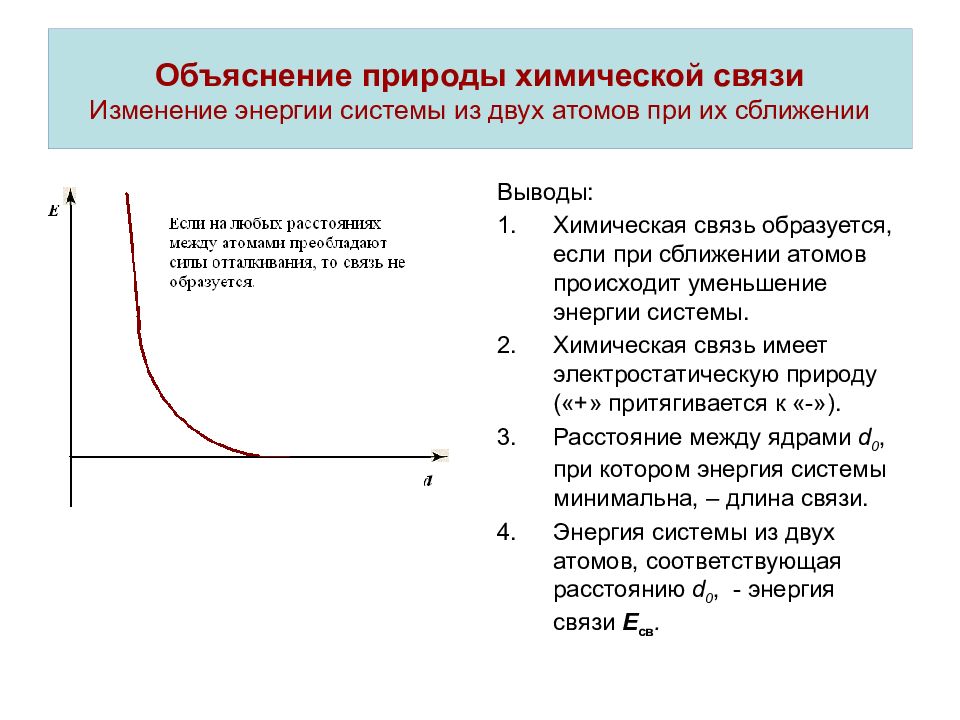
Слайд 3: Объяснение природы химической связи Изменение энергии системы из двух атомов при их сближении
Выводы: Химическая связь образуется, если при сближении атомов происходит уменьшение энергии системы. Химическая связь имеет электростатическую природу («+» притягивается к «-»). Расстояние между ядрами d 0, при котором энергия системы минимальна, – длина связи. Энергия системы из двух атомов, соответствующая расстоянию d 0, - энергия связи Е св.
Слайд 4: Типы химической связи Ионная связь
Два важнейших типа химической связи – ионная и ковалентная связь. Ионная связь – это связь между ионами.
Слайд 5: Типы химической связи Ковалентная связь
Ковалентная связь образуется одной или несколькими общими для двух атомов электронными парами.
Слайд 6: Оценка характера связи по разности электроотрицательностей элементов
Если разность электроотрицательностей Δ χ 1,75, то преобладает ионный характер связи. Если разность электроотрицательностей Δ χ 1,75, связь преимущественно ковалентная. LiF Δ χ = 4,0 – 1,0 = 3,0 ионная CCl 4 Δ χ = 3,0 – 2,5 = 0,5 ковалентная полярная Cl 2 Δ χ = 3,0 – 3,0 = 0 ковалентная Чисто ионной связи не существует. Чисто ковалентная связь реализуется только в молекулах, состоящих из одинаковых атомов. Кроме ионной и ковалентной связи различают еще металлическую, водородную и координационную связи.
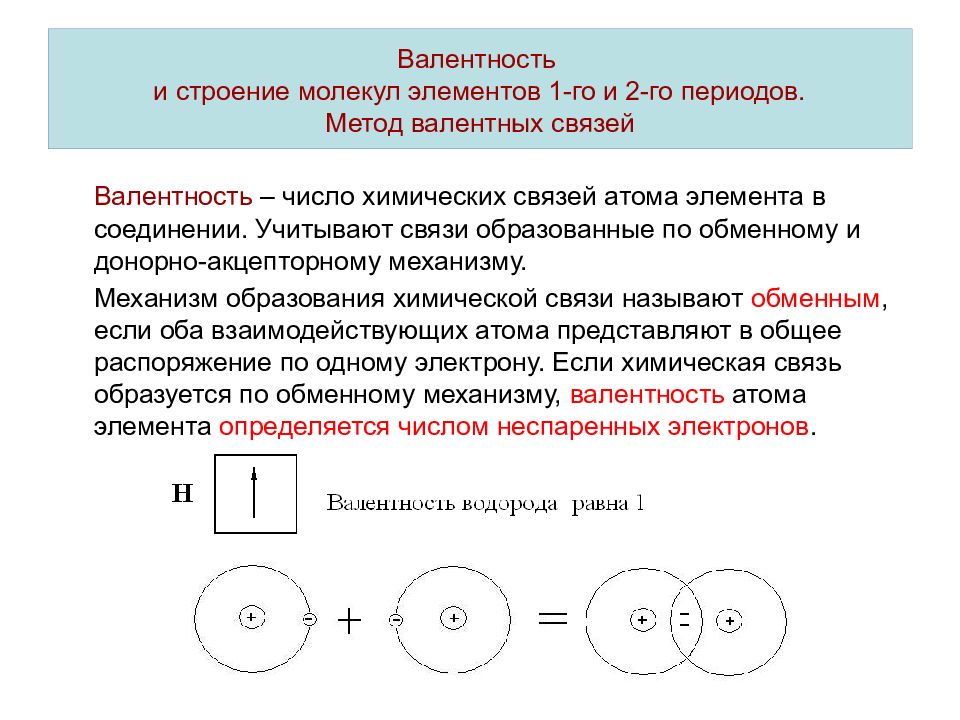
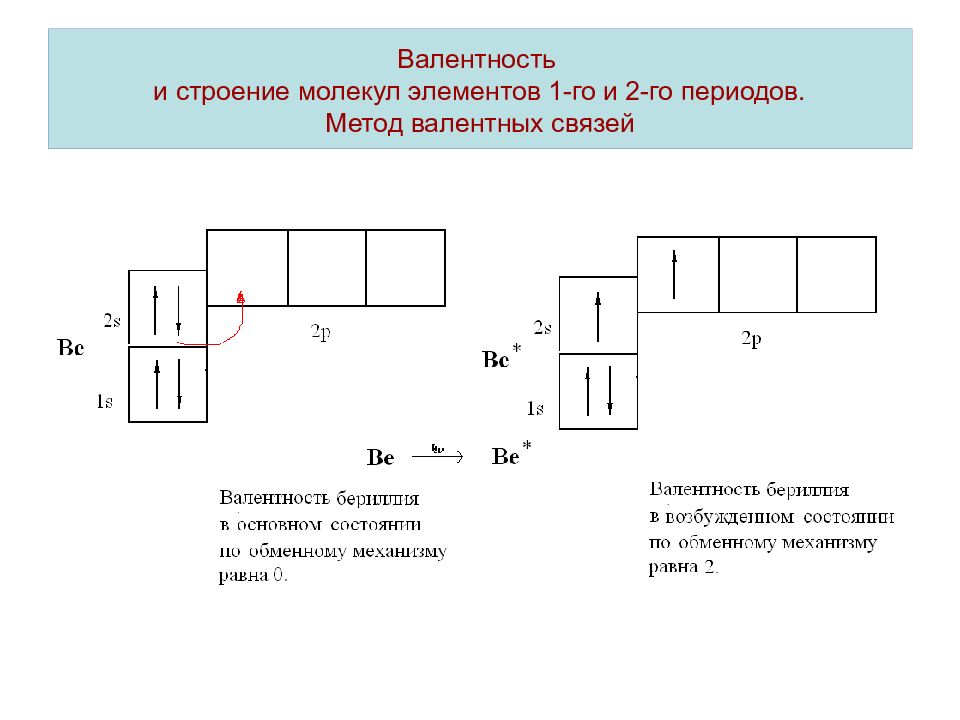
Слайд 7: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
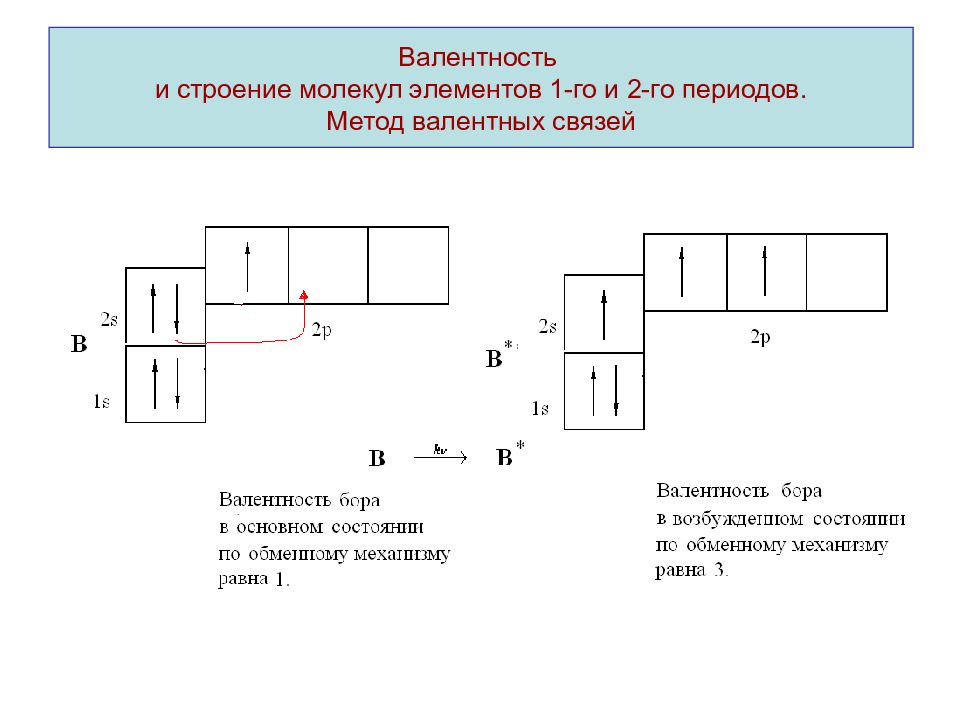
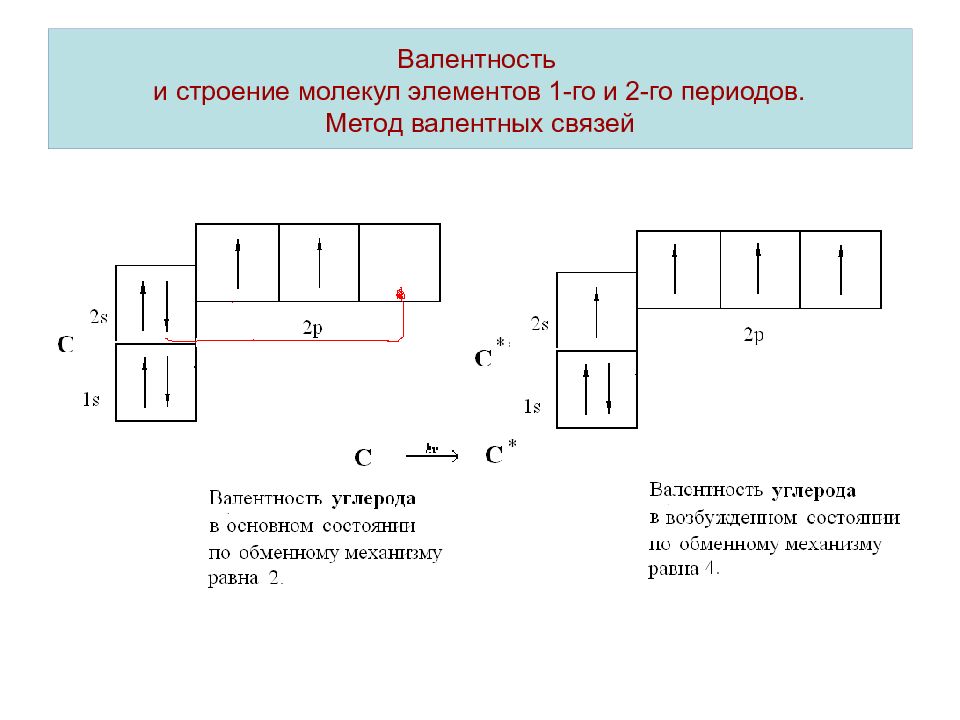
Валентность – число химических связей атома элемента в соединении. Учитывают связи образованные по обменному и донорно-акцепторному механизму. Механизм образования химической связи называют обменным, если оба взаимодействующих атома представляют в общее распоряжение по одному электрону. Если химическая связь образуется по обменному механизму, валентность атома элемента определяется числом неспаренных электронов.
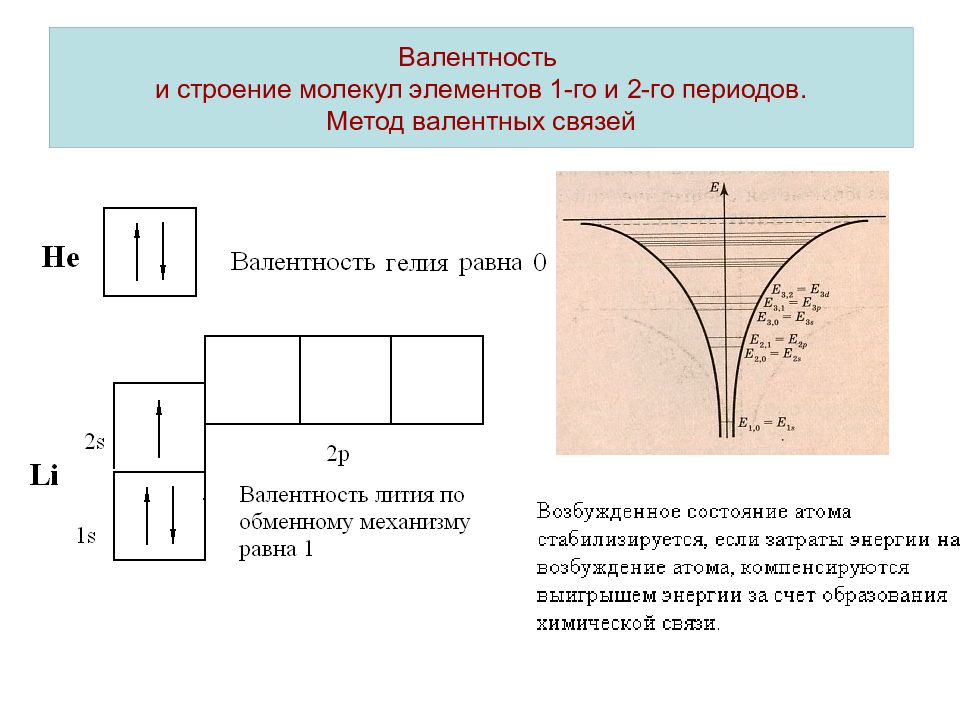
Слайд 8: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
Слайд 9: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
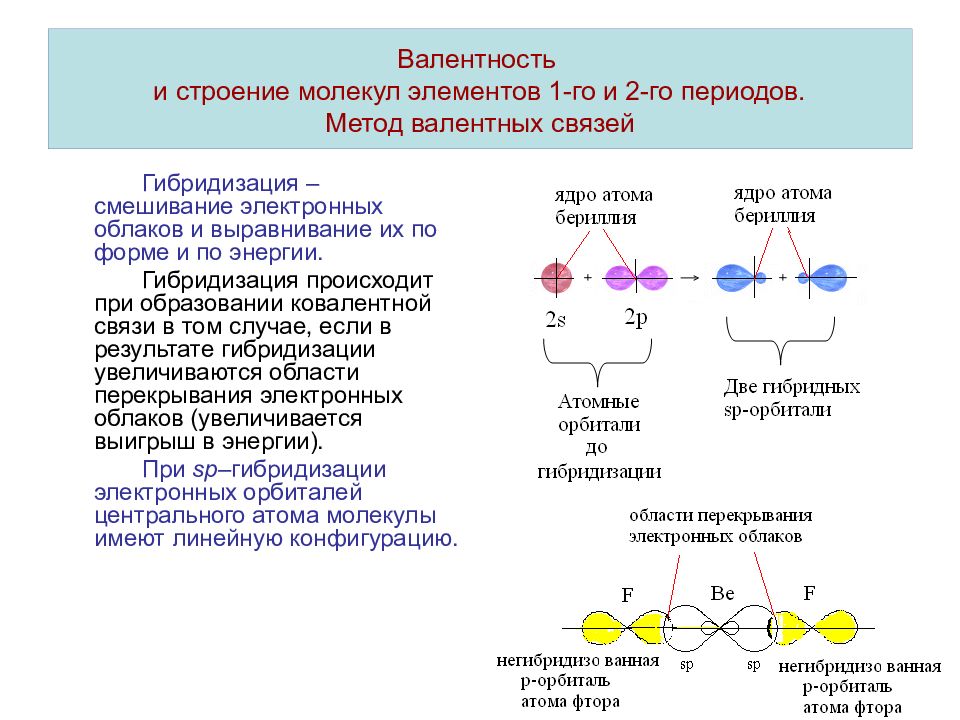
Слайд 10: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
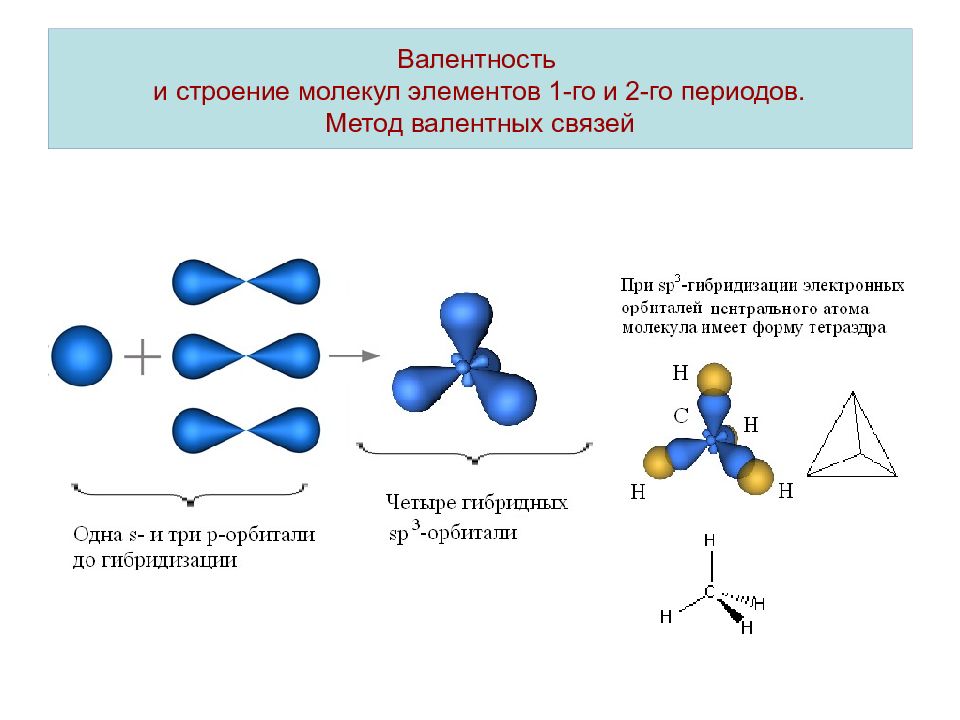
Гибридизация – смешивание электронных облаков и выравнивание их по форме и по энергии. Гибридизация происходит при образовании ковалентной связи в том случае, если в результате гибридизации увеличиваются области перекрывания электронных облаков (увеличивается выигрыш в энергии). При sp –гибридизации электронных орбиталей центрального атома молекулы имеют линейную конфигурацию.
Слайд 11: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
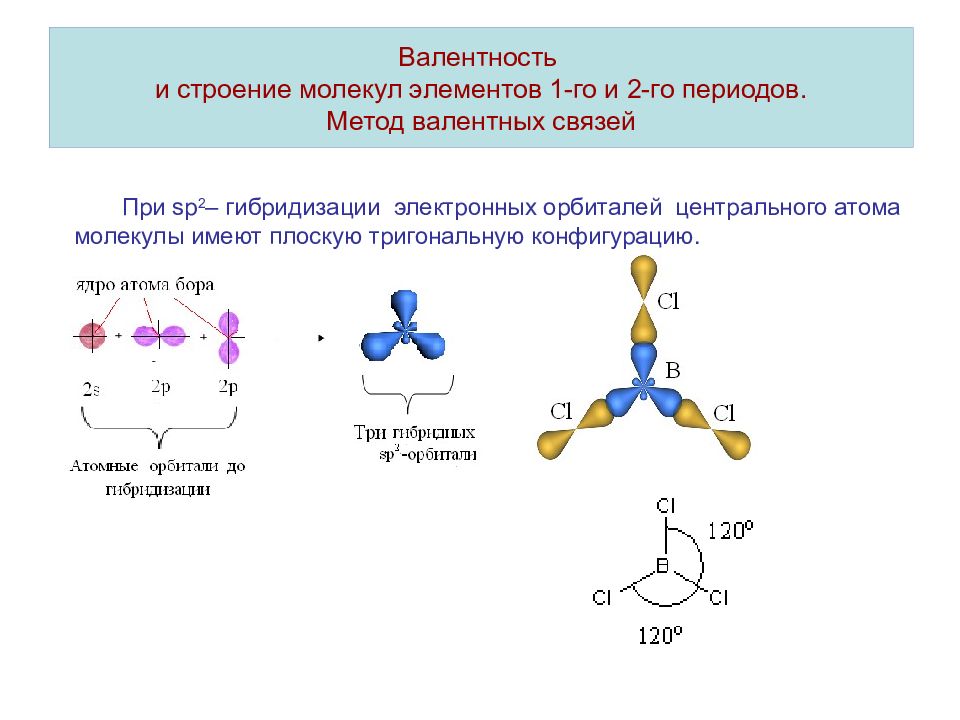
Слайд 12: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
При sp 2 – гибридизации электронных орбиталей центрального атома молекулы имеют плоскую тригональную конфигурацию.
Слайд 13: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
Слайд 14: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
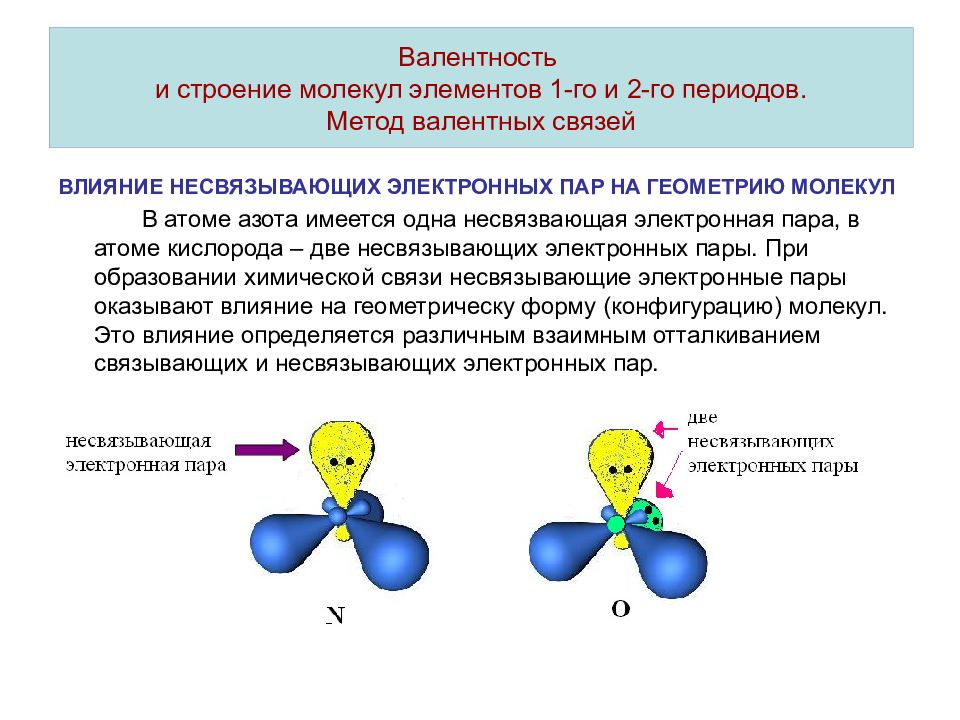
Слайд 15: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
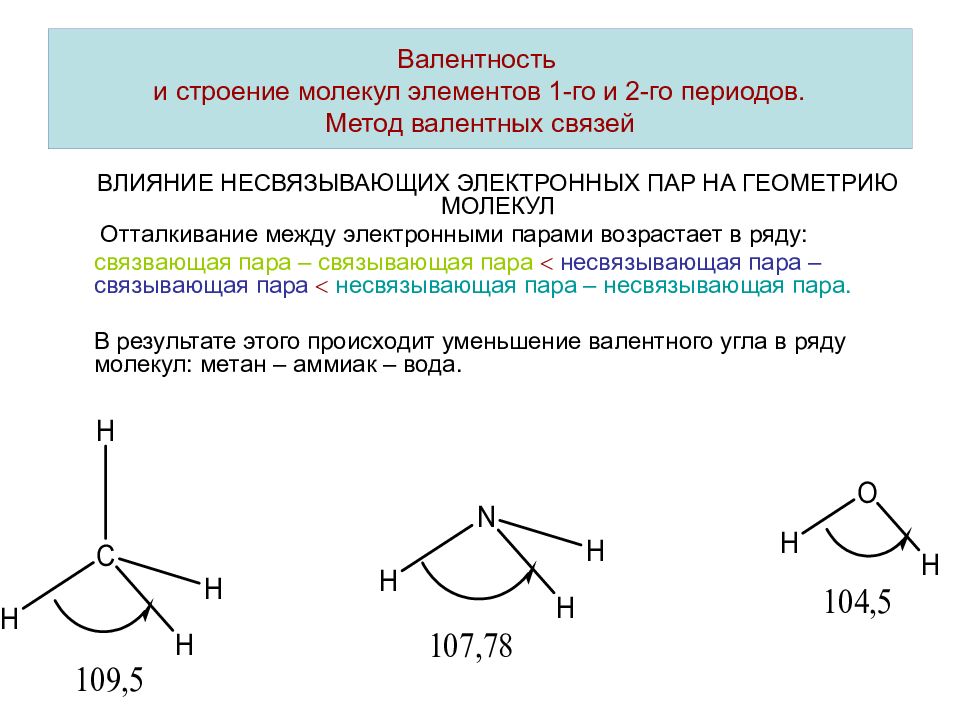
ВЛИЯНИЕ НЕСВЯЗЫВАЮЩИХ ЭЛЕКТРОННЫХ ПАР НА ГЕОМЕТРИЮ МОЛЕКУЛ В атоме азота имеется одна несвязвающая электронная пара, в атоме кислорода – две несвязывающих электронных пары. При образовании химической связи несвязывающие электронные пары оказывают влияние на геометрическу форму (конфигурацию) молекул. Это влияние определяется различным взаимным отталкиванием связывающих и несвязывающих электронных пар. Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
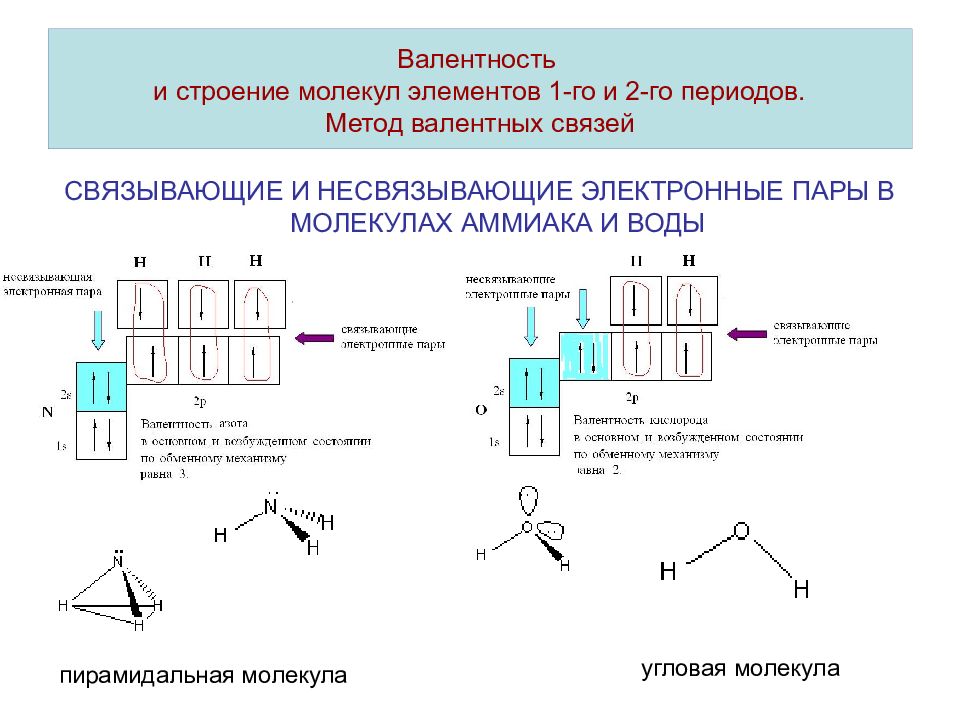
Слайд 16: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
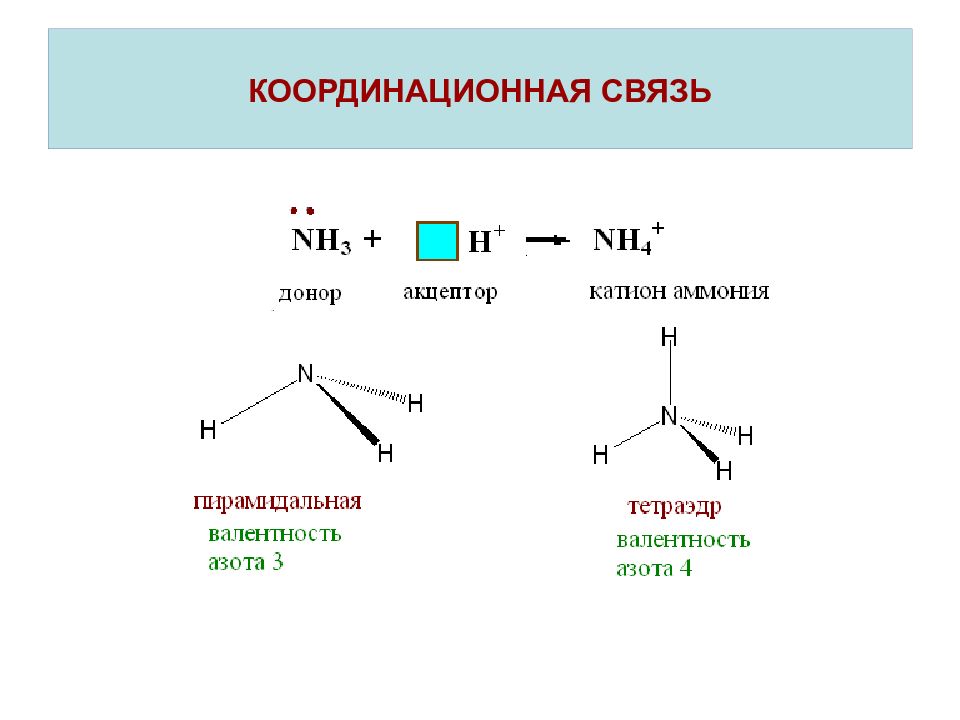
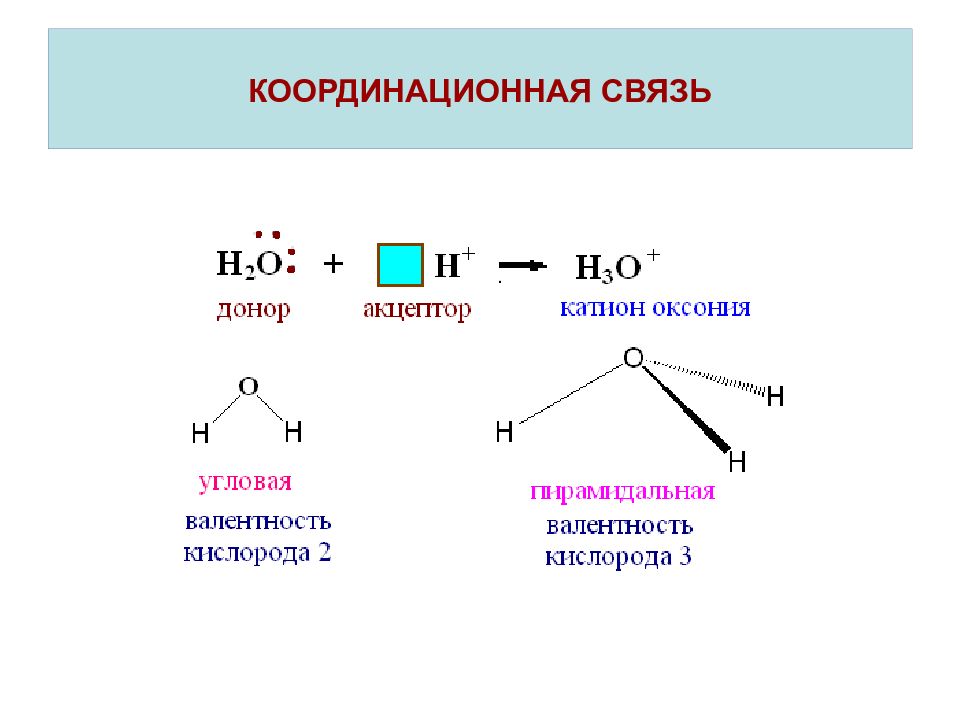
СВЯЗЫВАЮЩИЕ И НЕСВЯЗЫВАЮЩИЕ ЭЛЕКТРОННЫЕ ПАРЫ В МОЛЕКУЛАХ АММИАКА И ВОДЫ Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей пирамидальная молекула угловая молекула
Слайд 17: Валентность и строение молекул элементов 1-го и 2-го периодов. Метод валентных связей
ВЛИЯНИЕ НЕСВЯЗЫВАЮЩИХ ЭЛЕКТРОННЫХ ПАР НА ГЕОМЕТРИЮ МОЛЕКУЛ Отталкивание между электронными парами возрастает в ряду: связвающая пара – связывающая пара несвязывающая пара – связывающая пара несвязывающая пара – несвязывающая пара. В результате этого происходит уменьшение валентного угла в ряду молекул: метан – аммиак – вода.
Слайд 18: КРАТНЫЕ СВЯЗИ
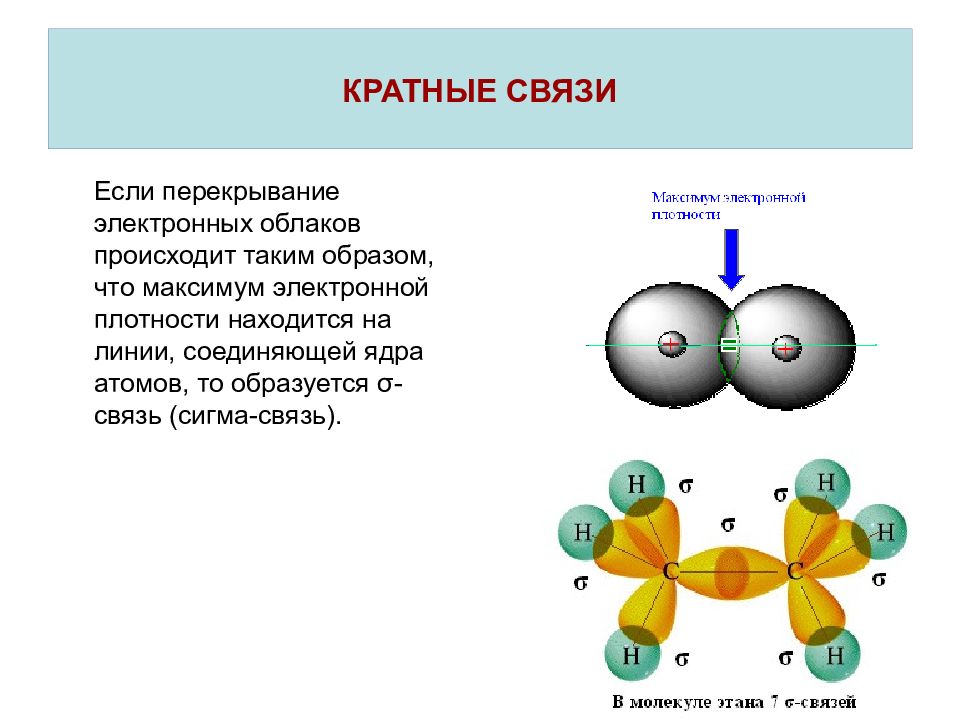
Если перекрывание электронных облаков происходит таким образом, что максимум электронной плотности находится на линии, соединяющей ядра атомов, то образуется σ -связь (сигма-связь).
Слайд 19: КРАТНЫЕ СВЯЗИ
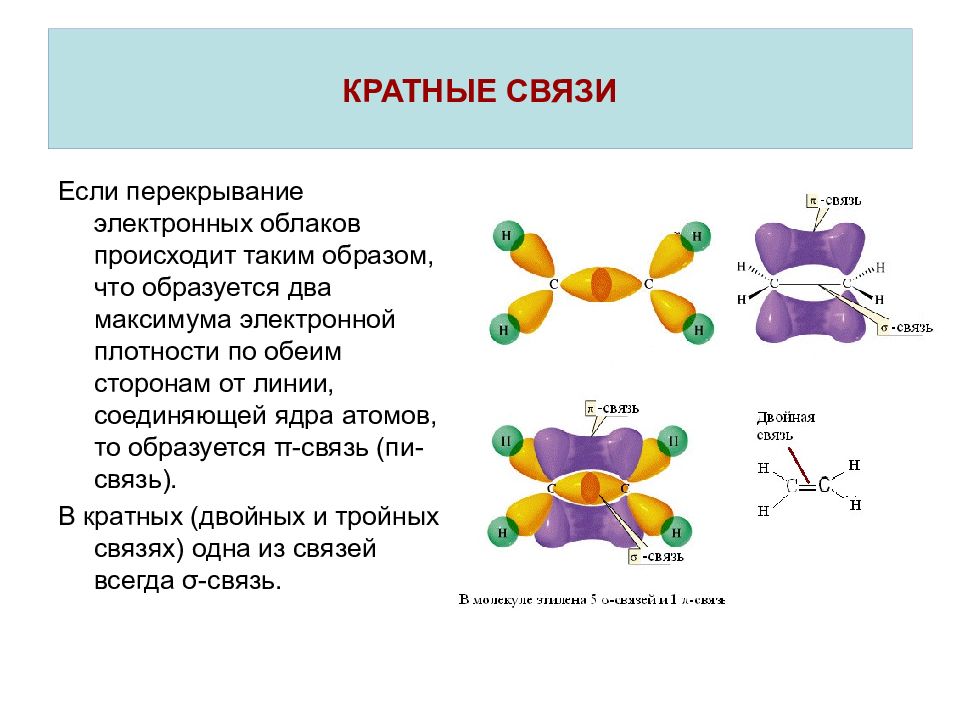
Если перекрывание электронных облаков происходит таким образом, что образуется два максимума электронной плотности по обеим сторонам от линии, соединяющей ядра атомов, то образуется π -связь (пи-связь). В кратных (двойных и тройных связях) одна из связей всегда σ -связь. КРАТНЫЕ СВЯЗИ
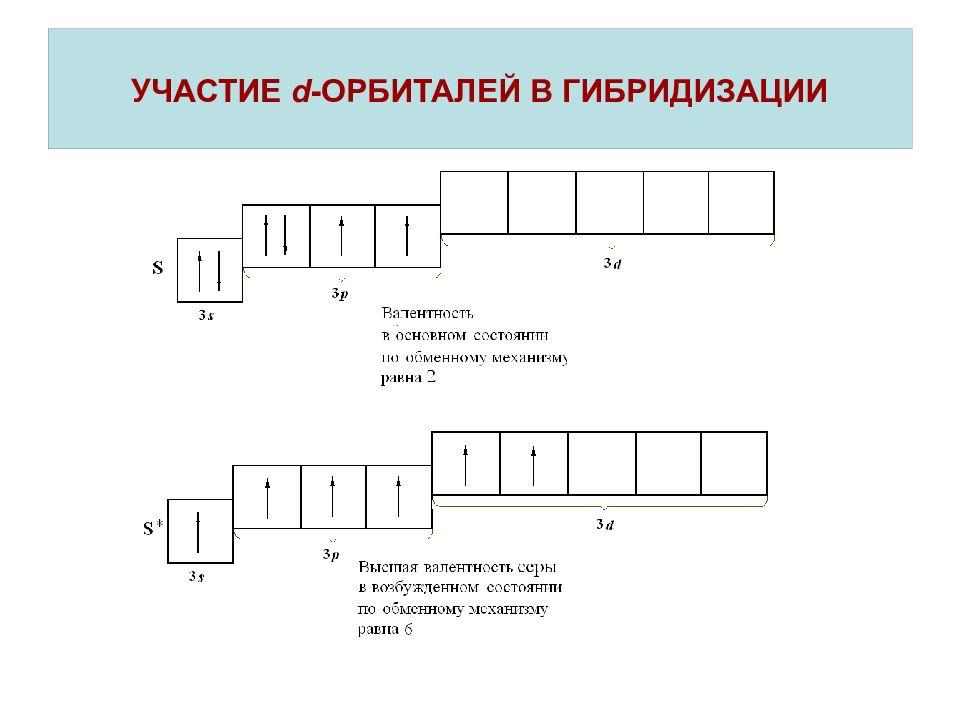
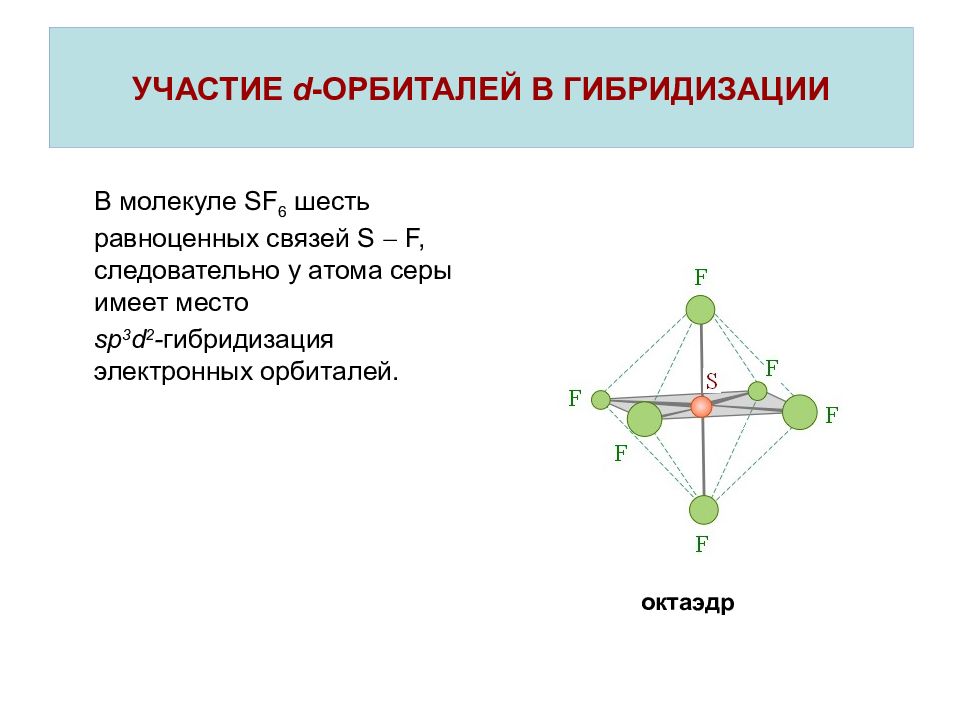
Слайд 21: УЧАСТИЕ d - ОРБИТАЛЕЙ В ГИБРИДИЗАЦИИ
В молекуле SF 6 шесть равноценных связей S F, следовательно у атома серы имеет место sp 3 d 2 - гибридизация электронных орбиталей. УЧАСТИЕ d - ОРБИТАЛЕЙ В ГИБРИДИЗАЦИИ октаэдр
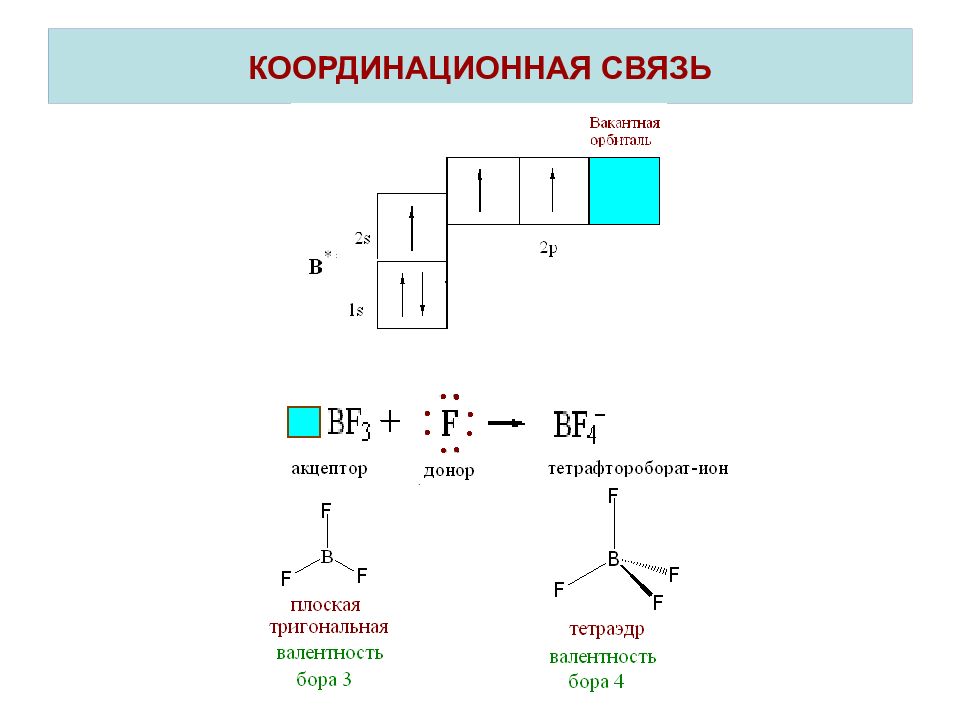
Слайд 22: КООРДИНАЦИОННАЯ СВЯЗЬ
Координационная связь – это ковалентная связь, которая образуется по донорно-акцепторному механизму. При наличии вакантных орбиталей ( □) молекула или ион проявляют свойства акцептора. Частица, предоставляющая при образовании химической связи в общее распоряжение электронную пару( ↑↓), называется донором. Таким образом, валентность атома зависит не только от числа неспаренных электронов, но и от наличия вакантных орбиталей и несвзывающих электронных пар.