Первый слайд презентации: Строение электронных оболочек атомов
Слайд 2
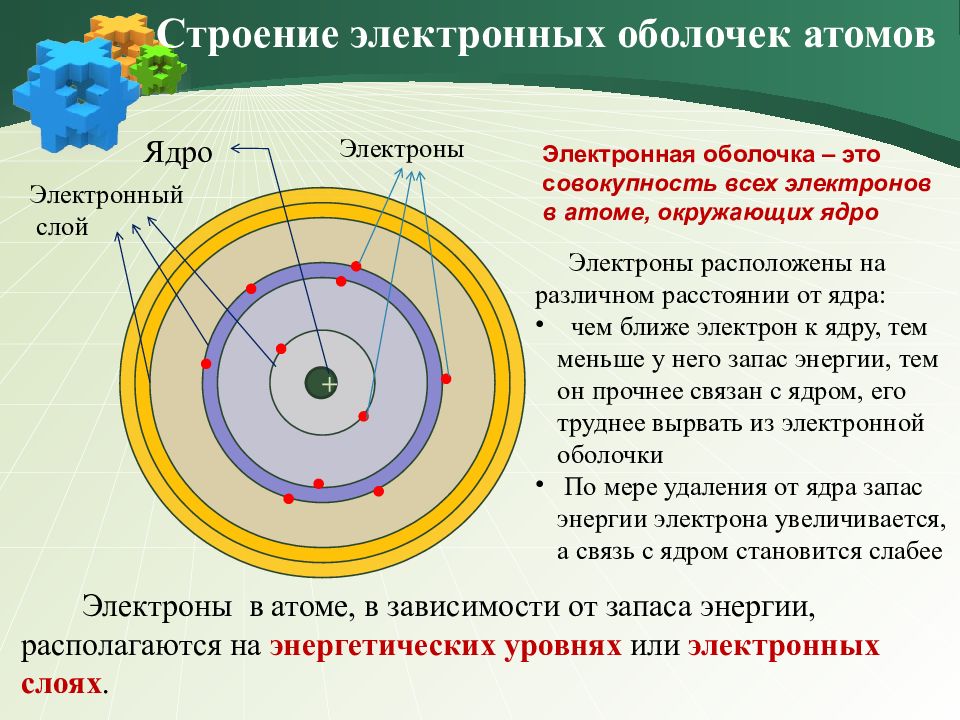
+ Ядро Э лектронный слой Строение электронных оболочек атомов Электроны расположены на различном расстоянии от ядра: чем ближе электрон к ядру, тем меньше у него запас энергии, тем он прочнее связан с ядром, его труднее вырвать из электронной оболочки По мере удаления от ядра запас энергии электрона увеличивается, а связь с ядром становится слабее Электроны Электронная оболочка – это с овокупность всех электронов в атоме, окружающих ядро Электроны в атоме, в зависимости от запаса энергии, располагаются на энергетических уровнях или электронных слоях.
Слайд 3: Строение электронных оболочек атомов
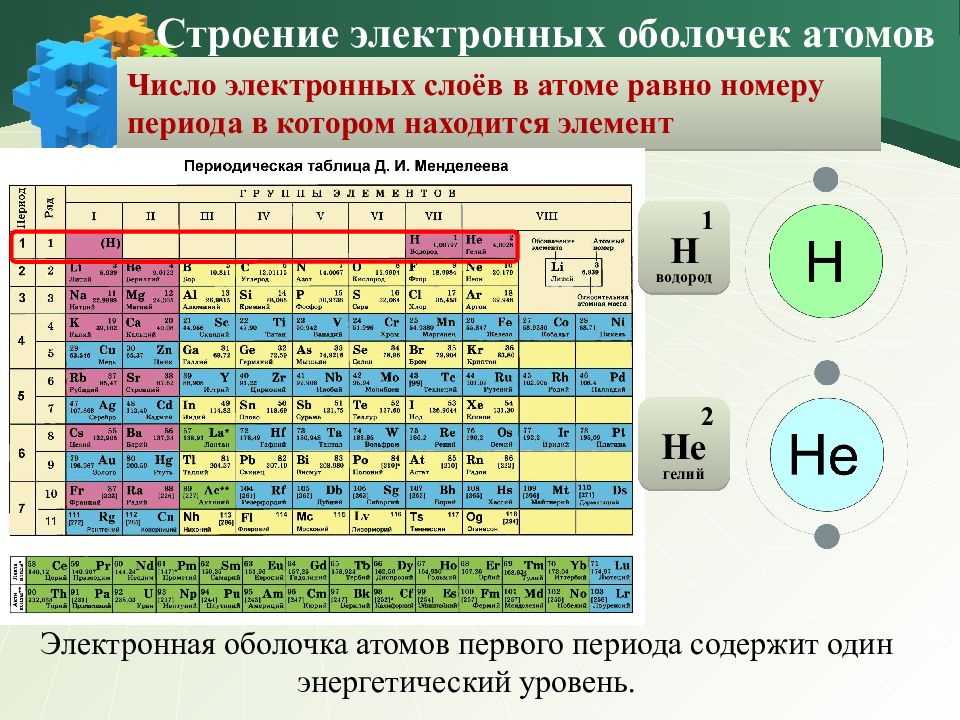
Число электронных слоёв в атоме равно номеру периода в котором находится элемент Строение электронных оболочек атомов Электронная оболочка атомов первого периода содержит один энергетический уровень. 1 Н водород 2 Не гелий
Слайд 4: Строение электронных оболочек атомов
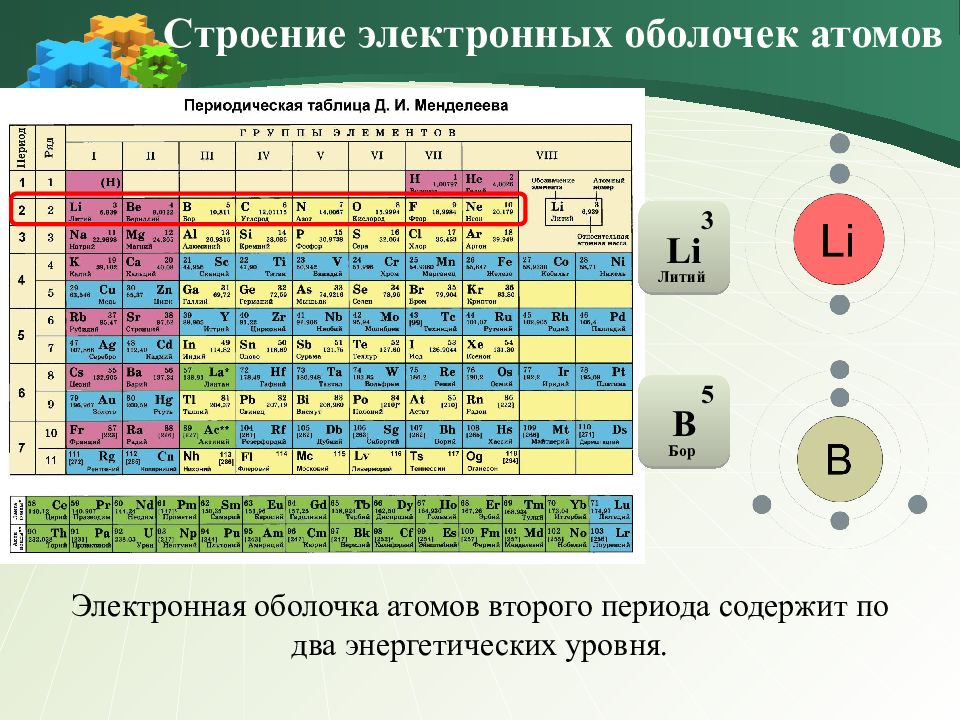
Электронная оболочка атомов второго периода содержит по два энергетических уровня. Строение электронных оболочек атомов 3 Li Литий 5 В Бор
Слайд 5
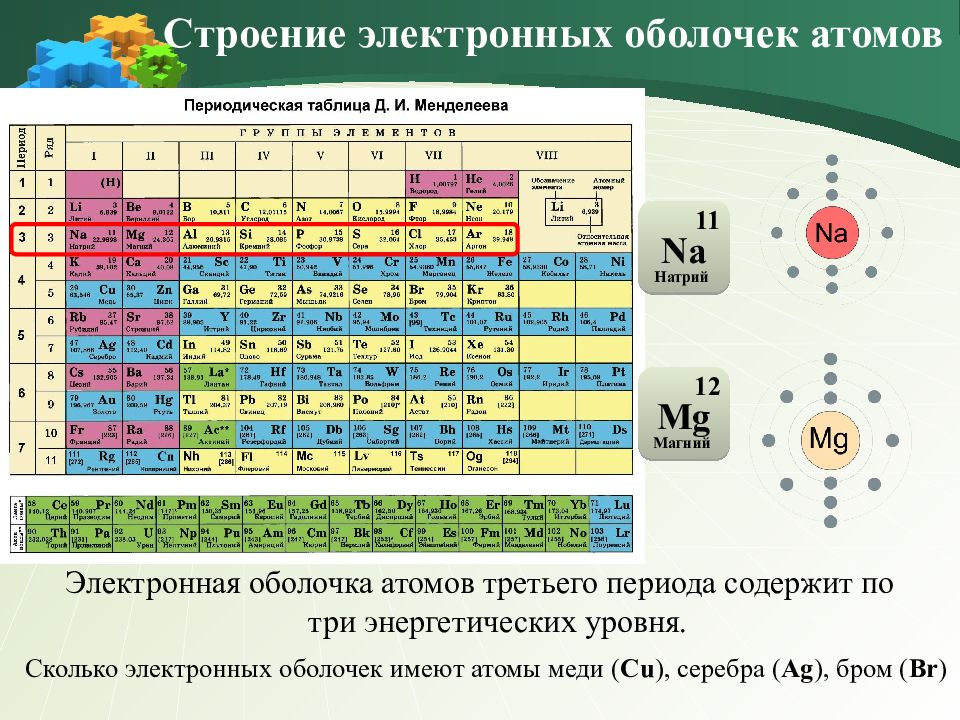
Электронная оболочка атомов третьего периода содержит по три энергетических уровня. Строение электронных оболочек атомов 11 Na Натрий 12 Mg Магний Сколько электронных оболочек имеют атомы меди ( Cu ), серебра ( Ag ), бром ( Br )
Слайд 6: Строение электронных оболочек атомов
Максимальное число электронов, находящихся на энергетическом уровне можно определить по следующей формуле: 1 эн.ур. : 2 • 1 2 = 2 2 эн.ур. : 2 • 2 2 = 8 3 эн.ур. : 2 • 3 2 = 18 4 эн.ур. : 2 • 4 2 = 32 Строение электронных оболочек атомов 2 n 2 номер энергетического уровня Энергетические уровни, содержащие максимальное число электронов, называются завершенными. Они обладают повышенной устойчивостью и стабильностью Энергетические уровни, содержащие меньшее число электронов, называются незавершенными
Слайд 7: Строение электронных оболочек атомов
Составим схемы строения электронных оболочек атомов химических элементов 1 периода Строение электронных оболочек атомов Н + 1 1 Не + 2 2 Составим схемы строения электронных оболочек атомов химических элементов 2 периода Li + 3 Be + 4 B + 5 C + 6 N + 7 O + 8 F + 9 Ne + 10 2 2 2 2 2 2 2 2 1 2 3 4 5 6 7 8
Слайд 8: Строение электронных оболочек атомов
Составим схемы строения электронных оболочек атомов химических элементов 3 периода Строение электронных оболочек атомов Na +1 1 Mg +1 2 Al +1 3 Ar +1 8 • • • Составим схемы строения электронных оболочек атомов химических элементов 4 периода K + 19 Ca + 20 Sc + 21 Ti + 22 • • • Cu + 29 Zn + 30 Ga + 30 2 2 2 2 2 2 2 2 2 2 2 8 8 8 8 8 8 8 8 8 8 8 1 2 3 8 1 2 2 2 2 2 3 • • • Kr + 36 2 8 8 18 18 18 17 10 9 8 8
Слайд 9: Строение электронных оболочек атомов
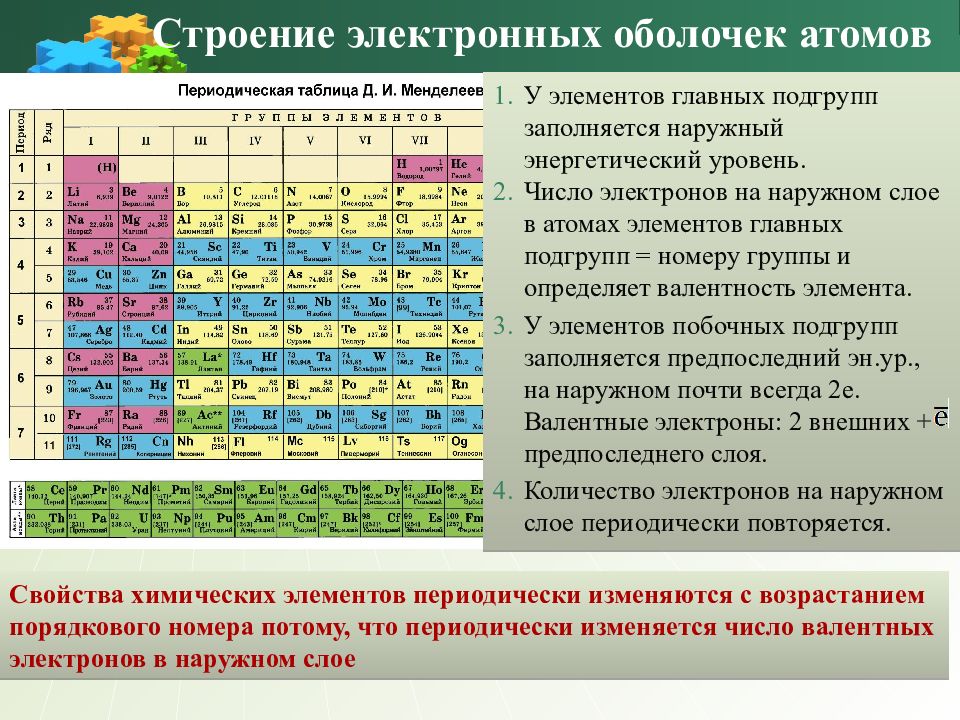
У элементов главных подгрупп заполняется наружный энергетический уровень. Число электронов на наружном слое в атомах элементов главных подгрупп = номеру группы и определяет валентность элемента. У элементов побочных подгрупп заполняется предпоследний эн.ур., на наружном почти всегда 2е. Валентные электроны: 2 внешних + предпоследнего слоя. Количество электронов на наружном слое периодически повторяется. Свойства химических элементов периодически изменяются с возрастанием порядкового номера потому, что периодически изменяется число валентных электронов в наружном слое
Слайд 10
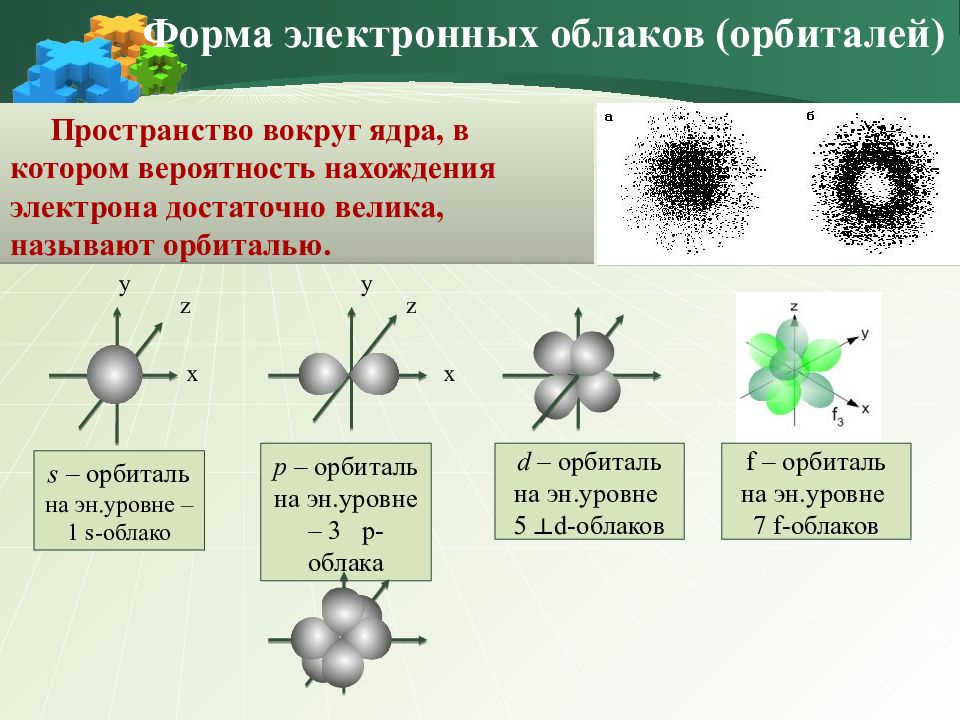
Пространство вокруг ядра, в котором вероятность нахождения электрона достаточно велика, называют орбиталью. Форма электронных облаков ( орбиталей ) z y x s – орбиталь на эн.уровне – 1 s -облако y x z р – орбиталь на эн.уровне – 3 р-облака d – орбиталь на эн.уровне 5 d -облаков ┴ f – орбиталь на эн.уровне 7 f -облаков
Слайд 11: Состояние электронов в атоме
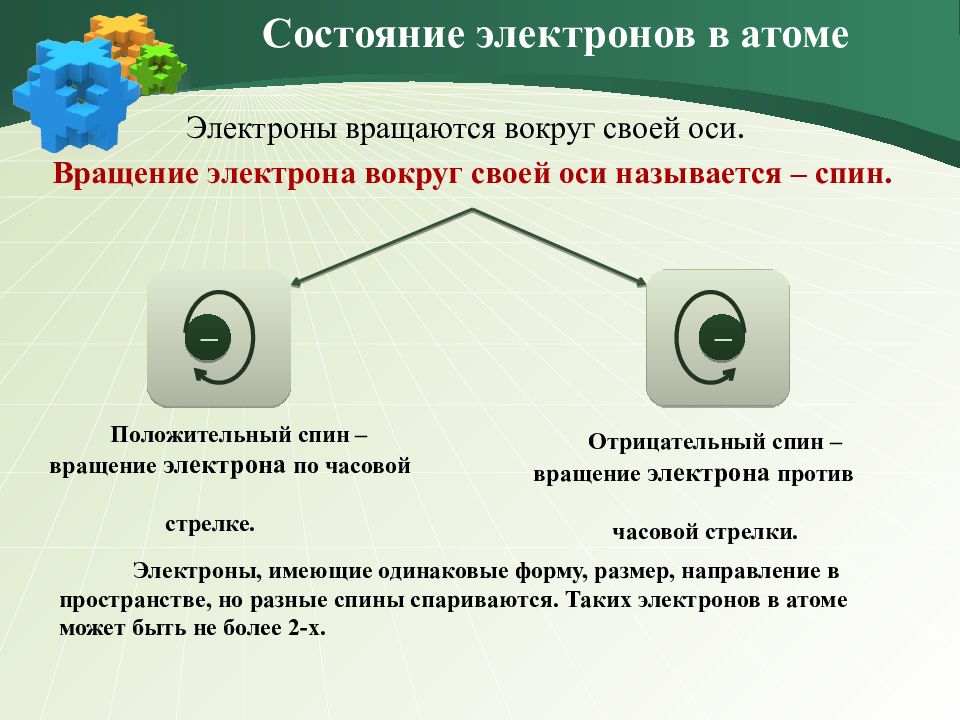
Электроны вращаются вокруг своей оси. Вращение электрона вокруг своей оси называется – спин. Состояние электронов в атоме Положительный спин – вращение электрона по часовой стрелке. ─ ─ Отрицательный спин – вращение электрона против часовой стрелки. Электроны, имеющие одинаковые форму, размер, направление в пространстве, но разные спины спариваются. Таких электронов в атоме может быть не более 2-х.
Слайд 12: Строение электронных оболочек атомов
Энергетические уровни делятся на подуровни: s, p, d, f. Число подуровней равно номеру уровня. Каждый новый уровень начинается с s -подуровня. 1 эн.ур. – 1 подуровень: s – 1 s- облако - 2 электрона 2 эн.ур. – 2 подуровня: s – 1 s- облако - 2 электрона р – 3р - облака - 6 электронов 3 эн.ур. – 3 подуровня: s – 1 s- облако - 2 электрона р – 3р - облака - 6 электронов d – 5 d- облаков - 10 электронов 4 эн.ур. – 4 подуровня s – 1 s- облако - 2 электрона р – 3р - облака - 6 электронов d – 5 d- облаков - 10 электронов f – 7 f- облаков - 14 электронов 1s < 2s < 2 p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f5d < 6p < 7s < 5f6d... Строение электронных оболочек атомов 8 электронов 18 электронов 32 электрона
Слайд 13
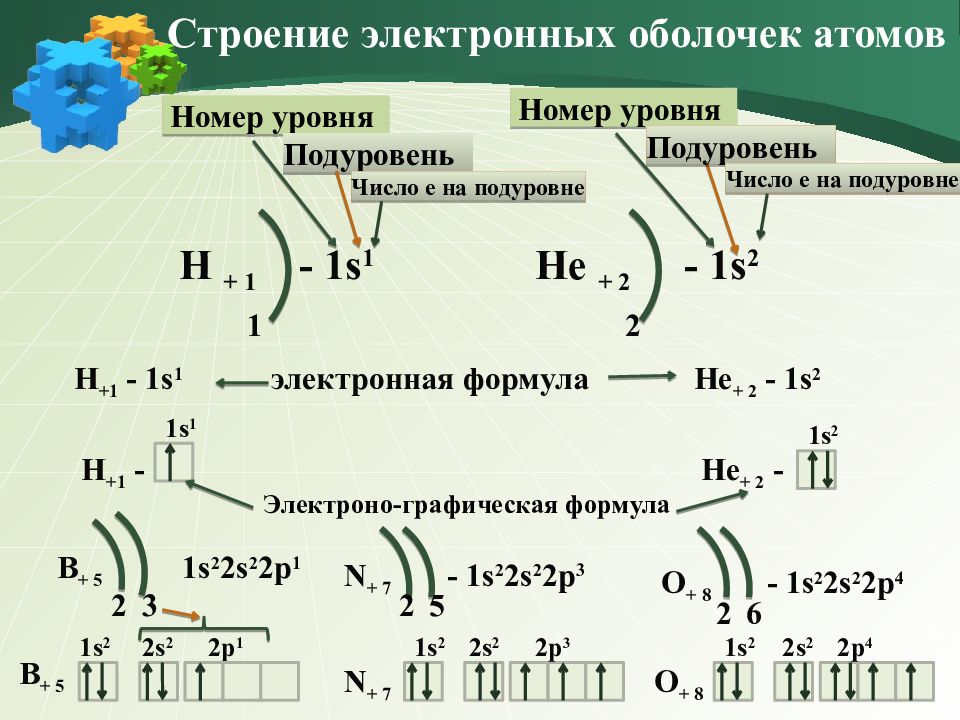
Электроно-графическая формула Строение электронных оболочек атомов Н + 1 - 1 s 1 1 Не + 2 - 1s 2 2 Номер уровня Подуровень Номер уровня Подуровень Число е на подуровне Число е на подуровне Н +1 - 1 s 1 электронная формула Н +1 - 1 s 1 Не + 2 - 1s 2 Не + 2 - 1s 2 B + 5 1s 2 2 s 2 2р 1 2 3 1s 2 2 s 2 2р 1 B + 5 N + 7 - 1s 2 2 s 2 2р 3 2 5 N + 7 1s 2 2 s 2 2р 3 O + 8 - 1s 2 2 s 2 2р 4 2 6 O + 8 1s 2 2 s 2 2р 4
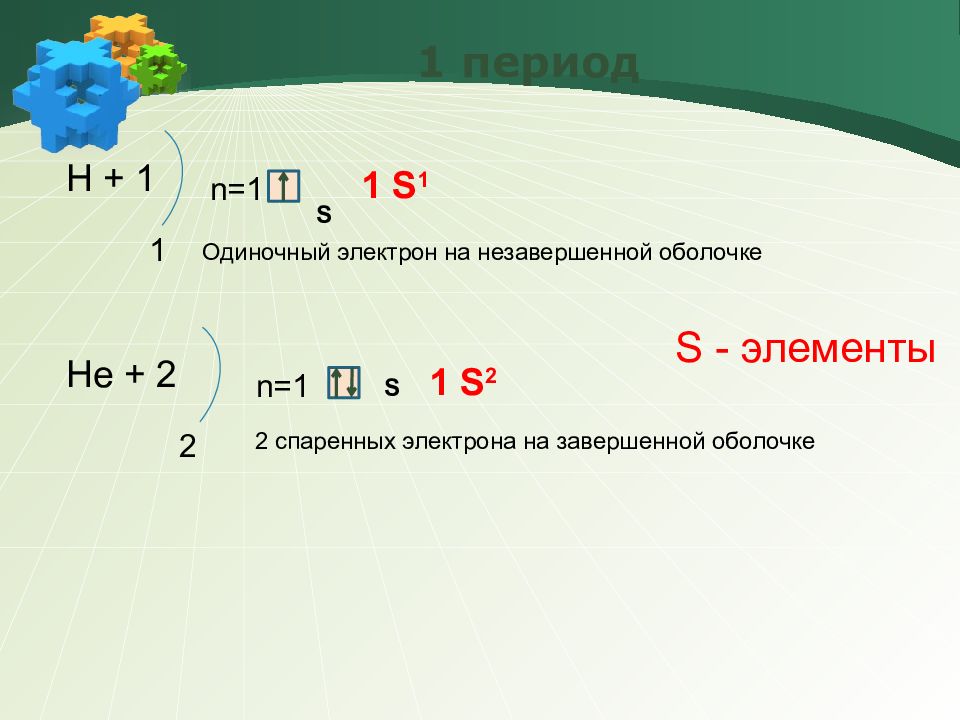
Слайд 14: 1 период
Н + 1 1 n=1 S 1 S 1 Н e + 2 2 n=1 S 1 S 2 Одиночный электрон на незавершенной оболочке 2 спаренных электрона на завершенной оболочке S - элементы
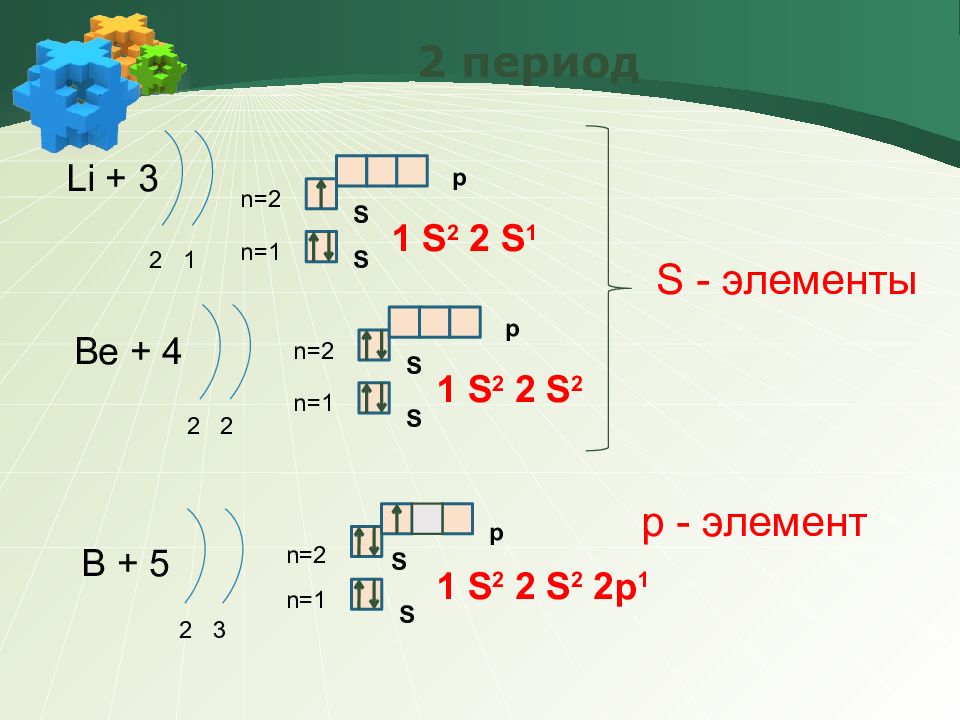
Слайд 15: 2 период
Li + 3 2 1 n=1 n=2 1 S 2 2 S 1 Be + 4 2 2 n=1 n=2 1 S 2 2 S 2 B + 5 2 3 n=1 n=2 1 S 2 2 S 2 2p 1 S - элементы р - элемент S S S S S S p p p
Слайд 16: 2 период
С + 6 2 4 n=1 n=2 N + 7 2 5 n=1 n=2 O + 8 2 6 n=1 n=2 1 S 2 2 S 2 2p 4 р - элементы 1 S 2 2 S 2 2p 2 1 S 2 2 S 2 2p 3 S S S S S S p p p
Слайд 17: 2 период
F + 9 2 7 n=1 n=2 Ne + 10 2 8 n=1 n=2 р - элементы 1 S 2 2 S 2 2p 5 1 S 2 2 S 2 2p 6 S S S S p p http:// www.alhimik.ru/stroenie/gl_3.html
Последний слайд презентации: Строение электронных оболочек атомов: Домашнее задание
Посмотреть видео https:// www.youtube.com/watch?v=F1D4zAXH-08 https://www.youtube.com/watch?v=z5HvF8MdmHk Ознакомится с материалом на сайте. Рассмотреть пример решения заданий (см. изображение) https:// www.youtube.com/watch?v=F1D4zAXH-08 https://vk.com/@ repetitor_po_himii_i_biologii-stroenie-atoma-ege-oge ДЗ: пар.31 изучить. Записать электронную конфигурацию элементов № 13, 19, 21, 26 (пример смотри в видео или на сайте) Домашнее задание.