Первый слайд презентации: Лекция № 13 Механизм химических реакций. Энергия активации. Цепные реакции
Энергия активации. Распределение Больцмана Теория активированного комплекса Цепные реакции
Элементарная стадия (акт) – превращение одной или нескольких находящихся в контакте частиц (ионов, радикалов, атомов, молекул) в другие частицы. Механизм реакций – это совокупность элементарных стадий, из которых складывается процесс превращения исходных веществ в продукты реакции. Частицы, которые способны осуществлять элементарный акт химического взаимодействия, должны обладать некоторой энергией, которую называют энергией активации (Е акт,, Е * ). Е акт – это избыточное количество энергии по сравнению с некоторой средней величиной, которой должна обладать реагирующая частица, чтобы осуществить химическую реакцию. Это избыток внутренней энергии системы. Между константой скорости реакции и энергией активации существует связь, которая выражается уравнением Аррениуса.
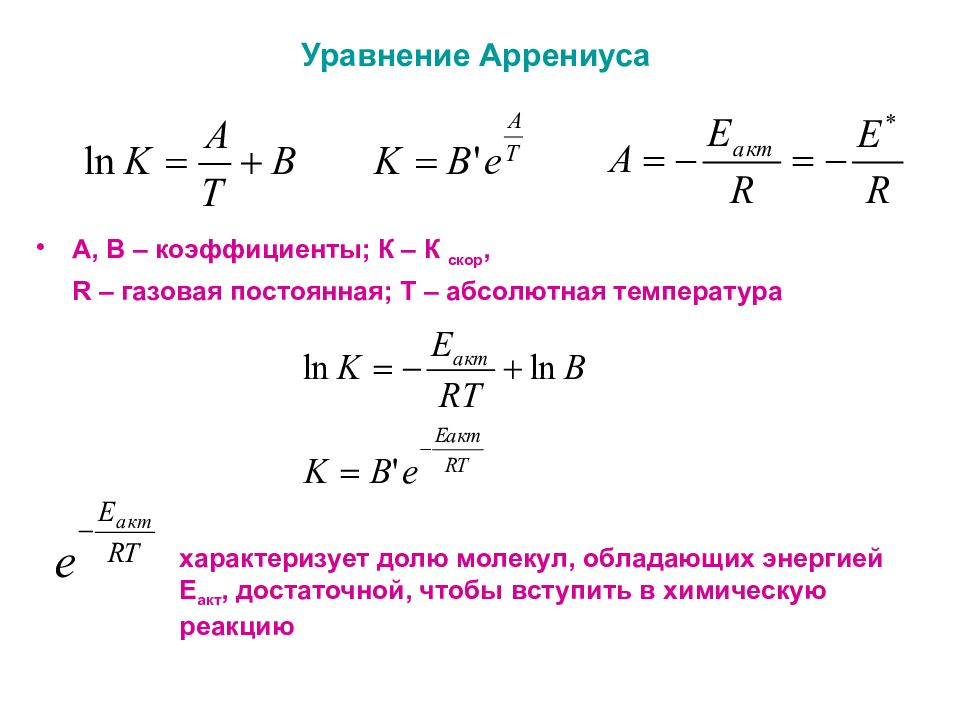
Слайд 3: Уравнение Аррениуса
А, В – коэффициенты; К – К скор, R – газовая постоянная; Т – абсолютная температура характеризует долю молекул, обладающих энергией Е акт, достаточной, чтобы вступить в химическую реакцию
Слайд 4
k ( v ) lnK 1/T T k v α Рост температуры способствует ускорению химической реакции. Существует эмпирическое правило: При повышении температуры на 10 0 С скорость реакции удваивается. Это происходит за счёт роста доли активных частиц и числа столкновений между ними. Е акт химической реакций ~ 80-240 кДж/моль Е акт с участием радикалов ~ 0÷60 кДж/моль Если Е частиц ≥ Е акт – реакция идёт Е част < Е акт – реакция не пойдёт.
Слайд 5
Распределение Больцмана E Т 2 Т 1 N * - число активных частиц N – общее число частиц. - доля молекул с энергией в интервале Δ E Т 2 >Т 1 Доля активных молекул колеблется от 10 -10 до 10 -20 E акт
Слайд 6
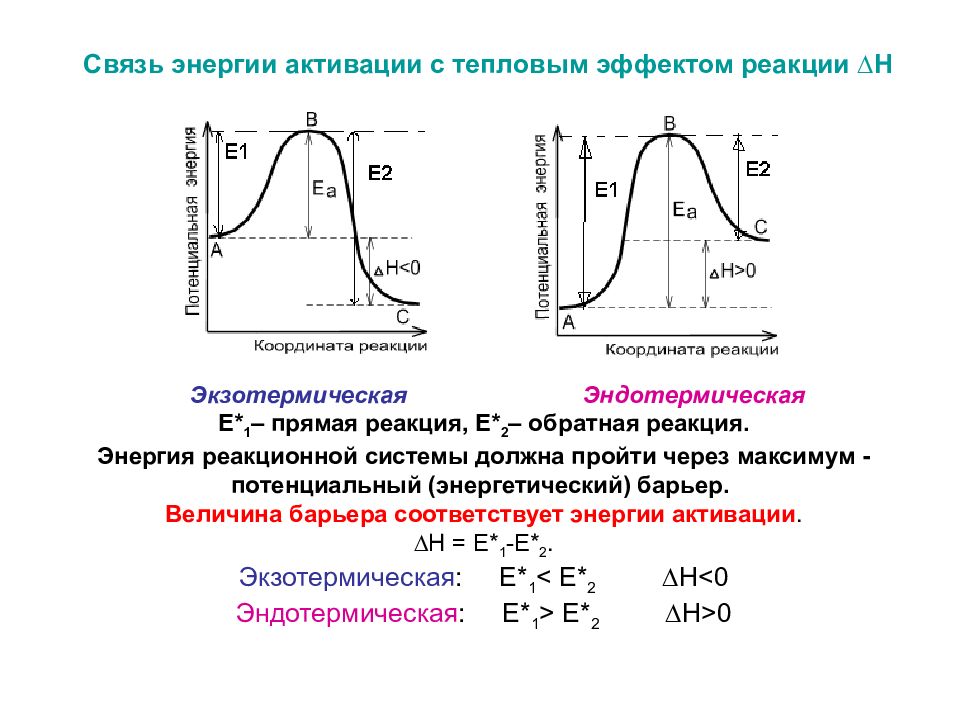
Связь энергии активации с тепловым эффектом реакции ∆Н Экзотермическая Эндотермическая Е* 1 – прямая реакция, Е* 2 – обратная реакция. Энергия реакционной системы должна пройти через максимум - потенциальный (энергетический) барьер. Величина барьера соответствует энергии активации. ∆Н = Е* 1 -Е* 2. Экзотермическая : Е* 1 < Е* 2 ∆Н<0 Эндотермическая : Е* 1 > Е* 2 ∆Н>0
Слайд 7
Энергия активации есть избыточное количество энергии, которым должна обладать реагирующая частица для преодоления потенциального барьера, разделяющего исходное и конечное состояние системы. Туннельный эффект – переход системы из исходного в конечное состояние, минуя вершину потенциального барьера при E<E акт (квантово-механическое вероятностное явление, не имеющее аналогов в классической физике) Наличие молекул с E>E акт - необходимое, но недостаточное условие для протекания реакции. Требуется еще соударение молекул и их определенное расположение друг относительно друга.
Состояние системы, соответствующей (∙) В, называют переходным состоянием или активированным комплексом. Реакция АВ+Д → А+ВД Система должна пройти через переходное состояние, когда расстояние между атомами А и В будут того же порядка, что и между атомами В и Д. На это тратится энергия. АВ+Д ↔[АВД]*→А+ВД Возможность образования активированного комплекса определяется числом столкновений между частицами. Активированный комплекс не является реальным промежуточным соединением. Он представляет собой молекулу в процессе разрыва старых и образования новых связей. Реакция образования активированного комплекса обратимая, а его разрушения – односторонняя необратимая.
Слайд 9: Понятие об активированном комплексе введено Генри Эйрингом
Теория об активированном комплексе базируется на 2-х представлениях: 1. Исходные вещества находятся в равновесии с активированным комплексом 2. Скорость реакции отождествляется со скоростью распада активированного комплекса Чем больше концентрация активированного комплекса, тем больше скорость образования продуктов реакции
Не всякие столкновения приводят к химическим превращениям, а лишь эффективные столкновения – такие столкновения, при которых химическая энергия контактирующих частиц достаточна для преодоления потенциального барьера. Стерический фактор – ориентация молекул друг относительно друга. Он определяется полярностью связей, временем сближения молекул и наличием нескомпенсированных электрических зарядов. Это вероятностная величина. P – стерический фактор z – число эффективных столкновений. В’= Pz – предэкспоненциальный множитель, зависит от температуры. Р для реакций атомов и однородных молекул =1 Р для сложных молекул и радикалов ~10 -6 ÷10 -3.
Слайд 11: 3. Цепные реакции
Цепные реакции характеризуются возникновением в каждом элементарном акте активной частицы, что вызывает цепь превращений исходных веществ в продукты. Создатель современного учения о цепных реакциях – Николай Николаевич Семенов (Нобелевская премия по химии 1956 г.) Институт химической физики РАН им. Н.Н. Семенова
Слайд 12: 3. Цепные реакции (продолжение)
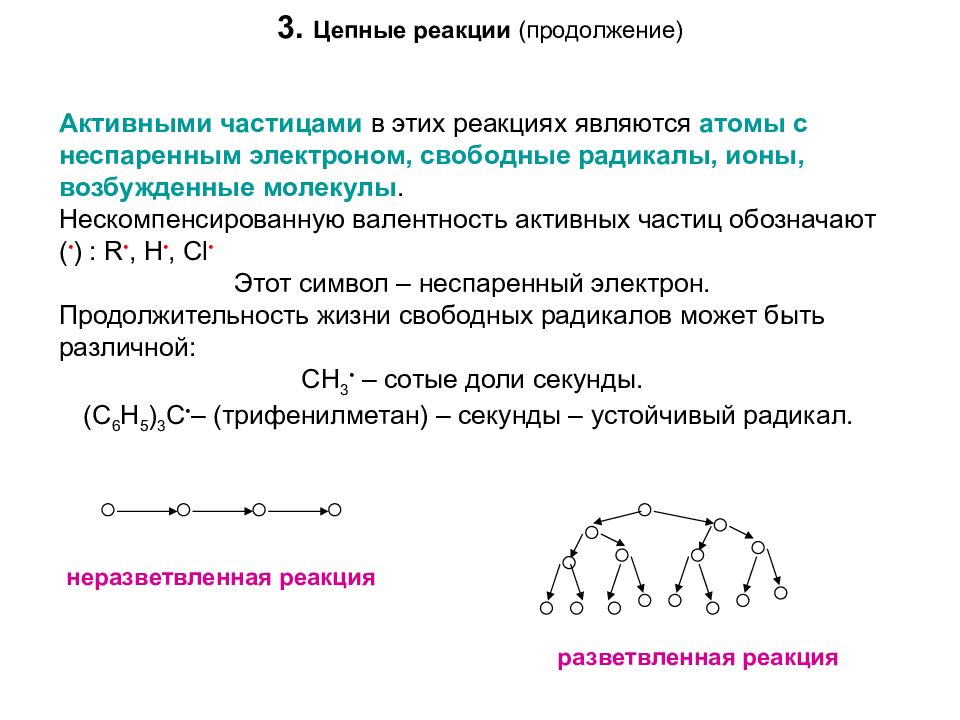
Активными частицами в этих реакциях являются атомы с неспаренным электроном, свободные радикалы, ионы, возбужденные молекулы. Нескомпенсированную валентность активных частиц обозначают ( • ) : R •, Н •, Cl • Этот символ – неспаренный электрон. Продолжительность жизни свободных радикалов может быть различной: CH 3 • – сотые доли секунды. (С 6 H 5 ) 3 C • – (трифенилметан) – секунды – устойчивый радикал. неразветвленная реакция разветвленная реакция
Слайд 13
Любая цепная реакция состоит из 3-х стадий: 1. Зарождение цепи 2. Продолжение цепи 3. Обрыв цепи 1. Зарождение цепи : а) CH 3 COH + 1/2О 2 →С H 3 СО • +НО • цепное окисление уксусного альдегида б) хлорирование в газовой среде Cl 2 → Cl • + Cl • или С l 2 →2 Cl • в) инициаторы – перекисные соединения K 2 S 2 O 8 → 2 K + +2 SO 4 •-
Слайд 14
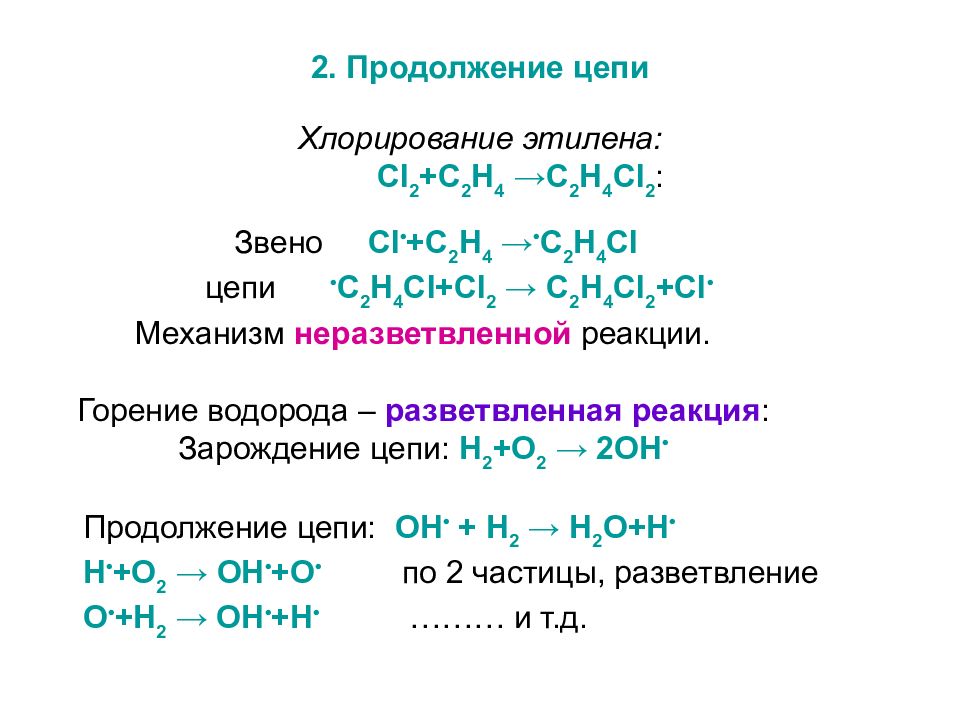
2. Продолжение цепи Хлорирование этилена: Cl 2 + C 2 H 4 → C 2 H 4 Cl 2 : Звено Cl • + C 2 H 4 → • C 2 H 4 Cl цепи • C 2 H 4 Cl + Cl 2 → C 2 H 4 Cl 2 + Cl • Механизм неразветвленной реакции. Горение водорода – разветвленная реакция : Зарождение цепи: H 2 + O 2 → 2 OH • Продолжение цепи: OH • + H 2 → H 2 O + H • H • + O 2 → OH • + O • по 2 частицы, разветвление O • + H 2 → OH • + H • ……… и т.д.
Слайд 15
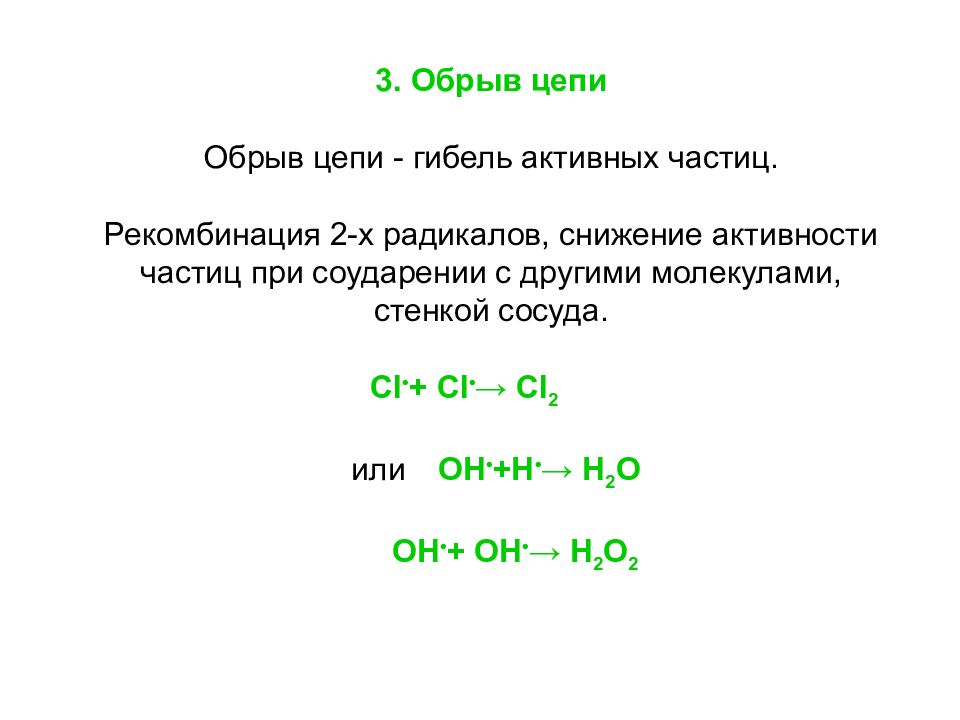
3. Обрыв цепи Обрыв цепи - гибель активных частиц. Рекомбинация 2-х радикалов, снижение активности частиц при соударении с другими молекулами, стенкой сосуда. Cl • + Cl • → Cl 2 или OH • + H • → H 2 O OH • + OH • → H 2 O 2
Слайд 16: Особенности кинетики цепных реакций
Звено цепи – повторяющаяся совокупность элементарных реакций, начинающихся образованием активной частицы и заканчивающихся её регенерацией. Длина цепи L – число звеньев на стадии продолжения цепи. Скорость цепных реакций зависит от длины цепи ( H 2 + Cl 2 → L ~10 6 ) Длина цепи определяется соотношением скоростей процесса обрыва и продолжения цепи. Обрыв цепи характеризуется вероятностью β. B ероятность продолжения цепи ( 1- β ). Обозначим V 0 – скорость зарождения цепи. Тогда скорость цепной реакции V равна: V=V 0 ∙L На каждый акт зарождения цепи приходится L звеньев цепной реакции.
Слайд 17: Разветвленные цепные реакции могут идти по двум механизмам:
1 – очень быстрое накопление частиц, К р >К обр Обрыв незначителен, реакция идёт со взрывом. 2 – если обрыв существенен, К обр >К р, устанавливается некоторая постоянная концентрация активных частиц n ∞ 2 1 n T n ∞
Последний слайд презентации: Лекция № 13 Механизм химических реакций. Энергия активации. Цепные реакции: Полимеризация – цепная реакция
Реакции образования полимеров называются реакциями полимеризации. Включают 3 основных стадии: Инициирование цепи Рост цепи Обрыв цепи Полимеры этого типа образуются из мономеров без выделения низкомолекулярных побочных продуктов. Элементарный состав полимера и мономера одинаков. Главные представители – полимеры винильных мономеров: n CH 2 =CHR →-(CH 2 -CHR-) n R – водород, алкил, арил, нитрил, галоген, сложный эфир, карбоксил и т.д. В реакции полимеризации полимер большей молекулярной массы образуется в первые моменты реакции.