Первый слайд презентации: Общая химия
Омский государственный технический университет Кафедра «Химия» Шубенкова Е.Г. Электролиз Мультимедийная слайд-лекция ©ОмГТУ, 2014
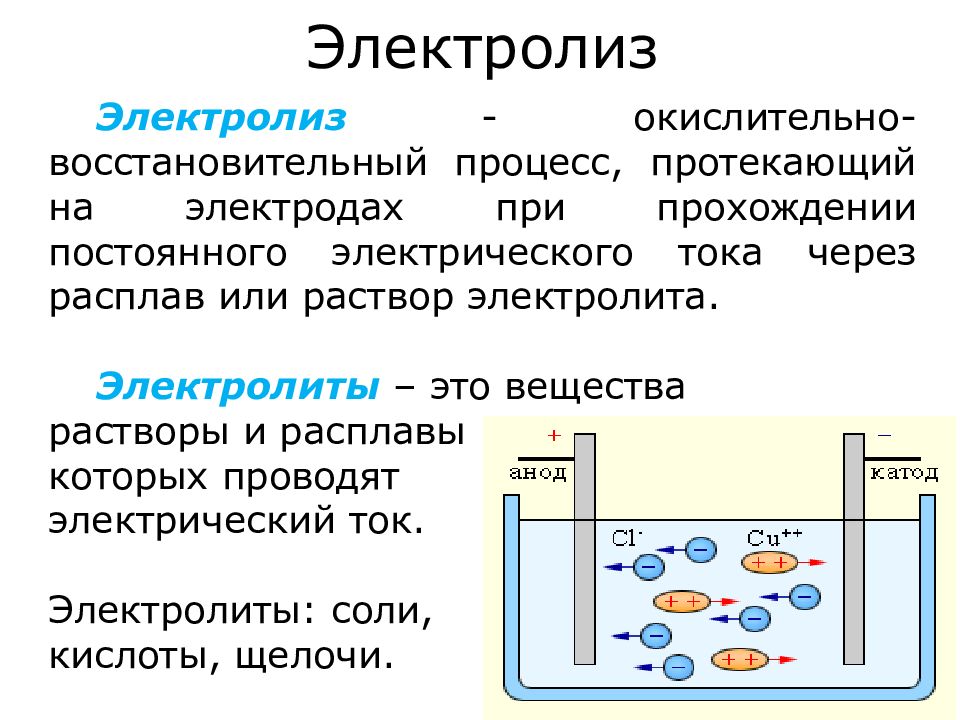
Слайд 2: Электролиз
Электролиз - окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Электролиты – это вещества растворы и расплавы которых проводят электрический ток. Электролиты: соли, кислоты, щелочи.
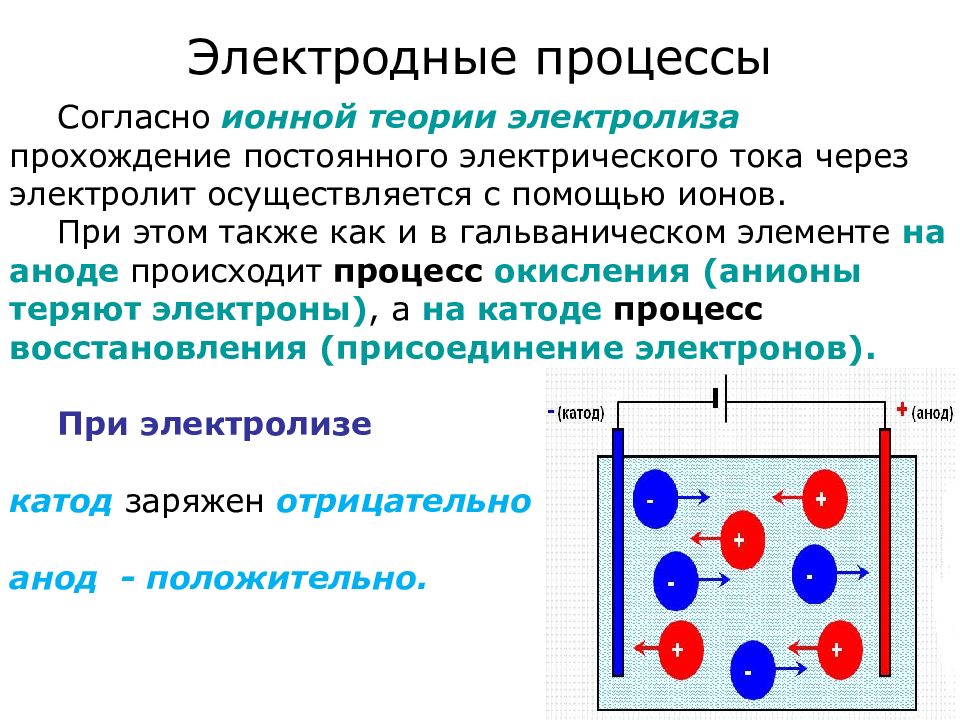
Слайд 3: Электродные процессы
Согласно ионной теории электролиза прохождение постоянного электрического тока через электролит осуществляется с помощью ионов. При этом также как и в гальваническом элементе на аноде происходит процесс окисления (анионы теряют электроны), а на катоде процесс восстановления (присоединение электронов). При электролизе катод заряжен отрицательно анод - положительно.
Слайд 4: Электролитическая ванна
Слайд 5: Электроды
Электрический ток подводится с помощью электродов. Различают электроды: инертные электроды не вступают в химические реакции, находясь в контакте с электролитами и при пропускании электрического тока (графит, платина, уголь); неинертные электроды вступают в химическую реакцию окисления на аноде при пропускании электри - ческого тока (алюминий, медь и др. металлы).
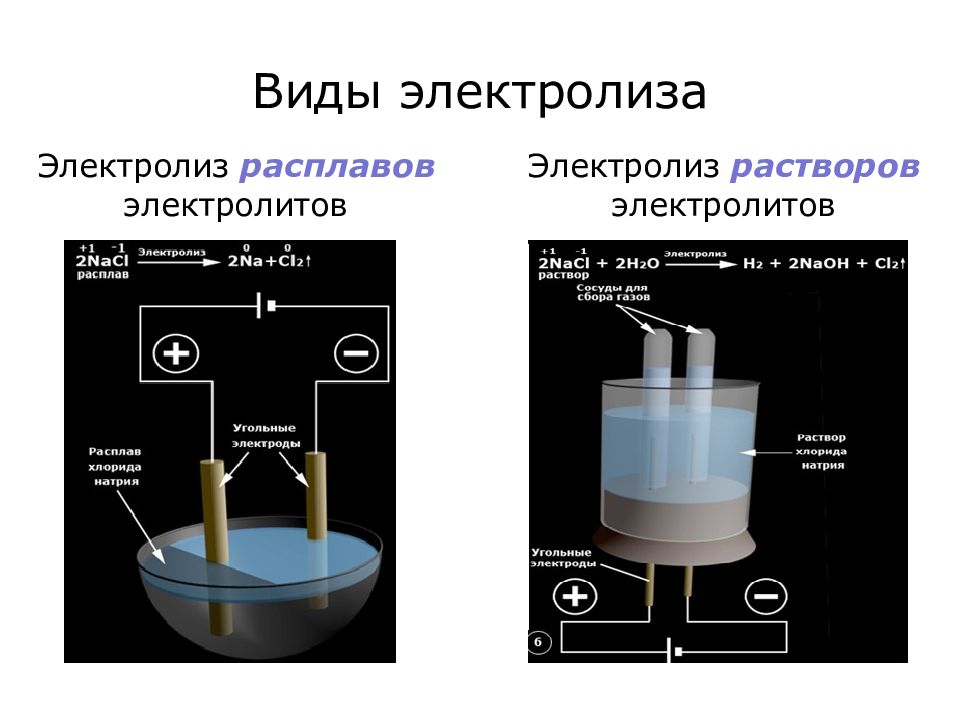
Слайд 6: Виды электролиза
Электролиз расплавов электролитов Электролиз растворов электролитов
Слайд 7: Электролиз расплавов на инертном аноде
В процессе электролиза расплавов на электродах происходят электрохимические реакции с участием только ионов расплава. На катоде восстанавливаются катионы металлов: Ме n+ + n е - → Ме 0 На аноде: анионы бескислородных кислот (кроме F - ) окисляются до соответствующего простого вещества: 2Cl - - 2e - ⟶ Cl 2 0 ↑ кислородсодержащие анионы выделяют кислород и превращаются в один из оксидов: SO 4 2- - 2e - ⟶ SO 2 ↑ + O 2 ↑
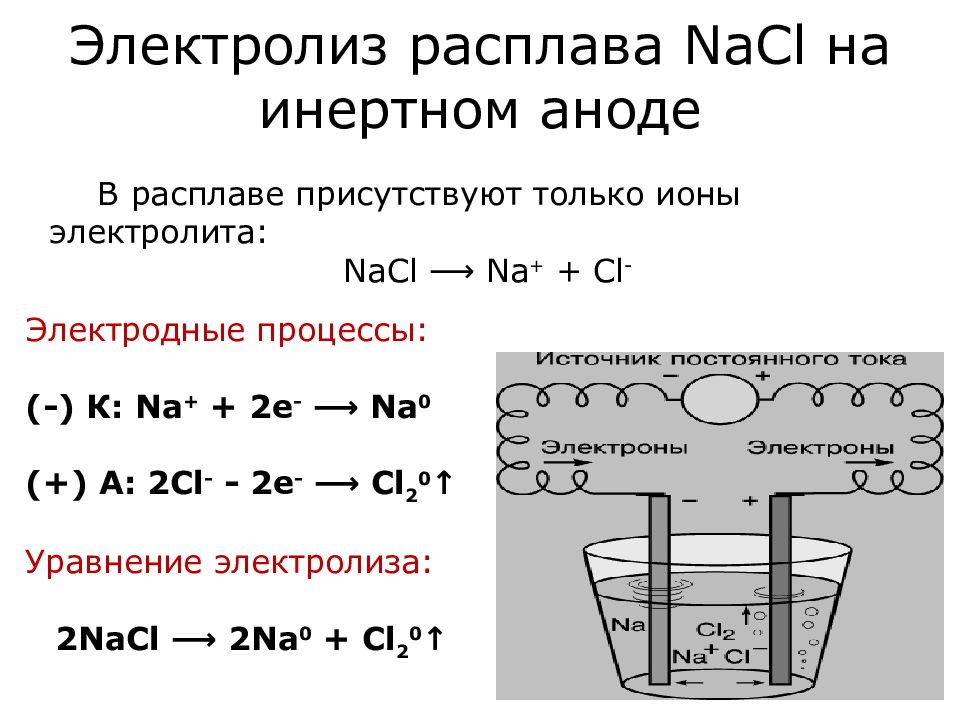
Слайд 8: Электролиз расплава NaCl на инертном аноде
Электродные процессы: (-) К: Na + + 2е - ⟶ Na 0 (+) А: 2Cl - - 2e - ⟶ Cl 2 0 ↑ В расплаве присутствуют только ионы электролита: NaCl ⟶ Na + + Cl - Уравнение электролиза: 2 NaCl ⟶ 2 Na 0 + Cl 2 0 ↑
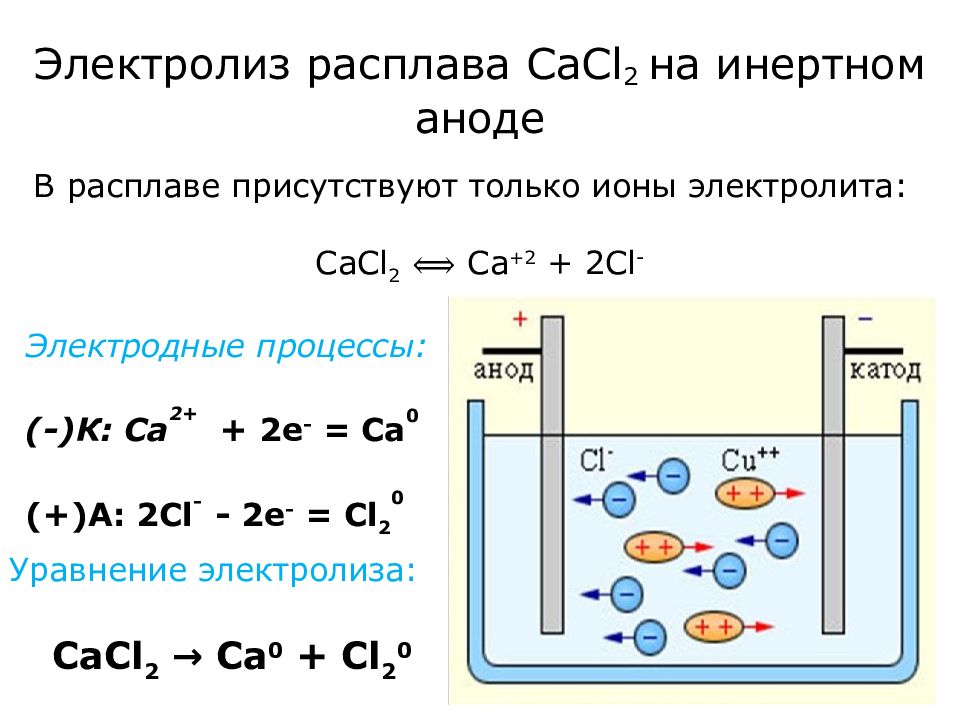
Слайд 9: Электролиз расплава СаС l 2 на инертном аноде
Электродные процессы: (-) К: Ca 2+ + 2e - = Ca 0 (+)A : 2 С l - - 2e - = Cl 2 0 Уравнение электролиза: CaCl 2 → Ca 0 + Cl 2 0 В расплаве присутствуют только ионы электролита: CaCl 2 ⟺ Ca +2 + 2 Cl -
Слайд 10: Электролиз расплава КОН на инертном аноде
Электролизом расплавов получают щелочные и щелочноземельные металлы.
Слайд 11: Алгоритм составления уравнения электролиза расплава
Помнить: в процессах на электродах участвуют только ионы электролита.
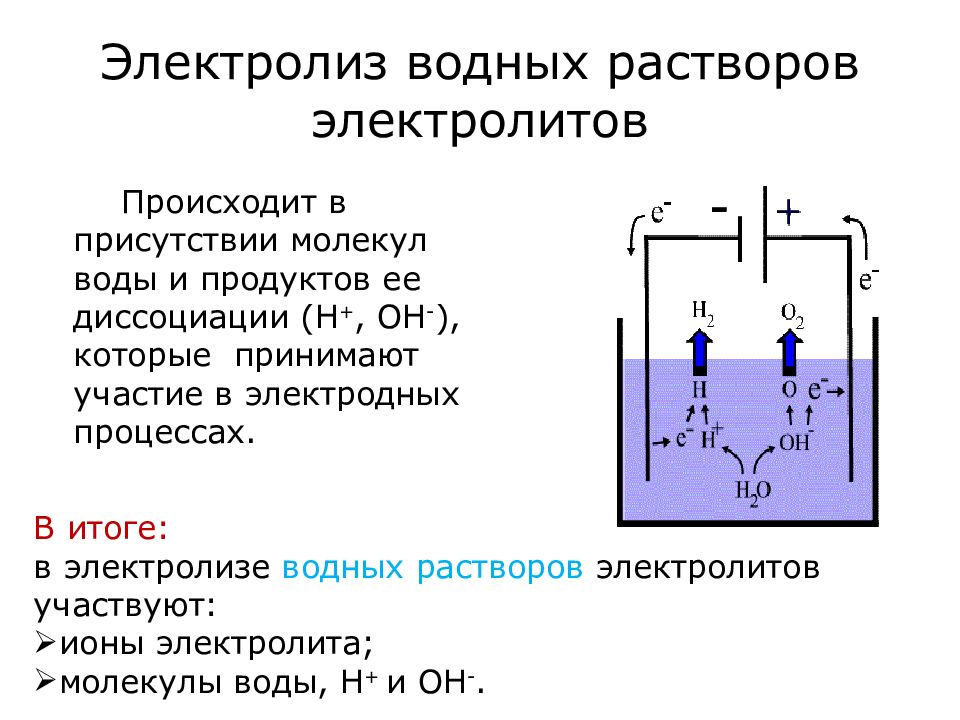
Слайд 12: Электролиз водных растворов электролитов
Происходит в присутствии молекул воды и продуктов ее диссоциации (Н +, ОН - ), которые принимают участие в электродных процессах. В итоге: в электролизе водных растворов электролитов участвуют: ионы электролита; молекулы воды, Н + и ОН -.
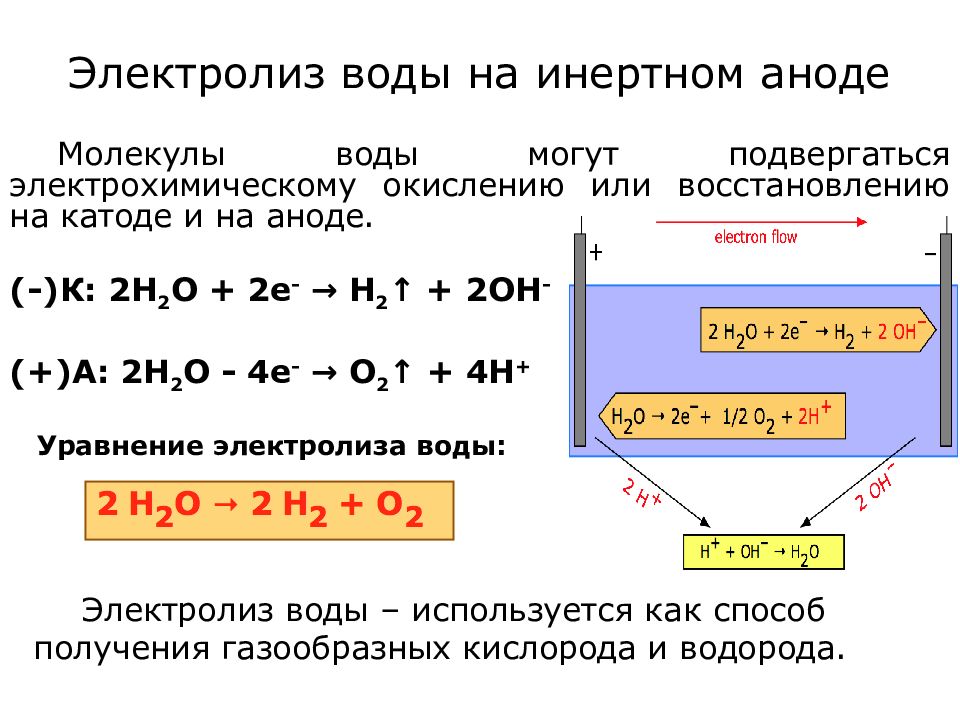
Слайд 13: Электролиз воды на инертном аноде
Электролиз воды – используется как способ получения газообразных кислорода и водорода. Уравнение электролиза воды: Молекулы воды могут подвергаться электрохимическому окислению или восстановлению на катоде и на аноде. (-)К: 2Н 2 О + 2е - → Н 2 ↑ + 2ОН - (+)А: 2Н 2 О - 4е - → О 2 ↑ + 4Н +
Слайд 14: Последовательность разрядки ионов
Электролиз водных растворов сопровождается избирательным разрядом ионов при этом имеет место определенная последовательность разрядки ионов на электродах. Последовательность разрядки ионов будет зависеть от относительных значений электродных потенциалов. На катоде первым будет восстанавливаться наиболее сильный окислитель (имеющий наибольшее значение φ). На аноде первым окисляется наиболее сильный восстановитель (имеющий наименьшее значение электродного потенциала φ).
Слайд 15: Правила электролиза. Процессы на катоде
Катионы активных металлов ( от Li до Al включительно) и катион аммония ( NH 4 + ) на катоде не восстанавливаются, вместо них восстанавливаются молекулы воды по уравнению: (-)К: 2Н 2 О + 2е - → Н 2 ↑ + 2ОН - Катионы металлов средней активности (от Al до водорода ) восстанавливаются на катоде совместно с молекулами воды: (-)К: Ме n+ + n е - → Ме 0 2Н 2 О + 2е - → Н 2 ↑ + 2ОН - 3. Катионы малоактивных металлов ( после водорода ) восстанавливаются на катоде: (-)К: Ме n+ + n е - → Ме 0 4. Ионы водорода восстанавливаются только из растворов кислот: (-)К: 2Н + + 2е - → Н 2 ↑
Слайд 16: Правила электролиза. Процессы на аноде
1. Анионы бескислородных кислот ( ) окисляются на аноде до простых веществ: (+)А: 2. Анионы кислородсодержащих кислот ( и и др.), не окиляются на аноде, вместо них окисляются молекулы воды по уравнению: (+)А: 2Н 2 О - 4е - → О 2 ↑ + 4Н + 3. Фторид ионы ( F - ) не окисляются на аноде, вместо них окисляются молекулы воды: (+)А: 2Н 2 О - 4е - → О 2 ↑ + 4Н + 4. Анионы ОН - окисляются на аноде только при электролизе растворов щелочей: (+)А:
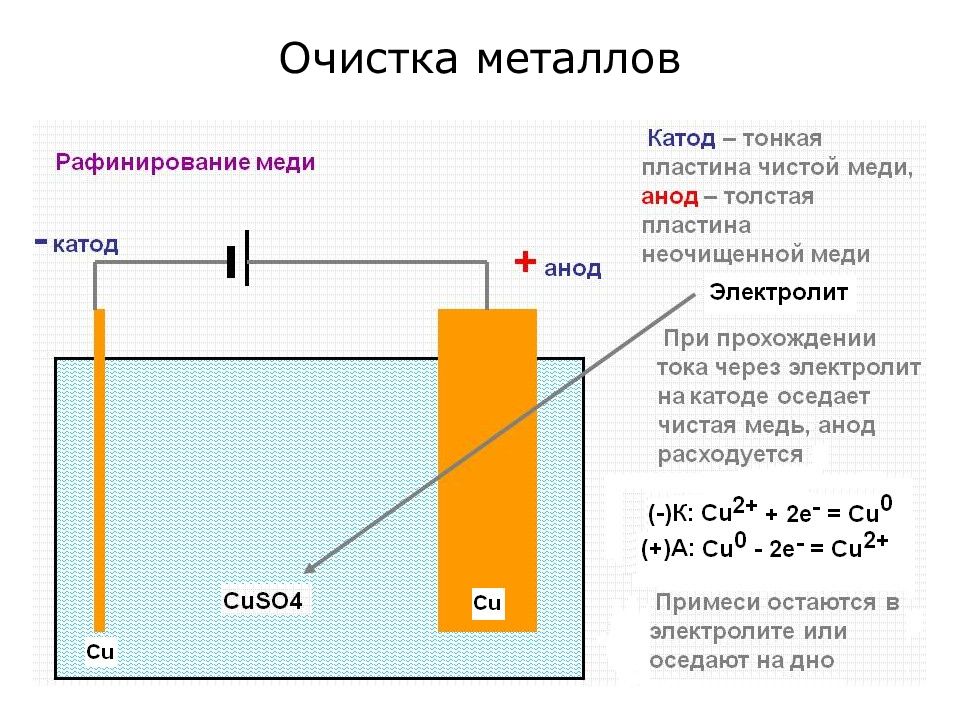
Слайд 17: Участие неинертных электрордов в электродных процессах
Если электроды неинертны (т.е. изготовлены из металлов), то анионы из раствора не окисляются, а окисляется сам анод: (+)А: В итоге: Анод растворяется. Применение: Для получения химически чистых металлов.
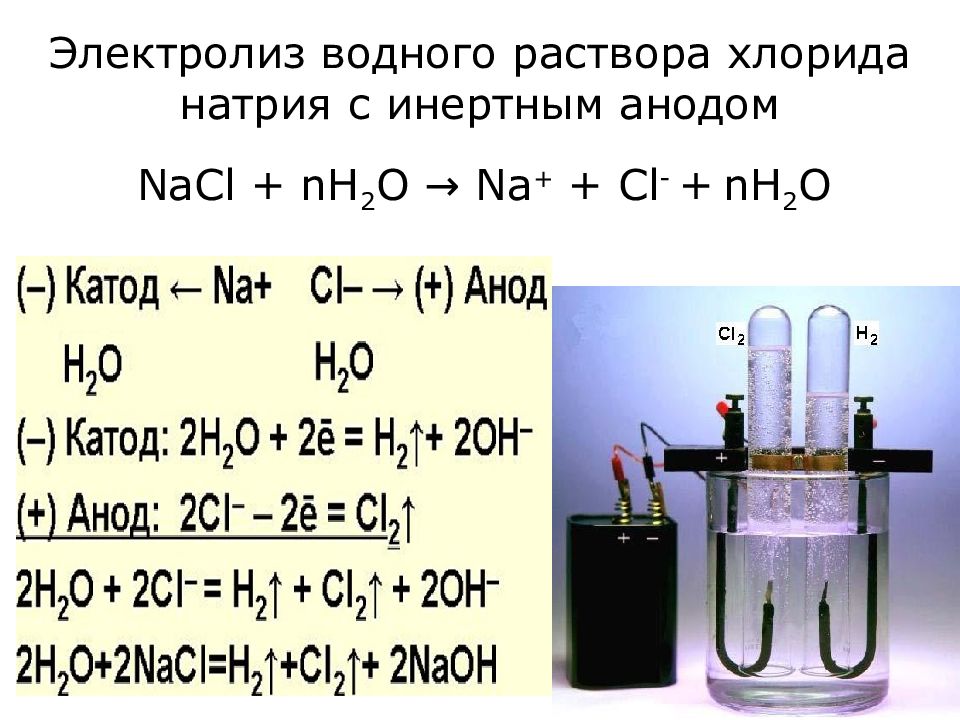
Слайд 19: Электролиз водного раствора хлорида натрия с инертным анодом
NaCl + nH 2 O → Na + + Cl - + n H 2 O
Слайд 20: Электролиз водного раствора хлорида цинка с инертным анодом
Электродные процессы: (-) К: Zn 2+ + 2 е - ⟶ Zn 0 2Н 2 О + 2е - → Н 2 ↑ + 2ОН - (+) А: 2Cl - - 2e - ⟶ Cl 2 0 ↑ Диссоциация соли: ZnCl 2 + nH 2 O → Zn 2+ + 2Cl - + n H 2 O Уравнение электролиза: 2ZnCl 2 + 2 H 2 O → Zn 0 + 2Cl 2 0 + Н 2 ↑ + Zn (OH) 2 ↓
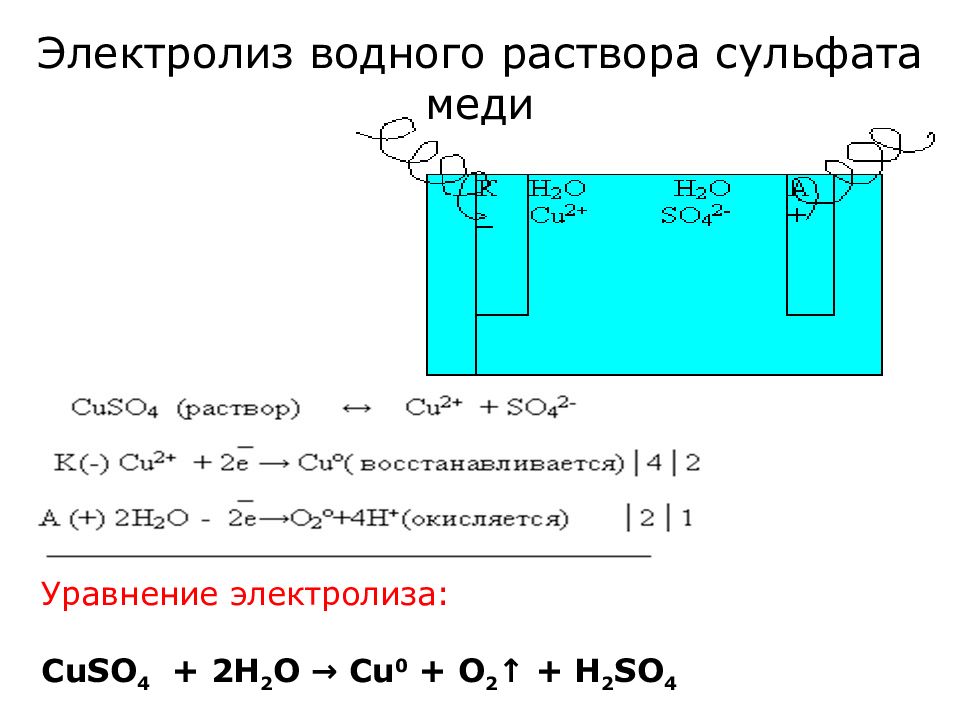
Слайд 21: Электролиз водного раствора сульфата меди
Уравнение электролиза: CuSO 4 + 2 H 2 O → Cu 0 + O 2 ↑ + H 2 SO 4
Слайд 22: Электролиз водного раствора нитрата серебра с неинертным (растворимым) анодом
Диссоциация соли: AgNO 3 + nH 2 O → Ag + + NO 3 - + n H 2 O Электродные процессы: В итоге:
Слайд 23: Алгоритм составления уравнений электролиза водных растворов
Помнить: правила электролиза на катоде и аноде.
Слайд 24: Количественные законы электролиза
В 30-х годах XIX века М. Фарадеем были установлены количественные законы электролиза: Масса, образовавшегося при электролизе вещества пропорциональна количеству прошедшего электричества. При электролизе различных химических соединений равные количества электричества приводят к электрохимическому превращению эквивалентных количеств веществ.
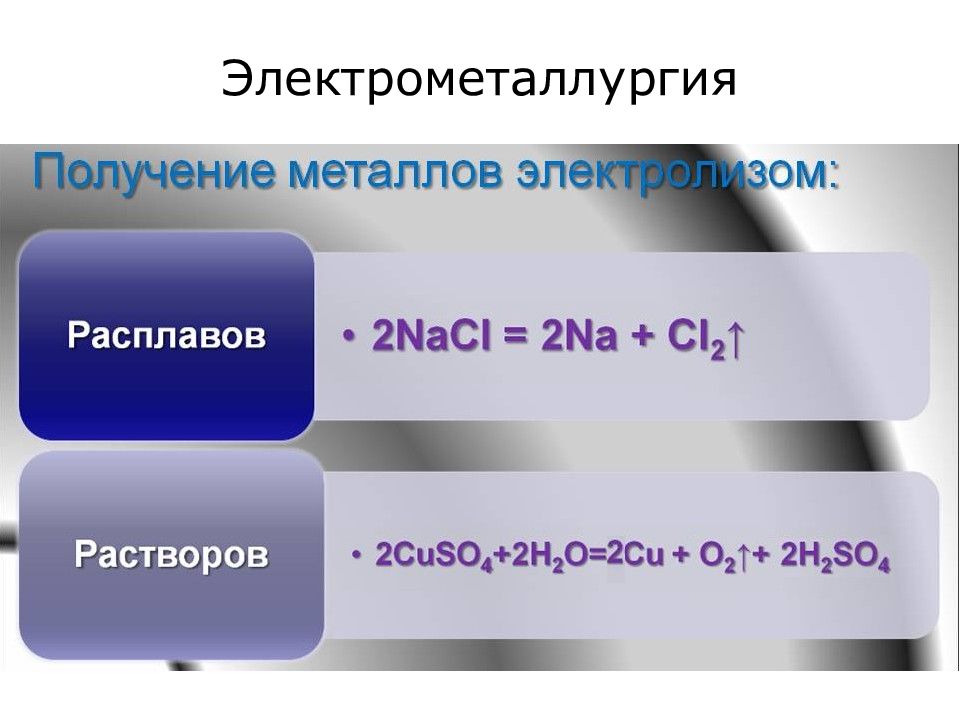
Слайд 26: Применение электролиза
Получение металлов (электрометаллургия). Покрытие металлических изделий другими металлами (гальваностегия). Получение точных металлических копий (гальванопластика).
Слайд 29
В подготовке учебных материалов использовались следующие электронные ресурсы: - himhelp.ru alhimik.ru h ttp://900igr.net/kartinki/fizika/Primenenie- elektroliza/009-- Anod.htm… http://www.chem1.com/CQ/ionbunk.html http://rrc.dgu.ru/res/chem/1se… http://istochnik-m.ucoz.ru/pub…