Первый слайд презентации: Простые эфиры
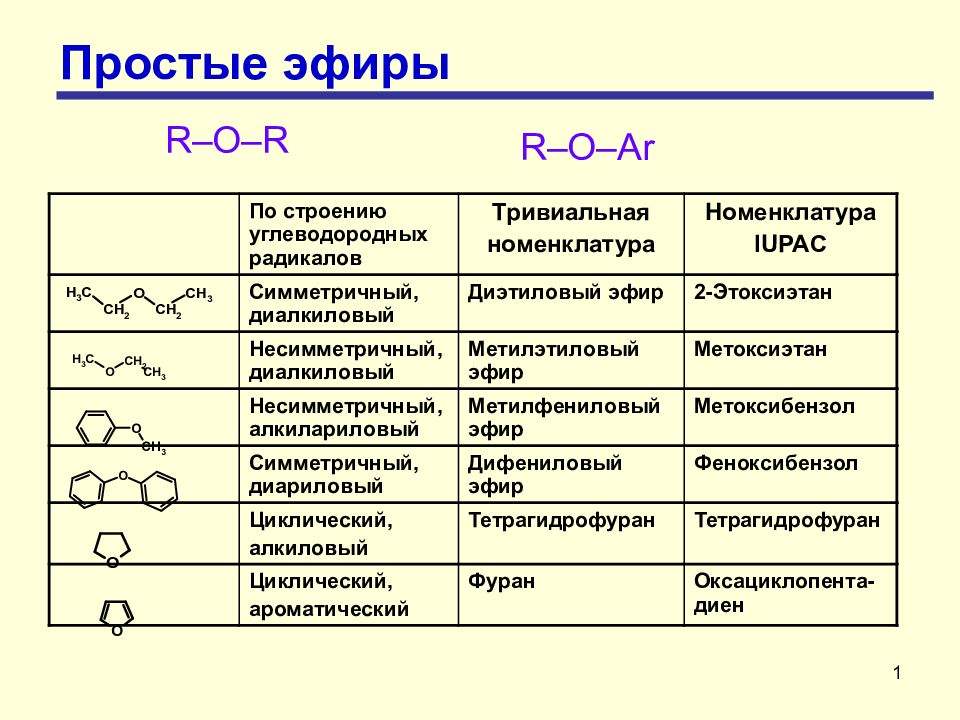
1 Простые эфиры По строению углеводородных радикалов Тривиальная номенклатура Номенклатура IUPAC Симметричный, диалкиловый Диэтиловый эфир 2-Этоксиэтан Несимметричный, диалкиловый Метилэтиловый эфир Метоксиэтан Несимметричный, алкилариловый Метилфениловый эфир Метоксибензол Симметричный, диариловый Дифениловый эфир Феноксибензол Циклический, алкиловый Тетрагидрофуран Тетрагидрофуран Циклический, ароматический Фуран Оксациклопента-диен R–O–R R–O–Ar
Слайд 2: Простые эфиры
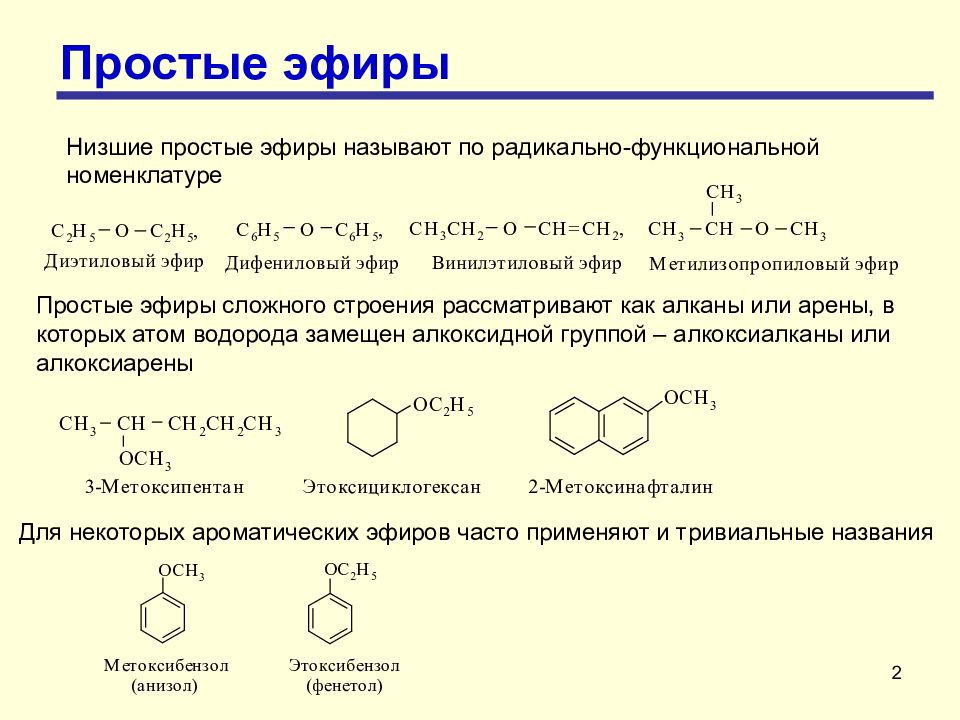
2 Простые эфиры Низшие простые эфиры называют по радикально-функциональной номенклатуре Простые эфиры сложного строения рассматривают как алканы или арены, в которых атом водорода замещен алкоксидной группой – алкоксиалканы или алкоксиарены Для некоторых ароматических эфиров часто применяют и тривиальные названия
Слайд 3: Простые эфиры
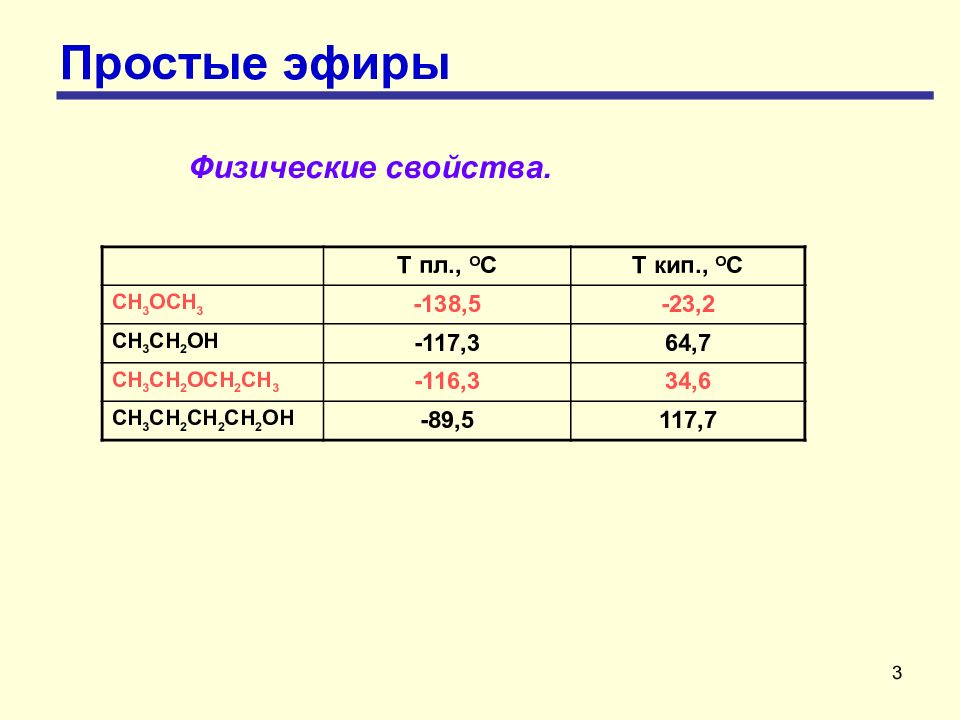
3 Простые эфиры Физические свойства. Т пл., О С Т кип., О С CH 3 OCH 3 -138,5 -23,2 CH 3 CH 2 OH -117,3 64,7 CH 3 CH 2 OCH 2 CH 3 -116,3 34,6 CH 3 CH 2 CH 2 CH 2 OH -89,5 117,7
Слайд 4: Простые эфиры
4 Простые эфиры Физические свойства Простые эфиры являются бесцветными жидкостями (кроме диметилового эфира, который в нормальных условиях является газообразным) и имеют своеобразный запах. Простые эфиры имеют более низкие температуры кипения, чем спирты, так как в эфирах отсутствуют межмолекулярные водородные связи. По той же причине простые эфиры (кроме диметилового эфира) плохо растворимы в воде. Простые эфиры менее полярны, чем спирты, их дипольный момент составляет (4,0-4,3)∙10-30 Кл∙м.
Слайд 5: Простые эфиры
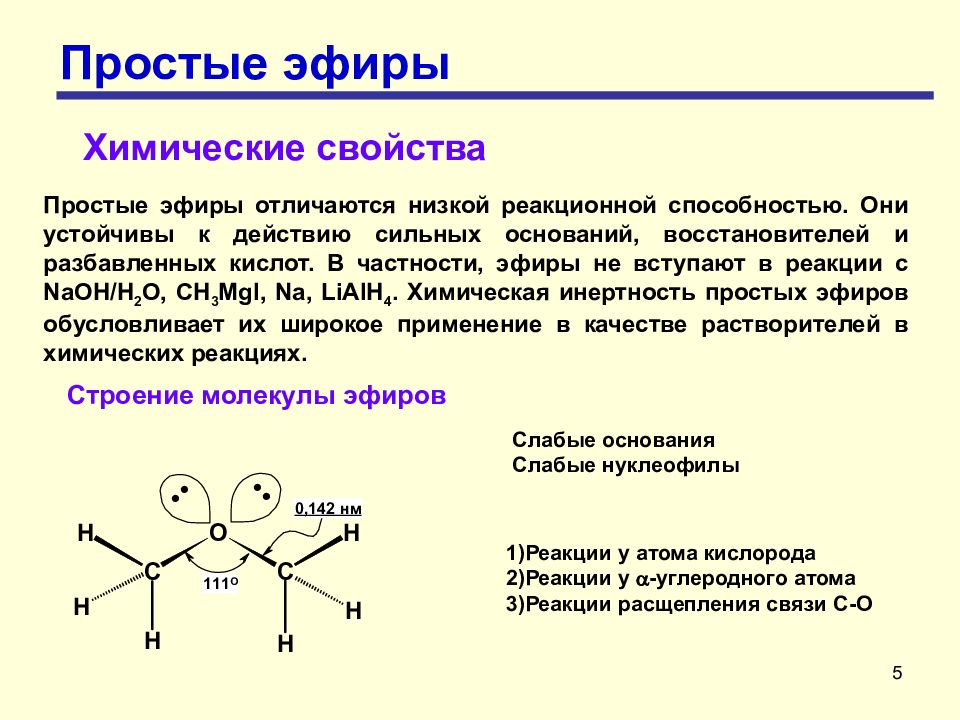
5 Простые эфиры Химические свойства Простые эфиры отличаются низкой реакционной способностью. Они устойчивы к действию сильных оснований, восстановителей и разбавленных кислот. В частности, эфиры не вступают в реакции с NaOH/Н 2 О, CH 3 MgI, Na, LiAlH 4. Химическая инертность простых эфиров обусловливает их широкое применение в качестве растворителей в химических реакциях. Строение молекулы эфиров Слабые основания Слабые нуклеофилы 1)Реакции у атома кислорода 2)Реакции у a -углеродного атома 3)Реакции расщепления связи С-О
Слайд 6: Простые эфиры
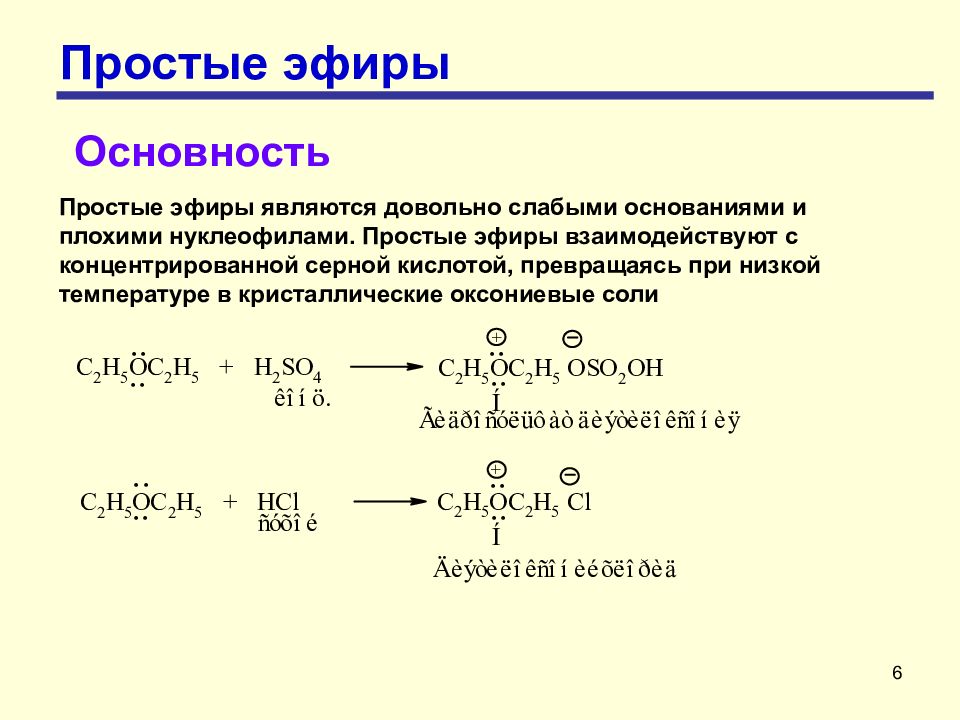
6 Простые эфиры Основность Простые эфиры являются довольно слабыми основаниями и плохими нуклеофилами. Простые эфиры взаимодействуют с концентрированной серной кислотой, превращаясь при низкой температуре в кристаллические оксониевые соли
Слайд 7: Простые эфиры
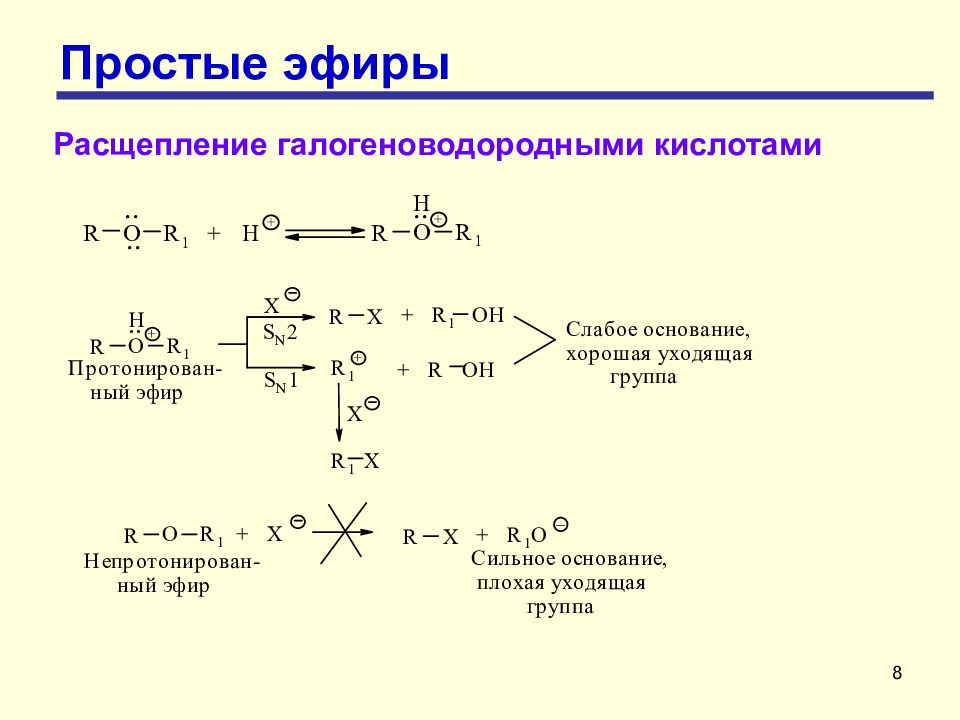
7 Простые эфиры Расщепление галогеноводородными кислотами Разрыв связи углерод-кислород происходит только в жестких условиях – при нагревании с концентрированными галогеноводородными кислотами НХ: HI > НВг > НС l реакционная способность уменьшается Условия реакции: Конц. HBr, HI ; 120-150 O C Реакция представляет собой нуклеофильное замещение в протониро-ванном эфире, более реакционноспособном, чем нейтральная молекула эфира (сравните с реакцией замещения в спиртах).
Слайд 9: Простые эфиры
9 Простые эфиры Расщепление галогеноводородными кислотами Реакция протекает по механизму S N 1 или S N 2 в зависимости от строения алкильных групп. Реакции расщепления эфиров, содержащих первичные и вторичные алкильные группы, протекают по механизму S N 2. Простые эфиры, содержащие третичную алкильную группу, расщепляются преимущественно по механизму S N 1. Расщепление эфира может протекать и одновременно по двум механизмам - S N 1 и S N 2, что приводит к смеси двух алкилгалогенидов и двух спиртов. Расщепление арилалкиловых эфиров Ar - O - Alk всегда протекает только по связи ArO - Alk с образованием алкилгалогенида и фенола.
Слайд 10: Простые эфиры
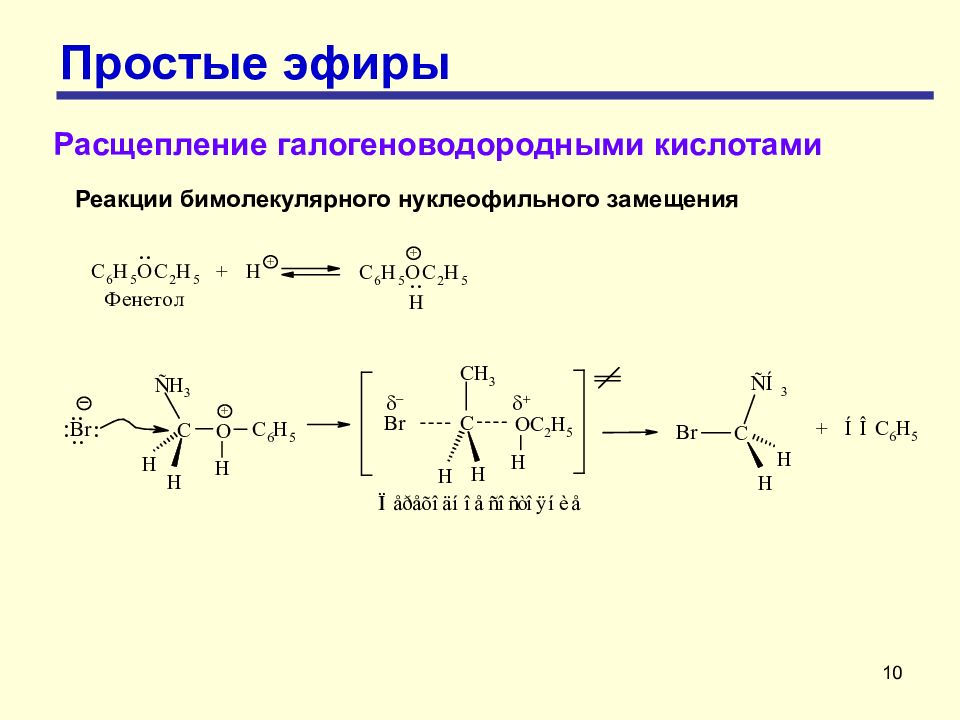
10 Простые эфиры Расщепление галогеноводородными кислотами Реакции бимолекулярного нуклеофильного замещения
Слайд 11: Простые эфиры
11 Простые эфиры Расщепление галогеноводородными кислотами Реакции мономолекулярного нуклеофильного замещения
Слайд 12: Простые эфиры
12 Простые эфиры Окисление кислородом воздуха. Пероксиды Простые эфиры на свету медленно окисляются кислородом воздуха с образованием гидропероксидов, которые со временем превращаются в полимерные пероксиды (автоокисление). Гидропероксиды и пероксиды неустойчивы, легко взрываются. Поэтому перед применением эфиров в реакциях, в том числе, в качестве растворителей, их очищают от указанных примесей. В случае умеренного содержания пероксидов в эфире его энергично встряхивают с алюмогидридом лития или с водным раствором сульфата железа (II). При этом пероксиды разрушаются, а эфир становится пригодным для перегонки.
Слайд 13: Простые эфиры
13 Простые эфиры Окисление кислородом воздуха. Пероксиды Простые эфиры на свету медленно окисляются кислородом воздуха с образованием гидропероксидов, которые со временем превращаются в полимерные пероксиды (автоокисление). Гидропероксиды и пероксиды неустойчивы, легко взрываются. Поэтому перед применением эфиров в реакциях, в том числе, в качестве растворителей, их очищают от указанных примесей. В случае умеренного содержания пероксидов в эфире его энергично встряхивают с алюмогидридом лития или с водным раствором сульфата железа (II). При этом пероксиды разрушаются, а эфир становится пригодным для перегонки.
Слайд 14: Простые эфиры
14 Простые эфиры Способы получения Межмолекулярная дегидратация спиртов. Вторичные и третичные спирты при нагревании в присутствии минеральных кислот отщепляют воду, превращаясь в алкены. В отличие от других вторичных и третичных спиртов изопропиловый спирт дает неплохой выход диизопропилового эфира.
Слайд 15: Простые эфиры
15 Простые эфиры Способы получения Синтез Вильямсона - взаимодействие галогенпроизводных с алкоксидами и феноксидами В лабораторных условиях простые эфиры получают по реакции Вильямсона взаимодействием галогенпроизводных, способных вступать в реакции SN 2, с алкоксид- и феноксид-ионами. Реакция с хорошим выходом протекает с галогенметанами и первичными галогеналканами. В случае вторичных галогеналканов реакция Вильямсона может быть осложнена побочной реакцией элиминирования где R 1 - первичный или вторичный алкил.
Слайд 16: Простые эфиры
16 Простые эфиры Способы получения При применении алкилтозилатов получение простых эфиров проходит еще более гладко Синтез Вильямсона - взаимодействие галогенпроизводных с алкоксидами и феноксидами
Слайд 17: Простые эфиры
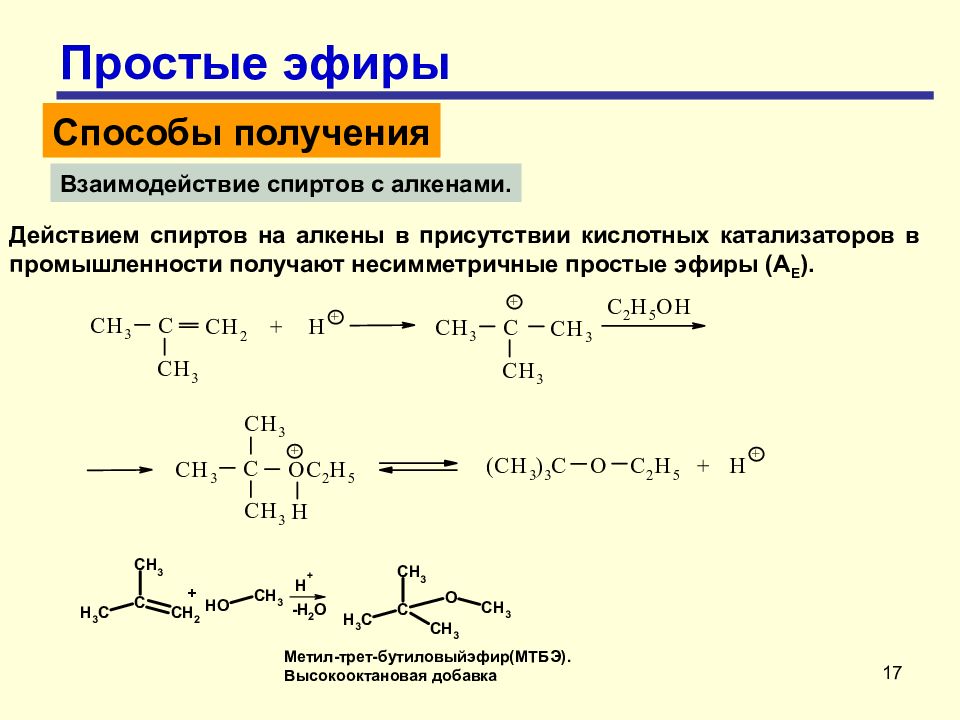
17 Простые эфиры Способы получения Взаимодействие спиртов с алкенами. Действием спиртов на алкены в присутствии кислотных катализаторов в промышленности получают несимметричные простые эфиры (А E ).
Слайд 18: Циклические простые эфиры
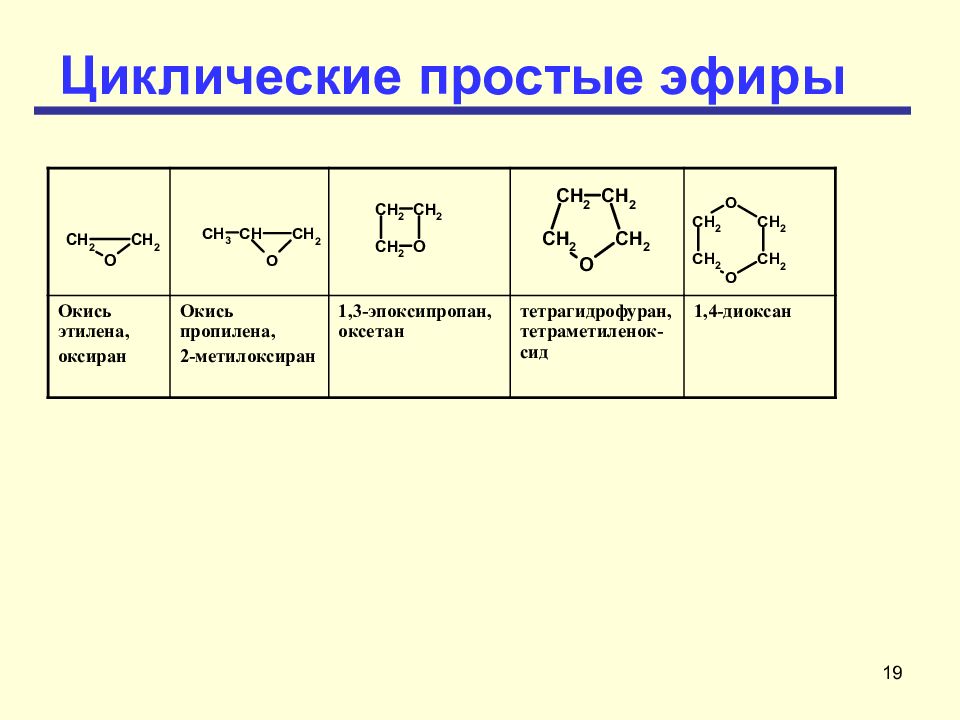
18 Циклические простые эфиры Основу названия этих соединений составляет наименование углеводорода, наличие кислородного мостика обозначают префиксом эпокси-. Название такого эфира может быть образовано и как производное оксирана. Оксираны или эпоксисоединения эпоксиды
Слайд 19: Циклические простые эфиры
19 Циклические простые эфиры Окись этилена, оксиран Окись пропилена, 2-метилоксиран 1,3-эпоксипропан, оксетан тетрагидрофуран, тетраметиленок-сид 1,4-диоксан
Слайд 20: Циклические простые эфиры
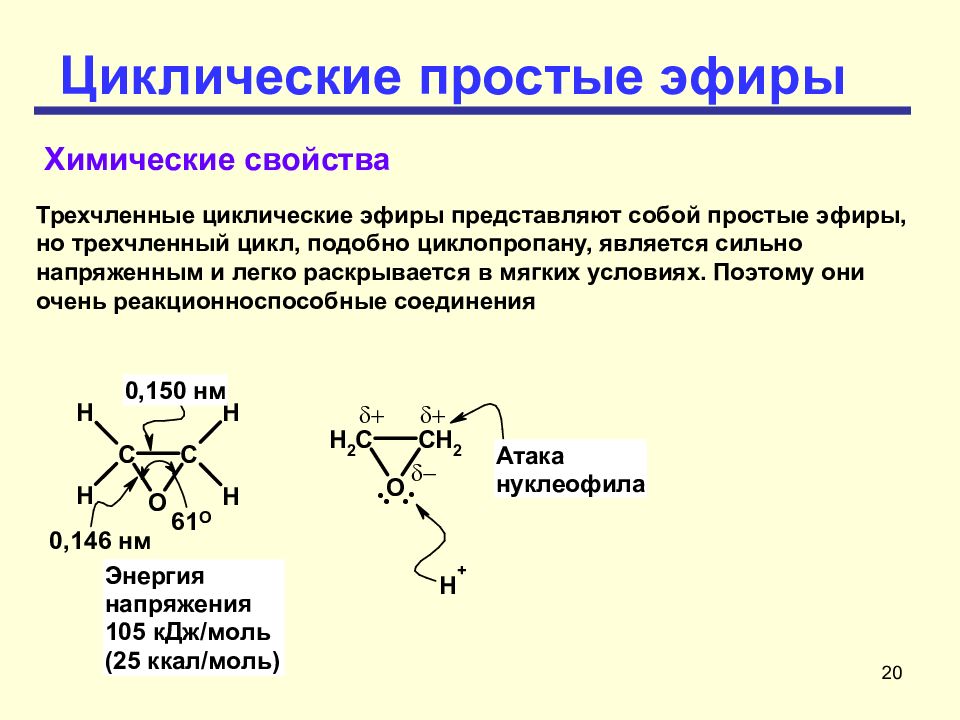
20 Циклические простые эфиры Химические свойства Трехчленные циклические эфиры представляют собой простые эфиры, но трехчленный цикл, подобно циклопропану, является сильно напряженным и легко раскрывается в мягких условиях. Поэтому они очень реакционноспособные соединения
Слайд 21: Циклические простые эфиры
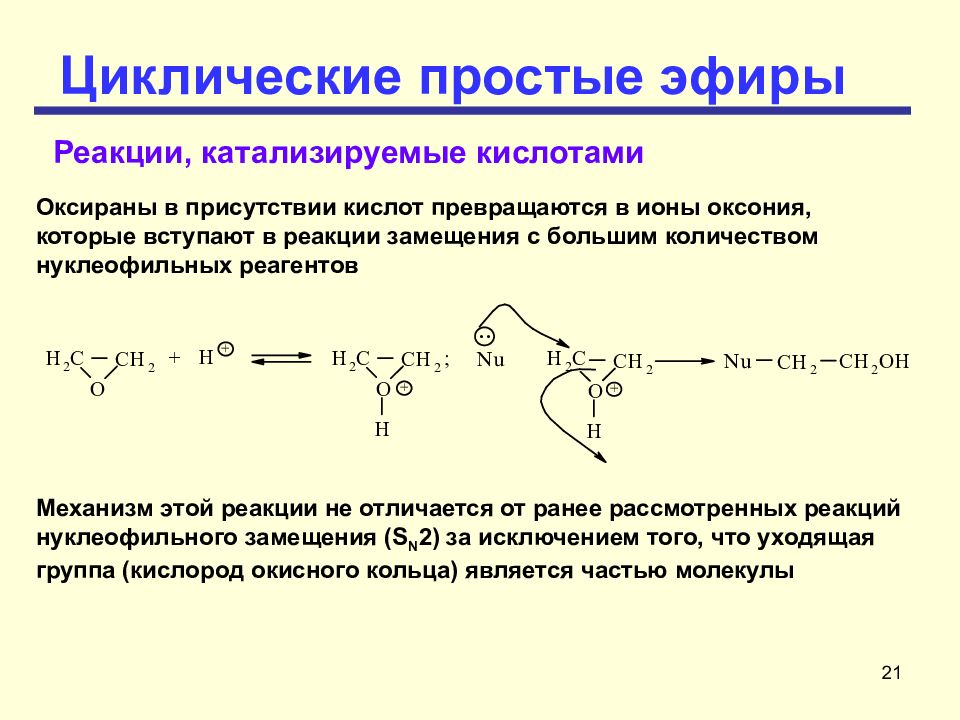
21 Циклические простые эфиры Реакции, катализируемые кислотами Оксираны в присутствии кислот превращаются в ионы оксония, которые вступают в реакции замещения с большим количеством нуклеофильных реагентов Механизм этой реакции не отличается от ранее рассмотренных реакций нуклеофильного замещения ( S N 2) за исключением того, что уходящая группа (кислород окисного кольца) является частью молекулы
Слайд 22: Циклические простые эфиры
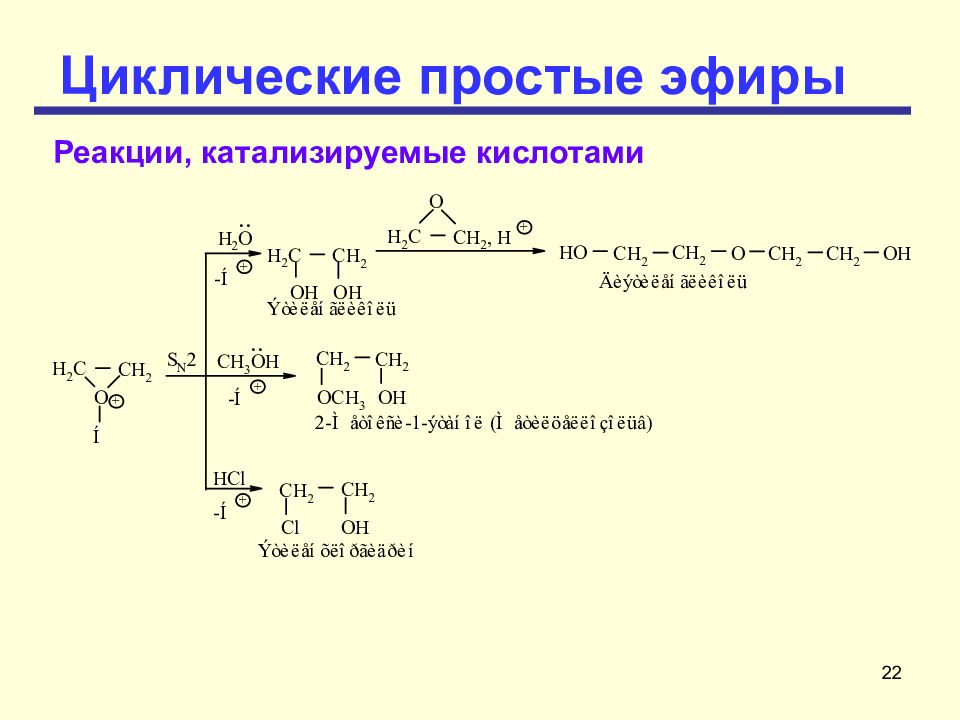
22 Циклические простые эфиры Реакции, катализируемые кислотами
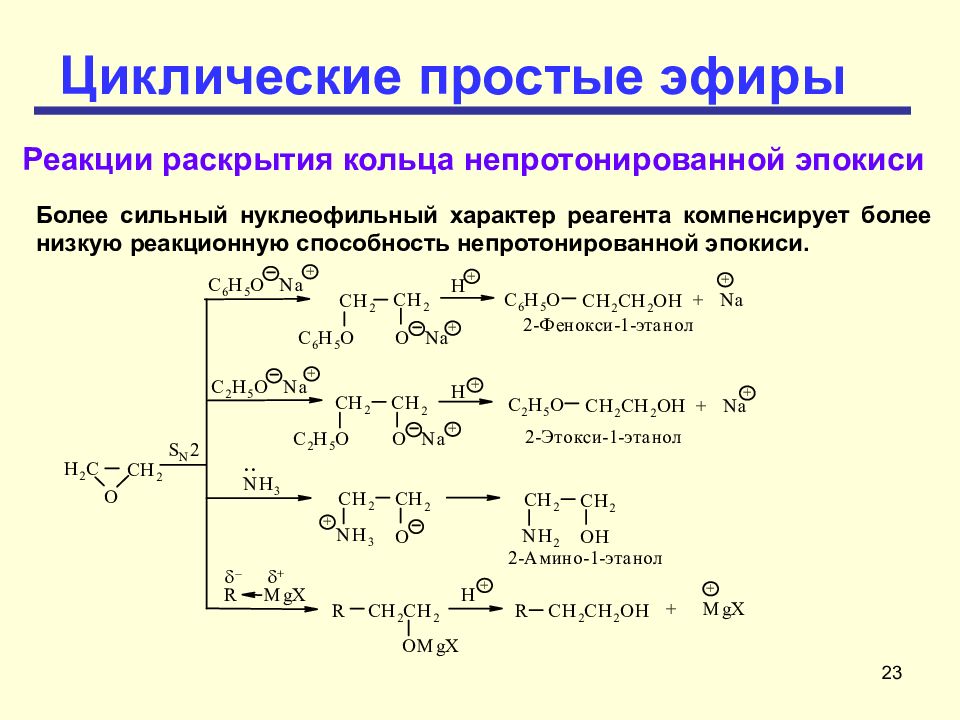
Слайд 23: Циклические простые эфиры
23 Циклические простые эфиры Реакции раскрытия кольца непротонированной эпокиси Более сильный нуклеофильный характер реагента компенсирует более низкую реакционную способность непротонированной эпокиси.
Слайд 24: Циклические простые эфиры
24 Циклические простые эфиры Четырехчленный циклический эфир – окись триметилэтилена (СН 2 ) 3 О расщепляется труднее, чем окись этилена. Тетрагидрофуран и 1, 4- диоксан представляет собой устойчивое соединение, которое часто используется в качестве растворителя
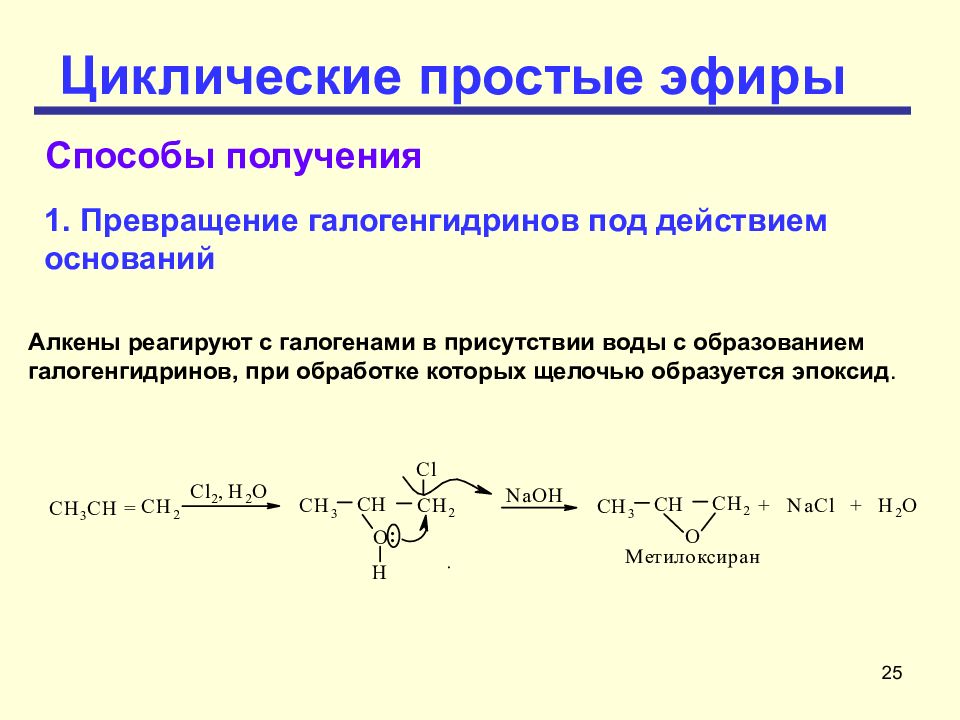
Слайд 25: Циклические простые эфиры
25 Циклические простые эфиры Алкены реагируют с галогенами в присутствии воды с образованием галогенгидринов, при обработке которых щелочью образуется эпоксид. Способы получения Превращение галогенгидринов под действием оснований
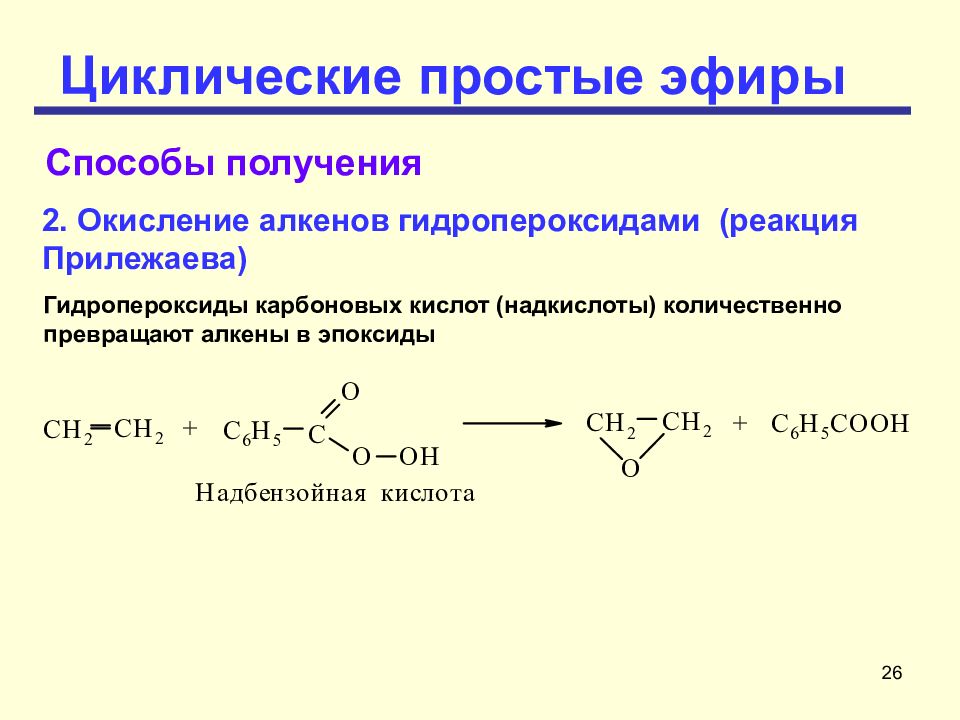
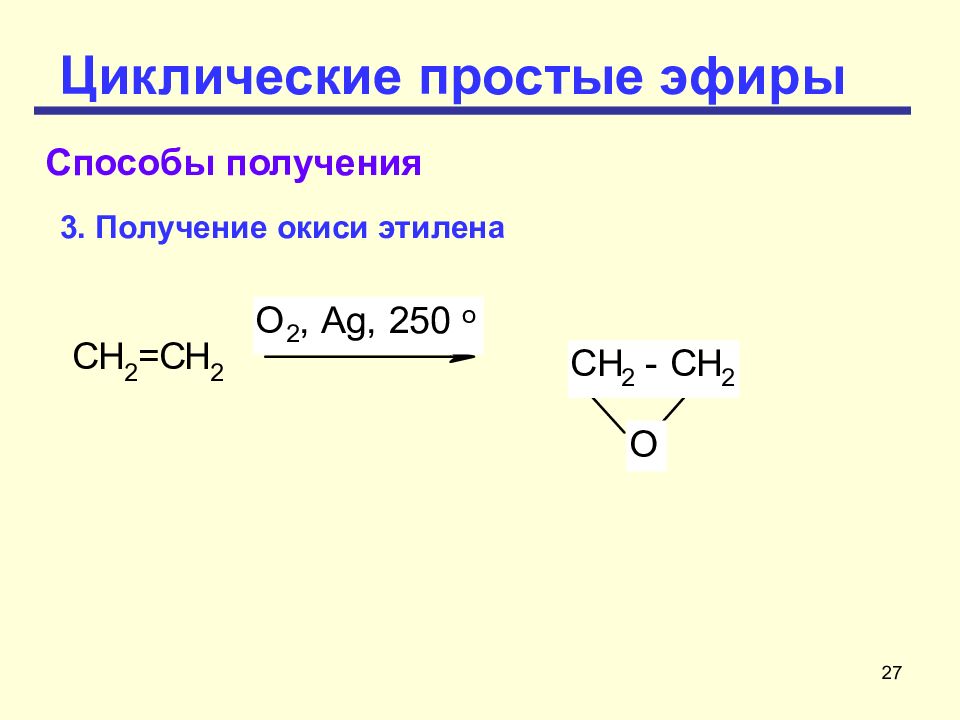
Слайд 26: Циклические простые эфиры
26 Циклические простые эфиры Гидропероксиды карбоновых кислот (надкислоты) количественно превращают алкены в эпоксиды 2. Окисление алкенов гидропероксидами (реакция Прилежаева) Способы получения