Первый слайд презентации: Развитие учебной мотивации на уроках химии через систему урочной и внеурочной деятельности
Составила Лифатова Л.Н. учитель химии МАОУ Лицей №3 им.А.С.Пушкина
Слайд 2: Все наши замыслы, все поиски и построения превращаются в прах, если у ученика нет желания учиться» (В.А.Сухомлинский)
Задача учителя организовать процесс обучения так, чтобы у учащихся развивались познавательные способности, формировались приемы умственной деятельности( анализ, синтез, абстрагирование, обобщение, сравнение), чтобы учащиеся умели самостоятельно работать, делать обобщение и выводы, творчески применять знания в новых ситуациях.
Слайд 4: Педагогические методы и приёмы мотивации учения, применяемые на уроках химии
словесные наглядные и практические методы репродуктивные и поисковые методы методы самостоятельной учебной работы и работы под руководством учителя.
Интерактивные технологии Технологии сотрудничества Элементы проблемного обучения
Слайд 6: Приемы мотивации
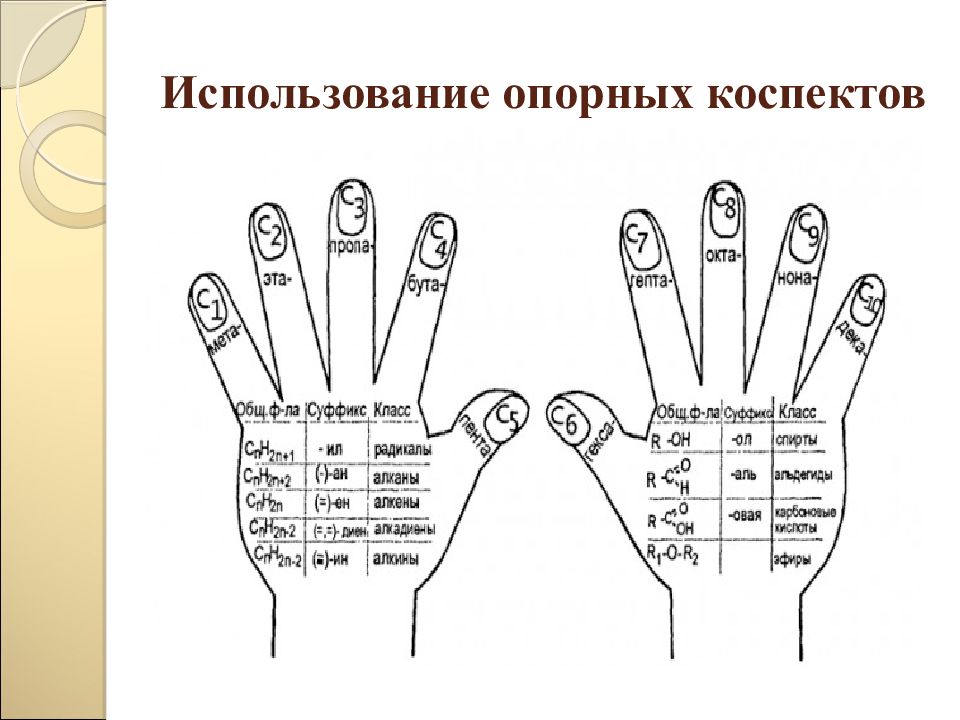
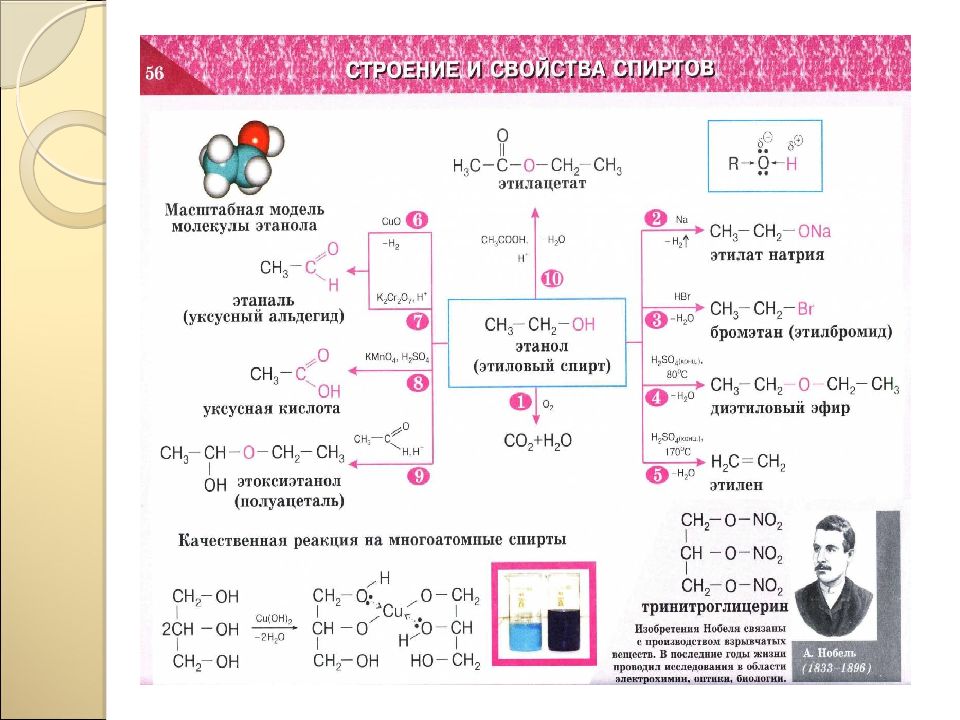
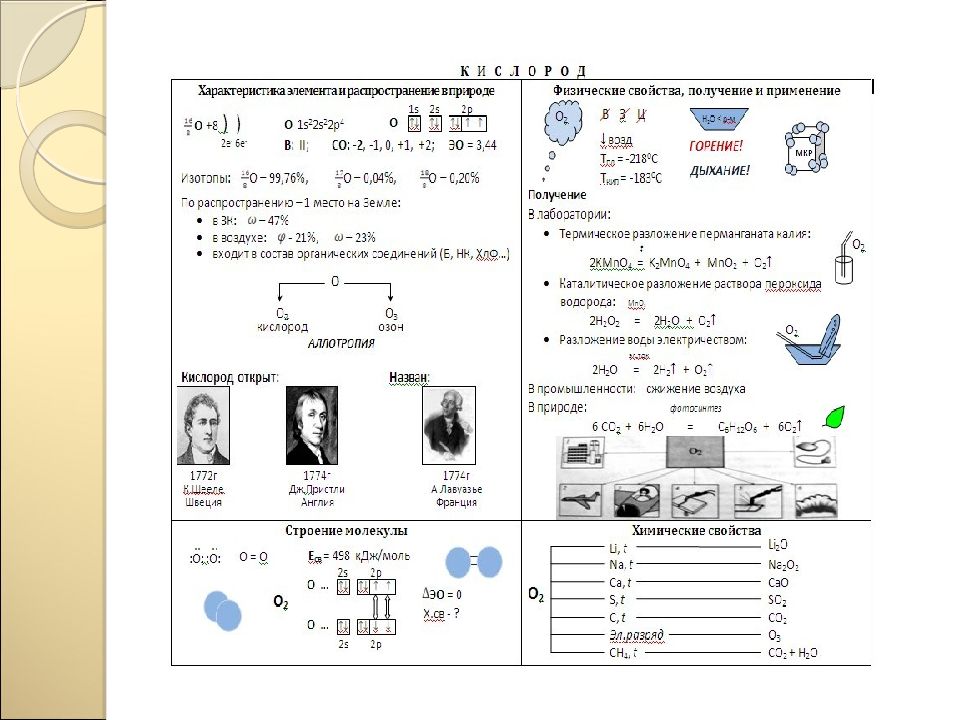
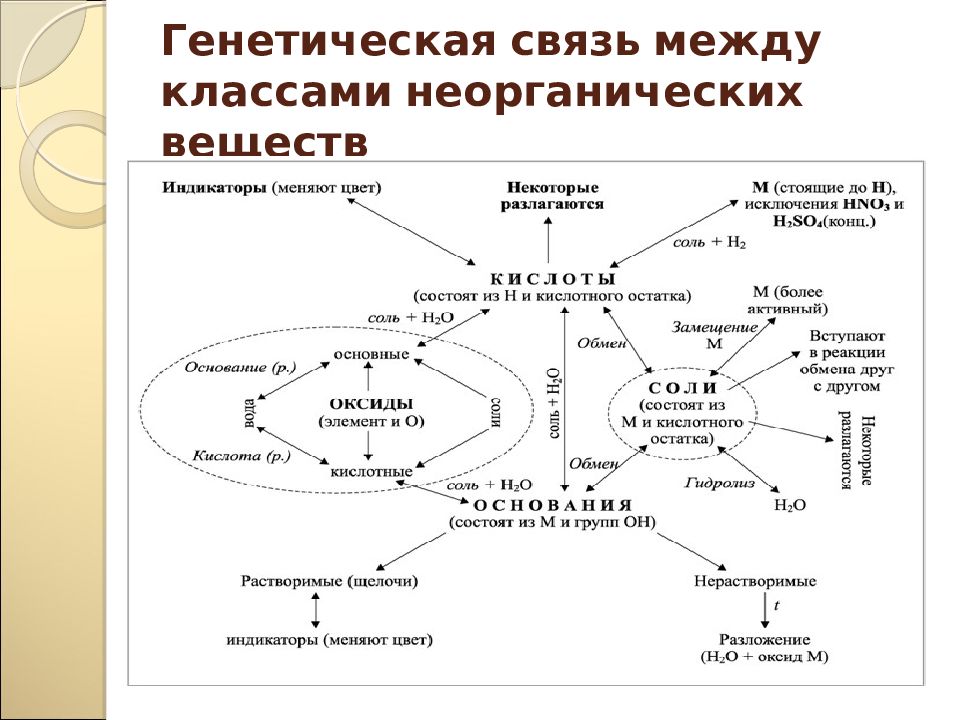
Загадка, тайна Проблемный вопрос, проблемная ситуация Противоречие фактов Опора на жизненный опыт Опорные схемы ИКТ-технологии Наличие соревновательных элементов Комплекс поощрительных действий
Слайд 7: Активные методы обучения
Метод дискуссии Метод самостоятельной работы с учеником Метод самостоятельной работы с дидактическими материалами Метод проблемного изложения Метод самостоятельного решения расчетных и логических задач Жизненность изучаемого материала
Слайд 8
Третий лишний Вычеркните символ элемента, выпадающего из общего ряда. Возможен не один вариант правильного ответа Ключ : названия, написание знаков, произношение, положение в Периодической системе, металл-неметалл а) B, Be, Ba ; в) Hg, Mn, Mg ; б) Al, Ta, Zn ; г) Li, P, С l.
Слайд 9
Десять элементов Олово, фосфор, водород, рутений, ртуть, селен, кислород, кальций, мышьяк, хлор, серебро Внимательно прочитайте следующие утверждения и после каждого вычеркивайте из списка один элемент. Какой останется? Этот элемент назван в честь Луны Это самый распространенный на Земле элемент Символ этого элемента начинается с буквы « S » Образует простое вещество – ядовитый газ желто-зеленого цвета В названии есть буква «а» Его химический знак Ag Это элемент 2 группы побочной подгруппы Элемент 4 периода Его название в переводе означает «светоносный» Он назван в честь России Если вы сделали все верно, то в ответе будет самый распростра-ненный в космосе элемент, образующий самый легкий газ - водород
Слайд 10
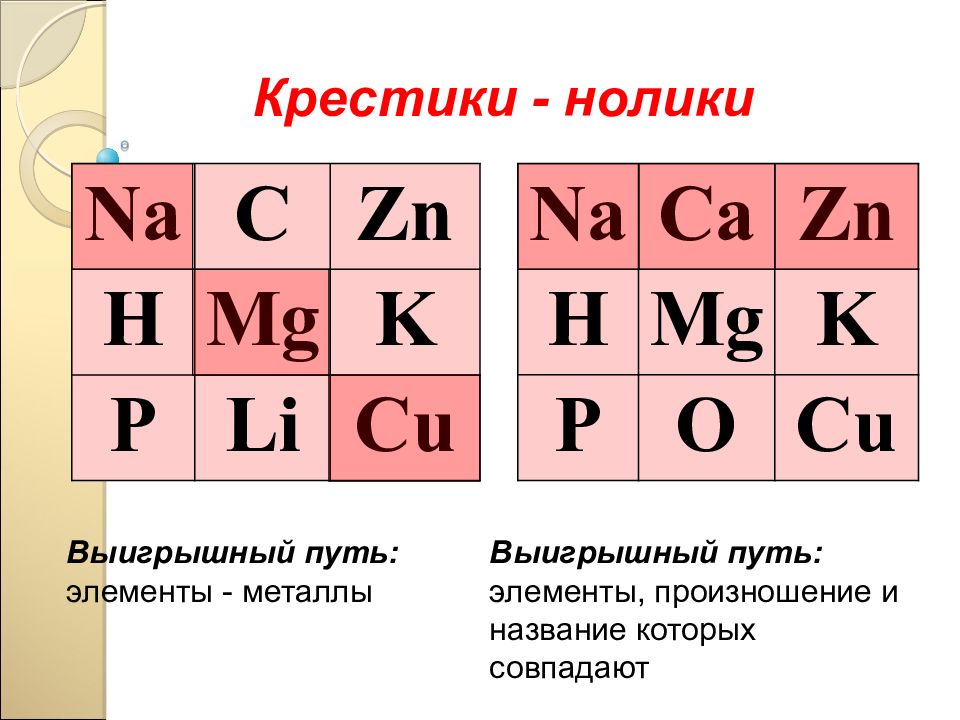
Na C Zn H Mg K P Li Cu Na C а Zn H Mg K P О Cu Крестики - нолики Выигрышный путь: элементы - металлы Выигрышный путь: элементы, произношение и название которых совпадают
Слайд 11: Сколько будет групп?
Дан список названий химических элементов: водород, менделевий, плутоний, уран, селен, кислород, тантал, эйнштейний, рутений, фосфор, скандий, кюрий. Символов химических элементов: N, Al, H, Fe, K, Ca, O, Si, Mg, Cu, Na, S, Ag, C, P, Cl, Zn Составьте из названий элементов или химических символов, похожих друг на друга по одному или нескольким признакам, группы и дайте им названия. Сколько групп получилось? Найдите другие способы классификации
Слайд 12: Древо знаний
Даны символы и названия химических элементов. Задача: предложить схему классификации, используя категории «металл-неметалл», «Элементы одной группы», «Элементы одного периода» Rb Li S Ca Te Br Zn Mg Cr Si K Cu O
Слайд 13: Дополни по аналогии
А) Be Mg Ca … … … Б) H He В С … … … В) At Br C Dy … … … Г ) Pu Np Se U … … Д) Po Os Co … …
Слайд 14
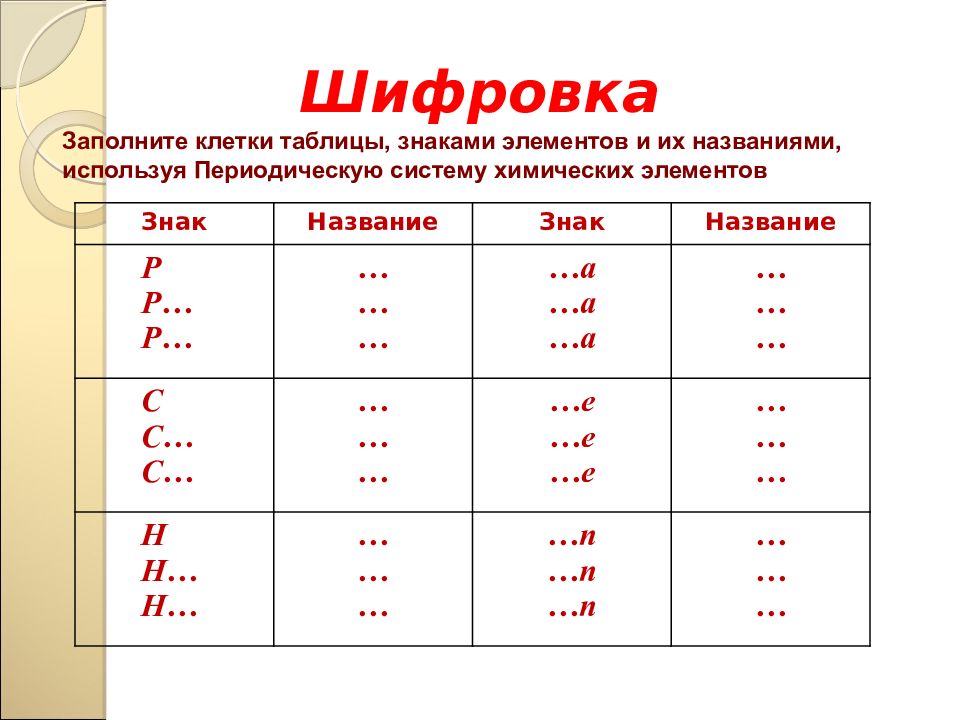
Шифровка Заполните клетки таблицы, знаками элементов и их названиями, используя Периодическую систему химических элементов Знак Название Знак Название Р Р… Р… … … … …а …а …а … … … С С… С… … … … …е …е …е … … … Н Н… Н… … … … … п … п … п … … …
Слайд 15
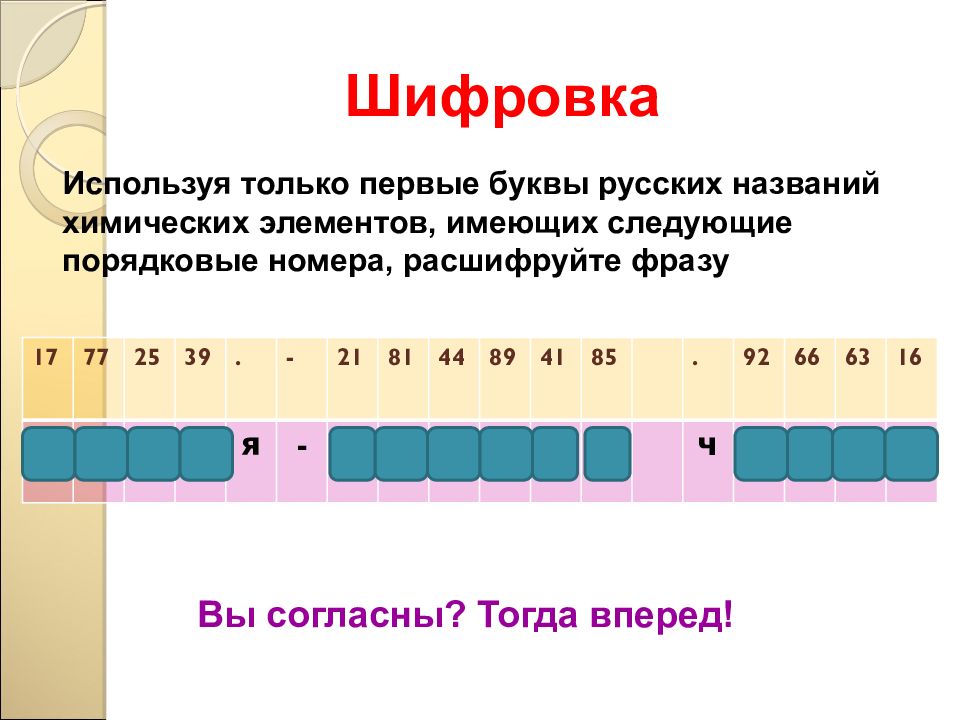
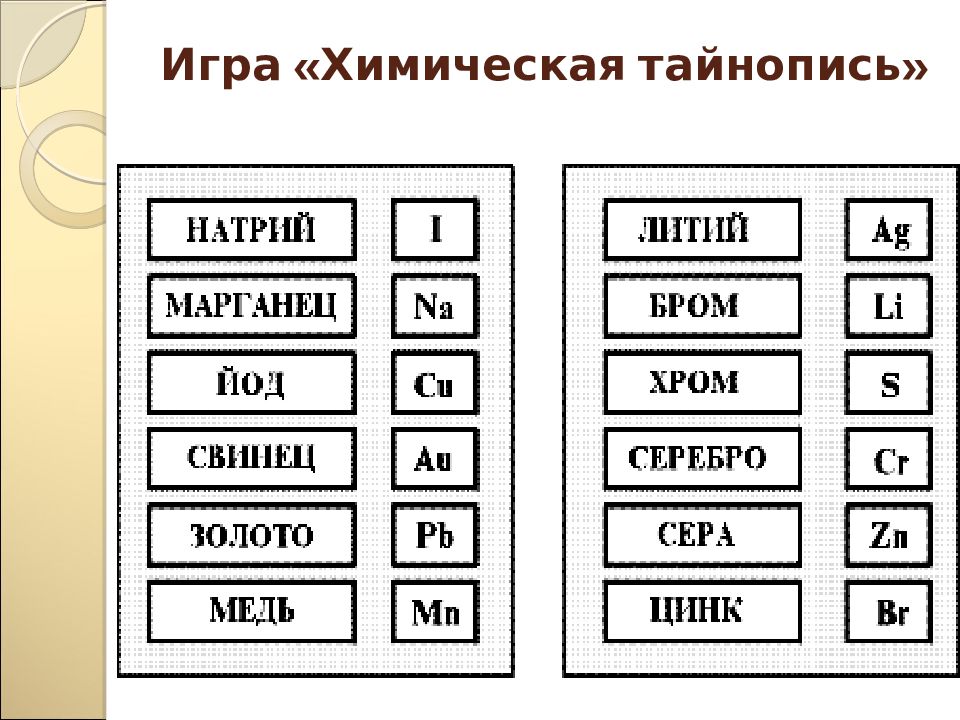
Шифровка Используя только первые буквы русских названий химических элементов, имеющих следующие порядковые номера, расшифруйте фразу 17 77 25 39 . - 21 81 44 89 41 85 . 92 66 63 16 х и м и я - с т р а н а ч у д е с Вы согласны? Тогда вперед!
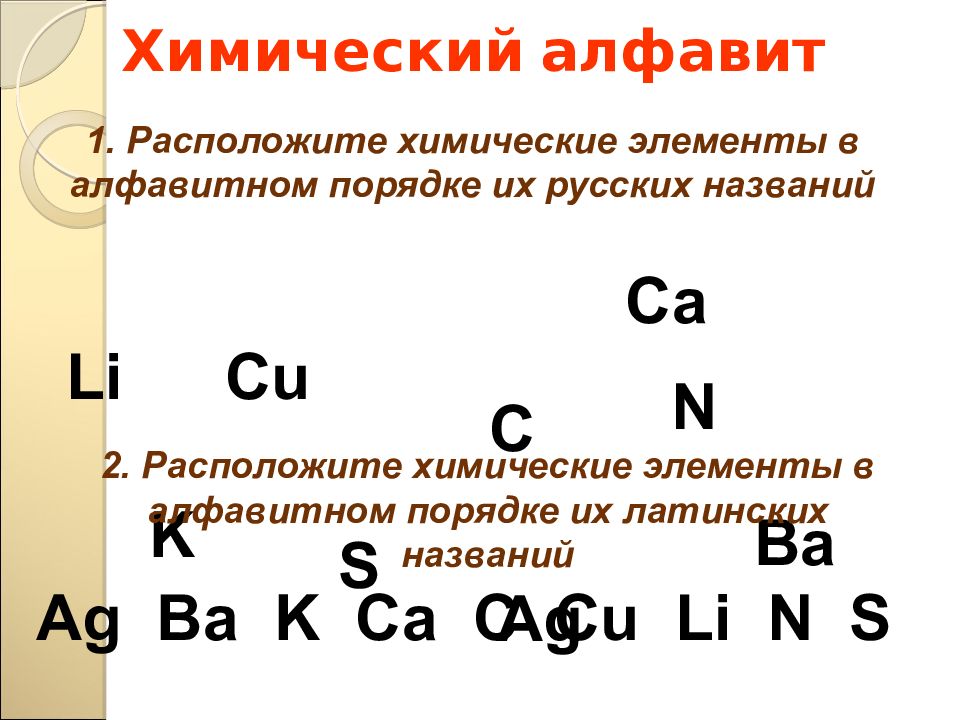
Слайд 16: Химический алфавит
С u Li Ba S С a K C Ag N 1. Расположите химические элементы в алфавитном порядке их русских названий 2. Расположите химические элементы в алфавитном порядке их латинских названий Ag Ba K Ca C Cu Li N S
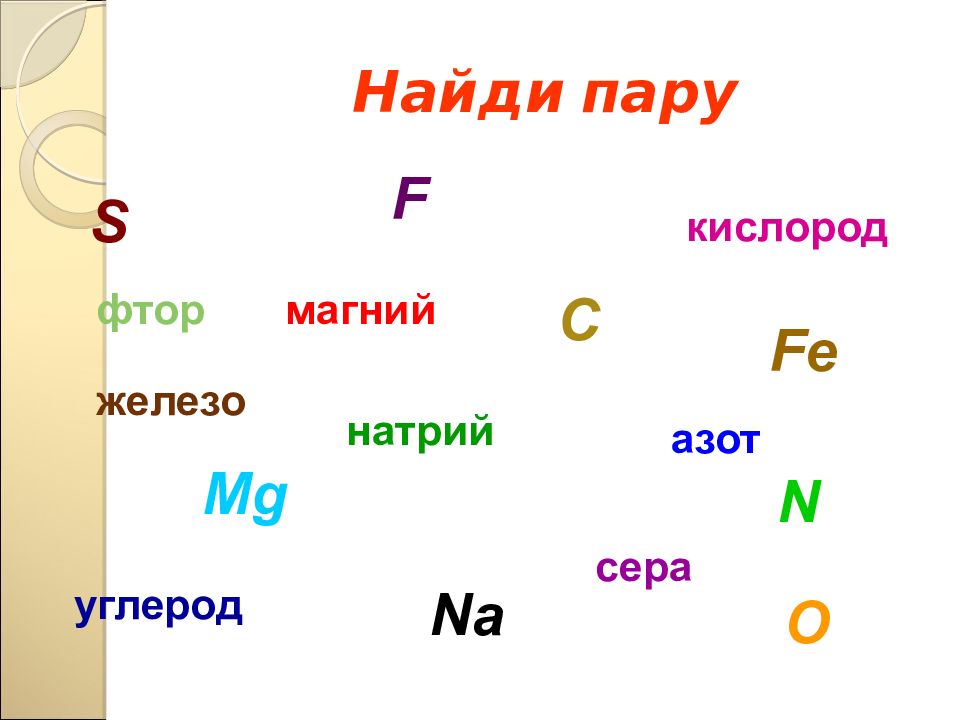
Слайд 17: Найди пару
железо сера углерод магний натрий кислород фтор азот Na Fe O C Mg F S N
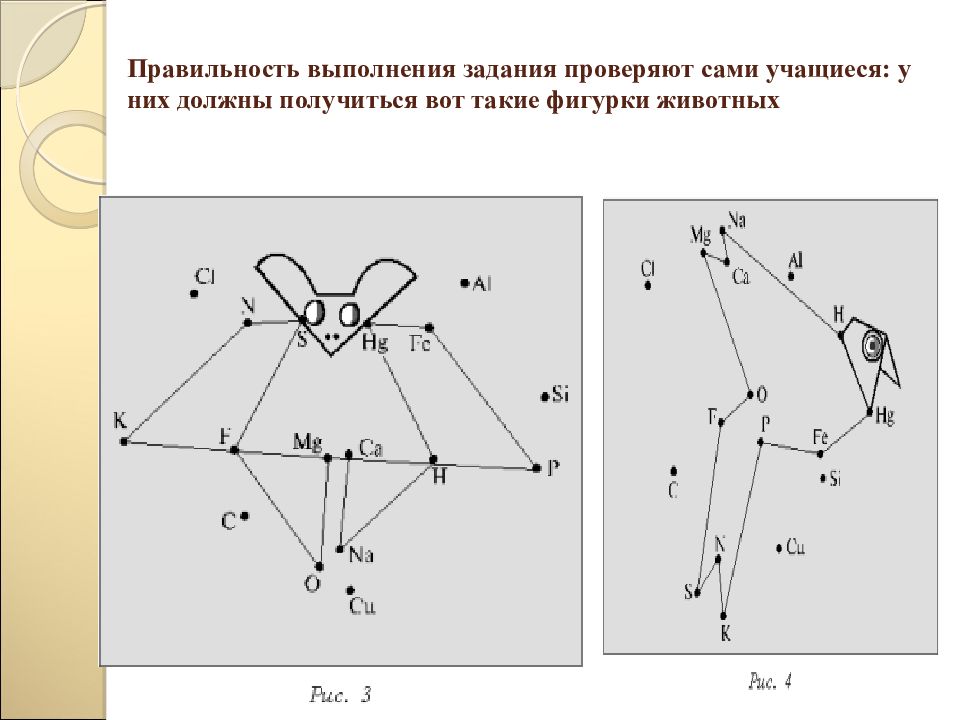
Слайд 20: Правильность выполнения задания проверяют сами учащиеся: у них должны получиться вот такие фигурки животных
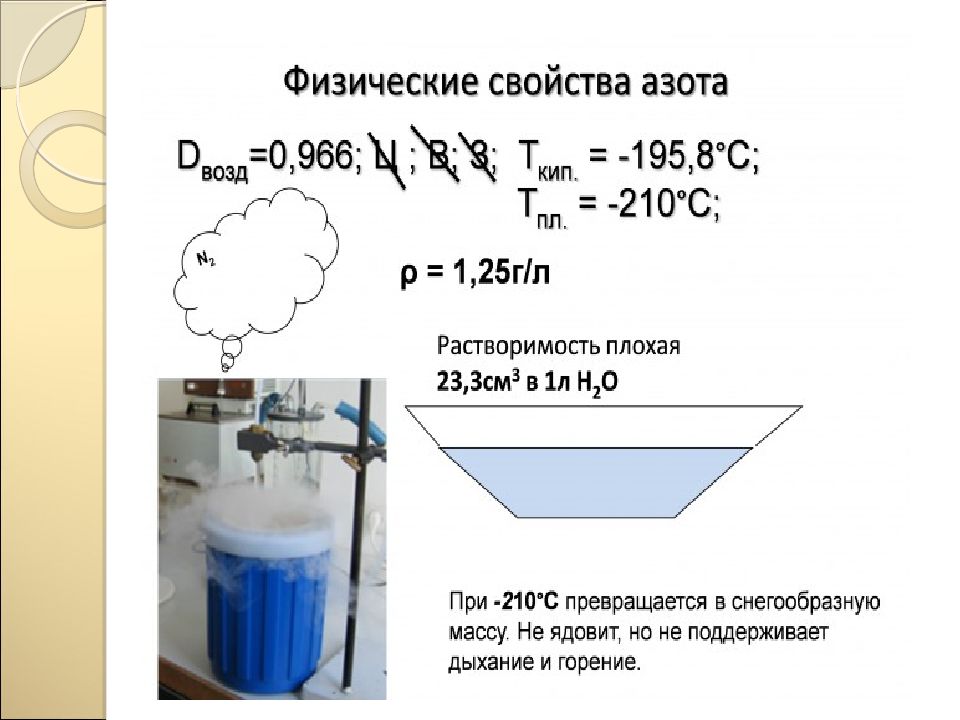
Слайд 23: Химические свойства азота
Окислительные N 2 0 2N -3 При нагревании с другими металлами (Ca, Al, Fe) При комнатной tº только с Li * При высокой tº, р, kat (Fe, оксиды Al, K) с H 2 Восстановительные N 2 0 2N +2 * При tº электрической дуги (3000 - 4000 º С) с О 2
Слайд 24: Напишите уравнения реакций, осуществив следующие переходы:
N 2 → Li 3 N → NH 3 → NO → NO 2 → HNO 3
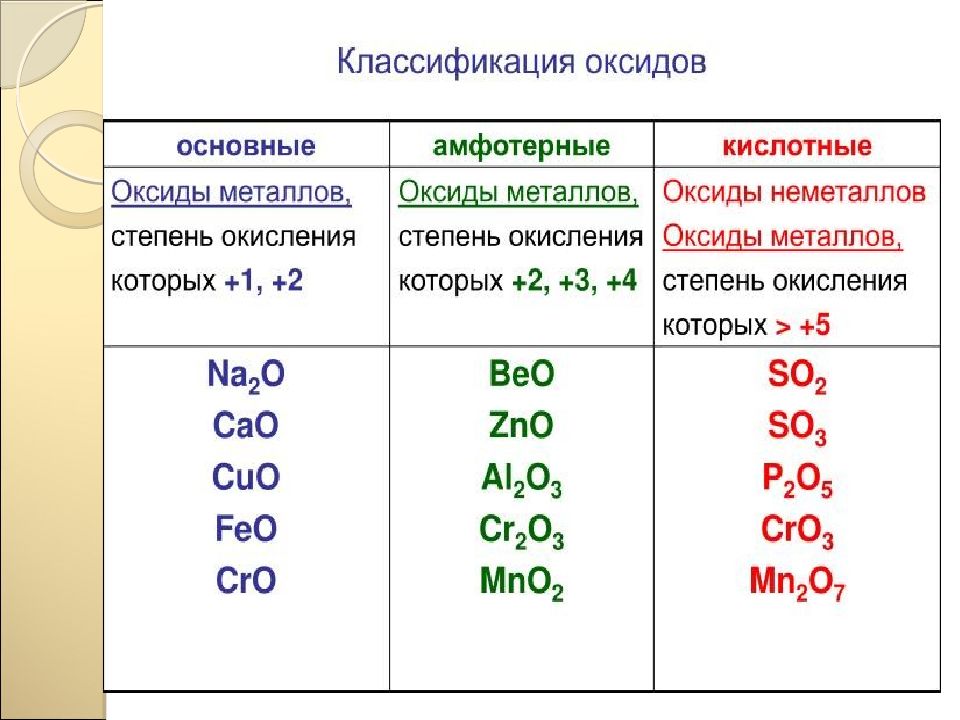
Слайд 31: Кислотные оксиды
Кислотные оксиды – это …………… 1. Выберите кислотные оксиды из списка веществ: SO 2 ; М gO; NaOH ; H 2 SO 4 ; P 2 O 5 ; SO 3 ; FeCl 3 ; К OH ; Cr 2 O 3 ; CrO 3 ; CaO. 2. Составьте формулы оксидов азота с валентностью от I до V. Определите, какой из них будет кислотный. 3. Составьте формулы оксидов марганца с валентностью II ; IV ; VII. Определите кислотные оксиды.
Слайд 32: Химические свойства кислотных оксидов
1. Взаимодействие с водой: SO 2 + H 2 O = CO 2 + H 2 O = P 2 O 5 + H 2 O = SO 3 + H 2 O = При взаимодействии кислотных оксидов с водой образуется 2. Взаимодействие с основаниями: SO 2 + NaOH = CO 2 + NaOH = P 2 O 5 + NaOH = SO 3 + К OH =
Слайд 35: Прием«Черный ящик»
Это сложное вещество обладает уникальными физическими свойствами. При очень небольшой молекулярной массе оно имеет аномально высокую температуру кипения. Образовано атомами самого распространённого элемента Вселенной и атомами самого распространённого элемента на Земле. ( ВОДА ) Камни, почву раздробил специальный бур Из земли фонтан забил, маслянист и бур. Та, что есть в фонтане этом, Всем нужна зимой и летом. В ней потом найдут бензин, И мазут, и керосин.(НЕФТЬ)
Слайд 36: Прием«Черный ящик»
тема «Этилен» задачу на вывод формулы: «Определить формулу углеводорода, в котором массовая доля углерода равна 85,7 %. Относительная плотность по водороду равна 14» темы: «Алюминий», факты из истории: «Он был открыт в 1825 году и стоил в 1500 раз дороже золота, а уже в 1855 году, Парижская выставка – демонстрировала его как самый редкий и дорогой металл, но стоимость его была уже в 10 раз дороже золота. На этой выставке Наполеон III заинтересовался брусками блестящего металла и приказал сделать из него для себя ложку. Именно благодаря прихоти Наполеона химик Девилль умудрился выбить из прижимистого императора средства на разработку этого металла. Так что ложка умудрилась послужить на благо науки»
Слайд 37: Приём «Мозговой штурм»
тема «Кислоты » Что объединяет эти фрукты? Какие ассоциации возникают у вас при упоминании слова«кислота»? Приема «Отсроченная отгадка» В начале урока учитель дает загадку (удивительный факт), отгадка к которой (ключик для понимания) будет на уроке при работе над новым материалом. Или загадка (удивительный факт) дается в конце урока, чтобы начать с нее следующее занятие.
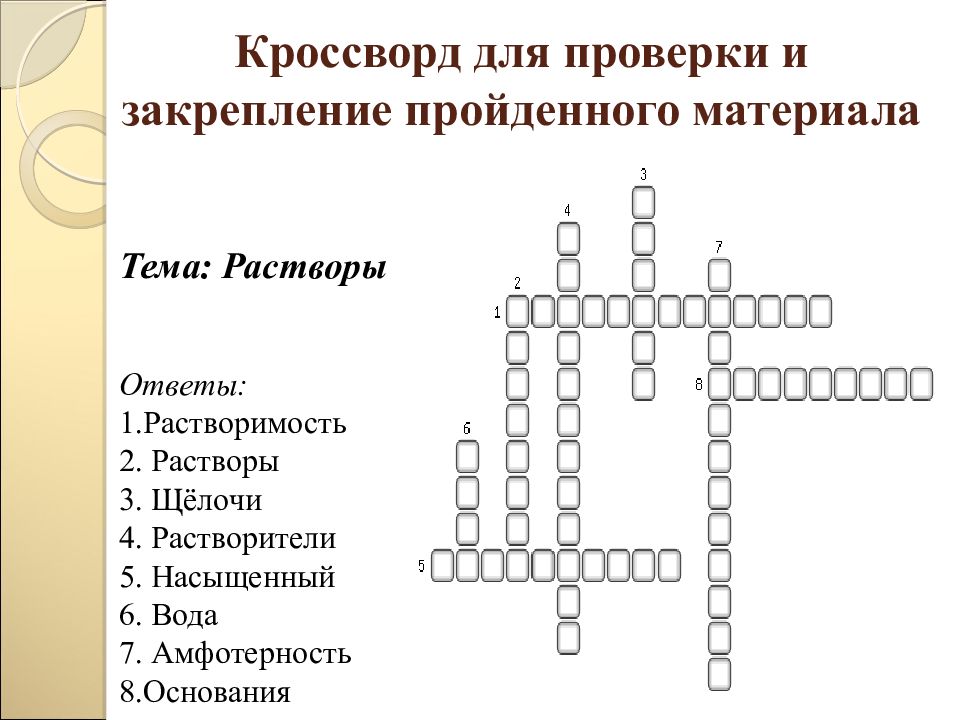
Слайд 39: Кроссворд для проверки и закрепление пройденного материала
Тема: Растворы Ответы: 1.Растворимость 2. Растворы 3. Щёлочи 4. Растворители 5. Насыщенный 6. Вода 7. Амфотерность 8.Основания
Слайд 40: Метод самостоятельного решения расчетных задач
Это вещество используют для получения искусственного меда; 26% ее содержится в сахарном тростнике; она является основным источником энергии для питания головного мозга. Про какое вещество идет речь, если известно, что 0,25 моль этого вещества имеет массу 85,5г, а массовая доля углерода – 0, 421, водорода – 0,064, кислорода – 0,547. Определите молекулярную формулу этого вещества. (Ответ:С 12 Н 22 О 11 – сахароза). Определите объем газа, который образуется при взаимодействии соляной кислоты с 40 г цинка. Определить объем газа, требуемый для «схватывания» гашеной извести, если известно, что при этом образуется 100 г. карбоната кальция.Что это за газ? Метод самостоятельного решения расчетных задач
Слайд 41: Прием «Логические операции»
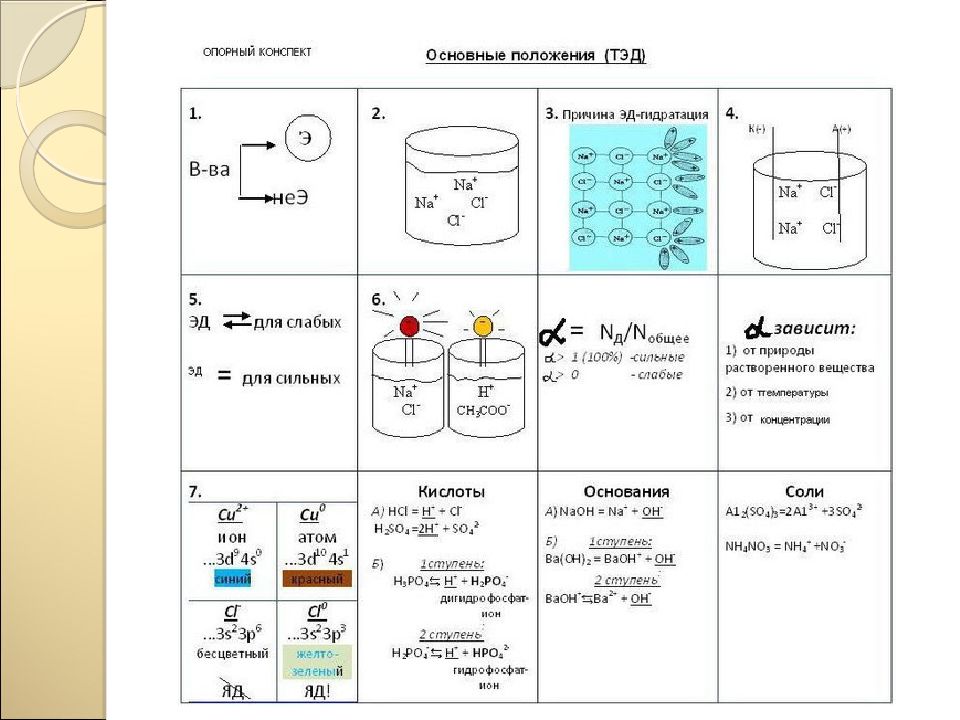
Задание «Классификация» Распределите вещества: КОН, H2S, ВаО,Н2SO4,Na3PO4, Cu(OH)2, HNO3,SO2, CaCO3, AlCl3, MgO, HCl, NaOH, AgCl по уровням: 1 уровень - 4 группы, 2 уровень - 8 групп, 3 уровень - 12 групп Прием «Поиск лишнего» Задание: Докажите, что выбранный вами «лишний» оксид отличается от четырех других: Na2O, BaO, CuO, CO2, P2O5 Прием «Моделирование» Рассмотрите символьные модели и дайте определение понятиям: «реакция обмена», «реакция соединения», «реакция замещения», «реакция разложения»,поставьте коэфициенты. AB + CD = AD + BC S + O2 = SO 3 AB = A + B H2O = H2 + O2 A + BC = AC + B Zn + HCl = ZnCl2+ H2 А + B = AB CaO+HBr=CaBr2+H2O
Слайд 42: Основные способы создания проблемных ситуаций
Показ двойственности свойств соединений Создание условий, когда ученики должны моделировать процессы, которые невозможно осуществить экспериментально Выявление противоположных свойств у веществ или процессов, принадлежащих к одной группе или типу Предложение решить экспериментальную задачу Напоминание учащимся о таких явлениях, которые они не могут объяснить на основе имеющихся у них знаний
Слайд 43: Примеры проблемных вопросов
Вы прокипятили белое бельё со стиральным порошком и содой в старом баке из оцинкованной жести и обнаружили, что на белье, которое находилось на дне бака, появились желтые пятна, а на стенках бака - белый рыхлый налёт. Почему это произошло? Напишите уравнения реакций. Как можно удалить пятна с белья и налёт со стенок бака? Что надо было сделать чтобы не испортить бельё ? Для лечения малокровия издавна применяли препараты железа. Известен и старинный народный рецепт средства от малокровия -«железное» яблоко: в яблоко (лучше антоновское) втыкают несколько гвоздей и выдерживают сутки. Затем гвозди вынимают, а яблоко съедают. Как вы можете объяснить эффективность «железного» яблока с точки зрения химии?
Слайд 45: Учебный химический эксперимент при изучении темы «Соли» Опыт 1. Физические свойства солей. Рассмотрите образцы солей из имеющихся в лаборатории. Найдите по справочнику их физические характеристики. Результаты наблюдений и физические константы занесите в таблицу
Слайд 46: Реакции кислот с металлами. Поместите в пробирку гранулу цинка и прилейте 1-2 мл раствора серной кислоты. Составьте уравнение реакции,опишите признаки реакции. Zn + H 2 SO 4 = ?
Слайд 47: Реакции нейтрализации. В три пробирки налейте по 10-15 мл разбавленного раствора (1%) гидроксида натрия, известковой воды и суспензии гидроксида меди ( II ). В первые две капните по 2-3 капли раствора фенолфталеина. Далее во все пробирки при постоянном помешивании круговыми движениями добавляйте по каплям раствор (1%) серной кислоты до исчезновения малиновой окраски в первых двух и до растворения осадка в третьей. В чем сходство и различия этих трех реакций
. 2NaOH + H 2 SO 4 = Na 2 SO 4 + 2H 2 O; Ca(OH) 2 + H 2 SO 4 = CaSO 4 + 2H 2 O; Cu(OH) 2( Тв.) + H 2 SO 4 = CuSO 4 + 2H 2 O
Слайд 49: Домашний эксперимент
Разделение смесей (тема «Чистые вещества и смеси»). Приготовьте смесь поваренной соли, земли и стружек, образующихся после заточки карандаша. Цель эксперимента: научиться разделять неоднородные смеси. Оборудование: поваренная соль, земля, стружки после заточки карандаша, стакан, вода, фильтр, ложка, сковорода. Методика проведения эксперимента:………………… Результаты эксперимента и выводы: Зарисуйте ход эксперимента. Дайте понятие неоднородным смесям. Сделайте вывод о полноте выделения веществ. На каких свойствах веществ основаны данные способы разделения смесей.
Слайд 50: Примеры домашнего эксперимента
1. Разделение смесей (тема «Чистые вещества и смеси»). Приготовьте смесь поваренной соли, земли и стружек, образующихся после заточки карандаша. 2. Взаимодействие между веществами (тема «Признаки химических реакций») Питьевая сода, поваренная соль, несколько капель уксуса 3.Выращивание кристаллов (тема «Растворы») Вырастить кристаллы из насыщенного раствора поваренной соли, медного купороса. 4. «Химическая грелка» 5. Приготовление лимонада (тема «Признаки химических реакций») 6. Изготовление леденцов («Занимательные опыты») 7.Чернила для тайнописи (тема «Занимательные опыты»).
Слайд 51: Изучение общей жёсткости водопроводной и родниковой воды г. Саратова
приготовление необходимых растворов
Слайд 52
Используемые реактивы Готовый к анализу реактив Создание щелочной среды Добавление реагента Окраска раствора до титрования Окраска раствора после титрования
Слайд 53
Оценка техногенной трансформации почв территории Городского парка культуры и отдыха им. М. Горького (г. Саратов)
Слайд 54: Использование петромагнитной характеристики почв, как индикатора загрязнения тяжёлыми металлами
Обработка проб в лаборатории
Слайд 55: Достижения учащихся в НПК 2018-2019
1.Назарова А. (10б), Хохлова К. (11б) - НПК «Мы – будущее 21 века» (2 и 3 место) 2. Гимранов К. (10б) -5-я НПК юных экологов (3 место) 3. Хохлова Ксения (11б) - 18 МНПК «Одиссея разума» (3 место) 4.Дворкина И. (11б) - II НПК «Эврика» 2018г (2 место) 5.Аббасова А. (9а)- Регион. конкурс «Вода - наше богатство» (1м) 6. Хохлова Ксения (11б)- Всерос. НПК по экологии «ОСА-2018» 7..Хохлова Ксения (11б)- Междун. форум «СГАУ» (3 место) 8.Соловьева Дарья(9а) Регион. конкурс "Моя планета"( 1 место) 9.Старникова В.(9в)- НПК Прорыв в науку 21 век.(1 место) 10.Кудряшева Я.- Российский национального конкурса проектов по охране и восстановления водных ресурсов (диплом 1 место) 13. Ермолаева К.-МНПК «Зеленая волна Саратова» (2 место) 14. Ермолаева К.Региональная НПК «Шаг в науку» (2 место)
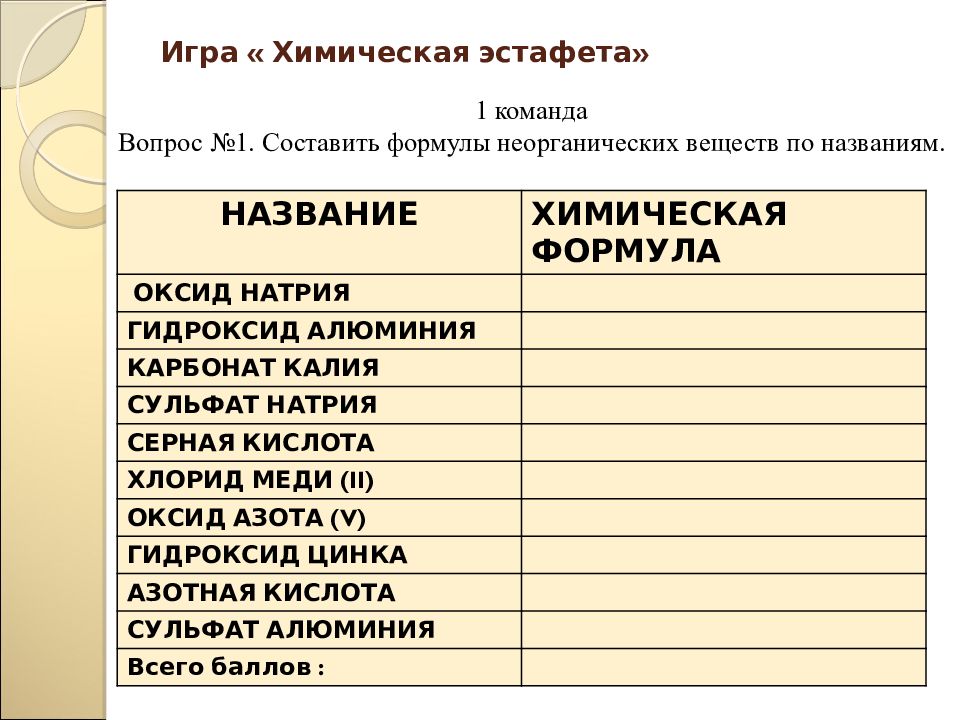
Слайд 56: Игра « Химическая эстафета»
НАЗВАНИЕ ХИМИЧЕСКАЯ ФОРМУЛА ОКСИД НАТРИЯ ГИДРОКСИД АЛЮМИНИЯ КАРБОНАТ КАЛИЯ СУЛЬФАТ НАТРИЯ СЕРНАЯ КИСЛОТА ХЛОРИД МЕДИ ( II) ОКСИД АЗОТА ( V ) ГИДРОКСИД ЦИНКА АЗОТНАЯ КИСЛОТА СУЛЬФАТ АЛЮМИНИЯ Всего баллов : 1 команда Вопрос №1. Составить формулы неорганических веществ по названиям.
Слайд 57: Вода – уникальное вещество планеты»
Подготовить информацию о воде по следующим разделам: 1)Распространение воды на нашей планете. 2)Вода – среда обитания животных и растений. 3)Уникальные физические свойства воды. 4)Химические свойства воды.
Слайд 58: Заключение
Мотивация-фактор успешного обучения учащихся на уроках В практике обучения есть положительные и отрицательные факторы влияющие на мотивацию Для развития мотивации нужно использовать все средства совершенствования учебного процесса