Первый слайд презентации: ЗАНИМАТЕЛЬНАЯ ХИМИЯ
ТЕМА : МНОГООБРАЗИЕ НЕОРГАНИЧЕСКИХ ВЕЩЕСТВ. КИСЛОТЫ. СВОЙСТВА И КЛАССИФИКАЦИЯ. Центр дополнительного образования «Дом научной коллаборации им. П.К. Анохина» при ФГБОУ ВО «ПИМУ» Минздрава России
Слайд 3
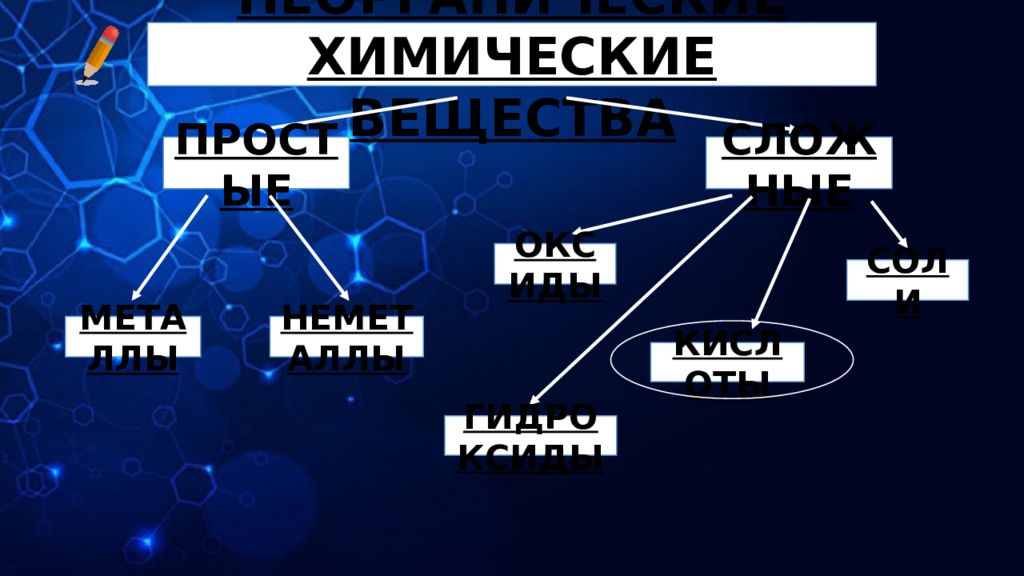
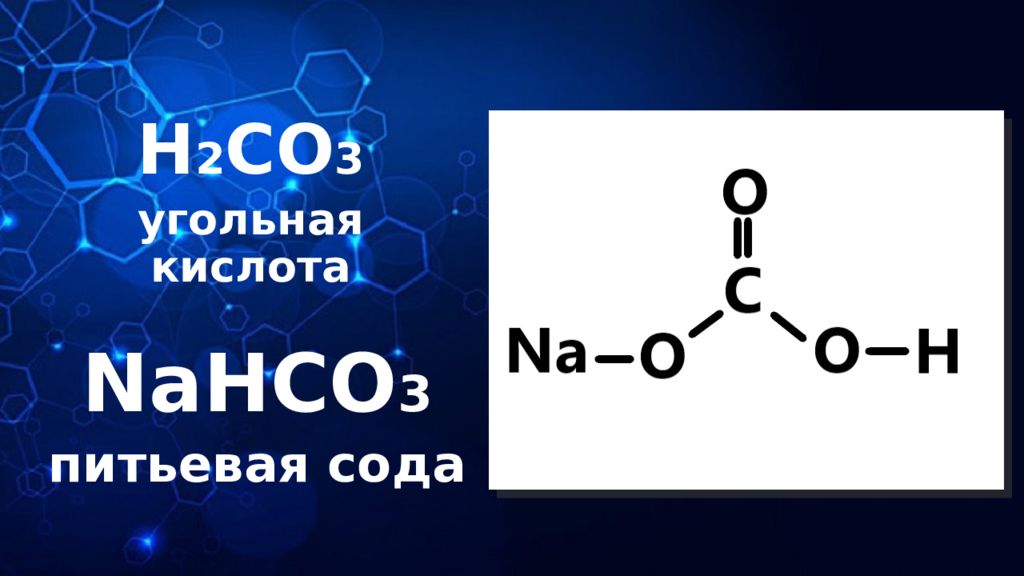
ХИМИЧЕСКИЕ ВЕЩЕСТВА НЕОРГАНИЧЕСКИЕ ОРГАНИЧЕСКИЕ ХИМИЧЕСКИЕ СОЕДИНЕНИЯ, В СОСТАВ КОТОРЫХ ВСЕГДА ВХОДИТ УГЛЕРОД (С) И ВОДОРОД (Н). ТРИВИАЛЬНОЕ НАЗВАНИЕ: УГЛЕВОДОРОДЫ CH 3 COOH CH 2 O C 6 H 12 O 6 ХИМИЧЕСКИЕ СОЕДИНЕНИЯ, НЕ СОДЕРЖАЩИЕ В СВОЕЙ ОСНОВЕ УГЛЕРОД (С) И ВОДОРОД (Н). FeCl 3 Cu(OH) 2 NaHCO 3
Слайд 4
НЕОРГАНИЧЕСКИЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА ПРОСТЫЕ МЕТАЛЛЫ СЛОЖНЫЕ НЕМЕТАЛЛЫ ОКСИДЫ ГИДРОКСИДЫ КИСЛОТЫ СОЛИ
Слайд 5
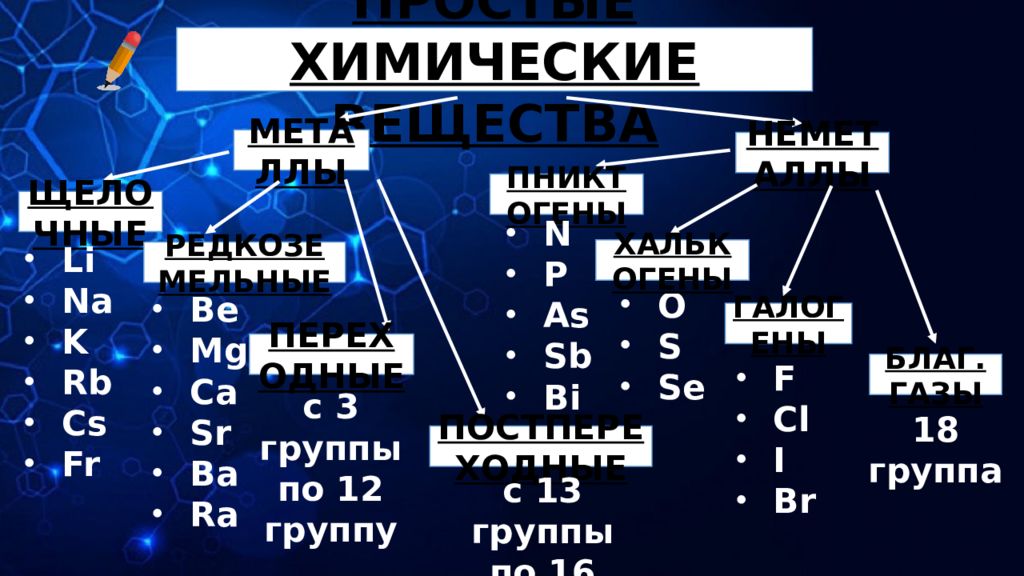
ПРОСТЫЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА МЕТАЛЛЫ НЕМЕТАЛЛЫ ЩЕЛОЧНЫЕ Li Na K Rb Cs Fr РЕДКОЗЕМЕЛЬНЫЕ Be Mg Ca Sr Ba Ra ПЕРЕХОДНЫЕ с 3 группы по 12 группу ПОСТПЕРЕХОДНЫЕ с 13 группы по 16 группу ПНИКТОГЕНЫ O S Se ХАЛЬКОГЕНЫ N P As Sb Bi ГАЛОГЕНЫ БЛАГ. ГАЗЫ F Cl I Br 18 группа
Слайд 6
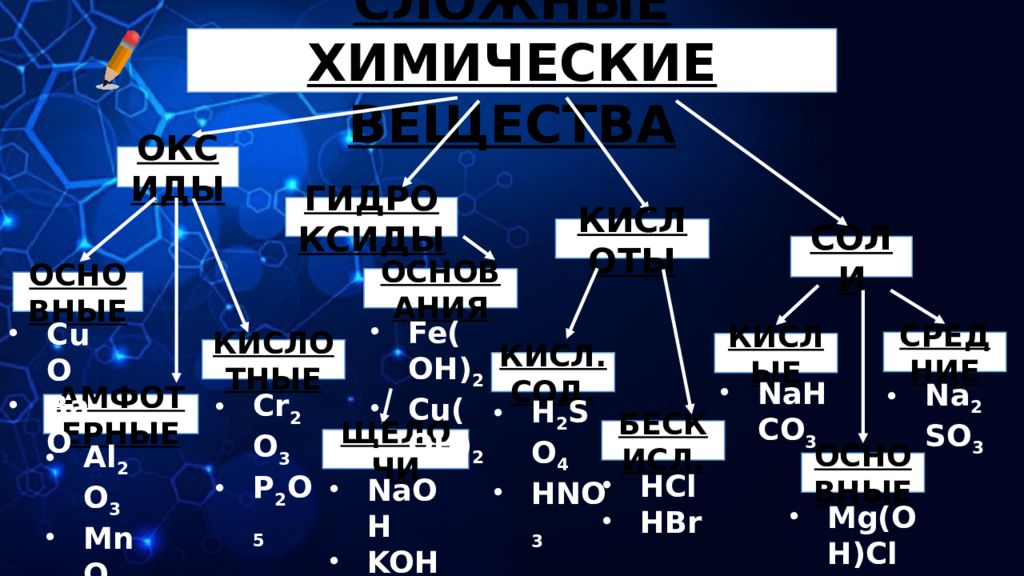
СЛОЖНЫЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА ОКСИДЫ ГИДРОКСИДЫ КИСЛОТЫ СОЛИ ОСНОВНЫЕ АМФОТЕРНЫЕ КИСЛОТНЫЕ CuO BaO Cr 2 O 3 P 2 O 5 Al 2 O 3 MnO 2 ОСНОВАНИЯ ЩЕЛОЧИ Fe(OH) 2 Cu(OH) 2 NaOH KOH КИСЛ.СОД. БЕСКИСЛ. H 2 SO 4 HNO 3 HCl HBr КИСЛЫЕ СРЕДНИЕ ОСНОВНЫЕ NaHCO 3 Na 2 SO 3 Mg(OH)Cl
Слайд 7: ХИМИЧЕСКИЕ ВЕЩЕСТВА: КИСЛОТЫ
КИСЛОТЫ – ЭТО СЛОЖНЫЕ ХИМИЧЕСКИЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ ОДНОГО ИЛИ НЕСКОЛЬКИХ АТОМОВ ВОДОРОДА, СПОСОБНЫХ ЗАМЕЩАТЬСЯ АТОМАМИ МЕТАЛЛА, И КИСЛОТНЫХ ОСТАТКОВ.
Слайд 9
КИСЛОТНЫЙ ОСТАТОК – ЭТО ВСЕГДА АНИОН (ТО ЕСТЬ ОТРИЦАТЕЛЬНО ЗАРЯЖЕННАЯ ЧАСТИЦА) И ЗАРЯД АНИОНА ВСЕГДА РАВЕН ЧИСЛУ АТОМОВ ВОДОРОДА В КИСЛОТЕ.
Слайд 11
HI ЙОДОВОДОРОДНАЯ КИСЛОТА ПРИМЕР КЛАССИФИКАЦИИ: бескислородная; одноосновная; растворимая; летучая; неустойчива к t ⁰; неметаллосодержащая.
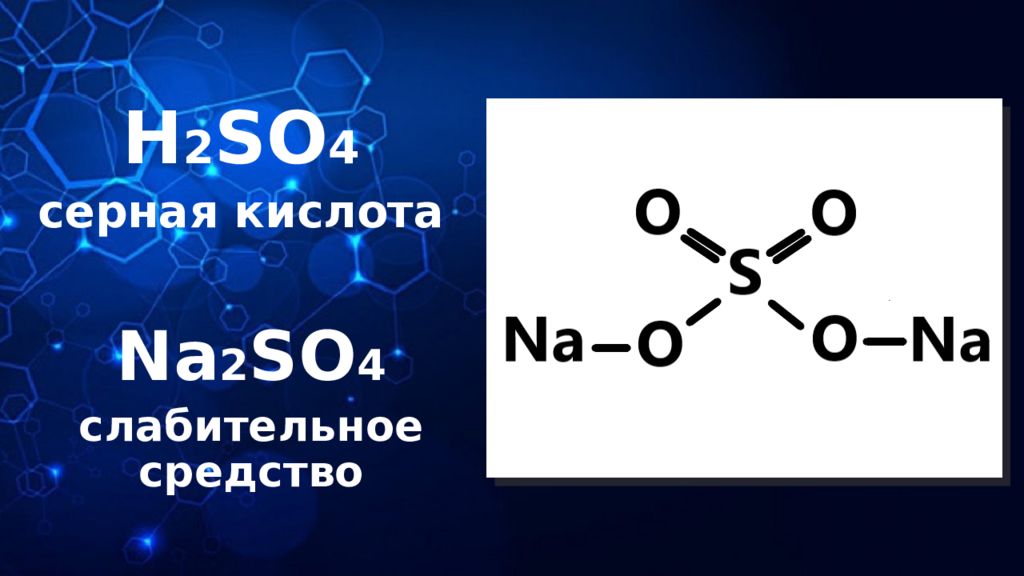
Слайд 12: СЕРНАЯ КИСЛОТА: физические свойства
КОНЦЕНТРИРОВАННАЯ СЕРНАЯ КИСЛОТА: тяжелая, плотная, маслянистая жидкость без цвета и запаха. Предельная концентрация: 100% Имеет формулу: H 2 SO 4
Слайд 13: СЕРНАЯ КИСЛОТА: химические свойства
СЕРНАЯ КИСЛОТА: окисляет угарный газ до углекислого: CO + H 2 SO 4 → CO 2 ↑ + SO 2 + H 2 O разбавленная H 2 SO 4 взаимодействует со всеми Ме, находящимися в электрохимическом ряду левее H 2 : Fe + H 2 SO 4 ( разб.) → FeSO 4 + H 2 ↑ качественная реакция на сульфат-ион. Продукт реакции – белый осадок сульфата бария – нерастворимый в воде и кислотах: H 2 SO 4 + BaCl 2 → BaSO 4 ↓ + 2HCl↑
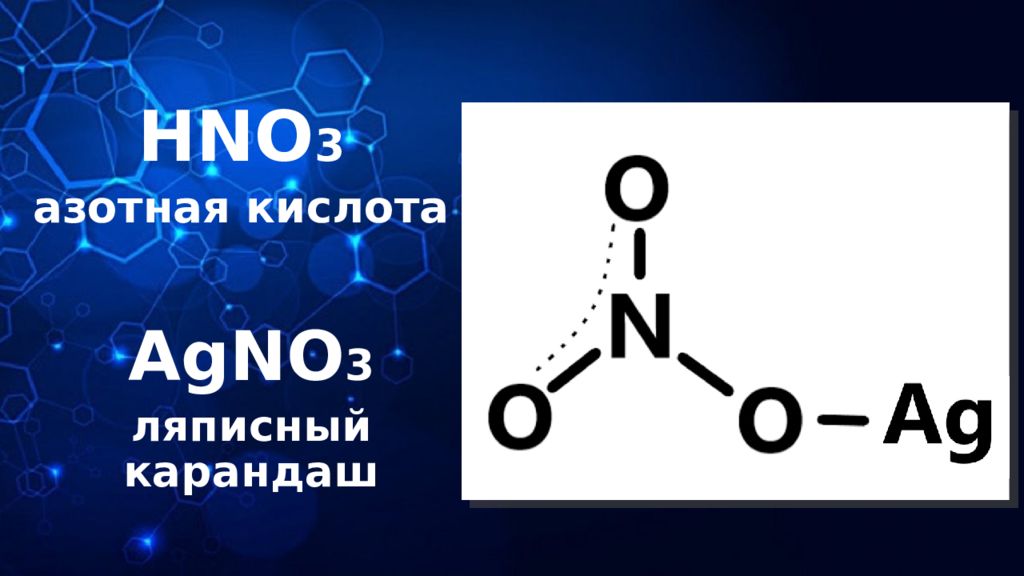
Слайд 14: АЗОТНАЯ КИСЛОТА: физические свойства
КОНЦЕНТРИРОВАННАЯ АЗОТНАЯ КИСЛОТА: бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. Предельная концентрация: 100% Имеет формулу: HNO 3
Слайд 15: АЗОТНАЯ КИСЛОТА: химические свойства
АЗОТНАЯ КИСЛОТА: золото, платина, иридий, родий и тантал инертны к азотной кислоте во всем диапазоне концентраций (т.е. не реагируют с ней); с Ме, находящимися в электрохимическом ряду и левее и правее H 2 реагирует по-разному, в зависимости от ее концентрации, например 3Cu + HNO 3 (30% ) → Cu(NO 3 ) 2 + 2NO↑ + 4H 2 O Cu + 4HNO 3 (60%) → Cu(NO 3 ) 2 + 2NO 2 ↑ + 2 H 2 O высококонцентрированная HNO 3 имеет бурую окраску вследствие происходящего на свету процесса разложения HNO 3 → 4NO 2 ↑ + 2 H 2 O + O 2 ↑
Слайд 16: СОЛЯНАЯ КИСЛОТА: физические свойства
КОНЦЕНТРИРОВАННАЯ СОЛЯНАЯ КИСЛОТА: бесцветная жидкость с резким удушливым запахом, дымящая на воздухе. Предельная концентрация: 40% Имеет формулу: H С l
Слайд 17: СОЛЯНАЯ КИСЛОТА: химические свойства
СОЛЯНАЯ КИСЛОТА: взаимодействует с Ме, стоящими в электрохимическом ряду левее H 2 : HCl + NaCl → 2NaCl + H 2 ↑ качественная реакция на хлорид-ион. Продукт реакции – белый студенистый осадок хлорида серебра – нерастворимый в азотной кислоте: H С l + AgNO 3 → AgCl↓ + HNO 3 ↑
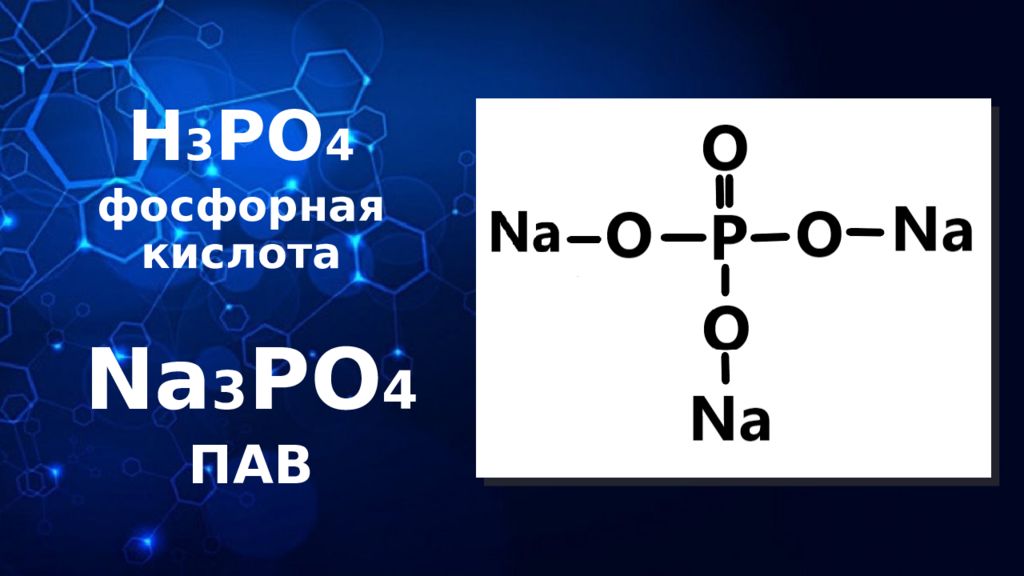
Слайд 18: ФОСФОРНАЯ КИСЛОТА: физические свойства
КОНЦЕНТРИРОВАННАЯ ФОСФОРНАЯ КИСЛОТА: тяжелая, плотная, маслянистая жидкость без цвета и запаха. Предельная концентрация: 100% Имеет формулу: H 3 PO 4
Слайд 19: ФОСФОРНАЯ КИСЛОТА: химические свойства
ФОСФОРНАЯ КИСЛОТА: взаимодействует с Ме, стоящими в электрохимическом ряду левее H 2 : 3H 3 PO 4 + 3Mg → Mg 3 (PO 4 ) 2 + 3 H 2 ↑ качественная реакция на хлорид-ион. Продукт реакции – ярко-желтый осадок фосфата серебра: 3H 3 PO 4 + 3AgNO 3 → Ag 3 PO 4 ↓ + 3HNO 3
Слайд 26
ДОМАШНЕЕ ЗАДАНИЕ Составить классификацию любой кислоты (нельзя использовать йодоводородную ); Как применяются в быту и в промышленности соляная, серная, азотная и фосфорная кислоты.
Слайд 28
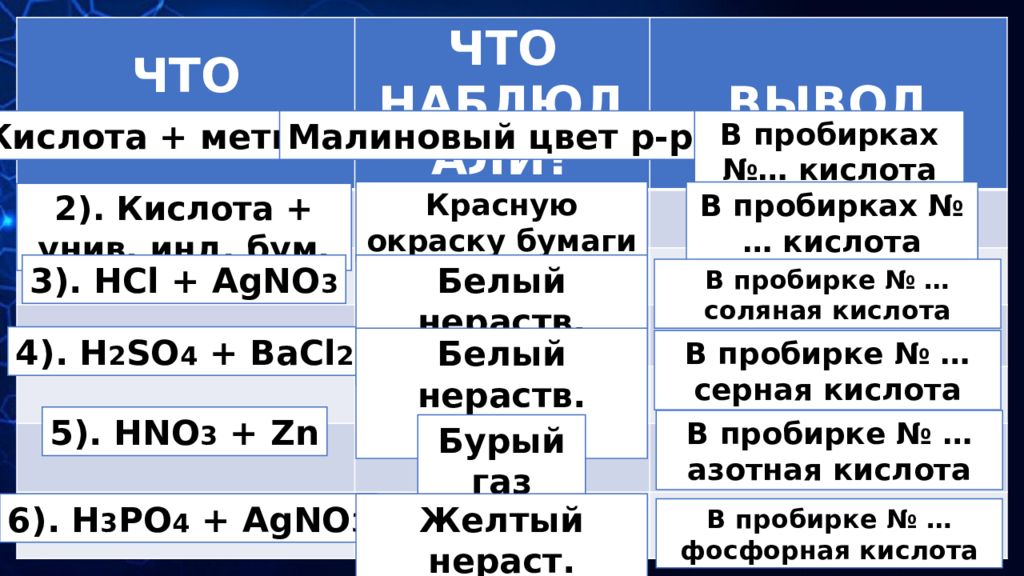
ЧТО ДЕЛАЛИ? ЧТО НАБЛЮДАЛИ? ВЫВОД 1). Кислота + метилоранж Малиновый цвет р- ра В пробирках №… кислота 2). Кислота + унив. инд. бум. Красную окраску бумаги В пробирках № … кислота 3). HCl + AgNO 3 4). H 2 SO 4 + BaCl 2 5). HNO 3 + Zn 6). H 3 PO 4 + AgNO 3 Белый нераств. осадок Белый нераств. осадок Бурый газ Желтый нераст. осадок В пробирке № … соляная кислота В пробирке № … серная кислота В пробирке № … азотная кислота В пробирке № … фосфорная кислота
Слайд 29
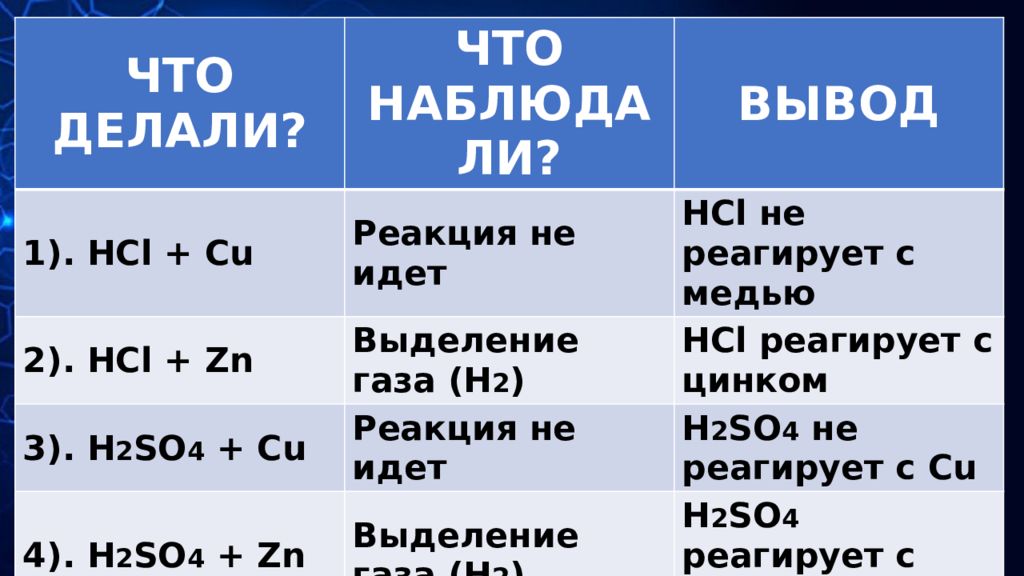
ЧТО ДЕЛАЛИ? ЧТО НАБЛЮДАЛИ? ВЫВОД 1). HCl + Cu Реакция не идет HCl не реагирует с медью 2). HCl + Zn Выделение газа ( H 2 ) HCl реагирует с цинком 3). H 2 SO 4 + Cu Реакция не идет H 2 SO 4 не реагирует с Cu 4). H 2 SO 4 + Zn Выделение газа ( H 2 ) H 2 SO 4 реагирует с цинком 5). HNO 3 + Cu Выделение газа ( H 2 ) HNO 3 реагирует с медью 6). HNO 3 + Zn Выделение газа ( NO 2 ) HNO 3 реагирует с цинком 7). H 3 PO 4 + Cu Реакция не идет H 3 PO 4 не реагирует с Cu 8). H 3 PO 4 + Zn Выделение газа ( H 2 ) H 3 PO 4 реагирует с цинком