Слайд 2: Цель проведения теста «Растворение»
сравнения профилей кинетики растворения ин витро ( сравнительнй тест кинетики растворения); сравнения скорости высвобождения АФИ изГЛФ и перехода его в жидкую фазу; для установления эквивалентности биофармацевтических свойств ЛП при изменении состава, места и технологии производства, изменений объема промышленных серий ЛП; для обоснованного отказа от проведения исследований биоэквивалентности некоторых ЛП; для определения ин виво /ин витро корреляции между растворением и др. Цель проведения теста «Растворение»
Слайд 3: Спецификация
Для препаратов немедленного высвобождения контроль в одной точке отсчета времени (чаще всего – 45 минут ) Для препаратов с модифицированным в ысвобождением: таблетки с отсроченным высвобождением – после 2 часов нахождения в кислой среде и 45-60 минут в буферной среде таблетки с пролонгированным высвобождением – через 1-2 часа; через 5-8 часов и через такой промежуток времени, при котором можно продемонстрировать полное высвобождение действующего вещества Спецификация
Слайд 4: Аппаратура для проведения теста «Растворение»
«Лопастная мешалка» Аппаратура для проведения теста «Растворение»
Слайд 5: Аппаратура для проведения теста «Растворение»
«Вращающаяся корзинка» Аппаратура для проведения теста «Растворение»
Слайд 6: Скорость вращения мешалки
для аппарата «Вращающаяся корзинка » - 100 об/мин (максимально 180-200 об\мин для пролонгированных форм) для аппарата «Лопастная мешалка » - 50 об/мин (25-250об\мин) Оптимально – 75 об\мин для препятствия образования конуса. Скорость вращения мешалки
Слайд 7: Среда растворения
Рекомендуема Фармакопеей вода очищенная, хлористоводородной кислоты раствор 0,1 М, буферные растворы с рН 6,8-7,8 (допустимое отклонение значений рН ±0,05), другие растворы, указанные в фармакопейной статье или нормативной документации. Среда растворения
Слайд 8: Среда растворения
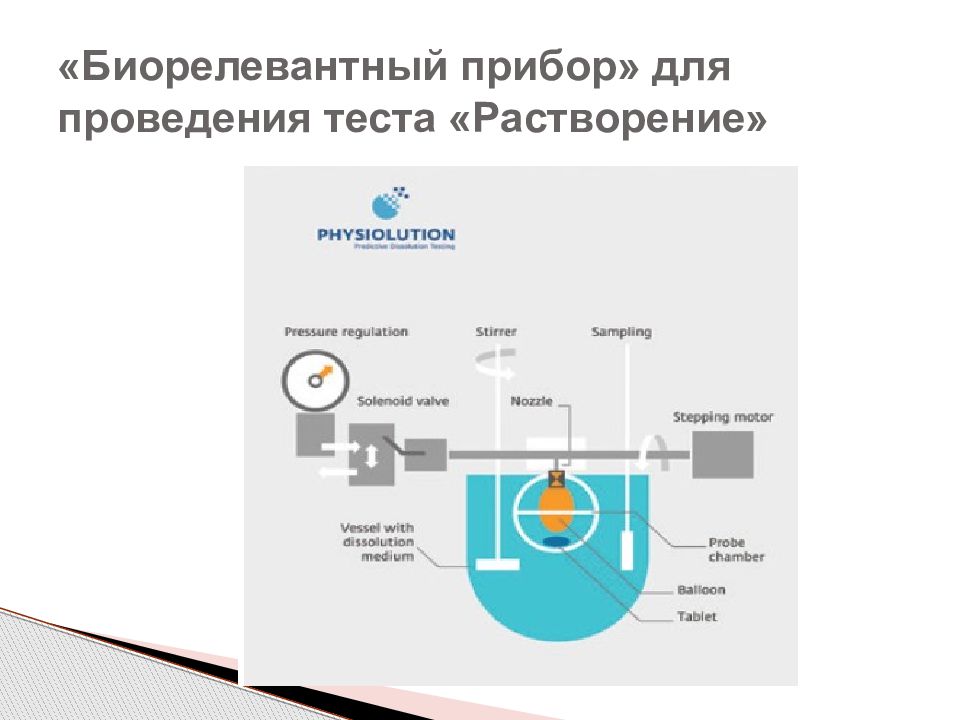
Биорелевантные среды - среды растворения, максимально приближенные к внутренним жидкостям человеческого организма как по химическому состав, так и по физико-химическим свойстам (рН, осмолярность, буферная емкость, поверхностное натяжение). Среда растворения
Слайд 9: Среда растворения
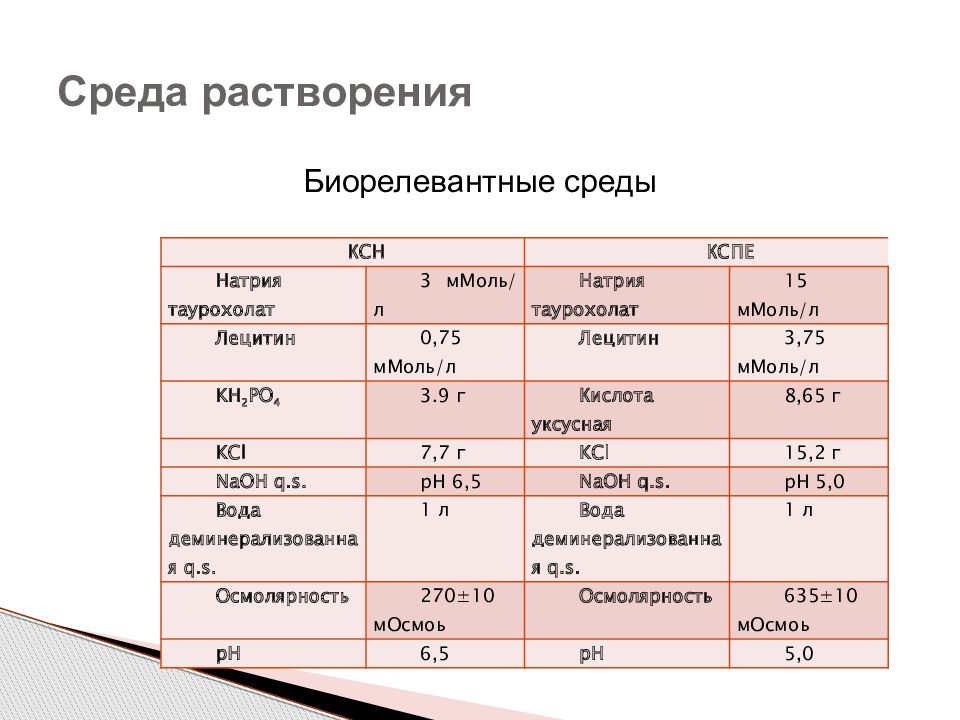
Биорелевантные среды Среда растворения КСН КСПЕ Натрия таурохолат 3 мМоль/л Натрия таурохолат 15 мМоль/л Лецитин 0,75 мМоль/л Лецитин 3,75 мМоль/л KH 2 PO 4 3.9 г Кислота уксусная 8,65 г KCl 7,7 г KCl 15,2 г NaOH q.s. рН 6,5 NaOH q.s. рН 5,0 Вода деминерализованная q.s. 1 л Вода деминерализованная q.s. 1 л Осмолярность 270±10 мОсмоь Осмолярность 635±10 мОсмоь рН 6,5 рН 5,0
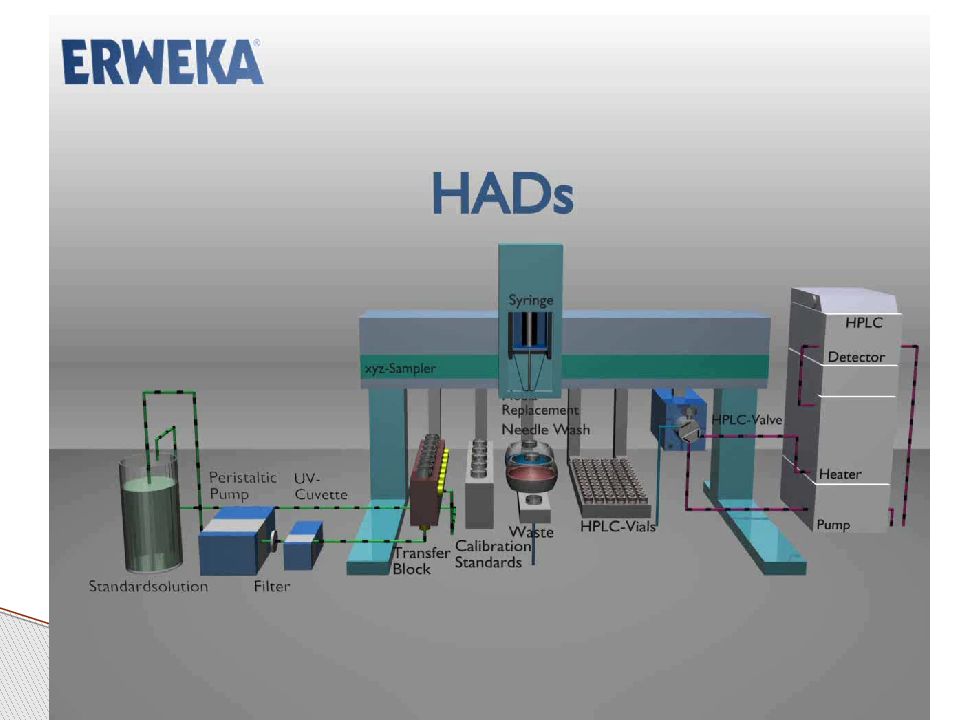
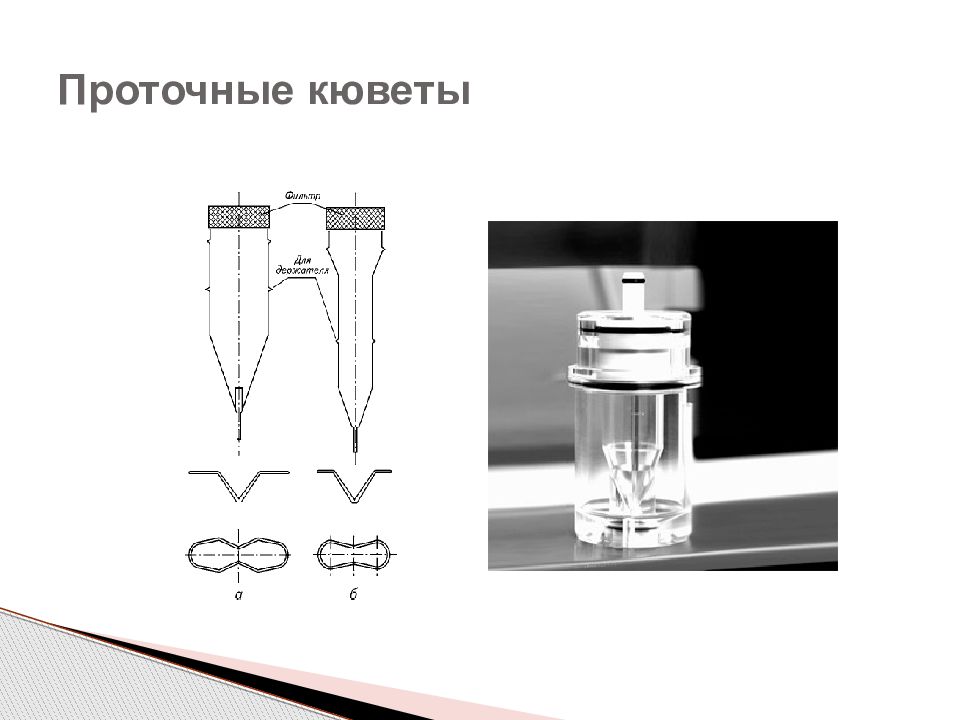
Слайд 11: Системы с ручным отбором проб
Достоинства: сравнительно небольшая стоимость, просты в использовании, сорбция лекарственных веществ на поверхностях таких систем незначительна, количественное определение возможно проводить различными методами Недостатки: невысокую производительность – можно проанализировать не более 6 таблеток одновременно, необходимо выполнять вручную большое количество операций в ремя изучения кинетики растворения на данной системе не должно превыщать 8 часов Системы с ручным отбором проб
Слайд 12: Полуавтоматические системы
Слайд 13: Полуавтоматические системы
Достоинства: некоторые операции выполняются автоматически (отбор проб, расчет результатов, происходит непрерывный мониторинг температуры в сосудах, скорость вращения мешалок и время отбора проб). и зучение кинетики растворения может проводиться от 1 до 24 часов. о дновременно исследуются до 12 таблеток Недостатки: некоторые операции аналитик проводит вручную (внесение таблеток в стаканы, заполнение стаканов средой растворения и их мойку) Полуавтоматические системы
Слайд 27
Биовейвер – процедура, в соответствии с которой определение взаимозаменяемости и регистрации генериков проводятся на основании их биофармацевтических свойств ( по БКС) и эквивалентности in vitro (изучения сравнительной кинетики растворения ) либо другими методами in vitro как альтернатива исследованиям биоэквивалентности in vivo.
Слайд 28: Условия проведения процедуры биовейвер
твердая лекарственная форма немедленного высвобождения системного действия. активная фармацевтическая субстанция (АФС) должна обладать широким терапевтическим индексом, относиться к 1-3 классу по БКС. вспомогательные вещества, входящие в состав исследуемых лекарственных препаратов, не должны влиять на высвобождение АФС при проведении испытаний. Условия проведения процедуры биовейвер
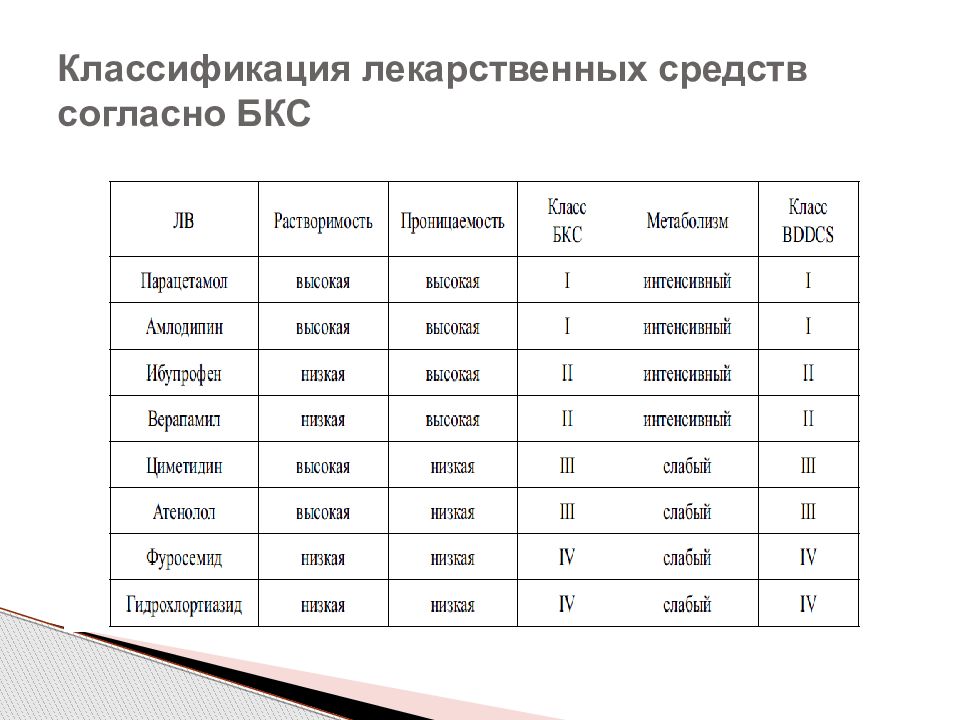
Слайд 29: Биофармацевтическая классификационная система
I класс «Высокая» растворимость «Высокая» проницаемость II класс «Высокая» растворимость «Низкая» проницаемость III класс «Низкая» растворимость «Высокая» проницаемость IV класс «Низкая» растворимость «Низкая» проницаемость Биофармацевтическая классификационная система