Первый слайд презентации
Сванте Аррениус Теория электролитической диссоциации 1877 г.
Слайд 3
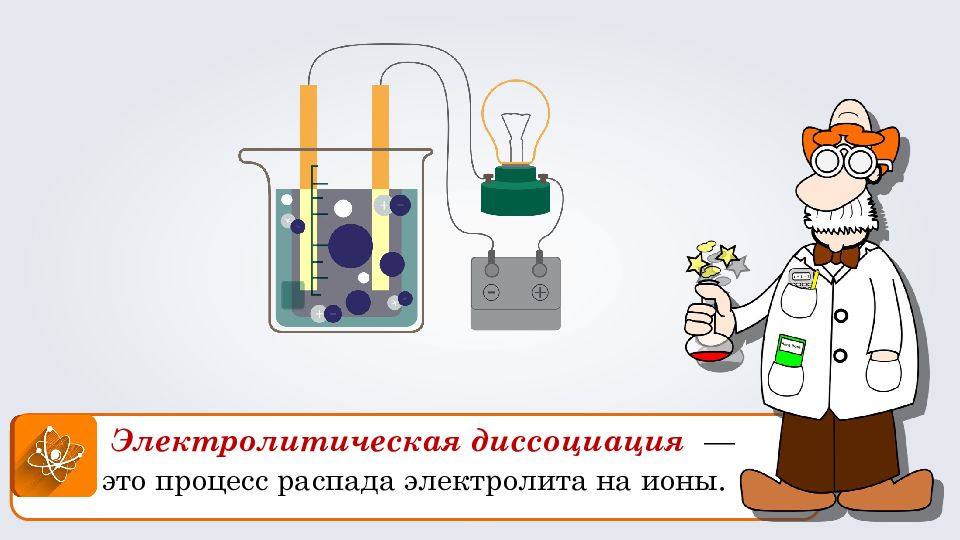
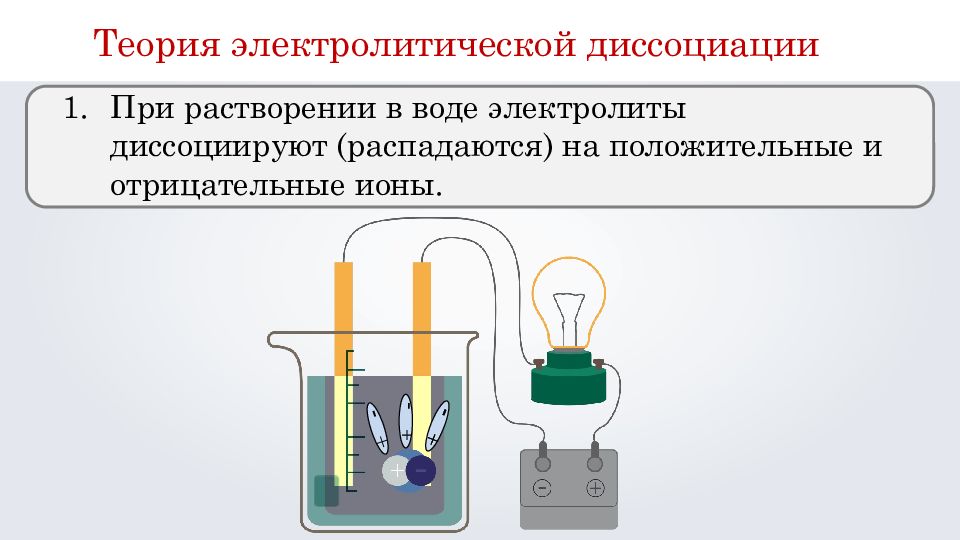
При растворении в воде электролиты диссоциируют (распадаются) на положительные и отрицательные ионы. + - + - + - + - Теория электролитической диссоциации
Слайд 4
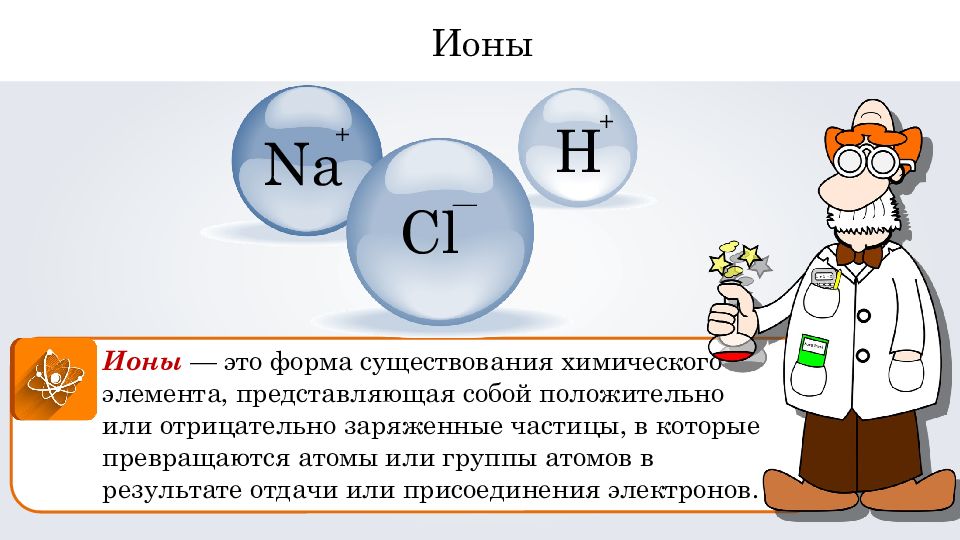
Ионы — это форма существования химического элемента, представляющая собой положительно или отрицательно заряженные частицы, в которые превращаются атомы или группы атомов в результате отдачи или присоединения электронов. Cl — Na + H + Ионы
Слайд 5
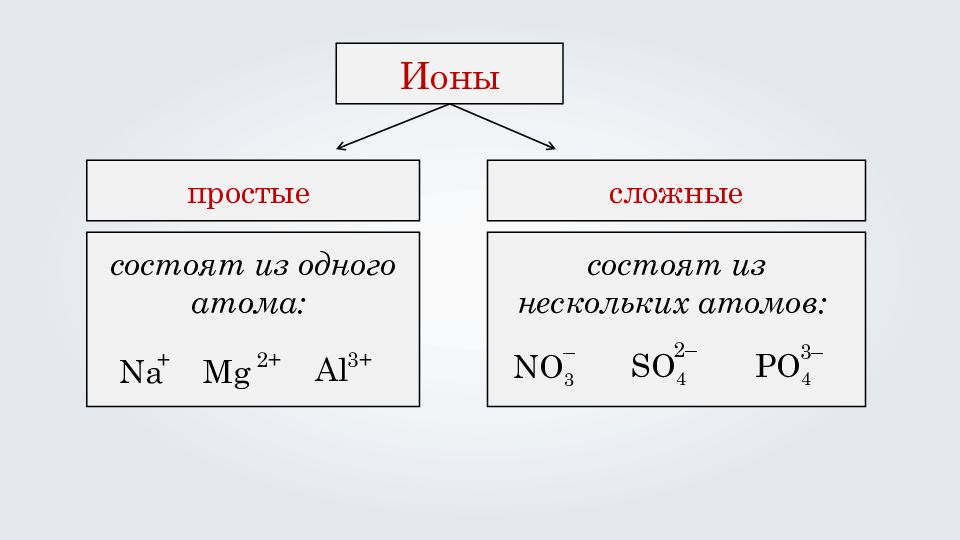
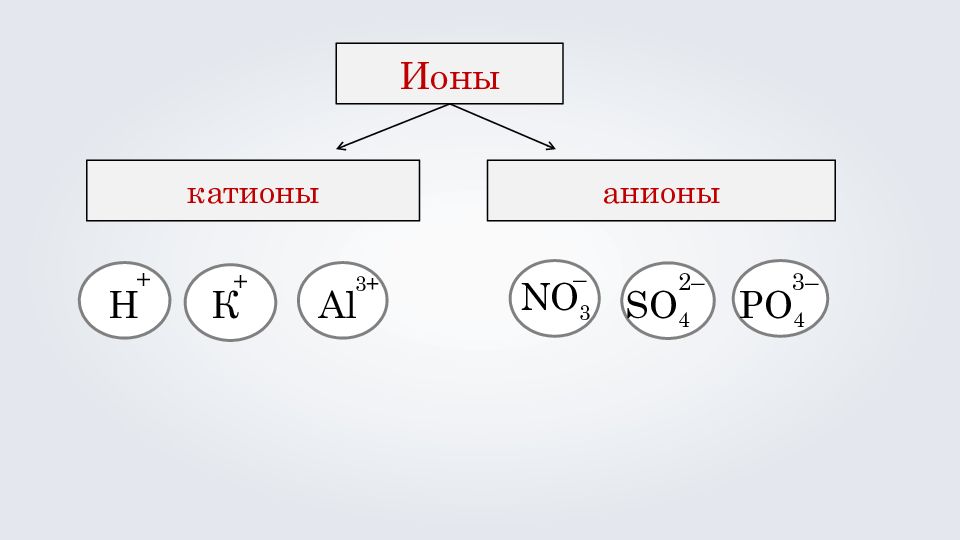
состоят из одного атома : Al 3+ М g 2+ Na + Ионы простые сложные состоят из нескольких атомов: NO 3 – SO 4 2– PO 4 3–
Слайд 7
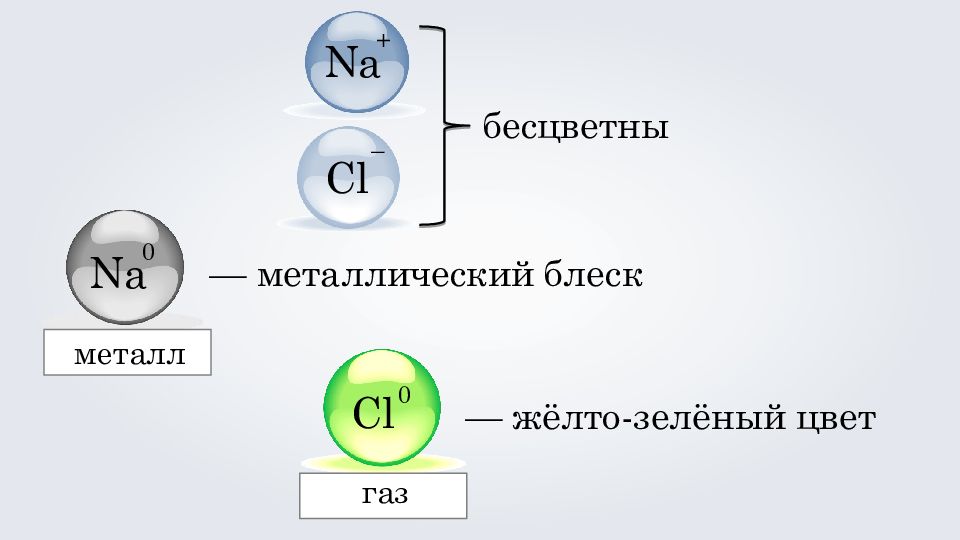
Na Cl + – бесцветны Na 0 — металлический блеск металл 0 — жёлто-зелёный цвет Cl газ
Слайд 8
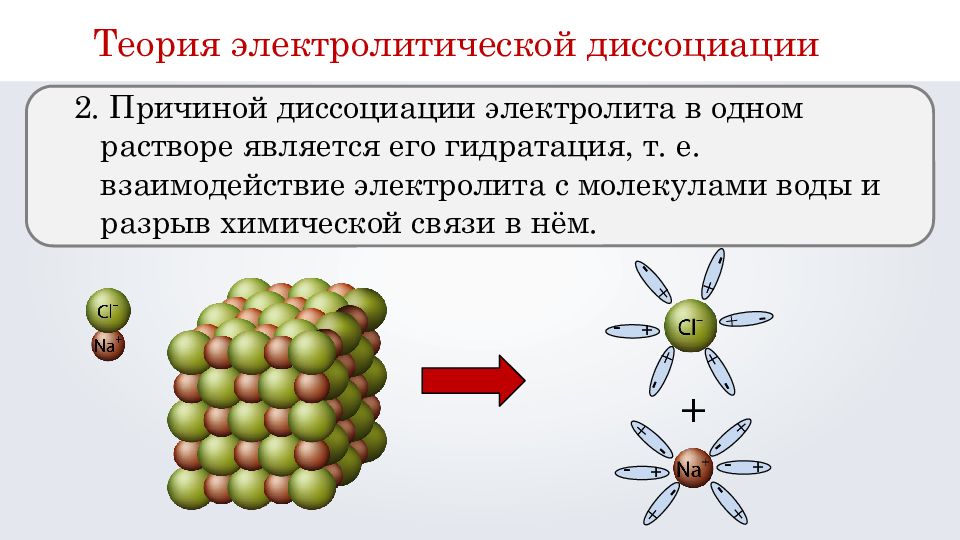
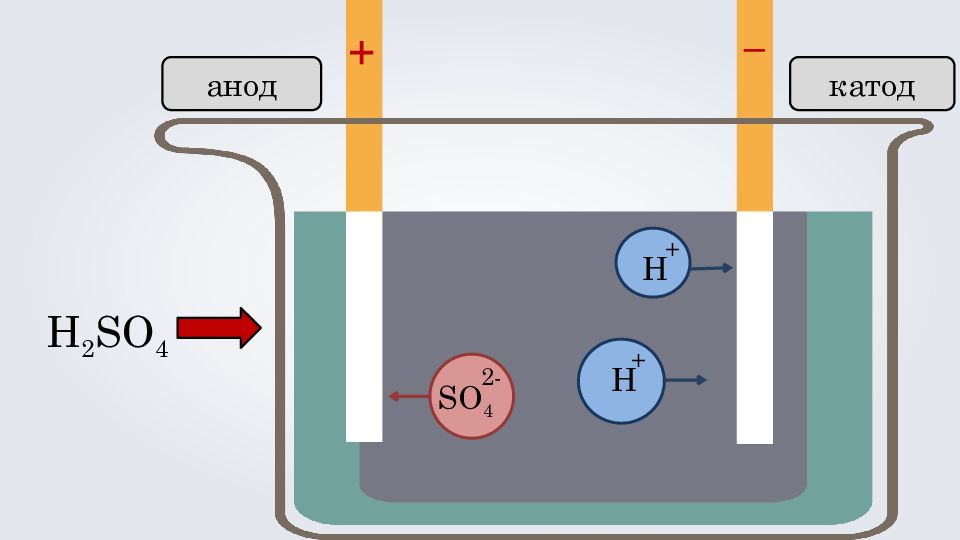
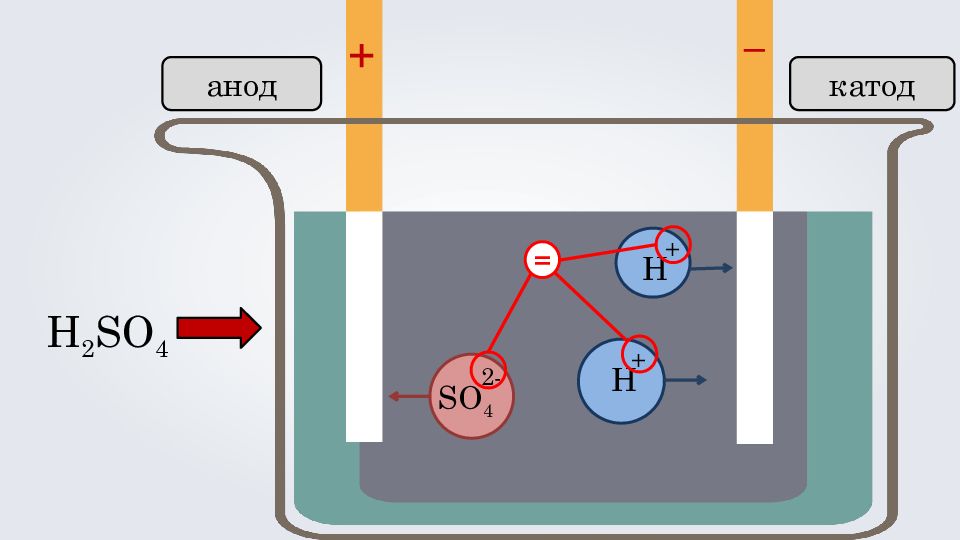
2. Причиной диссоциации электролита в одном растворе является его гидратация, т. е. взаимодействие электролита с молекулами воды и разрыв химической связи в нём. + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + - + Теория электролитической диссоциации
Слайд 9
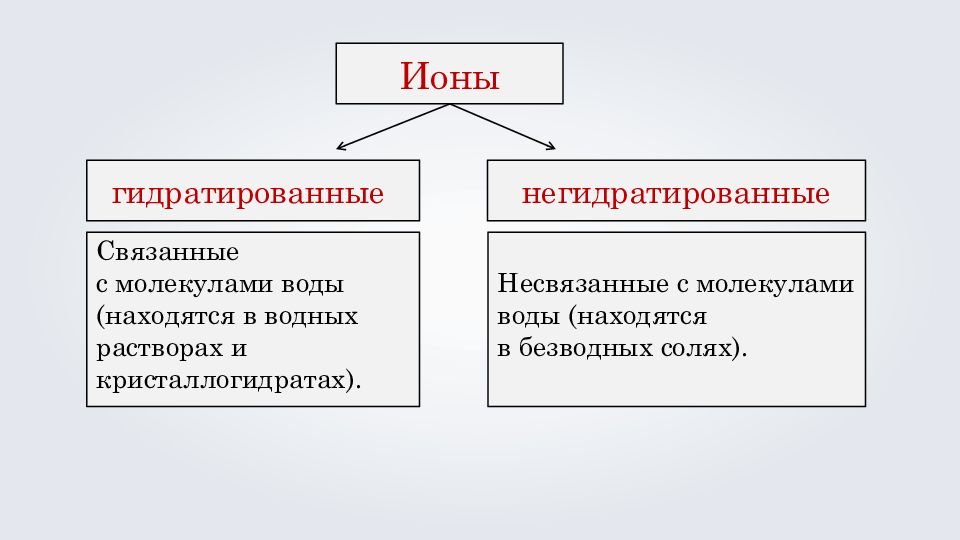
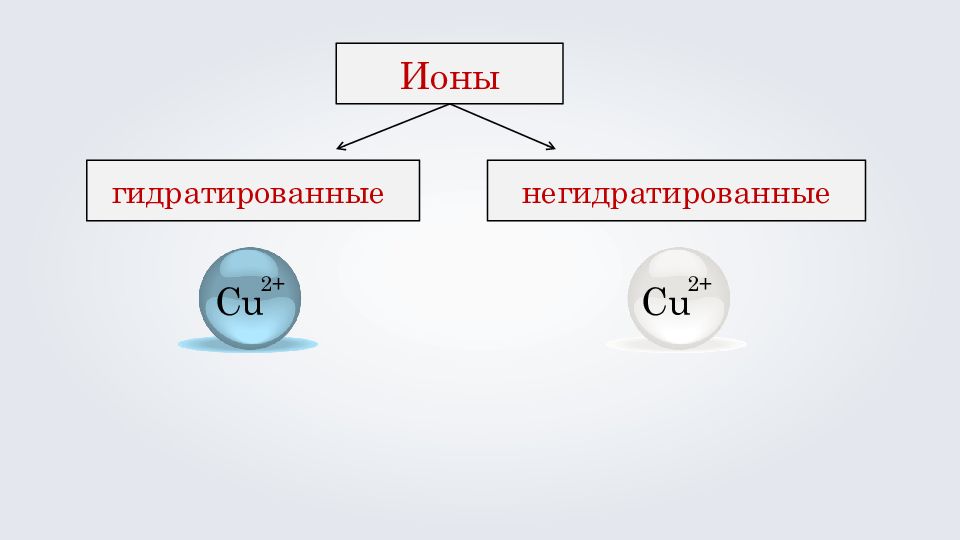
Связанные с молекулами воды (находятся в водных растворах и кристаллогидратах). Ионы гидратированные негидратированные Несвязанные с молекулами воды (находятся в безводных солях ).
Слайд 11
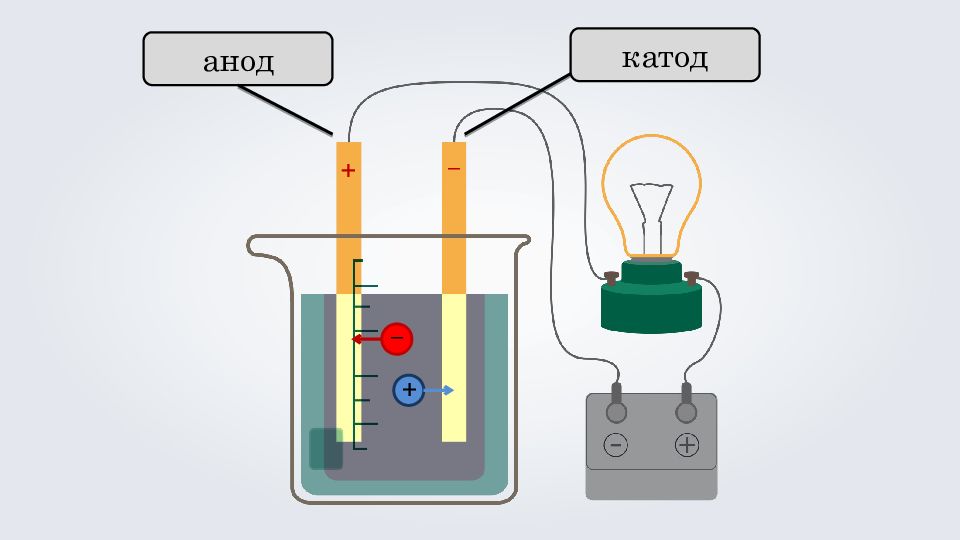
3. Под действием электрического тока, положительно заряженные ионы движутся к отрицательно заряженному полюсу источника тока — катоду, поэтому их называют катионами, а отрицательно заряженные ионы движутся к положительному полюсу источника тока — аноду, поэтому их называют анионами. Теория электролитической диссоциации
Слайд 16
Теория электролитической диссоциации 4. Электролитическая диссоциация — процесс обратимый для слабых электролитов. Н 2 СО 3 2Н + СО 3 + 2-
Слайд 17
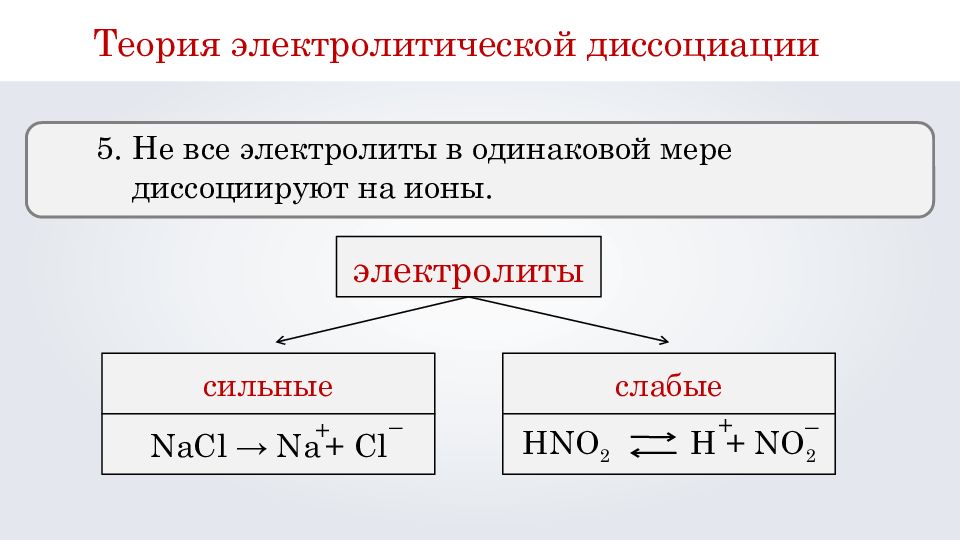
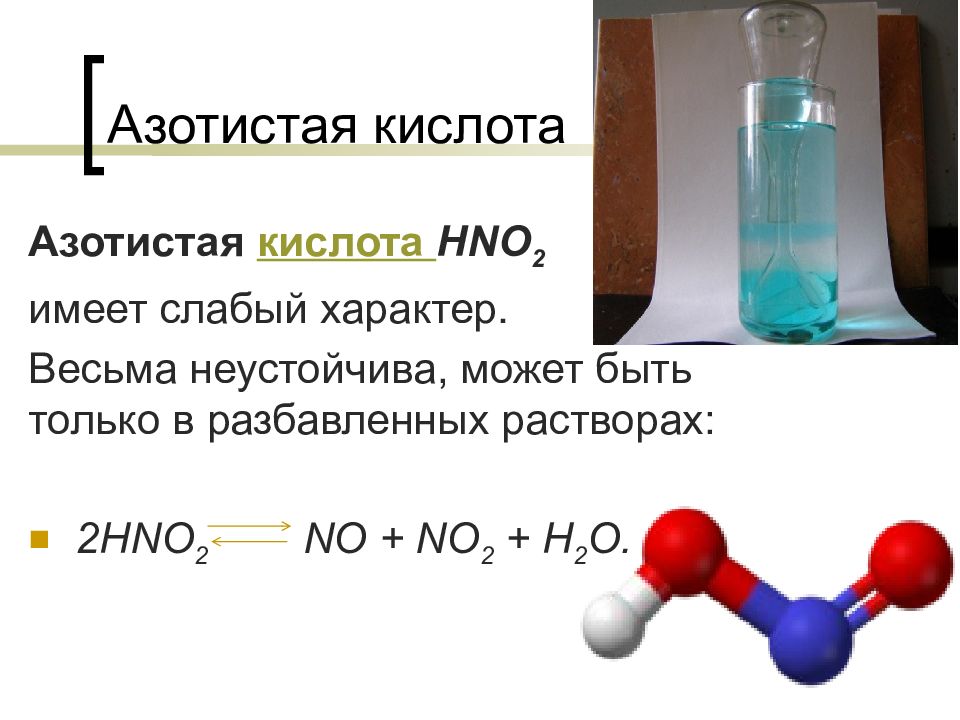
Теория электролитической диссоциации 5. Не все электролиты в одинаковой мере диссоциируют на ионы. электролиты сильные слабые NaCl → Na + Cl + – HNO 2 H + NO 2 + –
Слайд 18
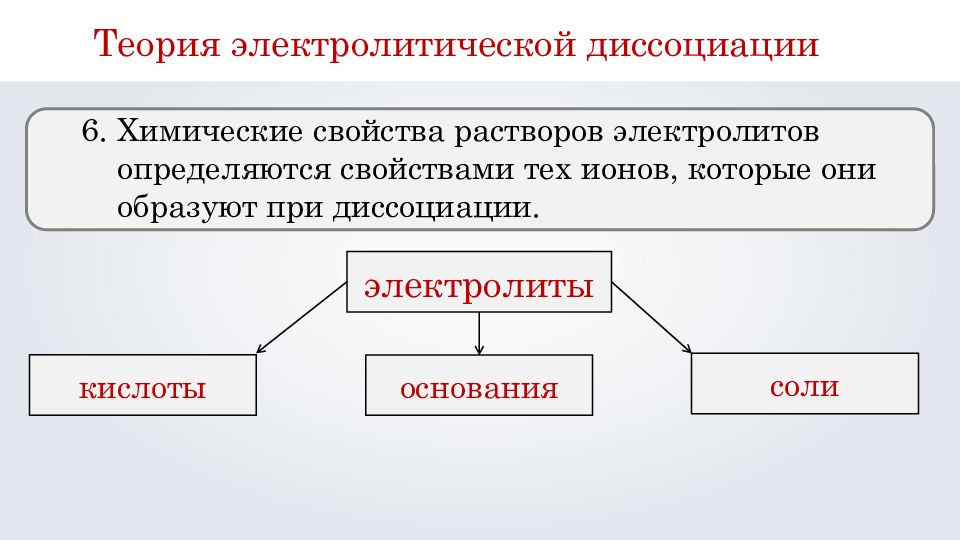
Теория электролитической диссоциации 6. Химические свойства растворов электролитов определяются свойствами тех ионов, которые они образуют при диссоциации. электролиты кислоты основания соли
Слайд 19
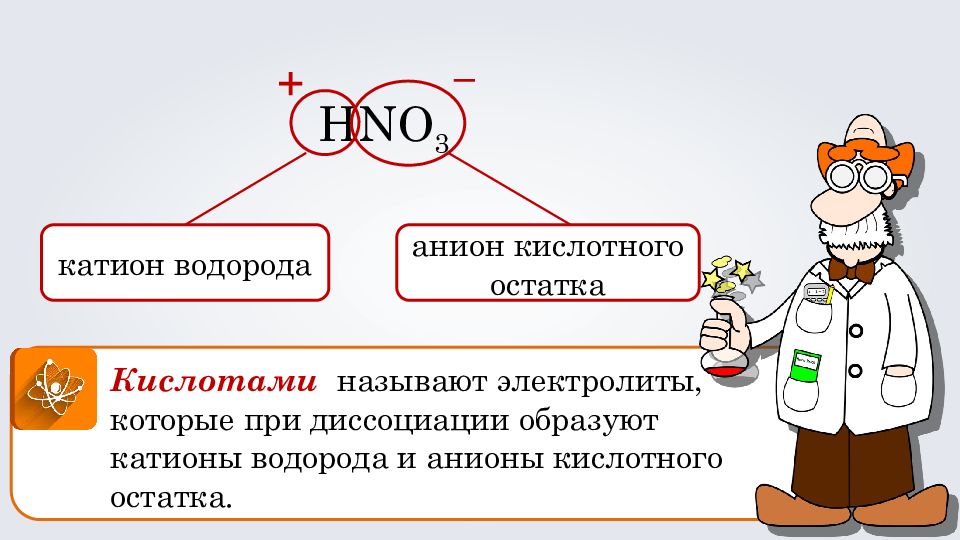
Кислотами называют электролиты, которые при диссоциации образуют катионы водорода и анионы кислотного остатка. HNO 3 к атион водорода анион кислотного остатка + –
Слайд 20
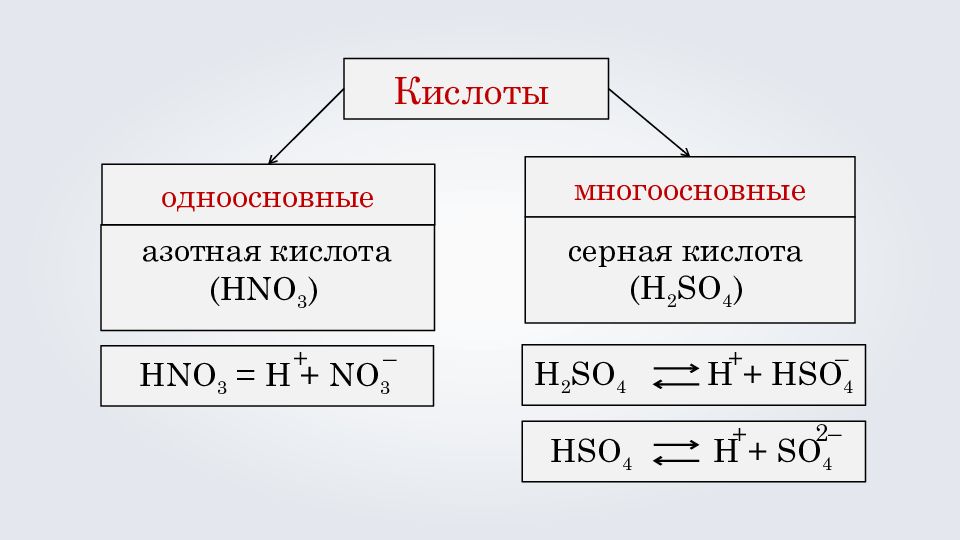
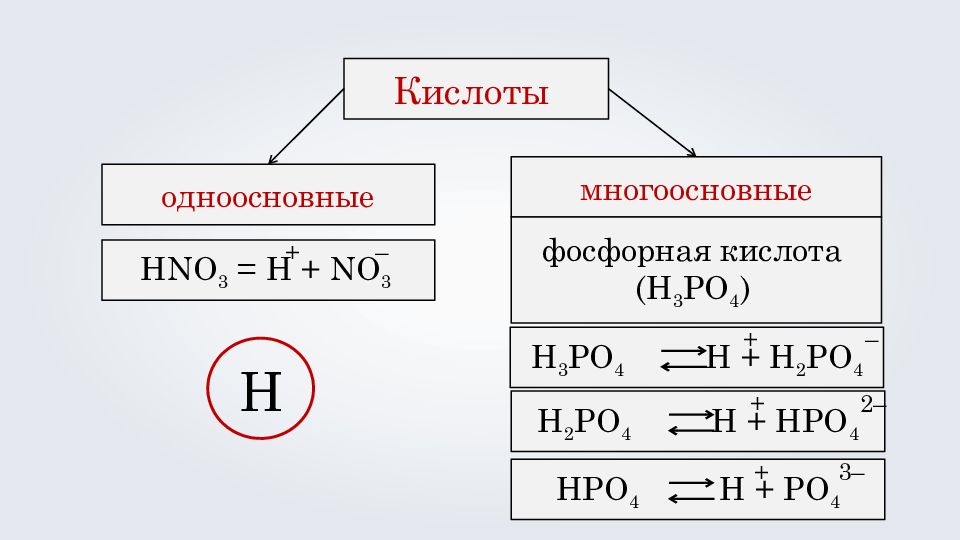
Кислоты одноосновные многоосновные HNO 3 = H + NO 3 + – H 2 SO 4 H + HSO 4 + – HSO 4 H + SO 4 + 2 – азотная кислота ( HNO 3 ) серная кислота ( H 2 SO 4 )
Слайд 21
Кислоты одноосновные многоосновные HNO 3 = H + NO 3 + – H 3 PO 4 H + H 2 PO 4 + – H 2 PO 4 H + HPO 4 + 2 – HPO 4 H + PO 4 3 – фосфорная кислота ( H 3 P O 4 ) + H
Слайд 22
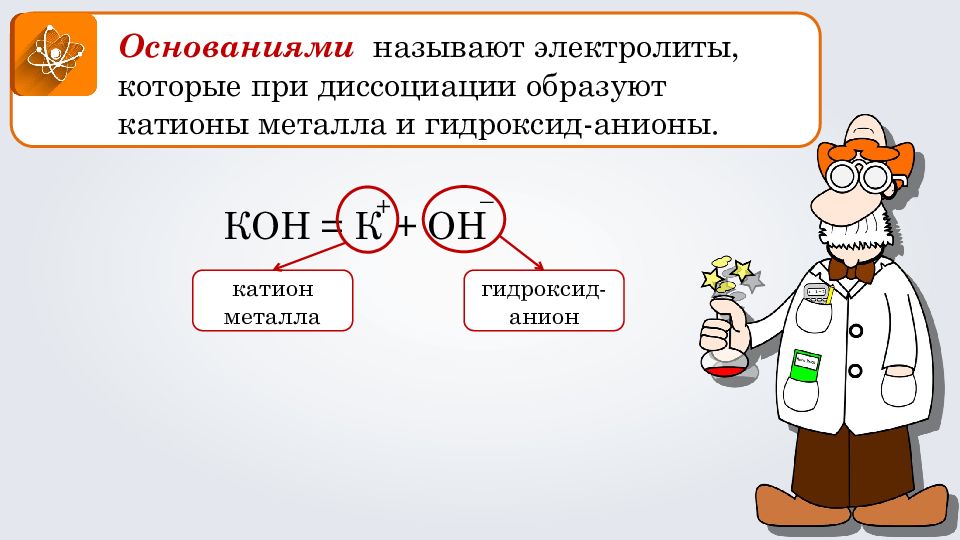
Основаниями называют электролиты, которые при диссоциации образуют катионы металла и гидроксид-анионы. КОН = К + ОН + – катион металла гидроксид-анион
Слайд 23
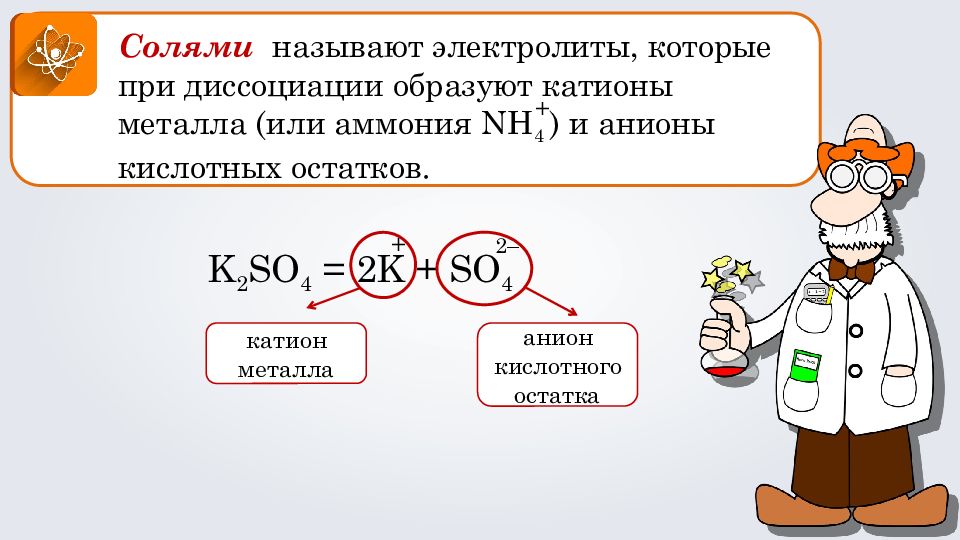
Солями называют электролиты, которые при диссоциации образуют катионы металла (или аммония NH 4 ) и анионы кислотных остатков. K 2 SO 4 = 2 K + SO 4 + 2– катион металла анион кислотного остатка +