Первый слайд презентации
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Кафедра химии Минаева Н.Н.
Слайд 2
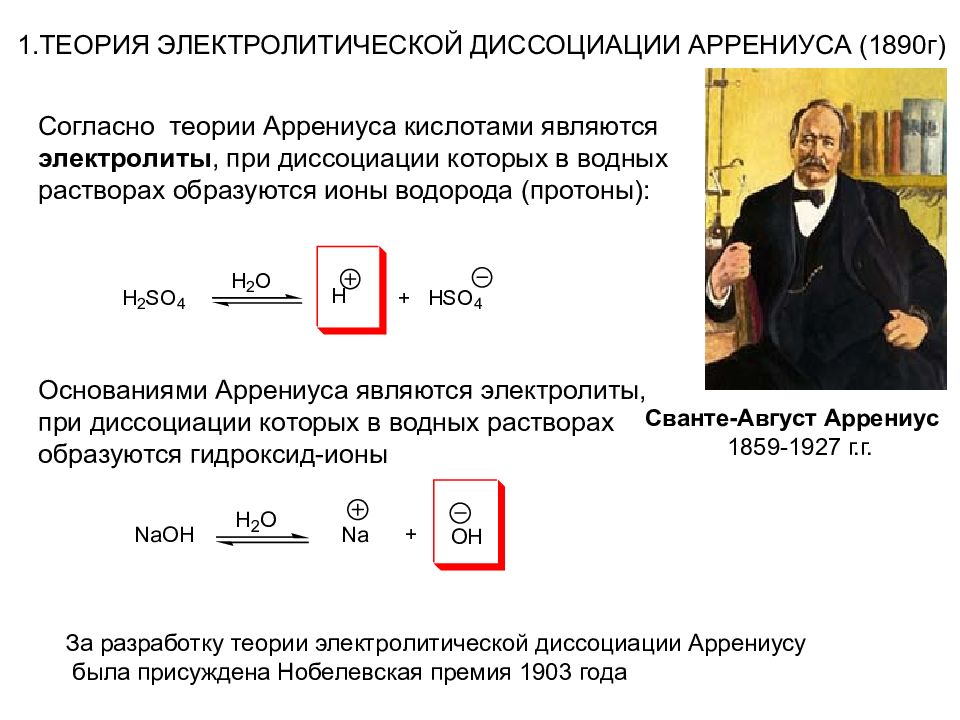
1.ТЕОРИЯ ЭЛЕКТРОЛИТИЧЕСКОЙ ДИССОЦИАЦИИ АРРЕНИУСА (1890г) Сванте-Август Аррениус 1859-1927 г.г. За разработку теории электролитической диссоциации Аррениусу была присуждена Нобелевская премия 1903 года Согласно теории Аррениуса кислотами являются электролиты, при диссоциации которых в водных растворах образуются ионы водорода (протоны): Основаниями Аррениуса являются электролиты, при диссоциации которых в водных растворах образуются гидроксид-ионы
Слайд 3
Классическая теория электролитической диссоциации Аррениуса применима только к водным растворам электролитов, а многие органические реакции протекают с участием электролитов в неводных средах. Известны соединения, которые не подходят под определение кислот и оснований по Аррениусу, однако проявляют кислотные или основные свойства, например, аммиак ( NH 3 ) не имеет гидроксид-иона, но проявляет свойства основания, хлорид алюминия проявляет кислотные свойства
Слайд 4
2. Протонная ( ПРОТОЛИТИЧЕСКАЯ ) теория, или теория кисл o т и оснований Бренстеда – Лоури (1923 ) Йоханнес-Николаус Брёнстед ( 1879-1947 ) датский физикохимик Томас Мартин Лоури ( 1874 -1936) английский химик
Слайд 5
Согласно теории Бренстеда-Лоури 1. кислота является донором, а основание - акцептором протонов (отсюда теория получила название «протонной» или « протолитической » ) кислоты и основания существуют только как сопряженные пары- A-H /A и H-B + /B ; 3. протон не существует в растворе в свободном виде, в воде он образует катион оксония ( гидроксония - Н 2 О + )
Слайд 6
Кислота А-Н, отдав протон, превращается в основание А ¯, которое называется сопряженным основанием данной кислоты. Основание ꞉ B, присоединив протон, переходит в сопряженную кислоту B + -Н. Кислота А-Н и основание А ¯, а также основание ꞉ B и кислота B + -Н являются сопряженными кислотно-основными парами: A-H/A и H-B + /B. В таких сопряжённых кислотно-основных парах чем сильнее кислота, тем слабее сопряженное ей основание, и чем сильнее основание, тем слабее сопряженная ему кислота. Кислоты и основания проявляют свои свойства только в присутствие друг друга: ни одно вещество не будет отдавать протон, если в системе нет акцептора протона – основания, и наоборот. Нейтральные молекулы и заряженные частицы, способные в зависи-мости от условий проявлять свойства как кислоты, так и основания, называются амфотеpными.
Слайд 7
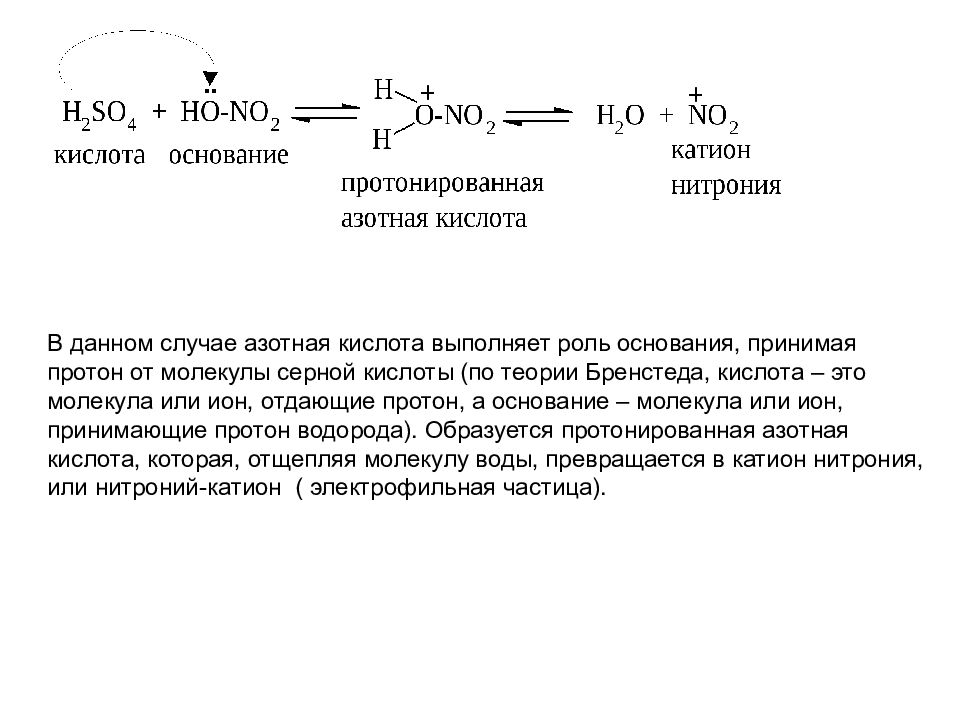
В данном случае азотная кислота выполняет роль основания, принимая протон от молекулы серной кислоты (по теории Бренстеда, кислота – это молекула или ион, отдающие протон, а основание – молекула или ион, принимающие протон водорода). Образуется протонированная азотная кислота, которая, отщепляя молекулу воды, превращается в катион нитрония, или нитроний-катион ( электрофильная частица).
Слайд 8
Мерой силы кислоты А—Н является константа кислотности K а ( a от англ. acid - кислота ), которая обычно определяется по отношению к стандартному основанию — воде: В сильно разбавленном растворе K а рассчитывают по формуле: K a =[ A - ] [ H 3 O + ]/[ AH ], чем больше значение K а, тем сильнее кислота. Как правило константы кислотности очень малы. Для уксусной кислоты K а при 25 0 С равна 1,76·10 –5. Оперировать такими малыми числами неудобно, поэтому в практической работе чаще пользуются величинами р Kа ( показатель кислотности: р K а = – lgKa, р Kа уксусной кислоты равна 4,75. Чем меньше значение р Kа, тем сильнее кис лота. А – Н + Н 2 О ↔ А ¯ + Н 2 О +
Слайд 9
ТИПЫ ОРГАНИЧЕСКИХ КИСЛОТ Органические кислоты классифицируют в зависимости от природы кислотного центра (атома элемента, с которым связан атом водорода, обусловливающий кислотные свойства): О-Н кислоты : карбоновые кислоты ( RCOOH ), спирты ( ROH ), фенолы ( Ar -OH ), вода (HOH) и др. S- Н кислоты: тиолы ( RSH) и др. N- Н кислоты: амины ( R-NH 2 ), амиды кислот ( R СО NH 2 и др. С - Н кислоты : углеводороды ( алканы, алкены =С-Н, алкины ≡С-Н)
Слайд 10
Сила кислот определяется устойчивостью образующихся после отщепления протона сопряженных оснований (анионов ). Чем устойчивее сопряженное основание (анион), тем сильнее кислота. Устойчивость же аниона обусловлена степенью делокализации отрицательного заряда и зависит от факторов: природы кислотного центра ( электроотрицательности и поляризуемости кислотного центра) ; характера заместителя,связанного с кислотным центром (электронные эффекты заместителя –ЭД или ЭА); сольватационных эффектов (природа растворителя).
Слайд 11
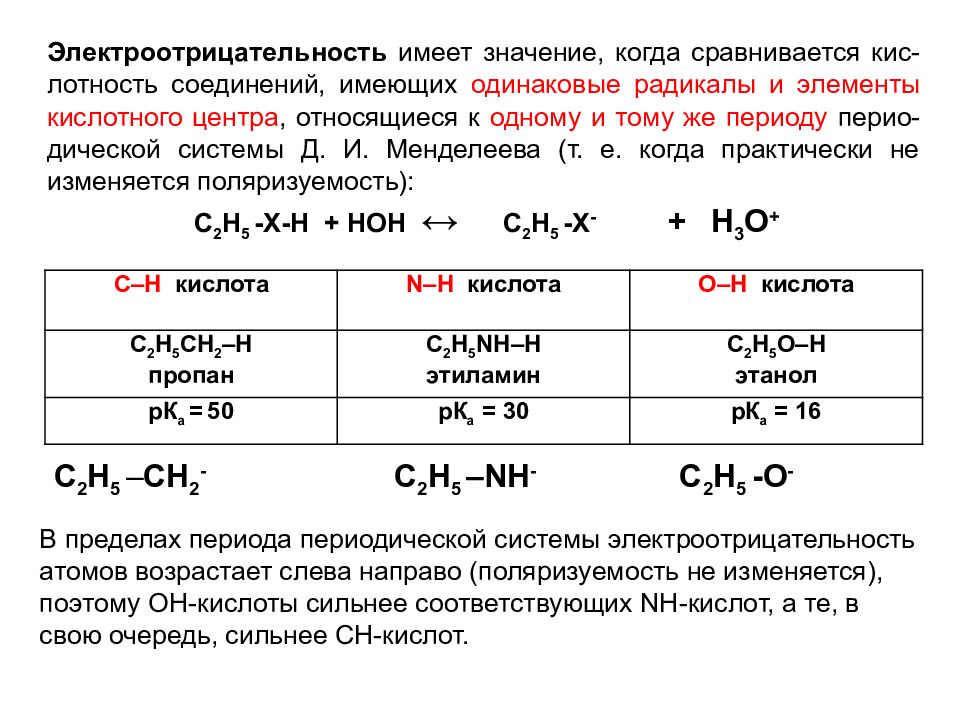
Электроотрицательность имеет значение, когда сравнивается кис-лотность соединений, имеющих одинаковые радикалы и элементы кислотного центра, относящиеся к одному и тому же периоду перио-дической системы Д. И. Менделеева (т. е. когда практически не изменяется поляризуемость ): С 2 Н 5 -Х-Н + НОН ↔ С 2 Н 5 -Х - + Н 3 О + С–Н кислота N – H кислота О–Н кислота С 2 Н 5 СH 2 –Н пропан С 2 Н 5 NH –H этиламин С 2 Н 5 О–Н этанол рК а = 50 рК а = 30 рК а = 16 С 2 Н 5 – СН 2 - С 2 Н 5 – NH - С 2 Н 5 - O - В пределах периода периодической системы электроотрицательность атомов возрастает слева направо ( поляризуемость не изменяется), поэтому ОН-кислоты сильнее соответствующих NН-кислот, а те, в свою очередь, сильнее СН-кислот.
Слайд 12
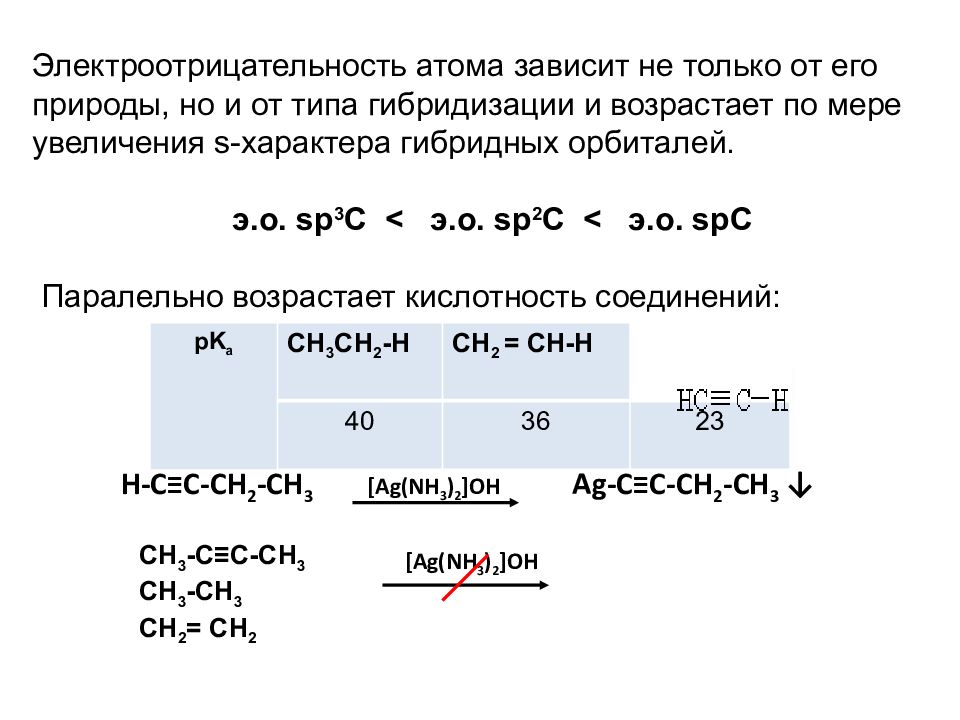
Электроотрицательность атома зависит не только от его природы, но и от типа гибридизации и возрастает по мере увеличения s-характера гибридных орбиталей. э.о. sp 3 C < э.о. sp 2 C < э.о. spC Паралельно возрастает кислотность соединений: pK a CH 3 CH 2 -H CH 2 = CH-H 40 36 23 H-C ≡ C-CH 2 -CH 3 Ag -C ≡C-CH 2 -CH 3 ↓ CH 3 -C≡C-CH 3 CH 3 -CH 3 CH 2 = CH 2 [ Ag(NH 3 ) 2 ]OH [ Ag(NH 3 ) 2 ]OH
Слайд 13
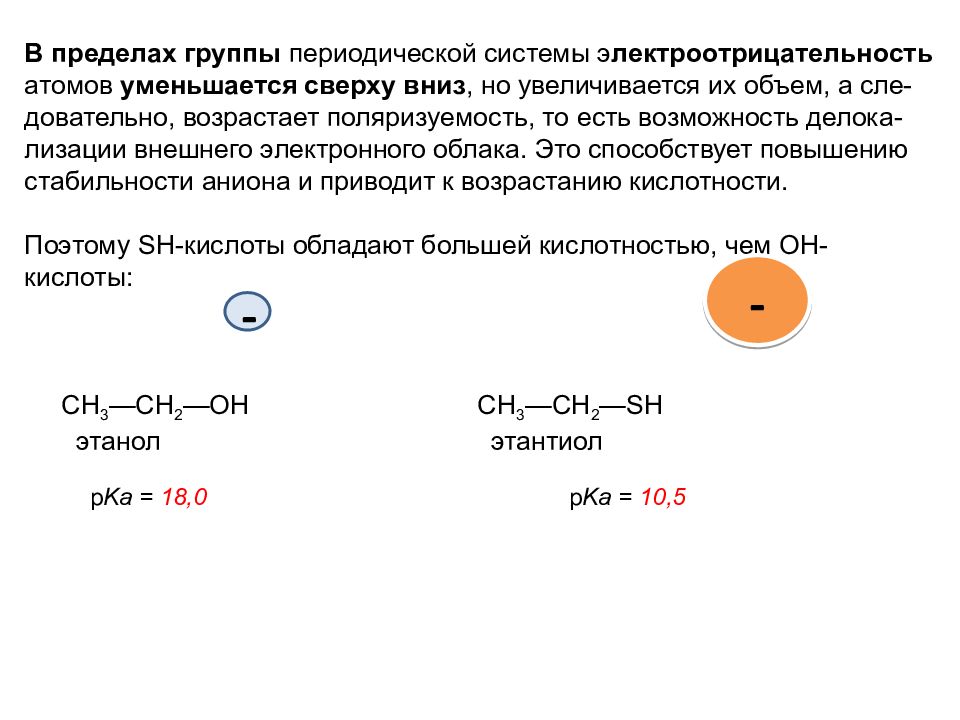
В пределах группы периодической системы э лектроотрицательность атомов уменьшается сверху вниз, но увеличивается их объем, а сле-довательно, возрастает поляризуемость, то есть возможность делока-лизации внешнего электронного облака. Это способствует повышению стабильности аниона и приводит к возрастанию кислотности. Поэтому SН-кислоты обладают большей кислотностью, чем ОН-кислоты : CH 3 —CH 2 —OH CH 3 —CH 2 —SH этанол этантиол р K а = 18,0 р K а = 10,5 - -
Слайд 14
Тиолы, как более сильные кислоты, в отличие от спиртов, реагируют не только со щелочными металлами, но и со щелочами, а также оксидами и солями тяжелых металлов (ртуть, свинец, мышьяк, хром, висмут и др.): Меркаптиды ртути, серебра нерастворимы в воде, поэтому эта реакция лежит в основе определения тиолов в биологических жидкостях. Тиолы, например, 2,3-димеркаптопропанол, используются в качестве антидотов при отравлении солями тяжелых металлов, люизитом.
Слайд 15
Органические кислоты с одинаковыми радикалами в зависимости от природы кислотного центра можно расположить по возрастанию кислотности: S Н -кислоты > ОН - кислоты > N Н - кислоты > СН -к ислоты С 2 Н 5 S –H > С 2 Н 5 О–H > С 2 Н 5 NH 2 > С 2 Н 5 СH 3 Тиолы более сильные кислоты, чем алифатические спирты, амины и углеводороды, соответственно
Слайд 16
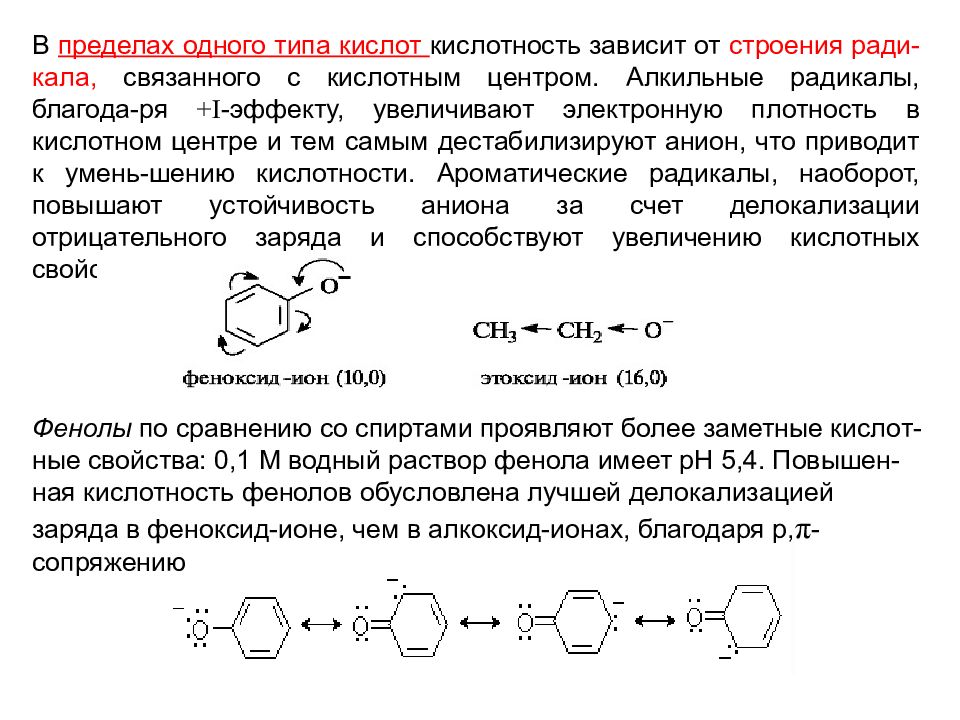
В пределах одного типа кислот кислотность зависит от строения ради-кала, связанного с кислотным центром. Алкильные радикалы, благода-ря +I -эффекту, увеличивают электронную плотность в кислотном центре и тем самым дестабилизируют анион, что приводит к умень-шению кислотности. Ароматические радикалы, наоборот, повышают устойчивость аниона за счет делокализации отрицательного заряда и способствуют увеличению кислотных свойств. Фенолы по сравнению со спиртами проявляют более заметные кислот-ные свойства: 0,1 М водный раствор фенола имеет рН 5,4. Повышен-ная кислотность фенолов обусловлена лучшей делокализацией заряда в феноксид-ионе, чем в алкоксид-ионах, благодаря р, π -сопряжению
Слайд 17
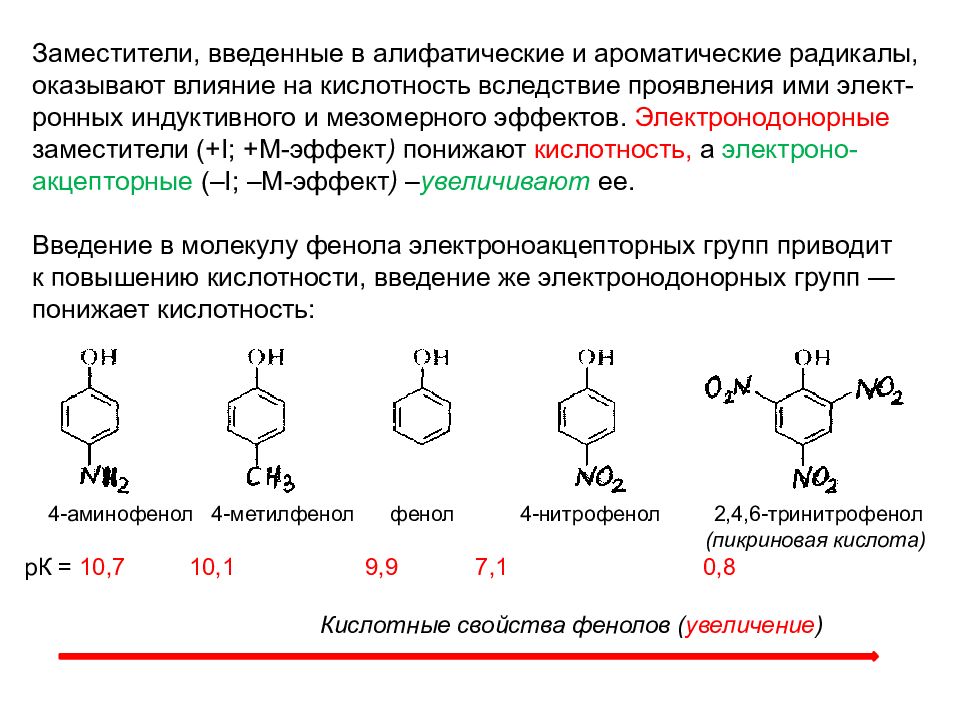
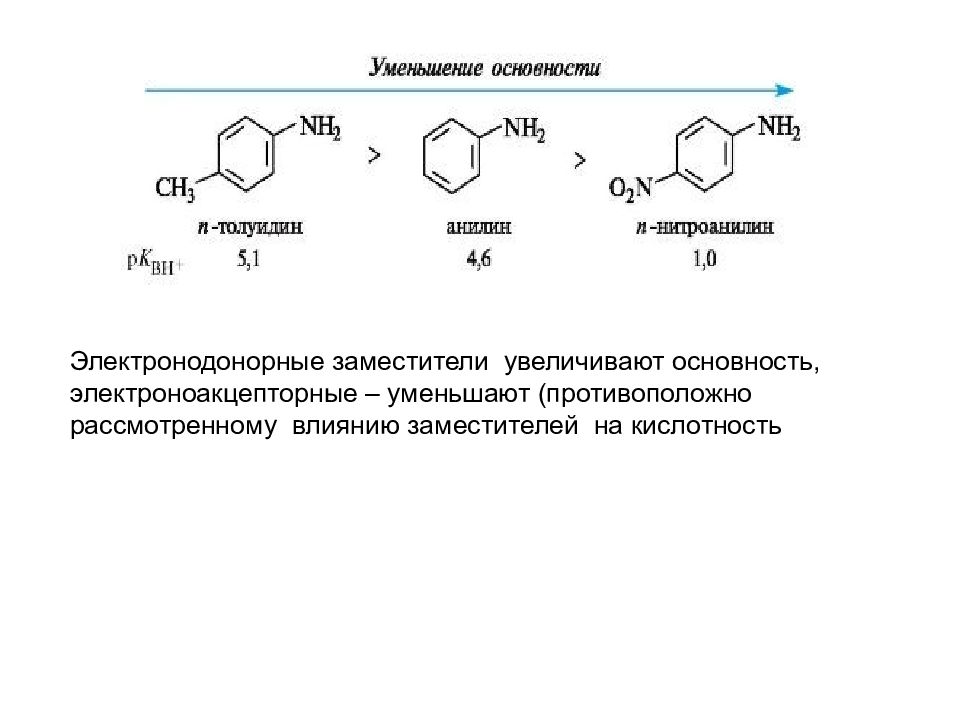
Заместители, введенные в алифатические и ароматические радикалы, оказывают влияние на кислотность вследствие проявления ими элект - ронных индуктивного и мезомерного эффектов. Электронодонорные заместители (+І; +М-эффект ) понижают кислотность, а электроно - акцепторные (–І; –М-эффект ) – увеличивают ее. Введение в молекулу фенола электроноакцепторных групп приводит к повышению кислотности, введение же электронодонорных групп — понижает кислотность: 4-аминофенол 4-метилфенол фенол 4-нитрофенол 2,4,6-тринитрофенол (пикриновая кислота) рК = 10,7 10,1 9,9 7,1 0,8 Кислотные свойства фенолов ( увеличение )
Слайд 18
В карбоновых кислотах при диссоциации образуются карбоксилат-ионы – самые стабильные органические анионы. В карбоксилат-ионе отрицательный заряд за счет р, π -сопряжения расп-ределён поровну между двумя атомами кислорода,т.е. он делокализо-ван и соответственно менее концентрирован, поэтому в карбоновых кислотах кислотный центр более сильный, чем в спиртах и фенолах. С увеличением углеводородного радикала,который выполняет роль э.д. кислотность монокарбоновых кислот снижается за счет уменьшения δ + на атоме углерода карбоксильной группы. Поэтому в гомологическом ряду кислот самой сильной является муравьиная кислота.
Слайд 20
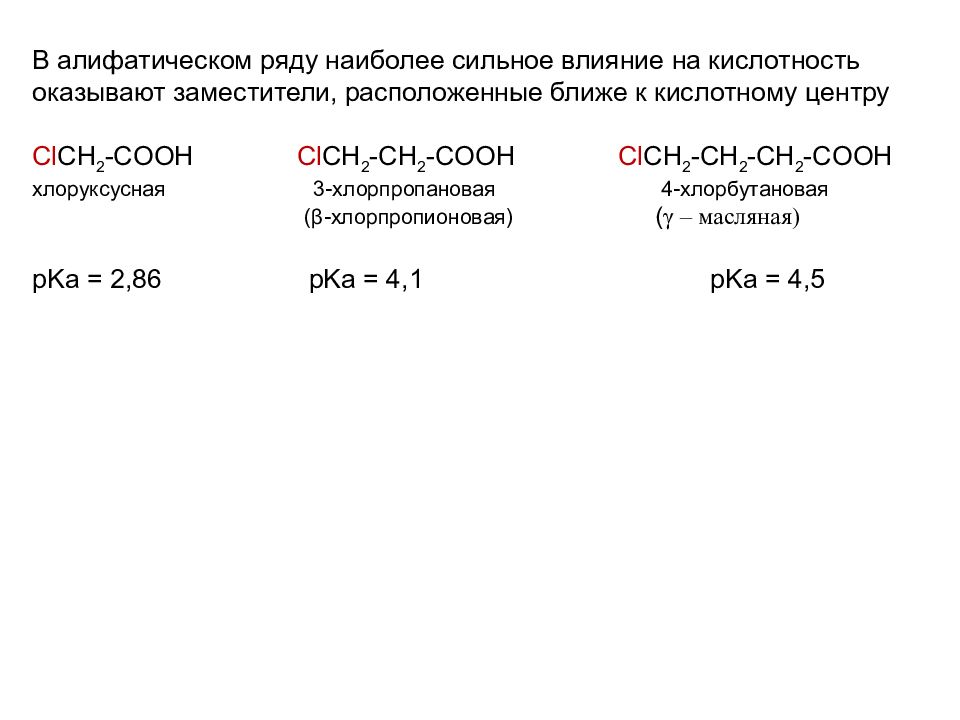
В алифатическом ряду наиболее сильное влияние на кислотность оказывают заместители, расположенные ближе к кислотному центру Cl CH 2 - COOH Cl CH 2 - CH 2 - COOH Cl CH 2 - CH 2 - CH 2 - COOH хлоруксусная 3-хлорпропановая 4-хлорбутановая ( β - хлорпропионовая ) ( γ – масляная) pKa = 2,86 pKa = 4,1 pKa = 4,5
Слайд 21
В алифатическом ряду наиболее оказывает влияние и количество заместителей; хлоруксусная дихлоруксусная трихлоруксусная pKa = 2,86 1,3 0,66
Слайд 22
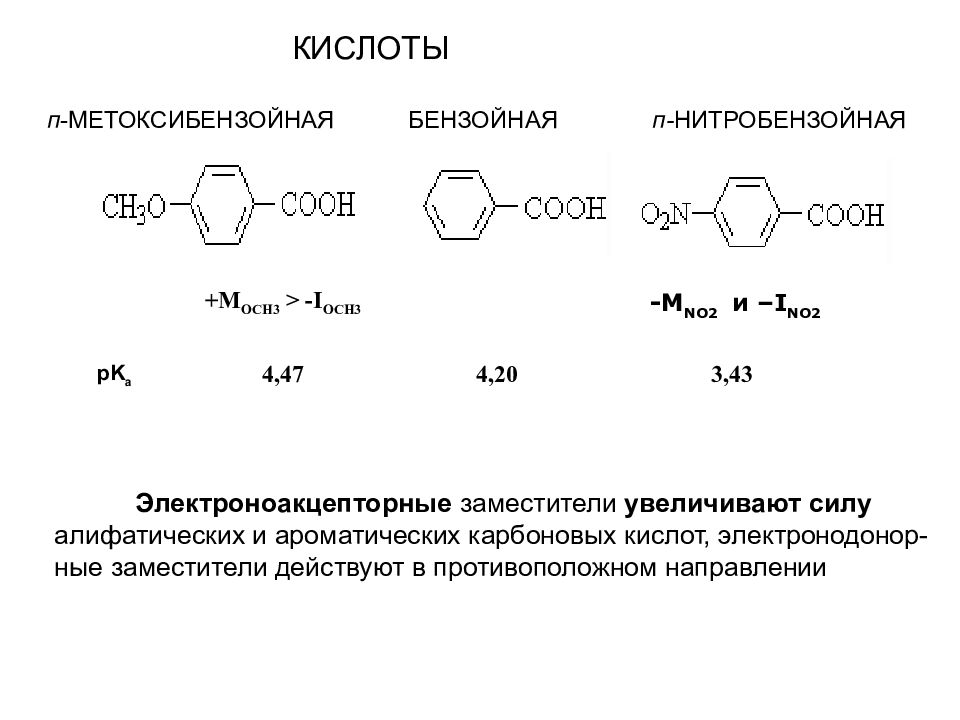
+ M OCH3 > - I OCH3 -M NO2 и – I NO2 pK a 4,47 4,20 3,43 Электроноакцепторные заместители увеличивают силу алифатических и ароматических карбоновых кислот, электронодонор-ные заместители действуют в противоположном направлении КИСЛОТЫ п -МЕТОКСИБЕНЗОЙНАЯ БЕНЗОЙНАЯ п- НИТРОБЕНЗОЙНАЯ
Слайд 23
Наряду с природой кислотного центра и строением радикала значи - тельное влияние на проявление кислотных свойств оказывает растворитель. Влияние растворителя определяют его диэлектричес - кой проницаемостью и способностью сольватировать растворенные частицы. Чем выше сольватационный эффект, тем стабильнее ионы в растворе. При равных прочих условиях сольватация аниона протекает тем сильнее, чем меньше его размер и менее делокализован в нем заряд, т.е. влияние сольватационного эффекта растворителя и влияние заместителей на кислотность противоположны друг другу. Наиболее эффективным растворителем является вода, обладающая высокой диэлектрической проницаемостью ( ε = 80 при 20 °С) и способностью к сольватации растворенных частиц.
Слайд 24
Влияние растворителя Взаимодействие молекул или ионов растворенного вещества с растворителем называется процессом сольватации. Стабильность аниона существенно зависит от его сольватации в растворе: чем больше ион сольватирован, тем он устойчивее, а сольватация тем больше, чем меньше размер иона и чем меньше делокализация в нем отрицательного заряда. НСООН муравьиная СН 3 СООН уксусная СН 3 –СН 2 –СООН пропановая С 15 Н 31 –СООН пальмитиновая рК а 3,7 4,8 4,9 В ряду карбоновых кислот с увеличением длины алифатического (гидрофобного) радикала кислотность уменьшается. Эффект сольватации может оказать более сильное воздействие на кислотность, чем электронные эффекты заместителей.
Слайд 25
ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Органические соединения, в состав молекулы которых входят атомы азота, кислорода, серы, могут выступать в роли оснований, присоединяя протон водорода за счет неподеленной пары электронов на внешнем энергетическом уровне. Такие атомы в молекуле органического вещества, присоединяющие протон, называются центрами основности. Основания по Бренстеду-Лоури делятся на n – основания и π – основания. n – Основания могут быть нейтральными или отрицательно заряженными частицами. π - Основания ( алкины, алкены, диены, арены) – центр основности - электроны π -связи.
Слайд 26
n-основания : анионы оксониевые ( ꞉ О) R– О Н — спирты НО — гидроксид-ион R– O –R — простые эфиры R–С( О ) R I - альдегиды, кетоны R–С О ОН –карбоновые кислоты RCOO — ацилат-ион R O — алкоксид-ион Н О Н -вода сульфониевые R–SH — тиолы RS — алкилсульфид-ион аммониевые H 2 N — амид-ион R–NH 2 — амины центр основности - являются электроны -связи или ароматической системы. Это слабые основания, которые с протоном образуют не ковалентные связи, а короткоживущие -комплексы π -основания :
Слайд 27
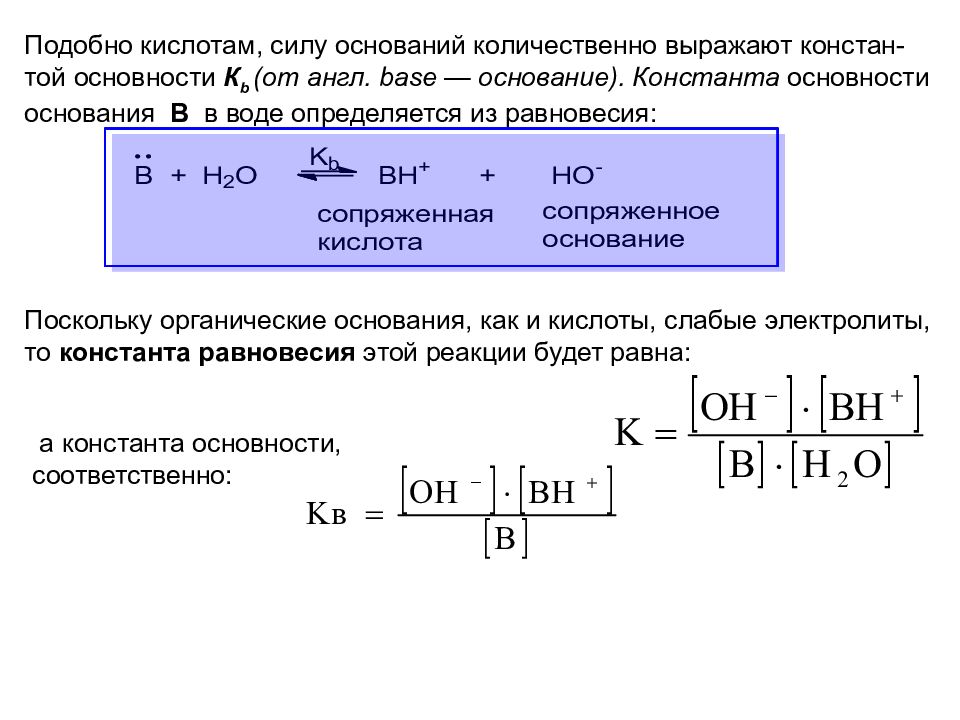
Подобно кислотам, силу оснований количественно выражают констан-той основности К b (от англ. base — основание). Константа основности основания В в воде определяется из равновесия: Поскольку органические основания, как и кислоты, слабые электролиты, то константа равновесия этой реакции будет равна: а константа о сновности, соответственно:
Слайд 28
Так как кислота отщепляет протон, а основание его присоединяет, то кислотные и основные свойства можно количественно характеризовать одной величиной - сродством к иону водорода. Это позволяет применять константы кислотной ионизации как для кислот, так и для оснований; Чем больше K b, тем сильнее основание. Как и в случае с кислотами, для удобства силу оснований выражают обычно величиной р K b : р K b = – lgK b. Чем меньше р K b, тем сильнее соответствующее основание. т.е. силу оснований оценивают константой кислотности сопряженной основанию кислоты ВН +, обозначаемую как р K ВН+. Чем больше значение рK ВН+, тем сильнее основание (A-H /A и H-B + /B)
Слайд 29
По аналогии с кислотами сила оснований зависит от ряда факторов: - природы основного центра; - характера заместителя, связанного с основным центром: природы растворителя. При равных других факторах с увеличением электроотрицательности атома основного центра, в пределах одного и того же периода, непо-деленная пара электронов удерживается прочнее, а следовательно, основность соединения уменьшается. Поэтому оксониевые основания слабее аммониевых. В пределах группы периодической системы с увеличением поляризу-емости атома основного центра усиливается делокализация неподе-ленной электронной пары и соответственно уменьшается основность соединения. Поэтому сульфониевые основания слабее оксониевых. Еще более слабыми основными свойствами обладают π -основания, в которых электронная пара, присоединяющая протон, не является свободной
Слайд 30
Качественно выраженность основных свойств зависит от тех же факторов, что и кислотных, но влияние их противоположно. В пределах одного и того же периода таблицы Менделеева, чем больше э лектроотрицательность элемента основного центра, тем прочнее он удержи-вает неподеленную пару электронов, и тем менее она доступна для протона. Поэтому, если сравнивать основность соединений с одинаковыми радикалами ( диметиловый эфир и диметиламин ), то оксониевое основание( метокиметан ) будет слабее аммониевого ( N- метиламин ). В тиониевых ( сульфониевых ) основаниях, например, СН 3 - S-СН 3 ( диметил-сульфид ) электронная плотность атома серы рассредоточена в большем объеме ( поляризуемость атома серы больше, чем кислорода), и плотность заряда значительно меньше. Поэтому сульфониевые основания слабее оксониевых и не способны образовывать прочные связи с протоном. В целом, сила n-оснований с одинаковыми радикалами уменьшается в ряду: N > O > S. Наибольшую основность среди органических соединений проявляют амины.
Слайд 31
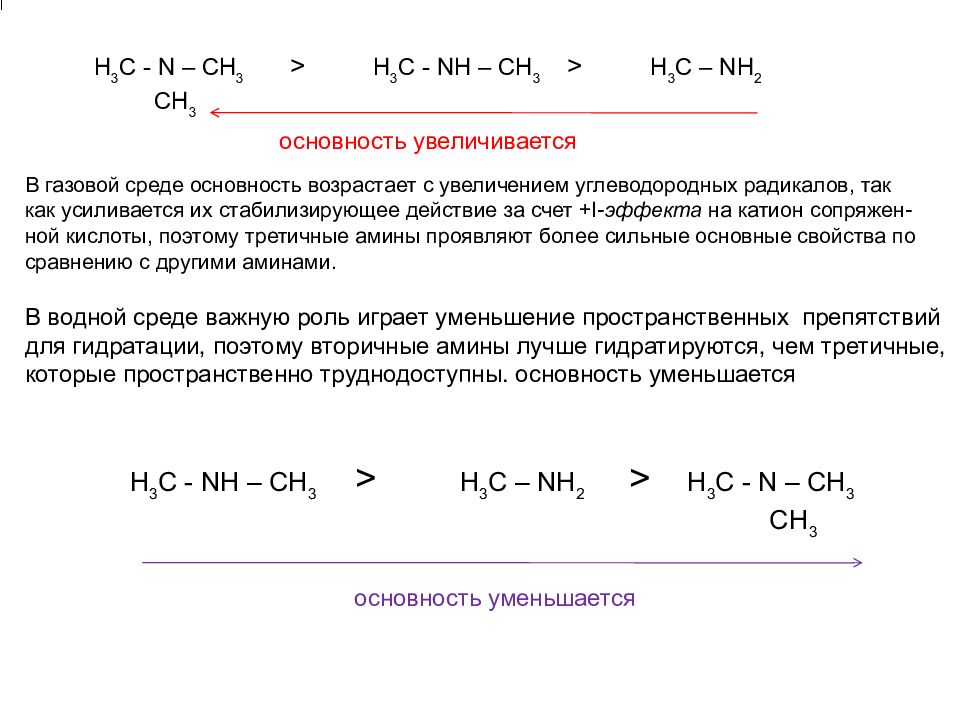
В водной среде важную роль играет уменьшение пространственных препятствий для гидратации, поэтому вторичные амины лучше гидратируются, чем третичные, которые пространственно труднодоступны. основность уменьшается H 3 C - NH – CH 3 > H 3 C – NH 2 > H 3 C - N – CH 3 CH 3 В газовой среде основность возрастает с увеличением углеводородных радикалов, так как усиливается их стабилизирующее действие за счет +I- эффекта на катион сопряжен-ной кислоты, поэтому третичные амины проявляют более сильные основные свойства по сравнению с другими аминами. Н 3 C - N – CH 3 > H 3 C - NH – CH 3 > H 3 C – NH 2 CH 3 основность уменьшается основность увеличивается
Слайд 32
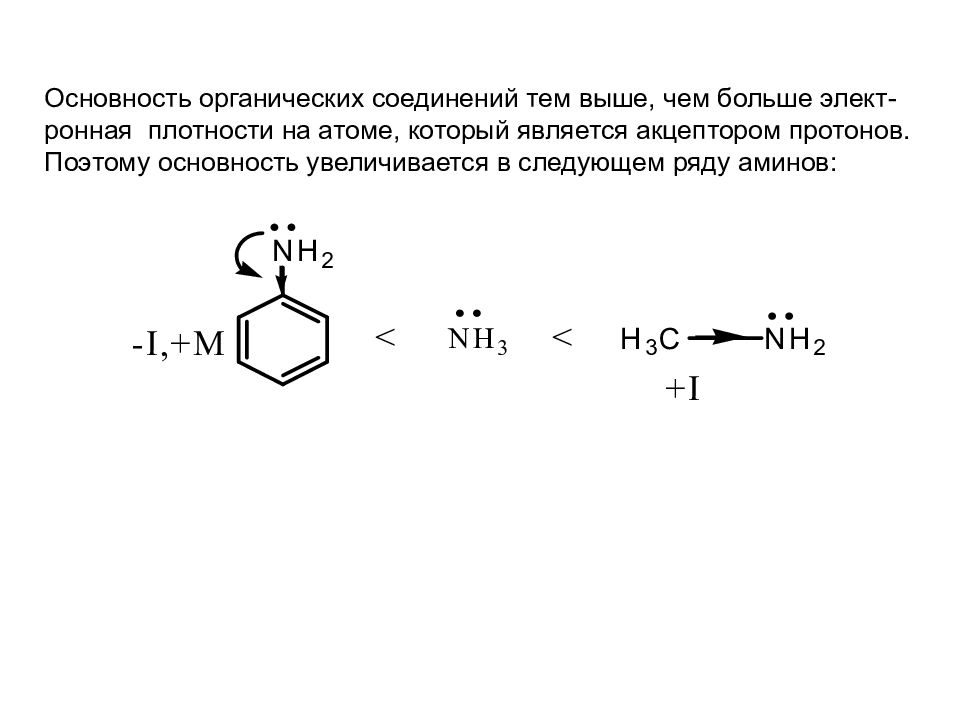
Основность органических соединений тем выше, чем больше элект-ронная плотности на атоме, который является акцептором протонов. Поэтому основность увеличивается в следующем ряду аминов :
Слайд 33
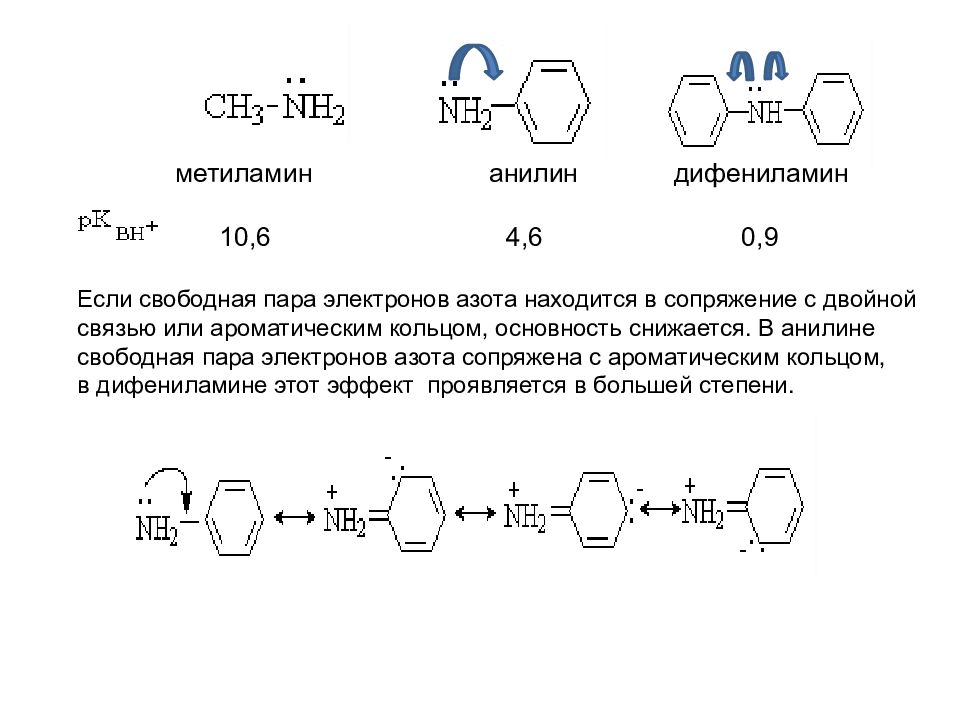
Если свободная пара электронов азота находится в сопряжение с двойной связью или ароматическим кольцом, основность снижается. В анилине свободная пара электронов азота сопряжена с ароматическим кольцом, в дифениламине этот эффект проявляется в большей степени. м етиламин анилин дифениламин 10,6 4,6 0,9
Слайд 34
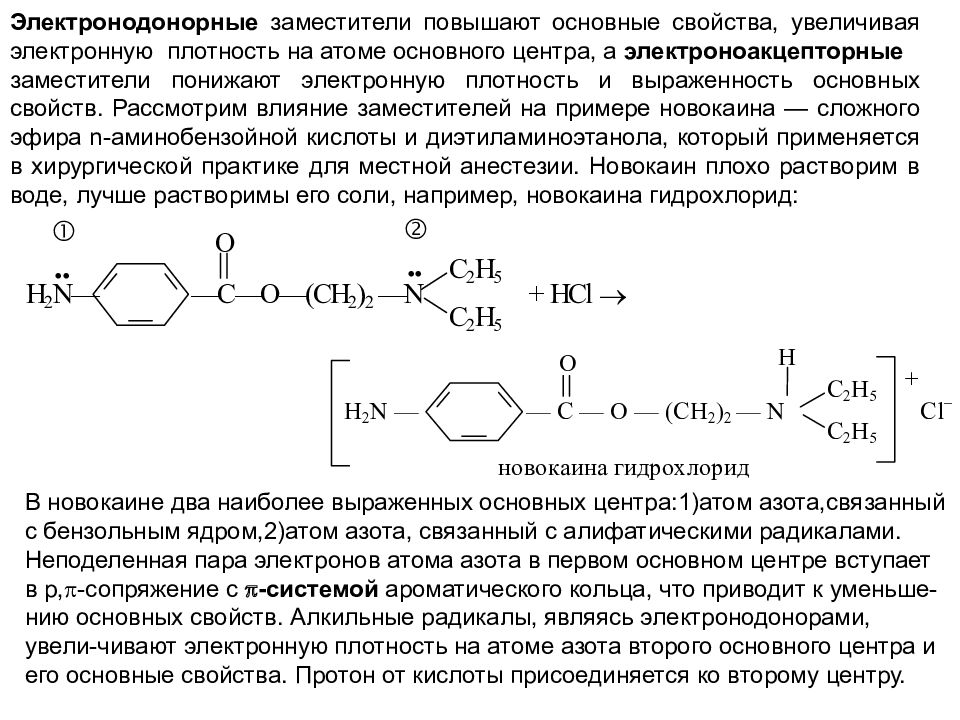
Электронодонорные заместители повышают основные свойства, увеличивая электронную плотность на атоме основного центра, а электроноакцепторные заместители понижают электронную плотность и выраженность основных свойств. Рассмотрим влияние заместителей на примере новокаина — сложного эфира n-аминобензойной кислоты и диэтиламиноэтанола, который применяется в хирургической практике для местной анестезии. Новокаин плохо растворим в воде, лучше растворимы его соли, например, новокаина гидрохлорид: В новокаине два наиболее выраженных основных центра:1)атом азота,связанный с бензольным ядром,2)атом азота, связанный с алифатическими радикалами. Неподеленная пара электронов атома азота в первом основном центре вступает в р, -сопряжение с -системой ароматического кольца, что приводит к уменьше - нию основных свойств. Алкильные радикалы, являясь электронодонорами, увели-чивают электронную плотность на атоме азота второго основного центра и его основные свойства. Протон от кислоты присоединяется ко второму центру.
Слайд 35
Электронодонорные заместители увеличивают основность, электроноакцепторные – уменьшают (противоположно рассмотренному влиянию заместителей на кислотность
Слайд 36
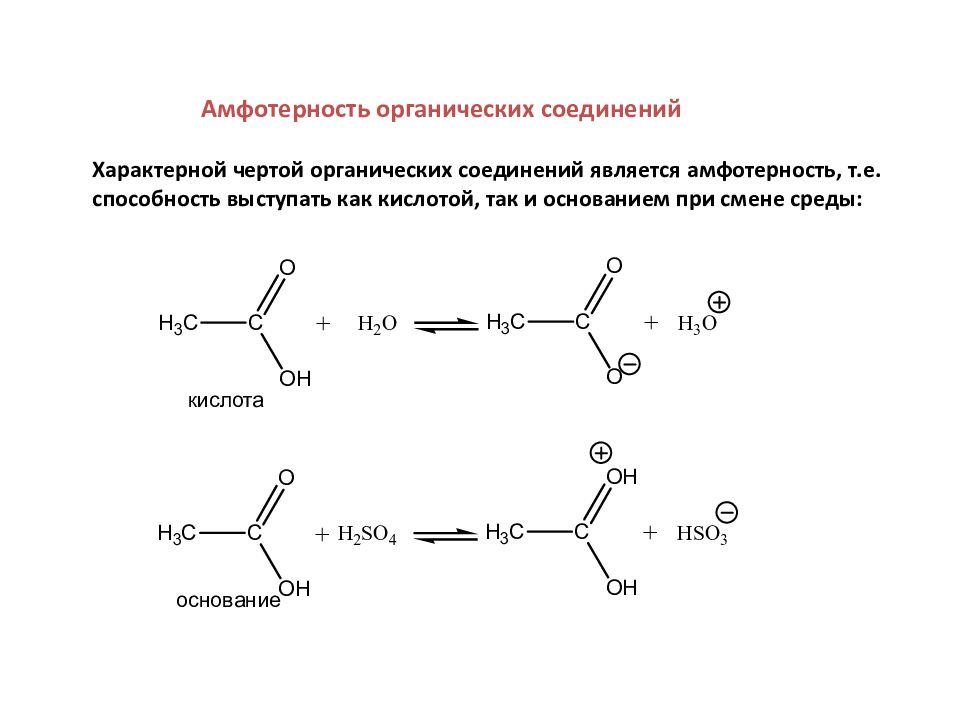
Амфотерность органических соединений Характерной чертой органических соединений является амфотерность, т.е. способность выступать как кислотой, так и основанием при смене среды:
Слайд 37
3. Электронная теория кислот и оснований, или Теория Льиса ( 1926 ) Джилберт Ньютон Льюис 1875- 1946 г. американский физикохимик Электронная теория кислот и оснований является наиболее общей теорией кислот и оснований кислоты - это вещества, способные принимать электронную пару ( акцетор электронной пары), а основания - вещества, способные давать электронную пару (доноры электронной пары) По Льюису К кислотам Льюиса относятся не только протон H +, но и все катионы, а также галогениды металлов 2 и 3 групп таблицы Менделеева: AlX 3, FeX 3, BX 3, SbX 5, SnX 4, ZnX 2 ( X = F, Cl, Br, I ). К основаниям Льюиса - все анионы OH -, OR -, CH 3 COO -, NH 2 - и т.д. и нейтральные соединения, имеющие неподеленные электронные пары или π - связи - H 2 O, ROH, ROR, RCH = O, RSH, NH 3, R 3 N, RCH = CH 2, R - C 6 H 5 и др.
Слайд 38
Если в теории Брёнстеда кислота — это донор протона, то согласно теории Льюиса сам протон является кислотой, поскольку имеет вакантную орбиталь. Таким образом, в представлении электронной теории кислота Брёнстеда явля-ется соединением, которое образует кислоту Льюиса. Поэтому согласно теории Льюиса к кислотам относят не только соединения, отщепляющие про-тон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов. Кислотно-основный процесс по Льюису состоит в образовании ковалентной связи между основанием и кислотой за счет электронной пары основания и ва-кантной орбитали кислоты. Основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса π – комплексы : Основания Льюиса, содержащие в своей структуре π -связь, образуют с кислотами π – комплексы
Слайд 39
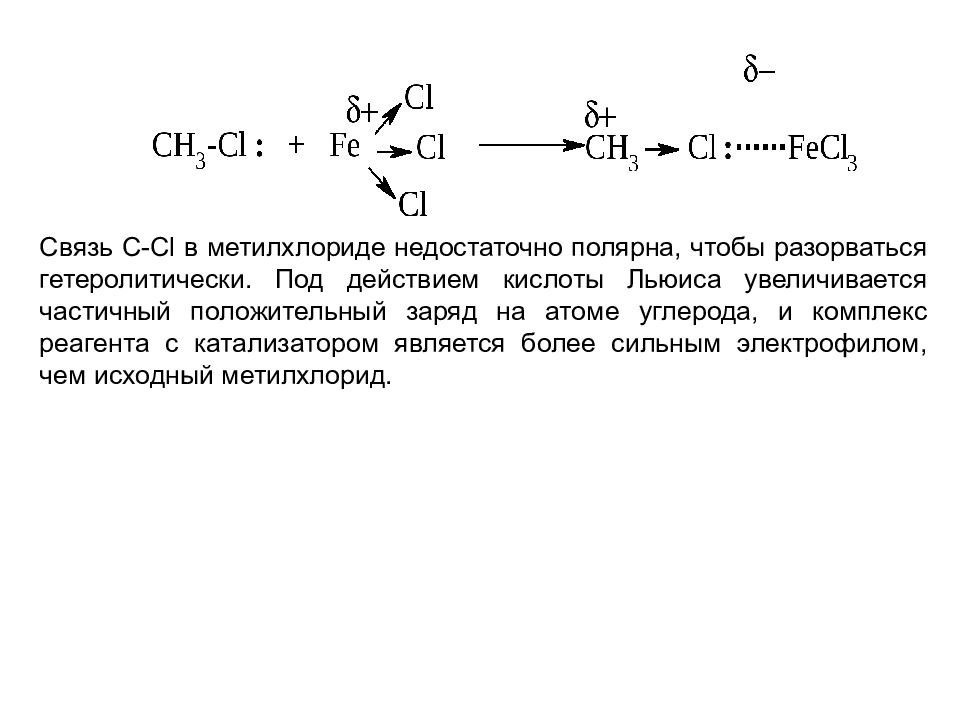
Связь C-Cl в метилхлориде недостаточно полярна, чтобы разорваться гетеролитически. Под действием кислоты Льюиса увеличивается частичный положительный заряд на атоме углерода, и комплекс реагента с катализатором является более сильным электрофилом, чем исходный метилхлорид.
Слайд 40
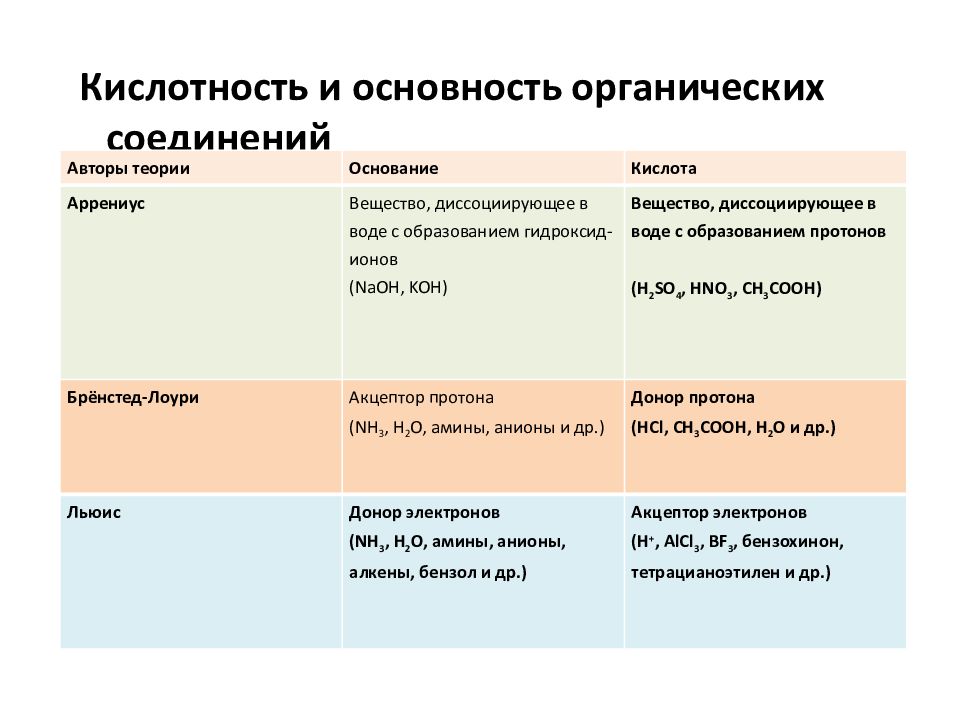
Кислотность и основность органических соединений Авторы теории Основание Кислота Аррениус Вещество, диссоциирующее в воде с образованием гидроксид-ионов ( NaOH, KOH ) Вещество, диссоциирующее в воде с образованием протонов ( H 2 SO 4, HNO 3, CH 3 COOH ) Брёнстед-Лоури Акцептор протона ( NH 3, H 2 O, амины, анионы и др.) Донор протона (HCl, CH 3 COOH, H 2 O и др.) Льюис Донор электронов ( NH 3, H 2 O, амины, анионы, алкены, бензол и др.) Акцептор электронов ( H +, AlCl 3, BF 3, бензохинон, тетрацианоэтилен и др.)
Слайд 41
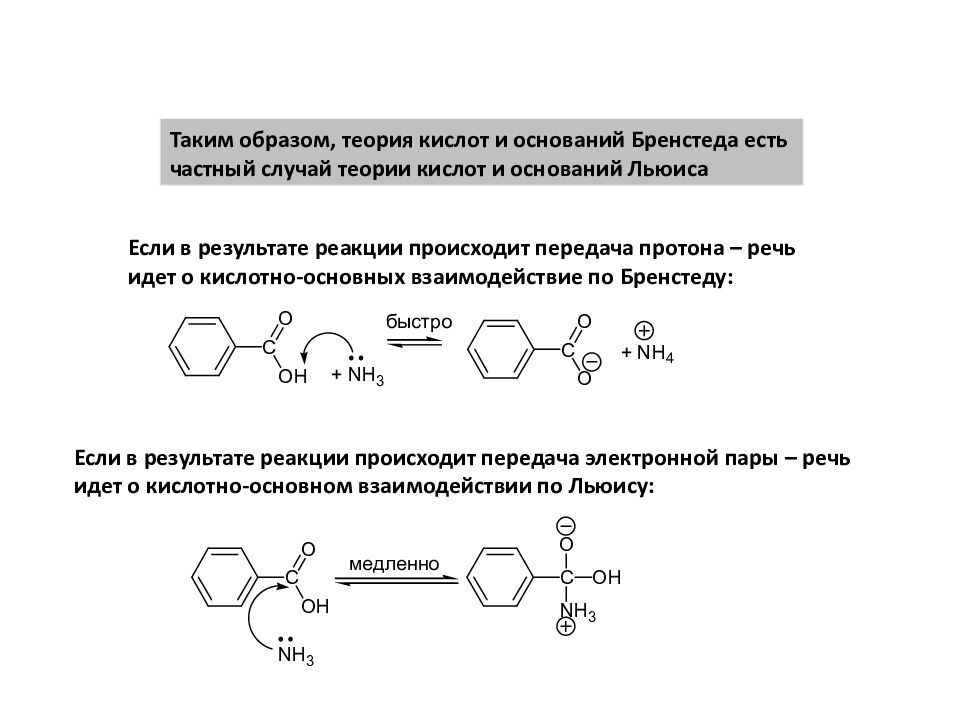
Таким образом, теория кислот и оснований Бренстеда есть частный случай теории кислот и оснований Льюиса Если в результате реакции происходит передача протона – речь идет о кислотно-основных взаимодействие по Бренстеду: Если в результате реакции происходит передача электронной пары – речь идет о кислотно-основном взаимодействии по Льюису:
Слайд 42
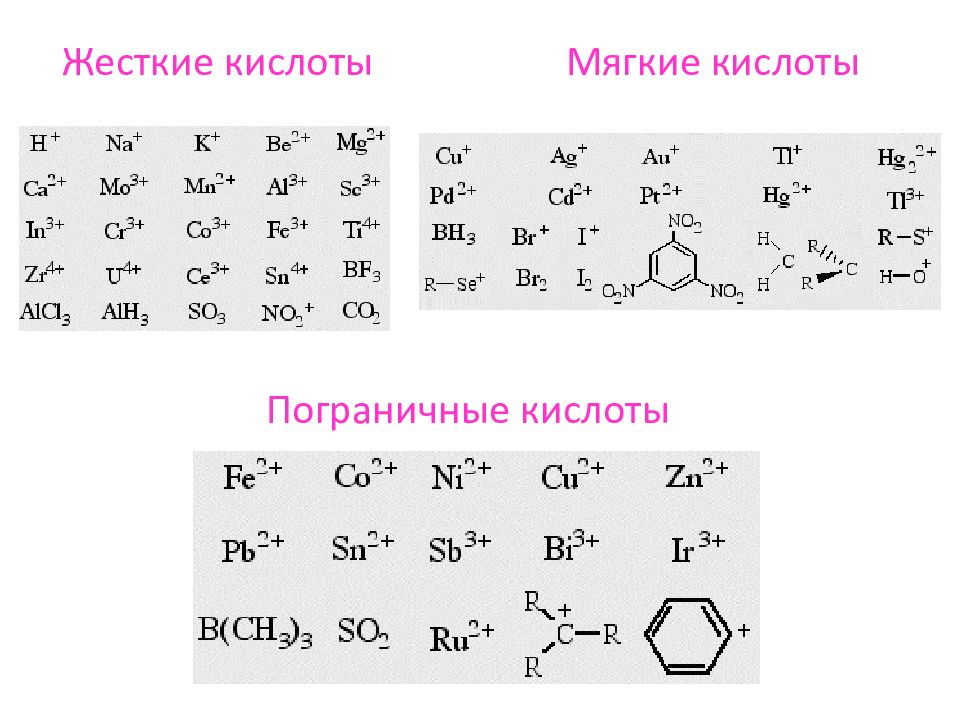
Легкость протекания кислотно-основной реакции определяется силой кислоты и основания, а также жесткостью или мягкостью кислоты и основания. Представление о жестких и мягких кислотах и основаниях (ЖМКО), введенное Р. Пирсоном, по существу является дальнейшим развитием теории Льюиса. Согласно концепции Пирсона кислоты и основания Льюиса делятся на жесткие и мягкие. К жестким кислотам относят кислоты Льюиса, в которых атомы-акцепторы имеют малый объем и несут высокий положительный заряд, а следовательно, обладают высокой электроотрицательностью и низкой поляризуемостью ( Н +, Li +, Na +, K +, Mg 2+, Ca 2+, Mn 2+, Al +3, Fe +3, AlCl 3, R—C + =0). Нижняя свободная молекулярная орбиталь (НСМО) в жестких кислотах имеет низкую энергию. К мягки v кислотам относятся кислоты Льюиса, в которых атомы-акцепторы имеют большой объем и несут низкий положительный заряд, а поэтому обладают низкой электроотрицательностью и высокой поляризуемостью ( Cu +, Ag +, Hg 2+, Pt 2+, J 2, Br 9 и др.). НСМО в мягких кислотах имеет высокую энергию.
Слайд 43
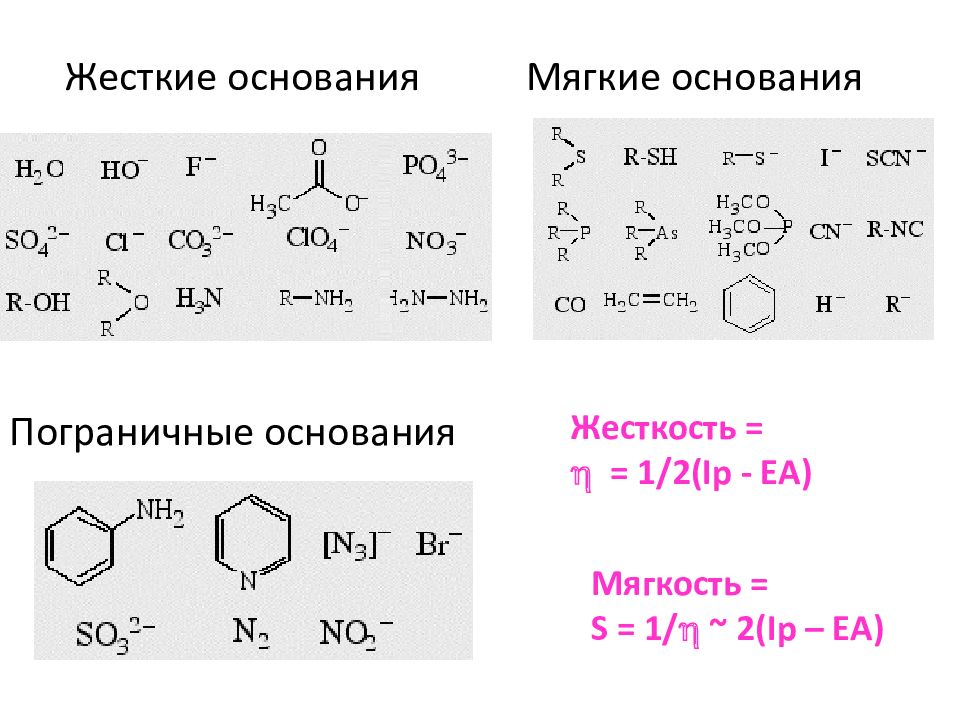
К жестким основаниям относят основания Льюиса, в которых атомы-доноры имеют высокую электроотрицательность и низкую поляризуемость (Н 2 0, ОН -,F-, CI-, CH 3 COO-, R—OH, R— О —R, NH 3, R — NH 2, H 2 N — NH 2, и др.). Верхняя занятая молекулярная орбиталь (ВЗМО) в жестких основаниях обладает низкой энергией. К мягким основаниям относят основания Льюиса, в которых атомы-доноры имеют низкую электроотрицательность и высокую поляризуемость ( RSH, RS-, R — S — R, HS-, CN -,R — CN, С 2 Н 4, С 6 Н 6, Н -, R- и др.), ВЗМО в мягких основаниях обладает высокой энергией. Исходя из общего положения о том, что более эффективно протекает взаи модействие между орбиталями с близкими энергиями, жесткие кислоты преимущественно реагируют с жесткими основаниями, а мягкие кислоты — с мягкими основаниями (принцип ЖМКО). Следует отметить, что понятия «жесткие» и «мягкие» кислоты и основания не связаны с понятиями «сильные» и «слабые» кислоты и основания. Так, мягкое основание Н - и жесткое "— С 2 Н 5 0 _ — являются сильными, а мягкое основание HS- и жесткое СН-СОО - слабыми основаниями.
Слайд 44
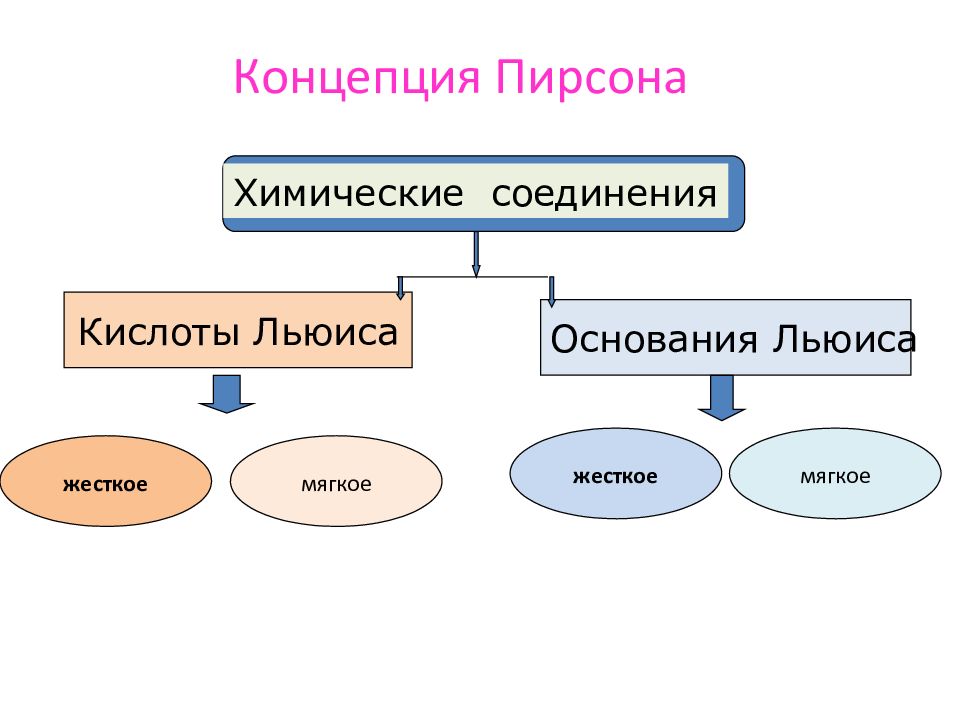
Концепция Пирсона Химические соединения Кислоты Льюиса Основания Льюиса жесткое мягкое жесткое мягкое
Слайд 45
Жесткие кислоты более легко и с образо-ванием более прочных связей реагируют с жесткими основаниями, а мягкие кислоты - с мягкими основаниями Концепция Пирсона
Слайд 46
Жесткие кислоты Жесткие основания -низкая поляризуемость -низкая поляризуемость - малый объем -малый объем -высокое сродство к (e) -высокий потенциал I p -высокая НВМО -низкая ВЗМО -большой (+) заряд -малый (-) заряд
Слайд 47
Мягкие кислоты Мягкие основания -высокая поляризуемость -высокая поляризуемость -большой объем -большой объем -низкая НВМО -высокая ВЗМО -малое сродство к (е) -малый I P -малый (+) заряд -большой (-)заряд Поляризуемость мягких кислот и оснований : в большом атоме ( или ионе с малым эффективным зарядом ядра ) относительно легко «искажается» электронное облако (частица поляризуется)
Слайд 49
Жесткие основания Мягкие основания Пограничные основания Жесткость = h = 1/2( Ip - EA) Мягкость = S = 1/ h ~ 2(Ip – EA)
Последний слайд презентации: КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ Кафедра химии Минаева Н.Н
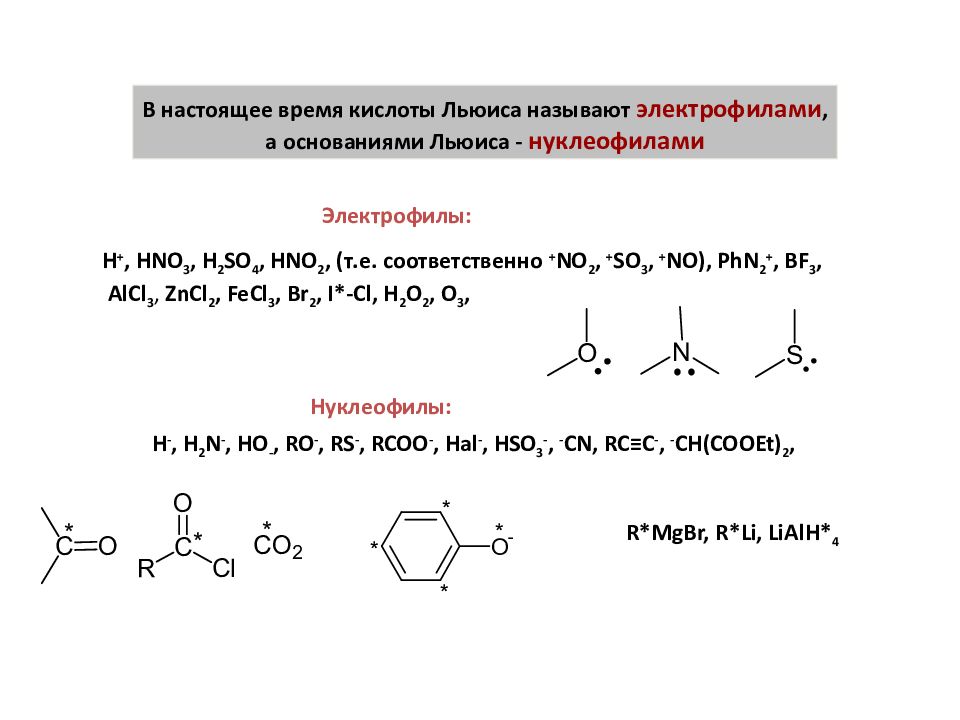
В настоящее время кислоты Льюиса называют электрофилами, а основаниями Льюиса - нуклеофилами Электрофилы: H +, HNO 3, H 2 SO 4, HNO 2, ( т.е. соответственно + NO 2, + SO 3, + NO), PhN 2 +, BF 3, AlCl 3, ZnCl 2, FeCl 3, Br 2, I*-Cl, H 2 O 2, O 3, Нуклеофилы: H -, H 2 N -, HO -, RO -, RS -, RCOO -, Hal -, HSO 3 -, - CN, RC ≡C -, - CH(COOEt) 2, R*MgBr, R*Li, LiAlH* 4