Первый слайд презентации: Та қ ырыбы: Химиялы қ кинетика
“ Та қ ырыбы: Химиялы қ кинетика Орында ғ андар: Қ адырбек.Ш, Анарматова.М Тобы;Химия21А Астана-2023
Слайд 2: ЖОСПАР:
Кіріспе Негізгі б ө лім 1. Химиялы қ реакцияларды ң жылдамды ғ ы 2. Химиялы қ реакциялар жылдамды ғ ыны ң температура ғ а т ә уелділігі 3. Химиялы қ реакциялар жылдамды ғ ыны ң катализаторларды ң қ атысуына т ә уелділігі. 4. Химиялы қ реакцияларды ң молекулалы ғ ы мен реті Қ орытынды Пайдаланыл ғ ан ә дебиеттер
Слайд 3: Химиялы қ кинетика
Химиялы қ кинетика – химиялы қ реакцияны ң жылдамды ғ ын, реакцияны ң ж ү ру механизмін ж ә не о ғ ан ә рт ү рлі факторларды ң ә серін зерттейтін ғ ылым саласы Бастапқы заттар Реакция өнімдері
Слайд 4
Химиялы қ реакцияларды ң жылдамды ғ ы белгілі бір уа қ ытта ә рекеттесетін заттар м ө лш ерін і ң ө з г е р у і н ай т а д ы c U орташа = ±
Слайд 5
Химиялы қ реакция жылдамды ғ ына ә сер ететін факторлар : температура қ ысым катализатор реакция ғ а қ атыс қ ан заттарды ң таби ғ аты еріткішті ң таби ғ аты реагенттерді ң концентрациясы
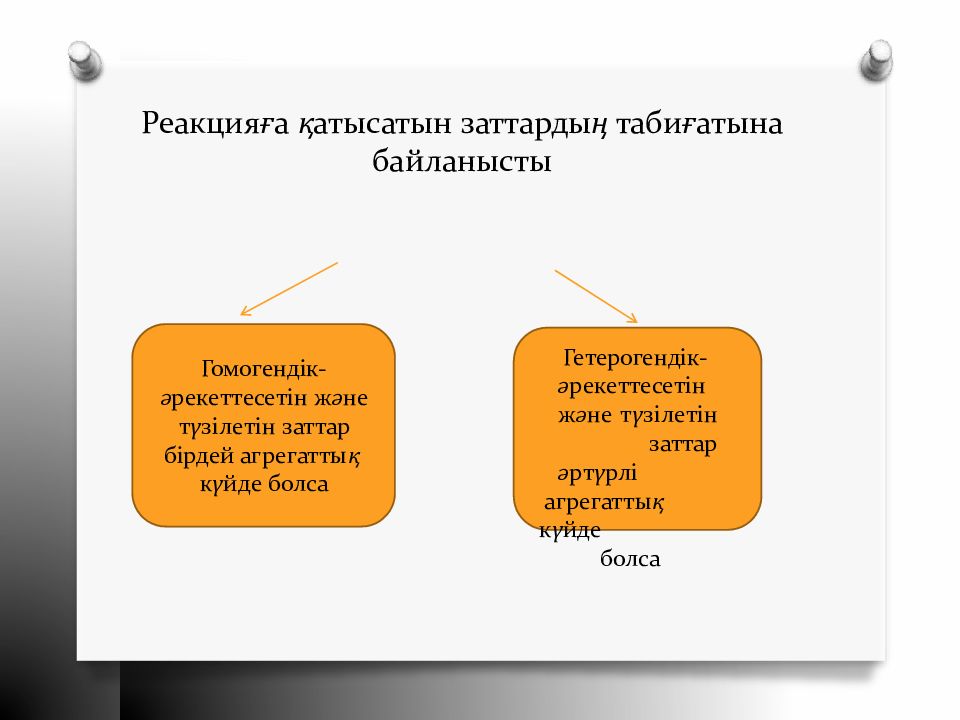
Гомогендік- ә рекеттесетін ж ә не т ү зілетін заттар бірдей агрегатты қ к ү йде болса Гетерогендік- ә рекеттесетін ж ә н е т ү з і л ет і н заттар ә рт ү рлі агрегатты қ к ү йде болса
Слайд 7: Ә рекеттесуші заттарды ң концентрациясы химиялы қ реакция жылдамды ғ ына қ алай ә сер етеді?
Х и м и я л ы қ реакц и я л ар т ез ж ү р у і ү шін т ү й і с е ті н молекулалар саны к ө п болуы керек, я ғ ни концентрацияны ө сіру керек. Реакцияны ң жылдамды ғ ына ә рекеттесуші заттарды ң концентрацияларыны ң ә серін зерттеген Норвегияны ң екі ғ алымы Гульдберг ж ә не Вааге 1867 жылы мынадай қ орытынды ғ а келген: химиялы қ реакцияны ң жылдамды ғ ы реакцияласушы заттарды ң концентрацияларыны ң к ө бейтіндісіне тура пропорционал болады, оны ә рекеттесуші массалар за ң ы деп атайды. Жалпы А + В = С те ң деуі бойынша ж ү ретін реакциялар ү шін б ұ л за ң мынадай те ң деумен ө рнектеледі.: ν = k С А С В М ұ нда ғ ы С А ж ә не С В – А ж ә не В заттарыны ң к он ц е н т рац и я с ы, м о л ь / л, k – жы л да м д ы қ к онс т а н т а с ы д еп аталатын пропорционалды қ коэффицент.
Слайд 8: Хим и ялы қ р еакци я ла р жылда м д ы ғ ыны ң температура ғ а т ә уелділігі
Т ем п е р а т у р а ж о ғ а р л а ғ ан с айын хим и я л ы қ реакцияны ң жылдамды ғ ы а р т а д ы. Г омо г ендік р е а к ци я л а р жылдамды ғ ыны ң температураны ң ж о ғ а р л а уы н а байл а ны ст ы а р т уы н 1 8 8 4 ж ы лы ашыл ғ ан Вант- Гофф ережесі аны қ тайды:“Tемператураны 10° ө сіргенде реакцияны ң жылдамды ғ ы 2-4 есе артады” υ Т2 = υ Т1 γ Т2 – Т1/10, м ұ нда ғ ы γ – температуралы қ коэффициент
Слайд 9
Химиялы қ реакцияны ң жылдамды ғ ыны ң т емпер а т ур а ғ а т ә у е л д і л ігі н г раф и к т ү р і н д е д е к ө рсетуге болады : U t g
К= А• е - E a¢ /RT К- жылдамды қ константасы, А- со қ ты ғ ысуларды ң жалпы саны E a¢- активтену энергиясы, е - н а т ур а л л о г а р иф мні ң не г і з і
Слайд 11
С.Аррениус молекулаларды ң теориясы ә рекеттесуі, б о й ы нш а о ла р ды ң со қ ты ғ ыс қ ан кездегі энергия қ орына байланысты, я ғ ни реакция ғ а тек бойында арты қ м ө лшерде энергия қ оры бар молекулалар ғ ана қ атыса алады да м ұ ндай молекулар активтелген молекулар деп атайды. Орташа энергия қ оры бар молекуланы реакция ғ а қ атыса алатындай актив к ү йге келтіру ү шін ж ұ мсалатын энергияны активтендіру энергиясы дейді. Химиялы қ реакцияны ң ж ү ру температурасы ө скенде химиялы қ ә рекеттесуге ә келіп со ғ атын “активті молекулаларды ң ” да саны артады.
Слайд 12: Х имия лы қ р еа к ци я ла р ж ылда м д ы ғ ыны ң катализаторды ң қ атысуына т ә уелділігі
Катализатор деп, реакция жылдамды ғ ын ө згертетін ж ә не реакция н ә тижесінде ө згеріссіз қ алатын заттарды атайды. O Егер катализатор реакция жылдамды ғ ын арттыратын болса, оны о ң, ал баяулататын болса теріс катализатор деп атайды. O Егер катализатор реакция барысында т ү зілсе, оны автокатализ деп атайды. O Кейбір заттар катализаторды ң ә сер етуіне кедергі жасайды, ондай заттарды ингибиторлар немесе катализатор улары дейді. O Ал кейбір заттар ө здері катализатор болмаса да, катализаторды ң активтілігін арттырады, ондай заттарды активаторлар дейді
Слайд 13: Қ ыш қ ылды – негіздік катализ
Қ ы ш қ ы лд ы – н егі з д і к к а т а л и з - қ ыш қ ылды ң реакция ғ а қ атысатын затты ң біріне ө зіні ң протонын беруі ар қ ылы ж ү ретін катализді ң т ү рі. Оны ң мысалы ретінде к ү рделі эфирлерді ң гидролизін к ө рсетуге болады. К ү р д е лі эф и р лер г и д р о ли з д е н г е н д е Ингольсті ң теориясы бойынша мына сатылардан ө теді:
Слайд 14: Б ұ л мысал қ ыш қ ылды ң катализаторлы қ ү лесін к ө рсетеді:
К ү рделі эфирге қ ыш қ ыл ө з протонын береді де ө зі ио н ғ а а й н а л ады П р о т он ды қ ос ы п алу а р қ ыл ы т ү з і л г ен о к с они й - и о н т ұ ра қ сыз келеді де, одан ә рі ыдырау ғ а ұ ырайды, н ә т и ж е с ін д е кар б а к а т и о н ж ә н е с п и рт т ү з і л еді Ә рі қ арай карбакатион су молекуласымен ә рекеттеседі С о ң ғ ы т ү з і л г ен о к с они й - и он, реа к ц и я ны ң б ір і нш і сатысында т ү зілген негізбен ә ректтеседі де, қ ыш қ ыл реакциядан босап шы ғ ады
Слайд 15: Химиялы қ реакцияларды ң реті
O Реакцияларды ң реттілігі деп жалпы т ү рде экспериментальды жолмен табыл ғ ан кинетикалы қ те ң деулердегі реагент концентрациясыны ң д ә режелік к ө рсеткішіні ң қ осындысын айтады. Мысалы: n 1 А + n 2 В = n 3 С + n 4 Д реакциясы ү шін реакцияны ң реті n = n 1 + n 2
Слайд 16: К ү рделі реакциялар
К ү рделі реакциялар деп – жалпы кинетикалы қ те ң деу бойынша жылдамды қ константасы болатын реакцияларды айтады. К ү рделі реакциялар ғ а : қ айтымды, п а р ал е л ь, к езе к ті, қ а т ар ж ү р етін ж ә не тізбекті реакциялар жатады.
Слайд 17
O а) Қ айтымды реакция- тура ж ә не кері ба ғ ытта ж ү ре д і, я ғ н и реак ц ия н ә т и ж ес і н д е т ү з і л г ен жа ң а заттар қ айтадан ә рекеттесіп, бастап қ ы заттар ғ а айналады. А + В → А 1 + В 1 O ә ) Параллельді реакция- бір мезгілде екі немесе бірнеше ба ғ ытта ж ү реді. O б) Кезекті реакция- бірінен бірі кезектесіп, аралы қ қ осылыстар т ү зе ж ү реді. А В С
Слайд 18
O в) Қ атар ж ү ретін реакция- бір реакция екінші реакциямен қ абаттасып ж ү реді. O Г) Тізбекті реакция - бос к ү йдегі радикалдар қ а т ыс а т ы н реак ц и я л ар ж а т а д ы (жану, қ опару,фотохимиялы қ реакциялар). Тізбекті реакцияны 1905 жылы орыс ғ алымы Н.А.Шилов ашты, ал оны ә рі қ арай зерттеуде Н.Н.Семеновты ң е ң бегі зор.
Слайд 19: қ орытынды
Химиялы қ кинетиканы ң ғ ылыми ж ә не практикалы қ ма ң ызы зор. Қ азіргі кездегі химия мен химиялы қ технологияны ң басты ба ғ ыттарыны ң дамуы химиялы қ реак ц и я л ар к ин етикасын з ерт т еум е н байланысты ж ү зеге асырылуда.
Слайд 20: Задачи 1.Температурный коэффициент реакции равен 2,5. Как изменится ее скорость при охлаждении реакционной смеси от изменения температуры от 50 °С до 30 °С? 2.При увеличении температуры с 30 до45°С скорость гомогенной реакции повысилась в 20 раз. Чему равна энергия активации реакции? 3.При установлении равновесия Fe203 (т) + 3CO ( r ) = 2Fe (т) + 3C02 (г) концентрация[CO] = 1 моль/л и [СО,] = 2 моль/л. Вычислите исходную концентрацию [CO] ис. если начальная концентрация СО2 равна нулю
Слайд 21: Сұрақтарға жауап беріңіздер ; 1.Химиялық реакция жылдамдығына қандай факторлар әсер етеді ? 2.Катализатор реакцияға қалай әсер етеді ? 3.Күрделі реакциялар дегеніміз не ? 4.Химиялық кинетика ғылымына үлес қосқан қандай ғалымдарды білесіз ? 5.Реакцияға қатысатын заттар табиғатына байланысты қалай жіктеледі ?
Слайд 22: Қолданылған әдебиеттер:
Т.С. Сейтембетов « ХИМИЯ» Б.А. Бірімжанов, Н.Н. Н ұ рахметов «ЖАЛПЫ ХИМИЯ» А.Ж. Сейтембетова «БИОЛОГИЯЛЫ Қ ХИМИЯ»