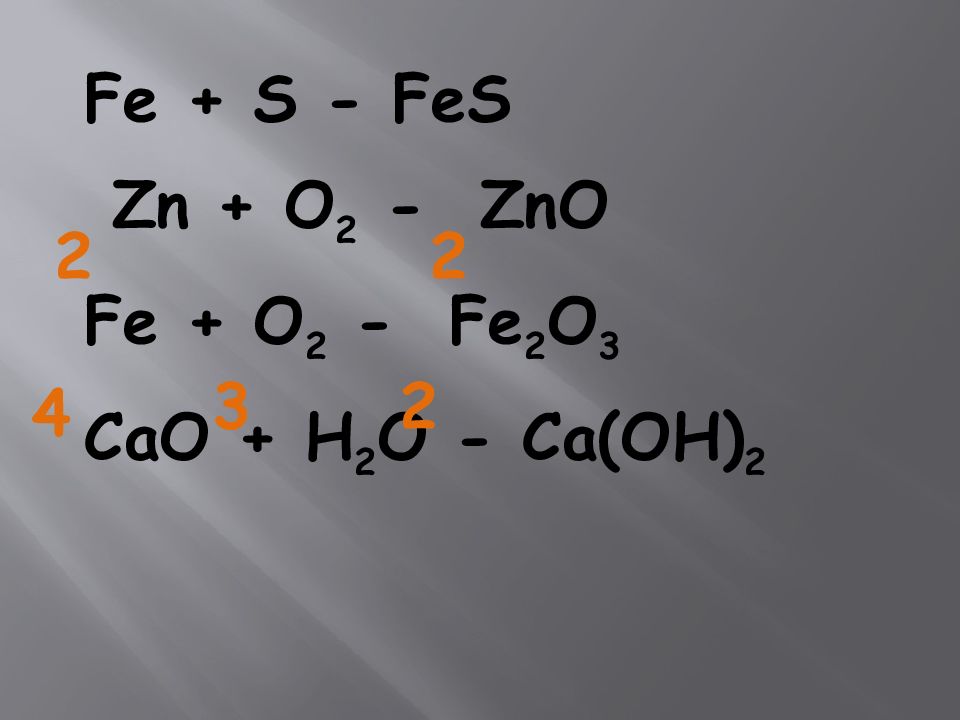Первый слайд презентации
Типы химических реакций Выполнила студентка группы 2-1 ХАО Шахова Анастасия
Слайд 2
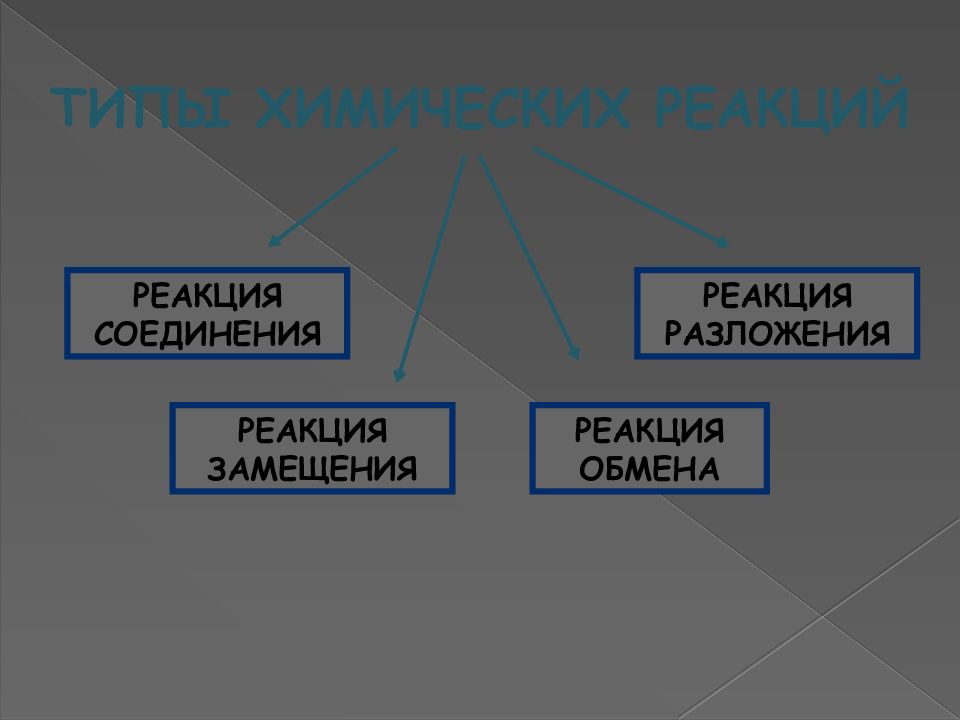
ТИПЫ ХИМИЧЕСКИХ РЕАКЦИЙ РЕАКЦИЯ СОЕДИНЕНИЯ РЕАКЦИЯ РАЗЛОЖЕНИЯ РЕАКЦИЯ ЗАМЕЩЕНИЯ РЕАКЦИЯ ОБМЕНА
Слайд 4
Реакция разложения малахита: оксид меди (II) (CuOH) 2 CO 3 = 2CuO + H 2 O + CO 2 малахит вода оксид углерода (IV)
Слайд 5
– это реакции, в результате которых сложное вещество разлагается на несколько других, более простых веществ. Реакции разложения - + =
Слайд 7
Выберите уравнения реакций разложения: 1) CaO + CO 2 = CaCO 3 2) CO 2 + 2NaOH = Na 2 CO 3 + H 2 O 3) Fe + S = FeS 4) 2H 2 O = 2H 2 + O 2 ↑ 5) CuO + H 2 = Cu + H 2 O 6) Zn + 2HCl = ZnCl 2 + H 2 ↑ 7) ZnO + H 2 SO 4 = ZnSO 4 + H 2 O 8) Cu(OH) 2 = CuO + H 2 O
Слайд 8
– это реакции, в которых из нескольких простых или сложных веществ образуется одно более сложное вещество. Реакции соединения - + = Подавляющее большинство реакций соединения экзотермичны.
Слайд 9
Fe + S - FeS Zn + O 2 - ZnO Fe + O 2 - Fe 2 O 3 CaO + H 2 O - Ca(OH) 2 4 2 2 2 3
Слайд 10
Выберите уравнения реакций соединения: 1) 2HgO = 2Hg + O 2 2) CaCO 3 = CaO + CO 2 3) CuSO 4 + Fe = Cu + FeSO 4 4) CuO + H 2 = Cu + H 2 O 5) 2H 2 + O 2 = 2H 2 O 6) H 2 SO 4 + 2KOH = K 2 SO 4 + 2H 2 O 7) BaO + SO 2 = BaSO 3
Слайд 11
Реакции между простым и сложным веществом, в результате которых атомы простого вещества замещают атомы одного из элементов сложного вещества, называются реакциями замещения. Реакции замещения - + + =
Слайд 12
Zn + HCl – ZnCl 2 + H 2 Fe + CuCl 2 – FeCl 2 + Cu Cu + HgSO 4 – CuSO 4 + Hg 2
Слайд 13
Реакции между двумя сложными веществами, в результате которых они обмениваются своими составными частями называются реакциями обмена. Реакции обмена - + + =
Слайд 14
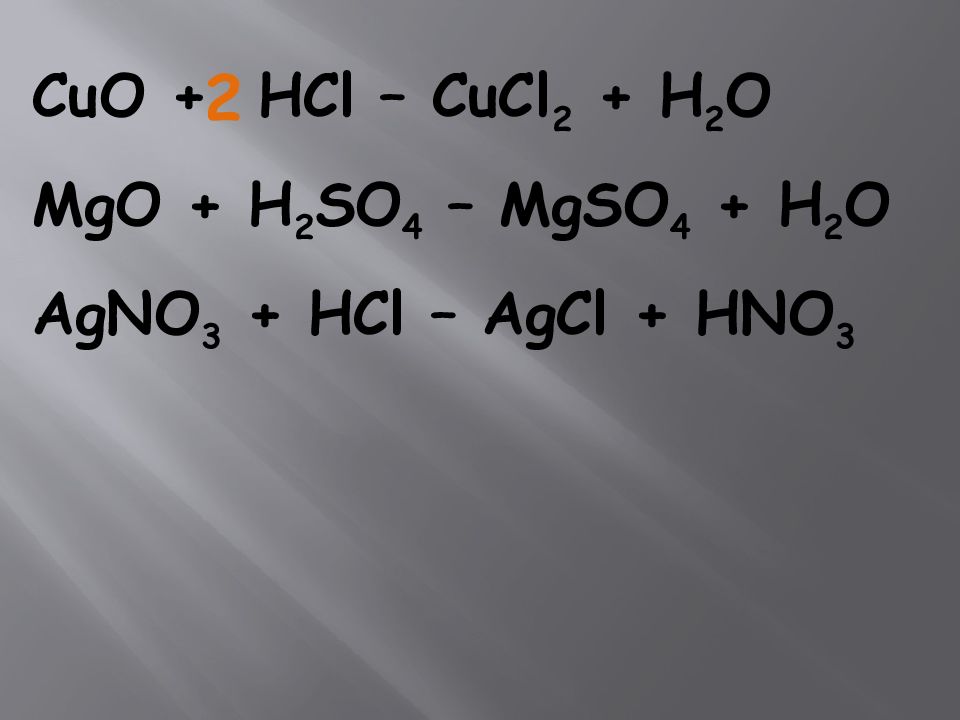
CuO + HCl – CuCl 2 + H 2 O MgO + H 2 SO 4 – MgSO 4 + H 2 O AgNO 3 + HCl – AgCl + HNO 3 2
Слайд 15
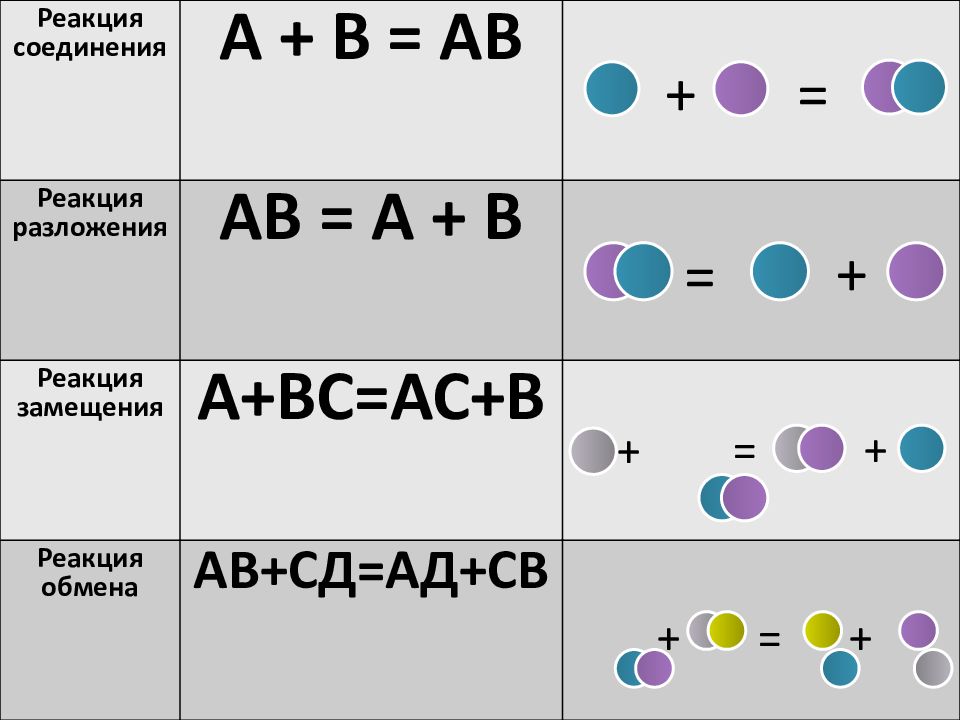
Реакция соединения А + В = АВ Реакция разложения АВ = А + В Реакция замещения А+ВС=АС+В Реакция обмена АВ+СД=АД+СВ + = + = + + = + + =