В основе методов КОТ лежит реакция нейтрализации. Что это за реакция? КОТ – методы кислотно-основного титрования (методы нейтрализации) основаны на взаимодействии кислот и оснований друг с другом: Н + + ОН - = Н 2 О Применяется для определения концентрации кислот, оснований и гидролизующихся солей (по катиону – как кислот ZnCl 2, по аниону – как оснований K 2 CO 3 ).
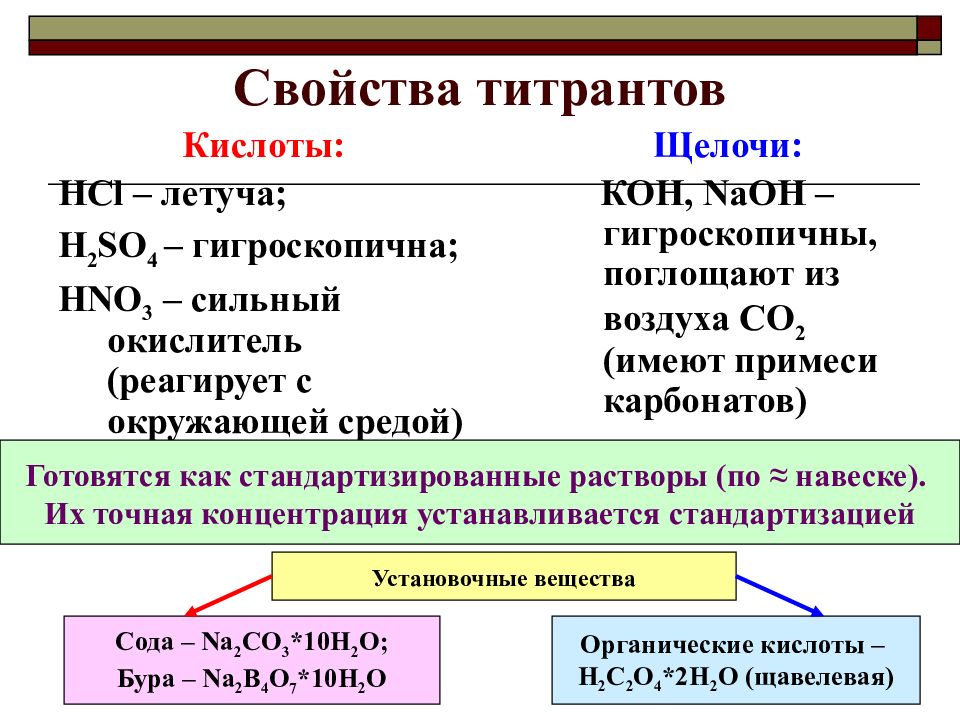
Слайд 8: Свойства титрантов
Кислоты: HCl – летуча; H 2 SO 4 – гигроскопична; HNO 3 – сильный окислитель (реагирует с окружающей средой) Щелочи: КОН, NaOH – гигроскопичны, поглощают из воздуха СО 2 (имеют примеси карбонатов) Готовятся как стандартизированные растворы (по ≈ навеске). Их точная концентрация устанавливается стандартизацией Сода – Na 2 CO 3 *10H 2 O; Бура – Na 2 B 4 O 7 *10H 2 O Органические кислоты – Н 2 С 2 О 4 *2Н 2 О (щавелевая) Установочные вещества
Слайд 10: Область перехода окраски индикатора в КОТ
М/О рТ Ф/Н рТ < 7,0 < 7,0 > 7,0 > 7,0 =7,0 =7,0 3,1 – 4,4 8,0 – 10,0
Слайд 11: Алгоритм выбора индикатора
Определите рН среды раствора определяемого вещества Выберите титрант согласно найденного значения рН Напишите уравнение реакции между определяемым веществом и титрантом Определите рН раствора в точке эквивалентности Согласно полученного значения рН выберите индикатор Определите изменение окраски индикатора при титровании
Слайд 12: Примеры работы с алгоритмом выбора индикатора
1. CH 3 COOH, pH < 7,0 2. NaOH 3. CH 3 COOH + NaOH = CH 3 COO Na + H 2 O 4. pH (H 2 O) = 7,0; pH ( CH 3 COO Na) > 7,0 5. Т.к. рН в ТЭ > 7,0, то индикатор – Ф/Н 6. 1. КОН, pH > 7,0 2. HNO 3 3. KOH + HNO 3 = KNO 3 + H 2 O 4. pH (H 2 O) = 7,0; pH (KNO 3 ) = 7,0 5. Т.к. рН в ТЭ = 7,0, то индикатор – любой, например М/О 6. Титровать от желтой через оранжевую до красной, от 1 избыточной капли титранта, объем которой нужно вычесть (- 0,03 мл).
Слайд 13: Применение КОТ
Определение кислот Определение оснований Определение гидролизующихся солей Определение временной (карбонатной) жесткости воды Определение кислотности и щелочности почвы, плодов, овощей, влажных выпадений Анализ лекарственных препаратов (неводное титрование).
Слайд 14: КОМПЛЕКСОМЕТРИЯ (КМТ)
В основе методов КМТ лежат реакции комплексообразования. Что это за реакции? Реакции комплексообразования должны быть: Стехиометрическими Практически необратимыми Протекать быстро Иметь удобный способ фиксирования КТТ
Слайд 15: КОМПЛЕКСОНОМЕТРИЯ (КМТ)
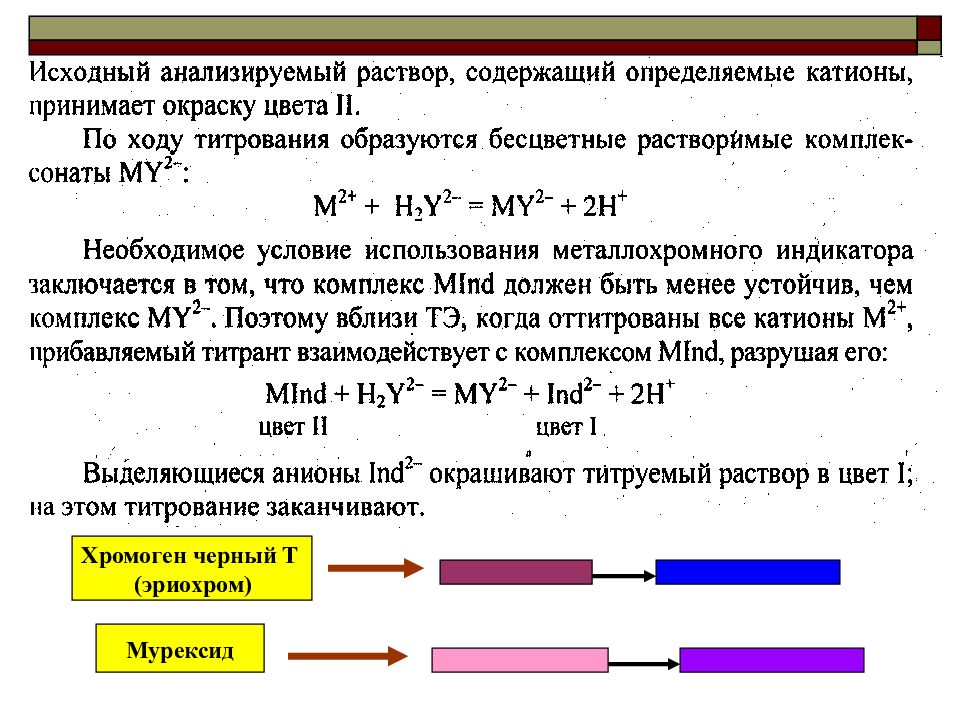
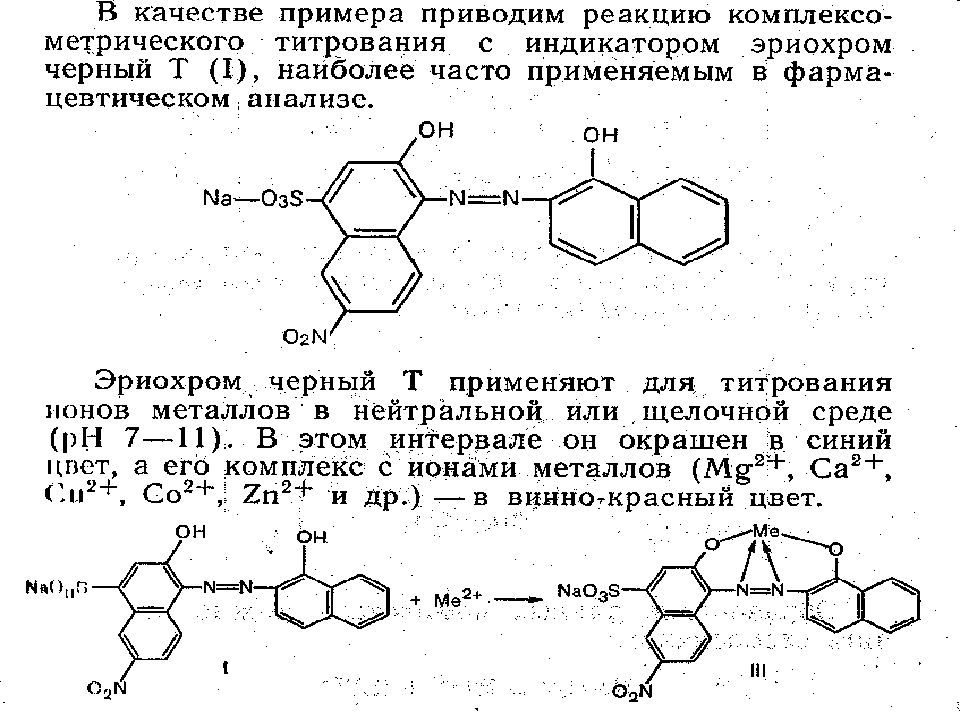
Метод комплексонометрического титрования – это разновидность комплексометрии. В основе комплексонометрии лежит реакция образования комплексных соединений при взаимодействии определяемого вещества и титранта: в КМТ – определяемые компоненты – катионы металлов (акцепторы электронной пары), а титранты – комплексоны (доноры электронной пары). Продукты реакций – внутрикомплексные соединения хелатного типа.
Слайд 16
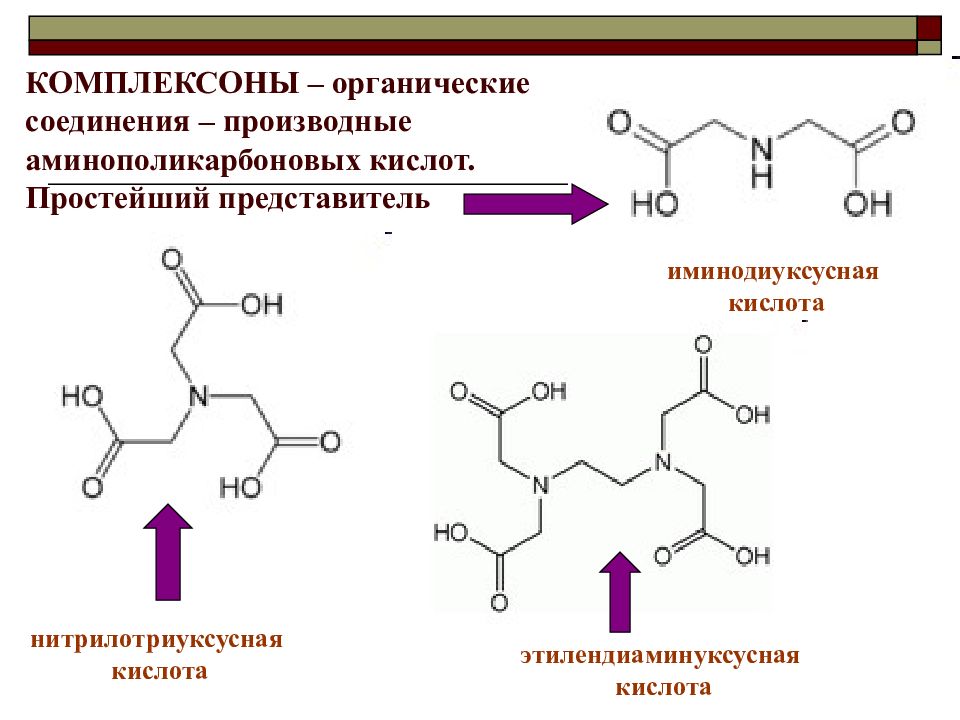
КОМПЛЕКСОНЫ – органические соединения – производные аминополикарбоновых кислот. Простейший представитель иминодиуксусная кислота нитрилотриуксусная кислота этилендиаминуксусная кислота
Слайд 17
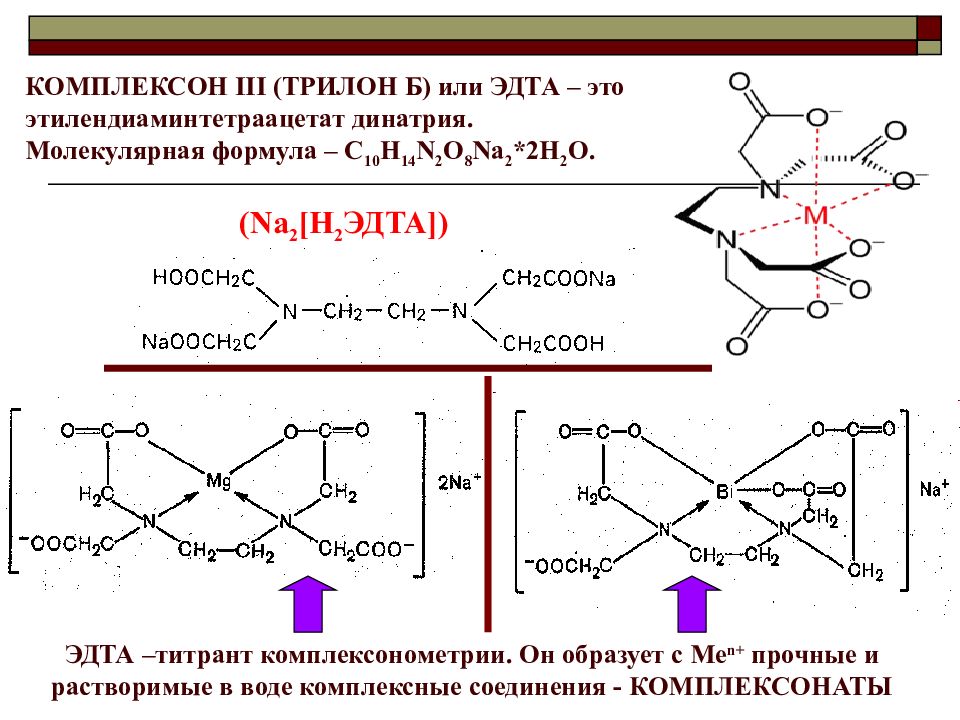
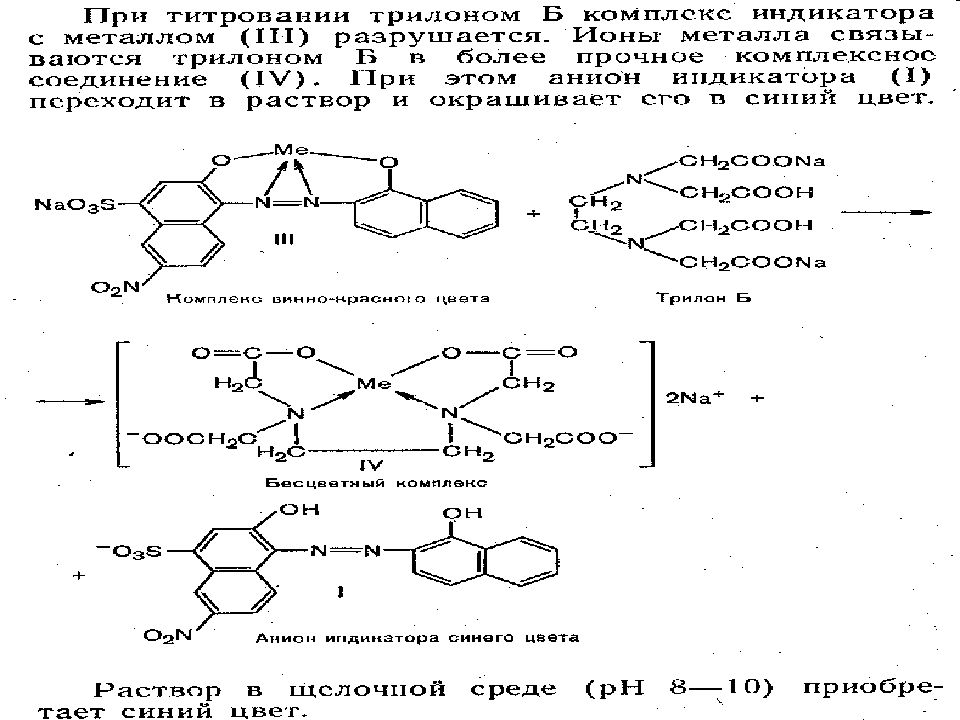
КОМПЛЕКСОН III (ТРИЛОН Б) или ЭДТА – это этилендиаминтетраацетат динатрия. Молекулярная формула – С 10 Н 14 N 2 O 8 Na 2 *2H 2 O. (Na 2 [H 2 ЭДТА ]) ЭДТА –титрант комплексонометрии. Он образует с Ме n+ прочные и растворимые в воде комплексные соединения - КОМПЛЕКСОНАТЫ
Слайд 23: Условия титрования КМТ
Титрант ЭДТА Строго определенное значение рН среды, создаваемое добавлением буферных растворов Энергичное перемешивание и медленное титрование Металлоиндикаторы добавлять в сухом виде (смесь индикатор : NaCl = 1:200) Титровать до изменения окраски (избыточную каплю вычитать не надо. Почему? )
Слайд 24: Приготовление титранта
ЭДТА можно готовить как по точной (стандартный), так и по приблизительной навеске (стандартизированный). Точную концентрацию свежеприготовленного стандартного (приготовленного по точной навеске) раствора ЭДТА определяют расчетным способом. При хранении ( даже в холодильнике ) раствор ЭДТА постепенно разлагается. Если раствор приготовлен не вами, приготовлен как стандартизированный (по приблизительной навеске) или он некоторое время уже хранился точную концентрацию необходимо определять стандартизацией с применением в качестве установочного вещества MgSO 4 *7H 2 O.
Слайд 25: Применение комплексонометрии
Определение общей жесткости воды, осадков Определение содержания Са 2+ и Mg 2+ в почве Определение многих катионов в природных объектах и лекарственных препаратах ( Zn 2+, Ca 2+, Mg 2+, Pb 2+ и др.)
Слайд 26: ОСАДИТЕЛЬНОЕ ТИТРОВАНИЕ (ОТ)
В основе методов ОТ лежат реакции осаждения. Что это за реакции? Требования к реакциям осаждения: Должна протекать строго по уравнению без побочных процессов Осадки д.б. практически не растворимыми и выпадать быстро Необходимо иметь возможность определить КТТ индикаторным способом
Слайд 29: Принцип действия индикаторов - реагентов
Роданометрические методы – железоаммонийные квасцы NH 4 Fe(SO 4 ) 2 *12H 2 O
Слайд 31: Метод Мора
Условия титрования: Нейтральная, слабощелочная среда (рН 6,5-10,3) Отсутствие катионов, дающих цветные осадки с индикатором K 2 CrO 4 Определенный порядок титрования ( AgNO 3 – титрант находится в пипетке или бюретке ) Титровать медленно, энергично перемешивая от лимонно-желтого раствора, через помутнение до оранжевого осадка от 1 избыточной капли титранта, объем которой нужно вычесть. Почему? Особые требования к мытью посуды!!!! Титрант метода - AgNO 3 готовится как вторичный стандарт. Почему? Как? Точная его концентрация устанавливается стандартизацией с применением в качестве установочного вещества NaCl.
Слайд 33: Метод Фольгарда
Титрант метода - NH 4 SCN готовится как вторичный стандарт. Почему? Как? Точная его концентрация устанавливается стандартизацией с применением в качестве установочного вещества AgNO 3. Как оно готовится? Как установить его точную концентрацию? Условия титрования: Кислая среда (индикатор - NH 4 Fe(SO 4 ) 2 *12H 2 O - приготовлен на HNO 3 !) Обратное титрование. В чем сущность его? Два рабочих раствора: 1 - AgNO 3 (в колбе) берется в избыточном, но точно измеренном количестве; 2 - NH 4 SCN (в пипетке или бюретке ) Титровать медленно, энергично перемешивая от бесцветного раствора над белым осадком до розового раствора над осадком от 1 избыточной капли титранта, объем которой нужно вычесть. Почему? Особые требования к мытью посуды!!!!
Слайд 34: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ (ОВТ)
В основе методов ОВТ лежат окислительно-восстановительные реакции. Что это за реакции?
Слайд 35
Реакция, применяемая в методах ОВТ должна: Протекать строго по уравнению без побочных процессов Протекать практически до конца Протекать достаточно быстро, чтобы равновесие устанавливалось практически мгновенно Определяться точно и однозначно КТТ любым известным способом ОВТ – титриметрические методы, основанные на ОВР, протекающих между анализируемым веществом и титрантом.
Слайд 38: Перманганатометрия
рН < 7,0 рН = 7,0 рН > 7,0 Е = 1,51 В Е = 0,60 В Е = 0,56 В
Слайд 40
4. Перманганатометрия – автокаталитическая реакция, катализатором которой является Mn 2+ Каплю нужно вычитать?
Слайд 41
KMnO 4 готовится как вторичный стандарт ( по какой навеске? ) за 7-10 дней до начала работы с ним. Точную концентрацию его определяют как? Установочные вещества -
Слайд 42
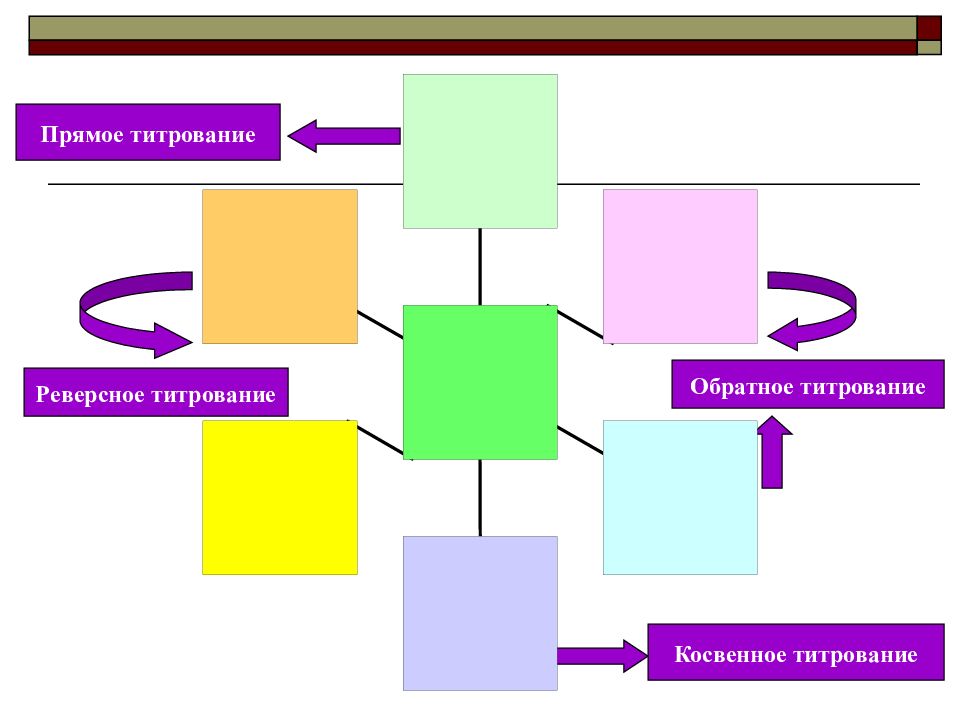
Обратное титрование Прямое титрование Реверсное титрование Косвенное титрование
Слайд 43: Иодометрия, иодиметрия
I 2 + 2e = 2I - Иодиметрия (прямое титрование) 2I - − 2e = I 2 ↓ Иодометрия (титрование заместителя)
Последний слайд презентации: МЕТОДЫ ТИТРИМЕТРИЧЕСКОГО АНАЛИЗА
Условия титрования: Титрование заместительное, I 2 − заместитель, образующийся при взаимодействии реагента KI с определяемым веществом или установочным окислителем. Слабокислая среда ( HCl, H 2 SO 4 ), т.к. в щелочной − I 2 реагирует с NaOH (обесцвечивание), в сильно кислой разлагается титрант с выделением S (помутнение), в нейтральной – реакция обратима и не пойдет до конца. Титрант – Na 2 S 2 O 3 (тиосульфат натрия) всегда в пипетке или бюретке. Избыток KI, т.к. I 2 плохо растворяется в воде и хорошо в KI, и для ускорения реакции. Реакция выделения I 2 идет медленно, а на свету I 2 разлагается, поэтому колбу с реакционной смесью ставят в темное место на 2-3 мин. Реакции проводят на холоду, т.к. при нагревании I 2 улетучивается. Индикатор – крахмал, добавляют в конце титрования, когда цвет анализируемого раствора светло желтый. Титровать медленно, энергично перемешивая (особенно после добавления крахмала). Титровать сначала без индикатора от бурой окраски раствора до светло желтой, затем добавить крахмал и далее титровать от темно синих крупинок крахмала до их обесцвечивания. Объем избыточной капли нужно вычесть? Почему?