Первый слайд презентации: Виды химической связи. Типы кристаллических решеток
Слайд 2
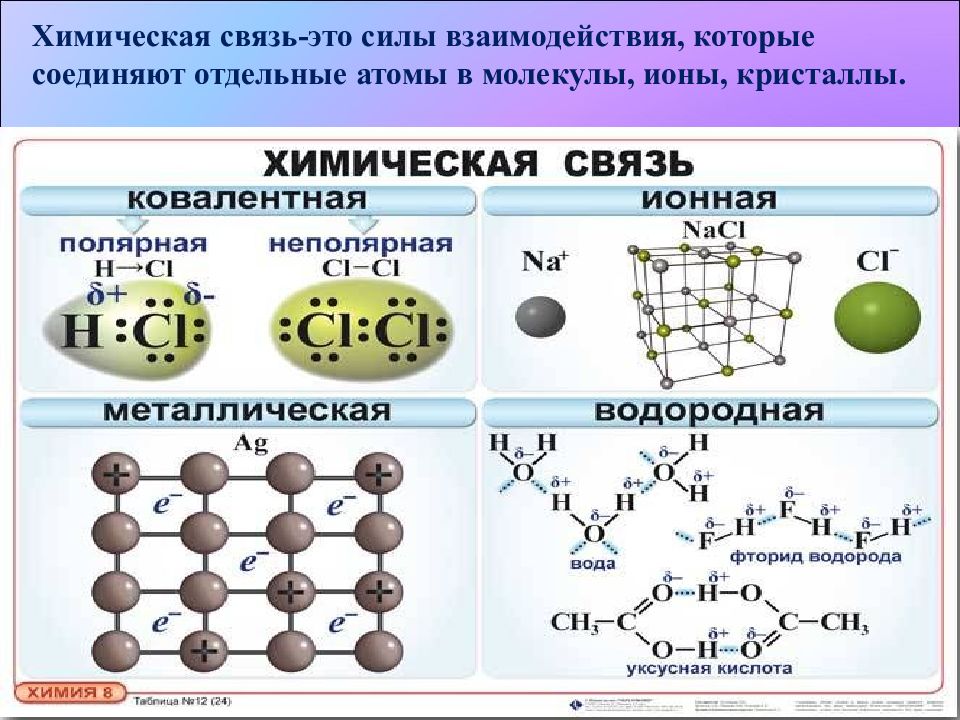
Химическая связь-это силы взаимодействия, которые соединяют отдельные атомы в молекулы, ионы, кристаллы.
Слайд 3
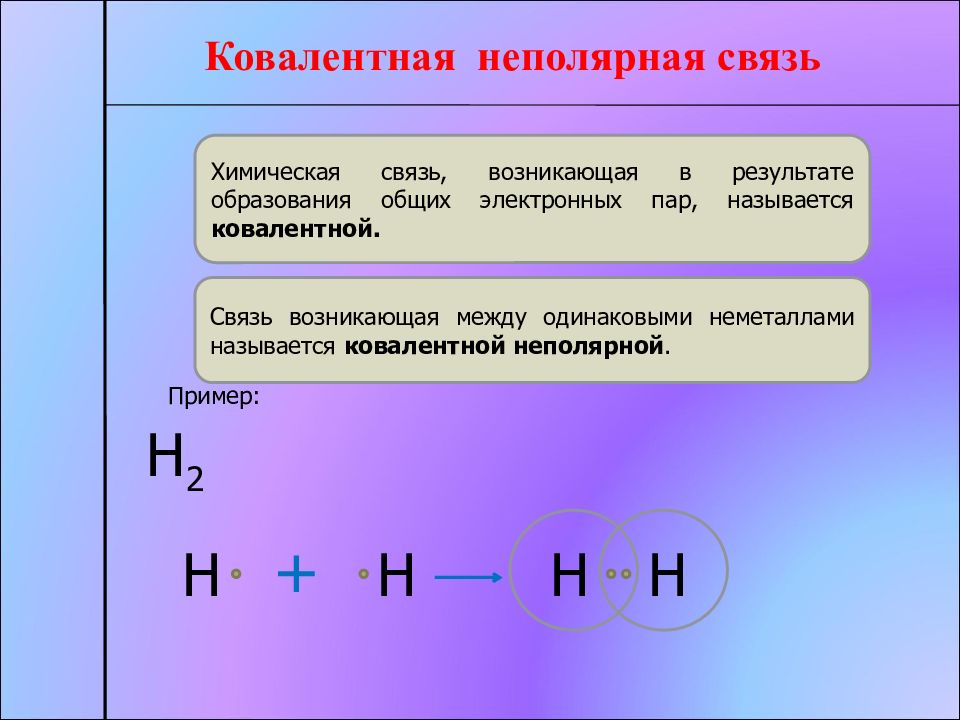
Ковалентная неполярная связь Химическая связь, возникающая в результате образования общих электронных пар, называется ковалентной. Связь возникающая между одинаковыми неметаллами называется ковалентной неполярной. Пример: Н 2 Н Н + Н Н
Слайд 4
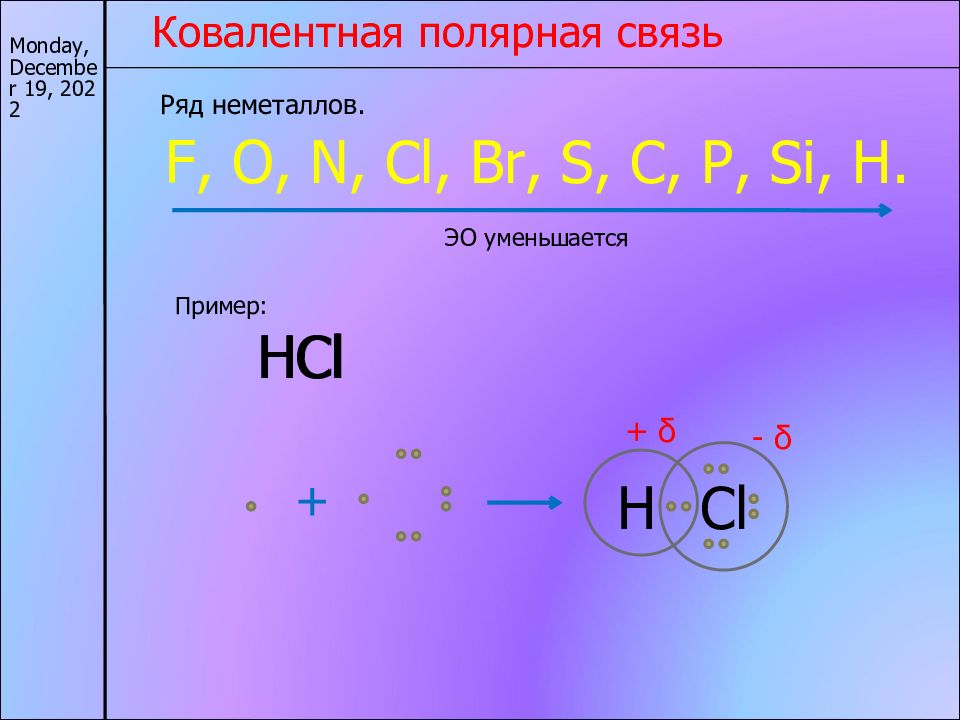
17/11/22 Ковалентная полярная связь Ряд неметаллов. F, O, N, Cl, Br, S, C, P, Si, H. ЭО уменьшается Пример: Н Cl Н Cl + Н Cl - δ + δ
Слайд 5
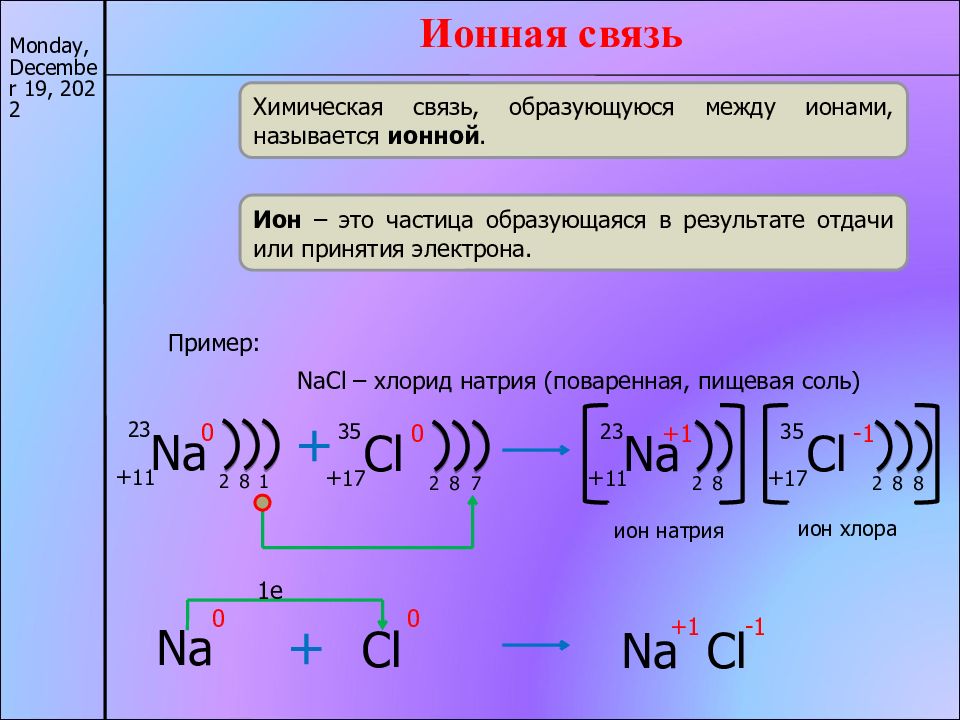
17/11/22 Ионная связь Химическая связь, образующуюся между ионами, называется ионной. Ион – это частица образующаяся в результате отдачи или принятия электрона. Пример: NaCl – хлорид натрия (поваренная, пищевая соль) Na + 11 23 0 2 8 1 + Cl + 17 35 0 2 8 7 Na 0 Cl 0 + Na +1 Cl -1 1e Na + 11 23 +1 2 8 ион натрия + 17 Cl 35 -1 2 8 8 ион хлора
Слайд 6
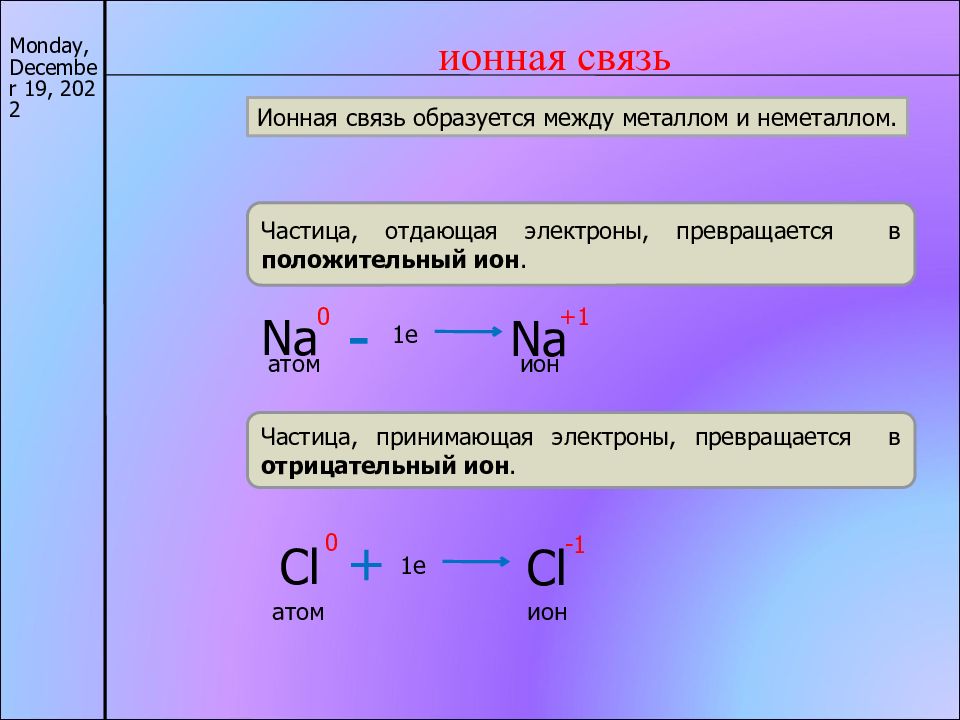
17/11/22 ионная связь Частица, отдающая электроны, превращается в положительный ион. Na +1 1e Na 0 - атом ион Частица, принимающая электроны, превращается в отрицательный ион. Cl 0 + Cl -1 1e атом ион Ионная связь образуется между металлом и неметаллом.
Слайд 7
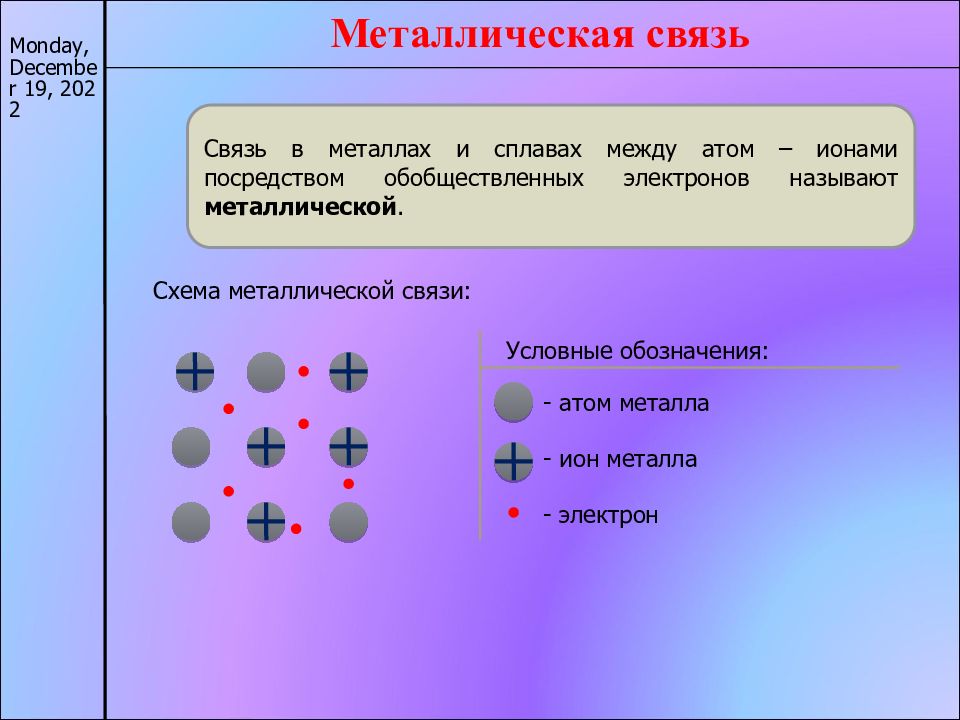
17/11/22 Металлическая связь Связь в металлах и сплавах между атом – ионами посредством обобществленных электронов называют металлической. Схема металлической связи: Условные обозначения: - атом металла - ион металла - электрон
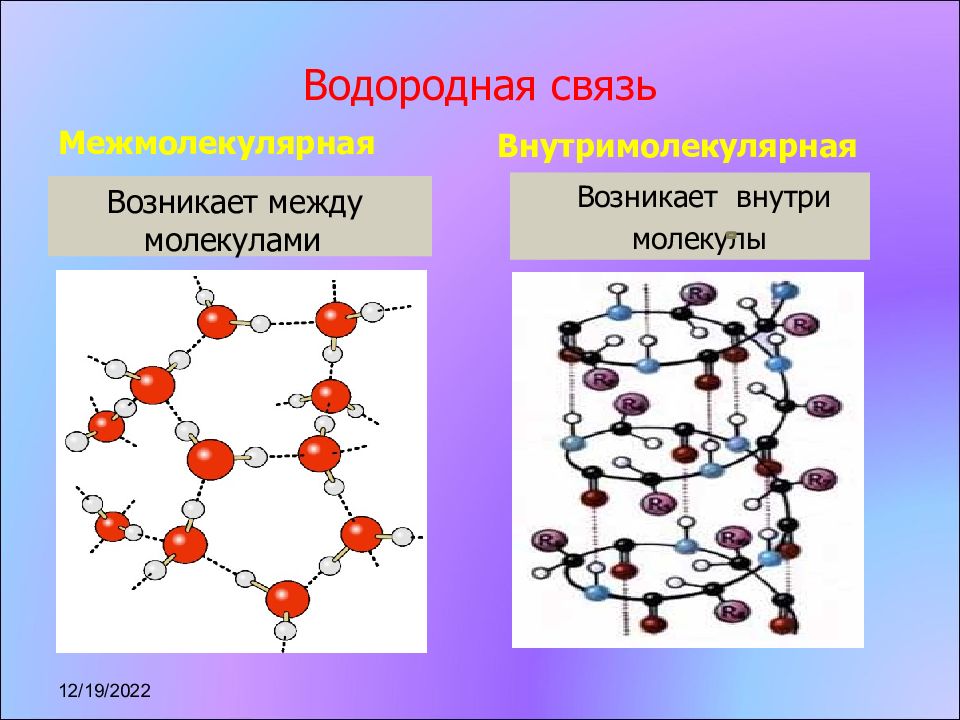
Слайд 8: Водородная связь
Межмолекулярная Возникает между молекулами Внутримолекулярная Возникает внутри молекулы 17.11.2022
Слайд 9: Сравнение различных видов связи
Сходство : любой вид связи образуется за счет перехода электронов Различие : способ образования ( передача электронов, образование общих электронных пар, переход электронов в свободное пространство ) 17.11.2022
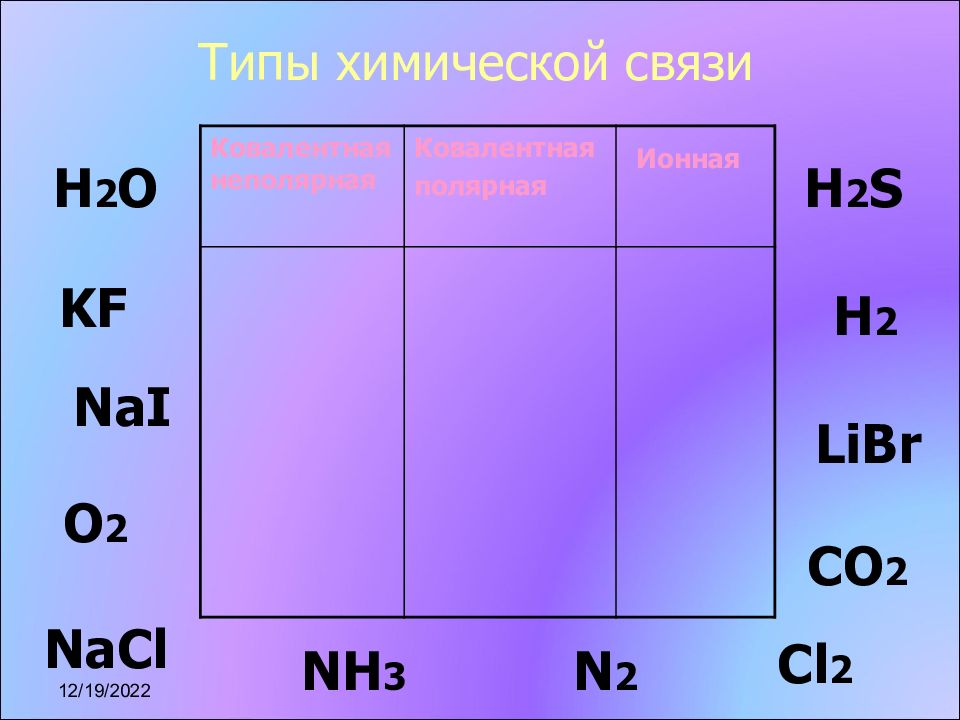
Слайд 10: Типы химической связи
Ковалентная неполярная Ковалентная полярная Ионная KF H 2 H 2 O Н 2 S О 2 NH 3 N 2 LiBr NaCl CO 2 Cl 2 NaI 17.11.2022
Слайд 11: Третий лишний»
Na Mg H 2 O 2 CaO AlJ 3 H 2 S HF Н 2 HCl CS 2 H 2 17.11.2022
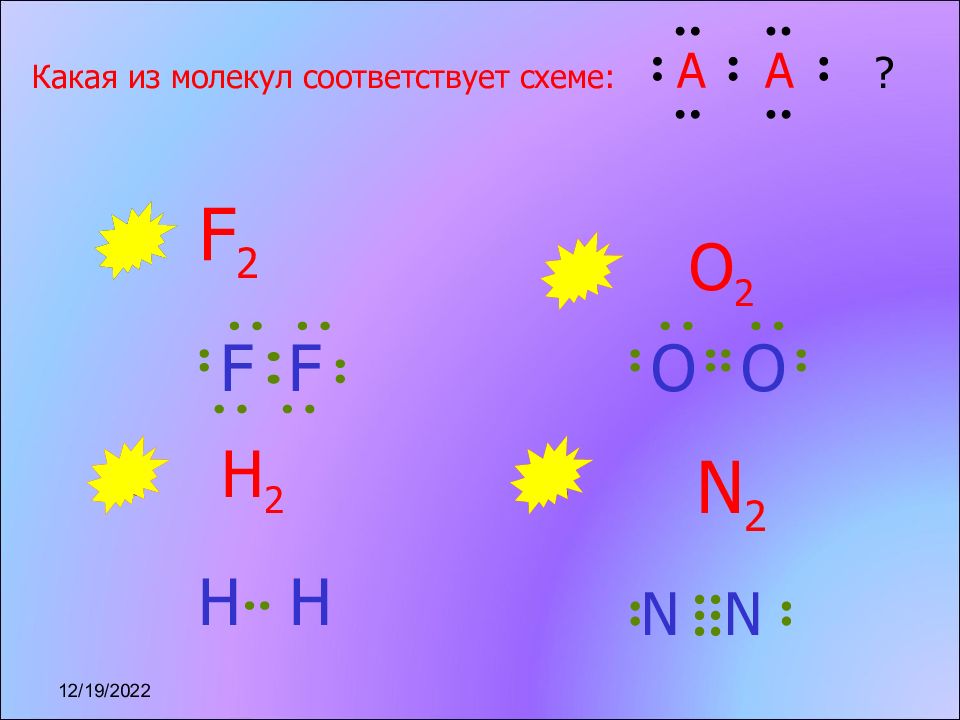
Слайд 12
Какая из молекул соответствует схеме: A A ? N 2 O 2 H 2 F 2 O O N N H H F F 17.11.2022
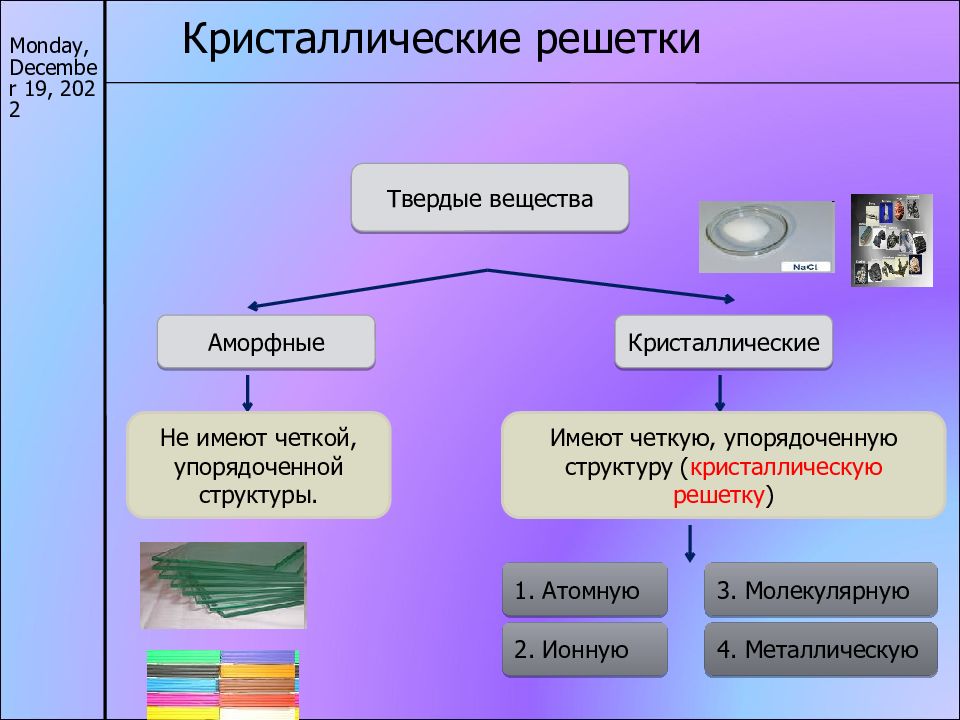
Слайд 13
17/11/22 Кристаллические решетки Твердые вещества Аморфные Кристаллические Не имеют четкой, упорядоченной структуры. Имеют четкую, упорядоченную структуру ( кристаллическую решетку ) 1. Атомную 2. Ионную 3. Молекулярную 4. Металлическую
Слайд 15
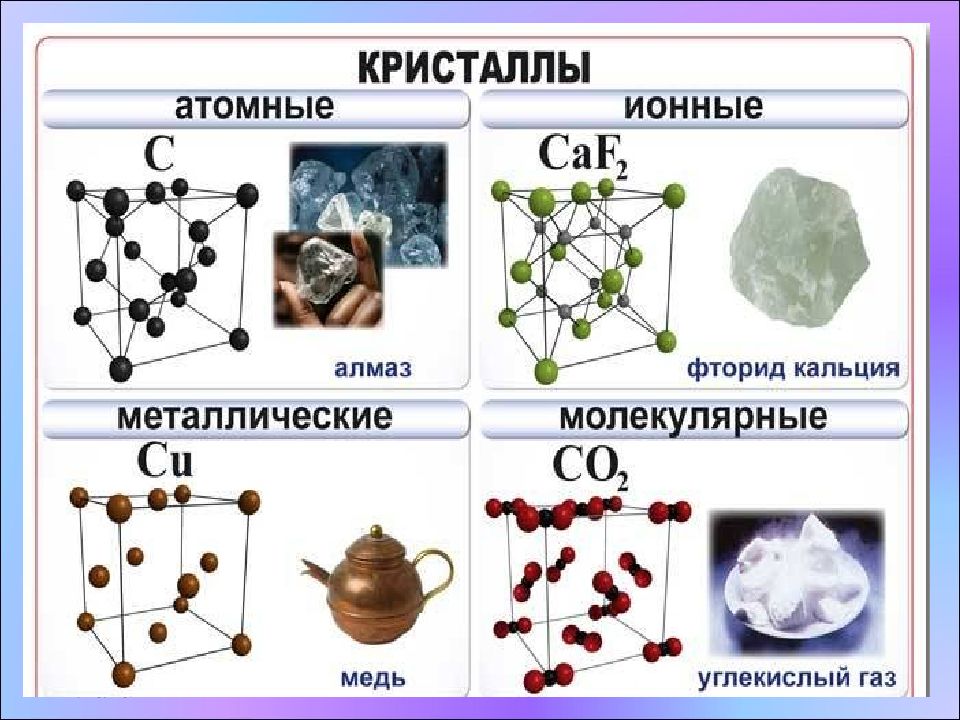
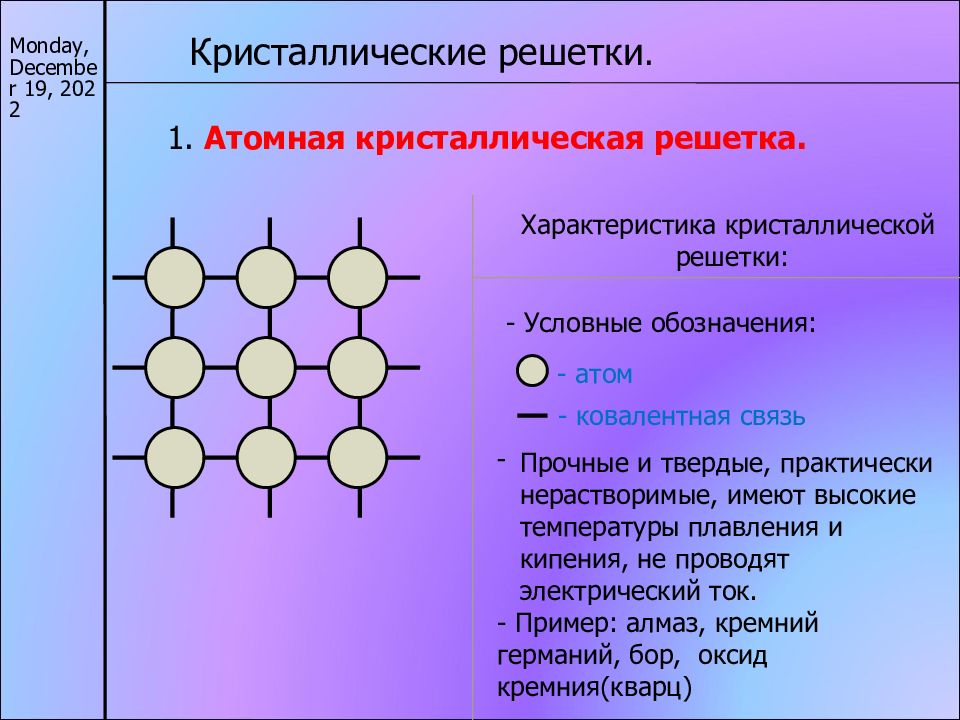
17/11/22 Кристаллические решетки. 1. Атомная кристаллическая решетка. Характеристика кристаллической решетки: - атом - ковалентная связь Прочные и твердые, практически нерастворимые, имеют высокие температуры плавления и кипения, не проводят электрический ток. - Пример: алмаз, кремний германий, бор, оксид кремния(кварц) - Условные обозначения:
Слайд 16
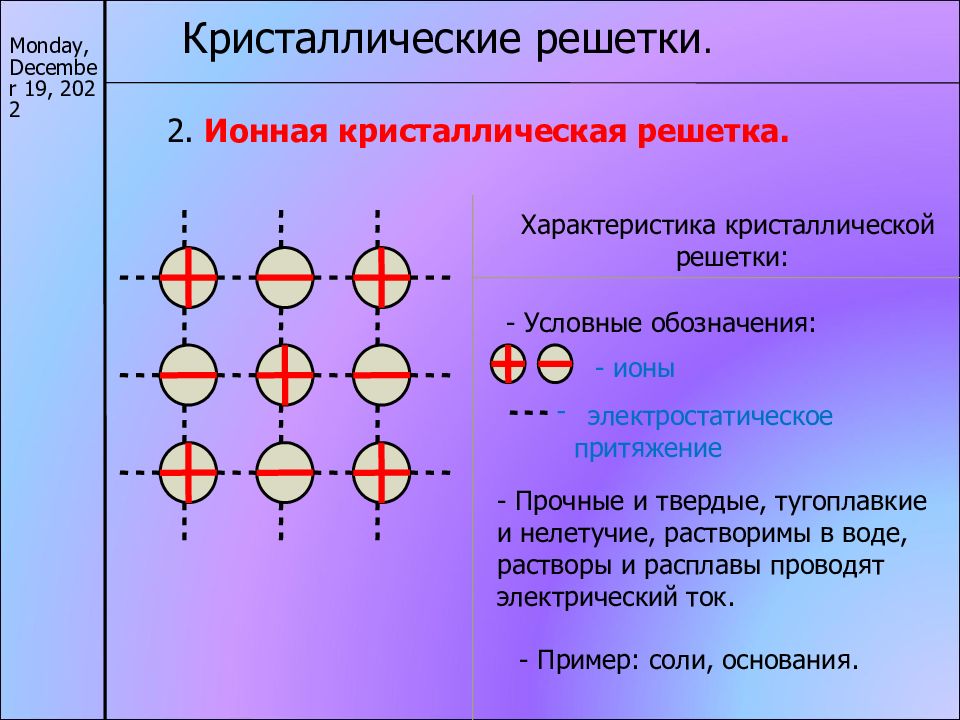
17/11/22 Кристаллические решетки. 2. Ионная кристаллическая решетка. Характеристика кристаллической решетки: - ионы электростатическое притяжение - Прочные и твердые, тугоплавкие и нелетучие, растворимы в воде, растворы и расплавы проводят электрический ток. - Пример: соли, основания. - Условные обозначения:
Слайд 17
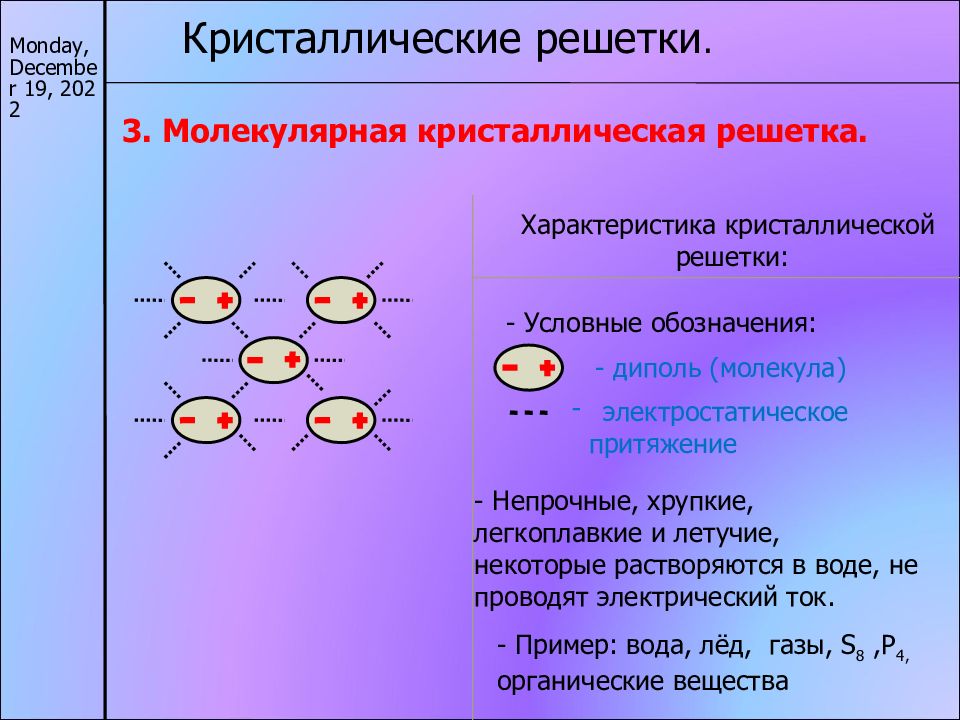
17/11/22 Кристаллические решетки. 3. Молекулярная кристаллическая решетка. Характеристика кристаллической решетки: - диполь (молекула) электростатическое притяжение - Непрочные, хрупкие, легкоплавкие и летучие, некоторые растворяются в воде, не проводят электрический ток. - Пример: вода, лёд, газы, S 8,P 4, органические вещества - Условные обозначения:
Слайд 18
17/11/22 Кристаллические решетки. 4. Металлическая кристаллическая решетка. Характеристика кристаллической решетки: - ион металла электрон - Ковкие, пластичные, электро- и теплопроводные, обладающие металлическим блеском. - Пример: все металлы. - Условные обозначения: - атом металла
Слайд 19: Вывод:
Строение атома ЭО Вид химической связи Тип кристаллической решетки Свойства веществ 17.11.2022
Последний слайд презентации: Виды химической связи. Типы кристаллических решеток: Установите соответствие
Между названием вещества и видом химической связи в нем Между названием вещества и типом кристаллической решётки в нем 17.11.2022 А) NO 1.Ковалентная неполярная Б) Na 2 S 2.Ковалентная полярная В) Ca 3.Металлическая Г) Cl 2 4.ионная А) CaCl 2 1.металлическая Б) Al 2.ионная В) NH 3 3.атомная Г) Si 4.молекулярная