Первый слайд презентации: Законы термодинамики
Слайд 2: Вопросы для повторения:
Что такое внутренняя энергия ? Назовите способы изменения внутренней энергии. Как определить работу газа? Как определить количество теплоты? Объясните физический смысл удельных величин.
Слайд 4: Способы изменения внутренней энергии
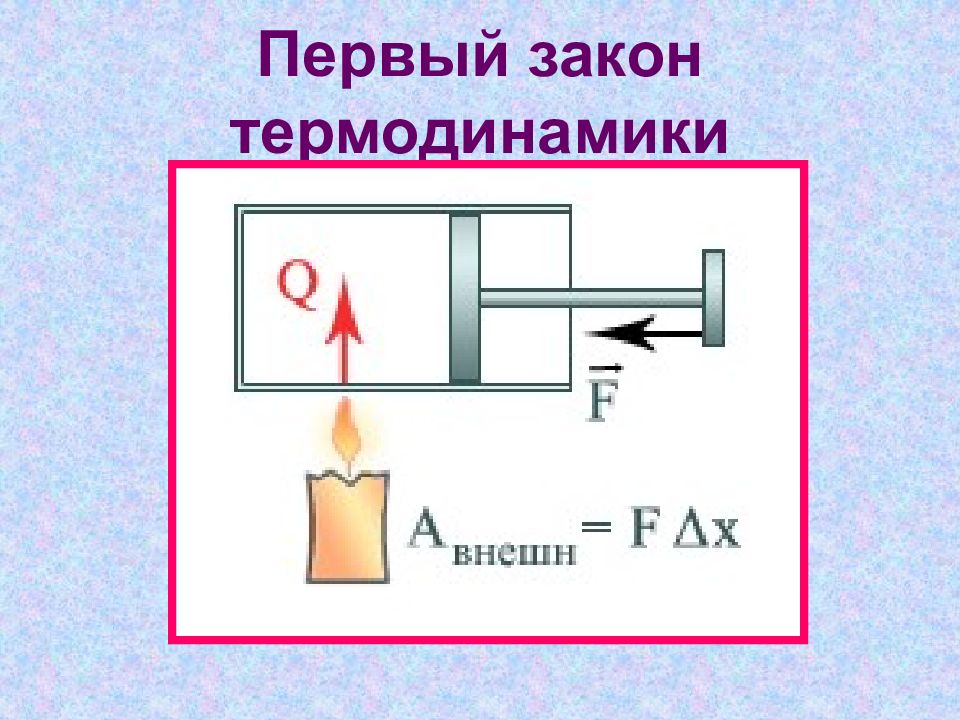
Слайд 5: Первый закон термодинамики
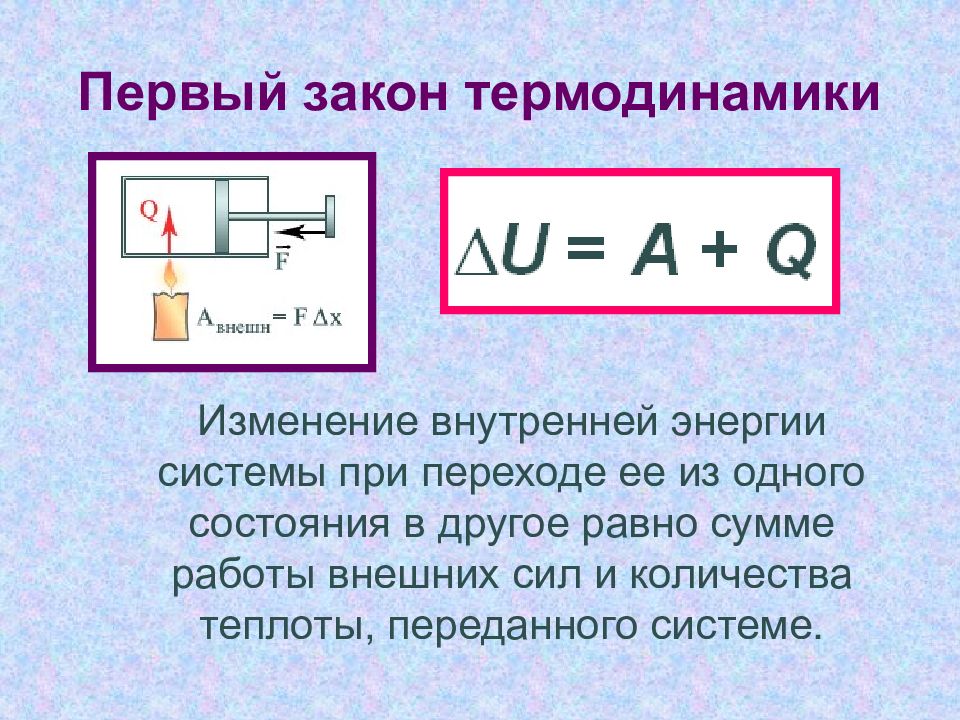
Слайд 6: Первый закон термодинамики
Изменение внутренней энергии системы при переходе ее из одного состояния в другое равно сумме работы внешних сил и количества теплоты, переданного системе.
Слайд 8: Первый закон термодинамики
Количество теплоты, переданное системе идет на совершение системой работы и изменение её внутренней энергии
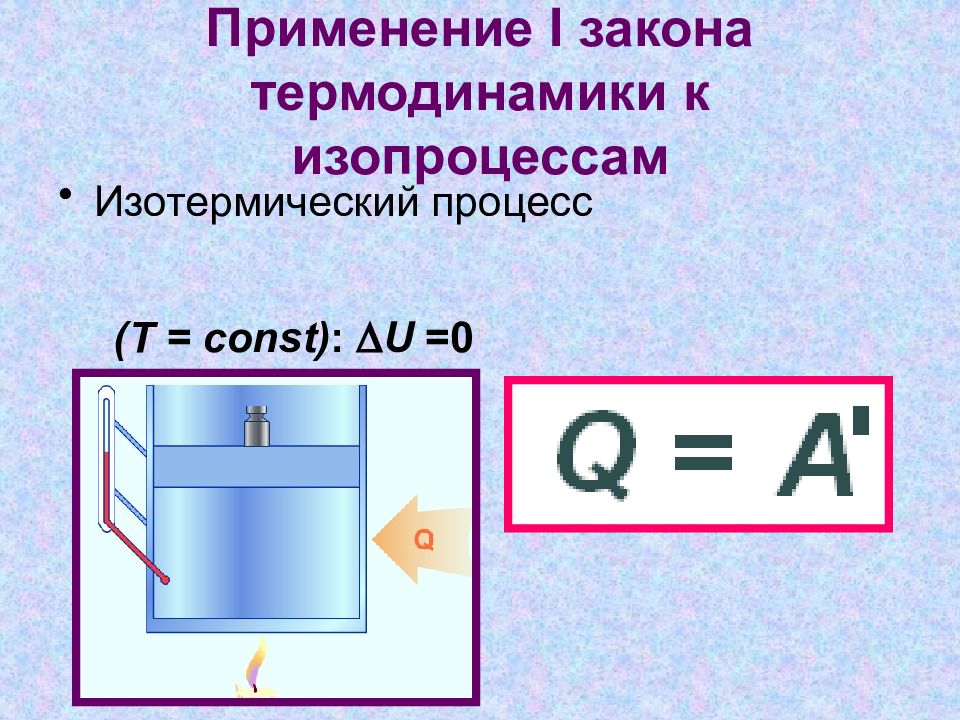
Слайд 9: Применение I закона термодинамики к изопроцессам
Изотермический процесс (T = const) : D U =0
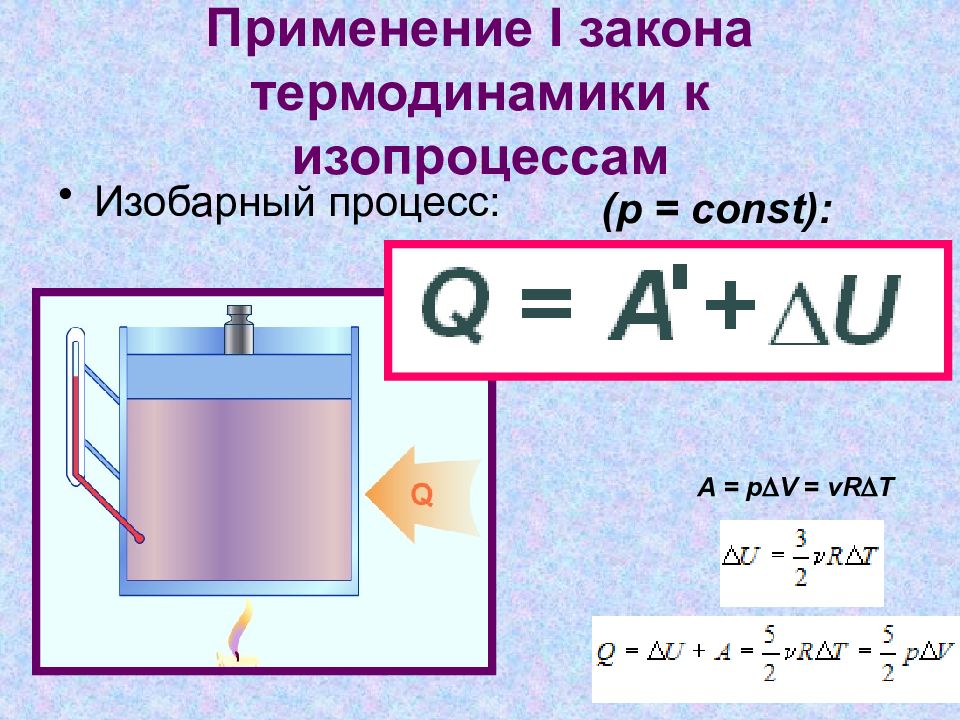
Слайд 10: Применение I закона термодинамики к изопроцессам
Изобарный процесс: A = p D V = vR D T (p = const):
Слайд 11: Применение I закона термодинамики к изопроцессам
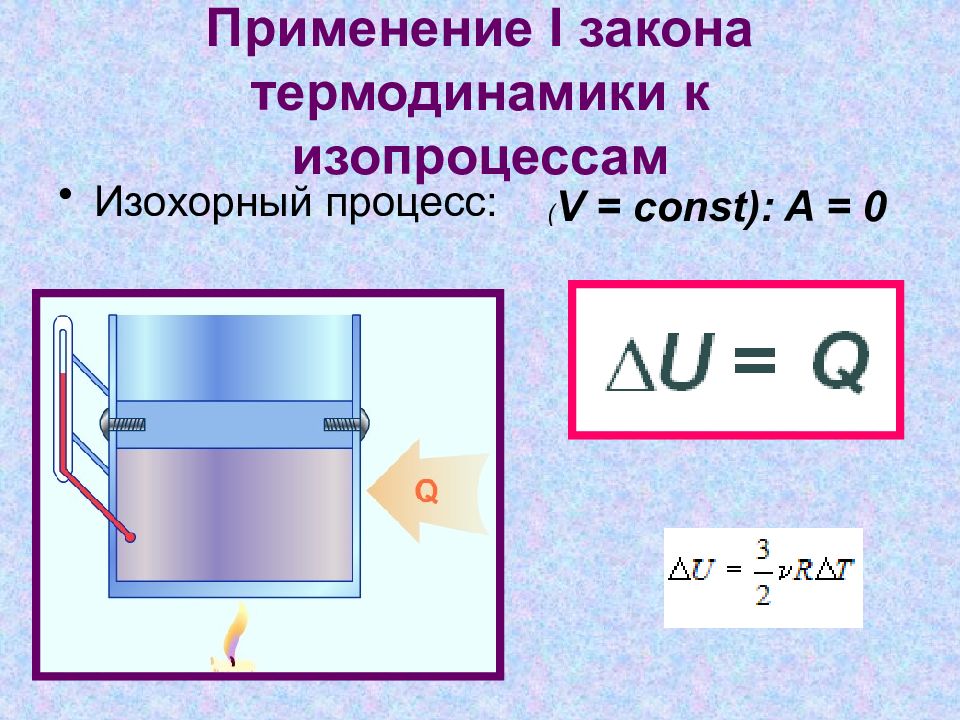
Изохорный процесс: ( V = const): A = 0
Слайд 12: Применение I закона термодинамики к изопроцессам
Адиабатный процесс : процесс, происходящий без теплообмена с окружающей средой. Q=0 Температура меняется только за счет совершения работы
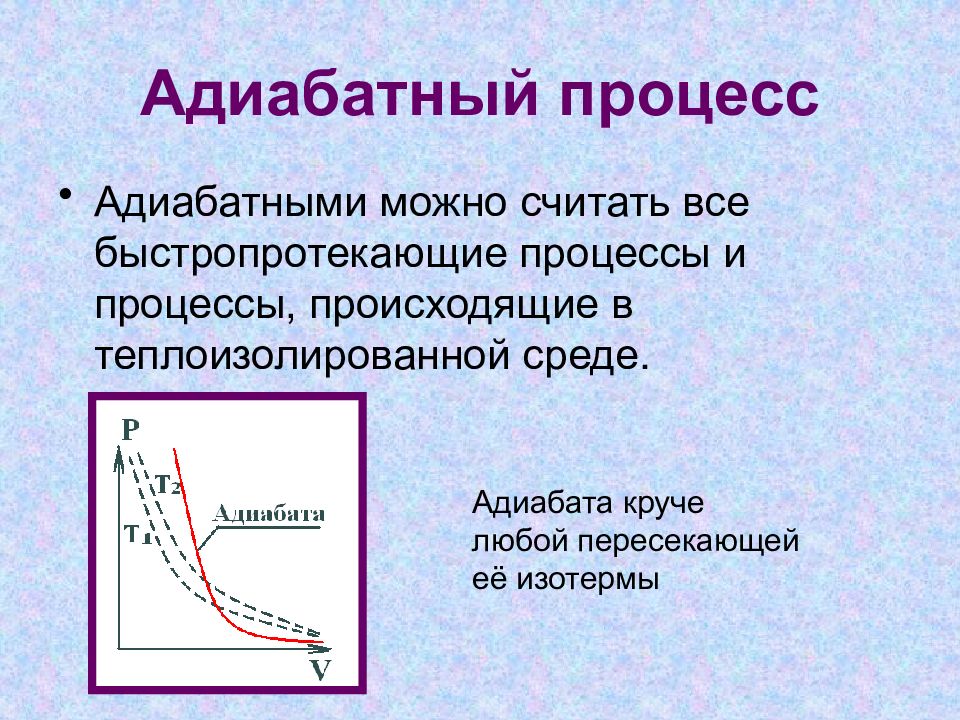
Слайд 13: Адиабатный процесс
Адиабатными можно считать все быстропротекающие процессы и процессы, происходящие в теплоизолированной среде. Адиабата круче любой пересекающей её изотермы
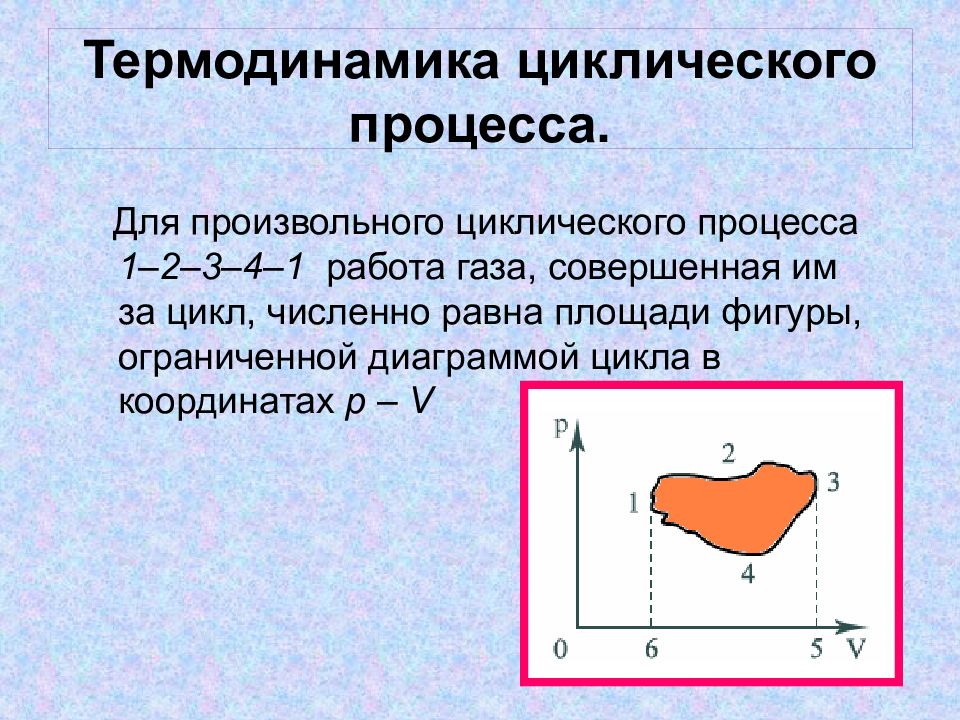
Слайд 14: Термодинамика циклического процесса
Для произвольного циклического процесса 1–2–3–4–1 работа газа, совершенная им за цикл, численно равна площади фигуры, ограниченной диаграммой цикла в координатах p – V
Слайд 15: Необратимость процессов в природе
Необратимые – процессы, которые могут самопроизвольно протекать только в одном направлении. В обратном направлении они могут протекать только как одно из звеньев более сложного процесса.
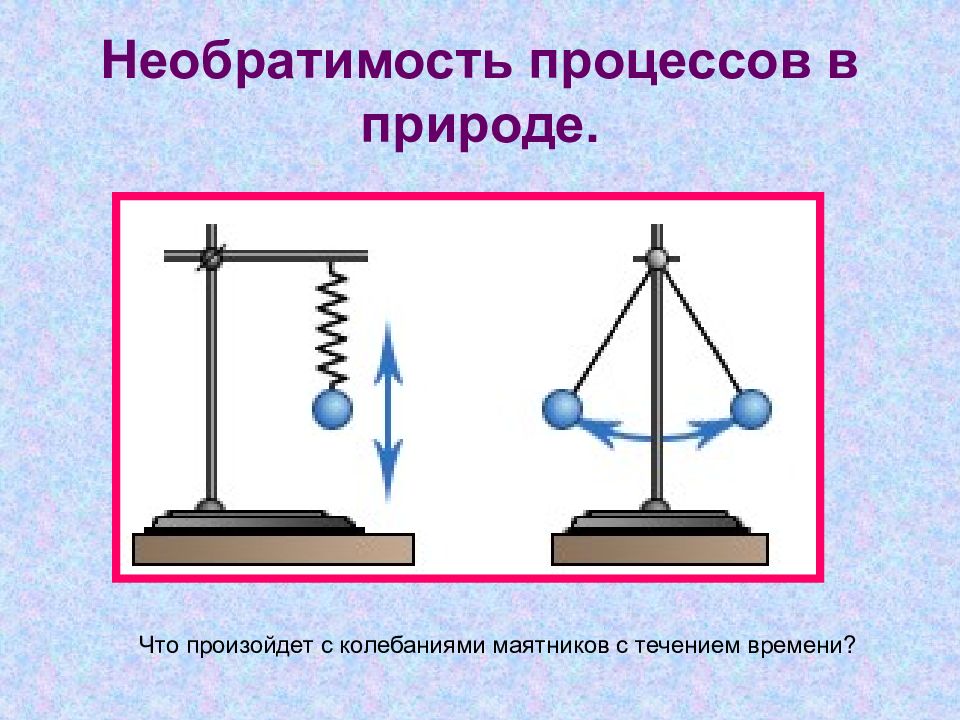
Слайд 16: Необратимость процессов в природе
Что произойдет с колебаниями маятников с течением времени?
Слайд 20: II закон термодинамики
Формулировка Клаузиуса (1850): невозможен процесс, при котором тепло самопроизвольно переходило бы от тел менее нагретых к телам более нагретым. Формулировка Томсона (1851): невозможен круговой процесс, единственным результатом которого было бы производство работы за счет уменьшения внутренней энергии. Формулировка Клаузиуса (1865): все самопроизвольные процессы в замкнутой неравновесной системе происходят в таком направлении, при котором энтропия системы возрастает; в состоянии теплового равновесия она максимальна и постоянна. Формулировка Больцмана (1877): замкнутая система многих частиц самопроизвольно переходит из более упорядоченного состояния в менее упорядоченное. Невозможен самопроизвольный выход системы из положения равновесия. Больцман ввел количественную меру беспорядка в системе, состоящей из многих тел – энтропию.