Первый слайд презентации: Амины, анилин: строение, свойства получение, применение
Преподаватель химии и биологии ГБОУ НПО РО ПУ № 61 имени Героя Советского Союза Вернигоренко И.Г. Г. Новошахтинск Ростовской области
Слайд 2: Цели урока
Рассмотреть строение, изомерию, свойства, получение, применение аминов и анилина. Развить навыки определения видов изомерии, номенклатурных названий, написания уравнений реакций химических свойств аминов и анилина.
Слайд 3: Строение
Амины - органические произведения аммиака, в молекуле которого один, два или все три атома водорода замещены углеводородным остатком.
Слайд 4: Классификация аминов
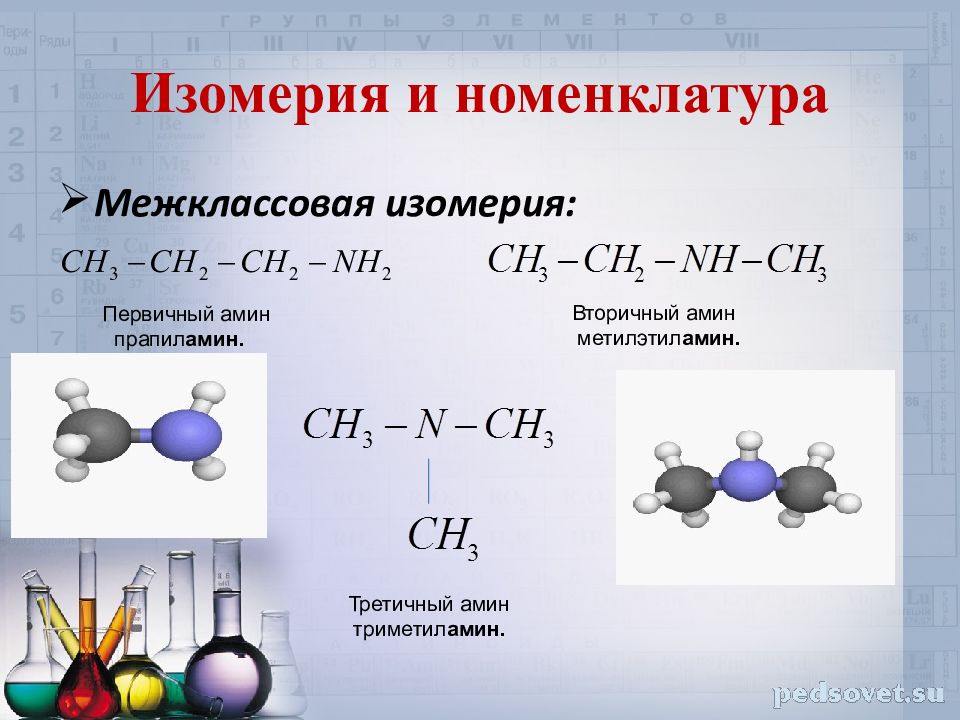
Слайд 5: Изомерия и номенклатура
Изомерия углеродного скелета: бутил амин изобутил амин
Слайд 6: Изомерия и номенклатура
Изомерия положения функциональной группы: пропил амин изопропил амин
Слайд 7: Изомерия и номенклатура
Межклассовая изомерия : Первичный амин прапил амин. Вторичный амин метилэтил амин. Третичный амин триметил амин.
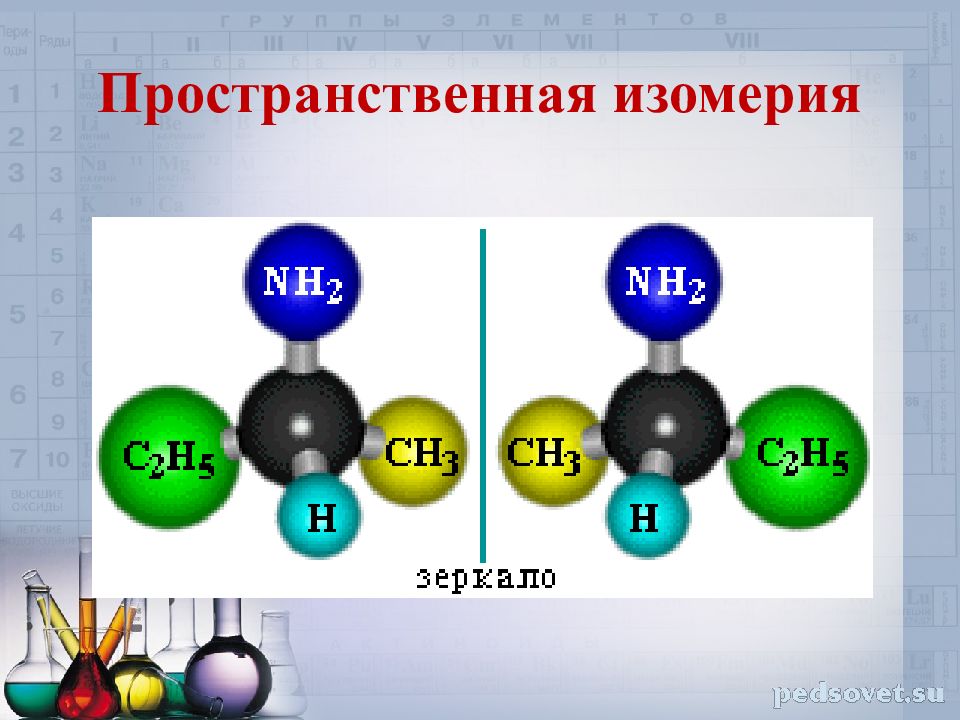
Слайд 8: Пространственная изомерия
Слайд 9: Получение
Получение аминов из галогенопроизводных В результате этой реакции образуется соль амина ( гидробромид этиламмония), из которой действием щёлочи можно выделить первичный амин ( этиламин):
Слайд 10
При взаимодействии полученного первичного амина и галогенопроизводного и последующей обработке щелочью получают вторичный амин ( диэтиламин ):
Слайд 12
Третичный амин может ещё раз вступить в реакцию с бромэтаном. При этом образуется четвертичная аммонийная соль, образованная бромид-ионом и катионом тетраэтиламмония :
Слайд 13: Физические свойства
Простейшие амины ( метиламин, диметиламин, триметиламин ) – газообразные вещества. Остальные низшие амины – жидкости, которые хорошо растворяются в воде. Имеют характерный запах, напоминающий запах аммиака. Первичные и вторичные амины способны образовывать водородные связи. Это приводит к повышению их температуры. Анилин – маслянистая жидкость, ограниченно растворимая в воде, кипящая при температуре 184
Слайд 14: Химические свойства
1. Амины как основания. Атом азота аминогруппы за счет неподеленной пары электронов может образовывать ковалентную связь по донорно – акцепторному механизму, вступая в роли донора. В связи с этим амины способны присоединять катион водорода. ИОН АММОНИЯ ИОН ЭТИЛАММОНИЯ
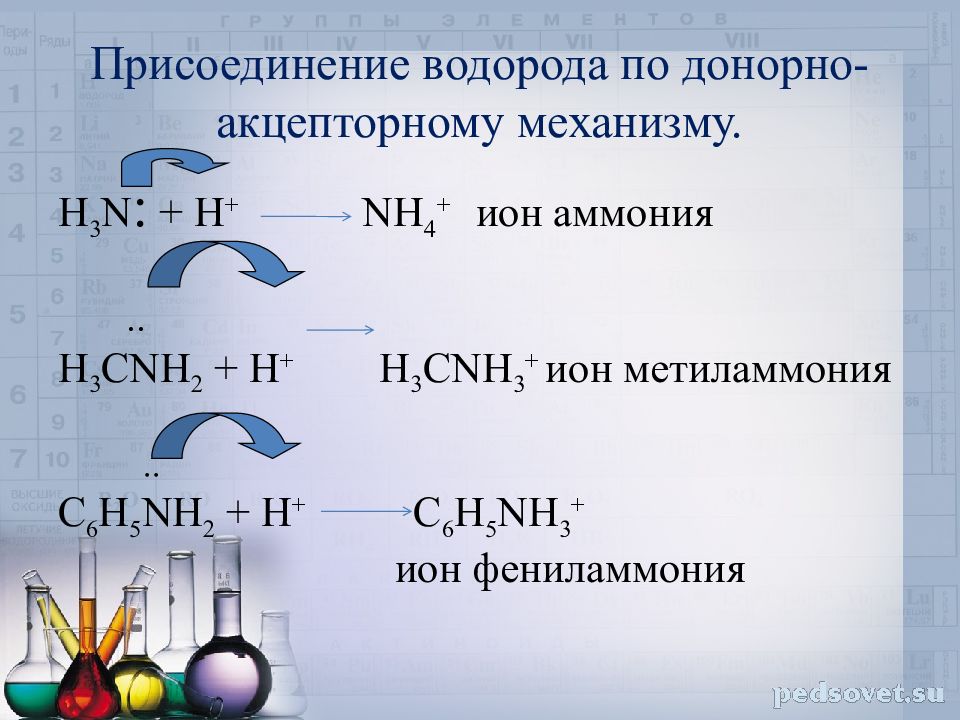
Слайд 15: Присоединение водорода по донорно-акцепторному механизму
H 3 N : + H + NH 4 + ион аммония .. H 3 CNH 2 + H + H 3 CNH 3 + ион метиламмония .. C 6 H 5 NH 2 + H + C 6 H 5 NH 3 + ион фениламмония
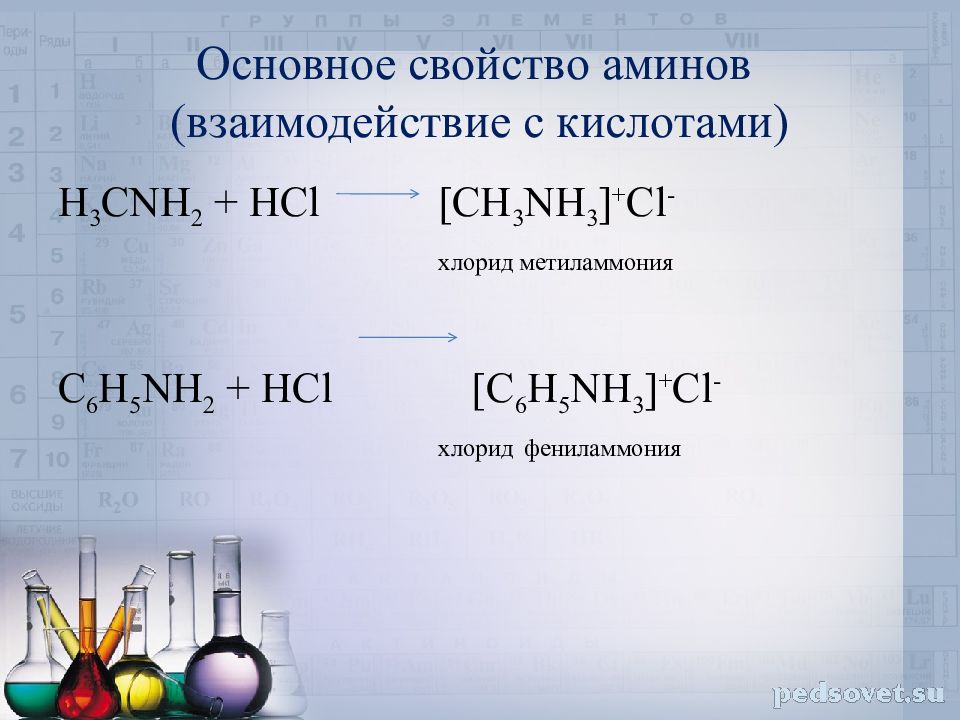
Слайд 16: Основное свойство аминов (взаимодействие с кислотами)
H 3 CNH 2 + HCl [CH 3 NH 3 ] + Cl - хлорид метиламмония C 6 H 5 NH 2 + HCl [C 6 H 5 NH 3 ] + Cl - хлорид фениламмония
Слайд 17: Ослабление основных свойств
CH 3 NH 2 NH 3 C 6 H 5 NH 2 Причина – влияние радикала
Слайд 19: Амины вступают в реакцию нуклеофильного замещения
Выступая в роли нуклеофилов:
Слайд 20: Амины взаимодействую с производными карбоновых кислот,( сложными эфирами, хлорагидридами, ангидридами )
Образуя Амиды – важнейший класс органических соединений: Амид – является продуктом замещения гидроксильной группы на остаток амина.
Слайд 21: Применение аминов
Амины широко применяются для получения лекарств, полимерных материалов. Анилин – важнейшее соединение данного класса, которое используется для производства анилиновых красителей, лекарств (сульфаниламидных препаратов), полимерных материалов (анилиноформальдегидных смол).
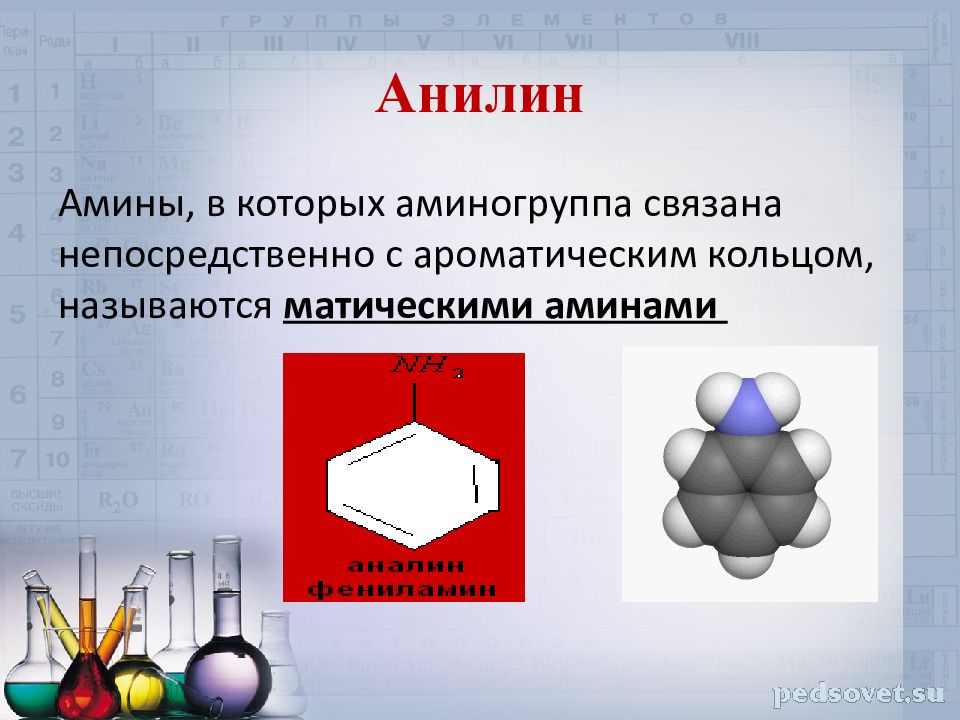
Слайд 23: Анилин
Амины, в которых аминогруппа связана непосредственно с ароматическим кольцом, называются матическими аминами
Слайд 24: Получение анилина
Реакция Зинина C 6 H 5 NO 2 + 6H C 6 H 5 NH 2 + 2H 2 O
Слайд 25: Физические свойства
Анилин представляет собой бесцветную маслянистую жидкость с характерным запахом (т. кип. 184 °С, т. пл. – 6 °С). На воздухе быстро окисляется и приобретает красно-бурую окраску. Ядовит.
Слайд 26: Свойства анилина
1. Анилин - гораздо более слабое основание, чем алифатические амины (K b = 5,2. 10 -10 ). Это объясняется тем, что электронная пара атома азота, которая обусловливает основные свойства аминов, частично смещается в бензольное кольцо. Анилин реагирует с сильными кислотами, образуя соли фениламмония C 6 H 5 NH 3 +, которые хорошо растворимы в воде, но нерастворимы в неполярных органических растворителях: С 6 Н 5 NН 2 + HCl → С 6 Н 5 NН 3 Сl.
Слайд 27
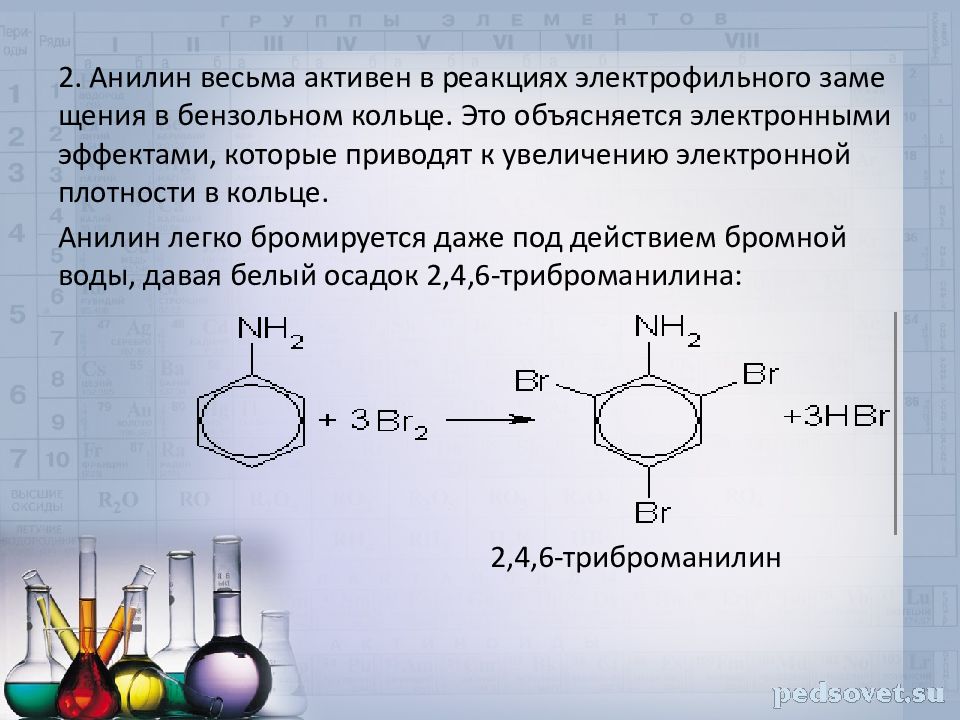
2. Анилин весьма активен в реакциях электрофильного замещения в бензольном кольце. Это объясняется электронными эффектами, которые приводят к увеличению электронной плотности в кольце. Анилин легко бромируется даже под действием бромной воды, давая белый осадок 2,4,6-триброманилина: 2,4,6-триброманилин
Слайд 28
3. При реакции анилина с азотистой кислотой образуются диазосоединения — соли диазония C 6 H 5 N 2 + : C 6 H 5 NH 2 + NaNO 2 + 2HCl → [C 6 H 5 -N≡N] + Cl - + NaCl + 2H 2 O. 4. Анилин легко окисляется различными окислителями с образованием ряда соединений, поэтому он темнеет при хранении. При действии хлорной извести Са ( Сl ) ОСl на водный раствор анилина появляется интенсивное фиолетовое окрашивание. Это — качественная реакция на анилин.
Слайд 29: Применение анилина
Анилин находит широкое применение в качестве полупродукта в производстве красителей, взрывчатых веществ и лекарственных средств (сульфаниламидные препараты).
Слайд 30: Закрепление знаний
I. С какими из перечисленных веществ реагируют амины предельного ряда: H 2 O ; 2. NaOH, 3. Cu(OH) 2, 4. HCl, 5.H 2 SO 4, 6.O 2 II. Какие виды изомерии у аминов? Углеродного скелета Положения заместителей Пол ож ения кратных связей
Слайд 31
III. Этил амин можно получить: Хлорэтана ; 2. Из пропена ; 3. Из бутина. IV. « Узнай своего » 1.NH 2 CH 3 2.CH 2 NH 2 COOH. 3.CH 3 NO 2 4.C 6 H 5 NH 5.CH 3 C 2 H 5 NH 2 6.CH 3 NHC 2 H 4. 7.C 3 H 6 NH 2 COOH 8.C 6 H 5 NH 2 9.C 3 H 6 NH 2 COOH. 10. NH 2 CH 10 COOH
Слайд 32
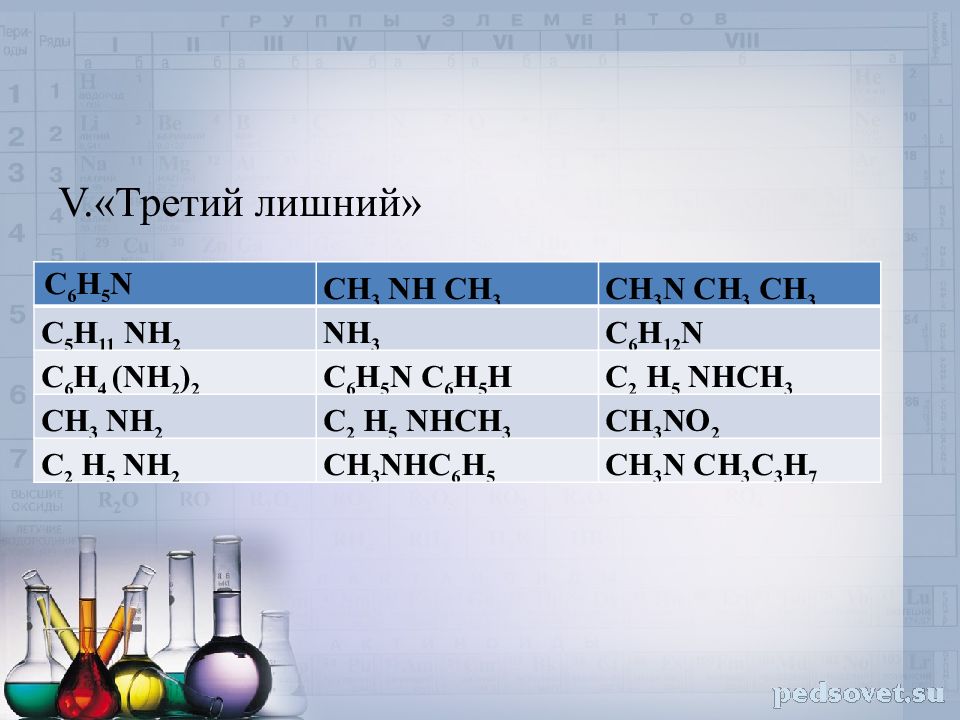
V.«Третий лишний» С 6 Н 5 N СН 3 N H СН 3 СН 3 N СН 3 СН 3 С 5 Н 11 N H 2 NH 3 С 6 Н 12 N С 6 Н 4 ( N H 2 ) 2 С 6 Н 5 N С 6 Н 5 H С 2 Н 5 N HCH 3 СН 3 N H 2 С 2 Н 5 N HCH 3 СН 3 N O 2 С 2 Н 5 N H 2 СН 3 N H С 6 Н 5 СН 3 N СН 3 C 3 H 7
Слайд 33: Взаимопроверка ответов
- 2,4 -1,2 -1 -1,4,5,6,8, V. 1-1, 2-2, 3-2, 4-3, 5-2
Слайд 34: Домашнее задание
О.С. Габриелян, И.Г. Остроумов учебник «Химия» для учреждений НПО и СПО для профессий технического цикла стр.171 – 175. Подготовить презентации по теме: «Применение аминокислот». Найти видео материалы по применению аминокислот.