Первый слайд презентации
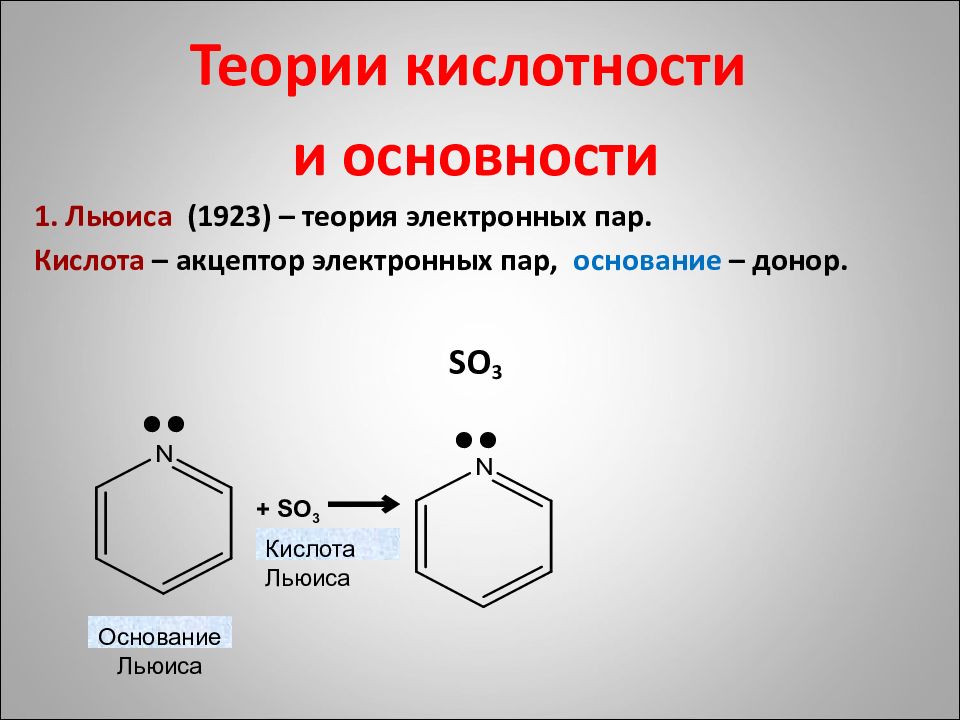
Теории кислотности и основности 1. Льюиса (1923) – теория электронных пар. Кислота – акцептор электронных пар, основание – донор. SO 3 + SO 3 Основание Льюиса Кислота Льюиса
Слайд 3
кислота основание Сопряженное основание Сопряженная кислота 2. Протолитическая теория Бренстеда-Лоури (1923 ) связывает кислотность и основность с участием протонов НА + В А + ВН
Слайд 4
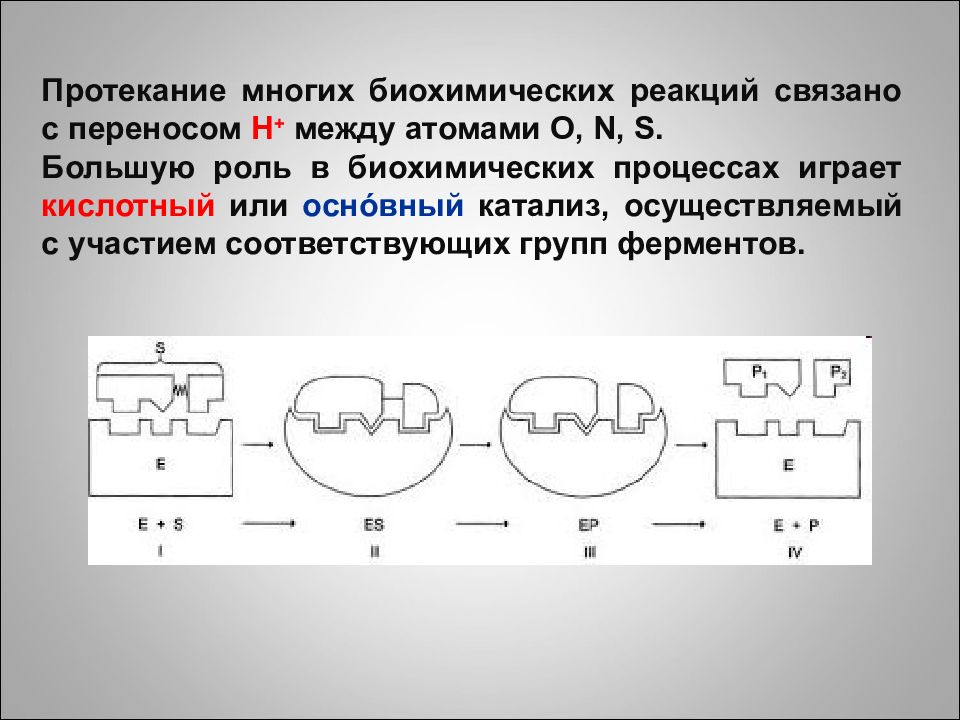
Протекание многих биохимических реакций связано с переносом H + между атомами O, N, S. Большую роль в биохимических процессах играет кислотный или осн ó вный катализ, осуществляемый с участием соответствующих групп ферментов.
Слайд 5
Кислоты Бренстеда Кислота Бренстеда – вещество, способное отдавать протоны, т.е. донор H +. В зависимости от природы элемента, с которым связан H, кислоты делятся на : C – H (углеводороды и их производные) N – H (амины, амиды, имины ) S – H (тиоспирты) O – H (спирты, фенолы, карбоновые кислоты) H и связанный с ним атом называют кислотным центром.
Слайд 6
Оценка кислотности Сила кислоты характеризуется K дисс (K a ), где a – acid ( кислота). HA H + + A - кислота сопряжённое основание Чем сильнее кислота, тем слабее сопряжённое основание, т.е. стабильнее анион Сравним: HCl H + + Cl - сильная кислота слабое сопряжённое основание ( стабильный анион, плохо присоединяет Н + ) CH 3 COOH H + + CH 3 COO - слабая кислота сильное сопряжённое основание (нестабильный анион, легко присоединяет Н + ) Качественно сила кислоты может быть оценена по стабильности аниона (сопряжённого основания), получающегося при диссоциации.
Слайд 7
Факторы, определяющие кислотность (стабильность аниона) 1. Влияние электроотрицательности (ЭО) атома в кислотном центре Чем больше ЭО, тем сильнее кислотные свойства,тем стабильнее анион. C 2 H 5 OH C 2 H 5 O - + H + ; pK a =15,8 этанол этоксид -ион ОН – кислота ( этилат ) C 2 H 5 NH 2 C 2 H 5 NH - + H + ; pK a =30 Этиламин pK a =- lg K a ЭО O > ЭО N, О прочнее удерживает электрон и менее доступен протону, т.е. C 2 H 5 O - стабильнее, чем C 2 H 5 NH -,следовательно, кислотные свойства C 2 H 5 OH более выражены, чем у C 2 H 5 NH 2.
Слайд 8: Влияние ЭО
СН 3 –СН 3 НС Ξ СН pK а =50-60 pK a =22 ЭО С( sp) > ЭО С (sp 3 ), поэтому С 2 Н 2 проявляет кислотные свойства, что подтверждается химическими реакциями: Ацетиленид меди ( I ) – качественная реакция на кислотный Н, связанный с С при тройной связи ( НС Ξ С-),
Слайд 9
2. Влияние радиуса атома C 2 H 5 OH C 2 H 5 O - + H + pK а =15,8 C 2 H 5 SH C 2 H 5 S - + H + pK а =10,5 Чем больше радиус атома, тем сильнее кислота и стабильнее анион. S 2- + H + + H + O 2-
Слайд 10
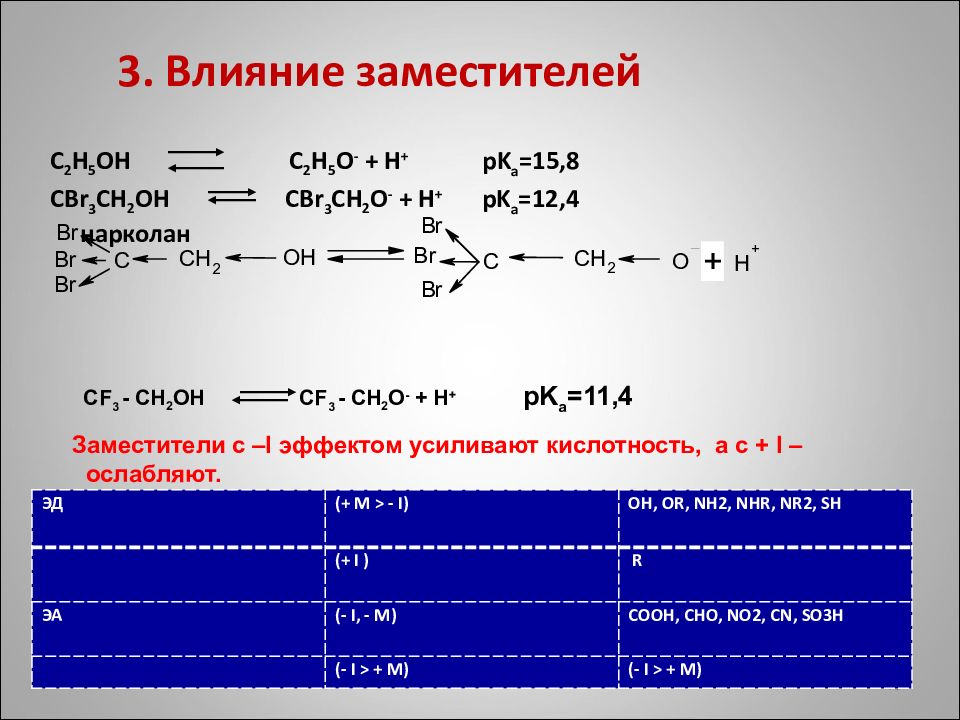
3. Влияние заместителей C 2 H 5 OH C 2 H 5 O - + H + pK а =15,8 CBr 3 CH 2 OH CBr 3 CH 2 O - + H + pK а =12,4 нарколан CF 3 - CH 2 OH CF 3 - CH 2 O - + H + pK а =11,4 Заместители с – I эффектом усиливают кислотность, а с + I –ослабляют. 10 ЭД (+ М > - I) OH, OR, NH2, NHR, NR2, SH (+ I ) R ЭА (- I, - M) COOH, CHO, NO2, CN, SO3 Н (- I > + M) (- I > + M)
Слайд 11
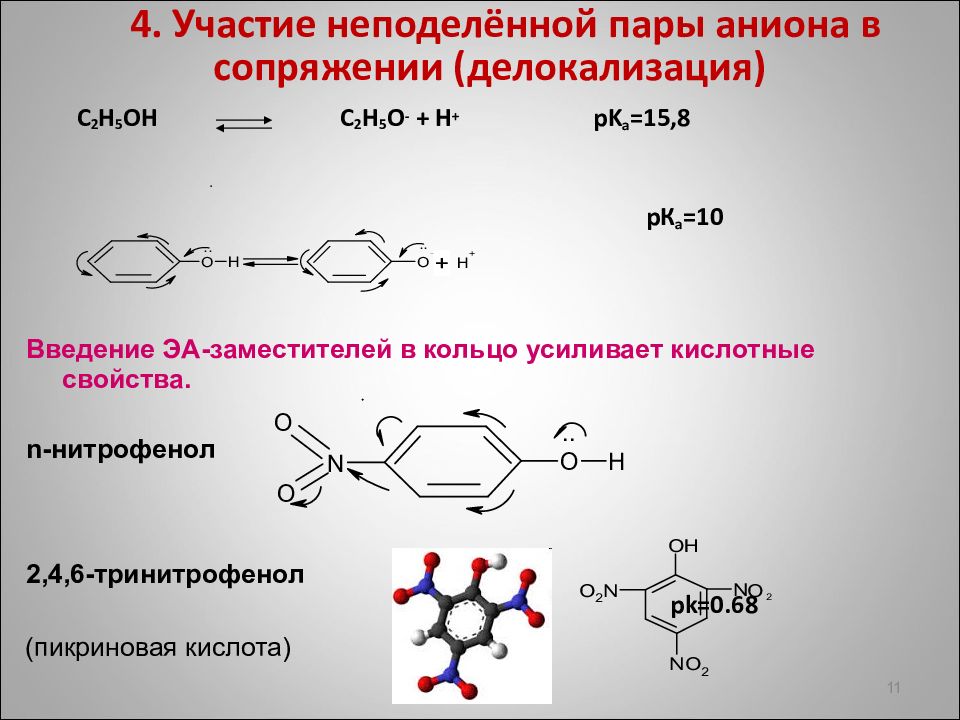
4. Участие неподелённой пары аниона в сопряжении ( делокализация ) C 2 H 5 OH C 2 H 5 O - + H + pK а =15,8 p К а =10 Введение ЭА-заместителей в кольцо усиливает кислотные свойства. n- нитрофенол 2,4,6-тринитрофенол pk =0.68 11 (пикриновая кислота)
Слайд 12
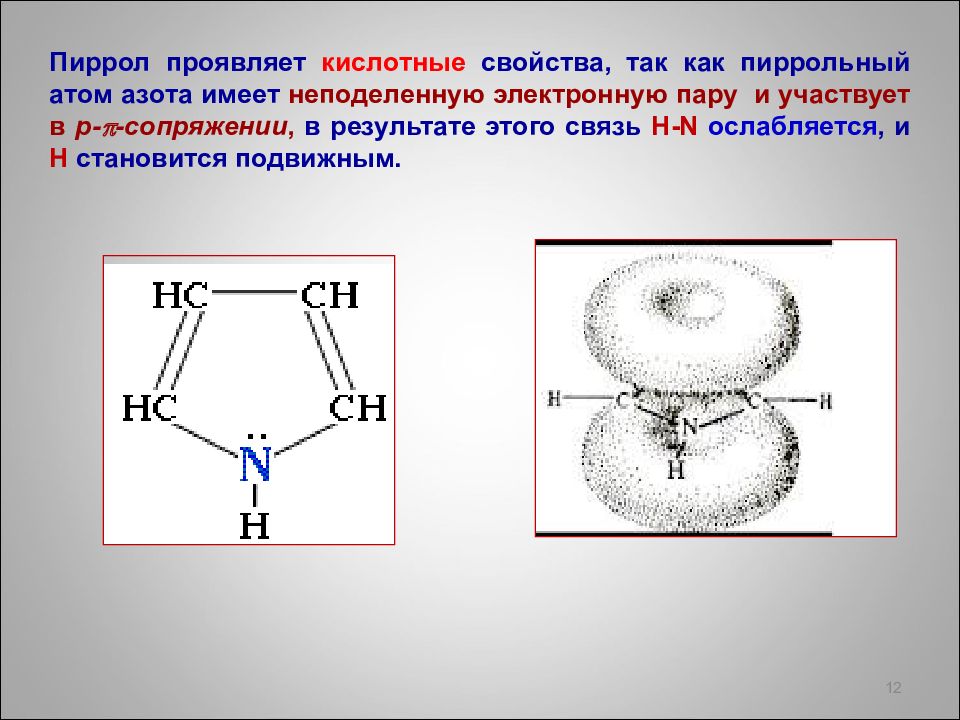
Пиррол проявляет кислотные свойства, так как пиррольный атом азота имеет неподеленную электронную пару и участвует в р- p -сопряжении, в результате этого связь Н- N ослабляется, и Н становится подвижным. 12
Слайд 13
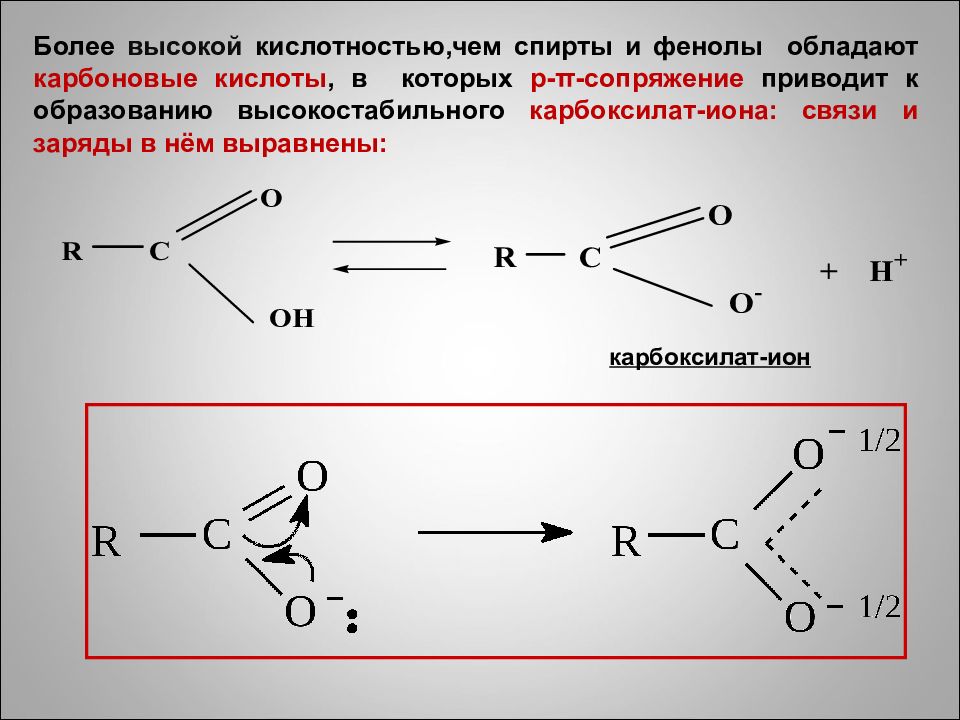
карбоксилат-ион Более высокой кислотностью,чем спирты и фенолы обладают карбоновые кислоты, в которых р- π -сопряжение приводит к образованию высокостабильного карбоксилат -иона: связи и заряды в нём выравнены:
Слайд 14
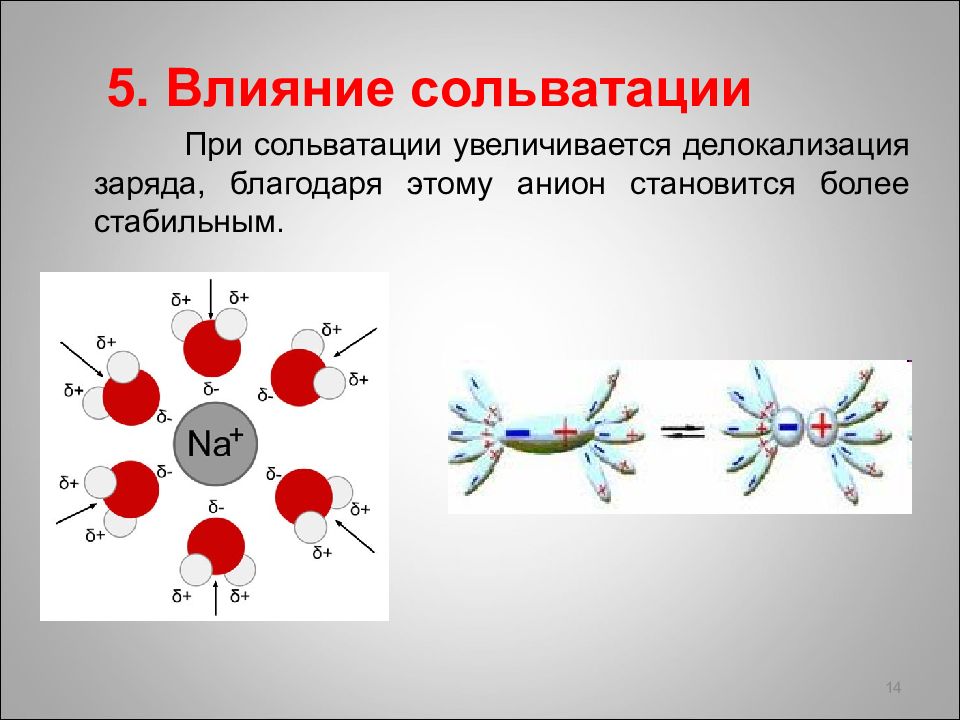
5. Влияние сольватации При сольватации увеличивается делокализация заряда, благодаря этому анион становится более стабильным. 14
Слайд 15
Кислотные свойства спиртов, фенолов, тиолов Спирт можно рассматривать как углеводород, в котором один или более атомов H замещены на OH - группы. Спирты классифицируются: по природе радикала (по характеру радикала): (предельные, непредельные – алифатические, алициклические, ароматические); по характеру атома C ( первичный, вторичный, третичный ), с которым связана OH -группа; по количеству OH (одно-, двух- и многоатомные ). 15
Слайд 16
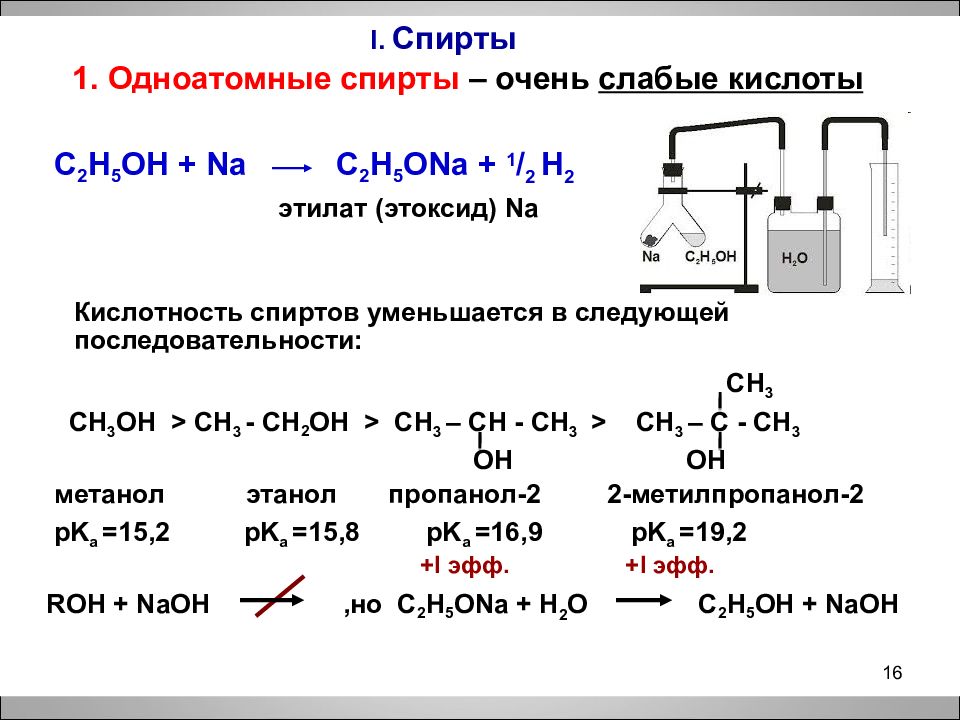
I. Спирты 1. Одноатомные спирты – очень слабые кислоты C 2 H 5 OH + Na C 2 H 5 ONa + 1 / 2 H 2 этилат (этоксид) Na Кислотность спиртов уменьшается в следующей последовательности: CH 3 CH 3 OH > CH 3 - CH 2 OH > CH 3 – CH - CH 3 > CH 3 – C - CH 3 OH OH метанол этанол пропанол-2 2-метилпропанол-2 pK а =15,2 pK а =15,8 pK а =16,9 pK а =19,2 ROH + NaOH,но C 2 H 5 ONa + H 2 O C 2 H 5 OH + NaOH 16 + I эфф. + I эфф.
Слайд 17
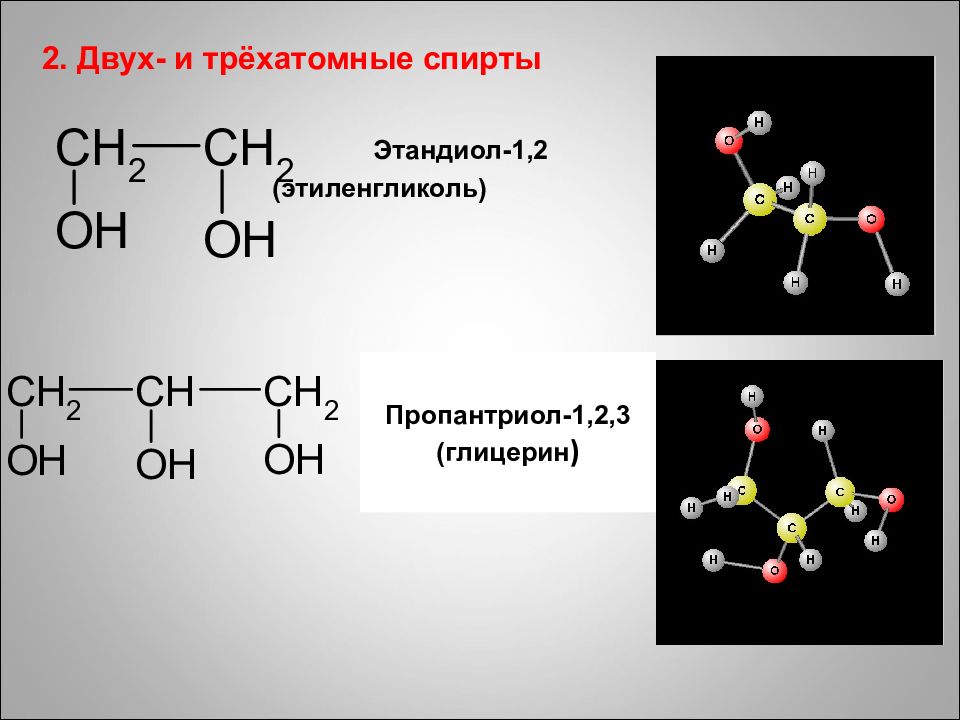
2. Двух- и трёхатомные спирты Этандиол-1,2 (этиленгликоль) Пропантриол-1,2,3 (глицерин )
Слайд 18
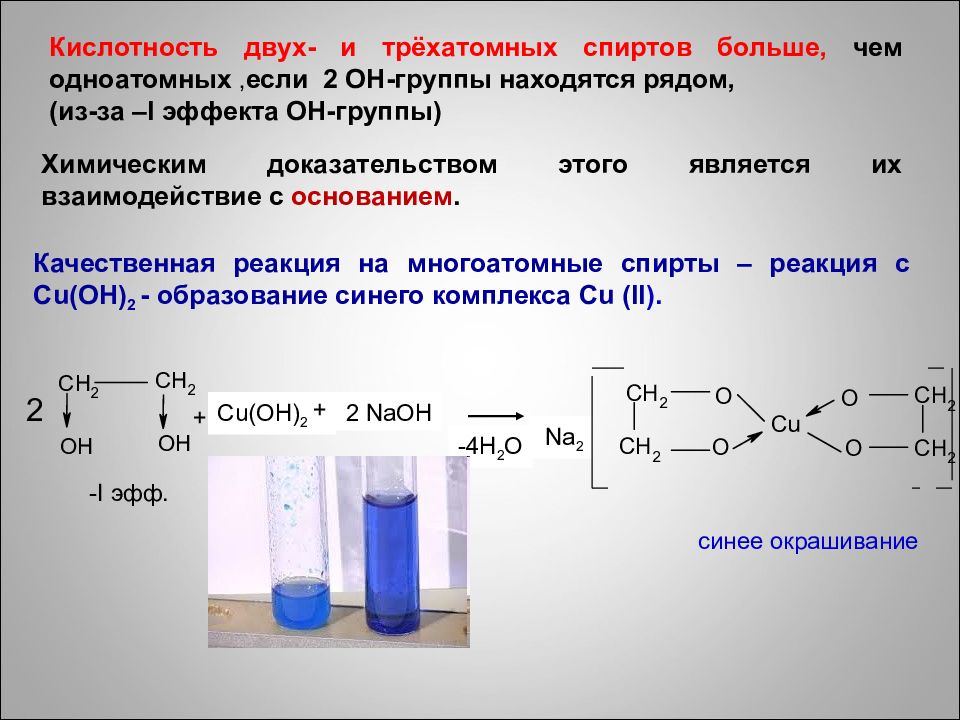
+ Cu(OH) 2 + 2 NaOH 2 -I эфф. -4 H 2 O Na 2 синее окрашивание Кислотность двух- и трёхатомных спиртов больше, чем одноатомных, если 2 ОН-группы находятся рядом, (из-за – I эффекта ОН-группы) Химическим доказательством этого является их взаимодействие с основанием. Качественная реакция на многоатомные спирты – реакция с Cu(OH) 2 - образование синего комплекса Cu (II ).
Слайд 19
19 Многоатомные спирты Накопление ОН-групп ведет к появлению сладкого вкуса: гексангексаол-1,2,3,4,5,6 (сорбит) пентанпентаол-1,2,3,4,5 (ксилит) Ксилит и сорбит – заменители сахара, используются при заболевании сахарным диабетом.
Слайд 20: Многоатомный циклический спирт-Инозит
циклогексангексаол - шестиатомный спирт. Из 9-и возможных стереоизомеров инозита свойствами витамина обладает только мезоинозит. 20
Слайд 21
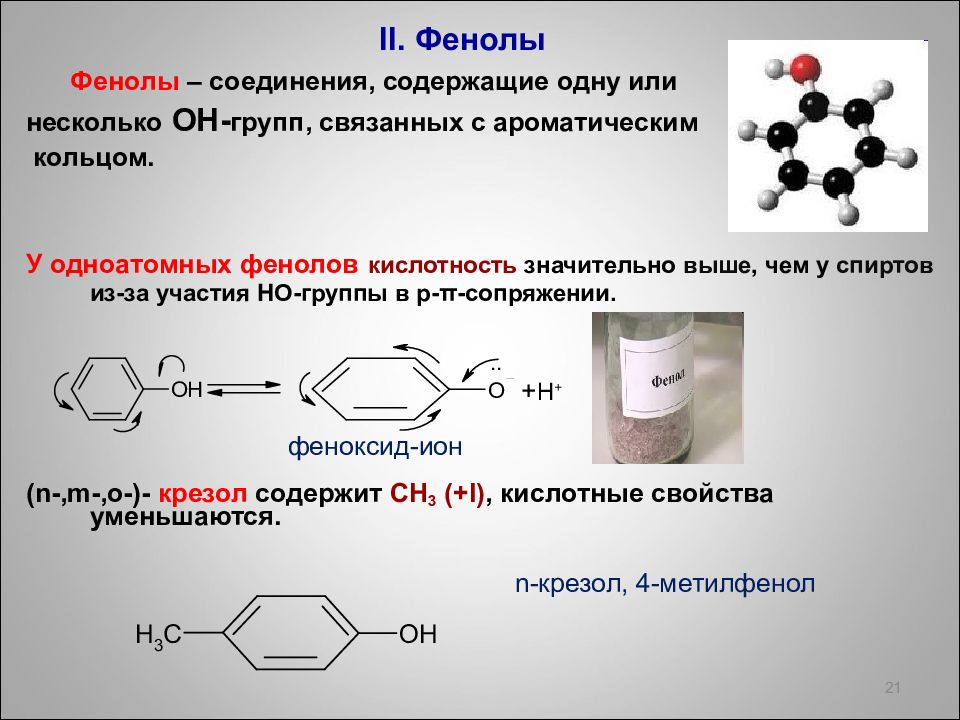
II. Фенолы Фенолы – соединения, содержащие одну или несколько ОН- групп, связанных с ароматическим кольцом. У одноатомных фенолов кислотность значительно выше, чем у спиртов из-за участия НО-группы в p- π - сопряжении. ( n -, m -, o -)- крезол содержит СН 3 ( + I), кислотные свойства уменьшаются. 21 n- крезол, 4-метилфенол феноксид-ион + Н +
Слайд 22
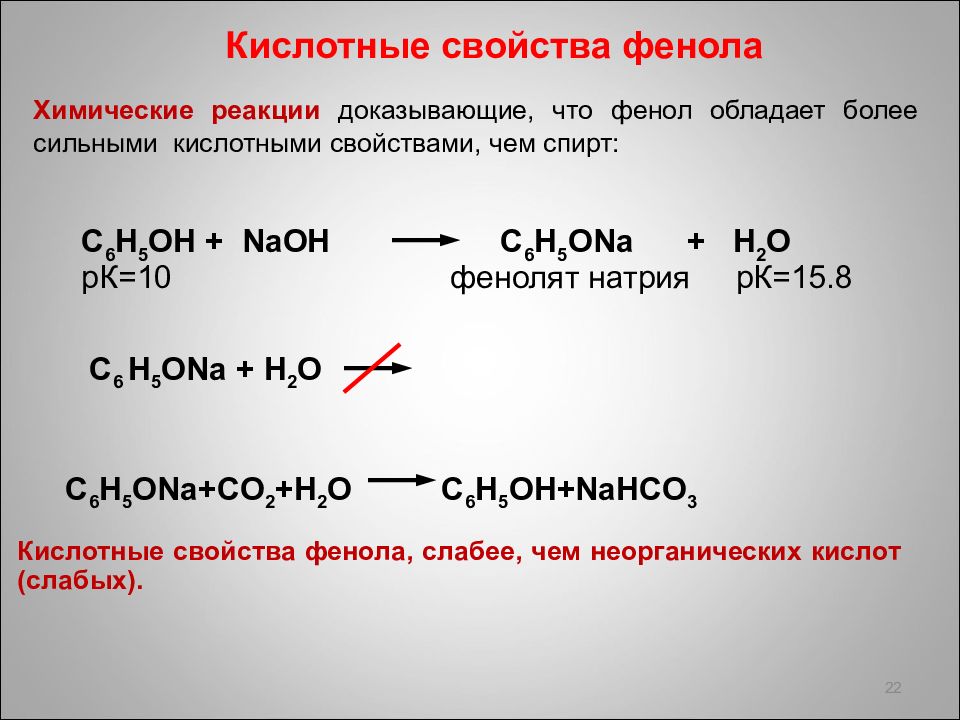
22 Химические реакции доказывающие, что фенол обладает более сильными кислотными свойствами, чем спирт : Кислотные свойства фенола C 6 H 5 ONa+CO 2 +H 2 O C 6 H 5 OH+NaHCO 3 Кислотные свойства фенола, слабее, чем неорганических кислот (слабых). C 6 H 5 OH + NaOH C 6 H 5 ONa + H 2 O p К =10 фенолят натрия p К =15.8 C 6 H 5 ONa + H 2 O
Слайд 23
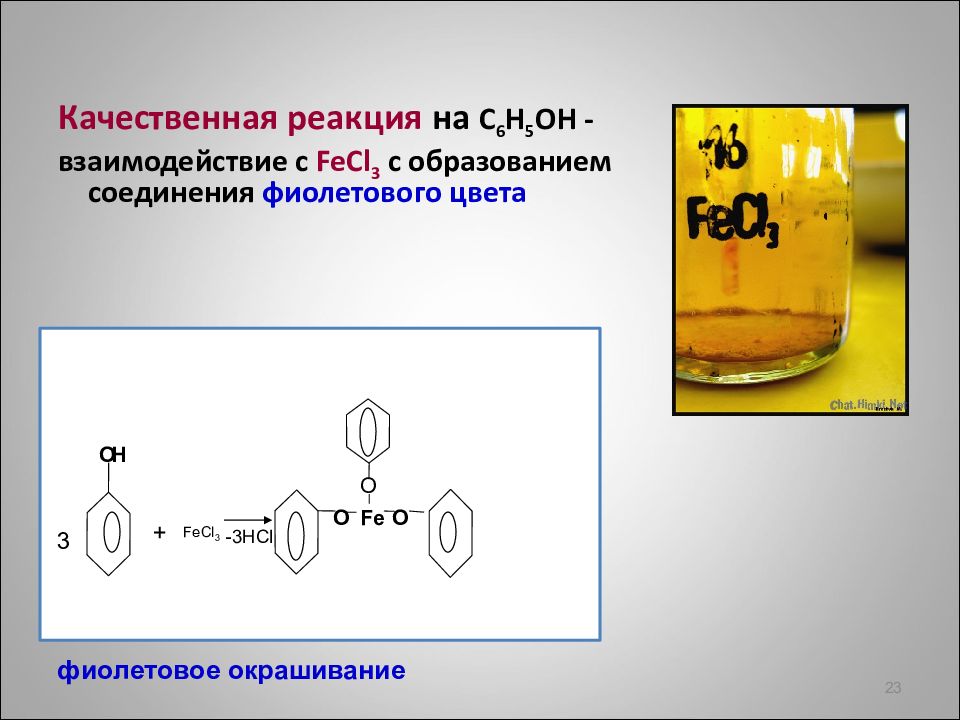
23 Качественная реакция на С 6 Н 5 ОН - взаимодействие с FeCl 3 с образованием соединения фиолетового цвета + -3 HCl 3 F e C l 3 O Fe O O O H фиолетовое окрашивание
Слайд 24
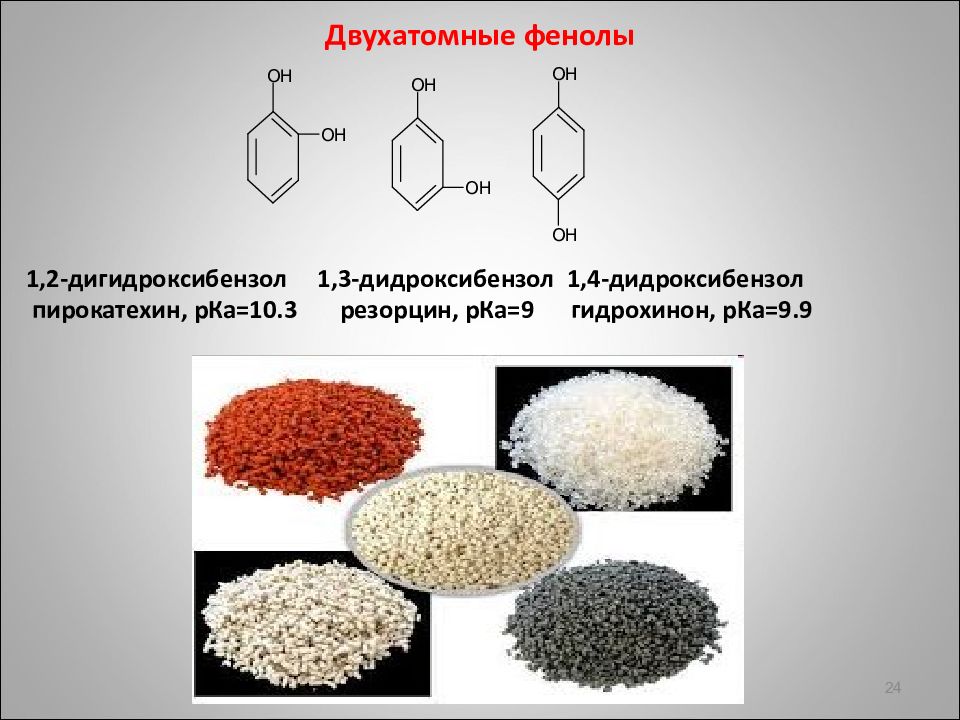
Двухатомные фенолы 1,2-дигидроксибензол 1,3-дидроксибензол 1,4-дидроксибензол пирокатехин, p Ка =10.3 резорцин, p Ка =9 гидрохинон, p Ка =9.9 24
Слайд 25
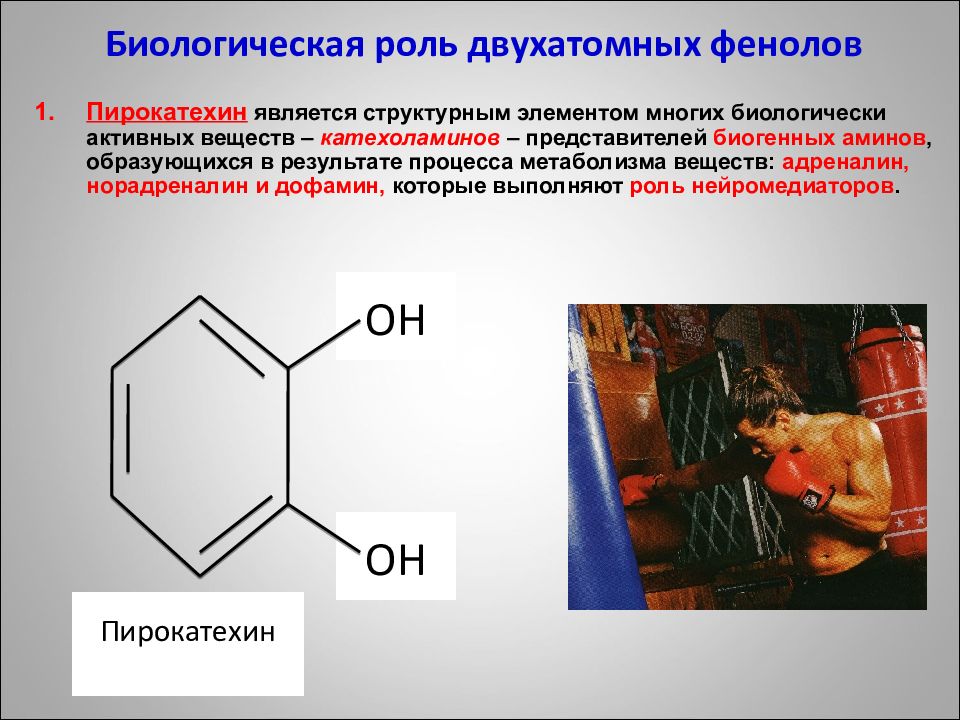
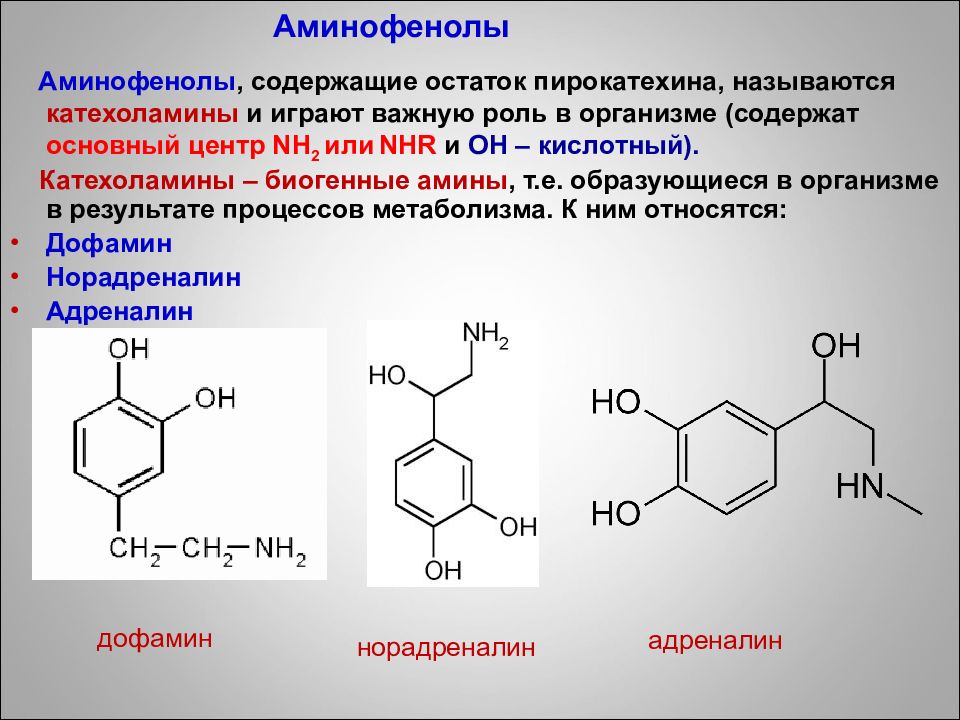
ОН ОН Биологическая роль двухатомных фенолов Пирокатехин является структурным элементом многих биологически активных веществ – катехоламинов – представителей биогенных аминов, образующихся в результате процесса метаболизма веществ : адреналин, норадреналин и дофамин, которые выполняют роль нейромедиаторов. Пирокатехин
Слайд 26
Адреналин – гормон мозгового вещества надпочечников, гормон страха. С Биологической активностью обладает лишь L- изомер, тогда как D – биологически неактивен. 26
Слайд 27
Резорцин используется в составе мазей или примочек при кожных заболеваниях. 27
Слайд 28
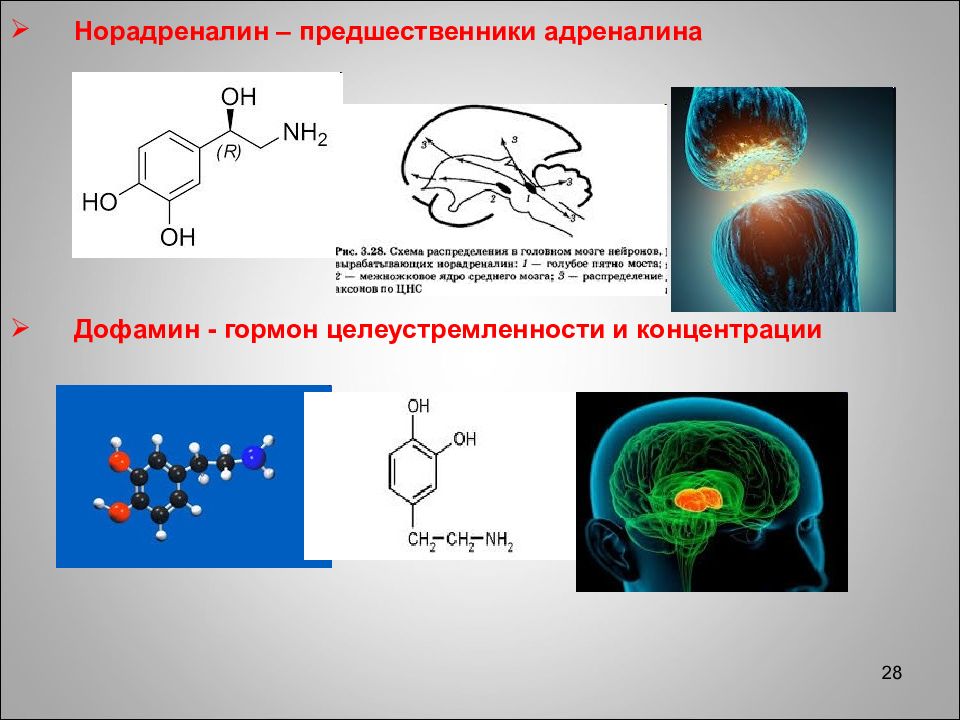
28 Норадреналин – предшественники адреналина Дофамин - гормон целеустремленности и концентрации
Слайд 29
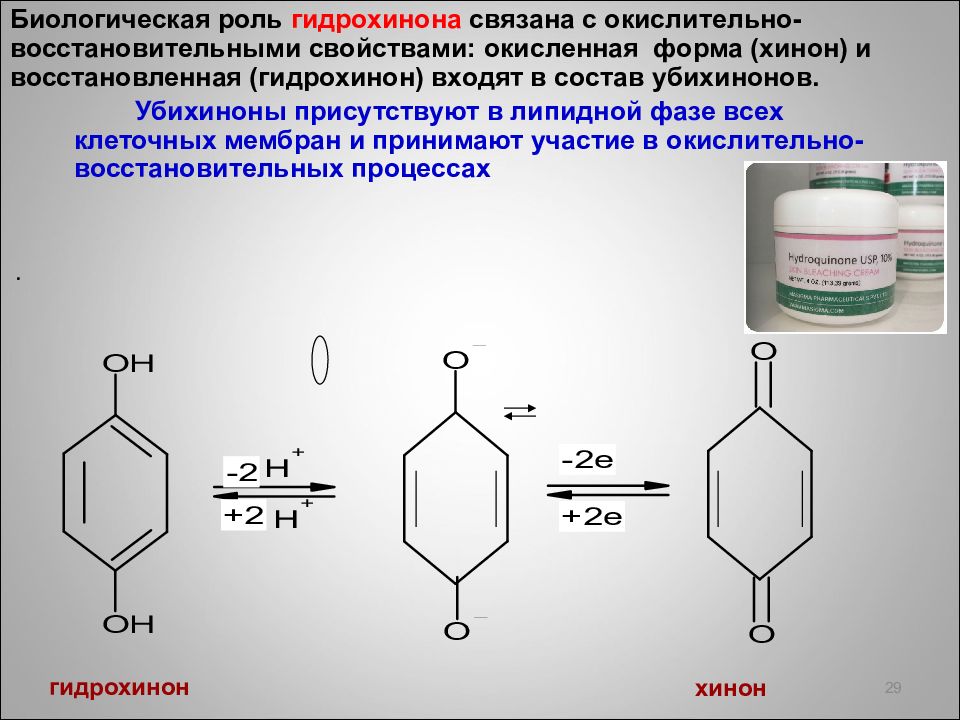
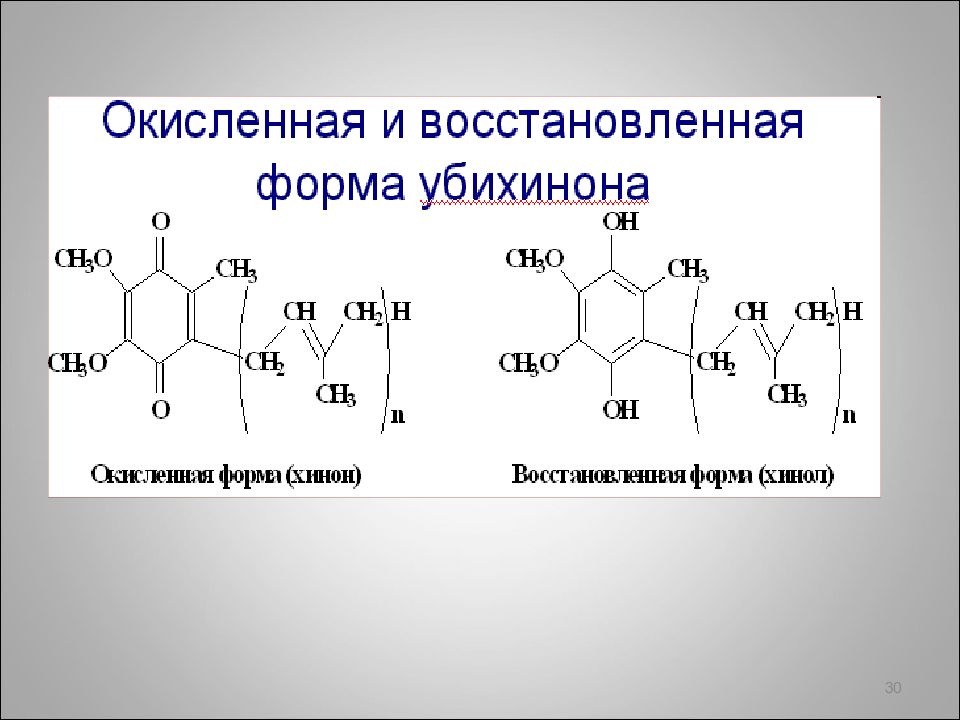
Б иологическая роль гидрохинона связана с окислительно -восстановительными свойствами: окисленная форма (хинон) и восстановленная (гидрохинон) входят в состав убихинонов. Убихиноны присутствуют в липидной фазе всех клеточных мембран и принимают участие в окислительно -восстановительных процессах . 29 гидрохинон хинон
Слайд 31
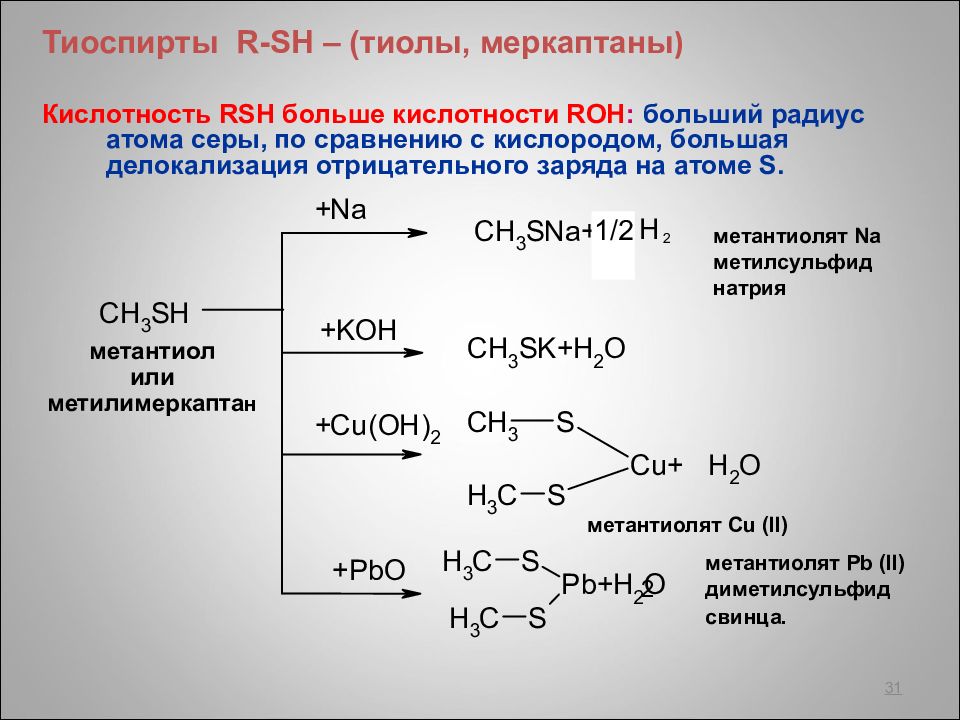
Тиоспирты R - SH – (тиолы, меркаптаны ) Кислотность RSH больше кислотности ROH : больший радиус атома серы, по сравнению с кислородом, большая делокализация отрицательного заряда на атоме S. 31 метантиол или метилимеркапта н метантиолят Na метилсульфид натрия метантиолят Cu (II) метантиолят Pb (II) диметилсульфид свинца. 2
Слайд 32
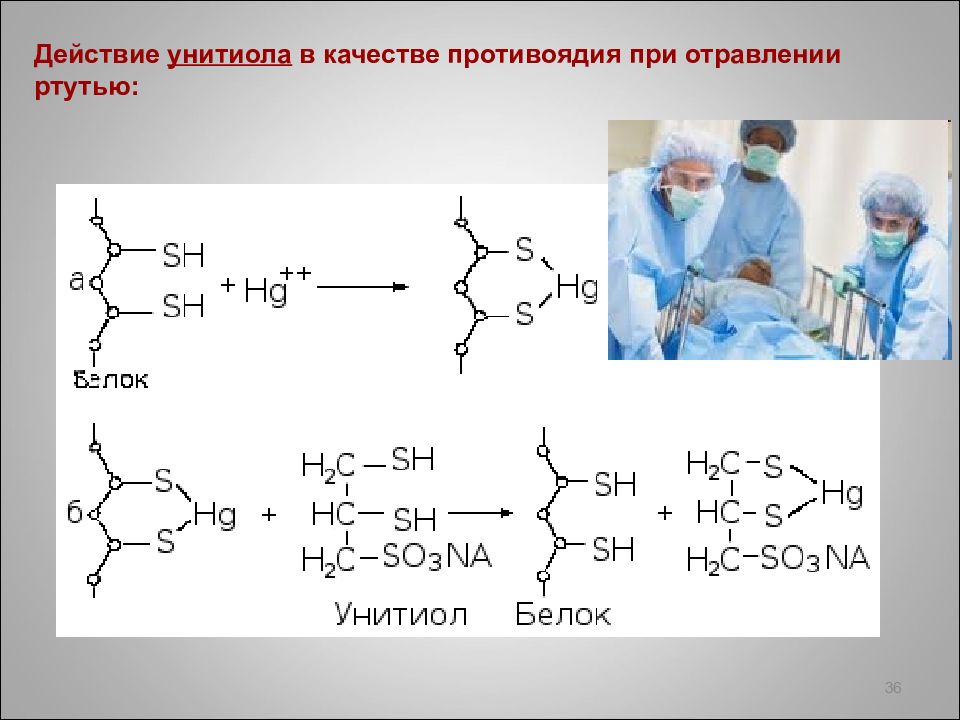
Особенность тиолов – образование труднорастворимых соединений с оксидами, гидроксидами, солями тяжёлых металлов ( Hg, Pb, Sb, Bi ). 2C 2 H 5 SH + HgO (C 2 H 5 S) 2 Hg + H 2 О В результате образуются МЕРКАПТИДЫ 32
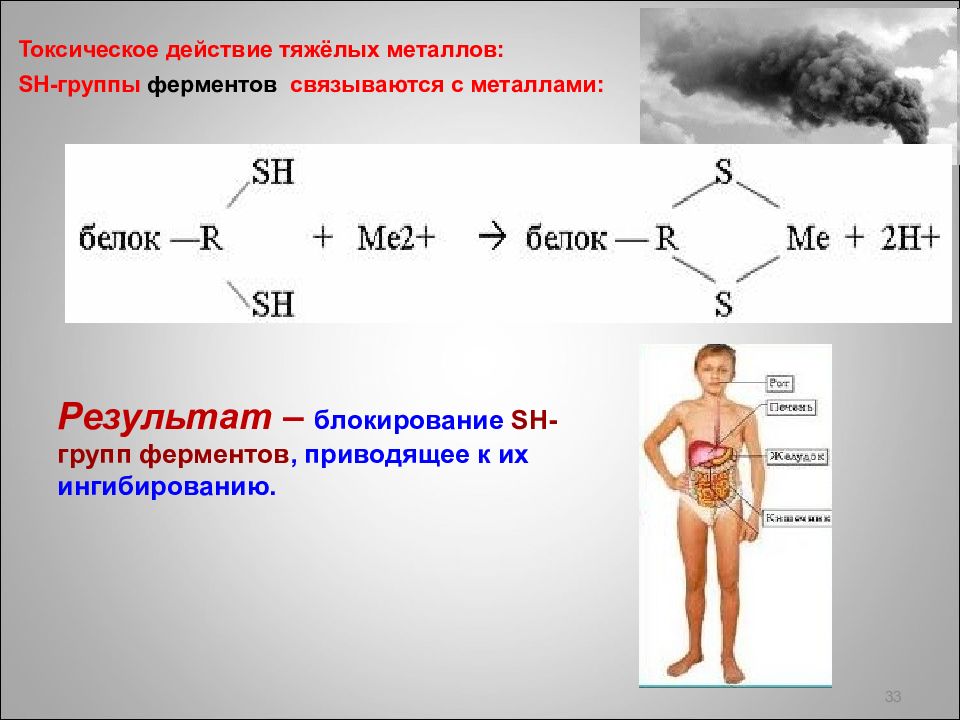
Слайд 33: Токсическое действие тяжёлых металлов: SH -группы ферментов c вязываются с металлами:
33 Результат – блокирование SH- групп ферментов, приводящее к их ингибированию.
Слайд 34
Антидоты – противоядия – содержат несколько HS -групп, образующих более прочные растворимые комплексы с тяжёлыми металлами, связывают свободный яд и освобождают инактивированный фермент. 34
Слайд 35
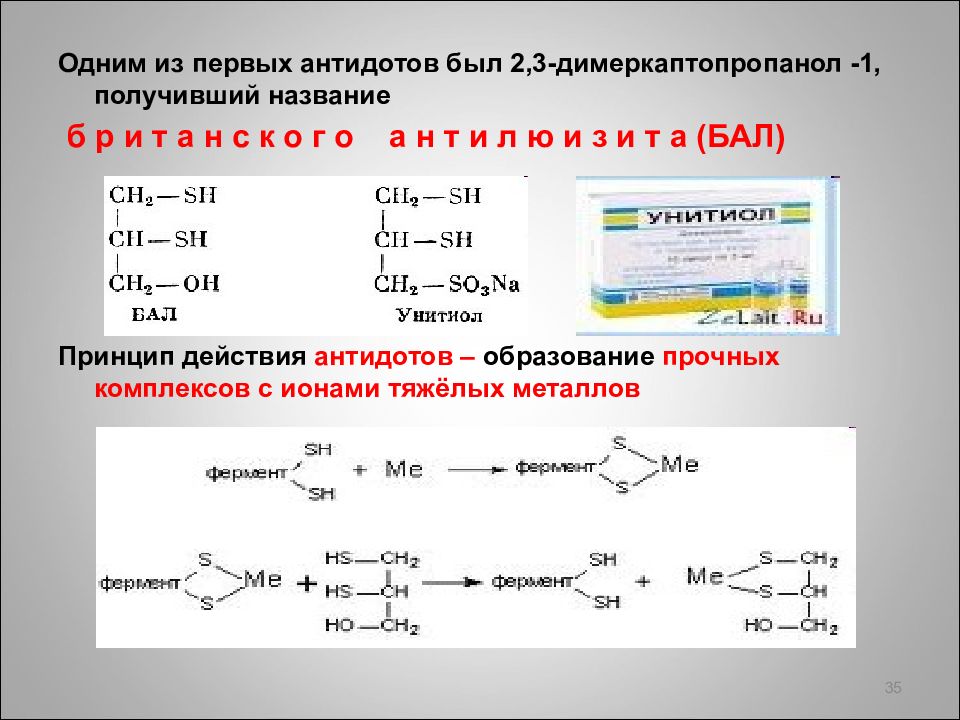
Одним из первых антидотов был 2,3-димеркаптопропанол -1, получивший название б р и т а н с к о г о а н т и л ю и з и т а (БАЛ) Принцип действия антидотов – образование прочных комплексов с ионами тяжёлых металлов 35
Слайд 37
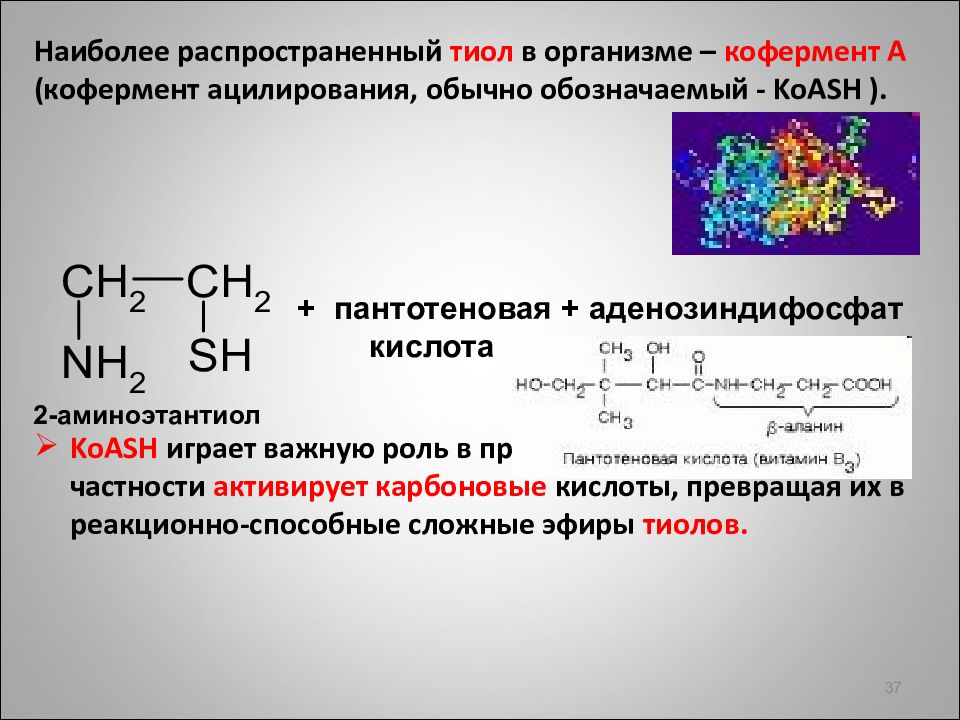
Наиболее распространенный тиол в организме – кофермент А (кофермент ацилирования, обычно обозначаемый - KoASH ). KoASH играет важную роль в процессах обмена веществ, в частности активирует карбоновые кислоты, превращая их в реакционно-способные сложные эфиры тиолов. 37 + пантотеновая + аденозиндифосфат кислота 2-аминоэтантиол
Слайд 39
Для спиртов характерны: 1 ) кислотные свойства; R – O – H 2) реакции нуклеофильного замещения S N ; R – O – H 3) Реакции элиминирования Е; (дегидратация) 4) Реакции окисления (ОВР). 39
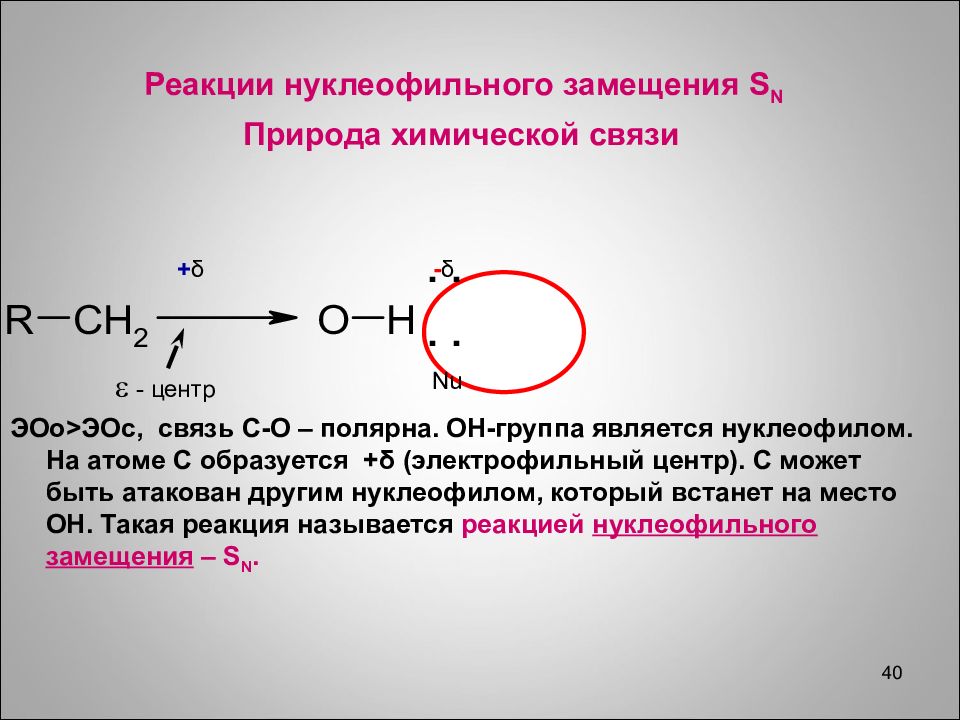
Слайд 40
40 Реакции нуклеофильного замещения S N Природа химической связи ЭОо>ЭОс, связь С-О – полярна. ОН-группа является нуклеофилом. На атоме С образуется + δ (электрофильный центр). С может быть атакован другим нуклеофилом, который встанет на место ОН. Такая реакция называется реакцией нуклеофильного замещения – S N. + δ - δ .. . . - центр Nu
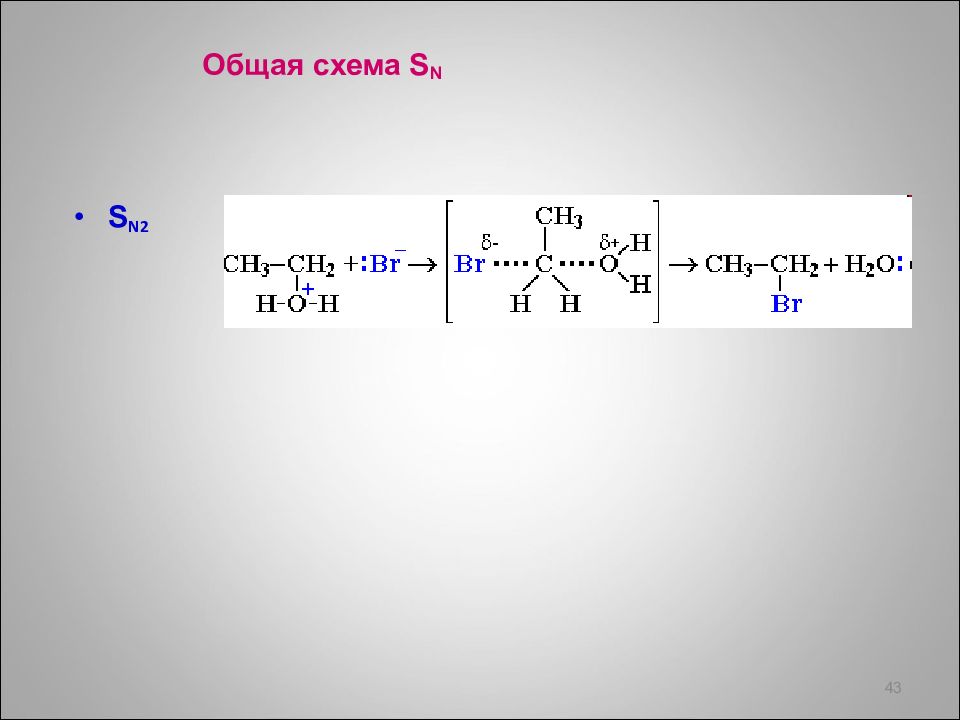
Слайд 41: Реакции S N
Реакции нуклеофильного замещения S N характерны для соединений, содержащих нуклеофил, связанный с sp 3 - гибридным атомом С. ROH - спирты R - Hal – галогенпроизводные R - SH – тиоспирты R - N Н 2 – амины 41
Слайд 44
Уходящий анион должен быть более устойчивым, чем атакующий. Самые стабильные анионы – галогениды ( Hal - ): Cl -, Br -, I -, поэтому реакции S N c RHal протекают легко: R– Cl + NaOH R–OH + NaCl Для ROH, RSH, RNH 2 реакции протекают трудно, т.к. соединения содержат плохо уходящие группы: ОН, SH, NH 2 44 H 2 O
Слайд 45: Для протекания реакции S N необходимо из плохо уходящей группы создать хорошо уходящую. Это делается с помощью катализатора (часто Н + )
45
Слайд 46
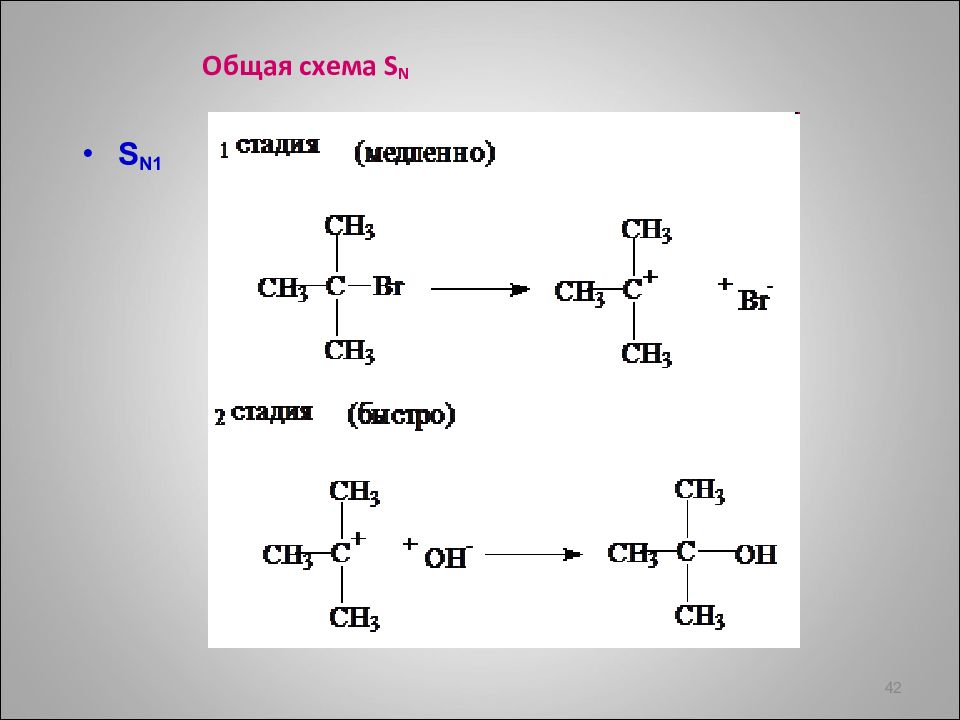
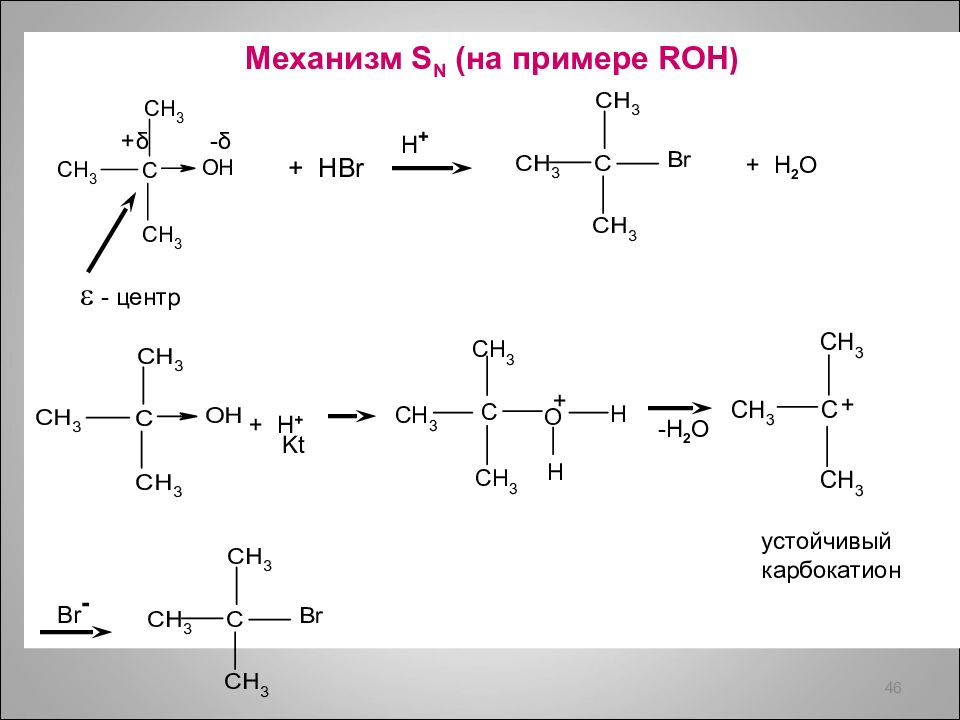
Механизм S N (на примере ROH ) 46 + δ - δ - центр + HBr H + + H 2 O + H + Kt -H 2 O + Br - устойчивый карбокатион +
Слайд 47
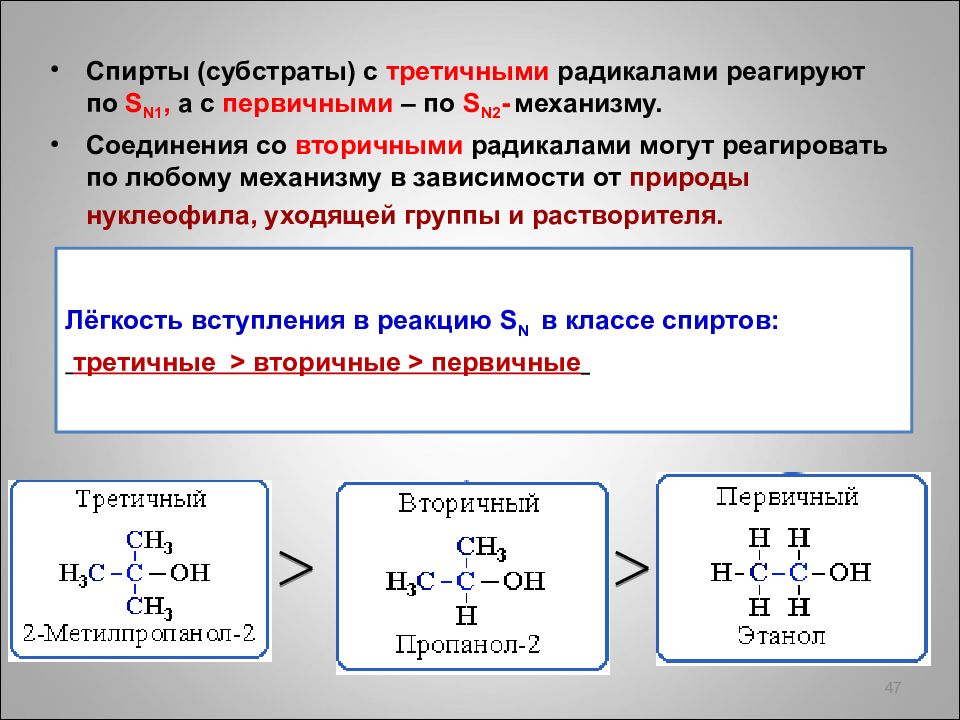
Спирты (субстраты) с третичными радикалами реагируют по S N1, а с первичными – по S N 2 - механизму. Соединения со вторичными радикалами могут реагировать по любому механизму в зависимости от природы нуклеофила, уходящей группы и растворителя. 47 Лёгкость вступления в реакцию S N в классе спиртов : третичные > вторичные > первичные
Слайд 48
48 В целом способность вступать в реакцию нуклеофильного замещения для соединений различных классов меняется в следующей последовательности: RHal > ROH > RSH > RNH 2 Группы SH, NH 2, NHR, NR 2 – чрезвычайно плохо уходящие. Их нуклеофильное замещение осуществляется специальными реакциями:
Слайд 49
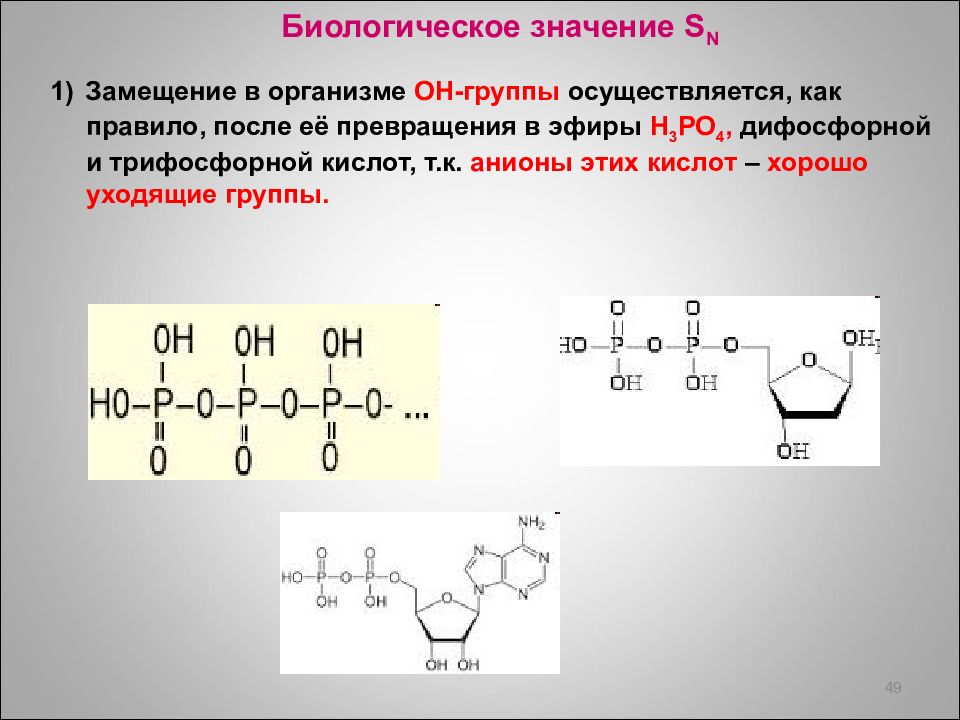
Биологическое значение S N 1) Замещение в организме ОН-группы осуществляется, как правило, после её превращения в эфиры H 3 PO 4, дифосфорной и трифосфорной кислот, т.к. анионы этих кислот – хорошо уходящие группы. 49
Слайд 50
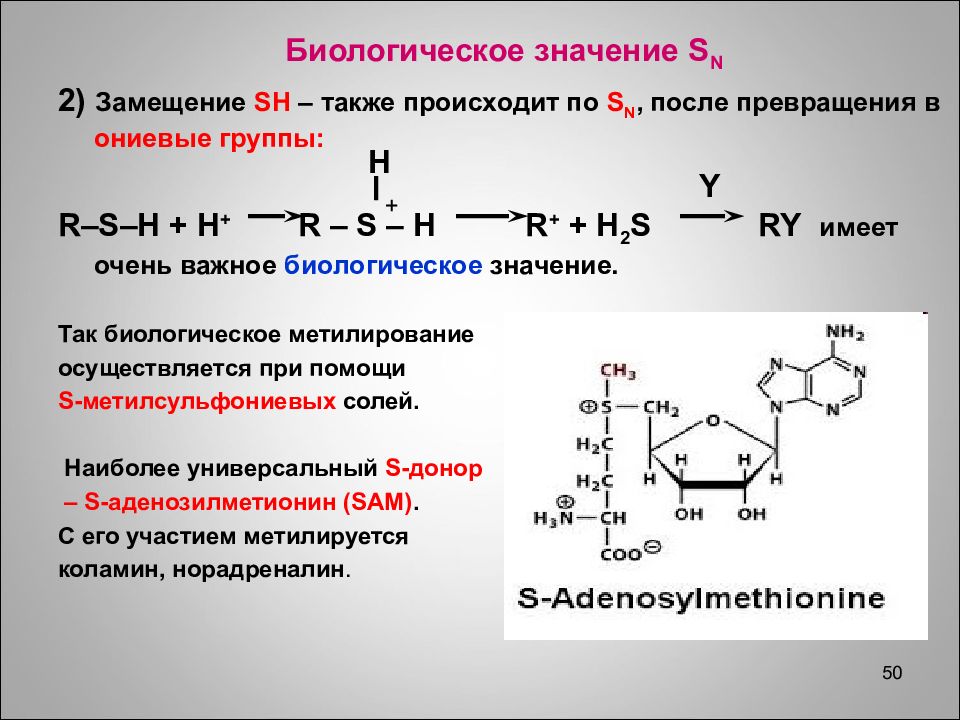
50 Биологическое значение S N 2) Замещение SH – также происходит по S N, после превращения в ониевые группы: R–S–H + H + R – S – H R + + H 2 S RY имеет очень важное биологическое значение. Так биологическое метилирование осуществляется при помощи S -метилсульфониевых солей. Наиболее универсальный S -донор – S -аденозилметионин ( SAM). С его участием метилируется коламин, норадреналин. H Y +
Слайд 51
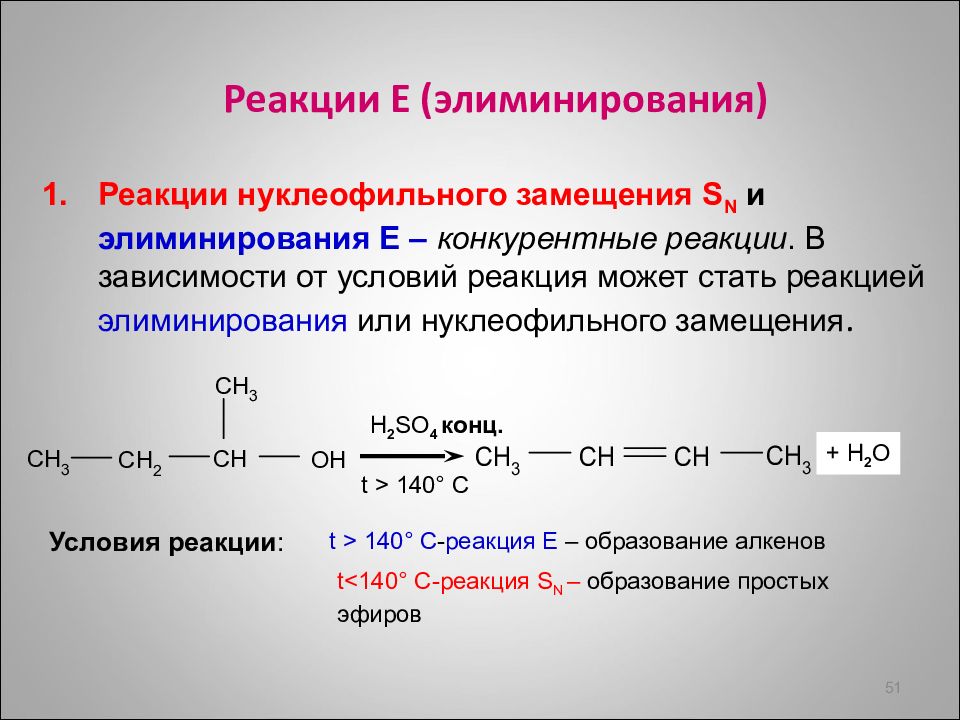
Реакции Е ( элиминирования ) Реакции нуклеофильного замещения S N и элиминирования Е – конкурентные реакции. В зависимости от условий реакция может стать реакцией элиминирования или нуклеофильного замещения. 51 + H 2 O H 2 SO 4 конц. t > 1 4 0 ° C t<1 4 0 ° C -реакция S N – образование простых эфиров Условия реакции : t > 1 4 0 ° C - реакция Е – образование алкенов
Слайд 52
Механизм Е Отщепление происходит по правилу Зайцева. Лёгкость протекания реакции: третичные > вторичные > первичные спирты Аналогично реакции Е протекают и в классе галогенпроизводных. Элиминирование в тиоспиртах, аминах протекает через образование сульфониевых или аммониевых катионов. 52 + H + (из H 2 SO 4 ) - H 2 O HSO 4 - - H 2 SO 4 + +
Слайд 53
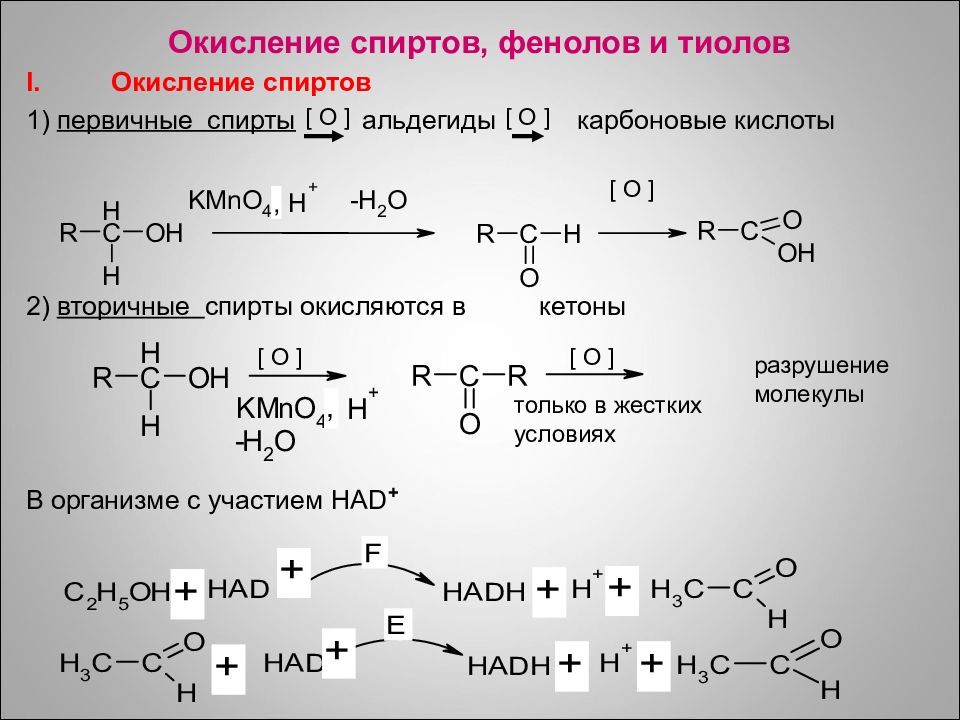
Окисление спиртов, фенолов и тиолов Окисление спиртов 1) первичные спирты альдегиды карбоновые кислоты 2) вторичные спирты окисляются в кетоны В организме с участием HAD + [ O ] только в жестких условиях [ O ] разрушение молекулы [ O ] [ O ] [ O ]
Слайд 54
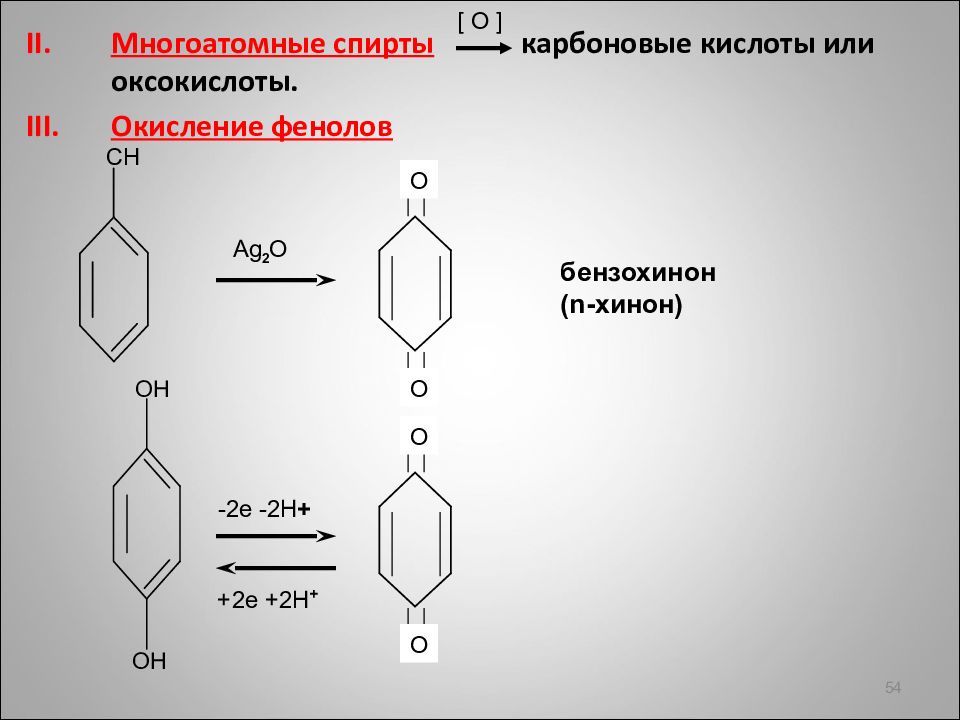
Многоатомные спирты карбоновые кислоты или оксокислоты. Окисление фенолов 54 [ O ] О О О О -2 e -2H + +2e +2H + Ag 2 O бензохинон ( n- хинон)
Слайд 55
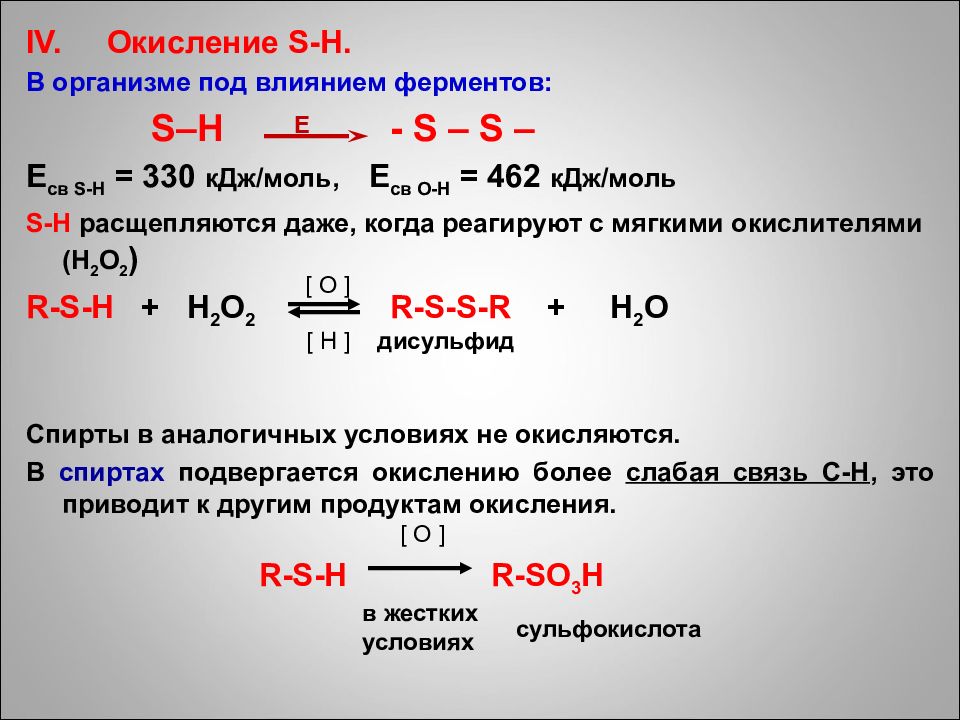
IV. Окисление S - H. В организме под влиянием ферментов : S–H - S – S – E св S-H = 330 кДж / моль, E св O-H = 462 кДж / моль S - H расщепляются даже, когда реагируют с мягкими окислителями ( H 2 O 2 ) R-S-H + H 2 O 2 R-S-S-R + H 2 O Спирты в аналогичных условиях не окисляются. В спиртах подвергается окислению более слабая связь C - H, это приводит к другим продуктам окисления. R-S-H R-SO 3 H E [ O ] [ H ] дисульфид [ O ] сульфокислота в жестких условиях
56
Слайд 57
Основания Бренстеда Основания Бренстеда – нейтральные молекулы или ионы, способные присоединять протоны (акцепторы Н + ). а) π-основания : молекулы с двойной или тройной связью, арены. б) « ониевые » или n -основания, молекулы или ионы, содержащие гетероатом S, N, O : « S » – сульфониевые «О» – оксониевые « N » – аммониевые 57
Слайд 58
Факторы, влияющие на основность а) Э O атома в основном центре Чем меньше ЭО, тем сильнее основность б) размер гетероатома Чем радиус меньше, тем основность больше в) влияние заместителей ЭД-заместители увеличивают основность, ЭА – уменьшают г) влияние сопряжения Участие в сопряжении ослабляет основность 58
Слайд 59
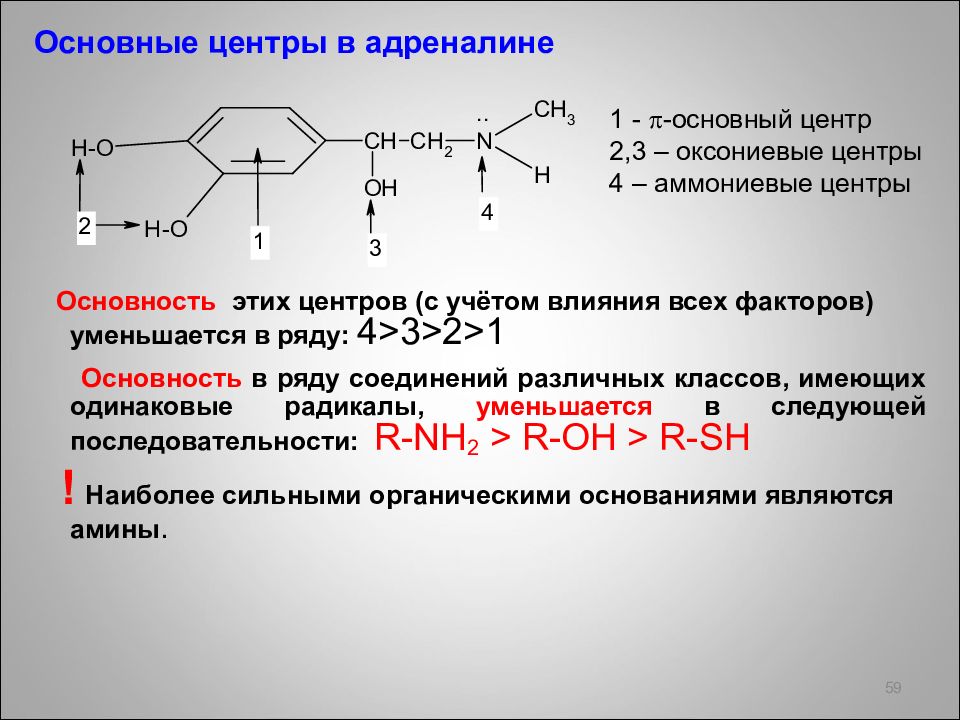
Основные центры в адреналине Основность этих центров (с учётом влияния всех факторов) уменьшается в ряду: 4>3>2>1 Основность в ряду соединений различных классов, имеющих одинаковые радикалы, уменьшается в следующей последовательности: R - NH 2 > R - OH > R - SH ! Наиболее сильными органическими основаниями являются амины. 59 1 - -основный центр 2,3 – оксониевые центры 4 – аммониевые центры
Слайд 60
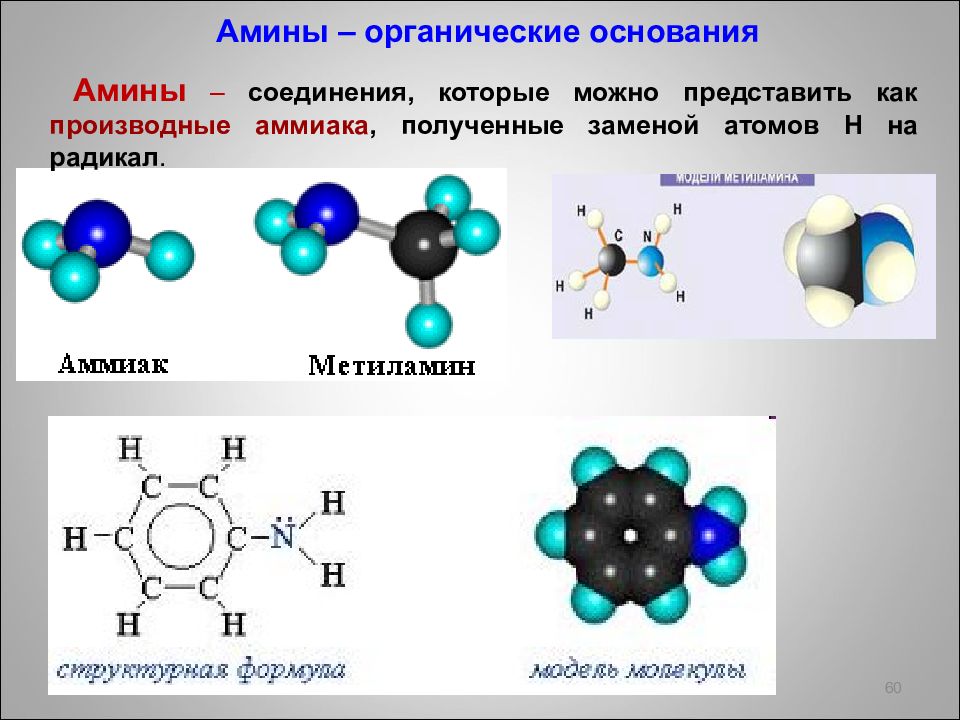
60 Амины – органические основания Амины – соединения, которые можно представить как производные аммиака, полученные заменой атомов Н на радикал.
Слайд 61
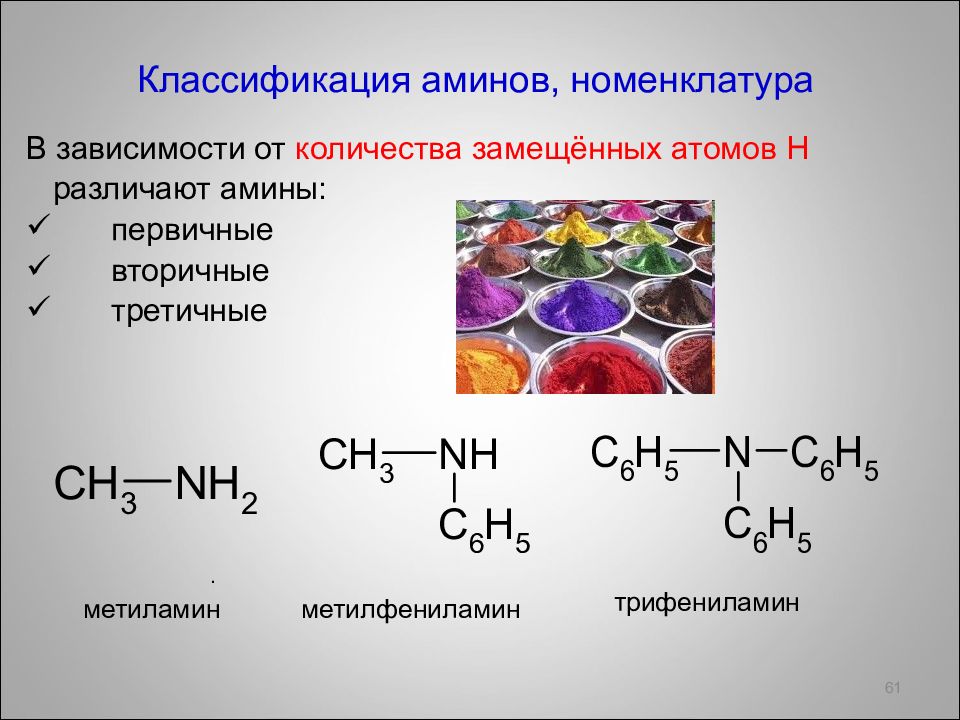
Классификация аминов, номенклатура В зависимости от количества замещённых атомов Н различают амины: первичные вторичные третичные 61 . метиламин метилфениламин трифениламин
Слайд 62
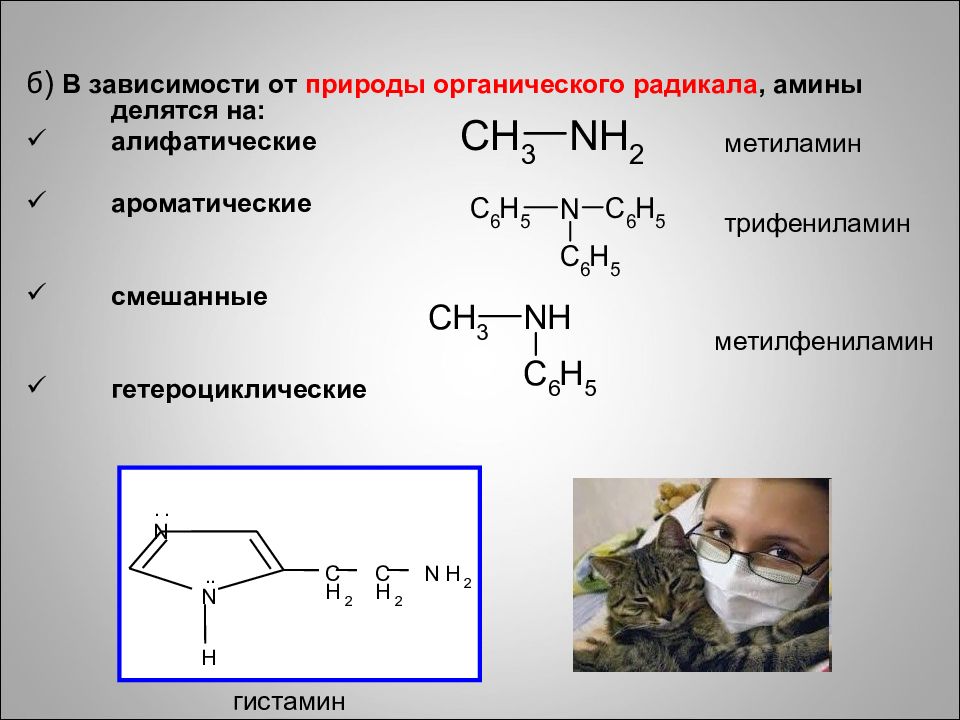
б ) В зависимости от природы органического радикала, амины делятся на: алифатические ароматические смешанные гетероциклические N N C H 2 C H 2 N H 2 H . . . . гистамин метиламин метилфениламин трифениламин
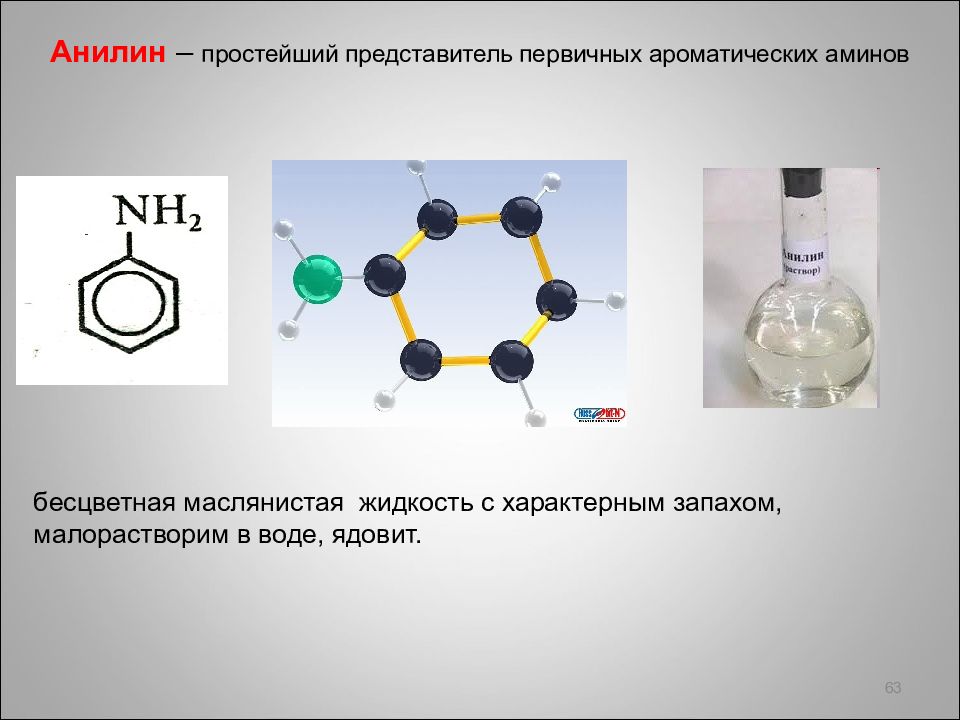
63 бесцветная маслянистая жидкость с характерным запахом, малорастворим в воде, ядовит.
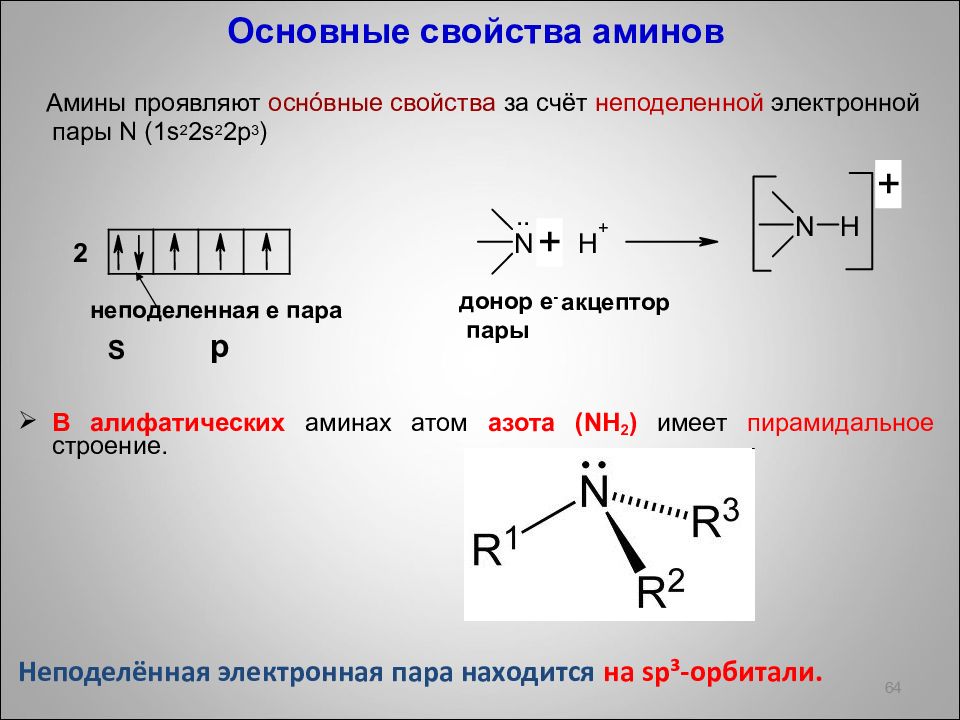
Слайд 64
Основные свойства аминов Амины проявляют осн ó вные свойства за счёт неподеленной электронной пары N (1s 2 2s 2 2p 3 ) В алифатических аминах атом азота ( NH 2 ) имеет пирамидальное строение. Неподелённая электронная пара находится на sp ³-орбитали. 64 донор е - пары акцептор 2 S неподеленная e пара р
Слайд 65
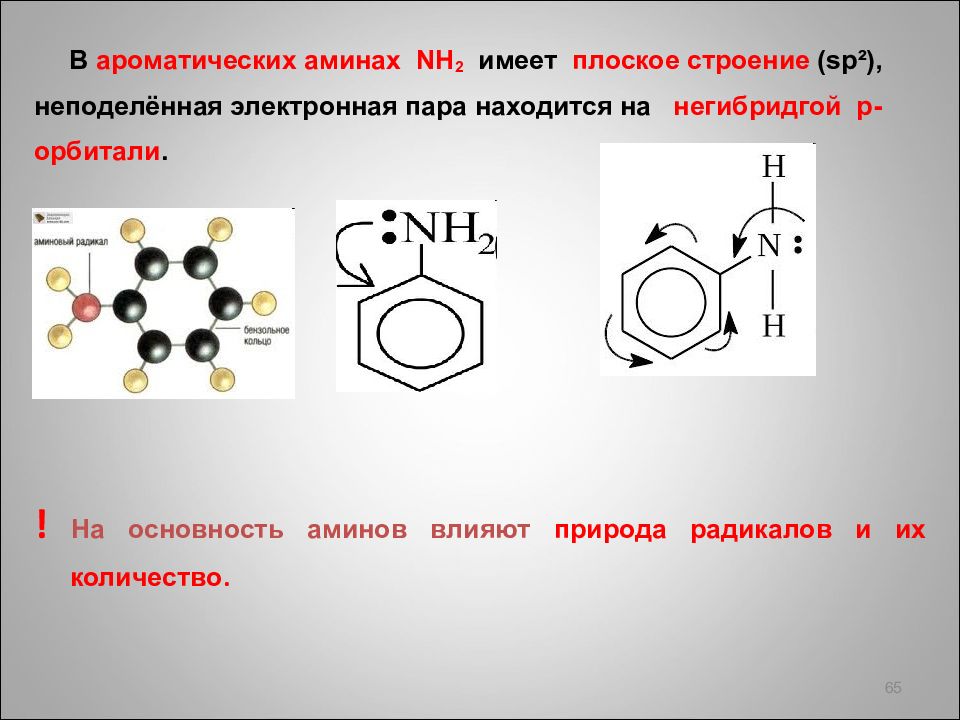
В ароматических аминах NH 2 имеет плоское строение ( sp ²), неподелённая электронная пара находится на негибридгой p - орбитали. ! На основность аминов влияют природа радикалов и их количеств о. 65
Слайд 66
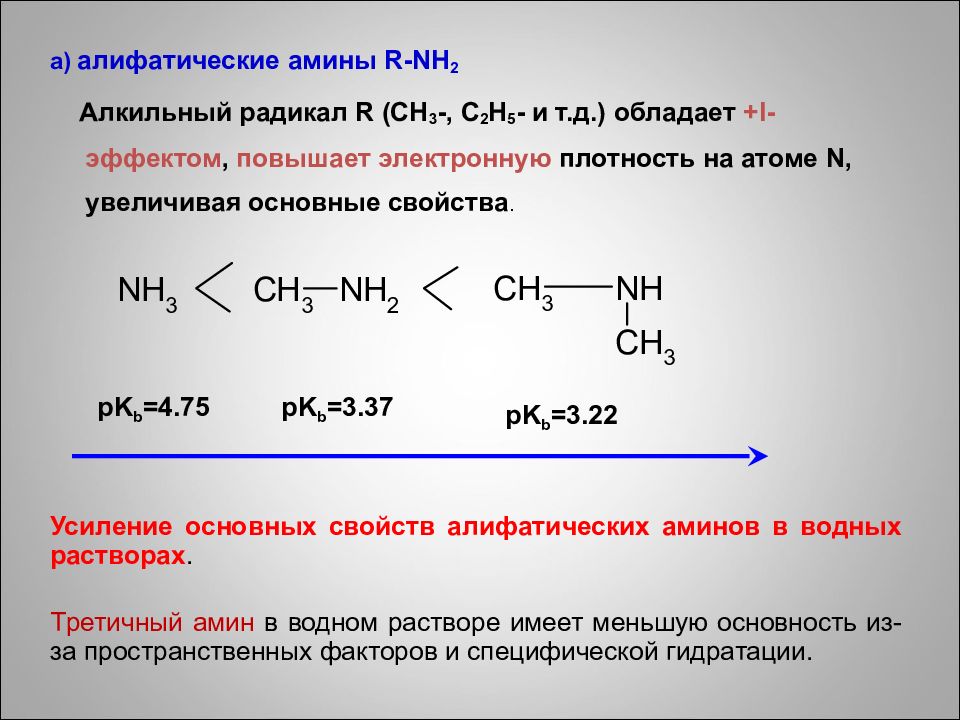
а) a лифатические амины R - NH 2 Алкильный радикал R ( CH 3 -, C 2 H 5 - и т.д.) обладает + I -эффектом, повышает электронную плотность на атоме N, увеличивая основные свойства. Усиление основных свойств алифатических аминов в водных растворах. T ретичный амин в водном растворе имеет меньшую основность из-за пространственных факторов и специфической гидратации. pK b =4.75 pK b =3.37 pK b =3.22
Слайд 67
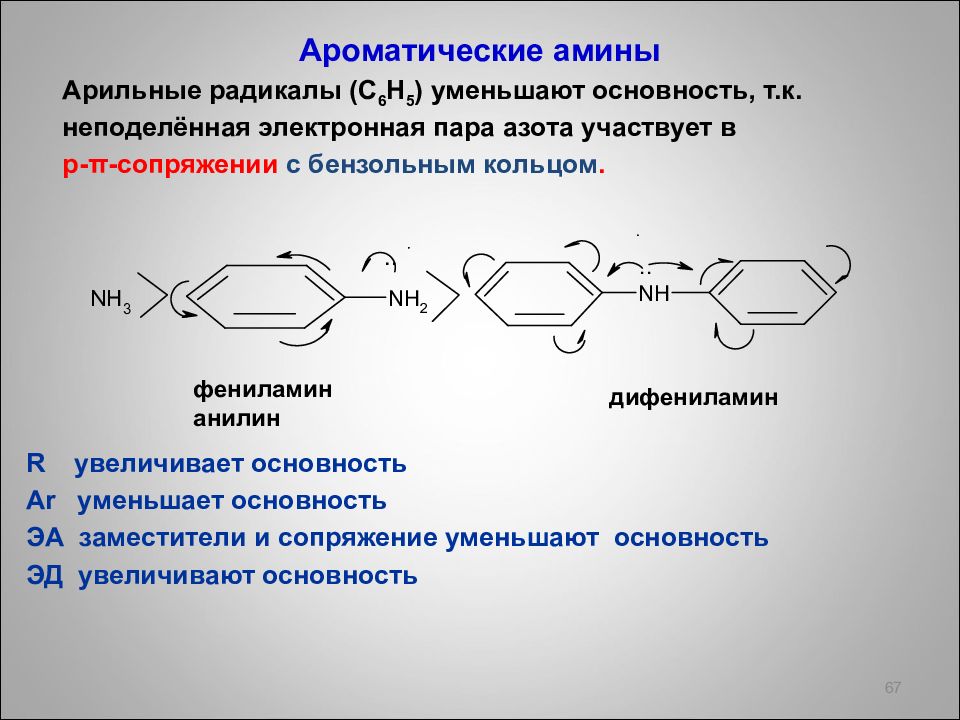
Ароматические амины Арильные радикалы ( С 6 Н 5 ) уменьшают основность, т.к. неподелённая электронная пара азота участвует в p - π -сопряжении с бензольным кольцом. R увеличивает основность Ar уменьшает основность ЭА заместители и сопряжение уменьшают основность ЭД увеличивают основность 67 фениламин анилин дифениламин ..
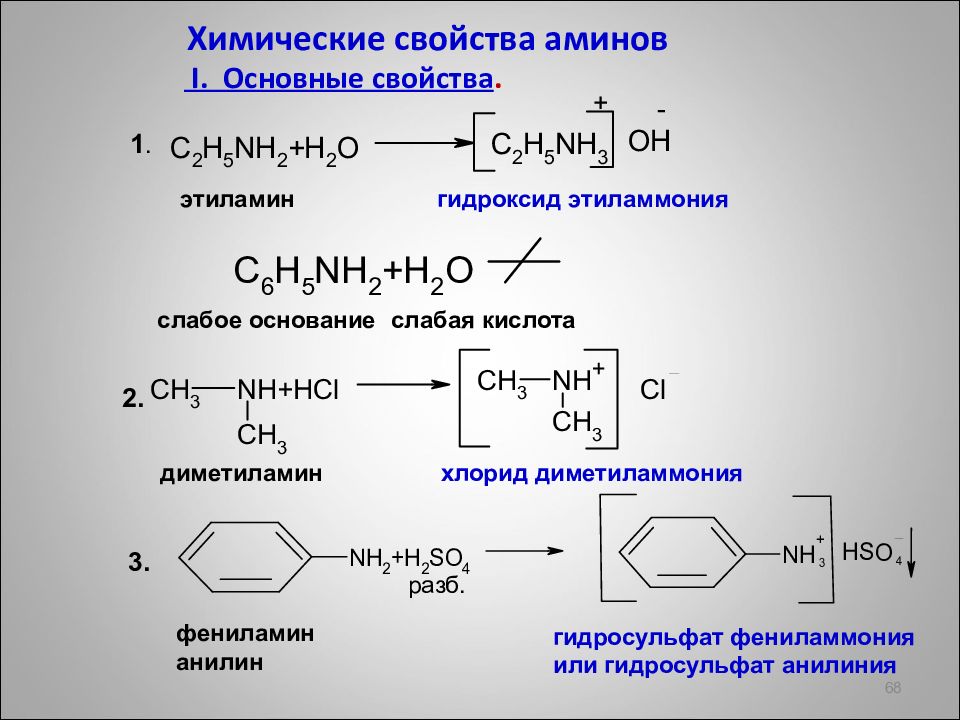
Слайд 68
Химические свойства аминов I. Основные свойства. 68 1. 2. 3. этиламин гидроксид этиламмония + слабое основание слабая кислота диметиламин хлорид диметиламмония фениламин анилин гидросульфат фениламмония или гидросульфат анилиния разб. + -
Слайд 69
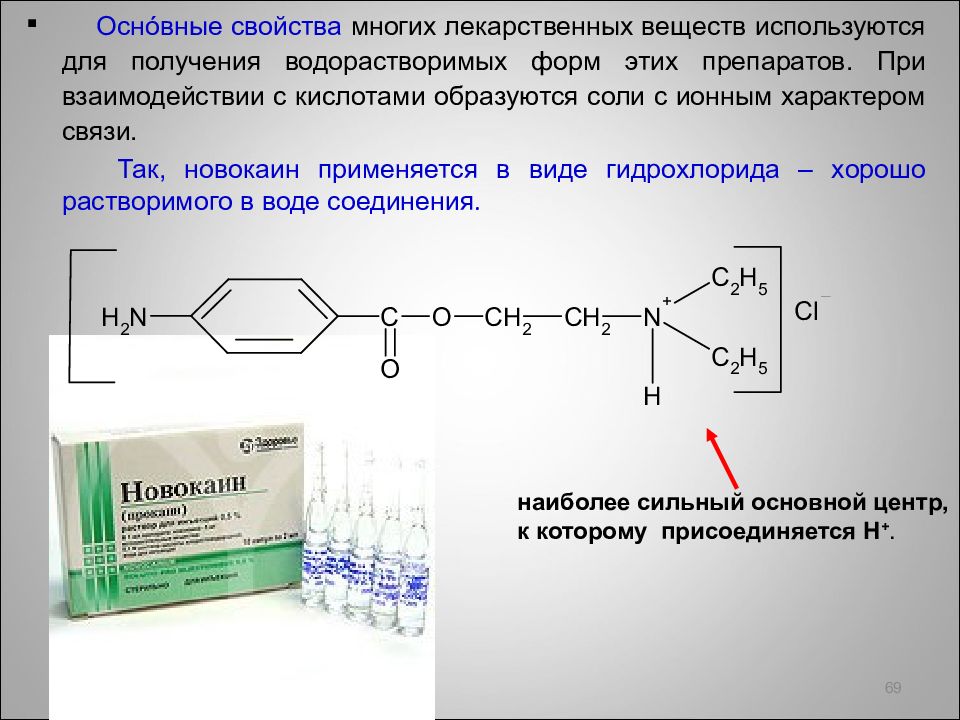
Осн ó вные свойства многих лекарственных веществ используются для получения водорастворимых форм этих препаратов. При взаимодействии с кислотами образуются соли с ионным характером связи. Так, новокаин применяется в виде гидрохлорида – хорошо растворимого в воде соединения. 69 наиболее сильный основной центр, к которому присоединяется H +.
Слайд 70
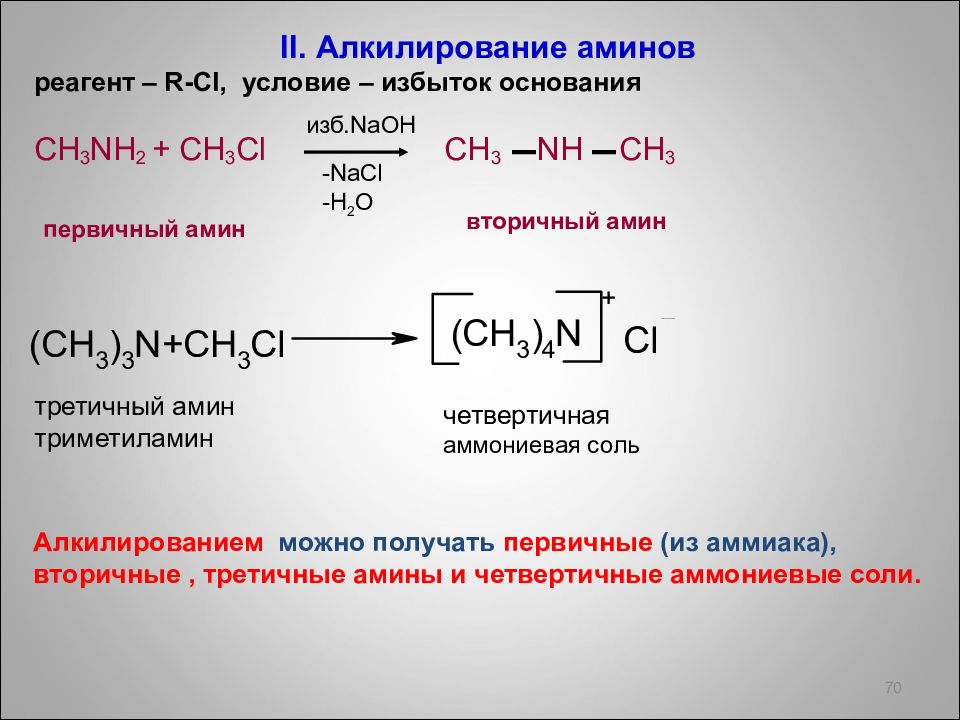
II. Алкилирование аминов реагент – R- Cl, условие – избыток основания CH 3 NH 2 + CH 3 Cl CH 3 NH CH 3 70 -NaCl -H 2 О изб. NaOH вторичный амин первичный амин третичный амин триметиламин четвертичная аммониевая соль + Алкилированием можно получать первичные (из аммиака), вторичные, третичные амины и четвертичные аммониевые соли.
Слайд 71
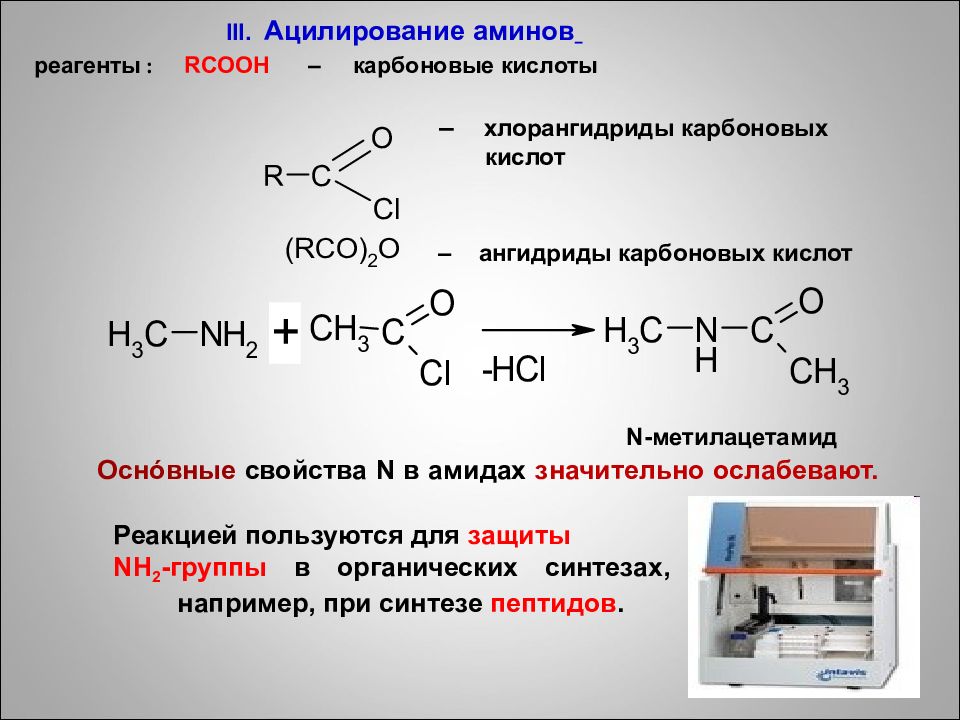
III. Ацилирование аминов реагенты : RCOOH – карбоновые кислоты 71 – хлорангидриды карбоновых кислот – ангидриды карбоновых кислот N- метилацетамид Осн ó вные свойства N в амидах значительно ослабевают. Реакцией пользуются для защиты NH 2 -группы в органических синтезах, например, при синтезе пептидов.
Слайд 72
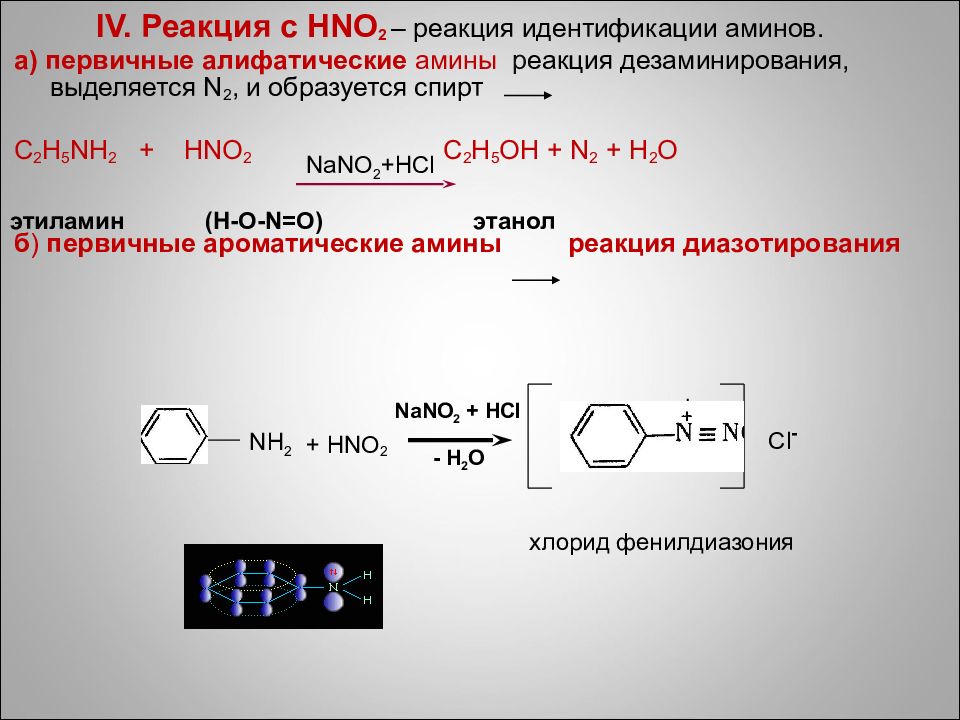
IV. Реакция с HNO 2 – реакция идентификации аминов. а) первичные алифатические амины р еакция дезаминирования, выделяется N 2, и образуется спирт С 2 H 5 NH 2 + HNO 2 C 2 H 5 OH + N 2 + H 2 O б ) первичные ароматические амины реакция диазотирования NaNO 2 +HCl этиламин (H-O-N=O) этанол + HNO 2 NaNO 2 + HCl - H 2 O + Cl - хлорид фенилдиазония NH 2
Слайд 73
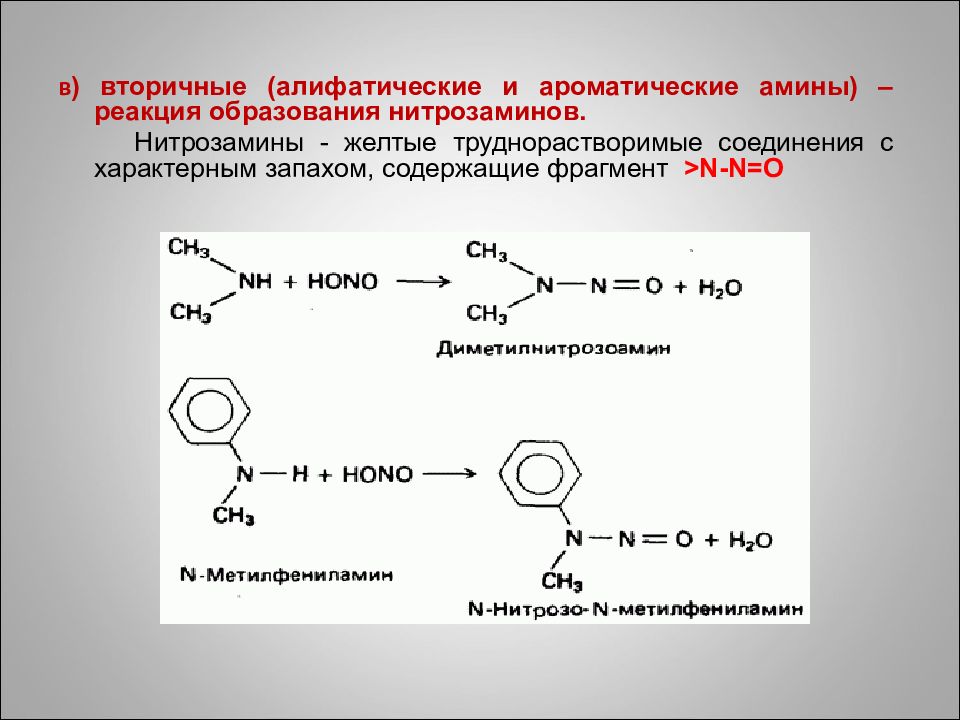
в ) вторичные (алифатические и ароматические амины) – реакция образования нитрозаминов. Нитрозамины - желтые труднорастворимые соединения с характерным запахом, содержащие фрагмент >N-N=O
Слайд 74
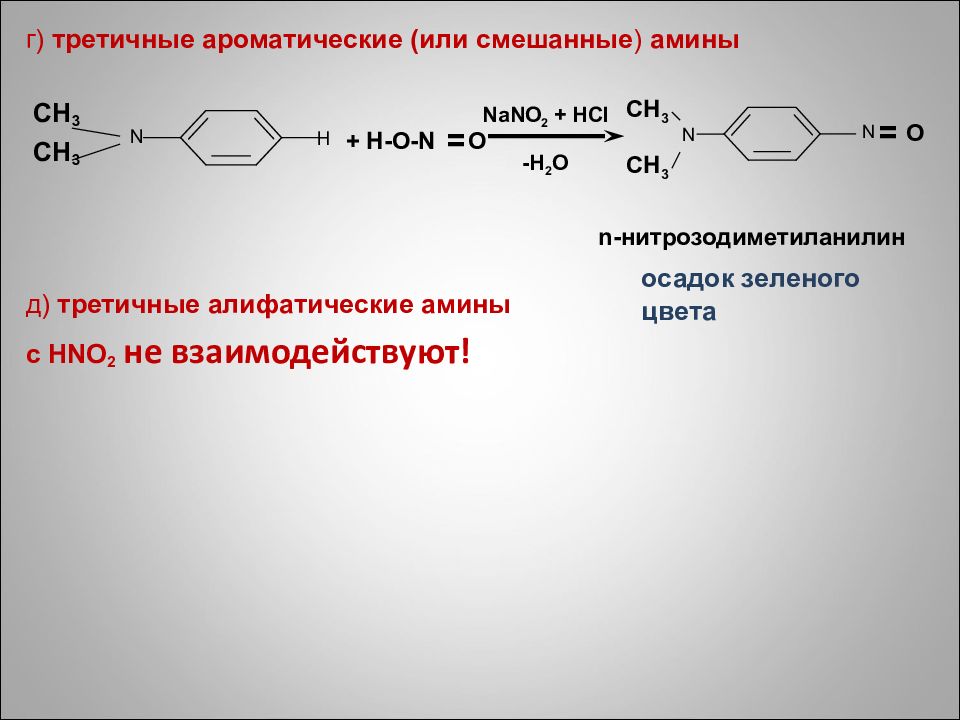
г) третичные ароматические (или смешанные ) амины CH 3 CH 3 д ) третичные алифатические амины с HNO 2 не взаимодействуют! + H-O-N O NaNO 2 + HCl -H 2 О O CH 3 CH 3 n- нитрозодиметиланилин осадок зеленого цвета
Слайд 75: Получение аминов
образуется соль амина, из которой действием щелочи можно выделить первичный амин ( этиламин ): При взаимодействии первичного амина и галогенпроизводного и последующей обработкой щелочью получают вторичные амины: Повторение приводит к образованию третичного амина: 1) Из галогенпроизводных
Слайд 76
2) Получение алифатических и ароматических вторичных аминов восстановлением нитросоединений. Восстановителем является водород «в момент выделения», который образуется при взаимодействии, например, цинка со щелочью или железа с соляной кислотой: Зинин Николай Николаевич (1812 – 1880) Русский химик – органик, академик. В 1842 году открыл реакцию восстановления ароматических нитросоединений и получил анилин, доказал, что амины – основания способные образовывать соли с различными кислотами
Слайд 77: Диамины
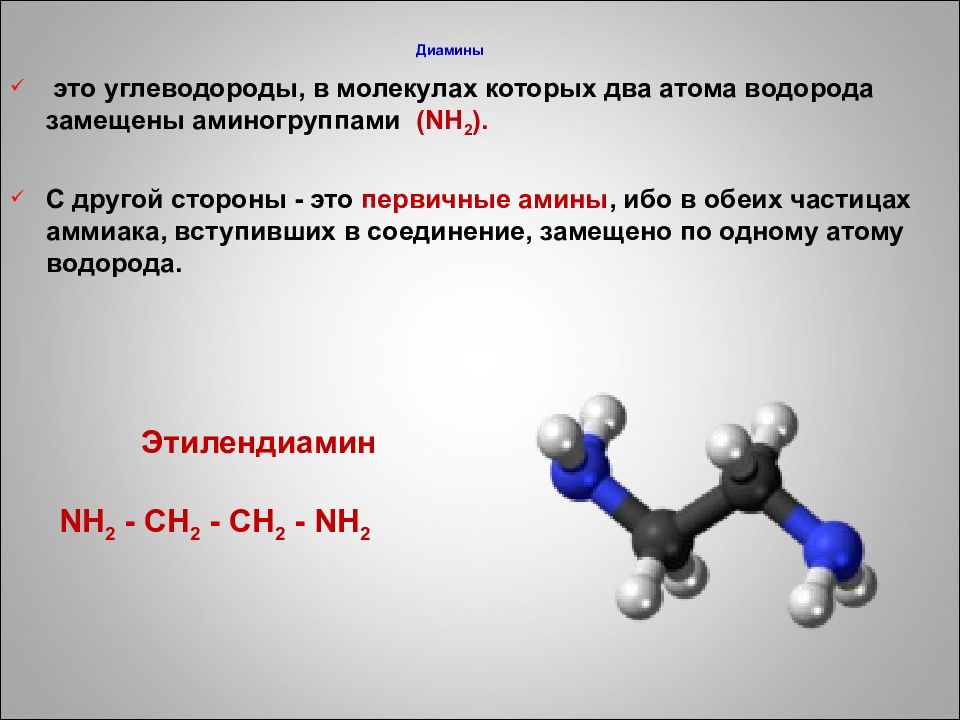
это углеводороды, в молекулах которых два атома водорода замещены аминогруппами ( N Н 2 ). С другой стороны - это первичные амины, ибо в обеих частицах аммиака, вступивших в соединение, замещено по одному атому водорода. Этилендиамин N H 2 - CH 2 - CH 2 - NH 2
Слайд 78: Путресцин H 2 N(CH 2 ) 4 NH 2
(1,4-диаминобутан или 1,4-тетраметилендиамин) Путресцин образуется при гниении белков из орнитина (диаминокарбоновая кислота): NH 2 -(CH 2 ) 3 -CH(COOH)-NH 2 → NH 2 -(CH 2 ) 4 -NH 2 + CO 2 ↑ орнитин путресцин Путресцин находится в моче при цистинурии и образуется при гниении мяса (в трупах, вместе с кадаверином) и рыбы (сельди). Искусственно получается всеми общими способами образования диаминов.
Слайд 79: Путресцин H 2 N(CH 2 ) 4 NH 2
Образуется в толстой кишке при ферментативном декарбоксилировании. Путресцин принимает активное участие в нормальном росте клеток, их дальнейшей дифференциации.
Слайд 80: Кадаверин
(1,5-диаминопентан или α-,ε- пентаметилендиамин) от лат. cadaver — «труп». Содержится в продуктах гнилостного распада белков; образуется из лизина при его ферментативном декарбоксилировании: NH 2 -(CH 2 ) 4 -CH(COOH)-NH 2 → NH 2 -(CH 2 ) 5 -NH 2 + CO 2 ↑ лизин кадаверин Кадаверин обладает неприятным запахом и принадлежит к группе птомаминов (трупных ядов), однако ядовитость кадаверина относительно невелика. Птоамины – от греч. ptoma — «труп», группа азотсодержащих химических соединений, образующихся при гнилостном разложении, с участием микроорганизмов, белков мяса, рыбы, дрожжей и пр. 80
Слайд 81: Алкалоиды
Гетероциклические, азотсодержащие основания растительного происхождения. Как правило представляют собой третичные амины ! Содержатся в растениях в виде солей органических кислот – лимонной, яблочной, щавелевой Эфедрин Кониин
Слайд 82: Эфедрин Алкалоид, содержащийся в различных видах растений рода эфедра, C 6 H 5 CH (OH) CH (NHCH 3 ) CH 3. Впервые выделен в 1887. По действию близок к адреналину. Возбуждает центральную нервную систему
Слайд 83: Кониин
Яд, выделенный из болиголова: этим веществом был отравлен Сократ.
Слайд 84: Никотин
Алкалоид, содержится, главным образом, в листьях и семенах различных видов табака и является жидкостью с неприятным запахом и жгучим вкусо м. Никотин
Слайд 85
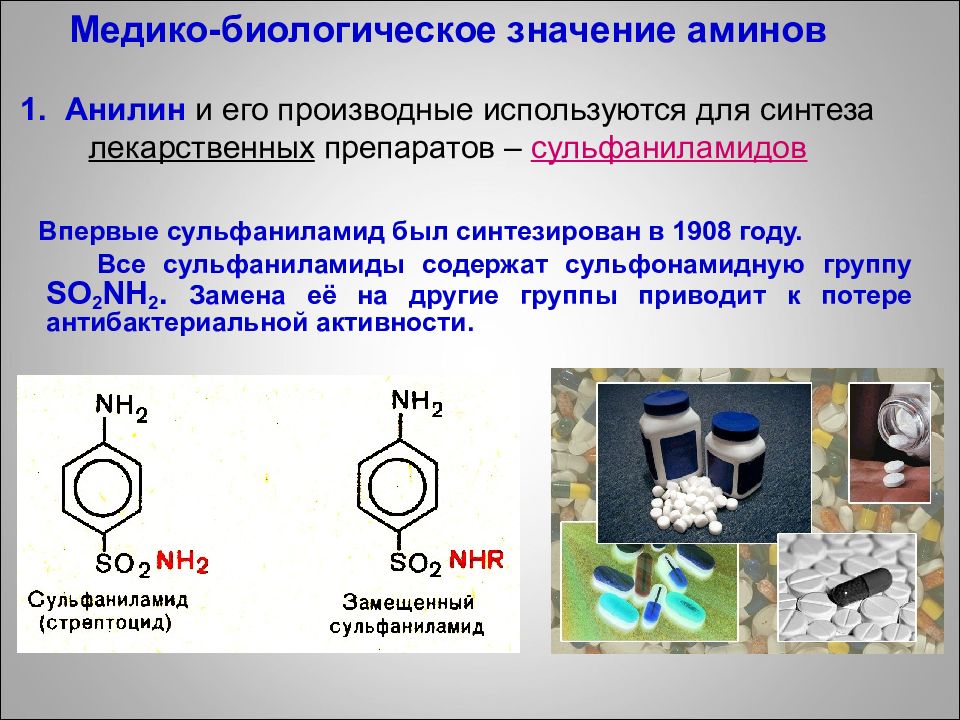
Впервые сульфаниламид был синтезирован в 1908 году. Все сульфаниламиды содержат сульфонамидную группу SO 2 NH 2. Замена её на другие группы приводит к потере антибактериальной активности. Медико-биологическое значение аминов 1. Анилин и его производные используются для синтеза лекарственных препаратов – сульфаниламидов
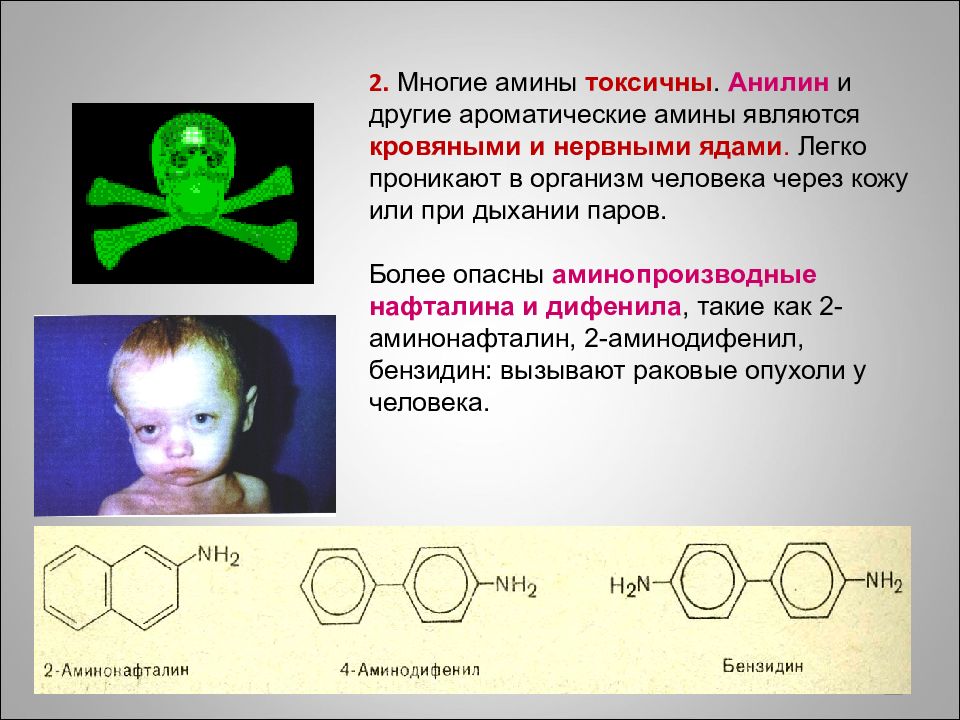
Слайд 86: 2. Многие амины токсичны. Анилин и другие ароматические амины являются кровяными и нервными ядами. Легко проникают в организм человека через кожу или при дыхании паров. Более опасны аминопроизводные нафталина и дифенила, такие как 2-аминонафталин, 2-аминодифенил, бензидин : вызывают раковые опухоли у человека
86
Слайд 87
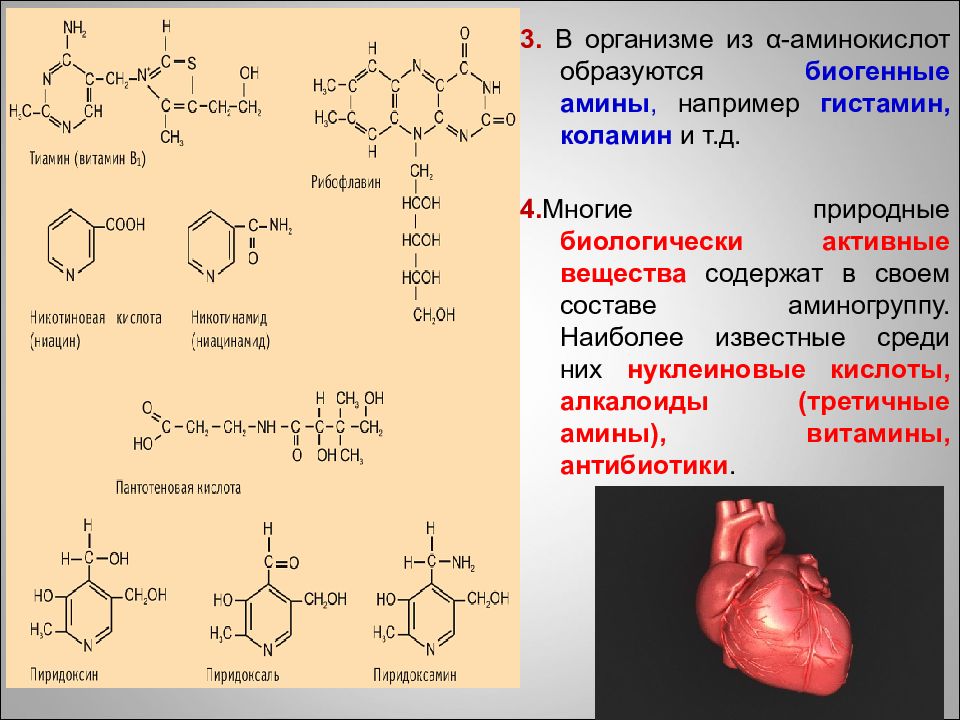
3. В организме из α - аминокислот образуются биогенные амины, например гистамин, коламин и т.д. 4. Многие природные биологически активные вещества содержат в своем составе аминогруппу. Наиболее известные среди них нуклеиновые кислоты, алкалоиды (третичные амины), витамины, антибиотики. 87
Слайд 89: Аминоспирты
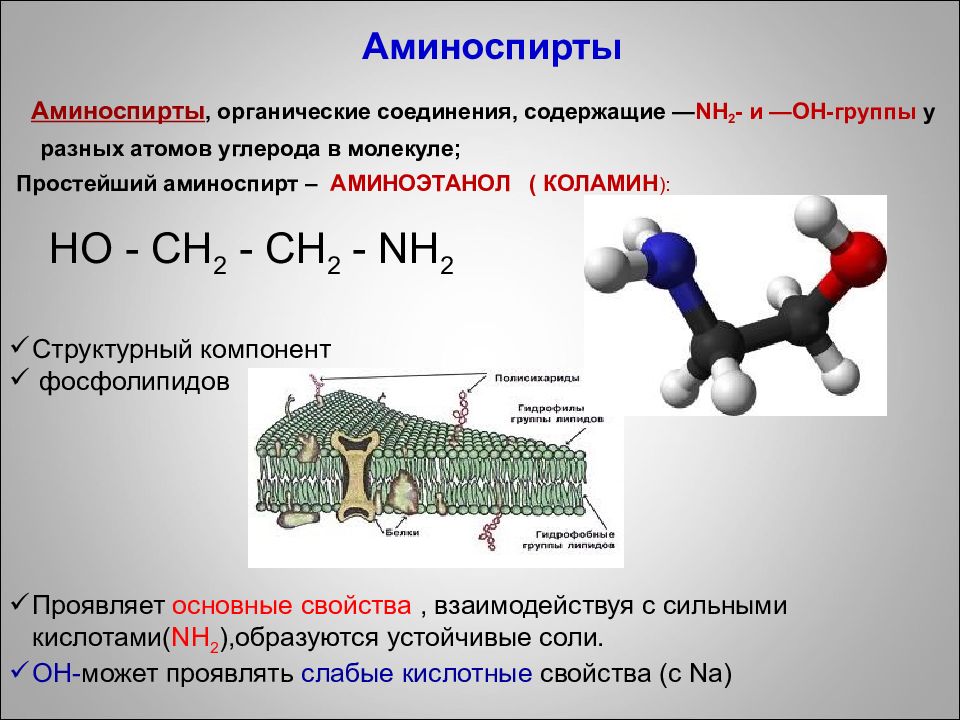
C труктурный компонент фосфолипидов Проявляет основные свойства, взаимодействуя с сильными кислотами( NH 2 ),образуются устойчивые соли. ОН- может проявлять слабые кислотные свойства (с Na ) Аминоспирты Аминоспирты, органические соединения, содержащие — NH 2 - и — ОН-группы у разных атомов углерода в молекуле; Простейший аминоспирт – АМИНОЭТАНОЛ ( КОЛАМИН ): HO - CH 2 - CH 2 - NH 2
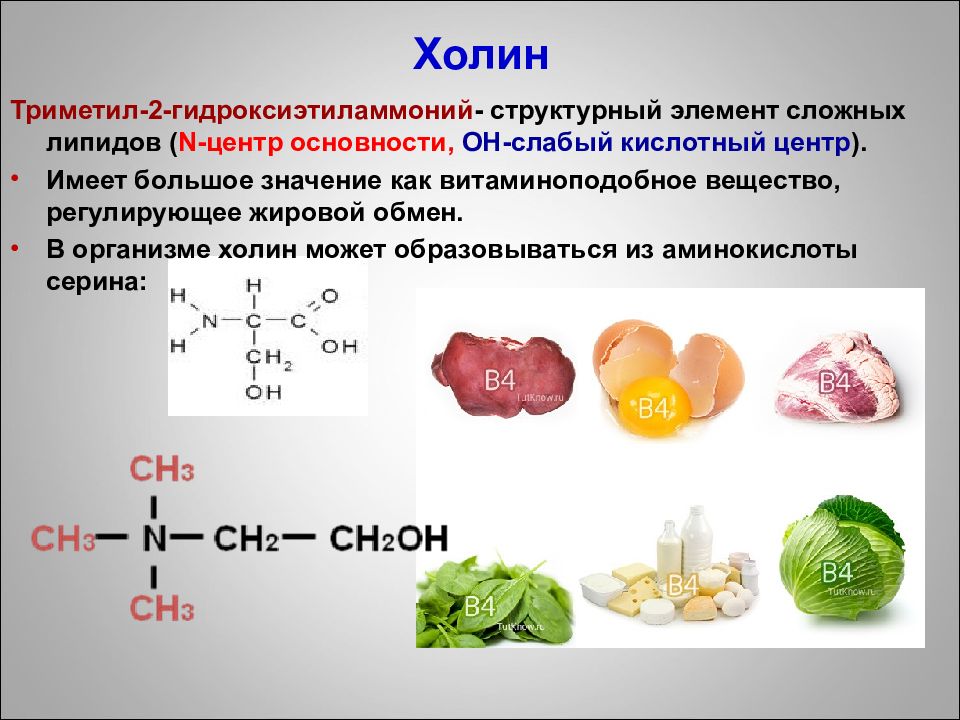
Слайд 90: Холин
Триметил-2-гидроксиэтиламмоний - структурный элемент сложных липидов ( N -центр основности, ОН-слабый кислотный центр ). Имеет большое значение как витаминоподобное вещество, регулирующее жировой обмен. В организме холин может образовываться из аминокислоты серина:
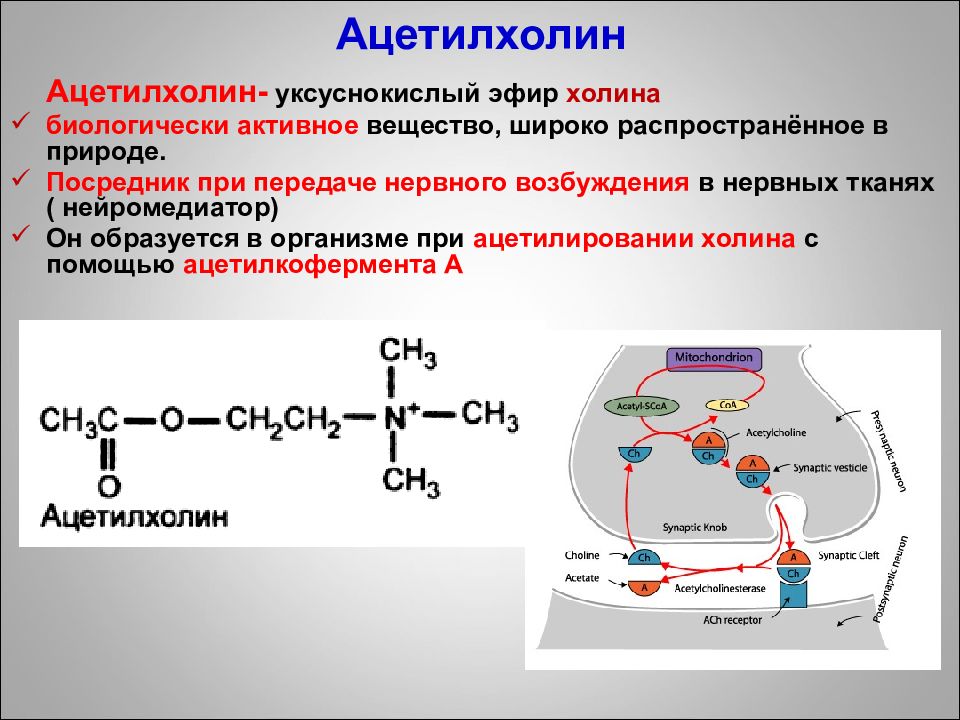
Слайд 91: Ацетилхолин
Ацетилхолин- уксуснокислый эфир холина биологически активное вещество, широко распространённое в природе. Посредник при передаче нервного возбуждения в нервных тканях ( нейромедиатор) Он образуется в организме при ацетилировании холина с помощью ацетилкофермента А
Слайд 92
Аминофенолы, содержащие остаток пирокатехина, называются катехоламины и играют важную роль в организме (содержат основный центр NH 2 или NHR и ОН – кислотный). Катехоламины – биогенные амины, т.е. образующиеся в организме в результате процессов метаболизма. К ним относятся: Дофамин Норадреналин Адреналин норадреналин дофамин адреналин Аминофенолы
Слайд 93: Катехоламины
Катехоламины, производные пирокатехина, активно участвуют в физиологических и биохимических процессах. Катехоламины – гормоны мозгового слоя надпочечников и медиаторы нервной системы, Они отражают и определяют состояние симпатического отдела вегетативной нервной системы, Играют важную роль в нейрогуморальной регуляции и нервной трофике.
Слайд 94: НОРАДРЕНАЛИН
Главным образом важна его роль именно как нейромедиатора. Синоним: норэпинефрин. По действию на сердце, кровеносные сосуды, гладкие мышцы, а также на углеводный обмен Н. обладает свойствами гормона и близок к своему N-метильному производному — адреналину. Концентрация норадреналина в крови, органах и выделениях организма позволяет судить о состоянии ( тонусе и реактивности) симпатической нервной системы. применение в медицинской практике: при падении кровяного давления, при коллапсе, шоке, кровопотерях и т. д.
Последний слайд презентации: Теории кислотности и основности 1. Льюиса (1923) – теория электронных: Дофамин
Дофамин [ 3,4-диоксифенилэтиламин, окситирамин, C 6 H 3 (OH) 2 CH 2 CH 2 (NH 2 ) ] – промежуточный продукт биосинтеза катехоламинов, образующийся в результате декарбоксилирования диоксифенилаланина ( ДОФА ). Дофамин (ДОФА) – важнейший нейромедиатор, участвующий в так называемой «системе награды». Когда мы делаем что-то хорошее в мозге выделяется дофамин, что и создаёт ощущение удовольствия Ряд органов и тканей (печень, лёгкие, кишечник и др.) содержат преимущественно дофамин. Наряду с адреналином и норадреналином дофамин. в небольших количествах секретируется надпочечниками.