Слайд 2
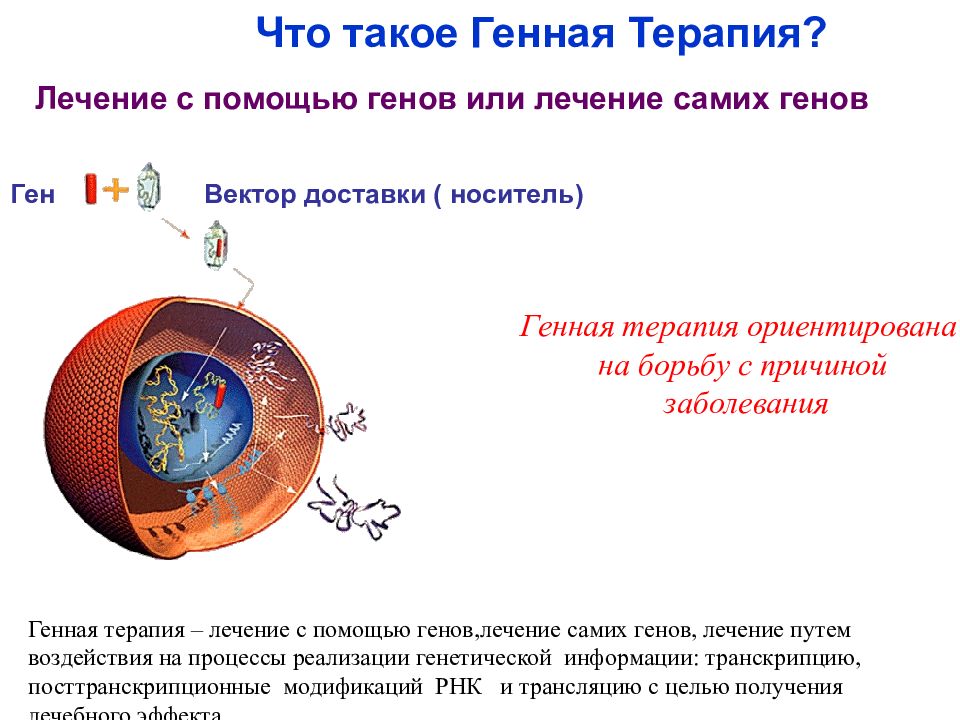
Вектор доставки ( носитель) Ген Генная терапия – лечение с помощью генов, лечение самих генов, лечение путем воздействия на процессы реализации генетической информации : транскрипцию, посттранскрипционные модификаций РНК и трансляцию с целью получения лечебного эффекта. Что такое Генная Терапия? Генная терапия ориентирована на борьбу с причиной заболевания Лечение с помощью генов или лечение самих генов
1976 - дефицит аргиназы - вирус папилломы Шоупа (Rogers,1976) 1980 - талассемия -бета Hb - ген (Klein 198 0 ) 1990 - меланома - Rv vector ex vivo ( клеточное маркирование) ( Rosenberg 1990) 1970 -1990 заложены основы генной терапии
Слайд 4
2- й этап 1990 -2003. Первые успехи клинических испытаний и трагические инциденты в ходе клинических испытаний. 1990 - дефицит аденозин-дезаминазы - ex vivo, лимфоциты (B laese,1990) 14 сентября 1990 года 4-летней Ашанти Де Силва, страдающей наследственным иммунодефицитом, были пересажены ее собственные Т-лимфоциты, предварительно трансформированные ex vivo геном аденозиндезаминазы. 1992 - семейная гиперхолестеринемия (Grossman 1994) 1991 - муковисцидоз, ген CFTR (Сr y stal et al.,1991) 1993 - глиобластома (интерлейкин) ( Sobol 1996) 1999 - Терри Гельсингер - первая смерть вследствие ГТ На 2-й день после печеночной инфузии аденовирусной конструкции у больного с наследственным дефицитом печеночного фермента орнитинтранскарбамилазы признаки анафилактического шока Смерть на 4-й день явилась следствием введения генетической конструкции. 200 2 - 6 случа ев лейкемии при ГТ иммунодефицита ( rv-vector,LMO2) X-linked SCID - врожденный иммунодефицит*, характеризующийся отсутствием В и Т-лимфоцитов и приводящий к смертельному исходу в первые годы жизни. Ретровирусный вектор интегрировал в проксимальную часть протоонкогена LMO-2 и Активировал пролиферативную активность Т-лимфоцитов. Через 30 месяцев развилась Т-клеточная лейкемия. Основные этапы становления генной терапии Этап -2
Слайд 5
3-й этап 2003 по наст.время Масштабный переход наиболее удачных лабораторных разработок к стадии клинических испытаний 2003 - первое “ генное лекарство “ Gendicine™ 2006 - разрешение FDA на проведение генной терапии плода Основные этапы становления генной терапии Этап-3
Слайд 6: Предпосылки для работ по ГТ
Информация о первичном биохимическом дефекте Выбор стратегии Генной Терапии (мутация, генная сеть) Наличие необходимого гена (генов), кДНК Генно-инженерная кухня (плазмиды, промоторы, маркерные и терапевтические гены) Выбор вектора и способов доставки Эффективная система детекции экспрессии трансгена Адекватная оценка терапевтического эффекта Этапность тестирования в ГТ Опыты in vitro (культуры клеток) Опыты in vivo ( биологические модели - мыши) Опыты in vivo ( биологические модели - собаки, свиньи, приматы) Клинические испытания 1-2-3 фазы
Слайд 7
Фазы клинических испытаний. 1фаза. Анализ безопасности введения генетических конструкций на отдельных пациентах. 2фаза. Увеличение числа пациентов и оценка терапевтического эффекта введенных генных конструкций. 3 фаза. Дальнейшее увеличение числа пациентов. Проведение испытаний в нескольких независимых клиниках. Оценка терапевтического эффекта, оптимизация доз вводимых генных конструкций. Подготовка протоколов к утверждению.
Слайд 8
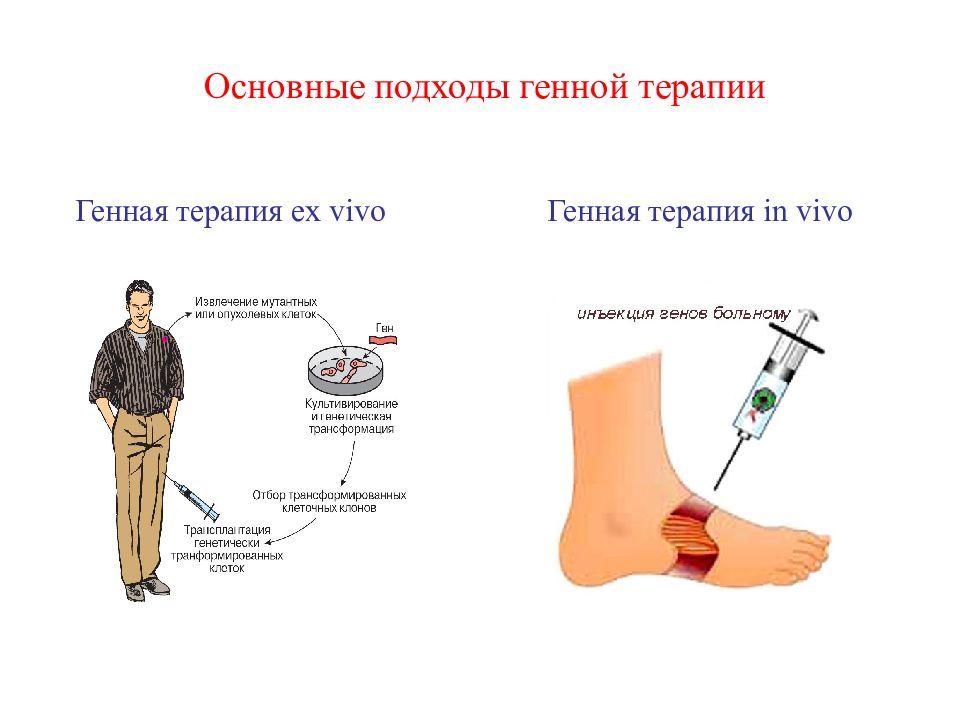
Основные подходы генной терапии Генная терапия in vivo Генная терапия ex vivo
Слайд 9: ПРЕИМУЩЕСТВА ГЕННОЙ ТЕРАПИИ (ГТ) ПЛОДА
Фетальная ГТ позволяет: Начать лечение в досимптоматическую фазу заболевания Избежать иммунного ответа при введении генных конструкций на 12-20 неделях беременности Достичь более высокой (терапевтической) концентрации трансгена - клетки С большей эффективностью трансфецировать стволовые клетки
Слайд 10
Одна из ключевых проблем генной терапии – эффективная доставка генетической конструкции в клетки пациента "организм человека затратил много тысяч лет, чтоб защитить себя от нападения факторов внешней среды, в т.ч. от чужеродной ДНК, пытавшейся проникнуть в его геном" Фрэнч Андерсона
Слайд 11
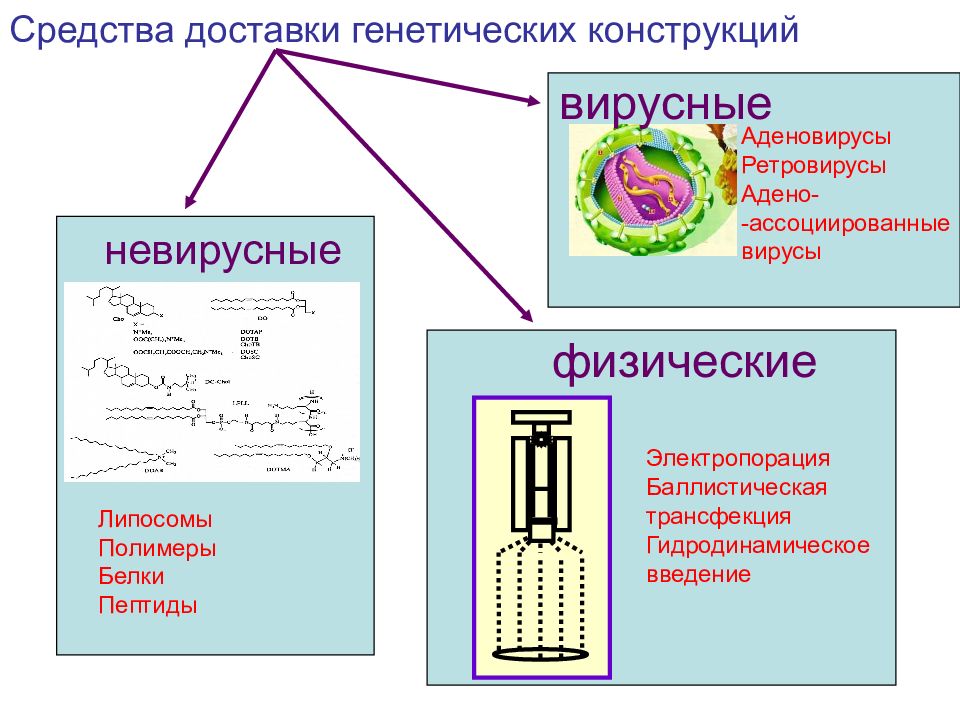
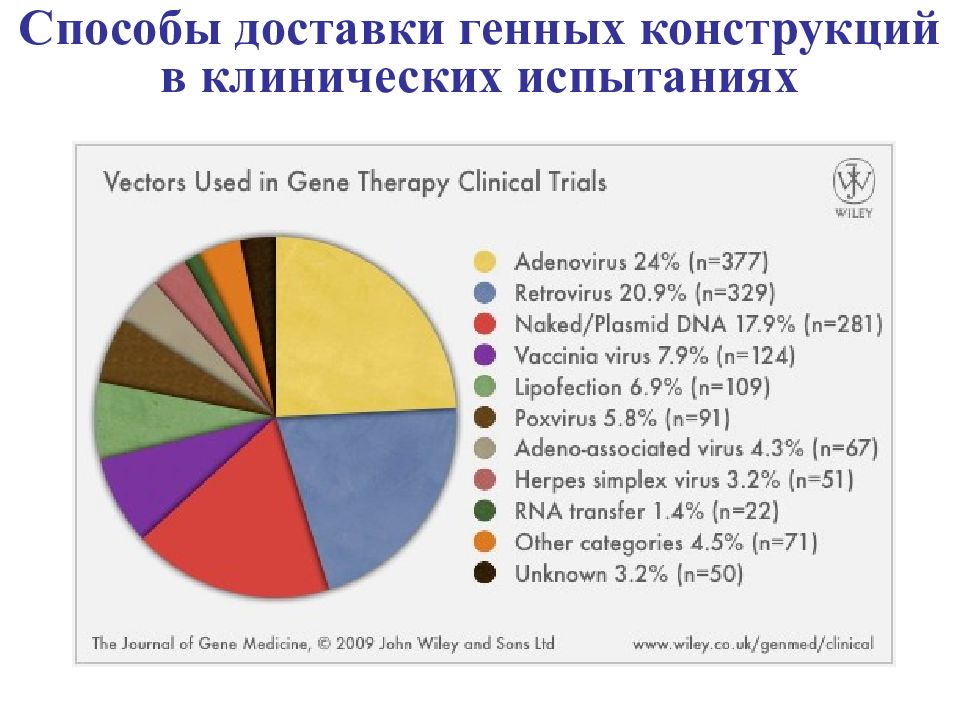
Средства доставки генетических конструкций Липосомы Полимеры Белки Пептиды физические Электропорация Баллистическая трансфекция Гидродинамическое введение вирусные Аденовирусы Ретровирусы Адено- -ассоциированные вирусы невирусные
Слайд 12
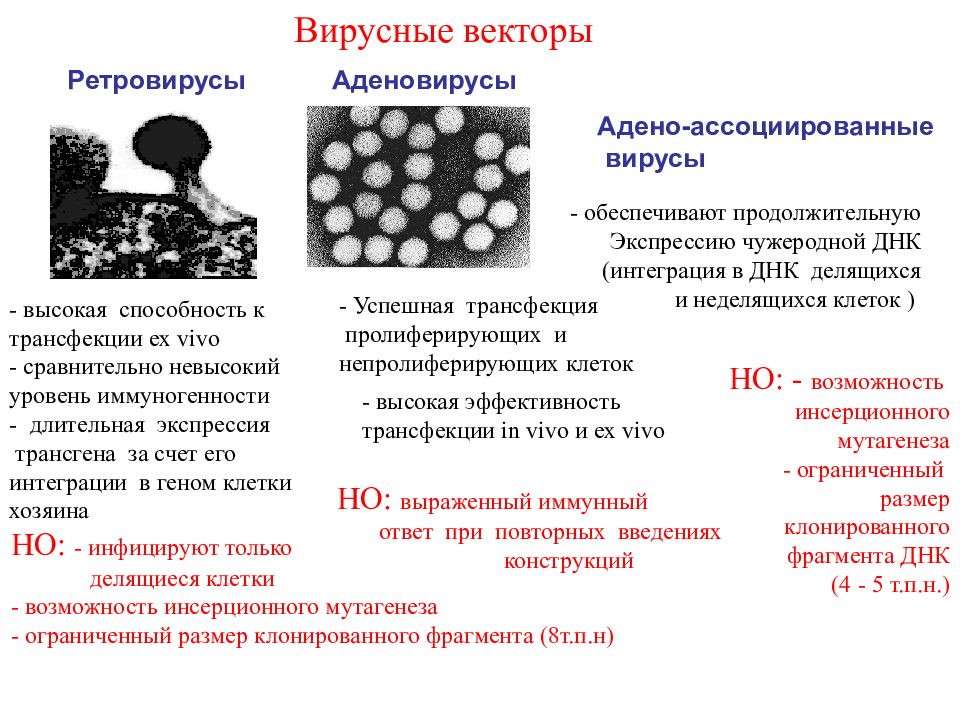
Ретровирусы Аденовирусы - высокая способность к трансфекции ex vivo - сравнительно невысокий уровень иммуногенности - длительная экспрессия трансгена за счет его интеграции в геном клетки хозяина НО : - инфицируют только делящиеся клетки - возможность инсерционного мутагенеза - ограниченный размер клонированного фрагмента (8т.п.н) - Успешная трансфекция пролиферирующих и непролиферирующих клеток - высокая эффективность трансфекции in vivo и ex vivo НО: выраженный иммунный ответ при повторных введениях конструкций Адено-ассоциированные вирусы - обеспечивают продолжительную Экспрессию чужеродной ДНК (интеграция в ДНК делящихся и неделящихся клеток ) НО : - возможность инсерционного мутагенеза - ограниченный размер клонированного фрагмента ДНК (4 - 5 т.п.н.) Вирусные векторы
Слайд 13
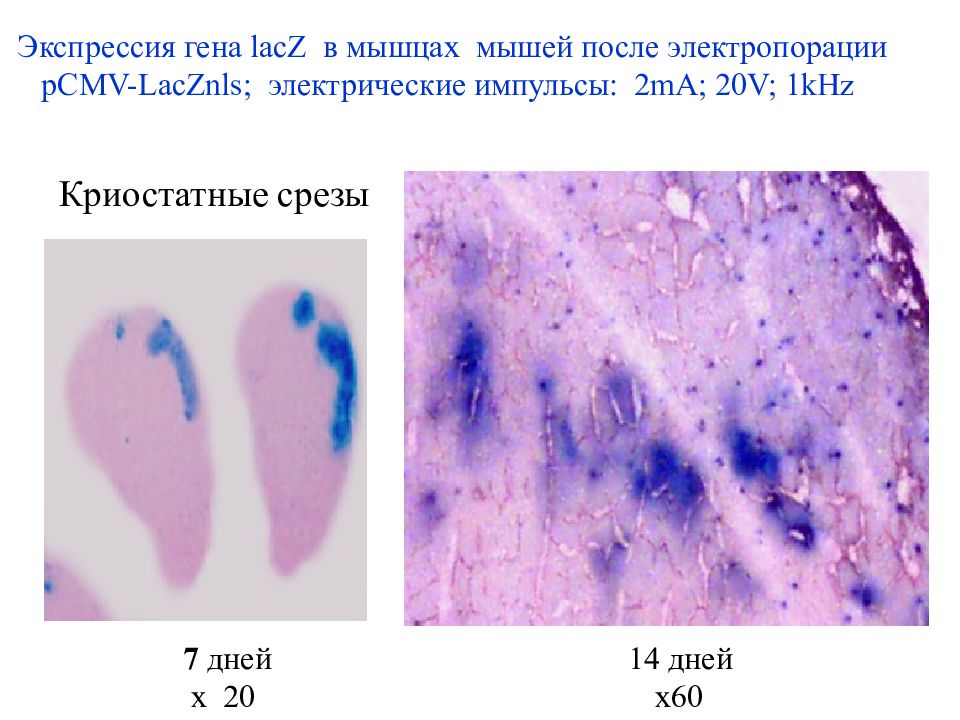
Доставка генных конструкций методом электропорации разрез кожи инъекция генетической конструкции в мышцу наложение электродов и проведение электропорации Экспрессия маркерного гена lacZ в ядрах мышечных волокон Физические способы доставки генетических конструкций Эффективность трансфекции зависит от дозы плазмидной ДНК, силы тока и числа импульсов.
Слайд 14
Экспрессия гена lacZ в мышцах мышей после электропорации pCMV-LacZ nls ; электрические импульсы: 2mA; 20V; 1kHz 7 дней 14 дней x 20 x60 Криостатные срезы
Слайд 15
Преимущества невирусных способов доставки генных конструкций - легко синтезируются - отсутствуют ограничения на размер доставляемого вектора экспрессии. - невирусные носители трансфецируют клетки, находящиеся на любой фазе клеточного цикла - в большинстве случаев носители не вызывают специфического иммунного ответа - безопасны в применении in vivo по сравнению с вирусными векторами.
Слайд 18
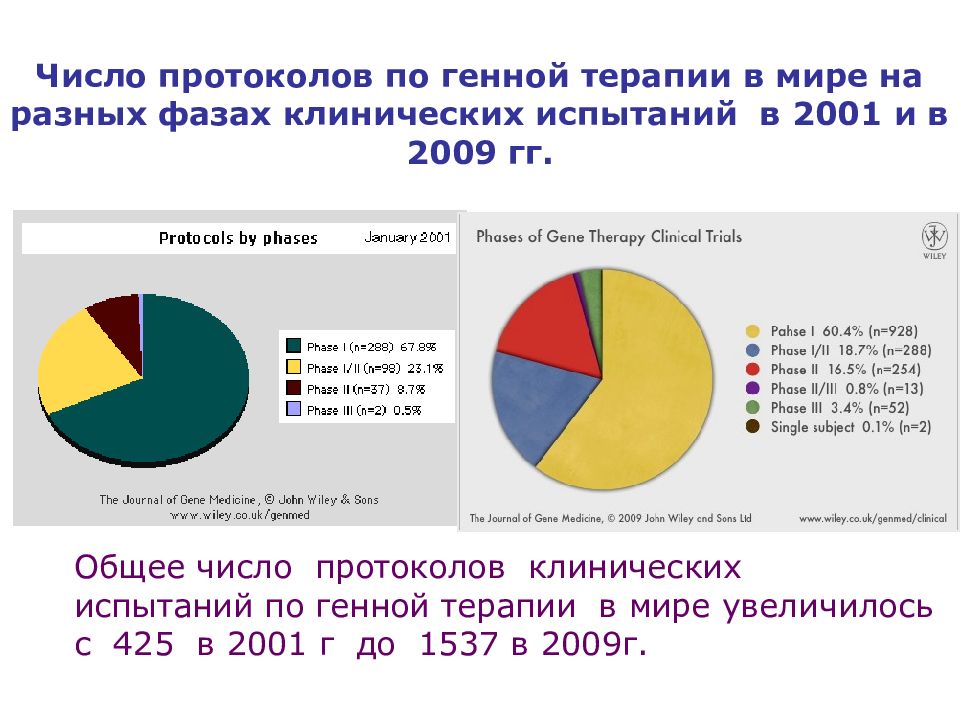
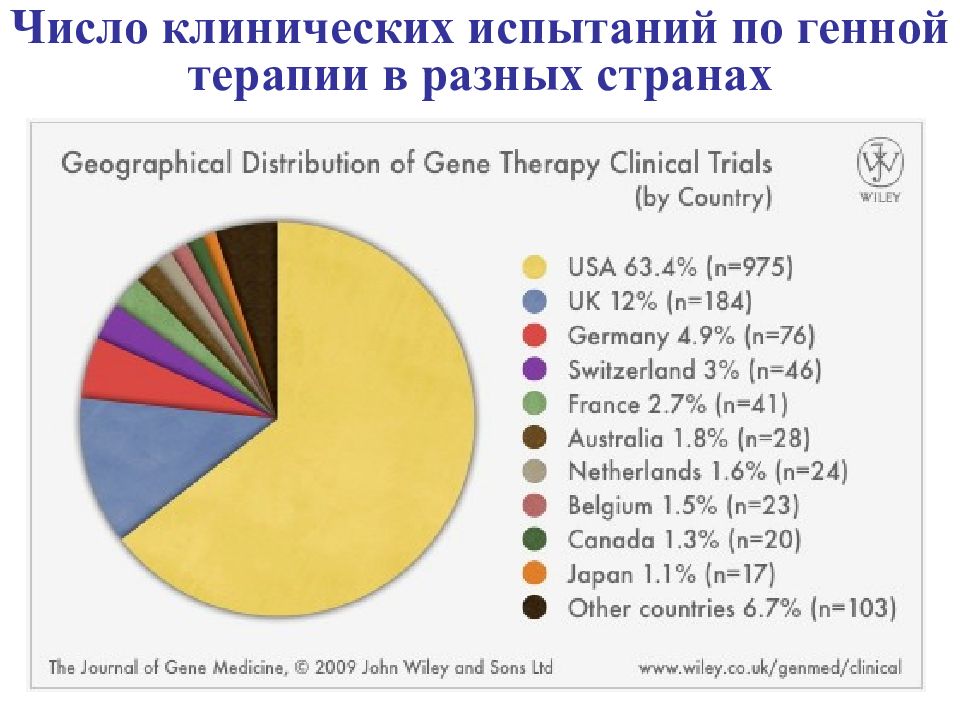
Общее число протоколов клинических испытаний по генной терапии в мире увеличилось с 425 в 2001 г до 1537 в 200 9 г. Число протоколов по генной терапии в мире на разных фазах клинических испытаний в 2001 и в 2009 гг.
Слайд 20
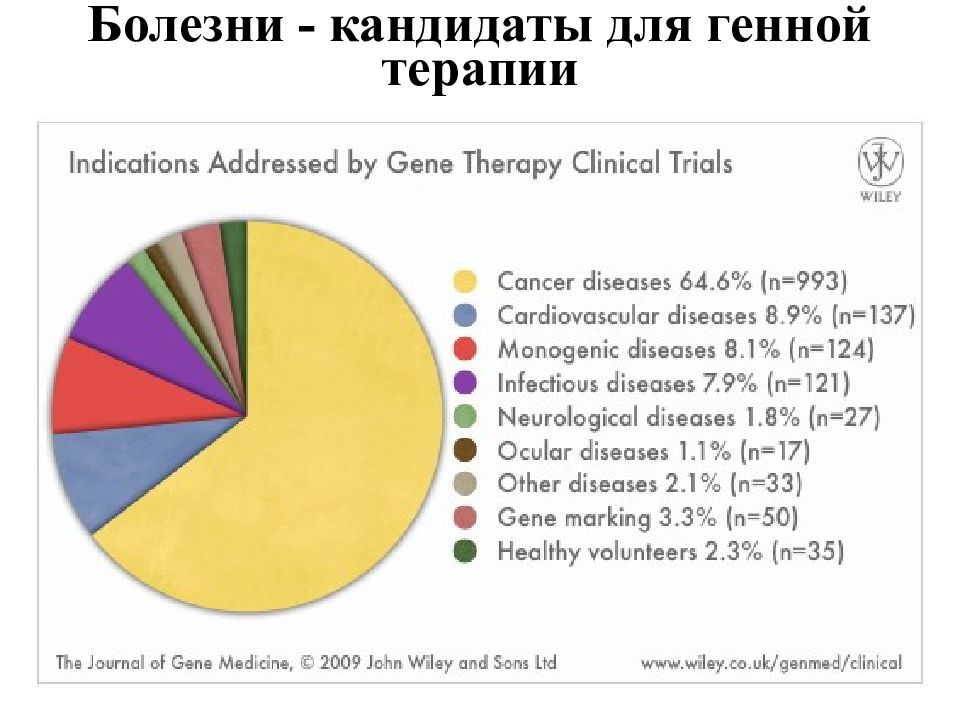
Всего около 2 000 лабораторий. Число публикаций по ГТ в 2008 г. в 3 раза больше, чем за 5 предшествующих лет. Национальный Институт Здоровья (США) выделил на ГТ в 200 4 г. 427,7 млн. $$. В 2009 г. > 1 500 официальных проектов по генной терапии. Разрешение FDA на генную терапию плода - февраль 2006 г. в России? 10 лабораторий - 3 клинических испытания (1 зарегистрировано). - боковой асмиотрофический склероз –Ин-т неврологии Москва облитерирующий эндартерит, инфаркт – Н.П.Бочков, Е.Д.Свердлов опухоли – Ин-т онкологии ((СПб), Ин-т биологии гена РАН (Москва) СМА – фармакогенетический вариант, вальпроевая к-та ИАГ им.Отта РАМН Много ли Генной Терапии в М ире ?
Слайд 22
Наследственные нервно-мышечные заболевания Наиболее распространенным наследственным нервно-мышечным заболеванием человека являются мышечная дистрофия Дюшенна и спинальная мышечная атрофия (СМА). Их частота составляет около 1:3000 новорожденных. Нервно-мышечные болезни затрагивают более чем 300 000 человек в Европе и еще приблизительно 2.2 миллиона пациентов во всем мире. Финансовый аспект. Стоимость комплексной диагностики и лечения нервно-мышечных заболеваний очень высока. Амбулаторная стоимость лечебных и реабилитационных мероприятий одного обездвиженного пациента с ДМД считается самой высокой среди всех болезней и оценивается в сумму между $400-500 000 в год. Актуальность проблемы лечения нервно-мышечных заболеваний
Слайд 23
Миодистрофия Дюшенна Наиболее частое сцепленное с полом наследственное заболевание человека Мутации в гене дистрофина являются первичным дефектом, обуславливающим нарушение целостности мембраны мышечных волокон. Мышечные клетки теряют способность поддерживать гомеостаз, дегенерируют и постепенно замещаются соединительной тканью, вызывая прогрессирующую мышечную слабость. Наиболее перспективный подход к лечению МДД – генная терапия Проблемы терапии миодистрофии Дюшенна Системность патологических процессов Затруднения в доставке генов или других активных агентов процессами соединительно- тканного замещения Большой размер гена и кДНК Высокая частота спонтанных мутаций ( до 30 процентов )
Слайд 24
коррекция дефекта путем введения нормальных копий кДНК гена Заместительная терапия коррекция мутаций на уровне гена или РН К- транскрипта активация генов препятствующих развитию патологических процессов Все вышеперечисленные стратегии лечения используются в настоящее время в клинических испытаниях по лечению наследственных НМЗ Итог первых 10 лет исследований – разработка и успешная апробация на животных моделях 3-х подходов к лечению МДД и других нервно- мышечных заболеваний. Начало исследований в области генной терапии наследственных нервно –мышечных болезней – 1992 г (Stratford-Pirrecaudet et al Widespread long-term gene transfer to mouse skeletal muscles and heart / J. Clin. Invest. – 1992 Коррекционная терапия Компенсационная терапия
Слайд 25
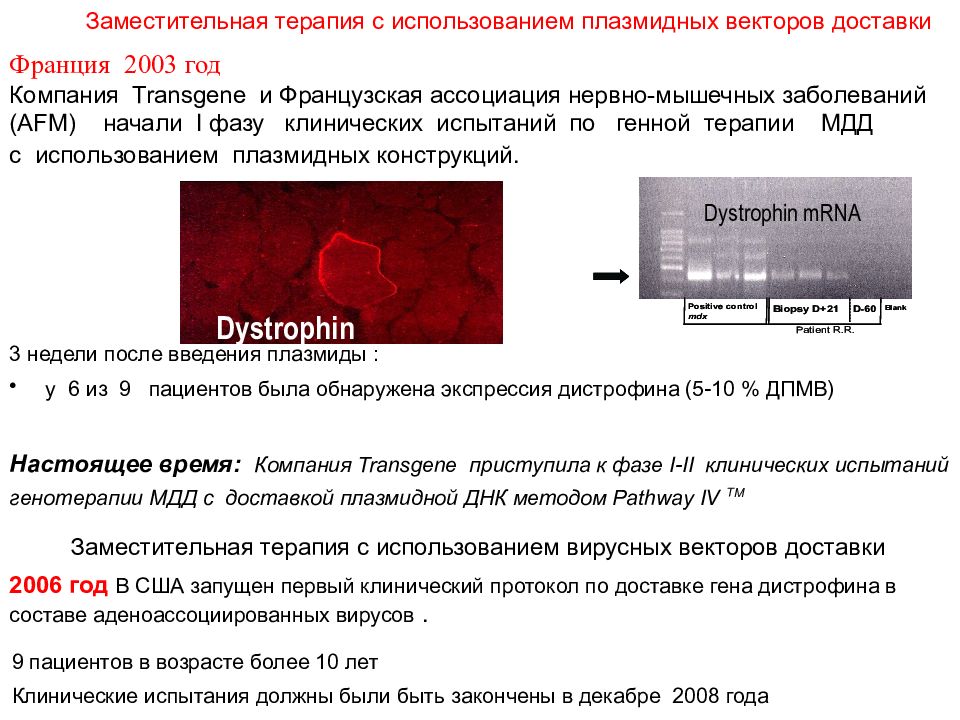
Заместительная терапия с использованием плазмидных векторов доставки Dystrophin Dystrophin mRNA Франция 2003 год Компания Transgene и Французская ассоциация нервно-мышечных заболеваний ( AFM) начали I фазу клинических испытаний по генной терапии МДД c использованием плазмидных конструкций. 3 недели после введения плазмиды : у 6 из 9 пациентов была обнаружена экспрессия дистрофина (5-10 % ДПМВ) Настоящее время : Компания Transgene приступила к фазе I - II клинических испытаний генотерапии МДД с доставкой плазмидной ДНК методом Pathway IV TM. 2006 год В США запущен первый клинический протокол по доставке гена дистрофина в составе аденоассоциированных вирусов. 9 пациентов в возрасте более 10 лет Клинические испытания должны были быть закончены в декабре 2008 года Заместительная терапия с использованием вирусных векторов доставки
Слайд 26
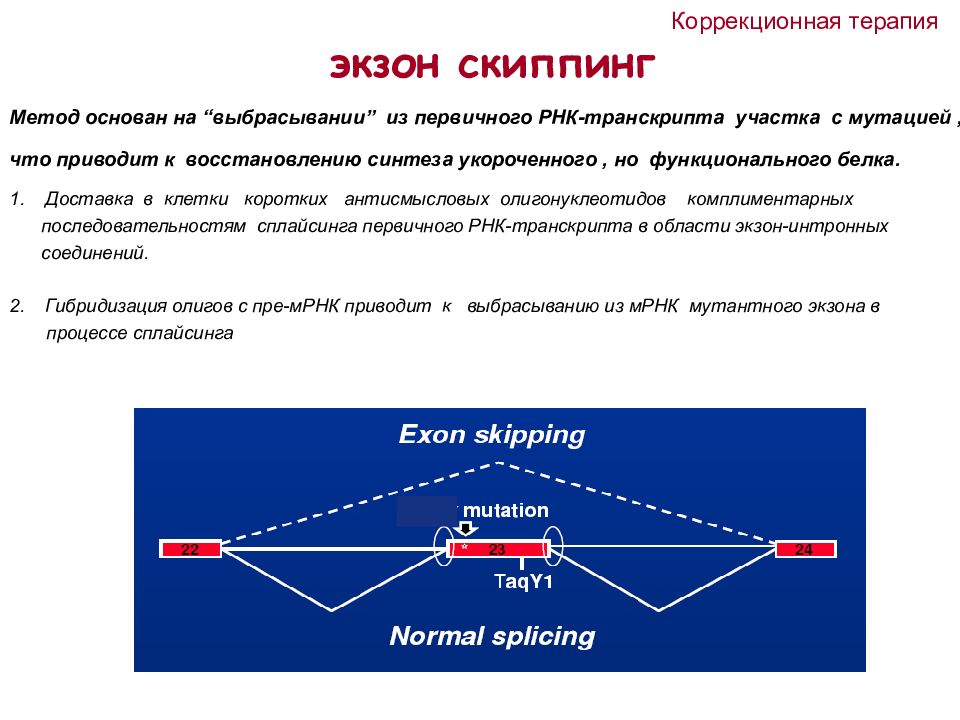
экзон скиппинг Метод основан на “ выбрасывании ” из первичного РНК-транскрипта участка с мутацией, что приводит к восстановлению синтеза укороченного, но функционального белка. Доставка в клетки коротких антисмысловых олигонуклеотидов комплиментарных последовательностям сплайсинга первичного РНК-транскрипта в области экзон-интронных соединений. Гибридизация олигов с пре-мРНК приводит к выбрасыванию из мРНК мутантного экзона в процессе сплайсинга Коррекционная терапия
Слайд 27
2006-2007 год Нидерланды ; 2007 год Великобритания 1-я фаза клинических испытаний по лечению МДД с использованием антисенс олигонуклеотидов. 4 и 9 пациентов в возрасте 10-14 лет. Изучение безопасности введения и эффективности удаления экзона 51 после в / м введения АСО. Для всех пациентов показано возобновление синтеза дистрофина в пораженных мышцах 2009 год Клинические испытания по лечению МДД с использованием антисенс олигонуклеотидов Только данная система олигонуклеотидов адаптированная для удаления несущего мутации экзона 51 может помочь в лечении около 17 % пациентов с МДД !!! Всего данный метод может быть использован для лечения до 85% пациентов с МДД !!! Ведется подготовка клинических испытаний с использованием экзон скиппинга по лечению миотонической дистрофии, спинной мускульной атрофии, и болезни Хантингтона, Результаты предклинических испытаний : высокая эффективность метода !!!!!!! После семи инъекций олигонуклеотидов во всех мышцах скелетной мускулатуры в диафрагме мышей mdx регистрировалось более 70% клеток с экспрессией дистрофина.
Слайд 28
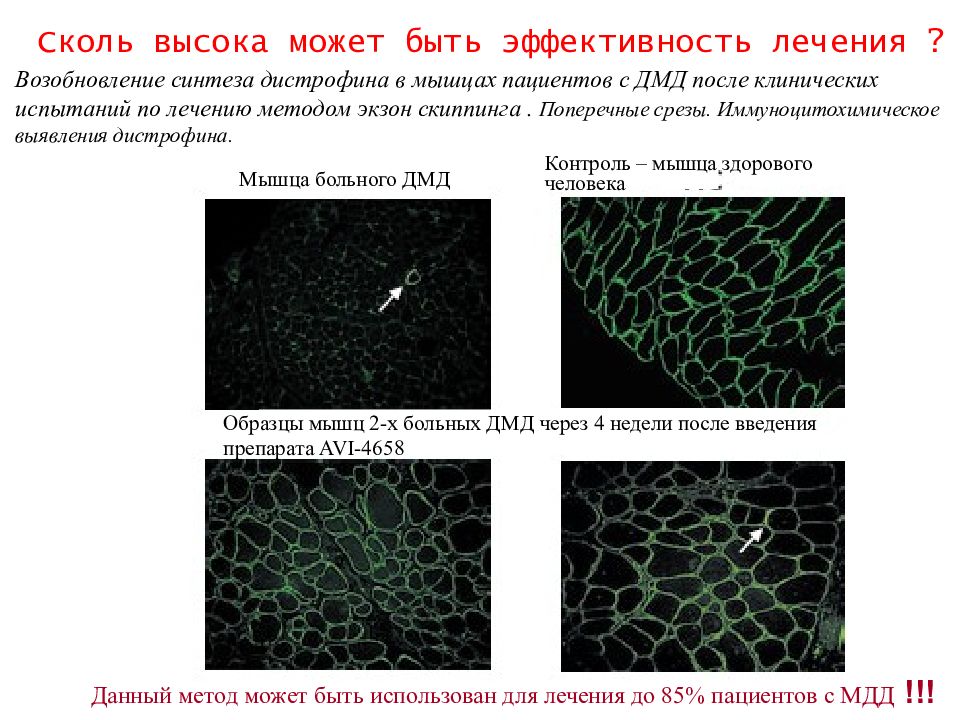
Возобновление синтеза дистрофина в мышцах пациентов с ДМД после клинических испытаний по лечению методом экзон скиппинга. Поперечные срезы. Иммуноцитохимическое выявления дистрофина. Мышца больного ДМД Контроль – мышца здорового человека Образцы мышц 2-х больных ДМД через 4 недели после введения препарата AVI -4658 Данный метод может быть использован для лечения до 85% пациентов с МДД !!! Сколь высока может быть эффективность лечения ?
Слайд 29
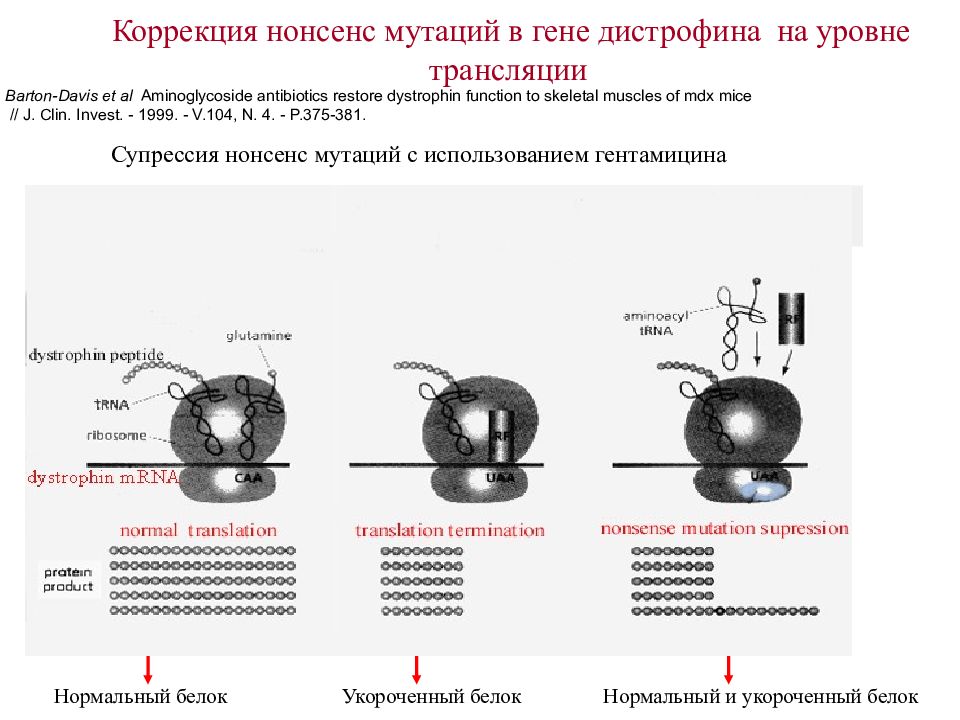
Коррекция нонсенс мутаций в гене дистрофина на уровне трансляции Barton-Davis et al Aminoglycoside antibiotics restore dystrophin function to skeletal muscles of mdx mice // J. Clin. Invest. - 1999. - V.104, N. 4. - P.375- 3 81. (stop codon UAG) UAA CAA UAA Нормальный белок Укороченный белок Нормальный и укороченный белок (p remature stop codon UAA) (p remature stop codon UAA) A. wild type B. mutant C. mutant in the presence of gentamicin Супрессия нонсенс мутаций с использованием гентамицина
Слайд 30
Компания PTC Therapeutics Скрининг 590 000 кандидатных соединений 4 из которых обладали выраженным эффектом. Наибольшая эффективность - PTC124 2006- 2007 г. Фаза 2 клинических испытаний по супрессии нонсенс мутаций с использованием препарата PTC124. Дизайн : 26 пациентов в возрасте 9 и 10 лет Прием различных доз PTC124 перорально 28 дней дважды в день Коррекция нонсенс мутаций на уровне трансляции. Результаты исследований (2007 г ) : Уровень маркерных белков поврежденных мышечных волокон, в результате терапии PTC124 значительно снижался. У некоторых пациентов было отмечено улучшение функционального состояния мышц. У всех пациентов показано дозо- зависимое увеличение синтеза дистрофина. Отмечена хорошая переносимость препарата и отсутствие побочных эффектов.
Слайд 31
Февраль 2009 Старт испытаний препарата PTC124 фазы 2b Для участия отобраны 165 пациентов с МДД В испытания вовлечены 14 стран ЕС, США, Канада 2010г - возможно привлечение пациентов РФ Ближайшие перспективы PTC124
Слайд 32
Компенсационная терапия МДД Активация гомологов дистрофина или других генов препятствующих развитию патологических изменений мышечных клеток
Слайд 33
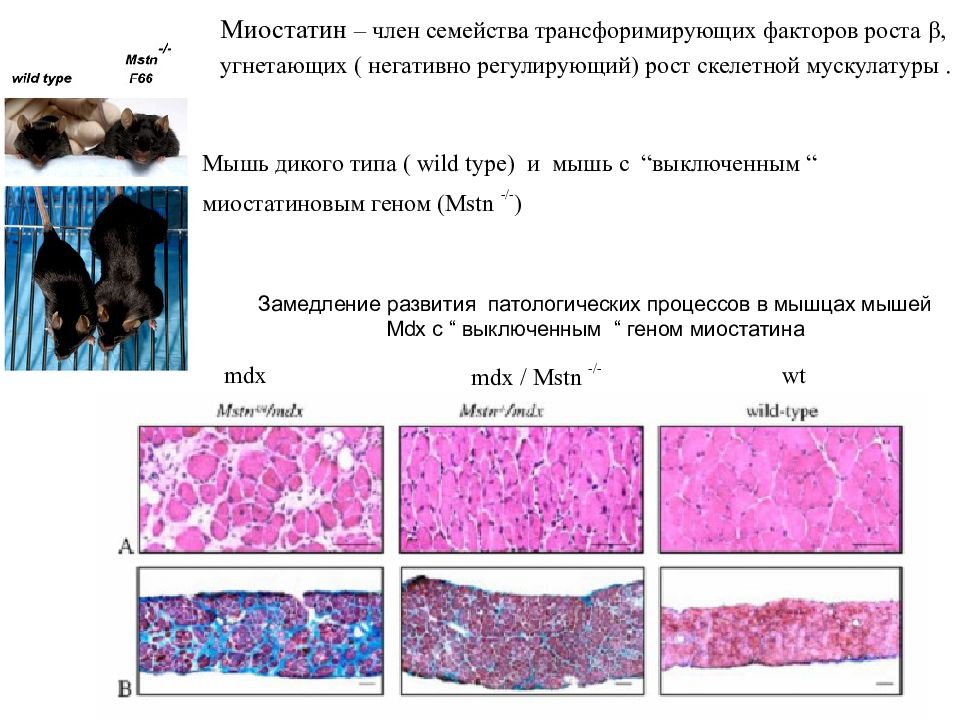
Миостатин – член семейства трансфоримирующих факторов роста β, угнетающих ( негативно регулирующий) рост скелетной мускулатуры. Мышь дикого типа ( wild type) и мышь с “ выключенным “ миостатиновым геном ( Mstn -/- ) mdx mdx / Mstn -/- wt Замедление развития патологических процессов в мышцах мышей Mdx с “ выключенным “ геном миостатина
Слайд 35
Nature Medicine - 12, 1147 - 1150 (2006) 8 институтов Италии и США 18 авторов Резюме : Показано, что внутрибрюшинные инъекции антибиотика Трихостатина А, мышам с мутациями а генах дистрофина или альфа саркогликана подавляют экспрессию миостатина. Результатом явилось восстановление мышечной массы, и предотвращение развития патологических процессов характерных для мышечных дистрофий.
Слайд 36
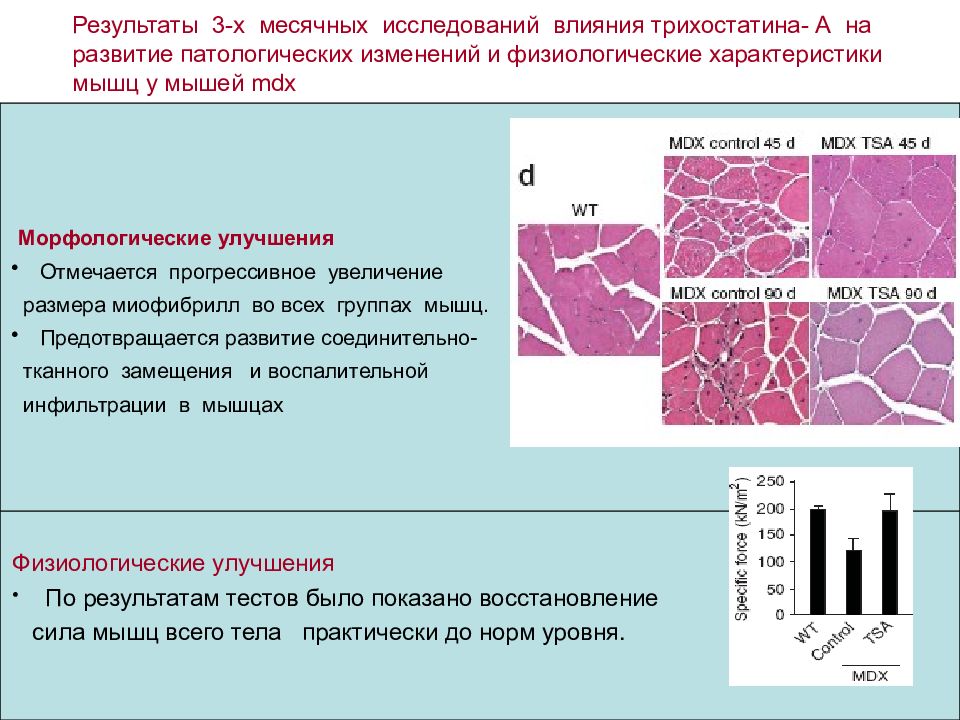
Результаты 3-х месячных исследований влияния трихостатина- А на развитие патологических изменений и физиологические характеристики мышц у мышей mdx Морфологические улучшения Отмечается прогрессивное увеличение размера миофибрилл во всех группах мышц. Предотвращается развитие соединительно- тканного замещения и воспалительной инфильтрации в мышцах Физиологические улучшения По результатам тестов было показано восстановление сила мышц всего тела практически до норм уровня.
Слайд 37
Спинальная мышечная атрофия - одно из наиболее частых наследственных нейромышечных заболеваний. Заболевание обусловлено гибелью моторных нейронов передних рогов спинного мозга. тип I - острая форма ( болезнь Верднига-Гоффмана) проявляется в первые шесть месяцев жизни и приводит к летальному исходу к двум годам. тип II - средняя (промежуточная) форма (болезнь Дубовича) с летальным исходом после 2-х лет. тип III - хроническая форма (болезнь Кугельберга-Веландер) Время манифестации заболевания колеблется от 2х до 17 лет.
Слайд 38
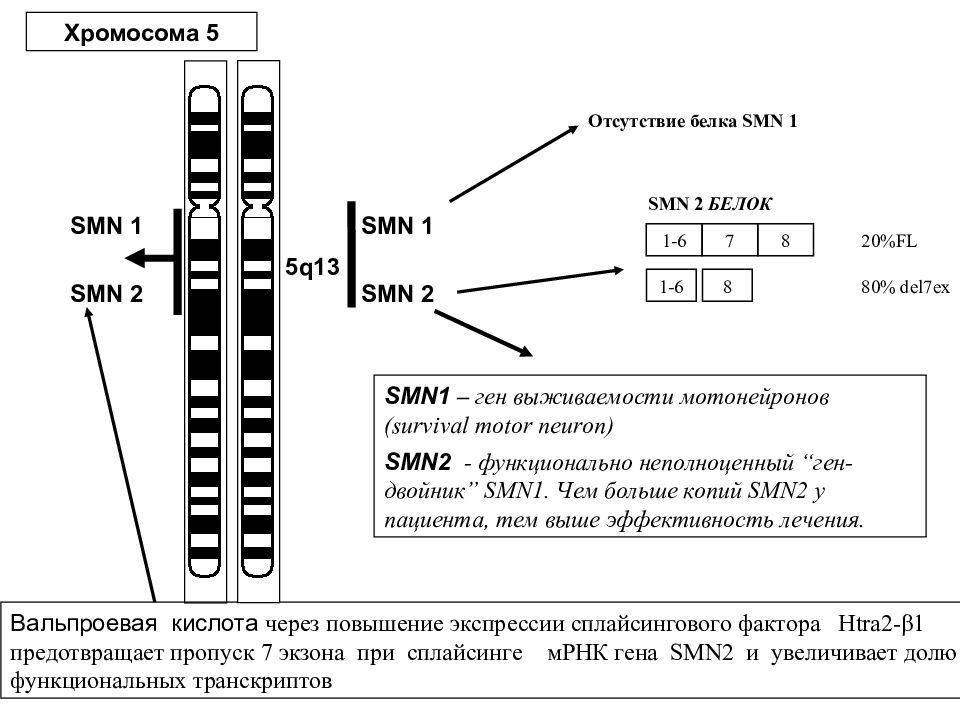
SMN 2 SMN 1 SMN 2 SMN 2 БЕЛОК Хромосома 5 SMN 1 Вальпроевая кислота через повышение экспрессии сплайсингового фактора Htra2-β1 предотвращает пропуск 7 экзона при сплайсинге мРНК гена SMN2 и увеличивает долю функциональных транскриптов 5q13 SMN1 – ген выживаемости мотонейронов (survival motor neuron) SMN2 - функционально неполноценный “ ген-двойник ” SMN1. Чем больше копий SMN 2 у пациента, тем выше эффективность лечения. 1-6 7 8 20%FL 1-6 8 80% del7 ex Отсутствие белка SMN 1
Слайд 39
Первая публикация российских авторов : ПЕРВЫЙ ОПЫТ ЛЕЧЕНИЯ БОЛЬНЫХ СПИНАЛЬНОЙ МЫШЕЧНОЙ АТРОФИЕЙ ПРЕПАРАТОМ ВАЛЬПРОЕВОЙ КИСЛОТЫ В.С. Баранов, В.Г. Вахарловский, В.Н. Команцев, О.С. Глотов, А.С. Глотов, А.В. Киселев МЕД. ГЕНЕТИКА 2005 Т.4,С.119-122. 2 больных, 9 и 15 лет. Конвулекса в течение 6 мес. Положительной динамики не выявлено. 9 больных, 2,2 до 11 лет. Конвулекс от 6 мес. до 3,3 лет. На фоне лечения отмечены положительные изменения двигательной активности и электронейромиографических показателей мышц разной степени выраженности. У 2-х пациентов отмечен выраженный положительный эффект : больные обрели способность к самостоятельной ходьбе. Первые результаты лечения отмечаются в среднем через 5-6 мес. СМА тип 2. Период наблюдения – 6 мес. - 3,3 года Некоторые итоги лечения 11 больных СМА тип 2 Выводы: Существует индивидуальная восприимчивость к лечению ВК у пациентов со СМА. Для оценки эффективности лечения необходим мониторинг уровня полноразмерной мРНК SMN 2, в сочетании с функциональными тестами.
Слайд 40
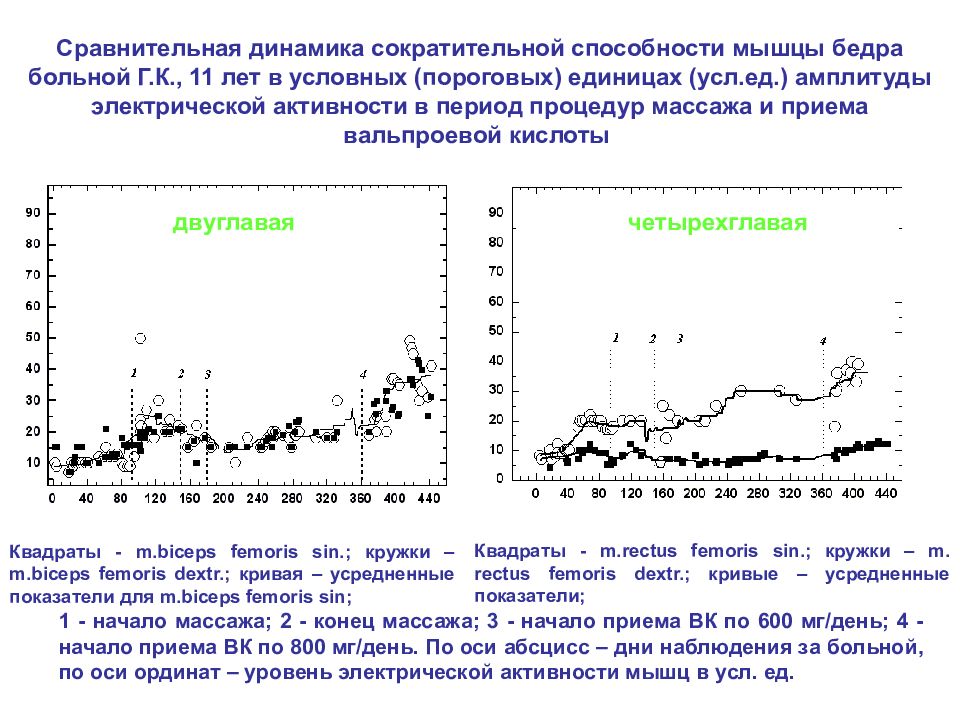
Квадраты - m. rectus femoris sin.; кружки – m. rectus femoris dextr.; кривые – усредненные показатели; Квадраты - m. biceps femoris sin.; кружки – m. biceps femoris dextr.; кривая – усредненные показатели для m. biceps femoris sin ; Сравнительная динамика сократительной способности мышцы бедра больной Г.К., 11 лет в условных (пороговых) единицах (усл.ед.) амплитуды электрической активности в период процедур массажа и приема вальпроевой кислоты четырехглавая двуглавая 1 - начало массажа; 2 - конец массажа; 3 - начало приема ВК по 600 мг/день; 4 - начало приема ВК по 800 мг/день. По оси абсцисс – дни наблюдения за больной, по оси ординат – уровень электрической активности мышц в усл. ед.
Слайд 41
Пилотные клинические испытания лечения СМА с помощью ВК (Brichta Wirth et al., 2006). 2006 год Кельн, Германия У из 7 из 20 пациентов лечение ВК привело к увеличению уровня полноразмерной мРНК. Улучшение клинических симптомов СМА наблюдали у 50% пациентов через 5-6 мес. после начала лечения.
Слайд 42
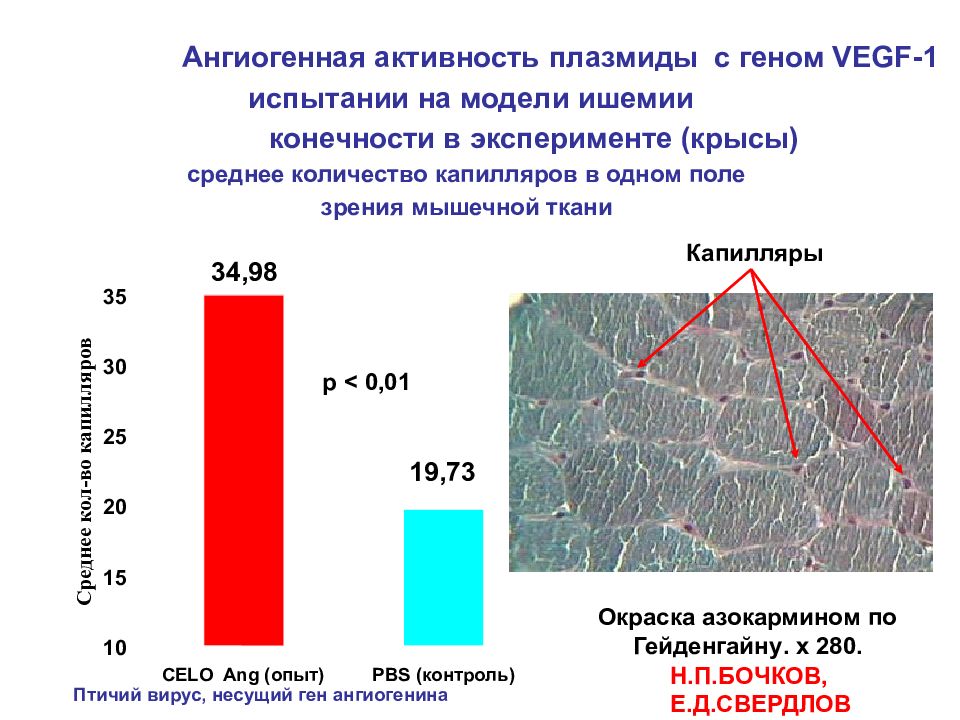
Ангиогенная активность плазмиды с геном VEGF-1 испытании на модели ишемии конечности в эксперименте (крысы) среднее количество капилляров в одном поле зрения мышечной ткани 19,73 34,98 10 15 20 25 30 35 CELO Ang (опыт) PBS (контроль) Среднее кол-во капилляров Окраска азокармином по Гейденгайну . х 280. p < 0, 01 Капилляры Н.П.БОЧКОВ, Е.Д.СВЕРДЛОВ Птичий вирус, несущий ген ангиогенина
Слайд 43
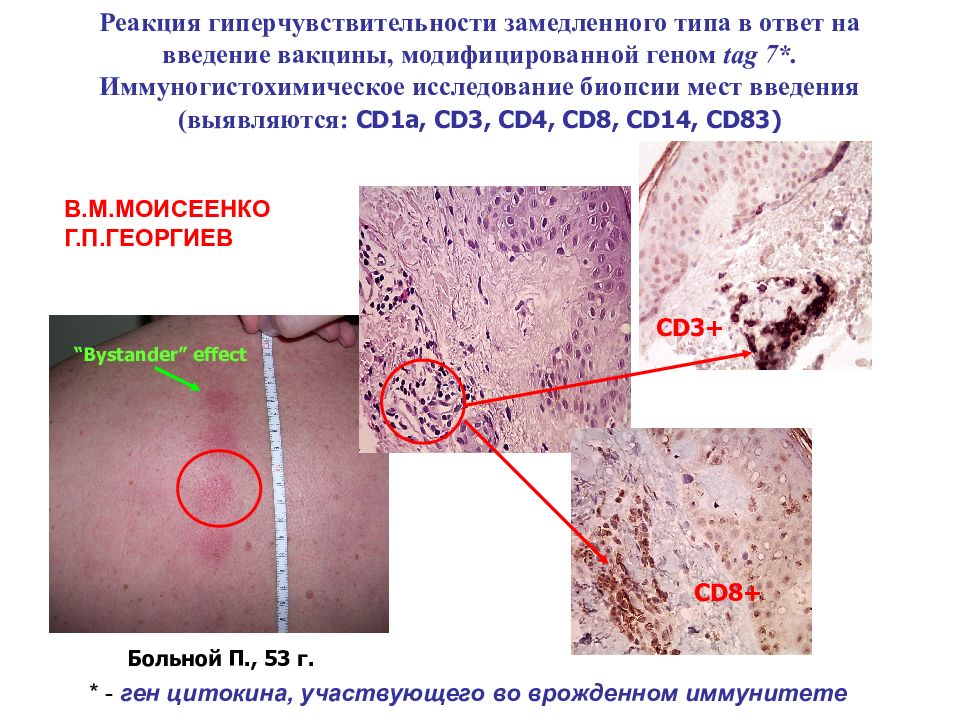
CD3+ CD8+ Реакция гиперчувствительности замедленного типа в ответ на введение вакцины, модифицированной геном tag 7*. Иммуногистохимическое исследование биопсии мест введения (выявляются: CD1a, CD3, CD4, CD8, CD14, CD83 ) Больной П., 53 г. “Bystander” effect В.М.МОИСЕЕНКО Г.П.ГЕОРГИЕВ * - ген цитокина, участвующего во врожденном иммунитете
Ишемия сердечной мышцы -VEGF, bFGF4 Инфаркт миокарда ( VEGF, bFGF4, CTFs (Cardiac Тranscription Factors) Атеросклероз (ApoE, ApoA1 ) Нейродегенеративные заболевания (GDNF, BDNF, MNTF, GABA, CNTF, SOD2, CP2, BCL2, BCLk, β- sinuclein ) Ревматизм, аллергические заболевания (блок TNFα, IL12) Онкологические заболевания : гены самоубийцы - CD (Cytosine Deaminase) гены лекарственной устойчивости (DHFR, MDR1, MGMT) гены высокой иммунной реактивности ( IL2, Interferon γ ) блок онкогенов ( siRNA, antisence RNA) блок васкуляризации опухоли (ангиотензин, эндотоксин) Диабет тип I (Pdx-1, IGF) Трофические язвы ( VEGF, HGF, PGIS, FOX2c )
Слайд 45
Имеющиеся на фармацевтическом рынке или близкие к широкому внедрению “ генные лекарства “ Разрешен к применению 16 Октября 2003 State Food and Drug Administration of China Gendicine™ ( компания SiBiono Genetechnologies ) – рекомбинантный аденовирус с геном супрессором опухолей p53 для комбинированого с радиотерапией лечения больных злокачественными новообразованиями головы и шеи Эффективность данного препарата ставится под сомнение некоторыми экспертами. Аналог : Advexin™ (INGN 201; Introgen; Austin, TX, USA) В КНР лечение с использованием Gendicine™ прошли несколько тысяч пациентов
Слайд 46
2006 год – препарат Oncorine™ (Chinese Shanghai Sunway Biotech ) рекомбинантный аденовирус с геном супрессором опухолей p53 для лечения больных злокачественными новообразованиями головы и шеи, глиом, рака легких, рака яичников Для некоторых онкологических заболеваний после лечения с использованием Oncorine™ в комбинации с химеотерапией по результатам оценки с использованием критериев ВОЗ регрессия опухолей происходила в 75.6 % Аналогичный препарат Onyx-015 проходит испытания компании Onyx Pharmaceutical’s 2009 год препарат Cerepro® (Ark Therapeutics Финляндия Великобритания) рекомбинантный аденовирус с геном тимидинкиназы для лечения глиом. Препарат вводится в ткани мозга. Ганцикловир вводится внутривенно. Синтезируемая в клетках мозга тимидинкиназа превращает ганцикловир в вещество специфически убивающее делящиеся раковые клетки. Использование препарата разрешено Финскими и Французскими Надзорными Медицинскими инстанциями.
Слайд 47
52 проекта на стадии : 37 онкология 7 сердечно-сосудистые заболевания 6 инфекционные заболевания 2 генная вакцинация Клинические испытания по генной терапии на фазе 3 клинических Испытаний. Март 2009 года
Слайд 48: Проблемы современной генной терапии
Безопасность Эффективность доставки Попадание в клетки (ткани) мишени Соответствующий уровень и время экспрессии .ppt
Последний слайд презентации: Генная Терапия Лекция 11
ВЫВОДЫ 1. ГТ выходит из застоя и вступает в фазу бурного развития. 2. Число официальных протоколов клинических испытаний превысило 1000 и включает все виды заболеваний. 3. Наиболее существенный прогресс в ГТ нервно-мышечных заболеваний отмечен для МДД, СМА, МД, МА и др. 4. Исследования и клинические испытания по ГТ требуют слаженной работы многочисленных научных лабораторий и клинических центров. 5. ГТ строго специфична для каждого заболевания и сугубо индивидуальна для каждого больного (конструкция, доза, способ доставки и пр.). 6. Если не произойдет чуда, в которое мы давно и упорно верим, Россия навсегда потеряет для себя этот вид медицины.