Первый слайд презентации: Тема лекции 3:
Основы современной теории пространственного строения органических соединений. Конфигурация и конформации Кафедра органической и биоорганической химии БГМУ
Слайд 2: Теоретическая основа ОХ
Теория строения А.М.Бутлерова, дополненная : Б) теорией валентных связей Полинга и теорией молекулярных орбиталей Малликена и Хюккеля А) квантовой структурой элементов-органогенов В) стереохимическими представлениями Вант-Гоффа,Э.Фишера, Бартона. Г) абсолютной конфигурацией стереоизомеров КИП Д) механизмами органич.реакций Н.Семенов, Ингольд и др. Е) теорией кислотности и основности Бренстеда-Лоури, Льюиса, Пирсона. 1828-1886 гг.
Слайд 4
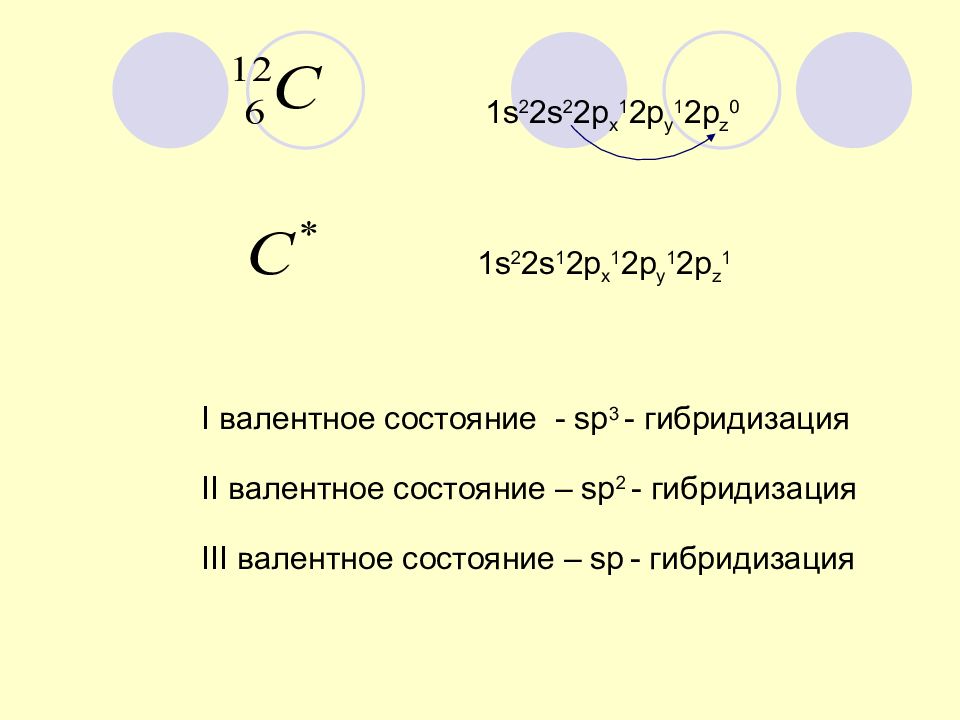
1 s 2 2s 2 2p x 1 2p y 1 2p z 0 1 s 2 2s 1 2p x 1 2p y 1 2p z 1 I валентное состояние - sp 3 - гибридизация II валентное состояние – sp 2 - гибридизация III валентное состояние – sp - гибридизация
Слайд 5: Химическое строение и структура
Химическое строение ( конституция по Бутлерову )-последовательность соединения атомов в молекуле с учетом характера химических связей между ними. Структура – взаимное пространственное расположение атомов (их ядер) друг относительно друга. Понятие структура включает строение, конфигурацию и конформации.
Слайд 6
Раздел химической науки, который занимается изучением пространственной структуры молекул и ее влиянием на физические и химические свойства молекул, а также ход протекания химических процессов носит название стереохимия. Стереохимия связана с изучением свойств изомеров, т.е. молекул, которые при различной структуре имеют одинаковые молекулярные формулы. Различают три типа изомерии: структурную, конфигурационную и конформационную. Конфигурационные изомеры и конформеры объединяют под общим названием стереоизомеры. СТЕРЕОХИМИЯ И СТЕРЕОИЗОМЕРЫ
Слайд 7
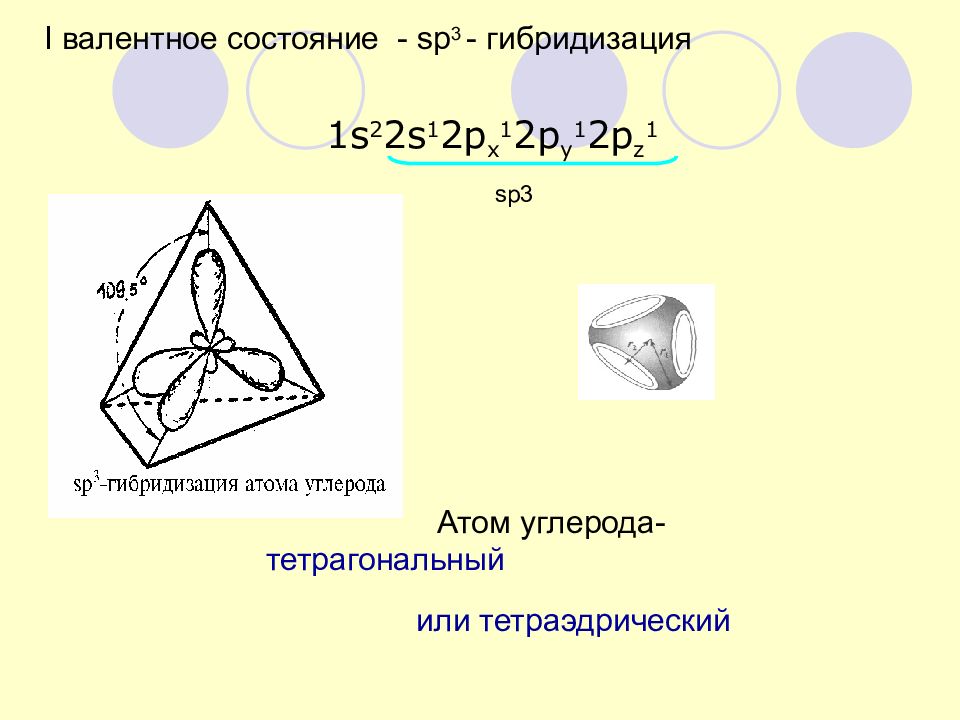
I валентное состояние - sp 3 - гибридизация 1 s 2 2s 1 2p x 1 2p y 1 2p z 1 Атом углерода- тетрагональный или тетраэдрический sp3
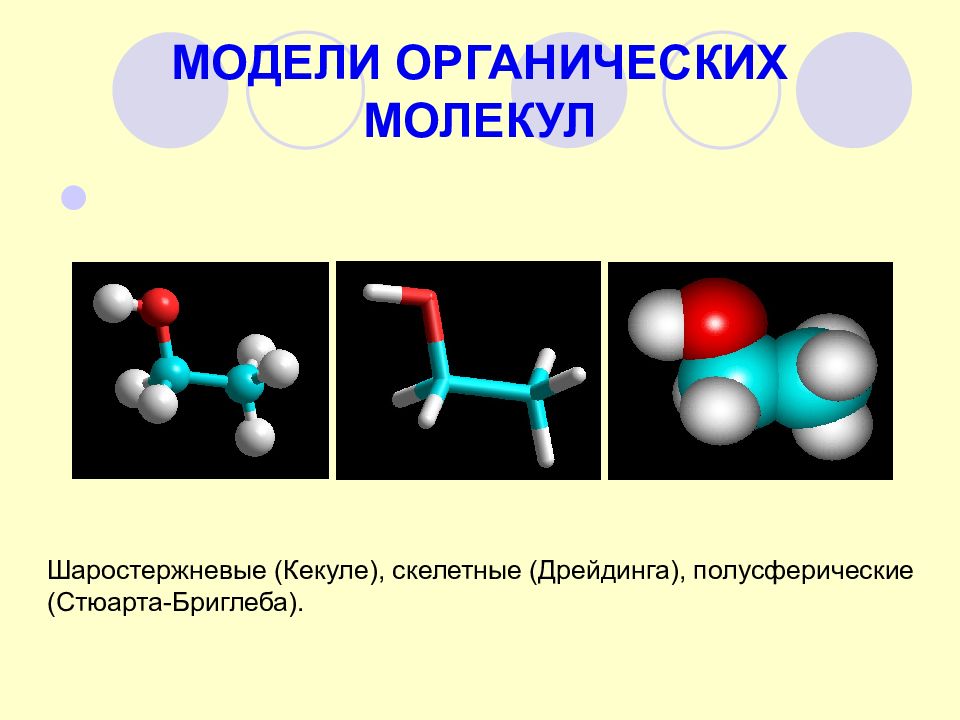
Слайд 8: МОДЕЛИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Шаростержневые (Кекуле), скелетные (Дрейдинга), полусферические (Стюарта-Бриглеба).
Слайд 10
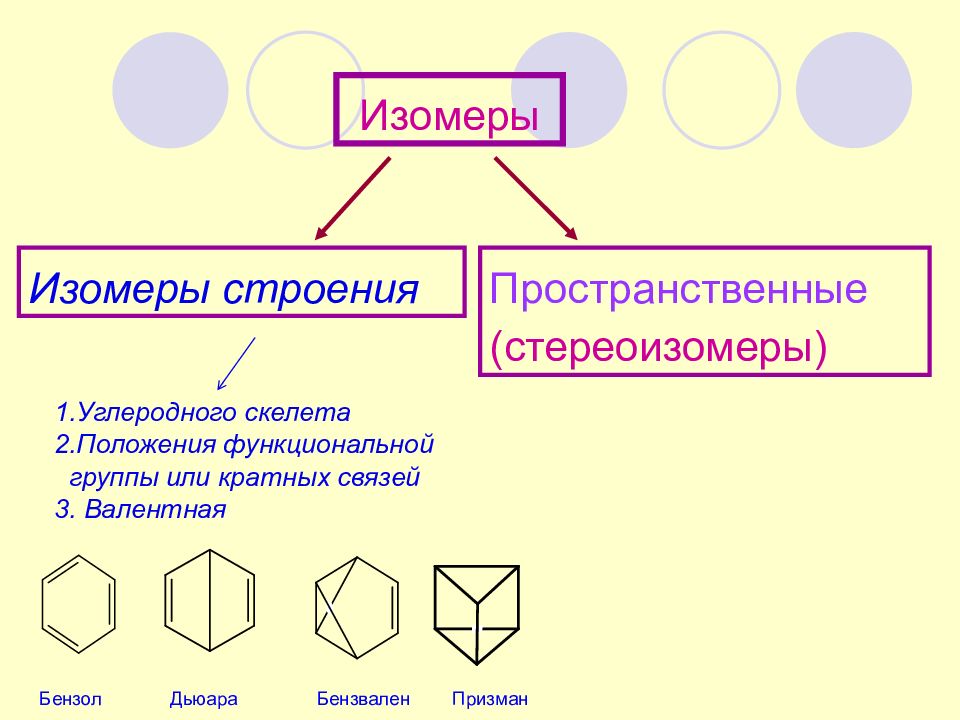
ИЗОМЕРЫ Изомерами называются соединения с одинаковым элементным составом, но отличающиеся последовательностью связывания атомов и (или) расположением их в пространстве
Слайд 11
Изомеры Изомеры строения Пространственные (стереоизомеры) 1.Углеродного скелета 2.Положения функциональной группы или кратных связей 3. Валентная Бензол Дьюара Бензвален Призман
Слайд 12
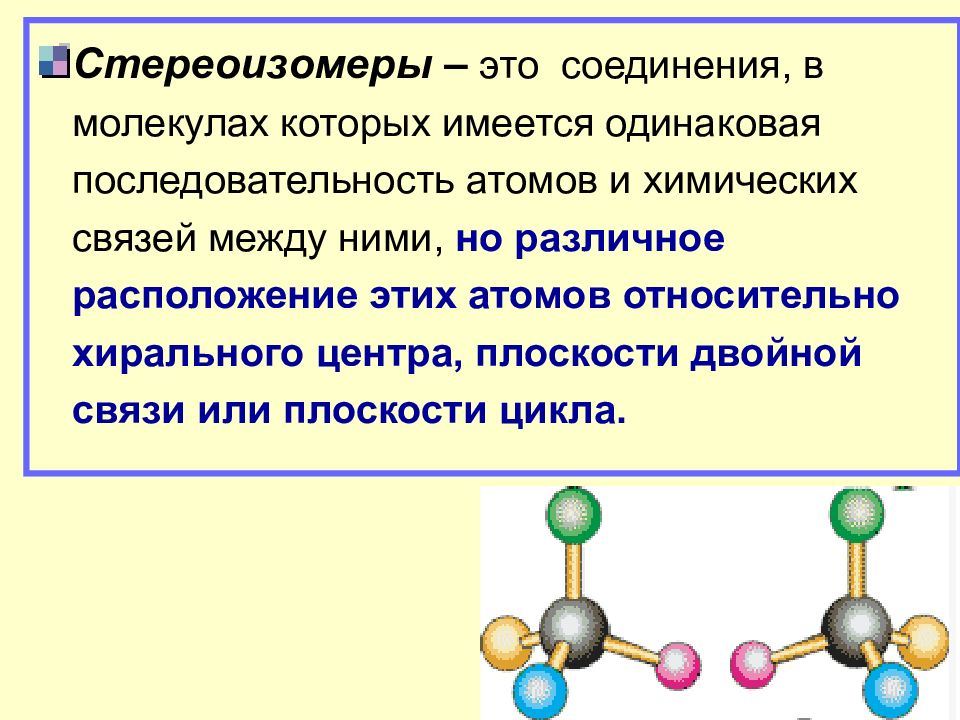
Стереоизомеры – это соединения, в молекулах которых имеется одинаковая последовательность атомов и химических связей между ними, но различное расположение этих атомов относительно хирального центра, плоскости двойной связи или плоскости цикла.
Слайд 13
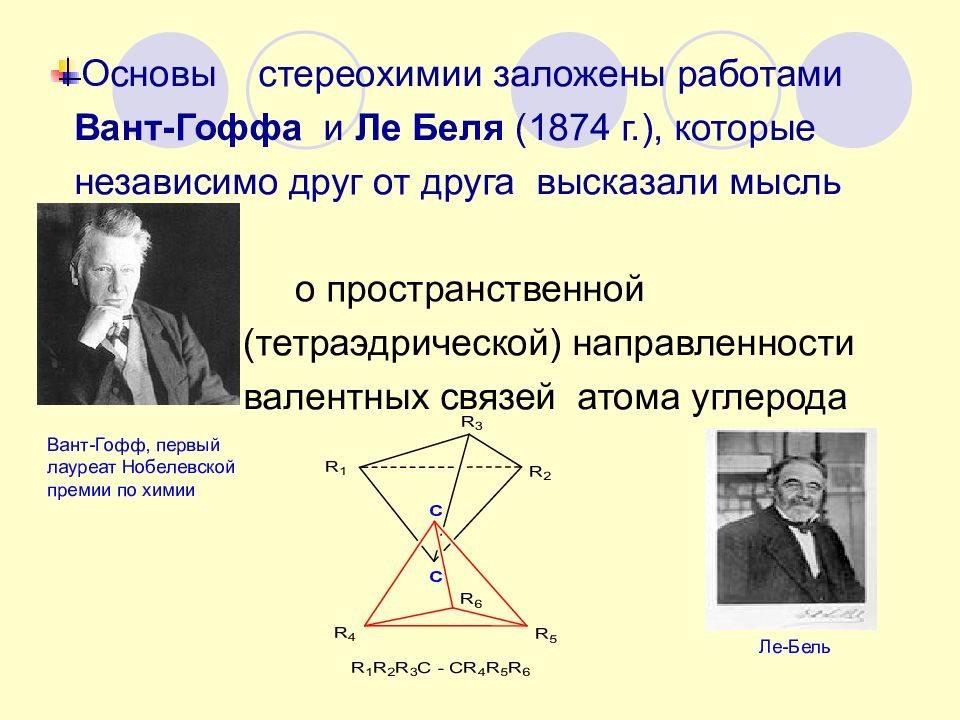
Основы стереохимии заложены работами Вант-Гоффа и Ле Беля (1874 г.), которые независимо друг от друга высказали мысль о пространственной (тетраэдрической) направленности валентных связей атома углерода Вант-Гофф, первый лауреат Нобелевской премии по химии Ле-Бель
Слайд 14
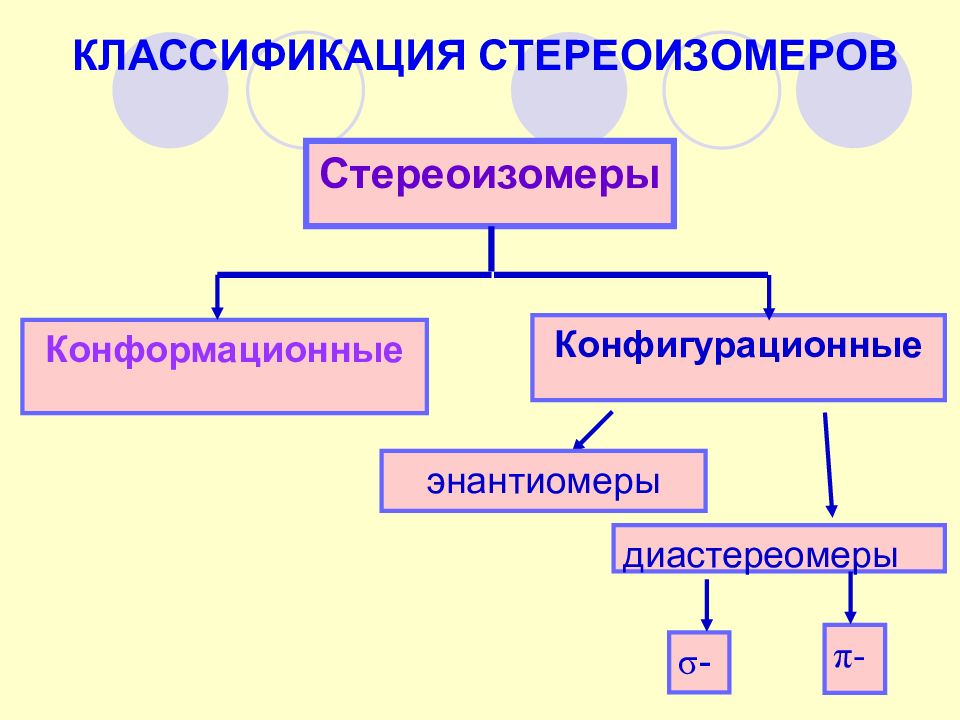
КЛАССИФИКАЦИЯ СТЕРЕОИЗОМЕРОВ Конфигурационные Стереоизомеры Конформационные диастереомеры энантиомеры π - σ -
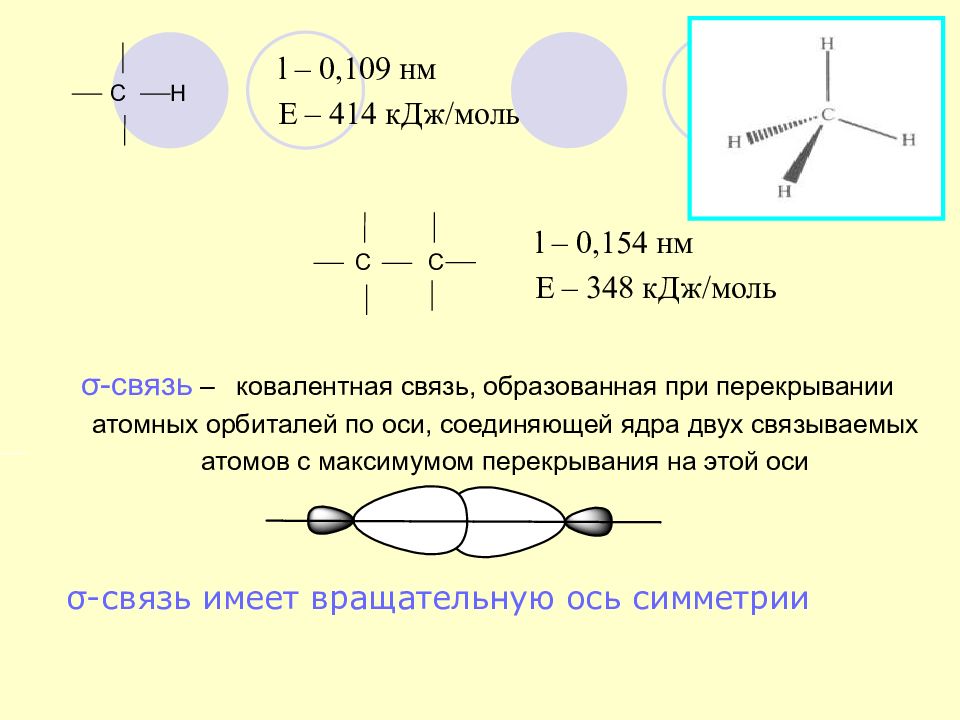
Слайд 15: С Н
l – 0,109 нм Е – 414 кДж/моль l – 0,154 нм Е – 348 кДж/моль С С σ -связь имеет вращательную ось симметрии σ -связь – ковалентная связь, образованная при перекрывании атомных орбиталей по оси, соединяющей ядра двух связываемых атомов с максимумом перекрывания на этой оси
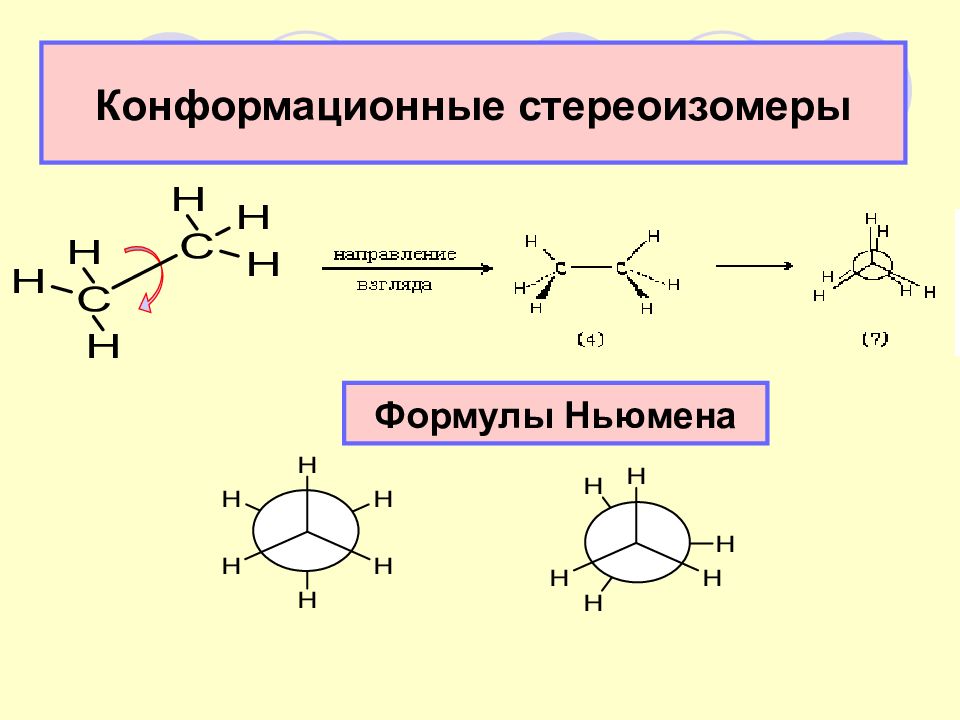
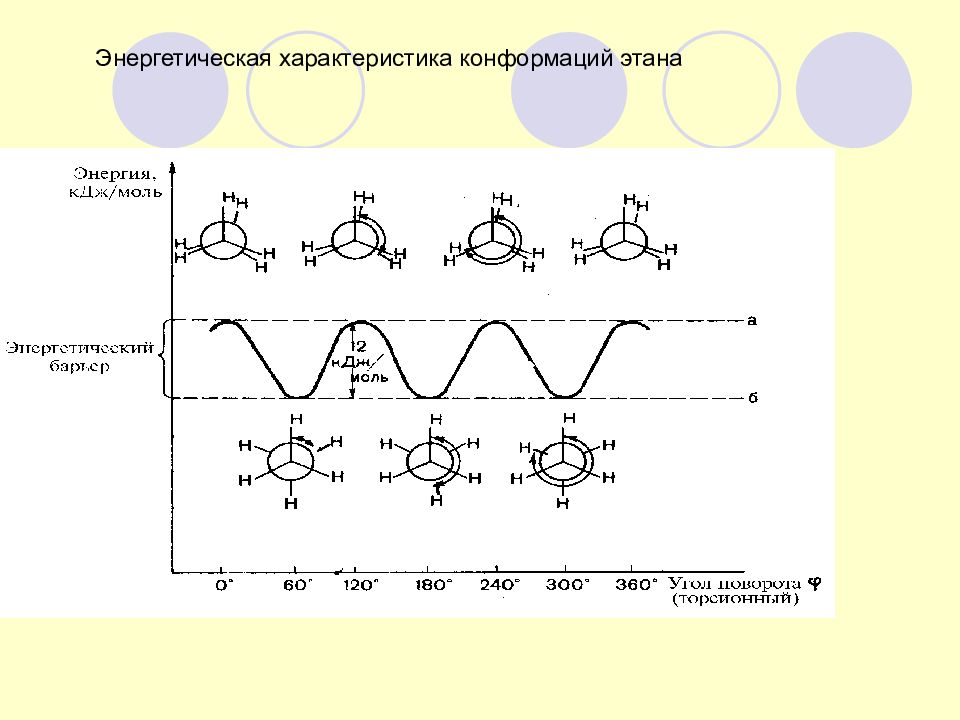
Слайд 16: Определение конформаций
Конформации - различные пространственные формы молекул, возникающие в результате вращения одних групп в молекуле относительно других по линии σ -связей и отличающиеся запасом энергии (термодинамической устойчивостью).
Слайд 17
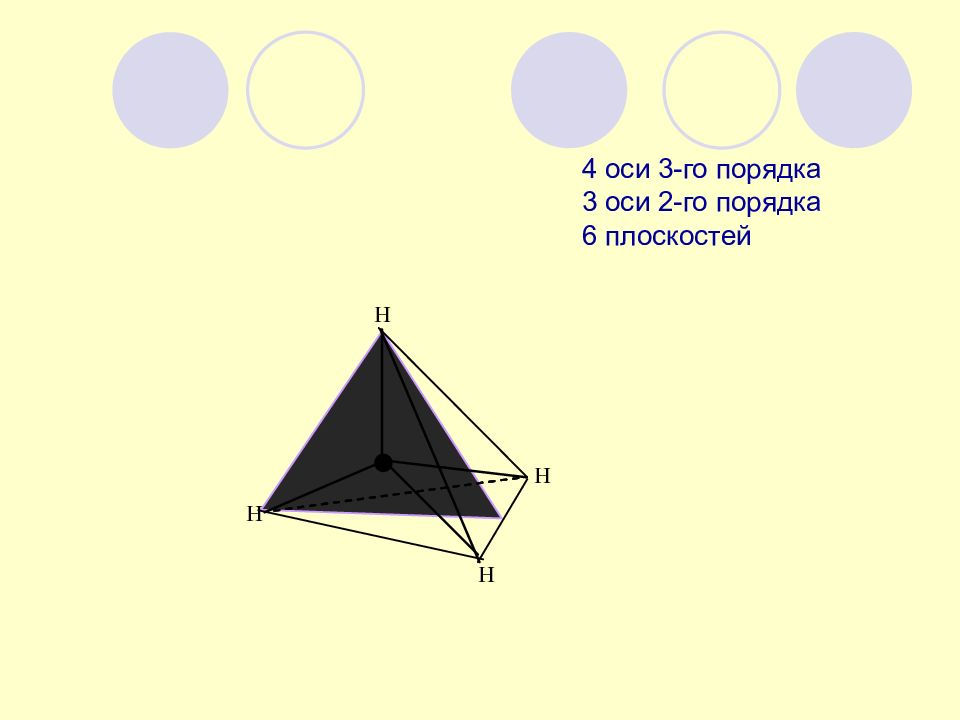
В стереохимии молекулу рассматривают как геометрическое тело в трехмерном пространстве молекула симметрична, если при перестановке в ней местами атомов или атомных групп не происходит никаких изменений ее структуры ЭЛЕМЕНТЫ СИММЕТРИИ ОРГАНИЧЕСКИХ МОЛЕКУЛ
Слайд 18
Элементы симметрии : 1 рода - оси симметрии С n 2 рода - плоскости симметрии σ - центры симметрии i - оси зеркального отражения S n
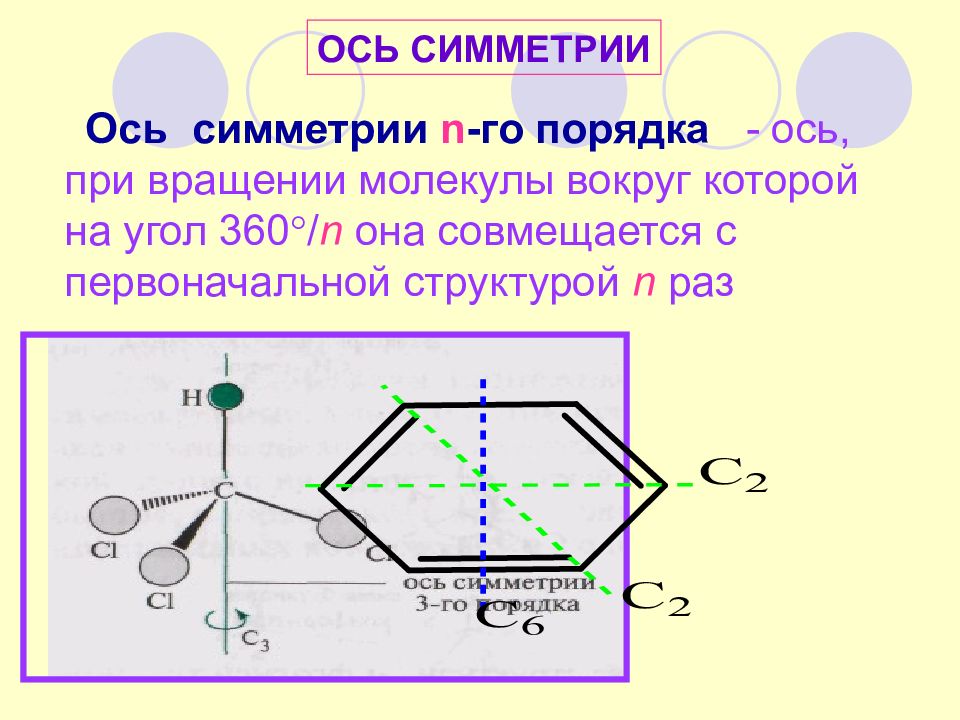
Слайд 19
Ось симметрии n -го порядка - ось, при вращении молекулы вокруг которой на угол 360 / n она совмещается с первоначальной структурой n раз ОСЬ СИММЕТРИИ
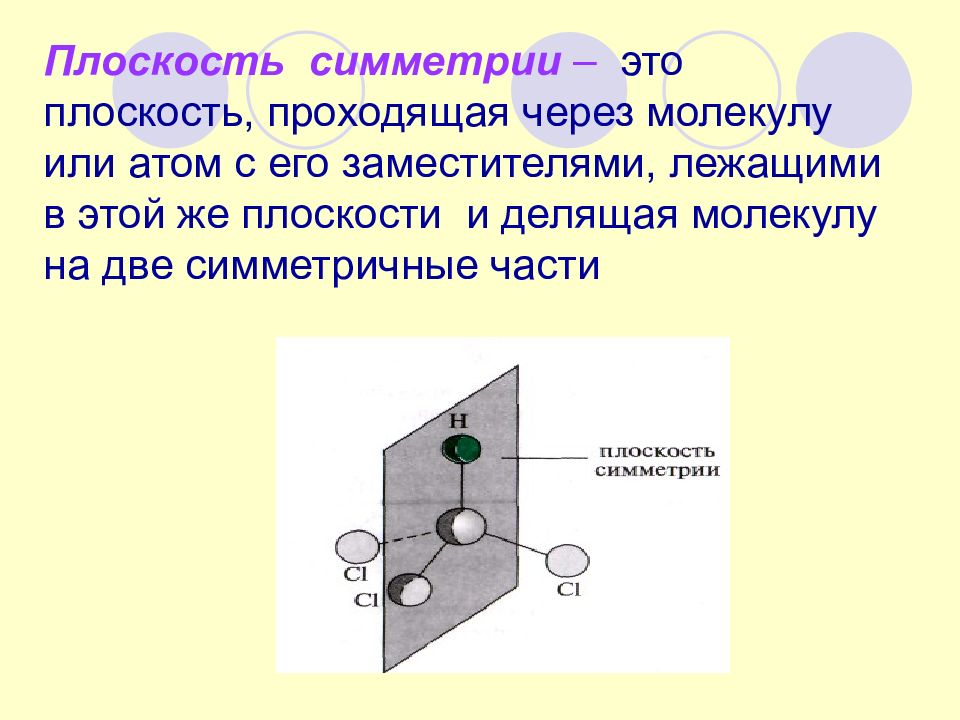
Слайд 20
Плоскость симметрии – это плоскость, проходящая через молекулу или атом с его заместителями, лежащими в этой же плоскости и делящая молекулу на две симметричные части
Слайд 21
ОСЬ ЗЕРКАЛЬНОГО ОТРАЖЕНИЯ 1.2-дифтор-1,2-дихлорэтан При повороте на 180 ° относительно оси S и отражения в плоскости обе части молекулы становятся симметричными
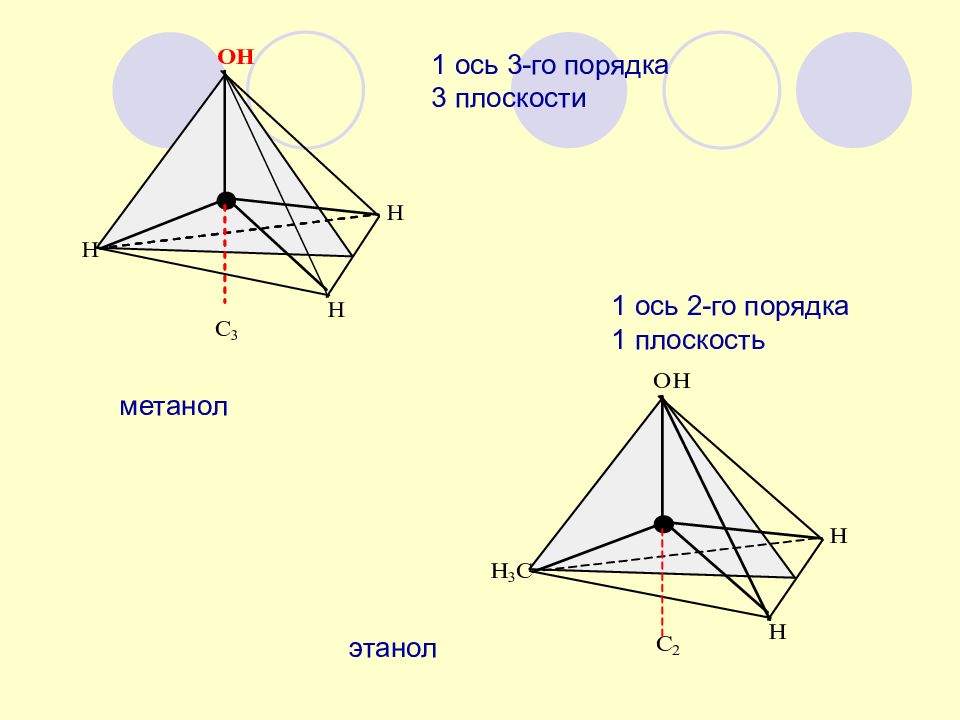
Слайд 23: 1 ось 3-го порядка 3 плоскости
метанол этанол 1 ось 2-го порядка 1 плоскость
Слайд 24
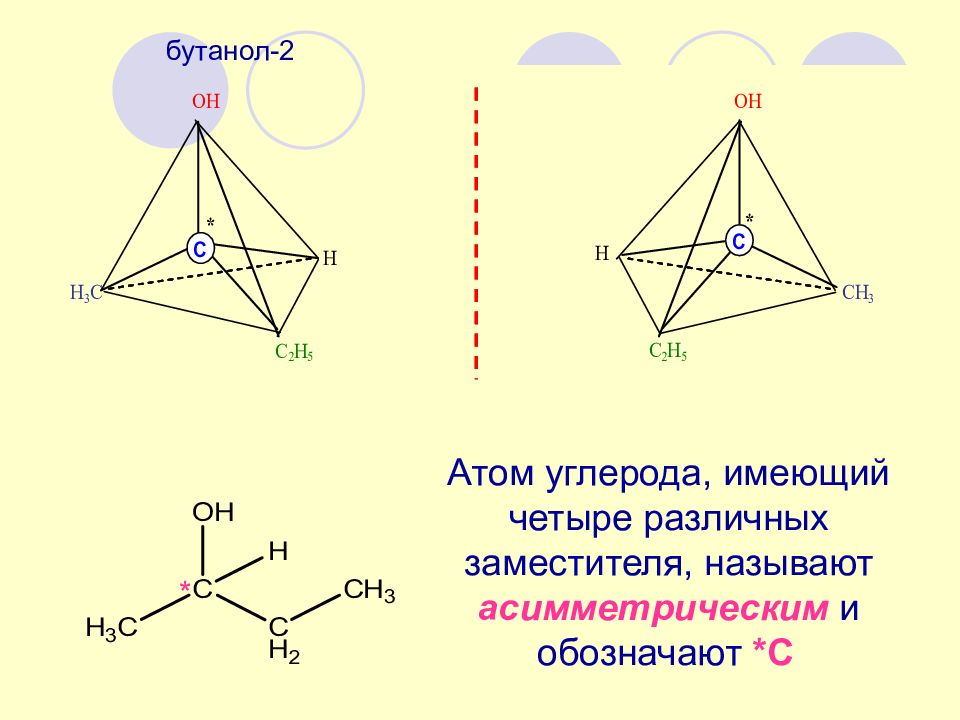
* бутанол-2 Атом углерода, имеющий четыре различных заместителя, называют асимметрическим и обозначают *С
Слайд 25
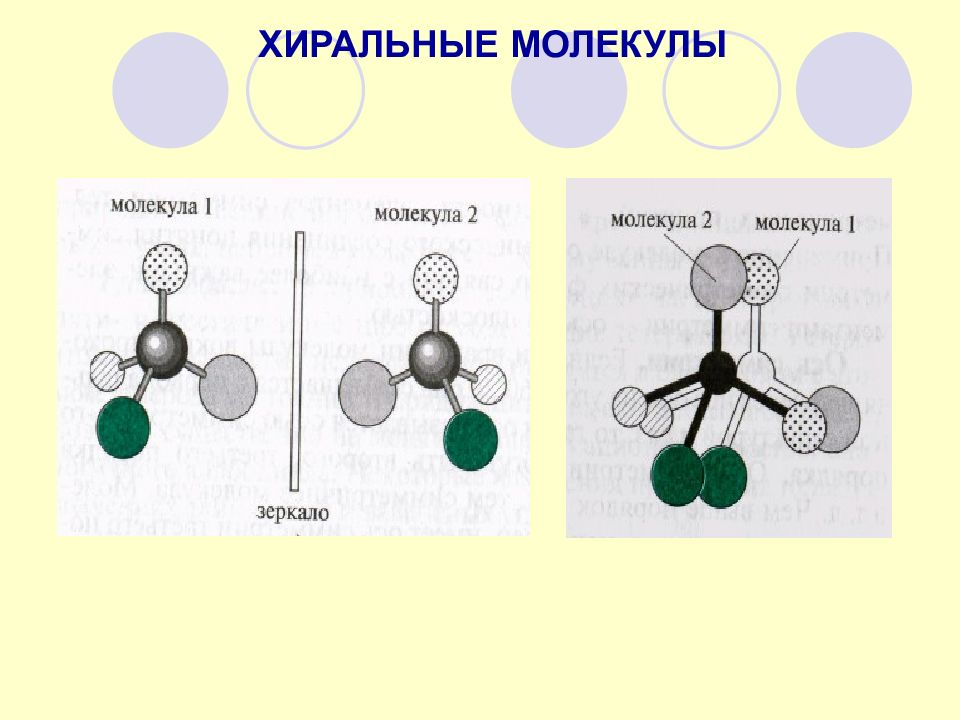
Молекулы, не обладающие элементами симметрии 2 рода и несовместимые со своим зеркальным изображением, называют хиральными Термин « хиральность » (рукоподобие, с heir – рука, греч. ) заключается в парности существованиии молекул, относящихся друг к другу как правая и левая рука (предмет и его зеркальное отображение). ХИРАЛЬНОСТЬ Асимметрический атом углерода – частный случай хирального центра
Слайд 28
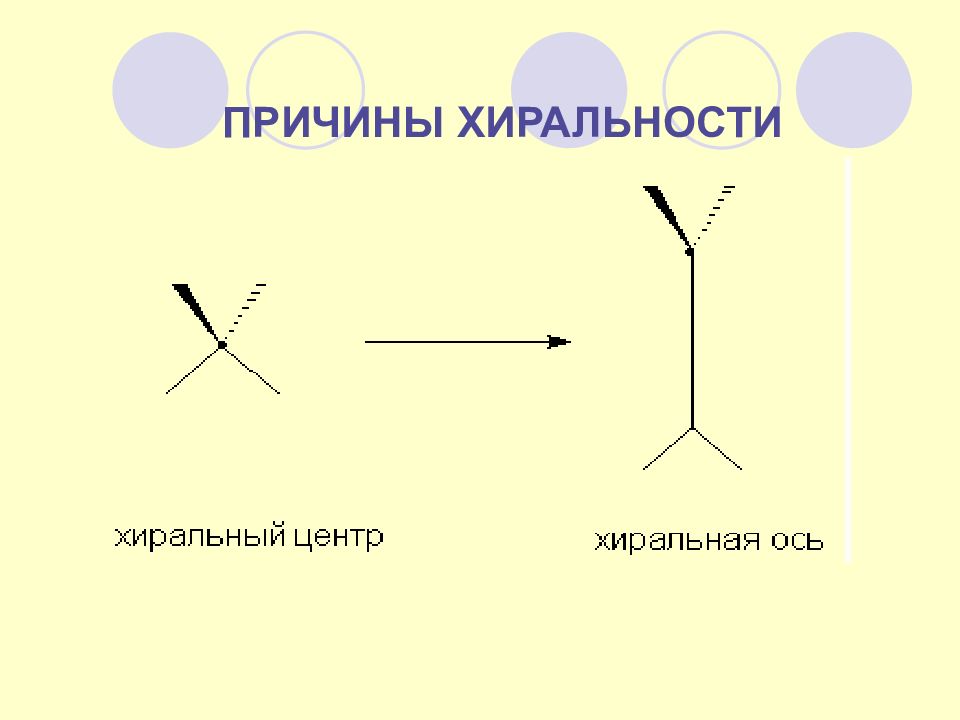
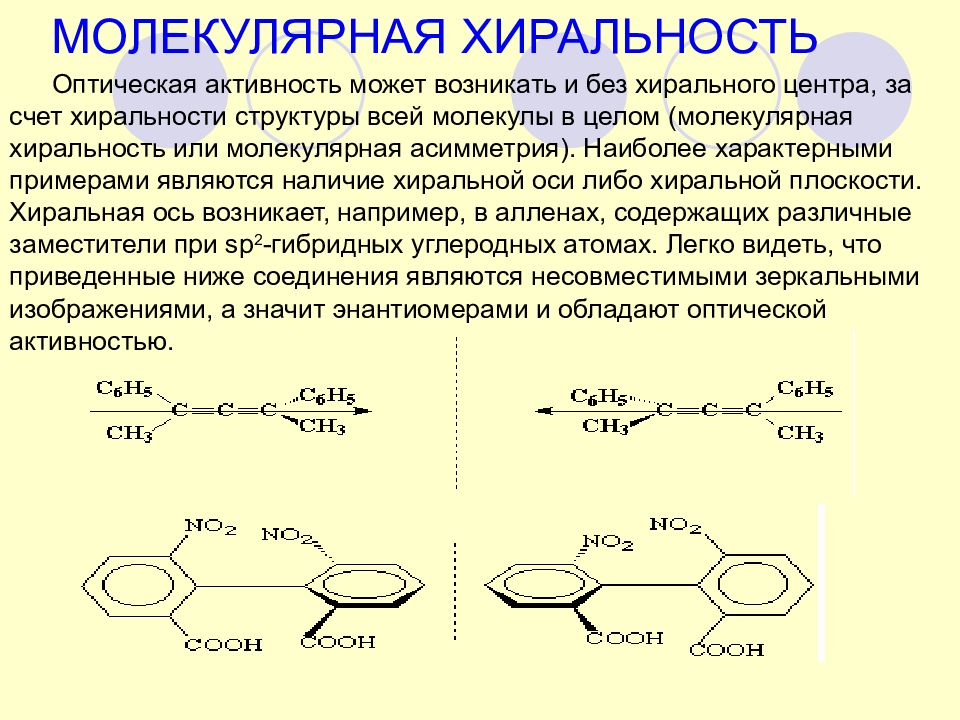
Оптическая активность может возникать и без хирального центра, за счет хиральности структуры всей молекулы в целом (молекулярная хиральность или молекулярная асимметрия). Наиболее характерными примерами являются наличие хиральной оси либо хиральной плоскости. Хиральная ось возникает, например, в алленах, содержащих различные заместители при sp 2 -гибридных углеродных атомах. Легко видеть, что приведенные ниже соединения являются несовместимыми зеркальными изображениями, а значит энантиомерами и обладают оптической активностью. МОЛЕКУЛЯРНАЯ ХИРАЛЬНОСТЬ
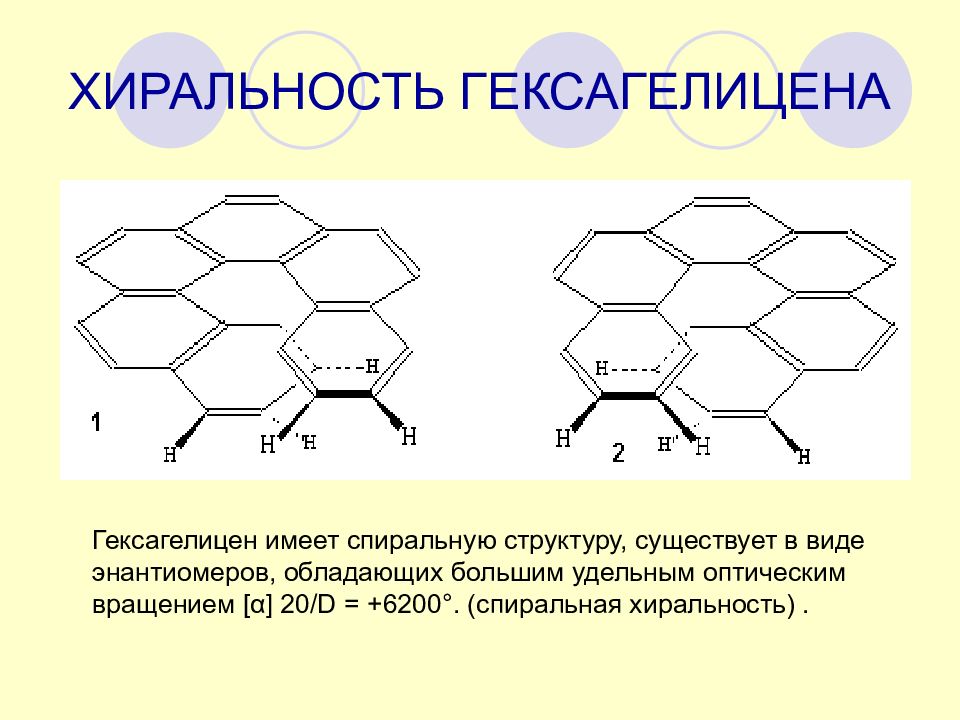
Слайд 30: ХИРАЛЬНОСТЬ ГЕКСАГЕЛИЦЕНА
Гексагелицен имеет спиральную структуру, существует в виде энантиомеров, обладающих большим удельным оптическим вращением [ α] 20 /D = +6200°. (спиральная хиральность).
Слайд 31
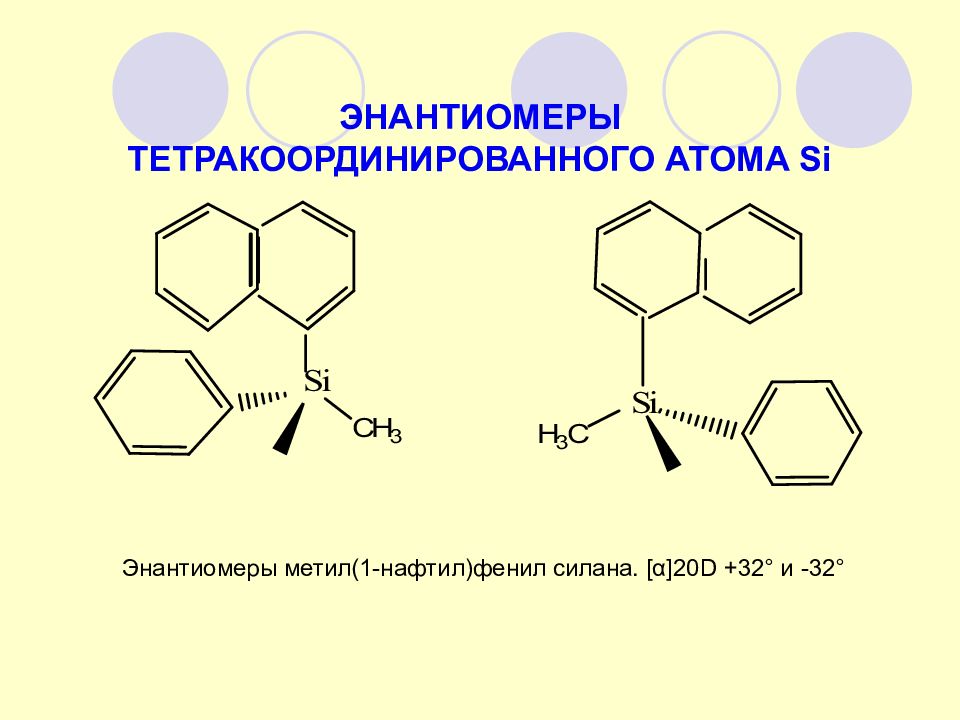
ЭНАНТИОМЕРЫ ТЕТРАКООРДИНИРОВАННОГО АТОМА Si Энантиомеры метил(1-нафтил)фенил силана. [ α] 20 D +32° и -32°
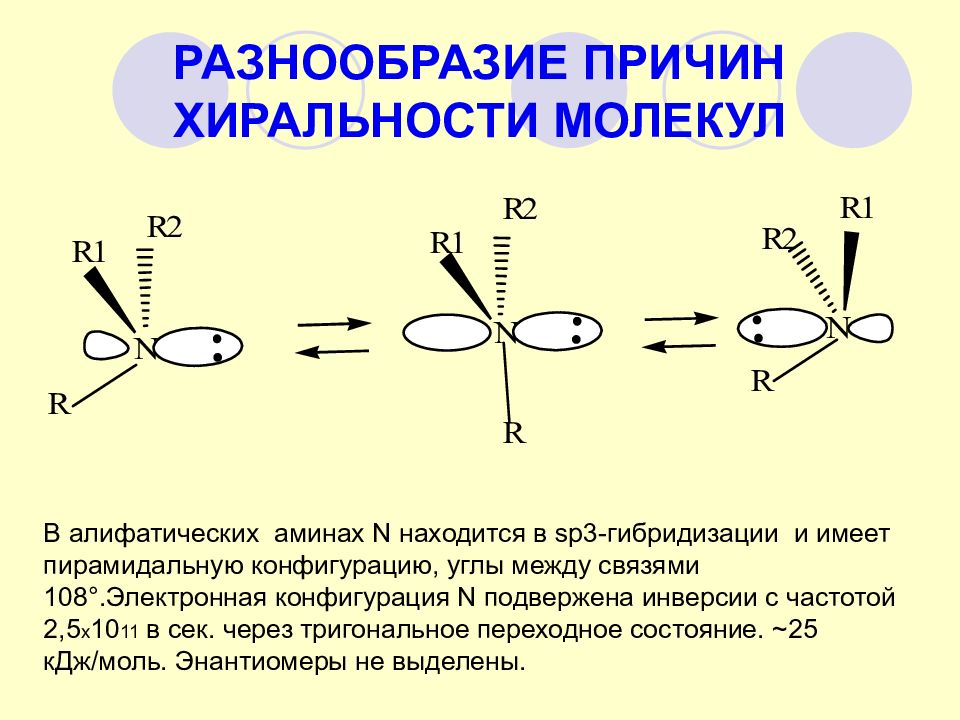
Слайд 32: РАЗНООБРАЗИЕ ПРИЧИН ХИРАЛЬНОСТИ МОЛЕКУЛ
В алифатических аминах N находится в sp3- гибридизации и имеет пирамидальную конфигурацию, углы между связями 108°.Электронная конфигурация N подвержена инверсии с частотой 2,5 х 10 11 в сек. через тригональное переходное состояние. ~25 кДж/моль. Энантиомеры не выделены.
Слайд 33
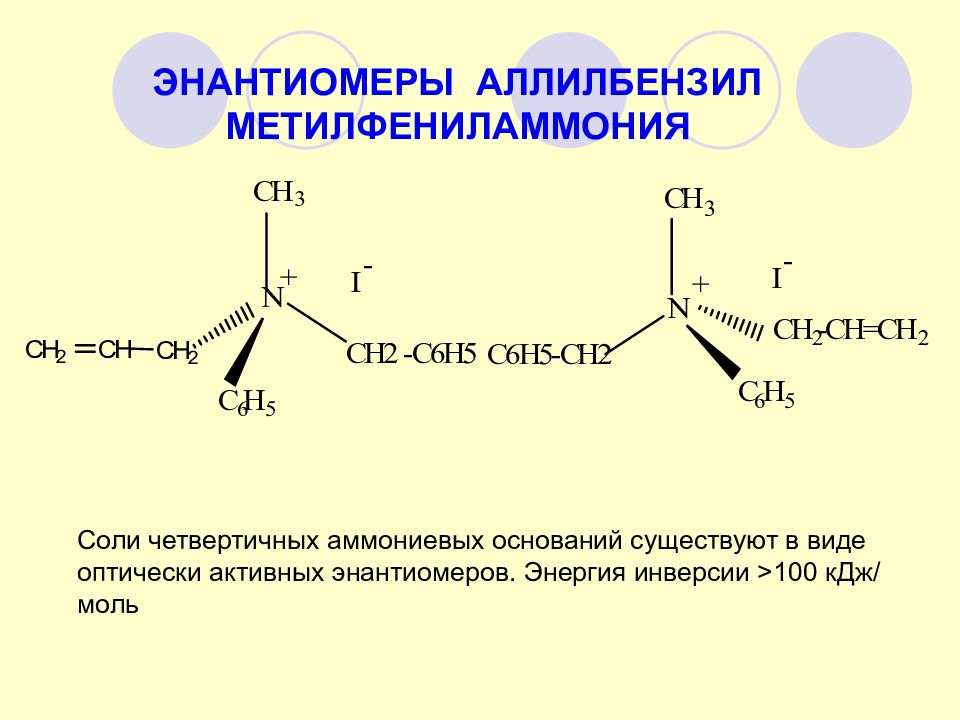
ЭНАНТИОМЕРЫ АЛЛИЛБЕНЗИЛ МЕТИЛФЕНИЛАММОНИЯ Соли четвертичных аммониевых оснований существуют в виде оптически активных энантиомеров. Энергия инверсии >100 кДж/моль
Слайд 34
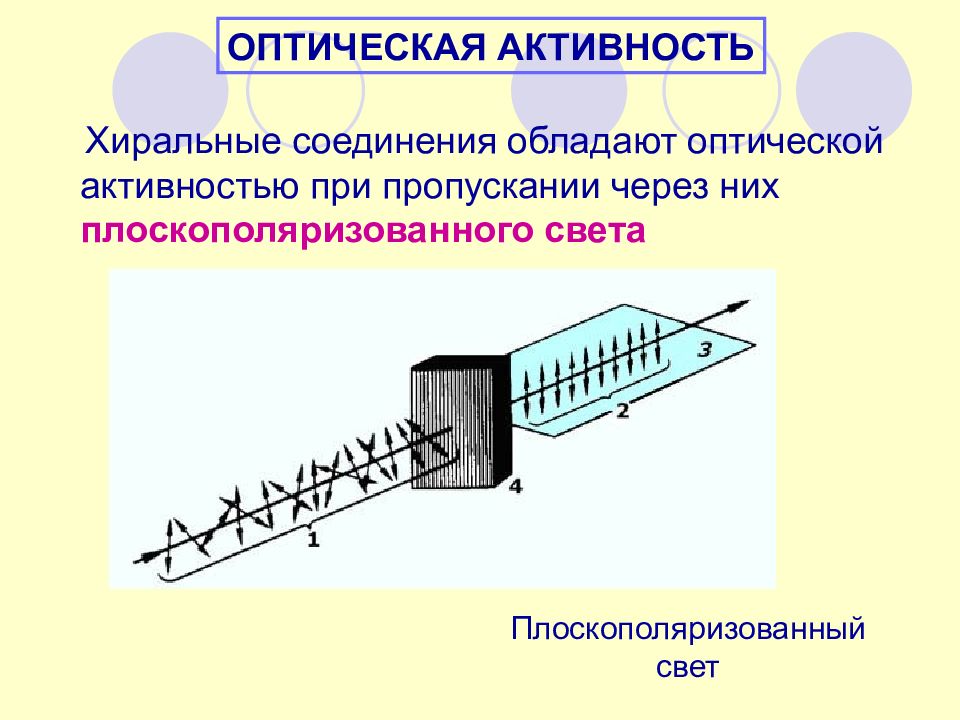
ОПТИЧЕСКАЯ АКТИВНОСТЬ Хиральные соединения обладают оптической активностью при пропускании через них плоскополяризованного света Плоскополяризованный свет
Слайд 35: Поляризованный свет
Поляризованный свет состоит из двух право- и лево- циркулярно поляризованных лучей
Слайд 37
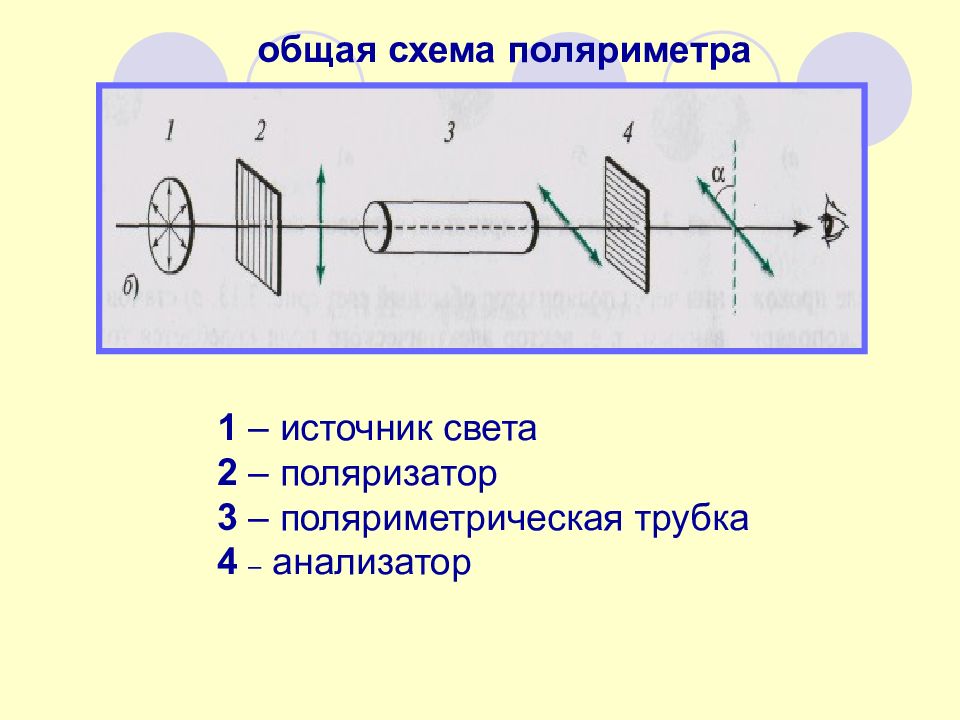
общая схема поляриметра 1 – источник света 2 – поляризатор 3 – поляриметрическая трубка 4 – анализатор
Слайд 38
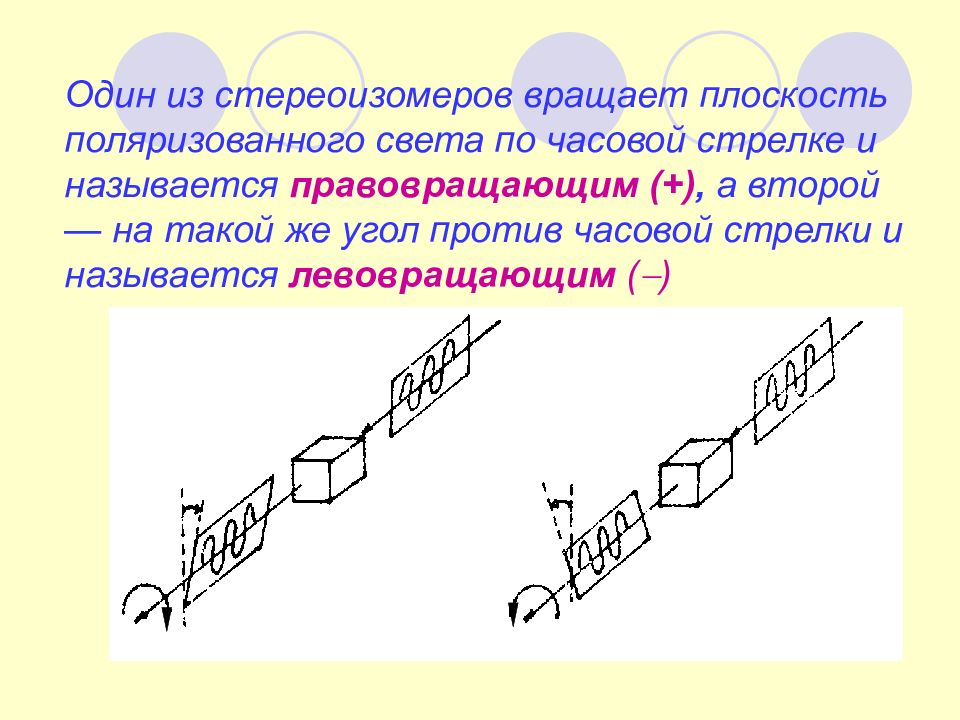
Один из стереоизомеров вращает плоскость поляризованного света по часовой стрелке и называется правовращающим (+), а второй — на такой же угол против часовой стрелки и называется левовращающим ( )
Слайд 39
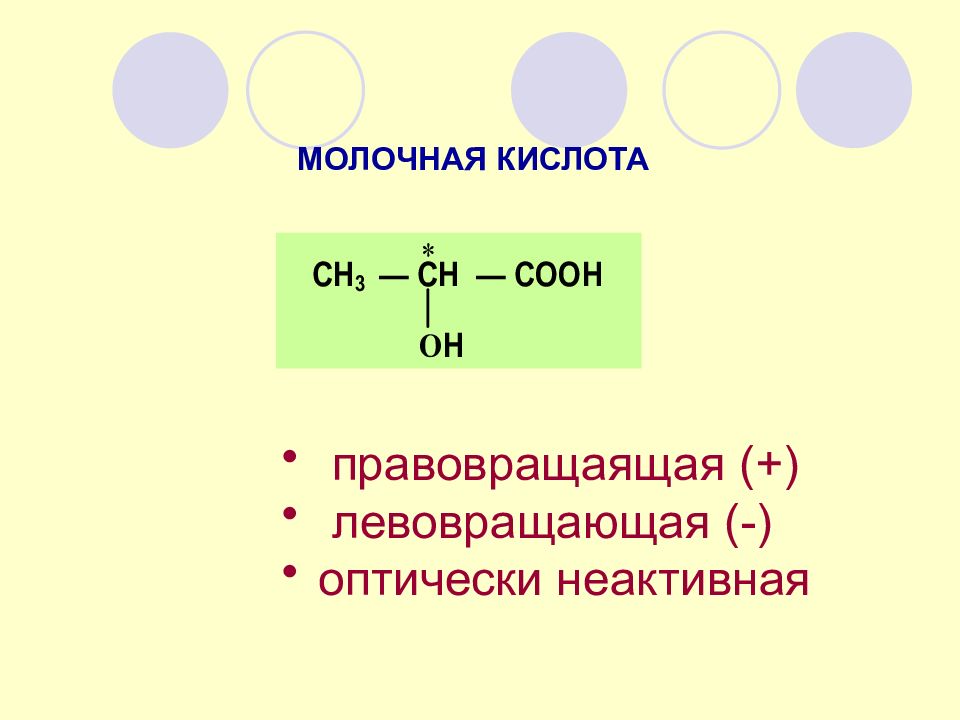
Величина вращения плоскости поляризованного света зависит от природы оптически активного вещества, его концентрации, длины пути, пройденного светом, длины волны плоскополяризованного света, температуры раствора, природы растворителя. Поэтому оптическую активность обычно выражают в единицах удельного вращения. Удельное вращение определяют как угол вращения плоскости поляризации раствором, содержащем в 1мл 1г оптически активного вещества при длине трубки 0,1м. Удельное вращение обозначается символом : в котором подстрочный индекс символизирует D -линию в спектре натрия (длина волны света 589,6 нм), а надстрочный индекс – температуру при которой проводилось измерение. Удельное вращение является константой оптически активного вещества и его значение для конкретных органических веществ можно найти в справочной литературе. Например, для (S) - молочной кислоты [ α] 20 /D = +2,26° (С1,24; вода). УДЕЛЬНОЕ ВРАЩЕНИЕ
Слайд 40
МОЛОЧНАЯ КИСЛОТА правовращаящая (+) левовращающая (-) оптически неактивная
Слайд 41
ПРОЕКЦИОННЫЕ ФОРМУЛЫ ФИШЕРА Углеродную цепь располагают вертикально 2. Вверху располагают старшую функциональную группу 3. Хиральный атом углерода переносится на плоскость в точку пересечения горизонтальной и вертикальной линий 4. Расположенные по горизонтали заместители направлены к наблюдателю, а по вертикали – «уходят» от наблюдателя
Слайд 42
ПРОЕКЦИОННЫЕ ФОРМУЛЫ Э.ФИШЕРА Заместители, обозначенные сплошными клиньями, направлены вперед от плоскости проекции, штрихованными – за плоскость проекции.
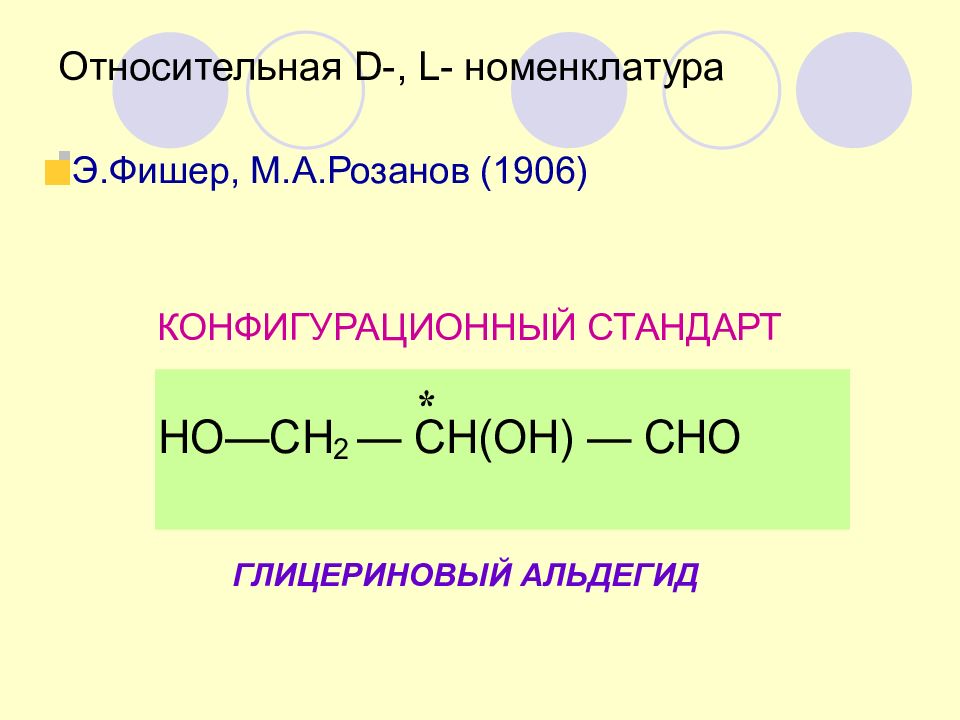
Слайд 44: Относительная D-, L- номенклатура
Э.Фишер, М.А.Розанов (1906) КОНФИГУРАЦИОННЫЙ СТАНДАРТ ГЛИЦЕРИНОВЫЙ АЛЬДЕГИД
Слайд 45
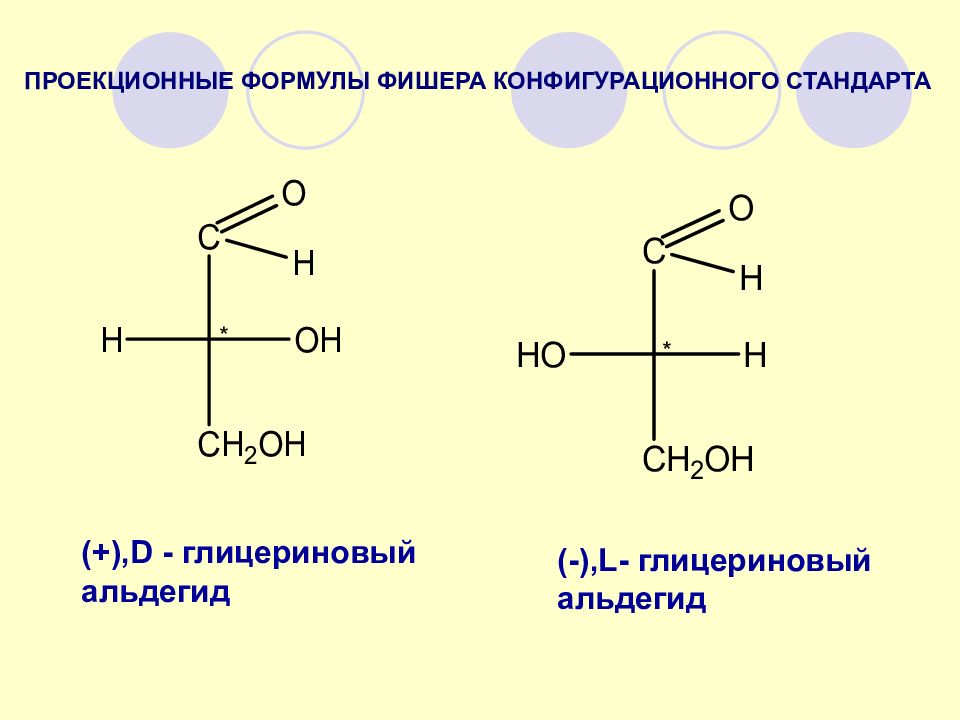
(+), D - глицериновый альдегид (-), L - глицериновый альдегид * * ПРОЕКЦИОННЫЕ ФОРМУЛЫ ФИШЕРА КОНФИГУРАЦИОННОГО СТАНДАРТА
Слайд 46
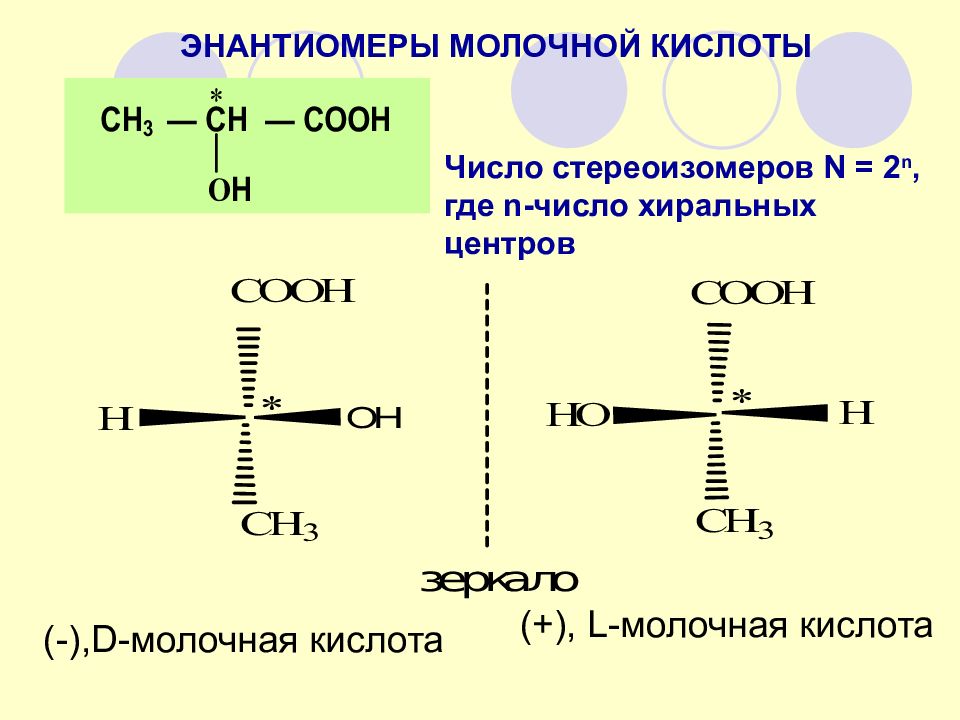
ЭНАНТИОМЕРЫ МОЛОЧНОЙ КИСЛОТЫ Число стереоизомеров N = 2 n, где n -число хиральных центров (+), L - молочная кислота (-), D - молочная кислота
Слайд 47
1. Формулы можно вращать в плоскости чертежа на 180 о, не меняя их стереохимического смысла: 2. Две (или любое четное число) перестановки заместителей у одного асимметрического атома не меняют стереохимического смысла формулы: . 3. Вместо перестановок проекционные формулы можно преобразовывать путем вращения любых трех заместителей по часовой стрелке или против нее; четвертый заместитель при этом положения не меняет (такая операция эквивалентна двум перестановкам): ОПЕРАЦИИ С ПРОЕКЦИОННЫМИ ФОРМУЛАМИ
Слайд 48: Определение конфигурации
Конфигурация - определенное пространственное расположение заместителей относительно хирального центра, плоскости цикла или двойной связи без учета различий в структуре за счет вращения групп по линии σ -связей.
Слайд 49
ЭНАНТИОМЕРИЯ Энантиомеры – пары стереоизомеров, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное изображение в идеальном плоском зеркале и обладают в ахиральной среде одинаковыми физическими и химическими свойствами, кроме знака оптического вращения
Слайд 50
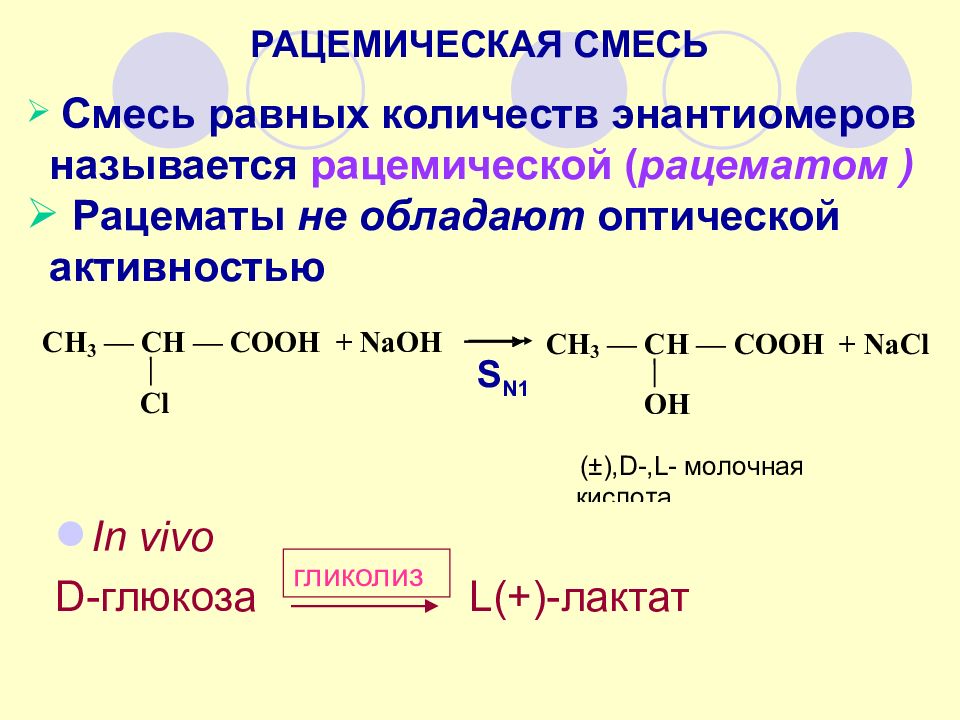
РАЦЕМИЧЕСКАЯ СМЕСЬ Смесь равных количеств энантиомеров называется рацемической ( рацематом ) Рацематы не обладают оптической активностью S N1 In vivo D -глюкоза L(+)-лактат гликолиз
Слайд 51
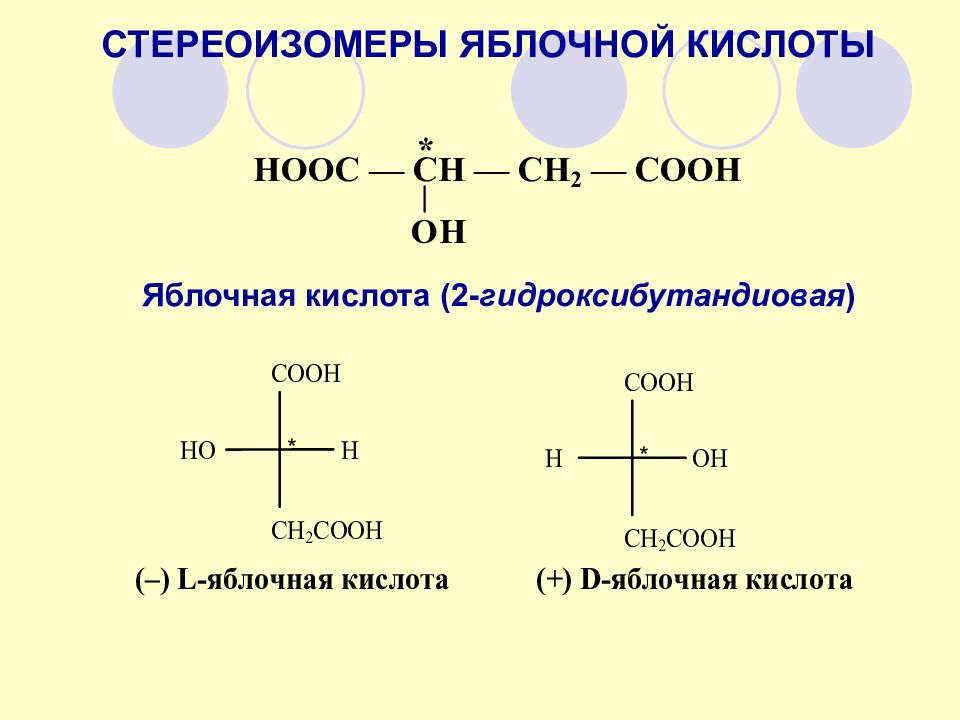
СТЕРЕОИЗОМЕРЫ ЯБЛОЧНОЙ КИСЛОТЫ Яблочная кислота (2- гидроксибутандиовая ) * *
Слайд 52: Стереоизомеры винной кислоты
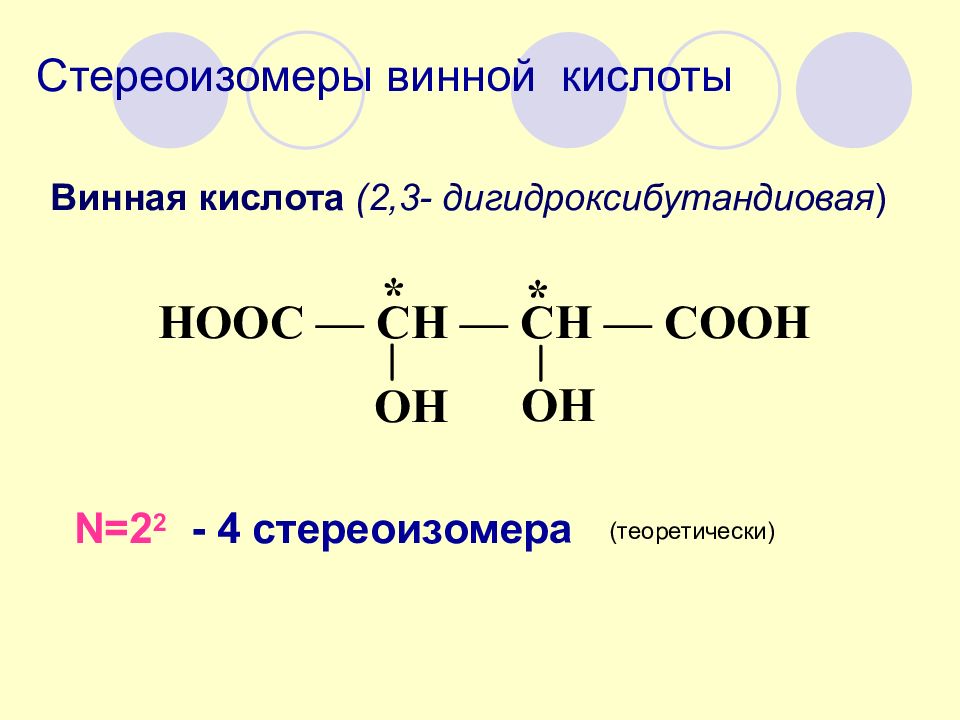
Винная кислота (2,3- дигидроксибутандиовая ) N=2 2 - 4 стереоизомера (теоретически)
Слайд 53
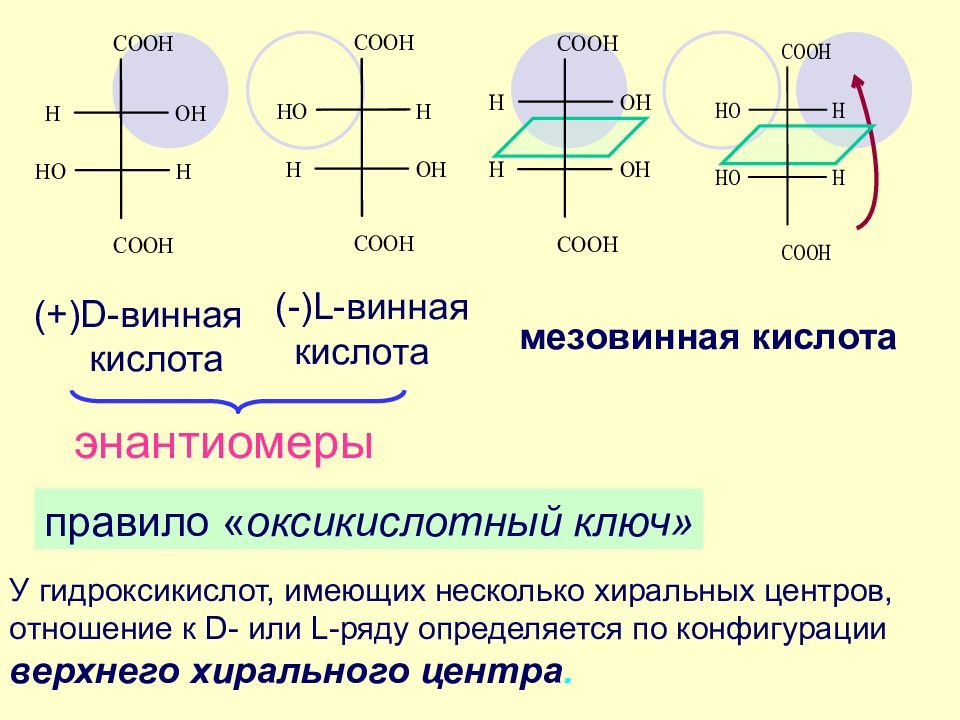
правило « оксикислотный ключ» (+)D-винная кислота (-)L-винная кислота мезовинная кислота энантиомеры У гидроксикислот, имеющих несколько хиральных центров, отношение к D- или L-ряду определяется по конфигурации верхнего хирального центра.
Слайд 54
D- и L – винные кислоты - энантиомеры D-винная кислота и мезовинная к-та – диастереомеры L-винная кислота и мезовинная к-та – диастереомеры Диастереомеры — стереоизомеры, не являющиеся зеркальным отражением друг друга и обладающие различными физическими и химическими свойствами Смесь D- и L - винных кислот называют виноградной кислотой ( рацемическая смесь ) ЭНАНТИОМЕРЫ и ДИАСТЕРЕОМЕРЫ ВИННОЙ КИСЛОТЫ
Слайд 55
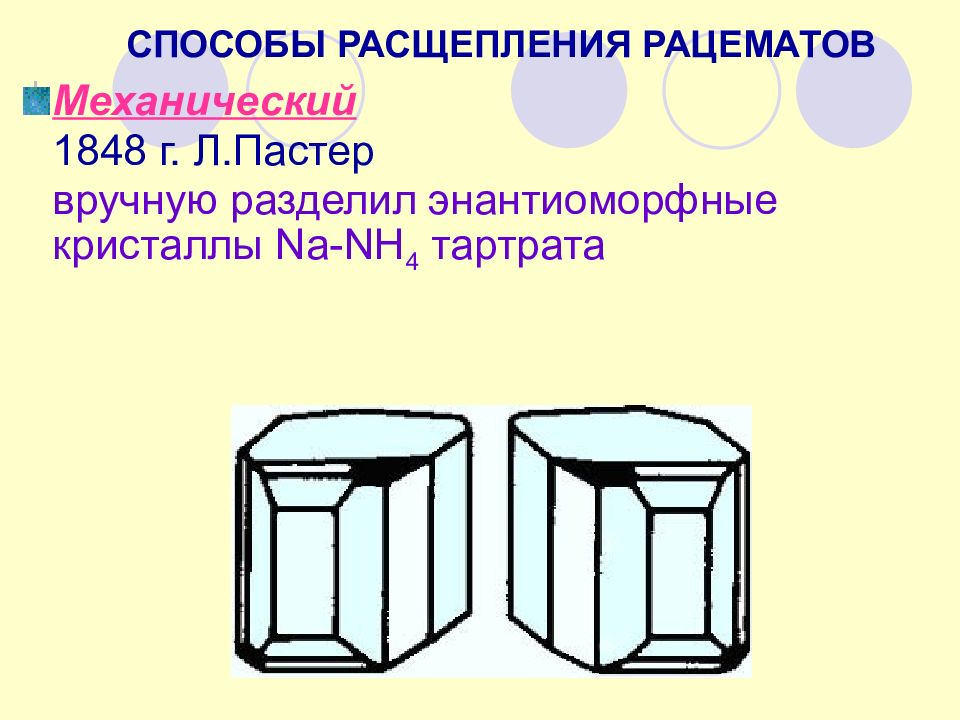
СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВ Механический 1848 г. Л.Пастер вручную разделил энантиоморфные кристаллы Na-NH 4 тартрата
Слайд 56
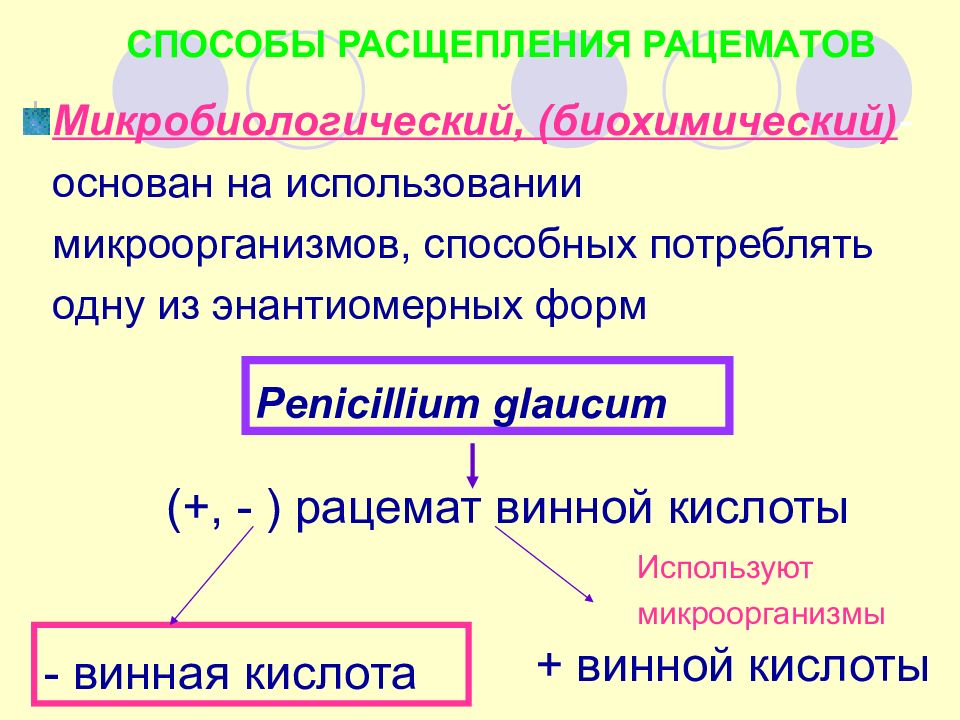
СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВ Микробиологический, (биохимический) - основан на использовании микроорганизмов, способных потреблять одну из энантиомерных форм Penicillium glaucum (+, - ) рацемат винной кислоты - винная кислота + винной кислоты Используют микроорганизмы
Слайд 57
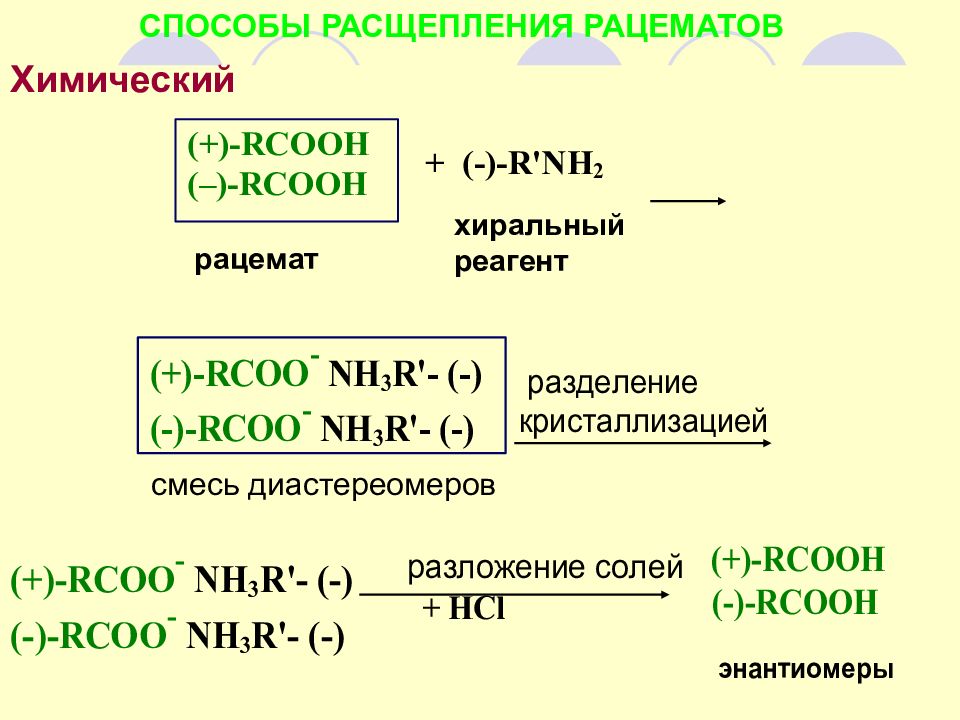
СПОСОБЫ РАСЩЕПЛЕНИЯ РАЦЕМАТОВ Химический - энантиомеры переводят в диастереомеры с последующим их разделением смесь диастереомеров Химический
Слайд 58: разделение рацемической смеси с помощью оптически активных хиральных сорбентов
АФФИННАЯ ХРОМАТОГРАФИЯ разделение рацемической смеси с помощью оптически активных хиральных сорбентов Аффинная хроматография основана на способности хирального сорбента связывать более эффективно один из энантиомеров смеси Так, в биохимической практике при пропускании через хроматографическую колонку с хиральным сорбентом биоэкстрактов выделяют: белки - ферменты, моноклональные антитела, рецепторные белки и др.
Слайд 59: Абсолютная конфигурация стереоизомеров
В 1951 году голландский ученый Бийвоет с использованием особого метода рентгеноструктурного анализа определил абсолютную конфигурацию Cs,Rb- соли D- винной кислоты и некоторых солей аминокислот и таким образом подтвердил что правовращающий глицериновый альдегид имеет D -конфигурацию.
Слайд 60
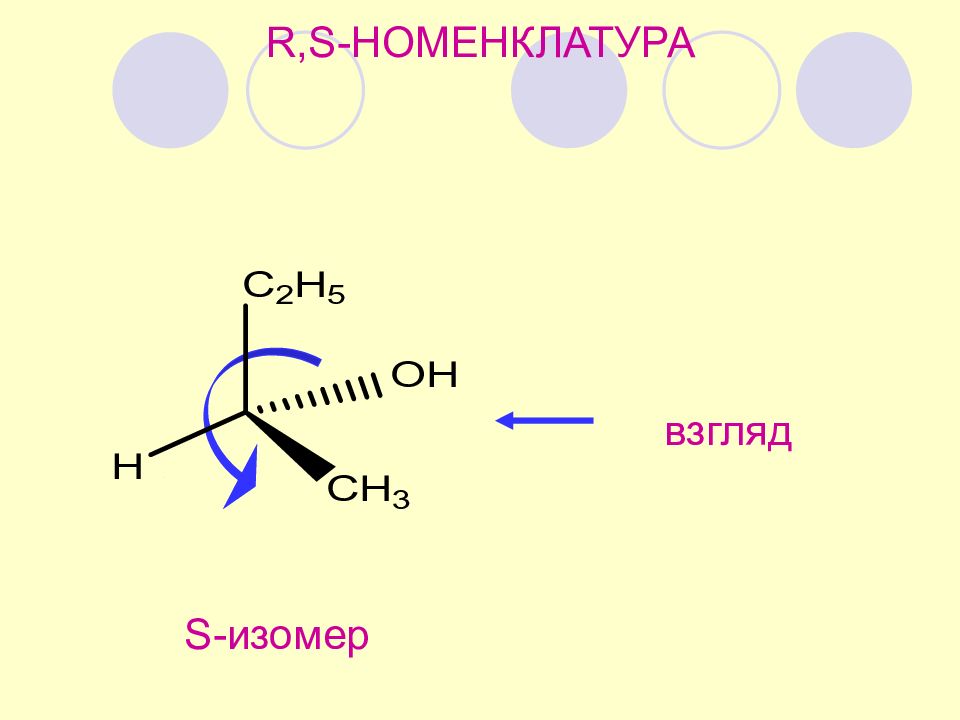
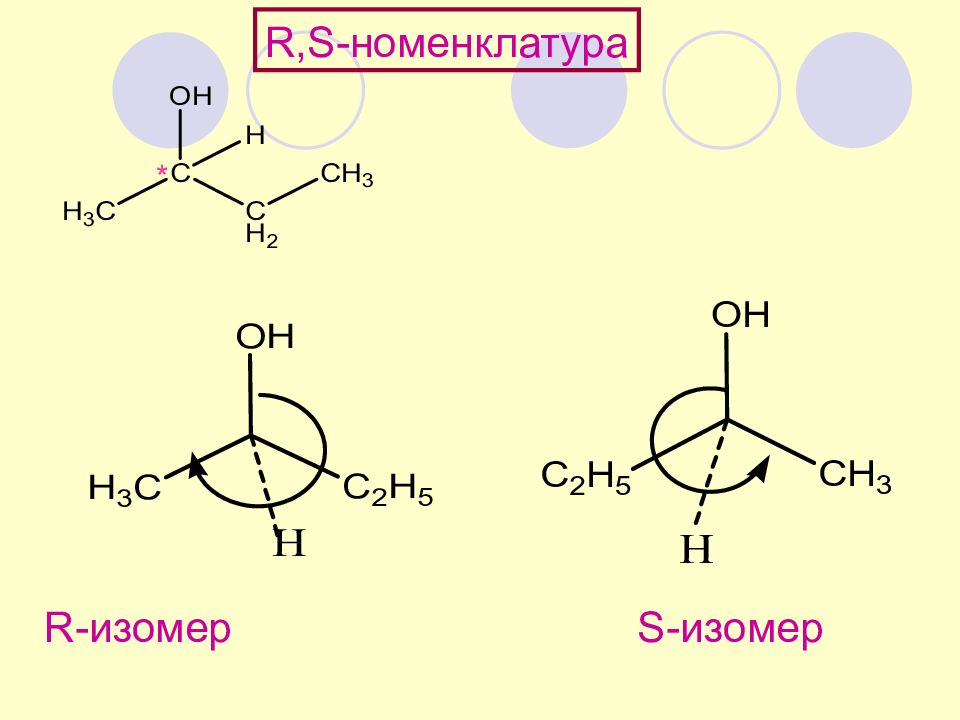
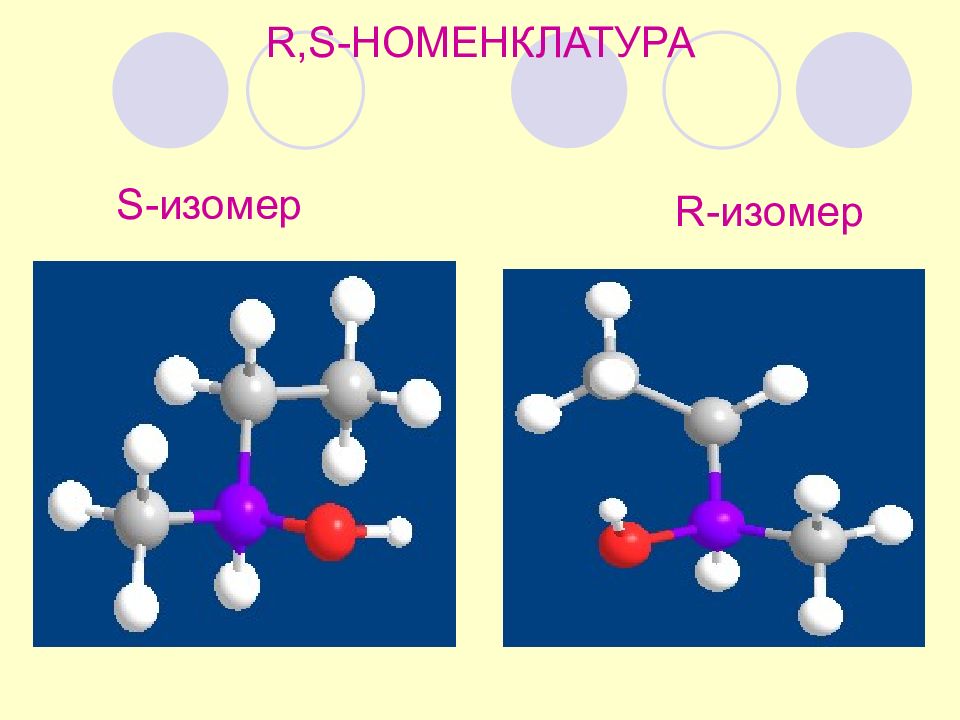
Убывание по часовой стрелке - R (от лат. rectu s правый) Убывание против часовой стрелки - S (от лат. sinister левый). R,S- номенклатура принадлежность к ряду R- или S - определяется порядком убывания старшинства заместителей у хирального центра Кан, Прелог, Ингольд Старшинство заместителей – по порядковому номеру в табл. Менделеева ( КИП )
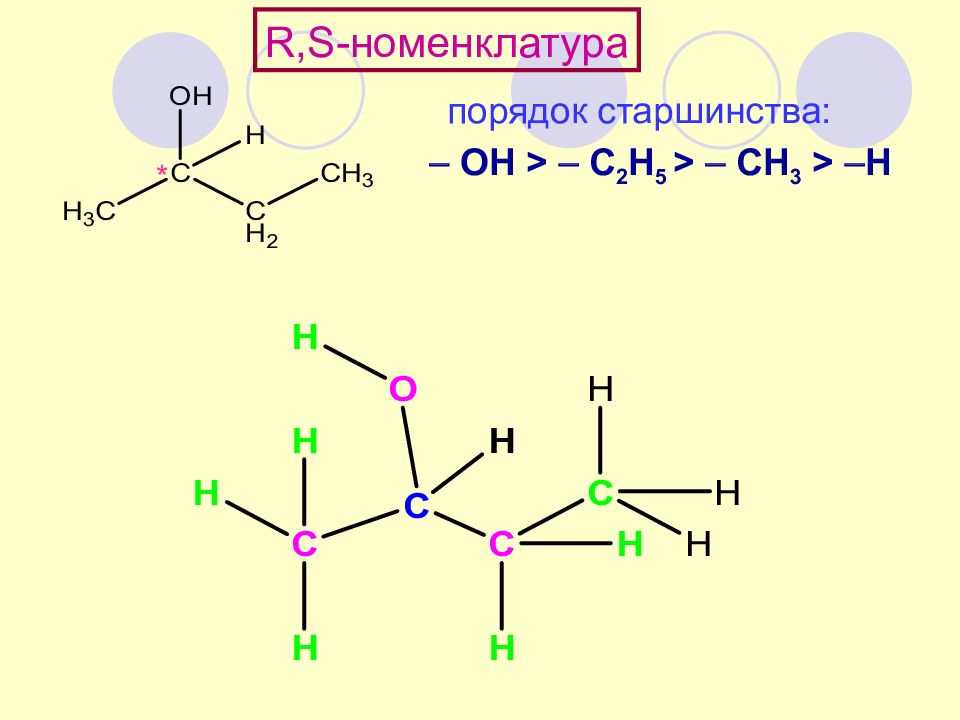
Слайд 62
R,S- номенклатура порядок старшинства: ОН > C 2 H 5 > CH 3 > H *
Слайд 64
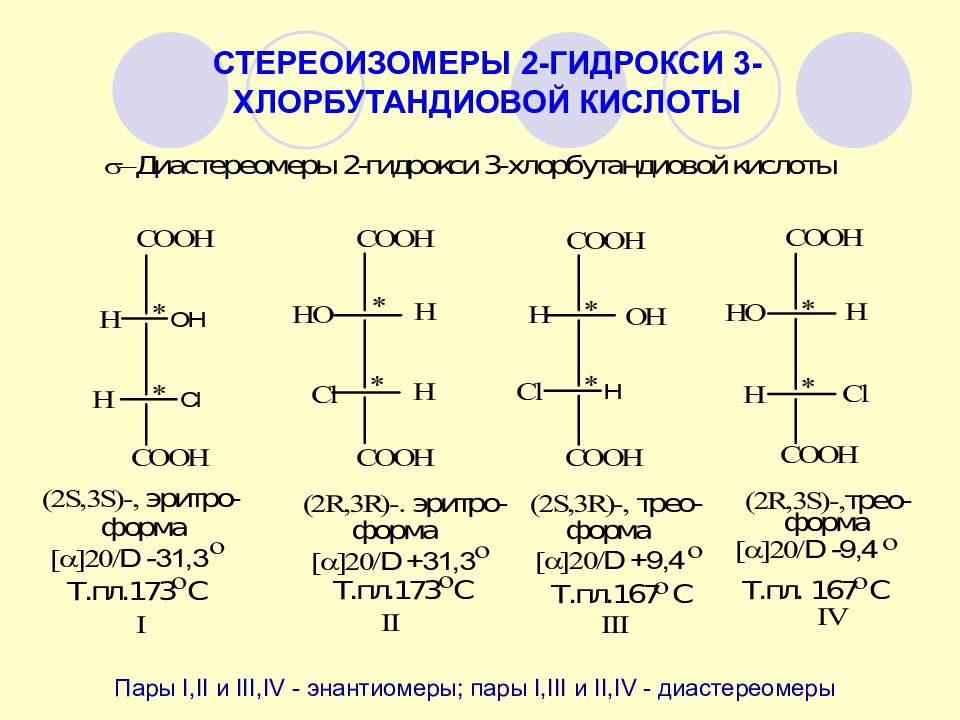
СТЕРЕОИЗОМЕРЫ 2-ГИДРОКСИ 3-ХЛОРБУТАНДИОВОЙ КИСЛОТЫ Пары I,II и III,IV - энантиомеры; пары I,III и II,IV - диастереомеры
Слайд 65
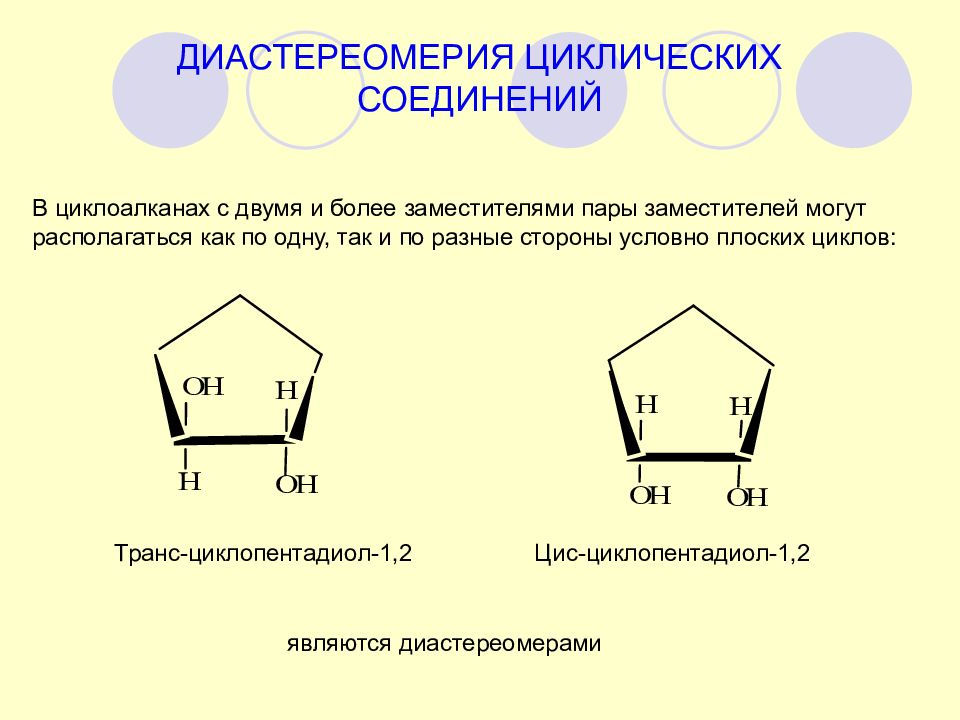
ДИАСТЕРЕОМЕРИЯ ЦИКЛИЧЕСКИХ СОЕДИНЕНИЙ В циклоалканах с двумя и более заместителями пары заместителей могут располагаться как по одну, так и по разные стороны условно плоских циклов: Транс-циклопентадиол-1,2 Цис-циклопентадиол-1,2 являются диастереомерами
Слайд 66
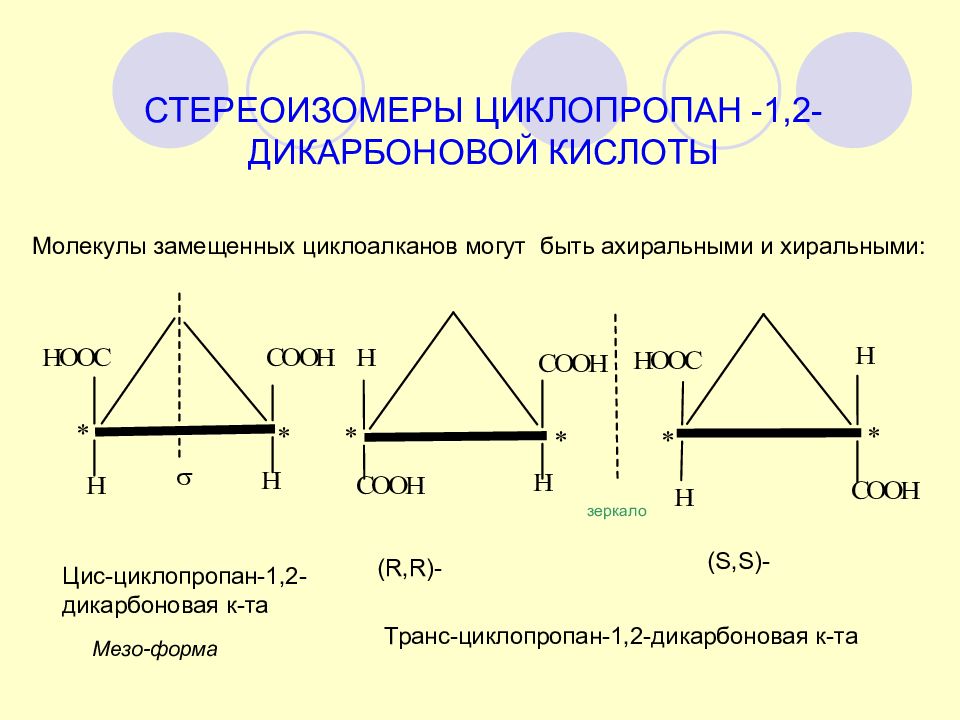
СТЕРЕОИЗОМЕРЫ ЦИКЛОПРОПАН -1,2-ДИКАРБОНОВОЙ КИСЛОТЫ Молекулы замещенных циклоалканов могут быть ахиральными и хиральными: зеркало Цис-циклопропан-1,2-дикарбоновая к-та ( R,R)- (S,S)- Транс-циклопропан-1,2-дикарбоновая к-та Мезо-форма
Слайд 67
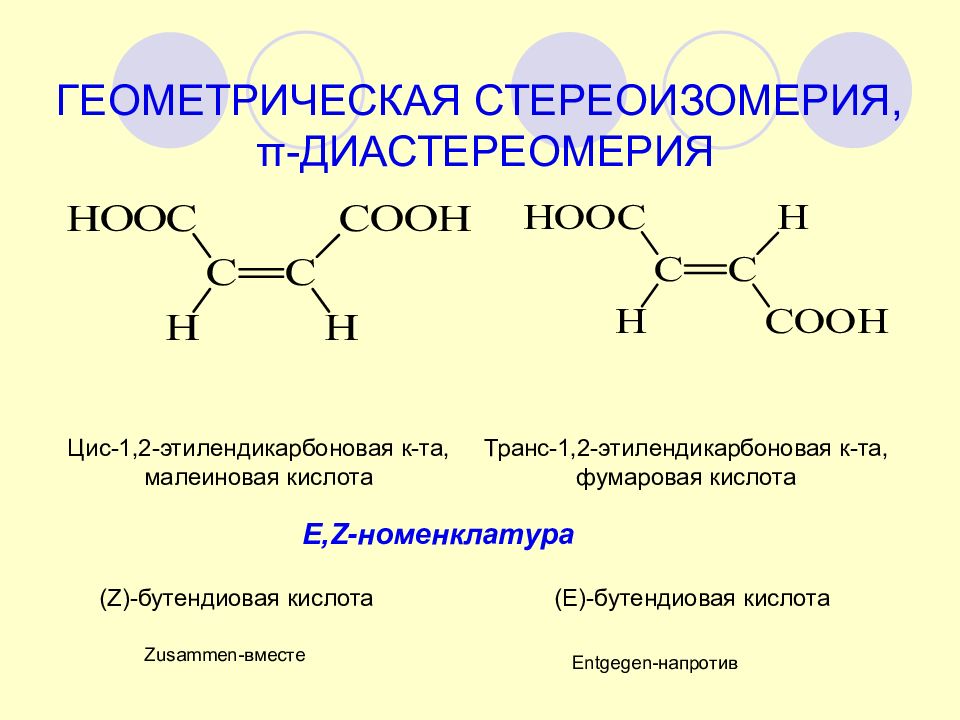
Цис-1,2-этилендикарбоновая к-та, малеиновая кислота Транс-1,2-этилендикарбоновая к-та, фумаровая кислота ГЕОМЕТРИЧЕСКАЯ СТЕРЕОИЗОМЕРИЯ, π -ДИАСТЕРЕОМЕРИЯ ( Z)- бутендиовая кислота (E)- бутендиовая кислота Zusammen- вместе Entgegen- напротив E,Z- номенклатура
Слайд 69: СВЯЗЬ ПРОСТРАНСТВЕННОГО СТРОЕНИЯ СОЕДИНЕНИЙ С ИХ БИОЛОГИЧЕСКОЙ АКТИВНОСТЬЮ
В организме реакции протекают с участием биокатализаторов – ферментов. Ферменты построены из хиральных молекул α - L- аминокислот, поэтому они чувствительны к хиральности взаимодействующих с ними субстратов. Хиральными молекулами являются также углеводы, фосфолипиды, витамины, гормоны, нуклеиновые кислоты.
Слайд 70: Определение комплементарности
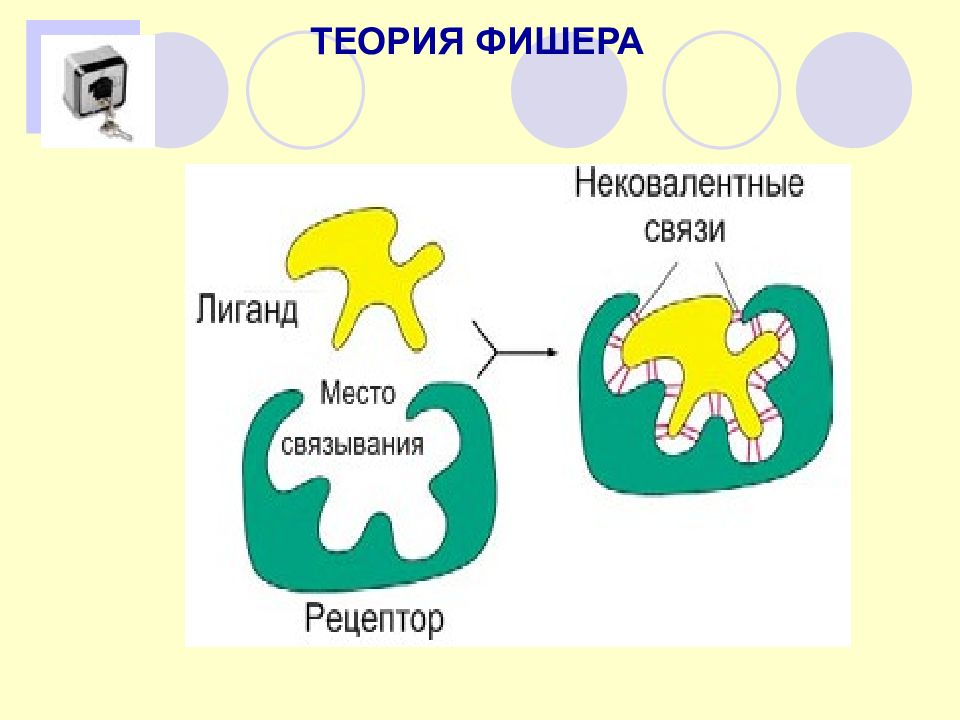
Комплементарность - пространствненная взаимодополняемость ( стерическое соответствие) поверхностей взаимодействующих молекул или их частей, приводящая, как правило, к образованию вторичных (ван-дер-ваальсовых, водородных,ионных ) связей между ними. Уникальность и прочность комплементарных структур определяется высокой избирательностью и значительной площадью гидрофобного взаимодействия на уровне атомных группировок или зарядов по принципу « ключ-замок » или « рука-перчатка ».
Слайд 71
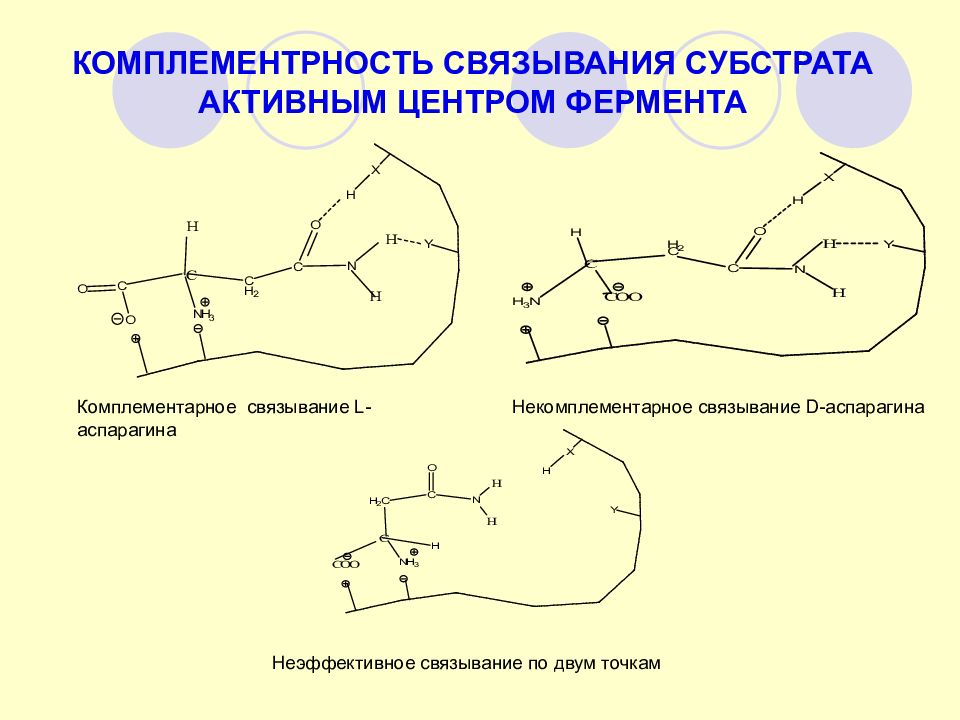
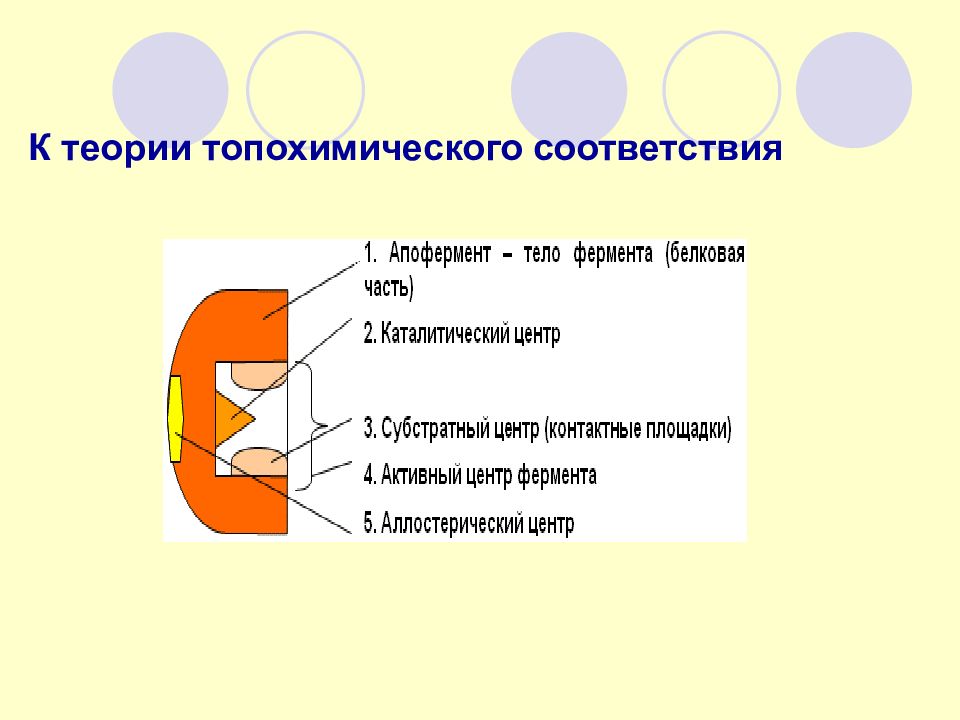
Комплементарное связывание L- аспарагина Некомплементарное связывание D- аспарагина Неэффективное связывание по двум точкам КОМПЛЕМЕНТРНОСТЬ СВЯЗЫВАНИЯ СУБСТРАТА АКТИВНЫМ ЦЕНТРОМ ФЕРМЕНТА
Слайд 73
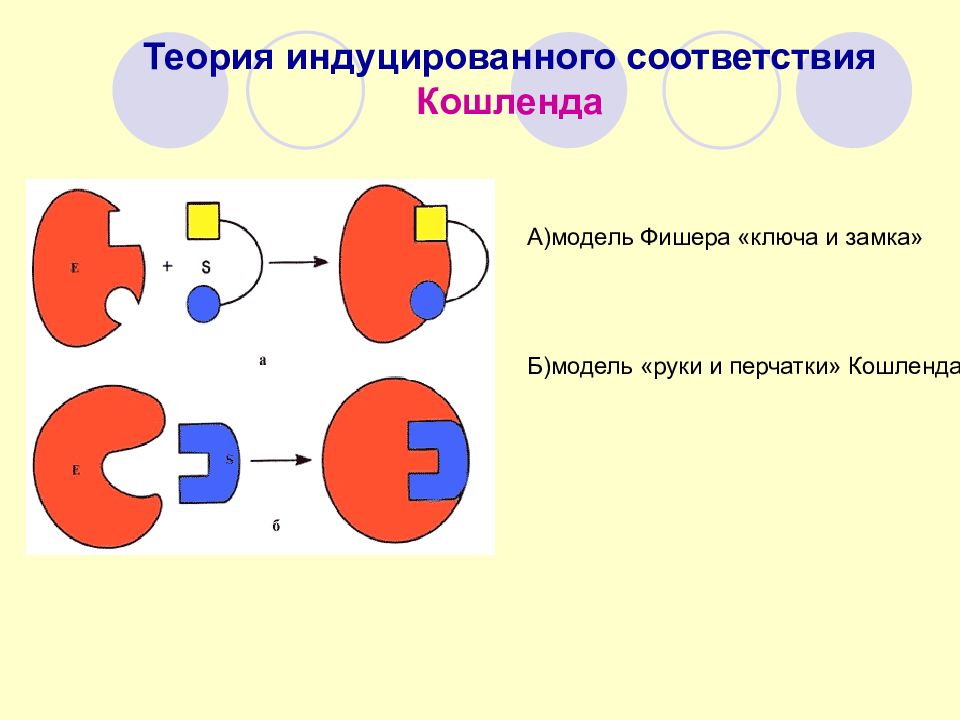
Теория индуцированного соответствия Кошленда А)модель Фишера «ключа и замка» Б)модель «руки и перчатки» Кошленда
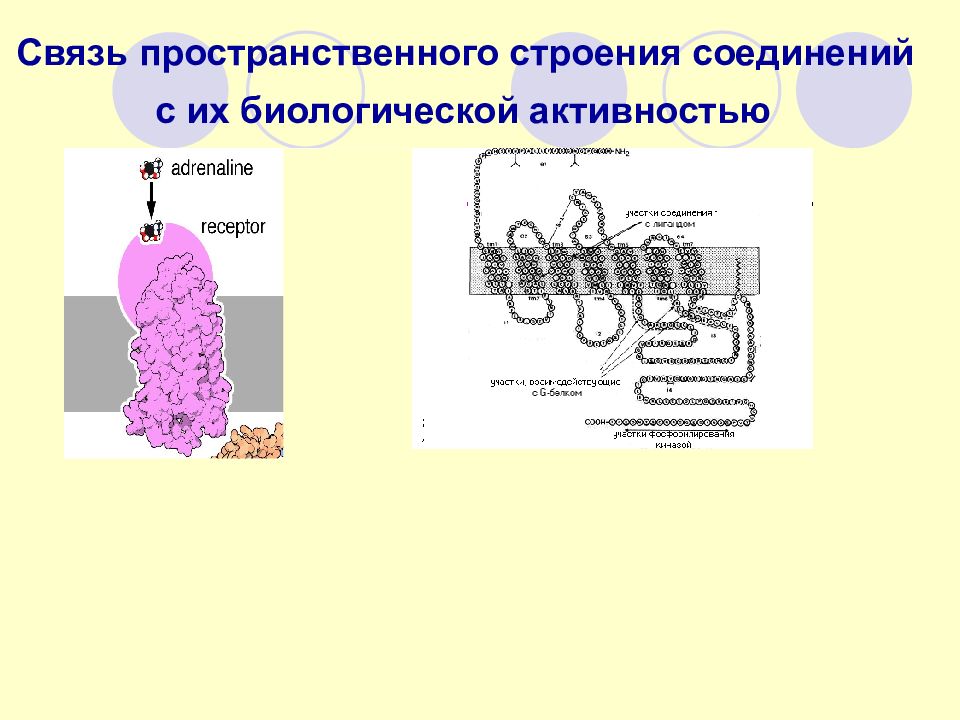
Слайд 75: Связь пространственного строения соединений с их биологической активностью
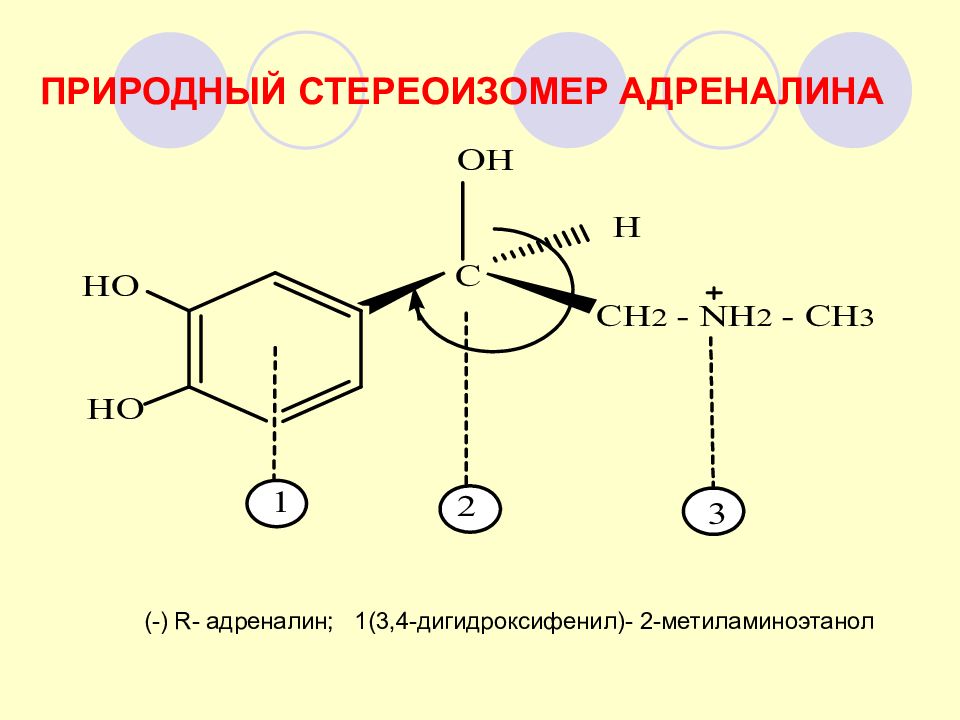
Слайд 76: ПРИРОДНЫЙ СТЕРЕОИЗОМЕР АДРЕНАЛИНА
(-) R - адреналин; 1(3,4-дигидроксифенил)- 2-метиламиноэтанол
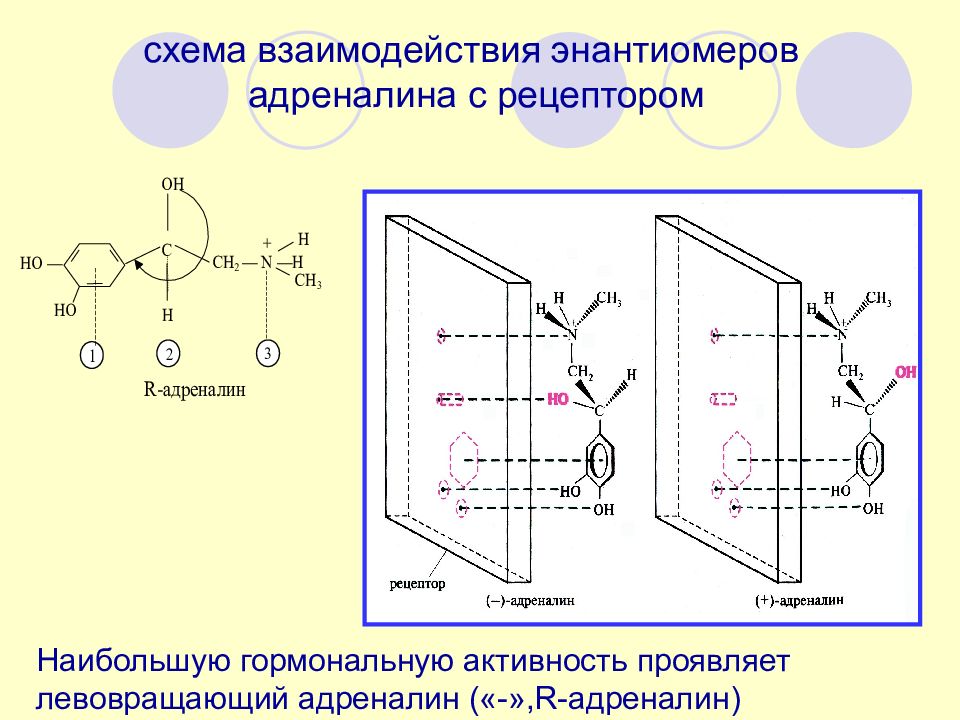
Слайд 77
схема взаимодействия энантиомеров адреналина с рецептором Наибольшую гормональную активность проявляет левовращающий адреналин («-», R- адреналин)
Слайд 85: М. Ломоносов 1751
«Слово о пользе химии» « …медик без довольного знания химии совершенен быть не может…»
Слайд 86
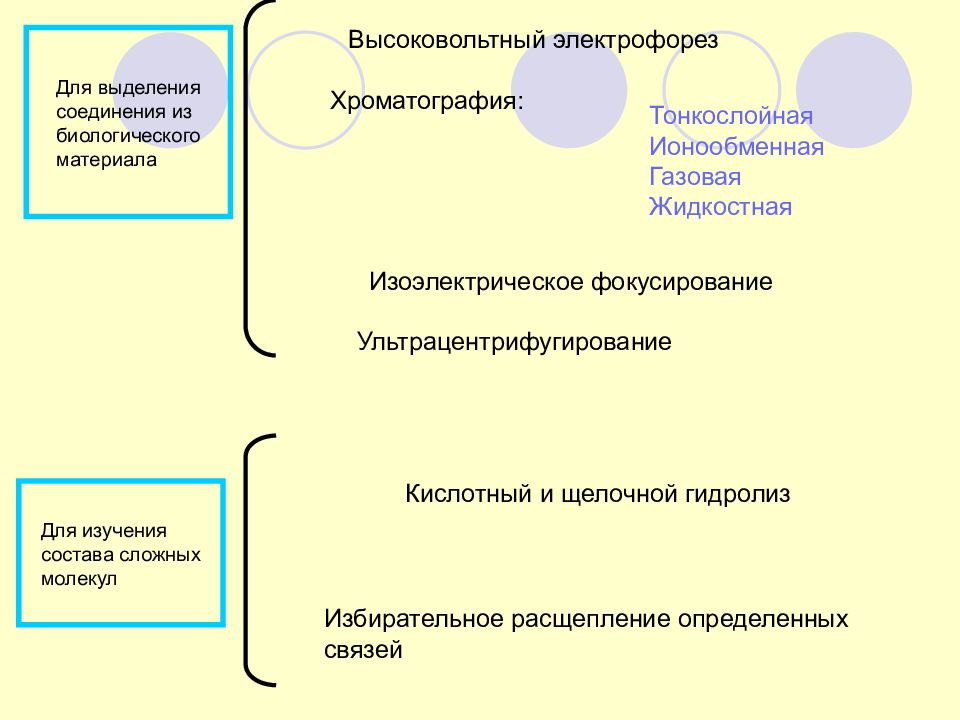
Высоковольтный электрофорез Для выделения соединения из биологического материала Хроматография: Тонкослойная Ионообменная Газовая Жидкостная Изоэлектрическое фокусирование Ультрацентрифугирование Для изучения состава сложных молекул Кислотный и щелочной гидролиз Избирательное расщепление определенных связей
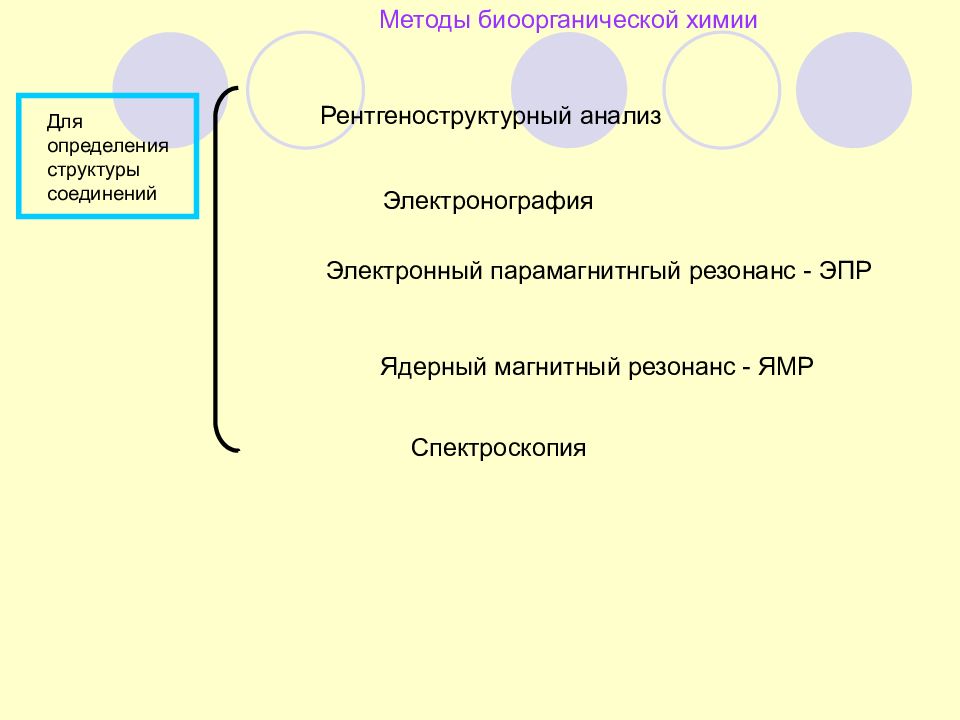
Слайд 87: Методы биоорганической химии
Для определения структуры соединений Рентгеноструктурный анализ Электронография Электронный парамагнитнгый резонанс - ЭПР Ядерный магнитный резонанс - ЯМР Спектроскопия
Слайд 88: Эпиграф к курсу лекций по БОХ
«Химики и врачи – это те, кто на самом деле понимают мир» Л.Полинг
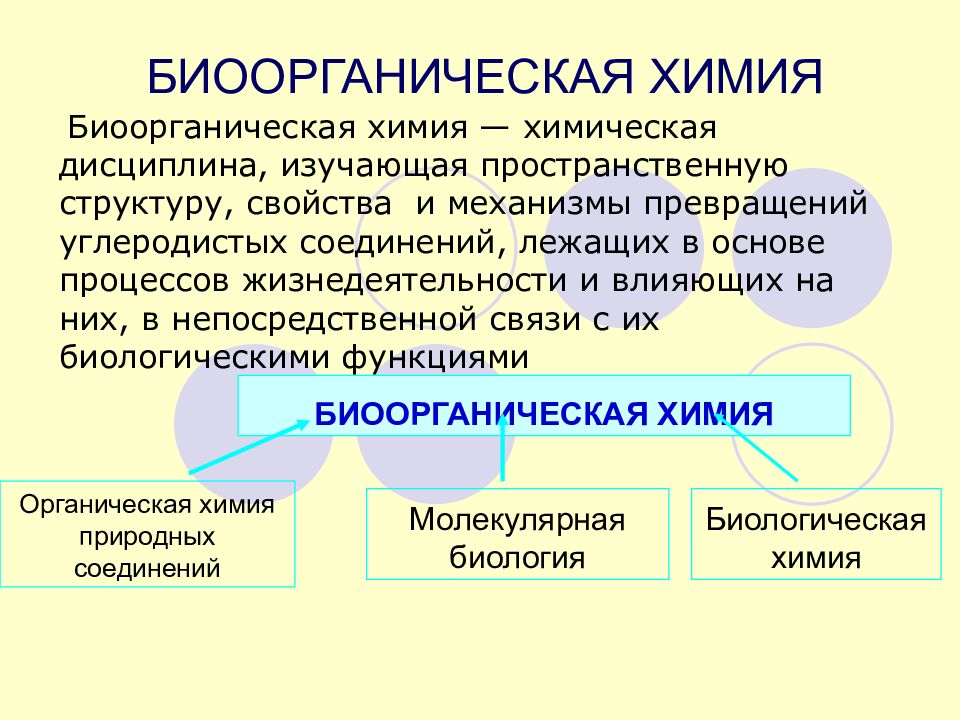
Слайд 89: БИООРГАНИЧЕСКАЯ ХИМИЯ
Биоорганическая химия — химическая дисциплина, изучающая пространственную структуру, свойства и механизмы превращений углеродистых соединений, лежащих в основе процессов жизнедеятельности и влияющих на них, в непосредственной связи с их биологическими функциями БИООРГАНИЧЕСКАЯ ХИМИЯ Органическая химия природных соединений Молекулярная биология Биологическая химия
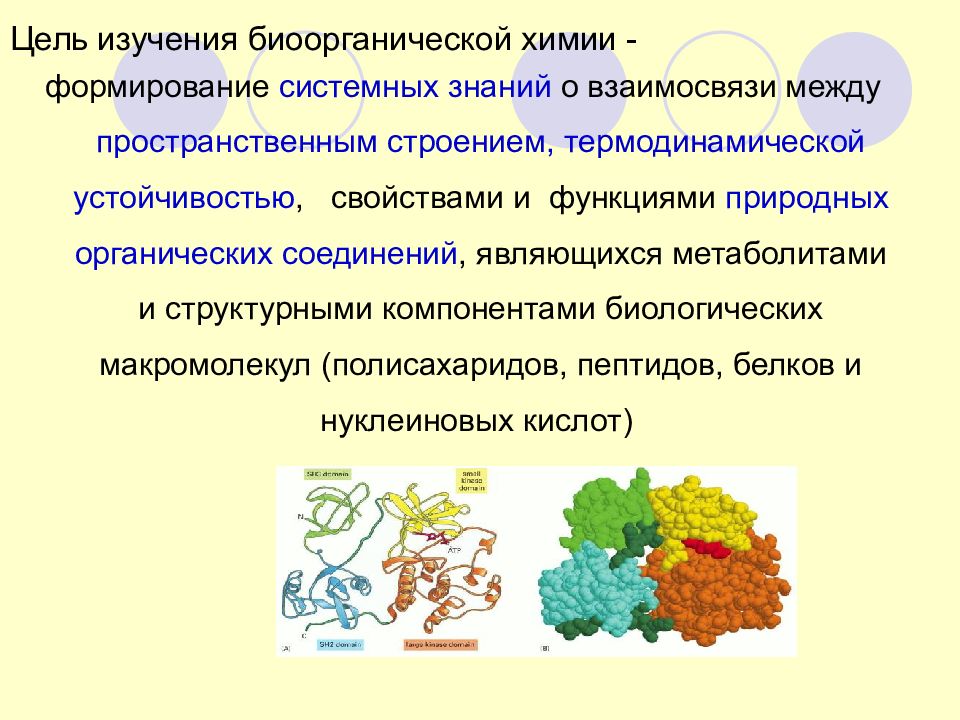
Слайд 90: Цель изучения биоорганической химии -
формирование системных знаний о взаимосвязи между пространственным строением, термодинамической устойчивостью, свойствами и функциями природных органических соединений, являющихся метаболитами и структурными компонентами биологических макромолекул (полисахаридов, пептидов, белков и нуклеиновых кислот)
Слайд 91: История становления биоорганической химии
Началом становления БОХ следует считать 1953г., когда ДюВиньо впервые получил химическим синтезом полипептидный гормон вазопрессин. Но без истории развития органической химии и химии природных соединений этот синтез был бы невозможным.
Слайд 92: Этапы развития химии природных соединений
1. Эмпирический (с середины 18 в.до конца 19 в.).От первоначального знакомства человека с органическими веществами до возникновения органической химии как науки. Термин органическая химия был введен шведск.уч.И.Берцеллиусом для определения химии растительных и животных веществ.
Слайд 93: Этапы развития органической химии
2. Аналитический (конец 18-середина 19в.).Появились методы установления состава органических веществ. Было показано что все органические вещества содержат углерод, а также в их состав могут входить такие элементы как водород,азот, сера, кислород,фосфор. Период господства витализма – особой жизненной силы.
Слайд 94: Этапы развития органической химии
3. Синтетический. В 1828 г.Ф.Велер синтезировал орган. в-во мочевину из неорган.-цианата аммония и тем самым положил начало этому этапу развития органической химии. 4. Структурный (вт.половина19-начало 20в.).Рождение научной теории строения органических соединений-А.М.Бутлеров,Кекуле, Майер. 5. Современный и выделение БОХ (вторая пол.20в.).
Слайд 95: Уровни исследования живых организмов
Молекулярный Надмолекулярный Биоорганическая химия Бионеорганическая химия Биофизика Клеточный Тканевой, органный Гистология Патанатомия Организменный Микробиология Биохимия Клинические дисциплины Популяционный Биогеоценозный Биология Эпидемиология Генетика Биосферный Экология
Слайд 96: акад. Виталий Гольданский
– это особая форма существования биополимерных тел (систем), характеризующихся хиральной чистотой и способностью к самоорганизации и саморепликации в условиях постоянного обмена с окружающей средой веществом, энергией и информацией 1986 г. Жизнь
Слайд 97: Специфика биоорганического подхода к изучению жизнедеятельности
использование молекулярных моделей,т.е.синтетических пептидов,нуклеотидов,других биологически значимых молекул и биоорегуляторов; их модифицированных аналогов; проведение исследований как in vitro, так и in vivo ; стремление понять и объяснить почему клетка,ее структуры, макромолекулы, биорегуляторы устроены так, а не иначе на основе современных химических представлений.
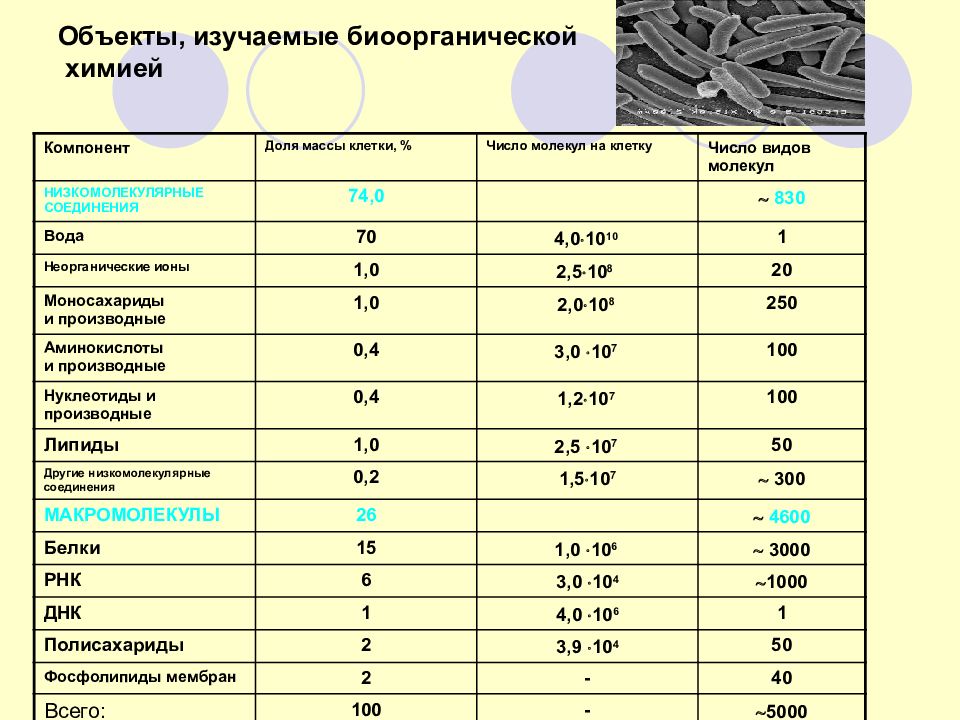
Слайд 98: Объекты, изучаемые биоорганической химией
Компонент Доля массы клетки, % Число молекул на клетку Число видов молекул НИЗКОМОЛЕКУЛЯРНЫЕ СОЕДИНЕНИЯ 74,0 830 Вода 70 4,0 10 10 1 Неорганические ионы 1,0 2,5 10 8 20 Моносахариды и производные 1,0 2,0 10 8 250 Аминокислоты и производные 0,4 3,0 10 7 100 Нуклеотиды и производные 0,4 1,2 10 7 100 Липиды 1,0 2,5 10 7 50 Другие низкомолекулярные соединения 0,2 1,5 10 7 300 МАКРОМОЛЕКУЛЫ 26 4600 Белки 15 1,0 10 6 3000 РНК 6 3,0 10 4 1000 ДНК 1 4,0 10 6 1 Полисахариды 2 3,9 10 4 50 Фосфолипиды мембран 2 - 40 Всего: 100 - 5000
Слайд 99: Объекты, изучаемые биоорганической химией
1.Низкомолекулярные метаболиты и биорегуляторы Оксикислоты Кетокислоты Аминокислоты Моносахариды Высшие жирные кислоты Витамины Гормоны Нуклеотиды и др. 2.Биомакромолекулы Полисахариды Белки Нуклеиновые кислоты Фосфолипиды Синтетические полимерные материалы, применяемые в медицине