Слайд 3
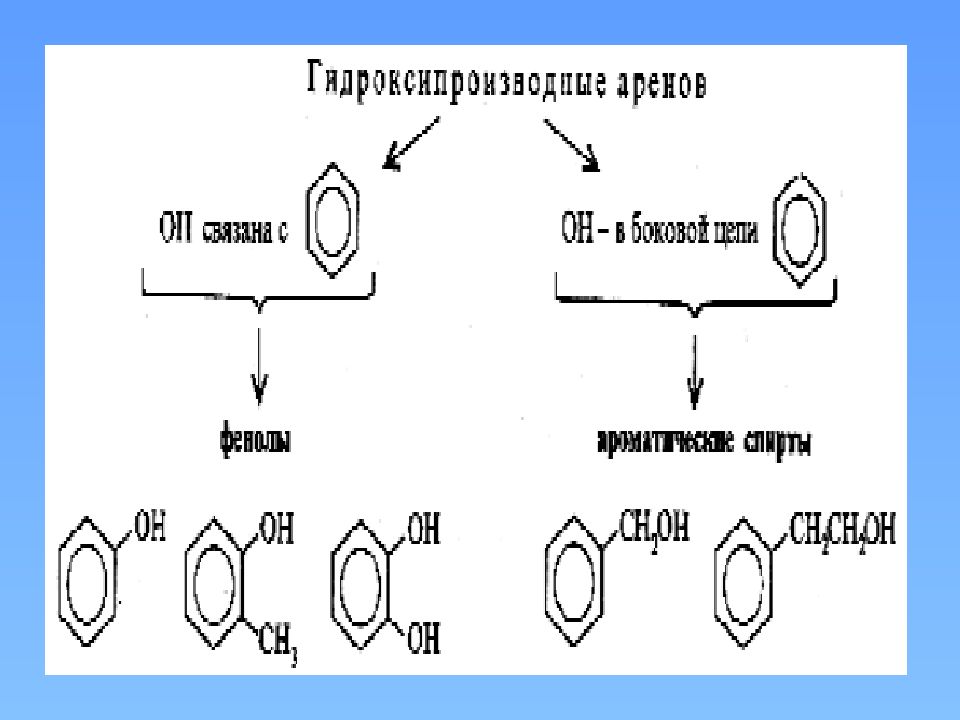
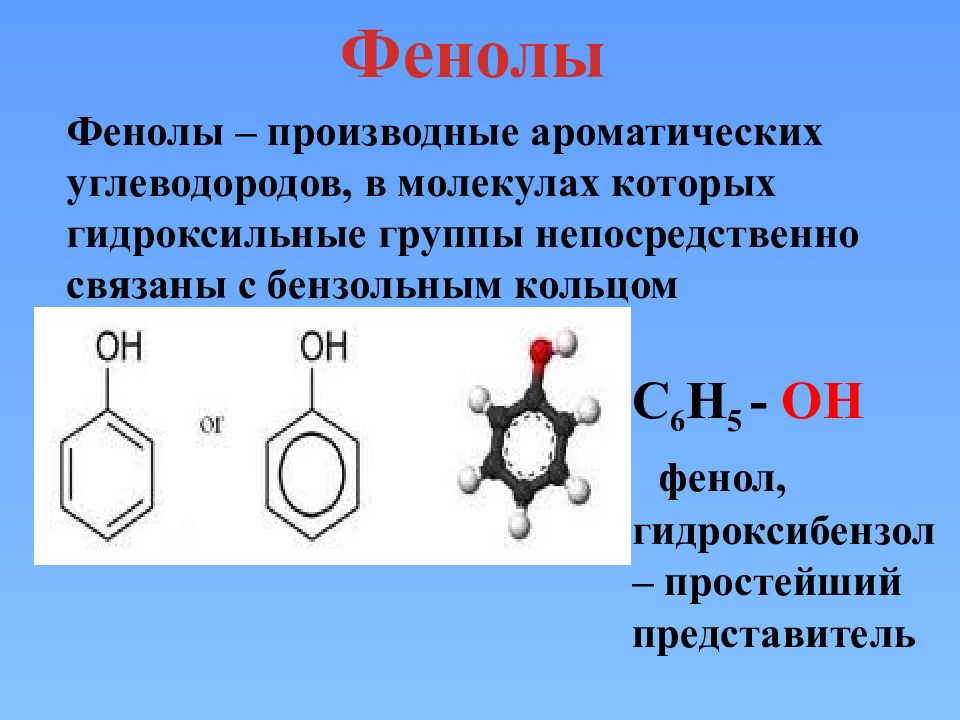
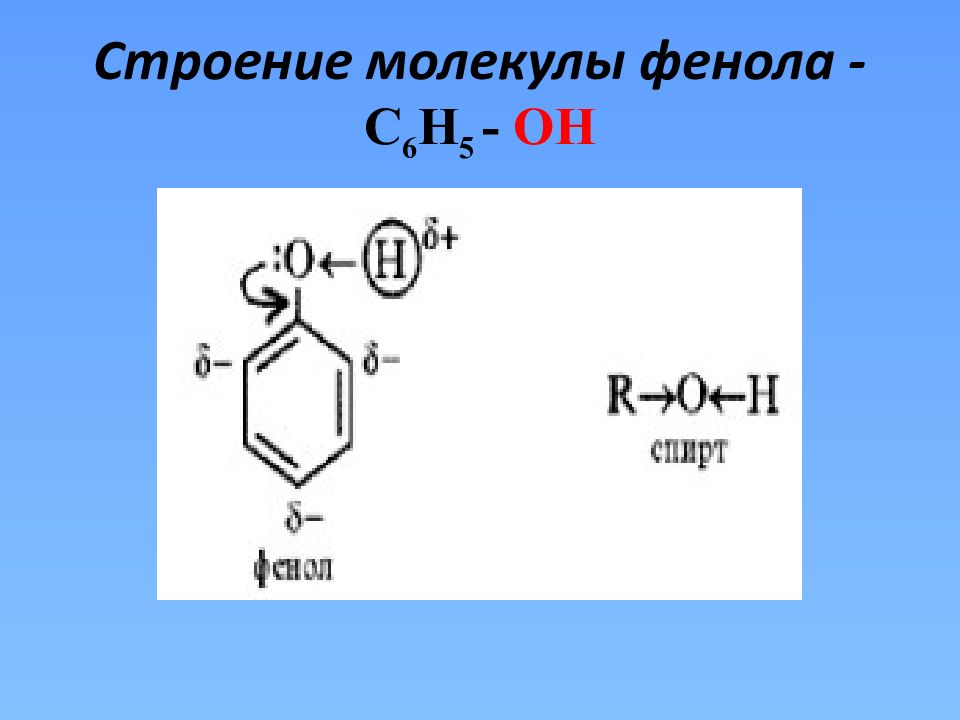
Фенолы С 6 Н 5 - ОН фенол, гидроксибензол – простейший представитель Фенолы – производные ароматических углеводородов, в молекулах которых гидроксильные группы непосредственно связаны с бензольным кольцом
Слайд 4
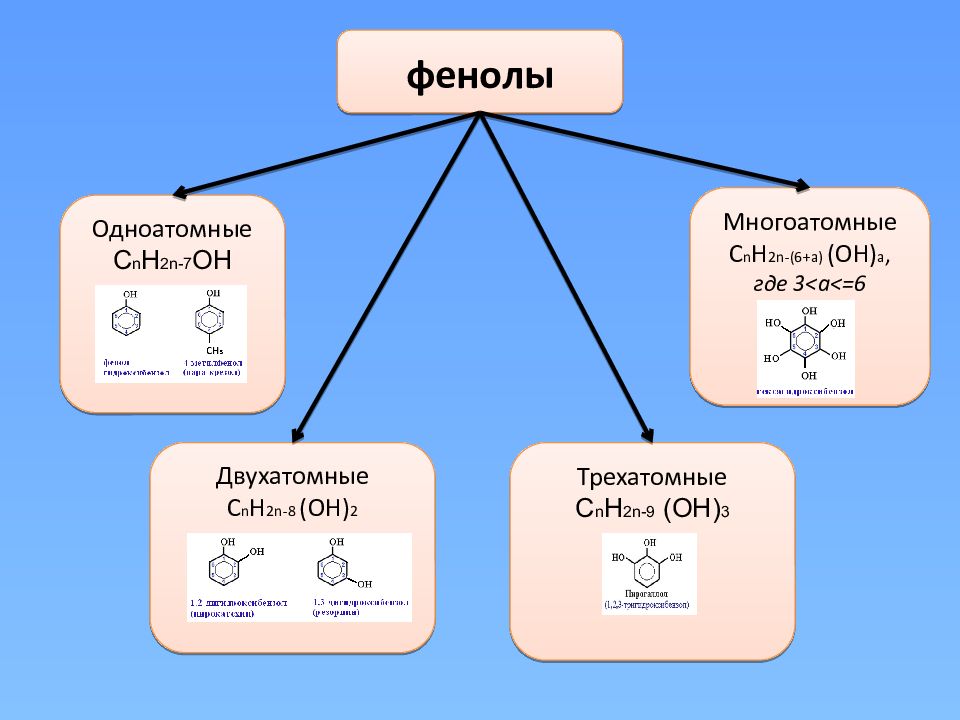
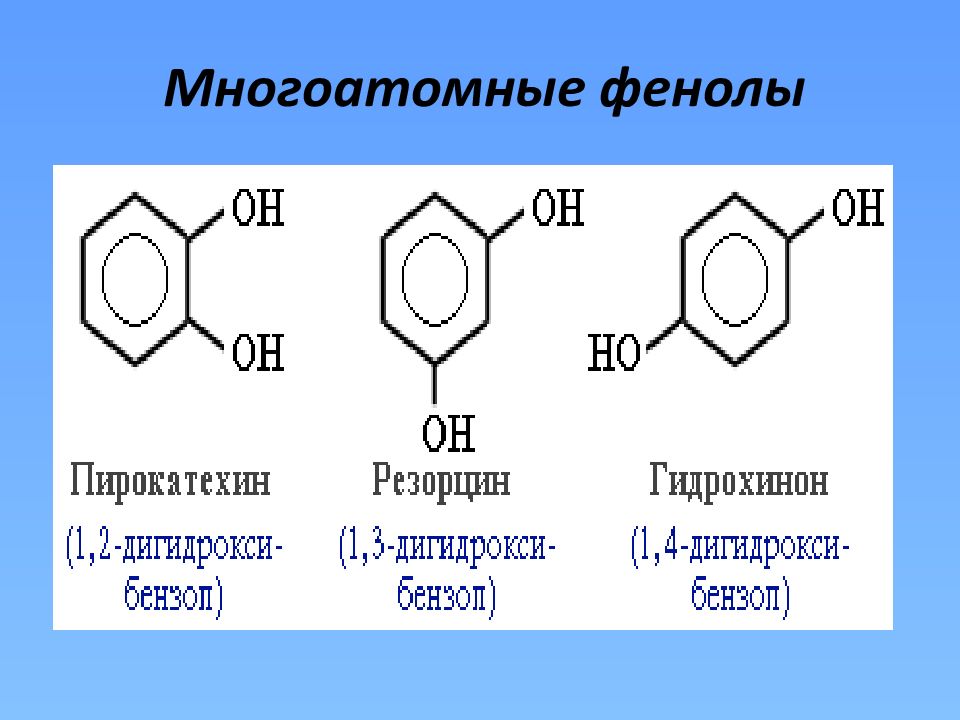
фенолы Одноатомные С n H 2n-7 OH Двухатомные С n H 2n-8 (OH) 2 Многоатомные С n H 2n-(6+a) (OH) a, где 3 <a<=6 Трехатомные С n H 2n-9 (OH) 3
Слайд 7
Фенолы Физические свойства Игольчатые бецветные кристаллы с характерным запахом (розовеют на воздухе в результате окисления), мало растворим в холодной воде, неограниченно – в горячей, t кип. =43С, t пл. =182С, антисептик, вызывает ожоги кожи, яд!
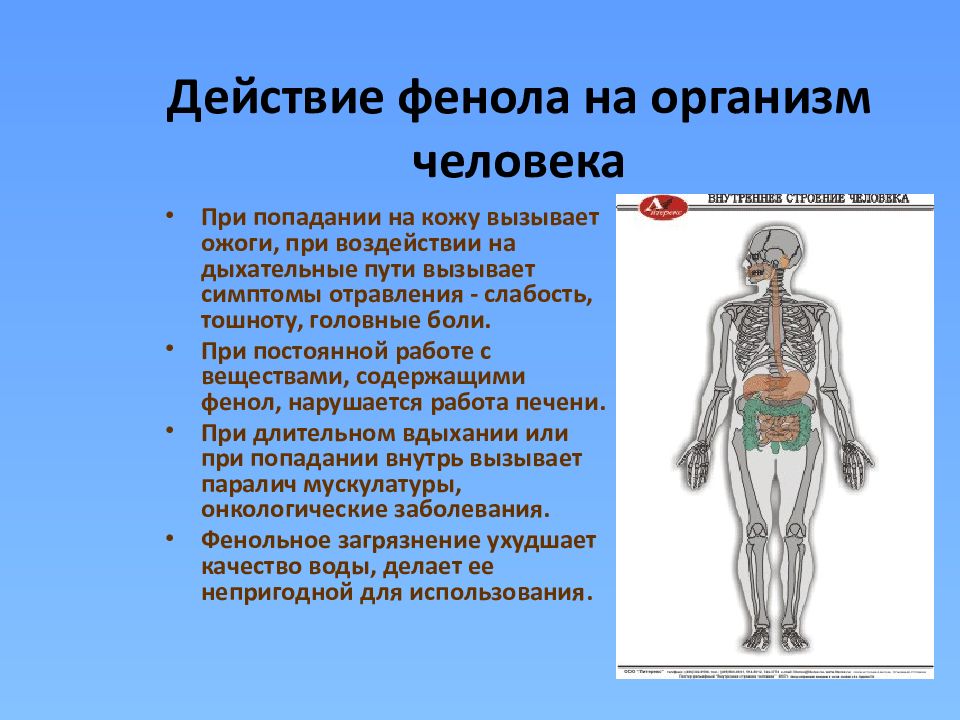
Слайд 8: Действие фенола на организм человека
При попадании на кожу вызывает ожоги, при воздействии на дыхательные пути вызывает симптомы отравления - слабость, тошноту, головные боли. При постоянной работе с веществами, содержащими фенол, нарушается работа печени. При длительном вдыхании или при попадании внутрь вызывает паралич мускулатуры, онкологические заболевания. Фенольное загрязнение ухудшает качество воды, делает ее непригодной для использования.
Слайд 9
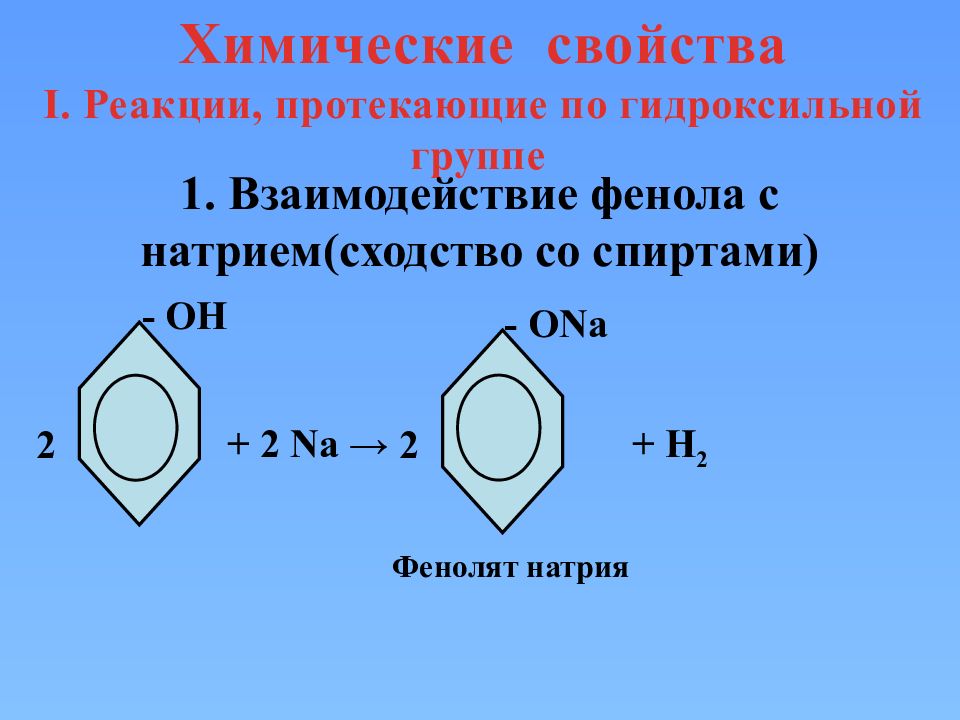
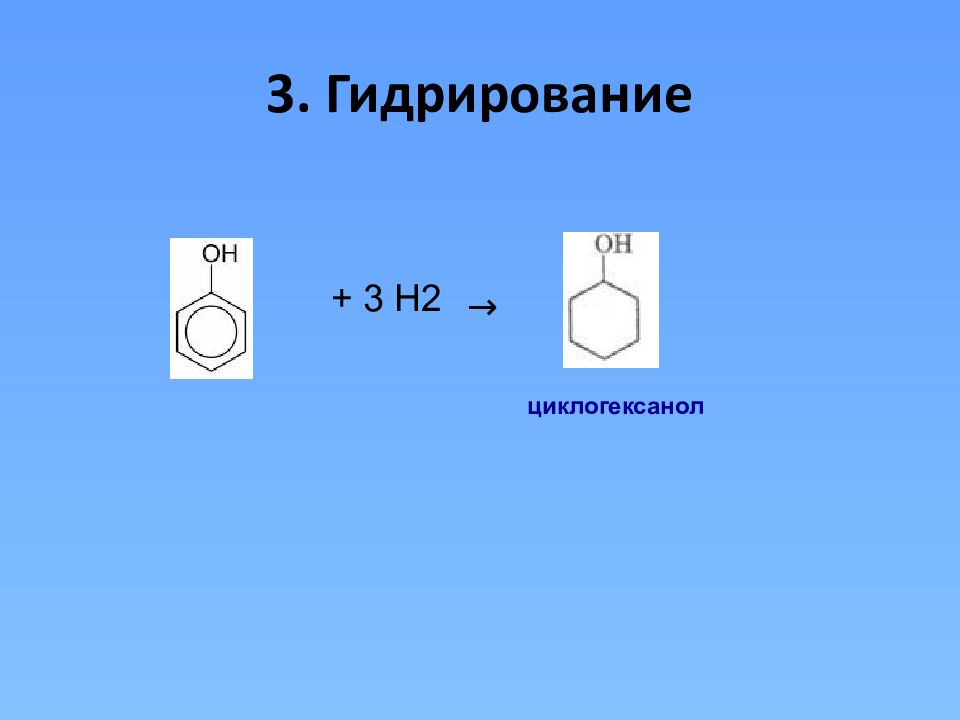
Химические свойства I. Реакции, протекающие по гидроксильной группе 1. Взаимодействие фенола с натрием(сходство со спиртами) - ОН + 2 Na → - О Na + H 2 2 2 Фенолят натрия
Слайд 10
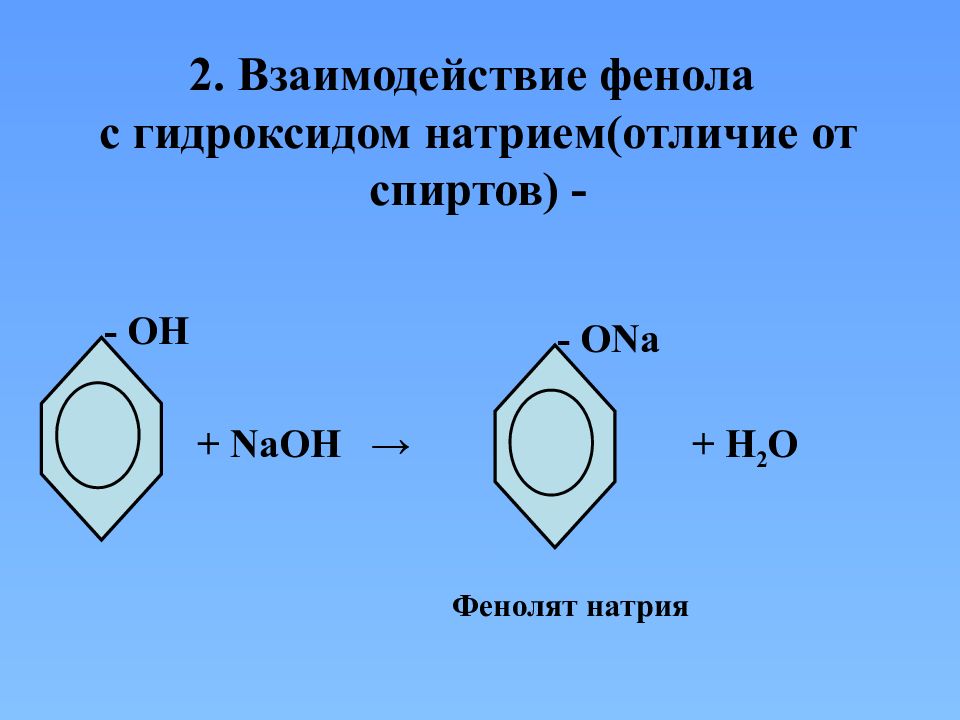
2. Взаимодействие фенола с гидроксидом натрием(отличие от спиртов) - - ОН + NaOH → - О Na + H 2 O Фенолят натрия
Слайд 11: Химические свойства
Кислотные свойства ( по группе ОН) 2 C 6 H 5 O-H + 2 Na-OH 2 C 6 H 5 ONa + H 2 O фенолят натрия Данная реакция указывает на кислотные свойства фенола. Фенол более слабая кислота, чем неорганические кислоты, его можно вытеснить из фенолятов даже угольной кислотой: C 6 H 5 ONa + CO 2 + H 2 O C 6 H 5 OH + NaHCO 3
Слайд 12: Вывод 1:
Бензольное кольцо повышает подвижность атома водорода в гидроксильной группе и усиливает кислотные свойства(у фенола выражены больше, чем у спиртов).
Слайд 13
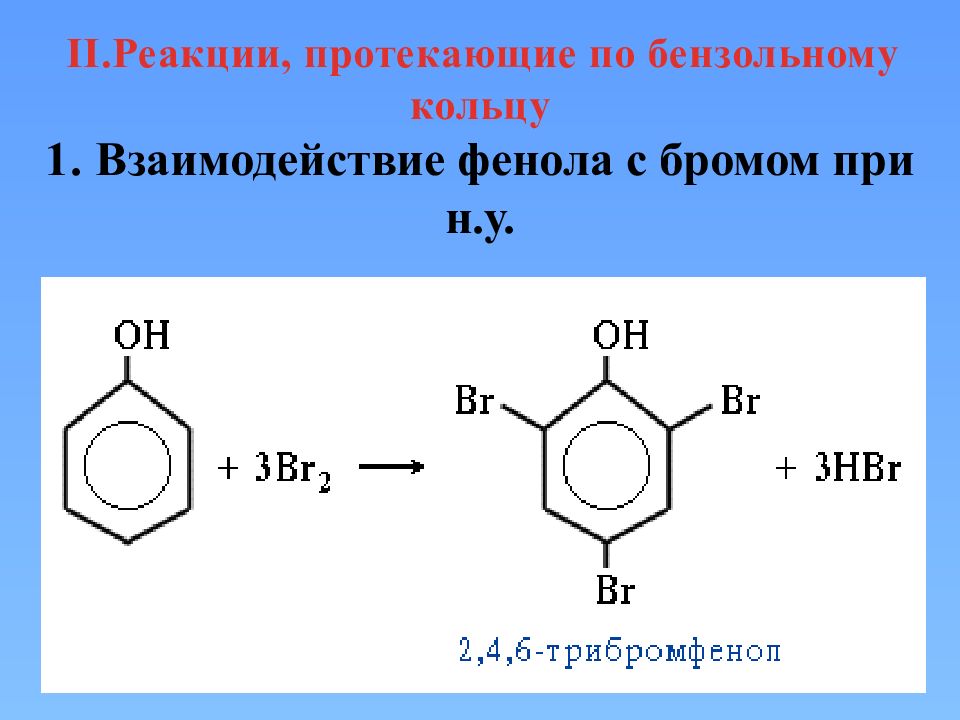
II.Реакции, протекающие по бензольному кольцу 1. Взаимодействие фенола с бромом при н.у.
Слайд 14
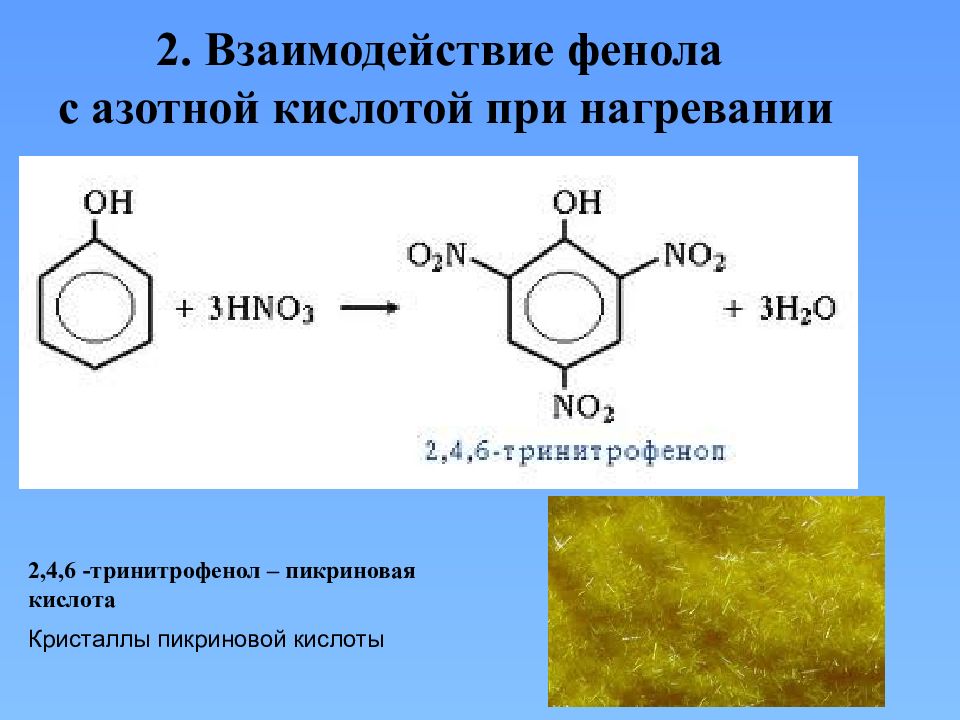
2. Взаимодействие фенола с азотной кислотой при нагревании 2,4,6 -тринитрофенол – пикриновая кислота Кристаллы пикриновой кислоты
Слайд 15: Вывод 2:
Гидроксильная группа обуславливает более лёгкое замещение атомов водорода в бензольном кольце в положениях 2,4,6. Вывод 3: Гидроксильная группа и бензольное кольцо взаимно влияют друг на друга.
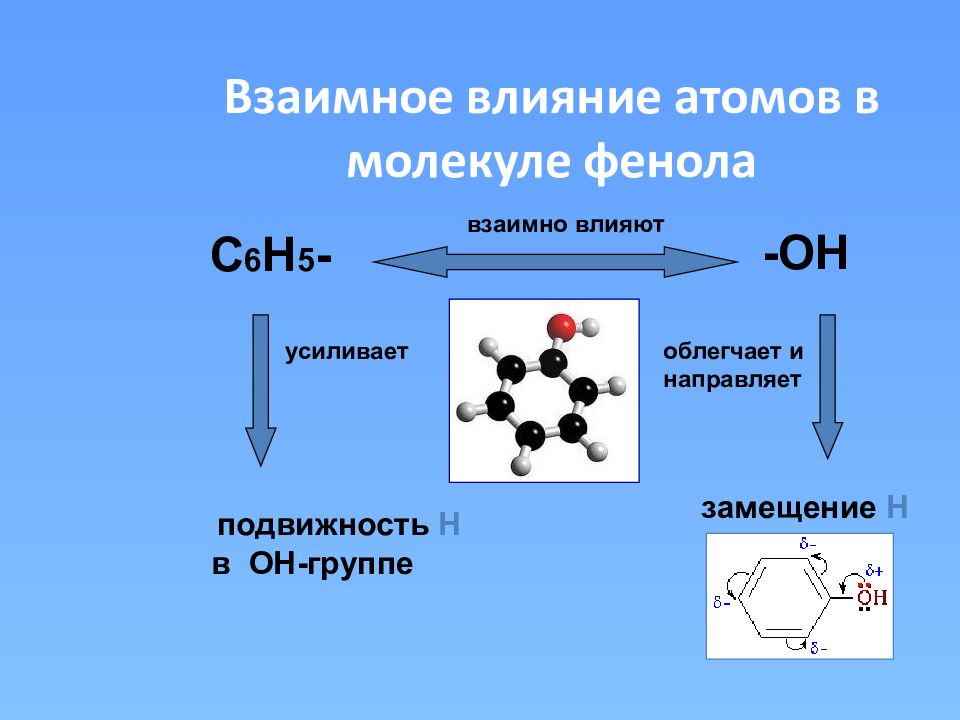
Слайд 16: Взаимное влияние атомов в молекуле фенола
С 6 Н 5 - -ОН взаимно влияют усиливает облегчает и направляет подвижность Н в ОН-группе замещение Н + + +
Слайд 18
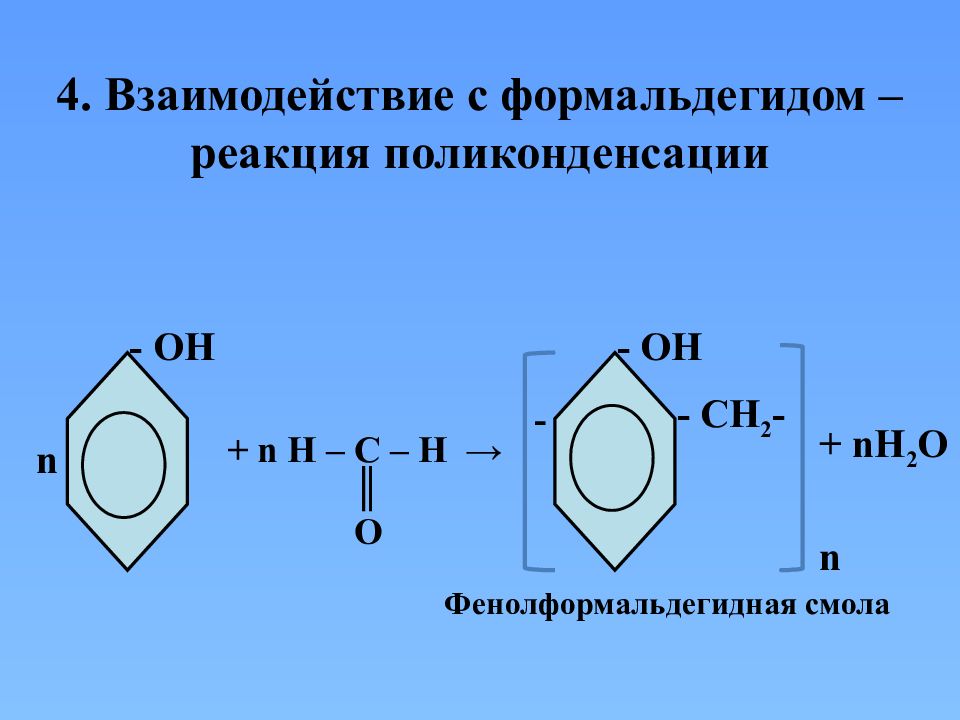
4. Взаимодействие с формальдегидом – реакция поликонденсации n - ОН + n H – C – H → ║ O - ОН - C Н 2 - - n Фенолформальдегидная смола + n Н 2 О
Слайд 19
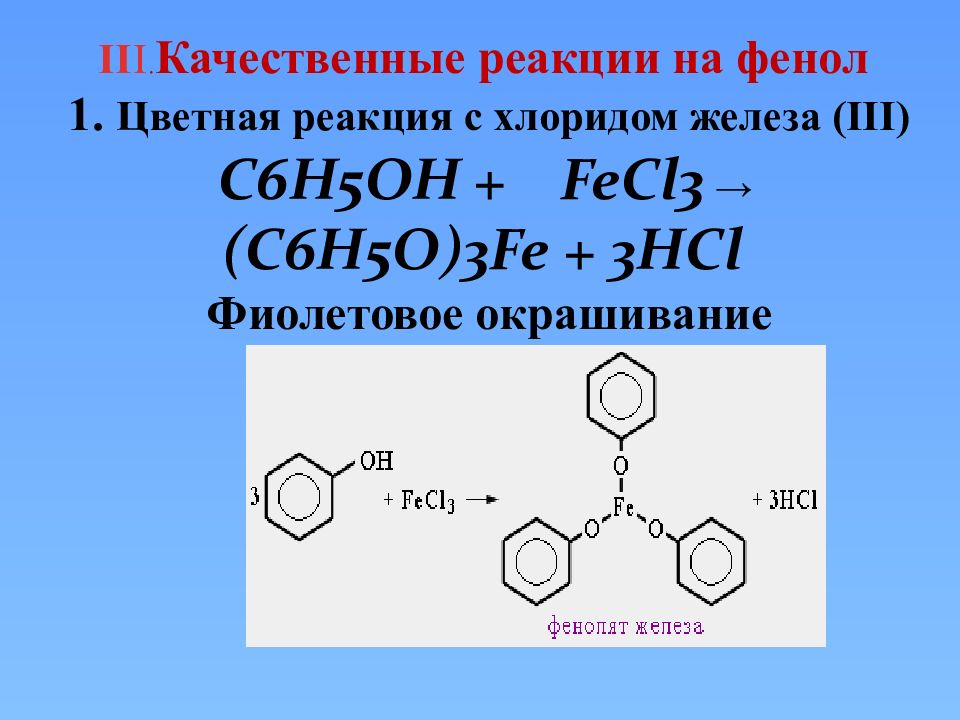
II I. Качественные реакции на фенол 1. Цветная реакция с хлоридом железа ( III) C6H5OH + FeCl3 → ( C6H5O ) 3Fe + 3 HCl Фиолетовое окрашивание
Слайд 20: 2. Взаимодействие с бромной водой при н. у
Белый кристаллический осадок C6H5OH + FeCl3 фиолетовое окрашивание C6H5OH + 3Br2 C6H2 Br3OH + 3HBr
Слайд 22: Применение фенола
Взрывчатые вещества красители пестициды Лекарственные вещества клеи Полимеры Древесно-стружечные плиты
Слайд 24
Фенолфталеи́н ( 4,4'-диоксифталофенон или 3,3-бис-(4-гидроксифенил)фталид )
Слайд 26
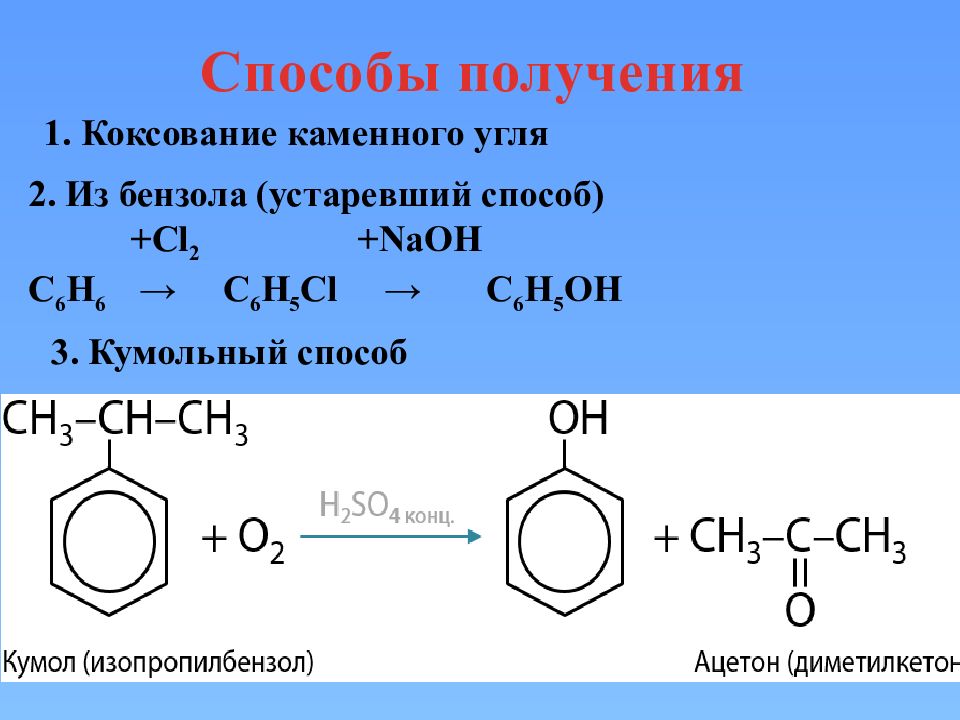
Способы получения 1. Коксование каменного угля 2. Из бензола (устаревший способ) +Cl 2 +NaOH С 6 Н 6 → С 6 Н 5 С l → С 6 Н 5 OH 3. Кумольный способ
Последний слайд презентации: Кислородсодержащие органические вещества Фенолы: Домашнее задание
1.Осуществите следующее превращения: СН 4 → С 2 Н 2 → бензол → С 6 Н 5 CI → C 6 H 5 OH → пикриновая кислота 2. Решите задачу: Какая масса фенолята калия получится при взаимодействии 4,7г фенола и 120г 14% - го раствора гидроксида калия?