Первый слайд презентации: Комплексонометрия
Слайд 2
Комплексонометрия – метод количественного титриметрического анализа, основанный на образовании комплексных соединений ионов металлов с комплексонами. Комплексонами называют органические соединения, молекулы которых содержат как кислотные, так и основные группы и потому способные образовывать с ионами металлов внутрикомплексные соединения.
Слайд 3
Внутрикомплексные соединения образуются в тех случаях, когда ионы металла-комплексообразователя с одной стороны замещают активные ионы водорода кислотных функциональных групп, а с другой стороны образуют связь по донорно-акцепторному механизму за счет свободных орбиталей иона металла и атомов основных групп, имеющими неподеленные электронные пары. К числу функциональных групп, содержащих ионы водорода, способные замещаться ионами металла-комплексообразователя, относятся: −COOH, −OH, −SO 3 H, −NH 2, −SH, =NH. К числу функциональных групп, с которыми ионы металла-комплексообразователя способны образовывать связь по донорно-акцепторному механизму, относятся: ≡N, =NH, −NH 2, −OH, =C=O, − S −, −N=N−. С помощью метода комплексонометрии определяют содержание в растворе различных ионов металлов: Mg 2+, Ca 2+, Zn 2+, Cd 2+, Al 3+, Ni 2+, Cu 2+, Co 2+, Fe 3+ и др.
Слайд 4
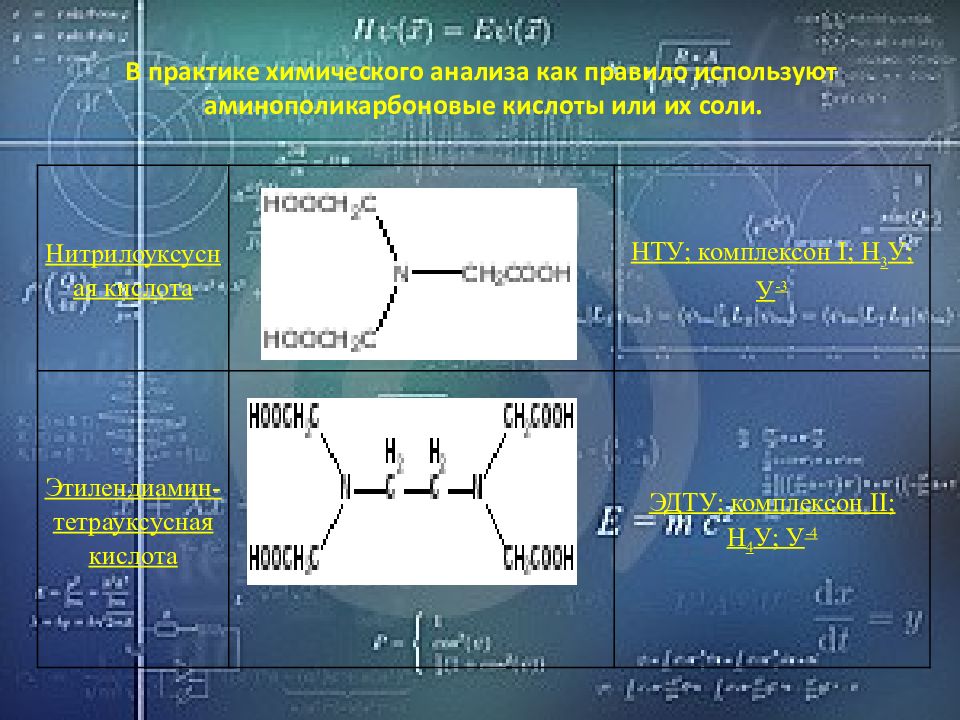
В практике химического анализа как правило используют аминополикарбоновые кислоты или их соли. Нитрилоуксусная кислота НТУ; комплексон I; Н 3 У; У -3 Этилендиамин-тетрауксусная кислота ЭДТУ; комплексон II; Н 4 У; У -4
Слайд 5
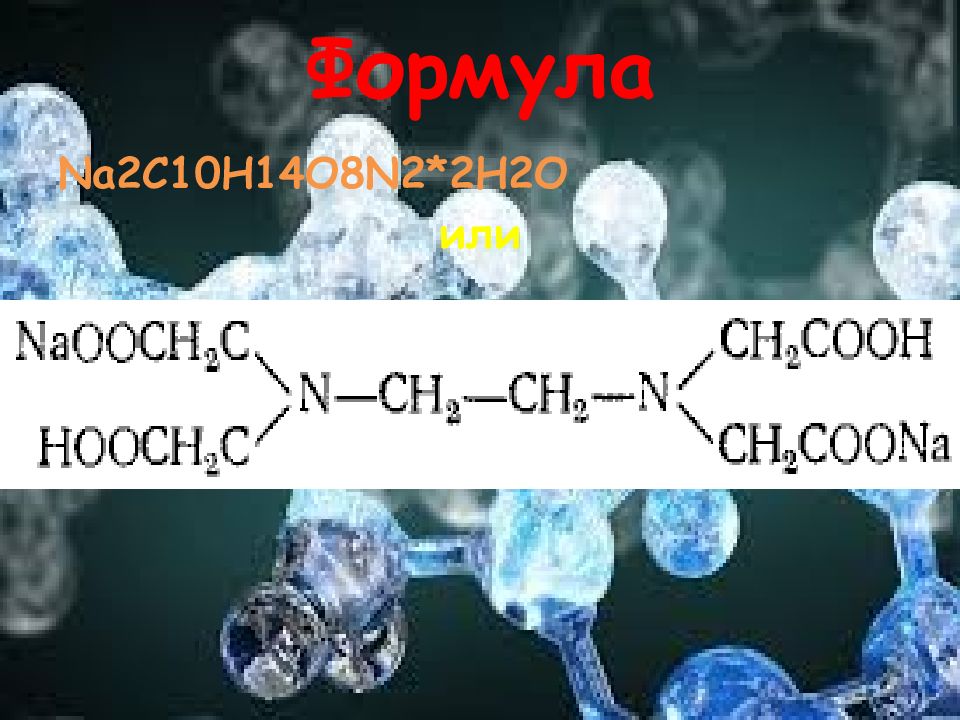
Чаще всего в качестве комплексона используют ЭДТА ( двузамещенный этилендиаминтетраацетат натрия) Комплексон III (этилендиаминтетрауксусной кислоты двунатриевая соль, трилон Б, хелатон III ) - представляет собой белый кристаллический порошок или кристаллы белого цвета, хорошо растворимые в воде и щелочах, очень малорастворимые в спирте ;растворимость в воде при температуре 20 °C составляет 100 г/л, при температуре 80 °C – 230 г/л. ж; рН 1%-ного водного раствора 4,5; рН препарата с массовой долей 5% 4-5.5. Образует очень устойчивые комплексные соединения с большинством катионов. Молекулярная масса: 336,21. Вступает в реакцию с сильными окислителями. При хранении не допускать контакта с алюминием, цинком, никелем, медью и медными сплавами.
Слайд 7
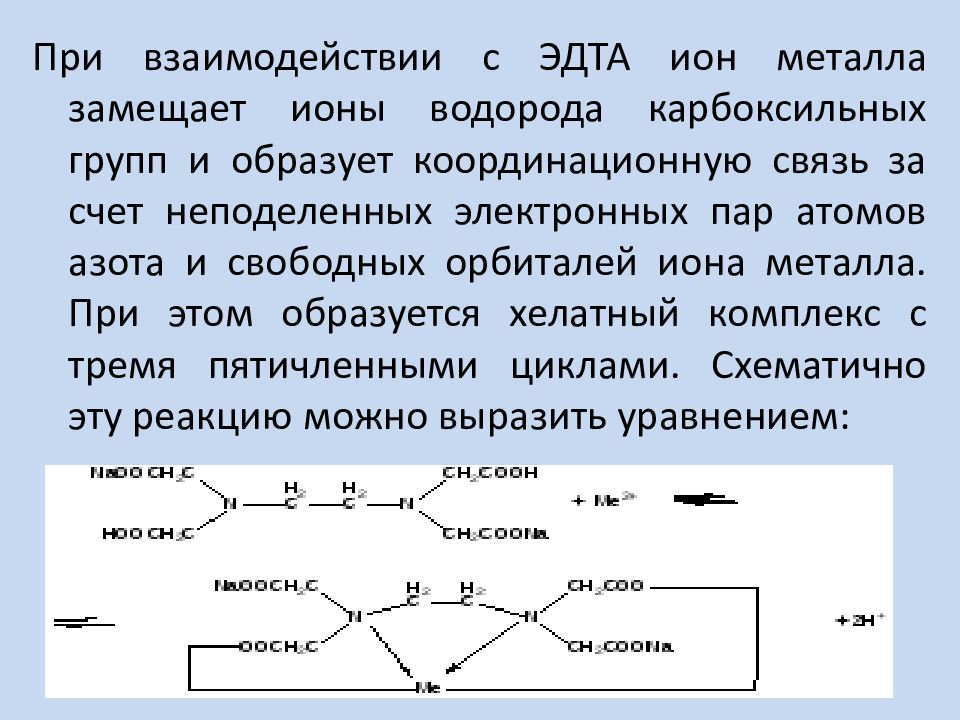
При взаимодействии с ЭДТА ион металла замещает ионы водорода карбоксильных групп и образует координационную связь за счет неподеленных электронных пар атомов азота и свободных орбиталей иона металла. При этом образуется хелатный комплекс с тремя пятичленными циклами. Схематично эту реакцию можно выразить уравнением:
Слайд 8
При взаимодействии с ЭДТА ион металла замещает ионы водорода карбоксильных групп и образует координационную связь за счет неподеленных электронных пар атомов азота и свободных орбиталей иона металла. При этом образуется хелатный комплекс с тремя пятичленными циклами. Схематично эту реакцию можно выразить уравнением:
Слайд 9
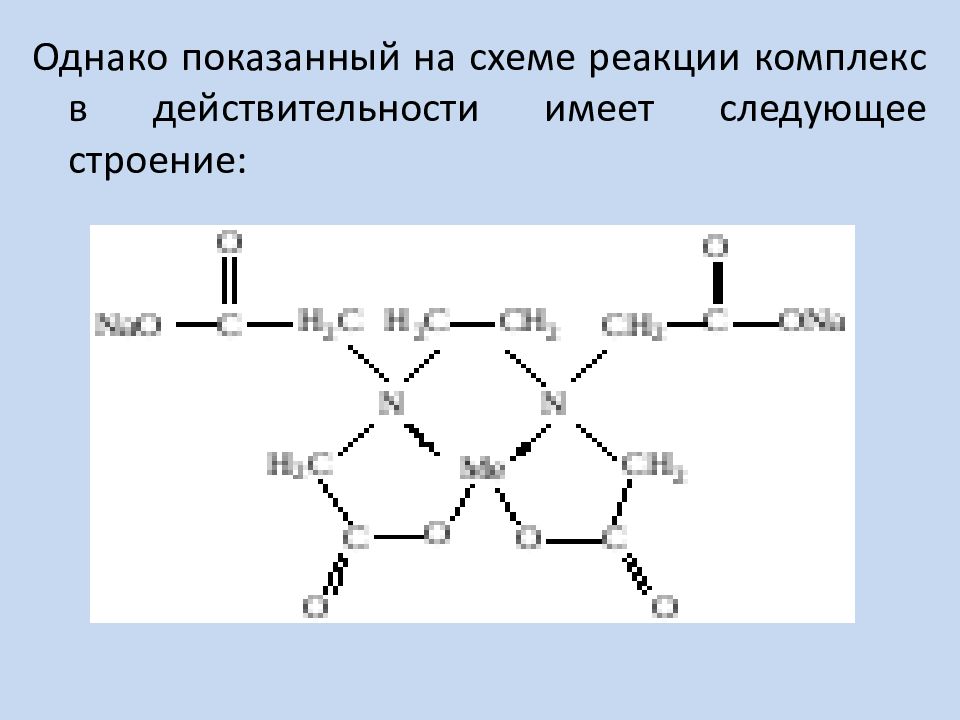
Однако показанный на схеме реакции комплекс в действительности имеет следующее строение:
Слайд 10
При титровании ЭДТА солей металлов-комплексообразователей протекают следующие реакции: 1) диссоциация комплексона: Na 2 H 2 Y 2Na + + H 2 Y 2− 2) взаимодействие с металлами: Me 2+ (Ca 2+ ) + H 2 Y 2− MeY 2− + 2H + Me 3+ (Al 3+ ) + H 2 Y 2− MeY − + 2H + Me 4+ (Th 4+ ) + H 2 Y 2- MeY + 2H +
Слайд 11
Реакции с участием комплексонов протекают стехиометрично, образуются очень прочные комплексы с соотношением металла к лиганду 1:1 не зависимо от заряда иона металла. Комплексоны не удовлетворяют требованиям предъявляемым первичным стандартным веществам, поэтому их точную концентрацию устанавливают путем стандартизации. В качестве первичных стандартных веществ используют соли Са 2+ и Mg 2+, приготовленные из фиксаналов или металлический цинк. В последнем случае, гранулы цинка взвешивают на аналитических весах, помещают в мерную колбу и растворяют в небольшом количестве НСl или H 2 SO 4, после растворения Zn, раствор нейтрализуют и доводят объем до метки. По массе цинка и объему полученного раствора рассчитывают точную концентрацию первичного стандартного раствора.
Слайд 12
При проведение комплексонометрического определения необходимо соблюдать определенные условия, важнейшим из которых является рН раствора. В сильно кислых растворах ( рН <3) образуются малоустойчивые кислые комплексы. При повышении рН устойчивость образовавшихся комплексов возрастает, однако в сильно щелочных средах рН >10 происходит образование малоустойчивых оксокомплексов или гидрооксиды Ме.
Слайд 13
Из выше приведенных реакций следует, что образование комплексонатов происходит с выделение кислоты, что приводит к увеличению рН. Поэтому, как правило, титрование проводят в присутствии соответствующих буферных растворов поддерживающих рН на определенном уровне.
Слайд 14
В комплексонометрии используют методы прямого и обратного титрования, а также метод замещения. Метод прямого титрования. Анализируемый раствор, содержащий катионы определенного металла, титруют стандартным раствором ЭДТА в присутствии буферного раствора. Этим методом определяют Mg 2+, Ca 2+, Zn 2+, Cd 2+, Al 3+, Ni 2+, Cu 2+, Co 2+, Fe 3+, Pb 2+, Ba 2+ и другие катионы.
Слайд 15
Метод обратного титрования. В тех случаях, когда по тем или иным причинам невозможно провести прямое титрование, используют обратное титрование. К анализируемому раствору прибавляют точно измеренный объем стандартного раствора комплексона, нагревают до кипения для завершения реакции комплексообразования, а после охлаждения оттитровывают избыток комплексона стандартными растворами MgSO 4 или ZnSO 4. Этот метод применяют в тех случаях, когда нет подходящего индикатора, когда в буферном растворе выпадает осадок гидроксида металла и когда реакция комплексообразования протекает медленно. Методом обратного титрования также определяют содержание катионов в нерастворимых в воде соединениях (Ca 2+ в CaC 2 O 4, Mg 2+ в MgNH 4 PO 4, Pb 2+ в PbSO 4 и т.п.).
Слайд 16
Метод замещения. Метод основан на том, что ионы Mg 2+ дают с комплексоном менее устойчивое комплексное соединение, чем подавляющее большинство других катионов. Поэтому при добавлении определяемого катиона к комплексонату Mg произойдет реакция обмена. Например, при определении ионов тория, к анализируемому раствору добавляют комплексонат магния MgY 2-, а затем оттитровывают выделившиеся ионы Mg 2+ стандартным раствором ЭДТА (6): Th 4+ + MgY 2− ThY + Mg 2+ (5) Mg 2+ + H 2 Y 2− MgY 2− + 2H + (6)
Слайд 17
Как правило, для фиксирования точки конца титрования в комплексонометрии используют так называемые металл-индикаторы, которые представляют собой органические красители, образующие с катионами определяемых металлов растворимые в воде окрашенные комплексные соединения. Получаемые при этом комплексы менее устойчивы, чем комплексы металлов с комплексонами. Металлоиндикаторы - это органические красители ( мурексид, эриохром черный Т, эриохром синечерный Б, цинкон и др.), которые образуют с определяемыми ионами растворимые в воде окрашенные комплексные соединения, менее прочные, чем комплекс катиона металла с трилоном Б.
Слайд 18
При добавлении индикатора к раствору соли металла образуется комплекс металла с индикатором, окрашенный определенным образом. При титровании ЭДТА полученного раствора, малоустойчивый комплекс металла с индикатором разрушается и образуется более устойчивый неокрашенный комплекс металла с комплексоном, а индикатор выделяется в свободном виде, и в конечной точке раствор приобретает окраску, свойственную индикатору.
Слайд 19
Сущность действия металл-индикатора на примере эриохрома черного Т можно представить следующим образом: 1) при добавлении индикатора к раствору соли металла (рН=8−10) образуется комплекс металла с индикатором красного цвета: Me 2+ + HInd 2− MeInd − + H + красный 2) при титровании полученного раствора ЭДТА этот комплекс разрушается, образуется более устойчивый бесцветный комплекс металла с комплексоном, а индикатор выделяется в свободном виде, придавая раствору синюю окраску: MeInd − + Na 2 H 2 Y MeNa 2 Y + HInd 2− + H + красный б/ цв. б/ цв. синий
Слайд 21
Эриохром чёрный Т — комплексонометрический индикатор. Физико-химические свойства: Чёрные или коричневые кристаллы, хорошо растворяются в спирте, плохо растворимы в воде. Токсичен! Применение: Применяется в качестве комплексометрического индикатора для определения ионов Mg, Mn, Pb, Zn, Cd, In, Zr, лантаноидов. В интервале рН 9,5—10,0 имеет синюю окраску, а его комплексы с ионами кальция, магния и цинка в тех же условиях красно-фиолетового цвета.
Слайд 22
Хромовый темно-синий кислотный. Физическо - химические свойства : Порошок темно-коричневого или черного цвета. Легко растворим в воде. 0,05 % раствор — вишнево-красного цвета. В интервале рН 9,5—10,0 имеет сине-фиолетовую окраску, его комплексы с ионами кальция, магния и цинка в тех же условиях красного цвета. Переход окраски при прямом титровании от красной к сине-фиолетовой.
Слайд 23
Мурексид (MX ) - органический краситель, пурпура аммония, аммиачная соль. Имеет пурпурно-красный цвет. Физико - химические свойства: Тёмно-красные, коричневатые или пурпурные мелкие кристаллы с зеленоватым блеском, плохо растворим в воде и нерастворим в этаноле, диэтиловом эфире. Молекулярная масса 238,18. Применение: В аналитической химии - как металлоиндикатор. Индикатор для комплексонометрического определения никеля ( рН 9,5-10), меди ( рН 8-10), скандия ( рН 2,6), кальция ( рН 10,8-13,2), марганца ( рН 10), тория ( рН 2,5) и других ионов.
Слайд 24
Для поддержания рН раствора на требуемом уровне обычно в титруемый раствор добавляют аммиачную буферную смесь. Индикаторы подбираются таким образом, чтобы интервал перехода их окраски находился в пределах скачка титрования. В настоящее время известно около 150 металл-индикаторов. Кроме металл-индикаторов для фиксирования точки конца титрования в комплексонометрии используют обычные кислотно-основные индикаторы, так как реакция комплексообразования сопровождается выделением ионов водорода H + в количестве, эквивалентном количеству определяемого катиона. Выделившуюся кислоту определяют методом нейтрализации с обычными кислотно-основными индикаторами.
Слайд 25
Условия комплексонометрическоro титрования: 1. Реакции комплексообразования должны протекать быстро, количественно и стехиометрично, чтобы вблизи точки эквивалент-ности определяемые катионы были практически полностью связаны в комплекс. Константа нестойкости образующихся комплексов должна быть малой величиной. 2. Определяемые ионы должны образовывать с металлоиндиктором менее прочные комплексы, чем их комплексы с трилоном Б. 3. Комплексонометрическое титрование следует проводить при определенном значении рН ( рН < 10), так как в щелочной среде могут образовываться осадки гидроксидов определяемых катионов или их основные соли.
Слайд 26: Применение
Основная функция: делает нерастворимые соли металлов растворимыми. В аналитической химии для определения многих катионов и анионов, напр.: Ca, Mg, Cu, Со, N i, Zn, Fe, Mo, Al, редкоземельных элементов, Tc, U, SO 4 2−, PO 4 3−, CN − и др. при потенциометрических, полярографических и амперометрических определениях, для маскировки, В производстве медицинских препаратов и при отравлениях тяжелыми металлами, В производстве бытовой химии и синтетических моющих средств, При консервировании и др. В реставрации для удаления следов коррозии с изделий из бронзы и других цветных металлов, особо хорошо себя проявляет в очистке изделий из В промышленности для промывки теплоэнергетического оборудования, труб, котлов; водоподготовки в котельных и теплосетях; в виде стабилизатора в процессах полимеризации; в целлюлозно-бумажной промышленности; при производстве каучука; в аналитической химии и в многих других областях.
Слайд 27: Описание
ТРИЛОН Б является торговым названием динатриевой соли этилендиаминтетрауксусной кислоты и представляет собой кристаллический порошок белого цвета. Данное название введено фирмой БАСФ и использовалась как торговая марка для данного вещества, но очень быстро вошло в обиход и используется другими фирмами для обозначения продукта. Используются также тринатриевая и тетранатриевая соль этилендиаминтерауксусной кислоты, но для связывания одного и того же количества ионов их надо брать в большем количестве. ТРИЛОН Б это ион коагулянт. Схема действия его основана на извлечении ионов металла из нерастворимых солей металлов и замещения их на ионы натрия, почти все соли которого растворимы в воде причем независимо от валентности металла 1 молекула трилона реагирует с 1 молекулой металла. Это ценное свойство нашло огромное применение в аналитике.
Слайд 28
ТРБ-2Na + CaCO3 ----> ТрБ-Ca + Na2Co3 ( раств ) ( нераств ) ( раств ) ( раств ) Аналогичное взаимодействие происходит с ионами меди железа (II и III) магния, марганца. Причем ТРИЛОН Б не является окислителем, и не взаимодействует с металлами, находящимися в нулевой степени окисления.
Слайд 29
Благодаря вышеуказанным свойствам ТРИЛОН Б находит широкое применение различных областях промышленности. В частности, его применяют для очистки трубопроводов котлов и нагревательных элементов от накипи и ржавчины. Накипь - это известковый нарост образованный солями магния и кальция, всегда присутствующих в любой воде, и определяющих ее жесткость. Образуется в трубопроводах, на нагревательных элементах из-за уменьшения растворимости солей с повышением температуры. В результате чего уменьшается полезное сечение трубопроводов, а в теплообменниках значительно падает коэффициент теплообмена. Аналогично, Трилон Б применяют для очистки автомобильных систем охлаждения, защиты стиральных машин как отдельный препарат или в комплексе со стиральным порошком. Трилон Б применяют также в аналитической химии, для качественного и количественного определения солей металлов, благодаря возможности вещества образовывать с ионами металлов комплексоны, окрашенные в различный цвет. Причем цвет раствора будет зависеть от иона металла, с которым образован комплекс.
Слайд 30: Опасность для человека
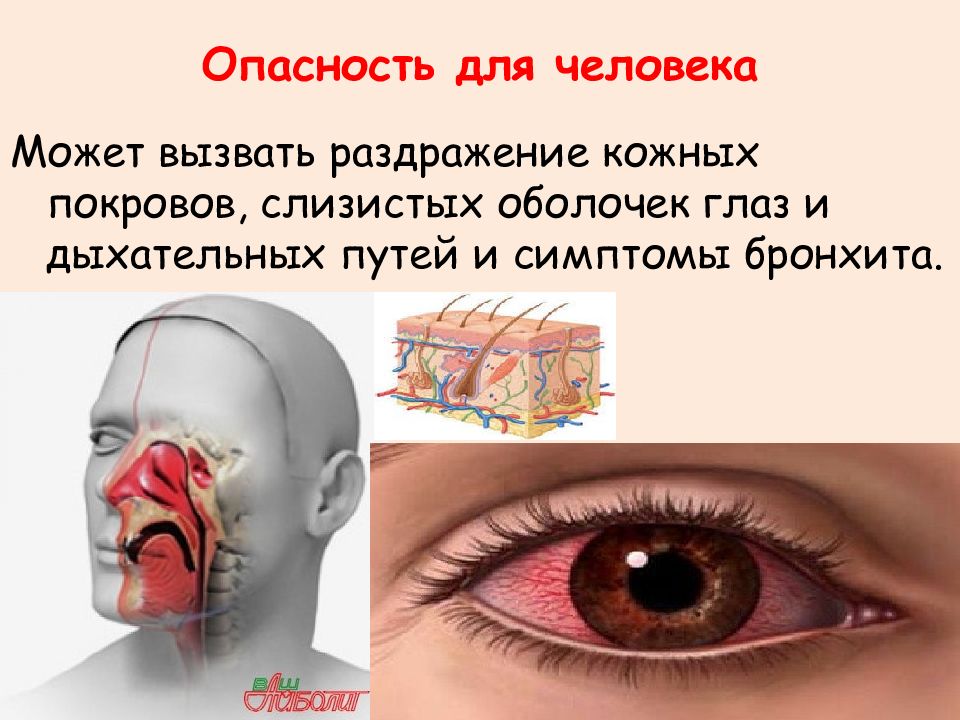
Может вызвать раздражение кожных покровов, слизистых оболочек глаз и дыхательных путей и симптомы бронхита.
Последний слайд презентации: Комплексонометрия
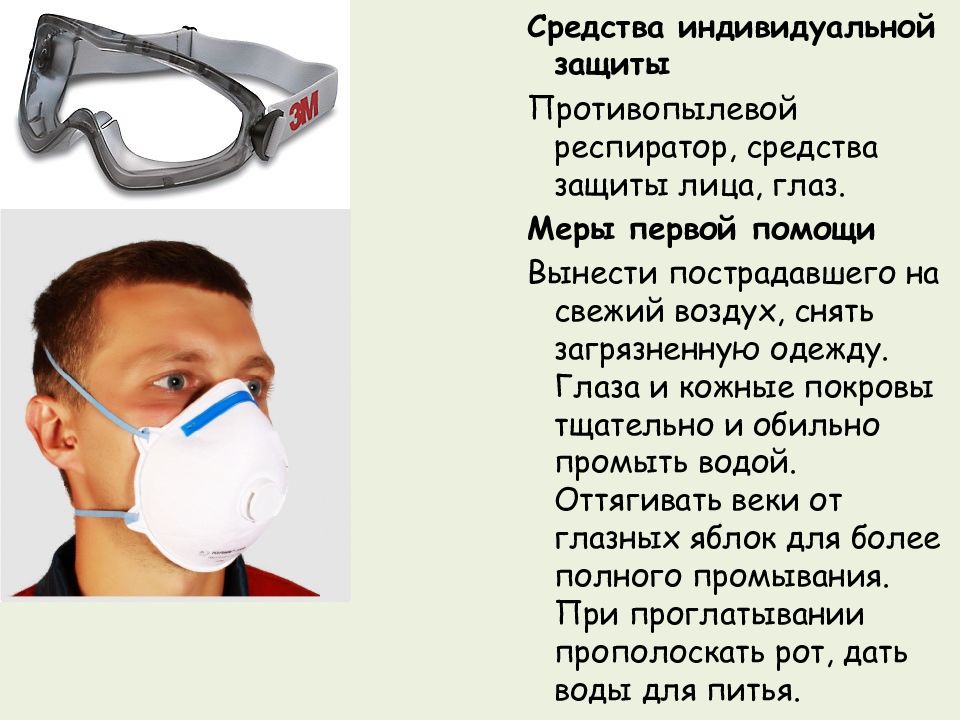
Средства индивидуальной защиты Противопылевой респиратор, средства защиты лица, глаз. Меры первой помощи Вынести пострадавшего на свежий воздух, снять загрязненную одежду. Глаза и кожные покровы тщательно и обильно промыть водой. Оттягивать веки от глазных яблок для более полного промывания. При проглатывании прополоскать рот, дать воды для питья.