Слайд 2
Феодосий Печерский: « Бесноватый страдает по неволе и может удостоиться жизни вечной, а пьяный страдает по собственной воле и предан на вечную муку». Н. Семашко : «Можно сказать, что сколько мужья выпили водки, столько их жены и дети пролили слез». К. Ушинский: « Пьяному на светлой улице темно». И. Ефимов: « Нет крепких вин, есть слабые головы».
Слайд 3: Загадка
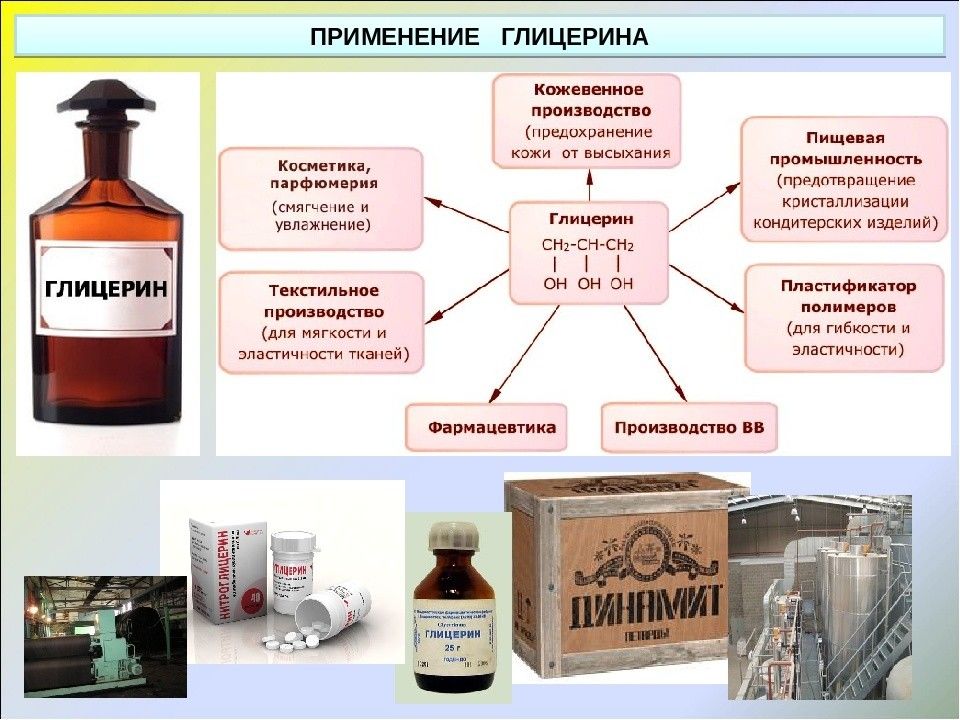
В переводе с латинского это слово означает «сладкий». И действительно благодаря необычному вкусу вещество часто используют в производстве кондитерских и хлебобулочных изделий. Кроме того, сладковатая жидкость активно применяется в косметологии, фармакологии и даже в военном деле.
Слайд 4: Цель урока:
Познакомить учащихся со строением, физическими и химическими свойствами многоатомных спиртов, значением и применением их в промышленности и в повседневной жизни; развитие умений составлять структурные формулы спиртов, записывать уравнения реакций, уметь составлять генетическую связь с другими классами органических веществ; воспитание экологического сознания, техника безопасности при работе со спиртами.
Слайд 5: Устный опрос:
1. Какие вещества называются спиртами? 2. По каким признакам их классифицируют? 3. Какое строение имеют одноатомные спирты? 4. Какое строение имеют многоатомные спирты? 5. Почему с увеличением молекулярной массы уменьшается растворимость одноатомных спиртов в воде? 6. Что напоминают спирты по своим химическим свойствам? 7. Почему опьяневший человек замерзает на морозе быстрее трезвого? 8. Какова смертельная доза алкоголя для взрослого человека? 9. Какая средняя доза алкоголя смертельна для детей и подростков?
Слайд 6: Написать формулу:
2,3 - диметилбутанол - 1. 3,3 - диметилбутанол - 1. гексанол - 3. Дать название следующим веществам :
Слайд 7: Ответы
1) СН2ОН - СН(СН3) - СН(СН3) - СН3. 2) СН2ОН - СН2 - С(СН 3 ) 2 - СН3. 3) СН3 - СН2 - СНОН - СН2 - СН2 - СН3
Слайд 8: План урока:
.Строение и физические свойства многоатомных спиртов .Химические свойства многоатомных спиртов .Применение спиртов.
Слайд 9: Определение
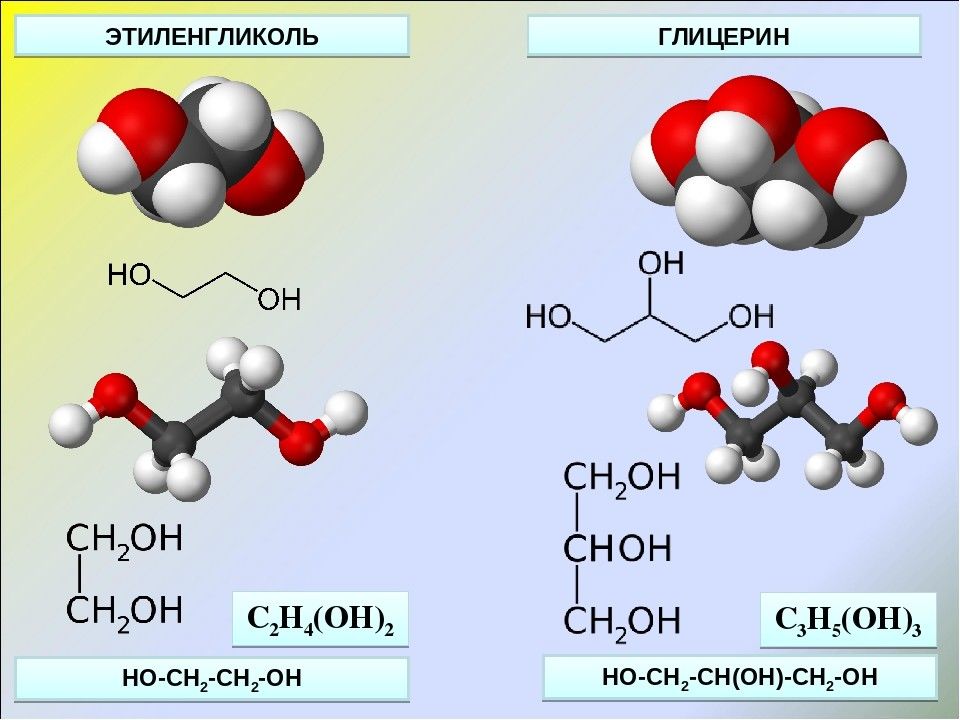
Многоатомные спирты – органические соединения, в молекулах которых содержится несколько гидроксильных групп (-ОН), соединённых с углеводородным радикалом
Слайд 11: Интересный факт
Этиленгликоль - является одним из суррогатов алкоголя. Первые случаи отравления этиленгликолем в нашей стране отмечены в период Великой Отечественной войны в 1943-1944 годах, когда этот препарат в качестве антифриза и тормозной жидкости стал применяться для технического обслуживания боевой техники и танковых войсках. Тогда же антифриз получил среди бойцов название "бешеное шампанское", что указывает на крепость и сильное действие этиленгликоля, а также на наличие в антифризе пузырьков. Тормозную жидкость тогда же окрестили "шасси-коньяком" или "ликером Шасси". Названия сохранились до наших дней. Как и в случае с другими суррогатами алкоголя, отравления этиленгликолем обычно носят групповой или массовый характер.
Слайд 12
Сиропообразная, вязкая бесцветная жидкость, имеет спиртовой запах, хорошо смешивается с водой, сильно понижает температуру замерзания воды (60%-ый раствор замерзает при -49 ˚С) –это используется в системах охлаждения двигателей – антифризы. Этиленгликоль токсичен – сильный Яд! Угнетает ЦНС и поражает почки. Физические свойства
Слайд 13: Физические свойства
Бесцветная, вязкая сиропообразная жидкость, сладкая на вкус. Не ядовит. Без запаха. Хорошо смешивается с водой. Распространён в живой природе. Играет важную роль в обменных процессах, так как входит в состав жиров (липидов) животных и растительных тканей. Триолы
Слайд 14: Номенклатура
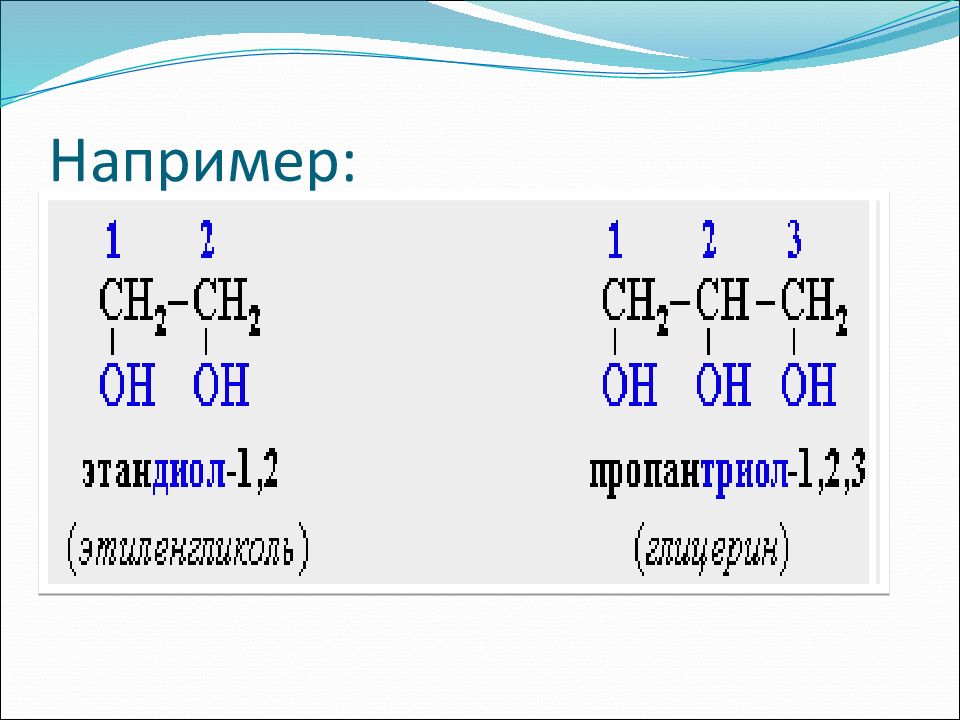
В названиях многоатомных спиртов ( полиолов ) положение и число гидроксильных групп указывают соответствующими цифрами и суффиксами -диол (две ОН-группы), -триол (три ОН-группы) и т.д.
Слайд 16: Получение многоатомных спиртов
I. Получение двухатомных спиртов В промышленности 1. Каталитическая гидратация оксида этилена (получение этиленгликоля): 2. Взаимодействие дигалогенпроизводных алканов с водными растворами щелочей :
Слайд 17: 3. Из синтез-газа :
2CO + 3H 2 250°,200 МПа, kat → CH 2 (OH)CH 2 (OH) В лаборатории Окисление алкенов :
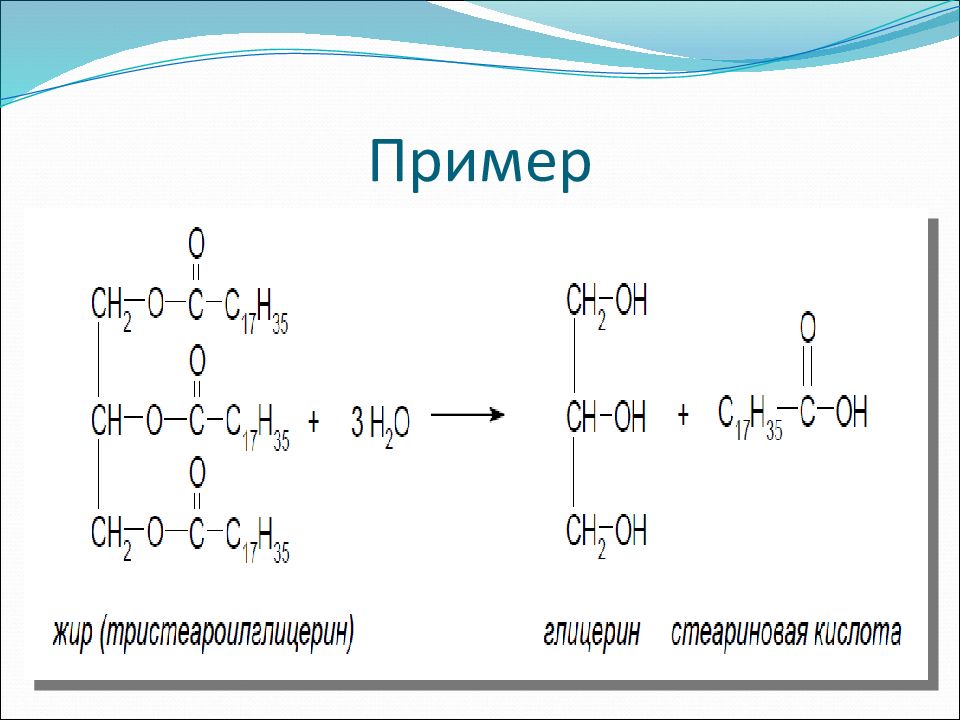
Слайд 18: II. Получение трёхатомных спиртов (глицерина)
В промышленности Омыление жиров (триглицеридов):
Слайд 20: Химические свойства многоатомных спиртов
1. С активными металлами: HO-CH 2 -CH 2 -OH + 2Na → H 2 ↑+ NaO-CH 2 -CH 2 -ONa ( гликолят натрия)
Слайд 23
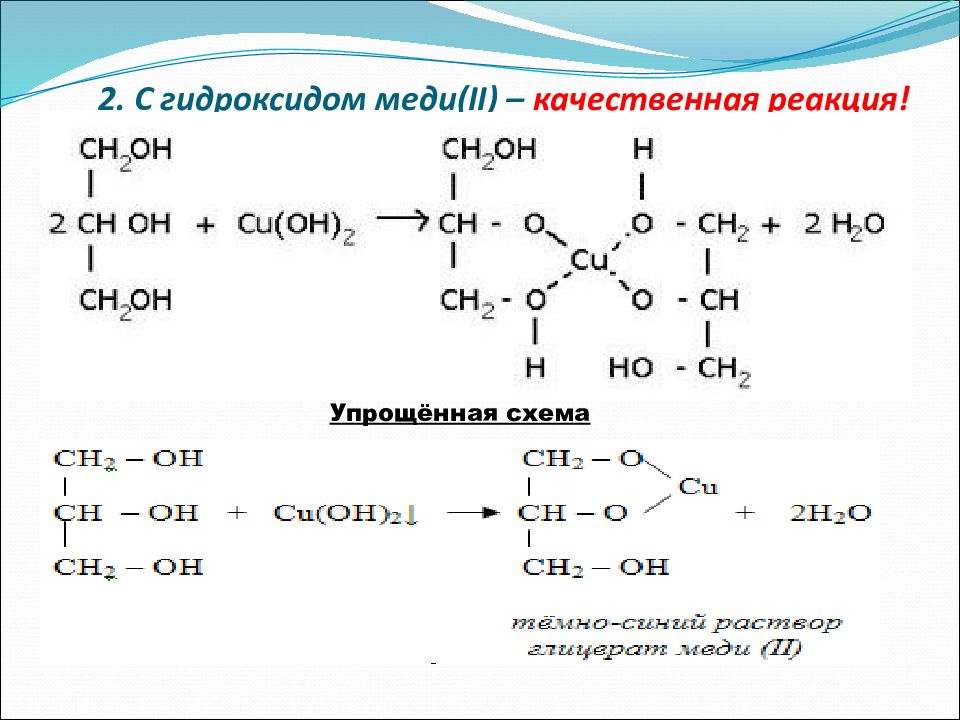
Качественная реакция многоатомных спиртов , позволяющая отличить соединения этого класса, – взаимодействие со свежеприготовленным гидроксидом меди(II). В щелочной среде при достаточной концентрации глицерина голубой осадок Cu(OH) 2 растворяется с образованием раствора ярко-синего цвета – гликолята меди(II):
Слайд 25
Специфические свойства Глицерин взаимодействует с азотной кислотой с образованием сложных эфиров. В зависимости от условий реакции (мольного соотношения реагентов, концентрации катализатора – серной кислоты и температуры) получаются моно-, ди- и тринитроглицериды:
Слайд 28
Тест по теме «Спирты» 1. Функциональная группа в молекулах спиртов: 1) -OH 2) -COOH 3) -COH 2. Реакция этерификации это реакция взаимодействия между: 1) спиртом и кислотой 2) альдегидом и кислородом 3) металлом и неметаллом 3. Установите соответствие между названием органического вещества и его формулой: А H H │ │ H― C― C―OH │ │ H H Б H │ H― C―OH │ H В H H H │ │ │ H― C ― C ― C ― H │ │ │ OH OH OH 1. пропантриол - 1. 2, 3 или глицерин 2. метанол или метиловый спирт 3. этанол или этиловый спирт Ответ запишите в виде последовательности цифр (например 132) _______________