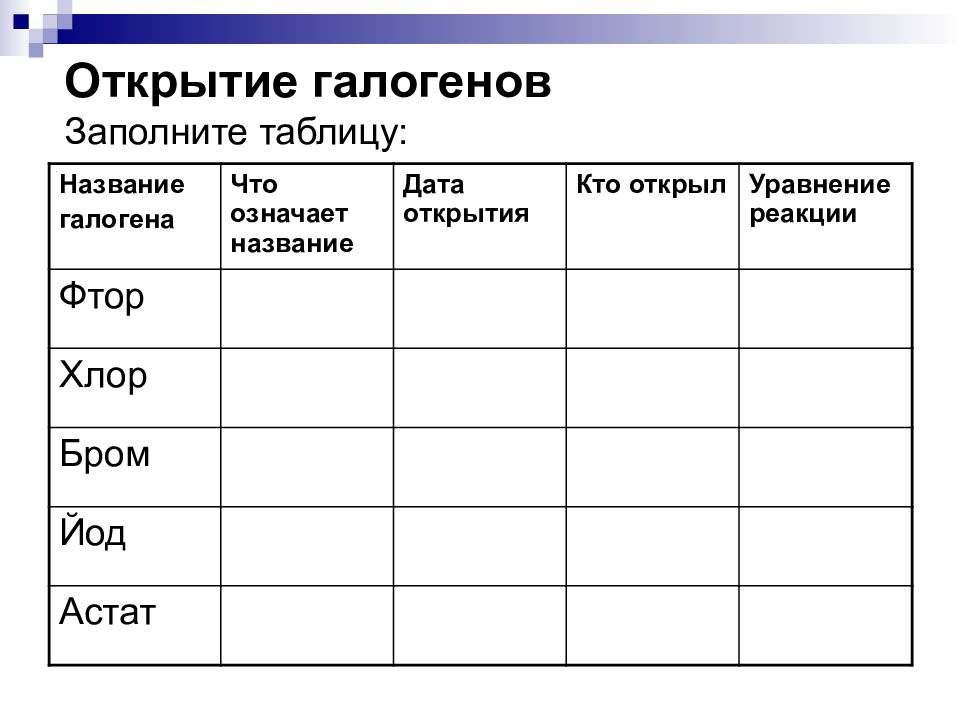
Название галогена Что означает название Дата открытия Кто открыл Уравнение реакции Фтор Хлор Бром Йод Астат
Слайд 3: Открытие фтора
Фтор( F 2 ) –от греч. «фторос»- разрушающий был открыт в 1866 году французским химиком Анри Муассаном электролизом смеси жидкого безводного HF и гидродифторида калия KHF 2 в платиновом сосуде: 2HF →H 2 ↑ + F 2 ↑ катод анод В 1906 году Муассан был удостоен Нобелевской премии за открытие элемента фтора и введение в практику электрической печи, названной его именем
Слайд 4: Открытие хлора
Хлор Cl 2 от греч. «хлорос» - желто-зеленый 1774 год Шведский аптекарь Карл Вильгельм Шееле «Я поместил смесь черной магнезии с муриевой кислотой в реторту, к горлышку которой присоединил пузырь, лишенный воздуха, и поставил ее на песчаную баню. Пузырь наполнился газом, который имел желто-зеленый цвет и пронзительный запах». Уравнение реакции: MnO 2 + 4HCl Cl 2 + MnCl 2 + 2H 2 O
Слайд 5: Открытие брома
Бром (Br 2 ) от греч. «бромос»- зловонный Был открыт в 1826 году Французским химиком (24-летним лаборантом) Антуаном- Жеромом Баларом Действием хлором на рассолы соляных болот Франции по реакции: 2NaBr + Cl 2 → 2NaCl + Br 2
Слайд 6: Открытие йода
Йод ( I 2 ) от греч. «иодес» - фиолетовый Был открыт в 1811 году Французским химиком-технологом и фармацевтом Бернаром Куртуа в золе морских водорослей Уравнение реакции: 2 NaI + H 2 SO 4 → Na 2 SO 4 + I 2
Слайд 7: Открытие астата
Астат( At 2 ) от греч. «астатос» - неустойчивый Был получен в 1940 году Искусственным путем при облучении висмута альфа-частицами Учеными Калифорнийского университета Д.Корсоном и К.Р.Маккензи
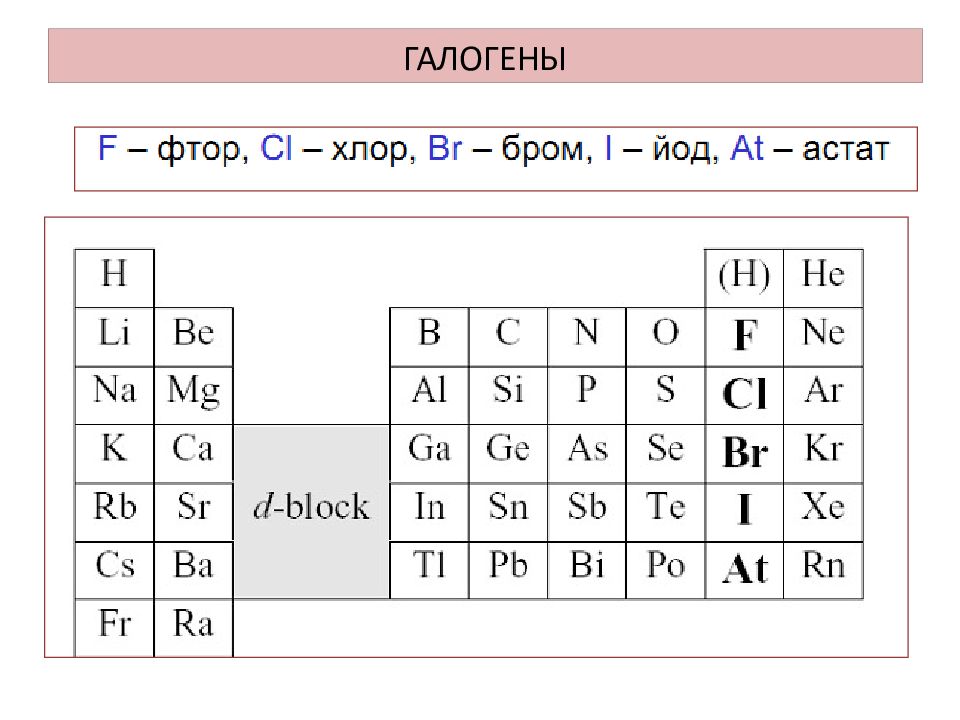
Слайд 8: Строение атомов галогенов
F + 9 ) ) 2 7 Cl +17 ) ) ) 2 8 7 Br + 35 ) ) ) ) 2 8 18 7 l + 53 ) ) ) ) ) 2 8 18 18 7 Заряд ядра увеличивается Радиус атома увеличивается Количество валентных электронов равно 7 Притяжение валентных электронов к ядру уменьшается Способность отдавать электроны увеличивается Неметаллические свойства ослабевают Окислительная способность уменьшается
Слайд 10: Возгонка йода
Кристаллический йод обладает способностью при нагревании переходить из твердого состояния в газообразное, минуя жидкое ( возгонка ),превращаясь в фиолетовые пары. Пары йода
F 2 светло-желтый газ Cl 2 желто-зеленый газ Br 2 красно-бурая жидкость I 2 темно-серые кристаллы с металлическим блеском At 2 черно-синие кристаллы Интенсивность цвета усиливается Плотность увеличивается Температуры плавления и кипения увеличиваются
Слайд 12: Химические свойства фтора
Взаимодействует со всеми металлами с выделением большого количества теплоты: с алюминием: 3 F 2 + 2 Al→ 2 AlF 3 + 2989 кДж с железом : 3 F 2 + 2Fe → 2FeF 3 + 1974 кДж При нагревании взаимодействует со многими неметаллами, кроме кислорода, азота и алмаза с водородом: F 2 + H 2 → 2HF 2 +547 кДж c кремнием: 2F 2 + Si → SiF 4 + 1615 кДж Окисляет другие галогены: хлор: F 2 + Cl 2 → 2ClF бром: F 2 + Br 2 → 2BrF йод: F 2 + I 2 → 2lF
Слайд 13: Химические свойства фтора
Реагирует при облучении даже с инертными газами Xe + F 2 → Xe F 2 + 152 кДж Взаимодействует со сложными веществами: с водой: 2F 2 + 2H 2 O → 4HF + O 2 ↑ c о щелочами: 2F 2 + 2NaOH → 2NaF + H 2 O + OF 2 ↑ с оксидом кремния: 2F 2 + SiO 2 → SiF 4 + O 2 ↑
Слайд 14: Химические свойства брома
Химическая активность брома меньше, чем у фтора и хлора, но достаточно высока. С металлами: Взаимодействие брома с алюминием 3Br 2 + 2Al → 2AlBr 3 С неметаллами: Взаимодействие с водородом Br 2 + H 2 → 2 HBr Взаимодействие с кремнием 2 Br 2 + Si → SiBr 4 При растворении брома в воде образуется бромная вода, которую используют в органической химии.
Слайд 15: Химические свойства йода
Химическая активность йода еще ниже, чем у брома. С металлами только при нагревании: Взаимодействие йода с железом I 2 + Fe → FeI 2 Взаимодействие йода с алюминием 3I 2 + 2Al → 2AlI 3 С неметаллами: Взаимодействует с водородом при нагревани I 2 + H 2 → 2 HI - Q
Слайд 16: Вывод:
химическая активность галогенов уменьшается от фтора к йоду, поэтому галоген с меньшим порядковым номером может вытеснять галоген с большим порядковым номером из его соединений с водородом и металлами: Взаимодействие хлорной воды с галогенидами 2KI + Cl 2 → 2KCl + I 2 NaCl + Cl 2 → 2NaBr + Cl 2 → 2NaCl + Br 2
Слайд 17: Качественные реакции на галогенид-ионы
Качественные реакции на хлориды, бромиды и йодиды -образование нерастворимых галогенидов серебра: NaCl + AgNO 3 → AgCl↓ + NaNO 3 белый творожистый осадок NaBr + AgNO 3 → AgBr↓ + NaNO 3 желтоватый творожистый осадок NaI + AgNO 3 → AgI↓ + NaNO 3 желтый творожистый осадок
Слайд 18: Галогены и здоровье
Заполни таблицу: Название галогена Роль в организме Недостаток Избыток Источник
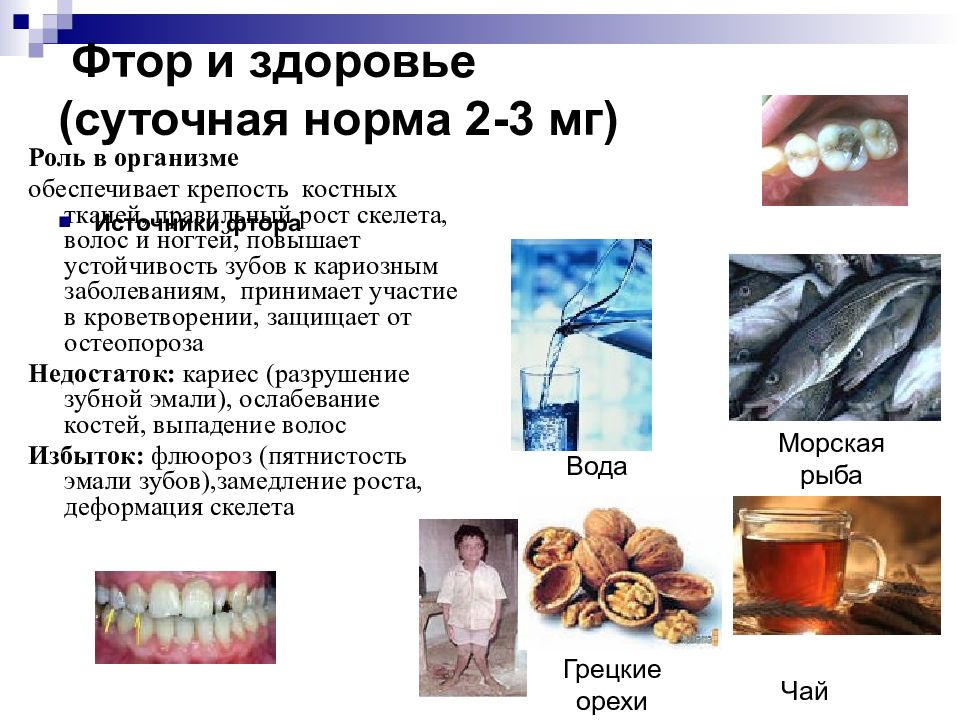
Слайд 19: Фтор и здоровье ( суточная норма 2-3 мг)
Роль в организме обеспечивает крепость костных тканей, правильный рост скелета, волос и ногтей, повышает устойчивость зубов к кариозным заболеваниям, принимает участие в кроветворении, защищает от остеопороза Недостаток: кариес (разрушение зубной эмали), ослабевание костей, выпадение волос Избыток: флюороз (пятнистость эмали зубов),замедление роста, деформация скелета Источники фтора Вода Морская рыба Грецкие орехи Чай
Слайд 20: Хлор и здоровье (суточная норма 2г)
Роль в организме: Образование соляной кислоты, поддержание водно-электролитного баланса, выведение шлаков и углекислого газа из организма, расщепление жиров Недостаток: мышечная слабость, сонливость, вялость, ослабление памяти, потеря аппетита, сухость во рту, выпадение зубов и волос Избыток: задержка воды в тканях, повышение кровяного давления, боли в голове и груди, диспепсические расстройства, сухой кашель, слезотечение, резь в глазах Источники хлора Свекла Бобовые Злаки Поваренная соль
Слайд 21: Бром и здоровье (суточная норма 0,5-2 мг)
Роль в организме: принимает участие в регуляции деятельности нервной системы, оказывает влияние на функции половых желез, влияет на процессы возбуждения и торможения в головном мозге Недостаток: бессонница, снижение уровня роста эритроцитов в крови. Избыток: кожное заболевание – бромодерма, нарушение работы нервной системы, апатия, сонливость, ослабление памяти Источники брома
Последний слайд презентации: Сравнительная характеристика галогенов: Йод и здоровье (суточная норма100-200 мкг)
Роль в организме: Участие в синтезе гормонов щитовидной железы, создание патрульных клеток в крови- фагоцитов. Избыток: гипертиреоз- увеличение обмена веществ учащение пульса, возбудимость Недостаток: гипотиреоз-снижение функции щитовидной железы( снижение обмена веществ, понижение температуры тела, слабость), базедова болезнь, умственная отсталость Источники йода Кальмары Хурма Томаты Морская рыба Морковь Морская капуста