Первый слайд презентации: Ароматические диазо- и азосоединения
Подготовила студентка группы ХМб-45 Кокоулина Л. С. Преподаватель : к. пед. н., доцент Зайцев М. А. Киров, 2020 ФГБОУ ВО «Вятский государственный университет» Институт химии и экологии Кафедра фундаментальной химии и методики обучения химии Предмет: избранные главы современной химии
Слайд 2: Содержание
Понятие о диазо- и азосоединениях Кислотно-основная таутомерия диазосоединений Строение солей диазония Механизм реакции диазотирования Химические свойства Реакция азосочетания Механизм реакции азосочетания Азокрасители
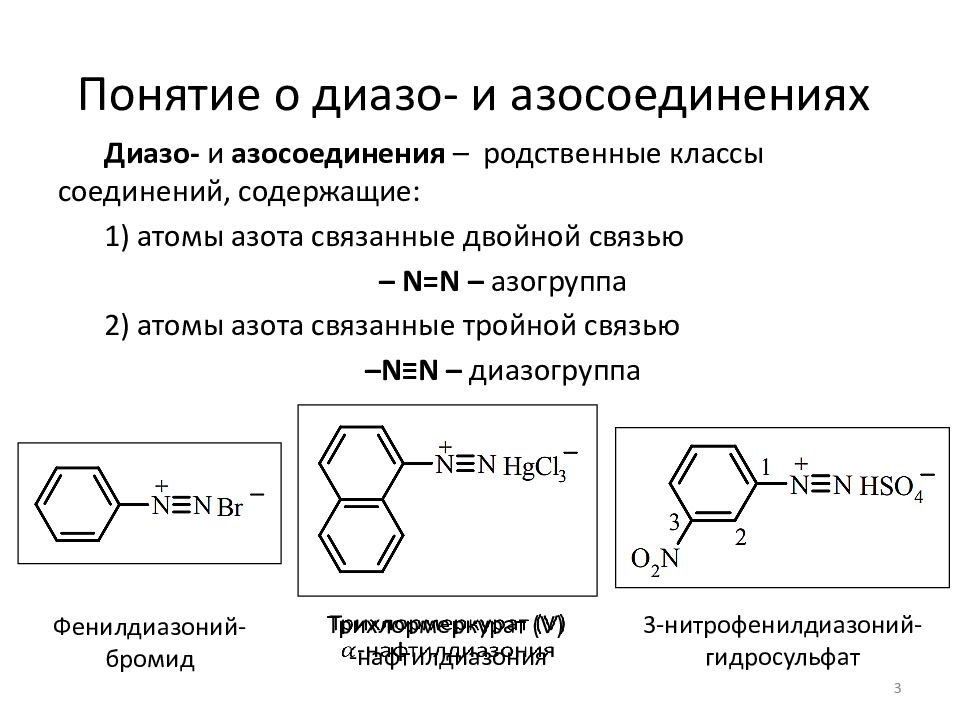
Слайд 3: Понятие о диазо- и азосоединениях
Диазо- и азосоединения – родственные классы соединений, содержащие: 1) атомы азота связанные двойной связью – N=N – азогруппа 2) атомы азота связанные тройной связью – N≡N – диазогруппа 3 Фенилдиазоний -бромид Трихлормеркурат ( V ) - нафтилдиазония 3-нитрофенилдиазоний - гидросульфат
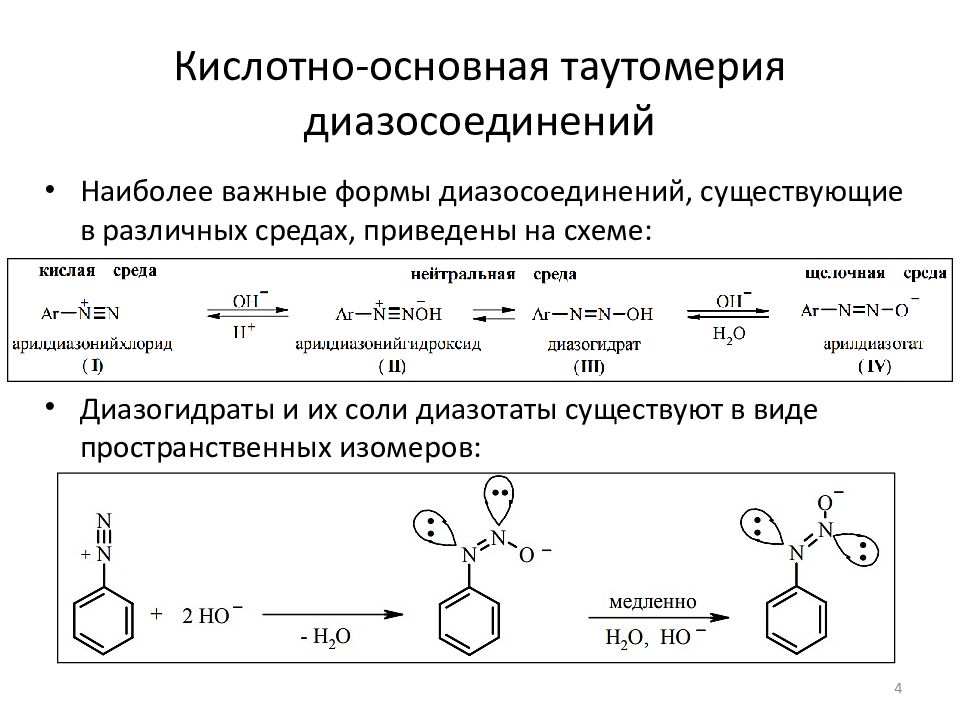
4 Наиболее важные формы диазосоединений, существующие в различных средах, приведены на схеме : Диазогидраты и их соли диазотаты существуют в виде пространственных изомеров:
Слайд 5: Кислотно-основная таутомерия диазосоединений
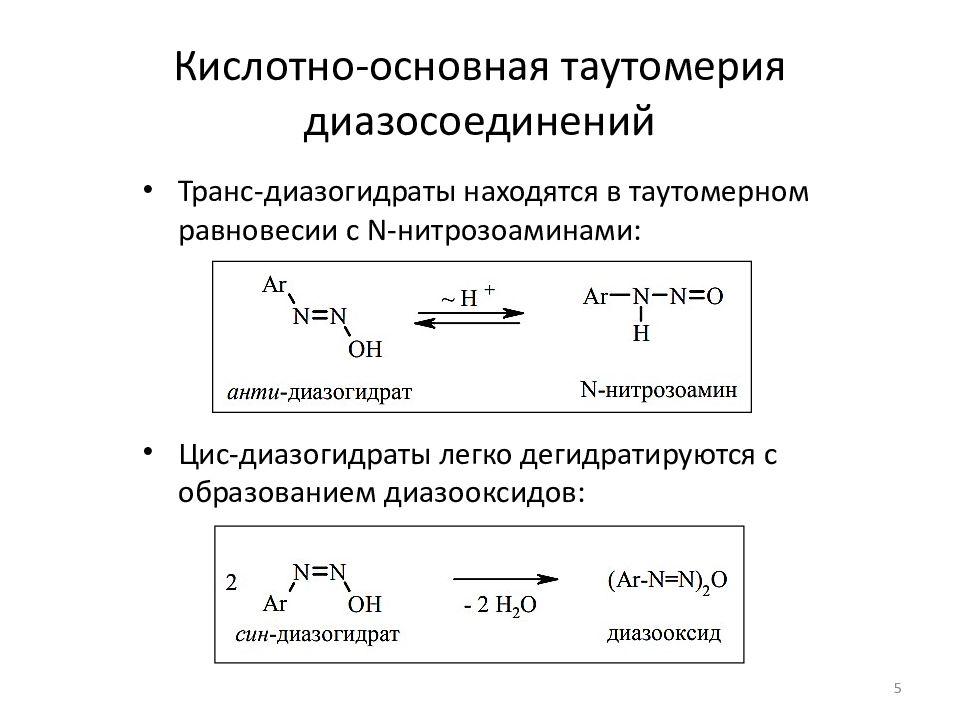
Транс- диазогидраты находятся в таутомерном равновесии с N- нитрозоаминами : Ц ис-диазогидраты легко дегидратируются с образованием диазооксидов : Кислотно-основная таутомерия диазосоединений 5
Слайд 6: Кислотно-основная таутомерия диазосоединений
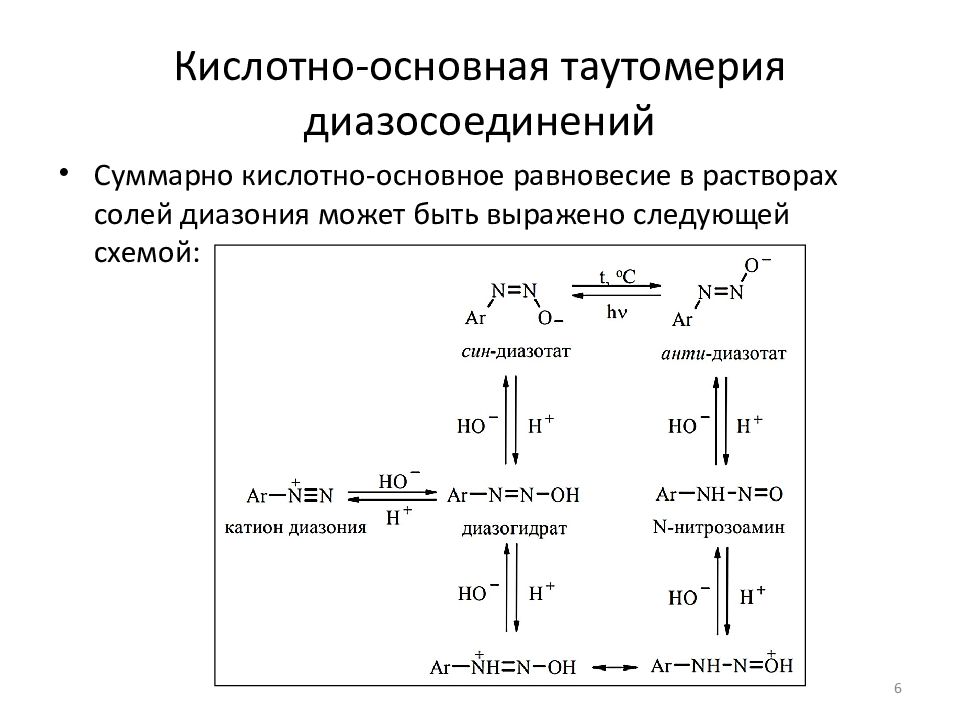
Суммарно кислотно-основное равновесие в растворах солей диазония может быть выражено следующей схемой: 6
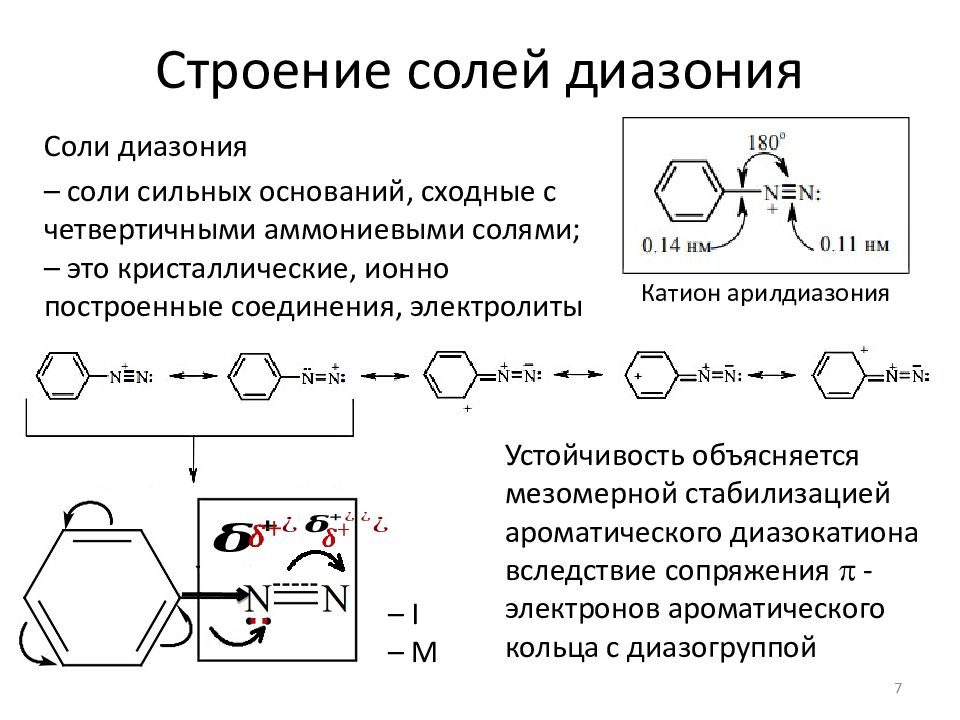
Слайд 7: Строение солей диазония
Резонансные структуры катиона фенилдиазония Строение солей диазония Соли диазония – соли сильных оснований, сходные с четвертичными аммониевыми солями ; – это кристаллические, ионно построенные соединения, электролиты 7 Катион арилдиазония – I – М Устойчивость объясняется мезомерной стабилизацией ароматического диазокатиона вследствие сопряжения - электронов ароматического кольца с диазогруппой
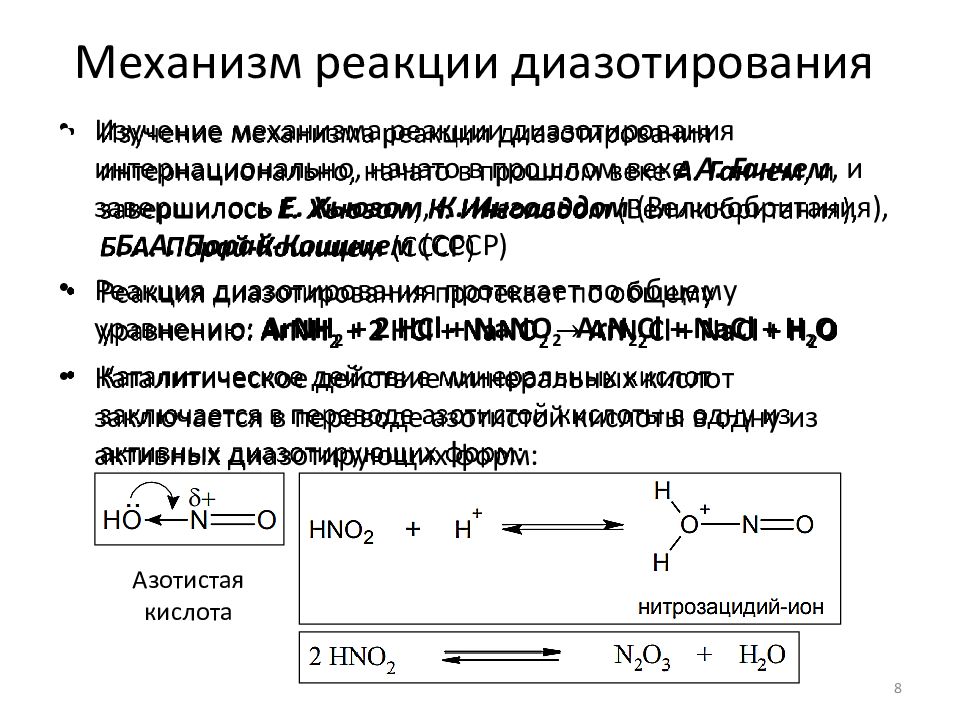
Слайд 8: Механизм реакции диазотирования
Изучение механизма реакции диазотирования интернационально, начато в прошлом веке А. Ганчем, и завершилось Е. Хьюзом, К. Ингольдом (Великобритания), Б. А. Порай-Кошицем (СССР) Реакция диазотирования протекает по общему уравнению: ArNH 2 + 2 HCl + NaNO 2 ArN 2 Cl + NaCl + H 2 O Каталитическое действие минеральных кислот заключается в переводе азотистой кислоты в одну из активных диазотирующих форм: 8 Азотистая кислота
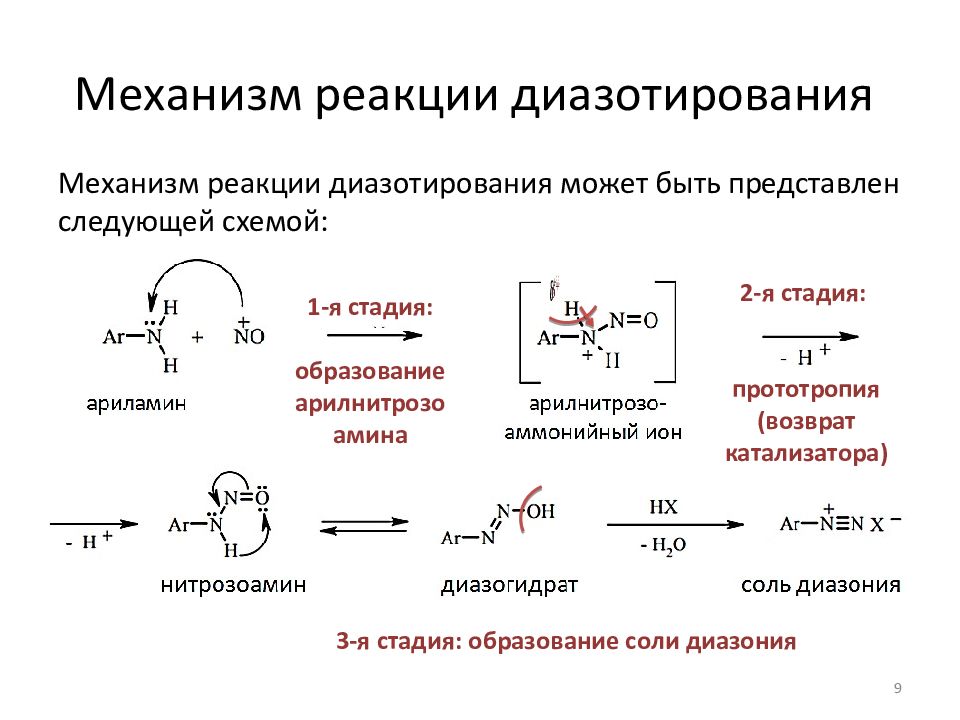
Слайд 9: Механизм реакции диазотирования
Механизм реакции диазотирования может быть представлен следующей схемой: 9 1-я стадия: образование арилнитрозо амина 2-я стадия: прототропия ( возврат катализатора ) 3-я стадия: образование соли диазония
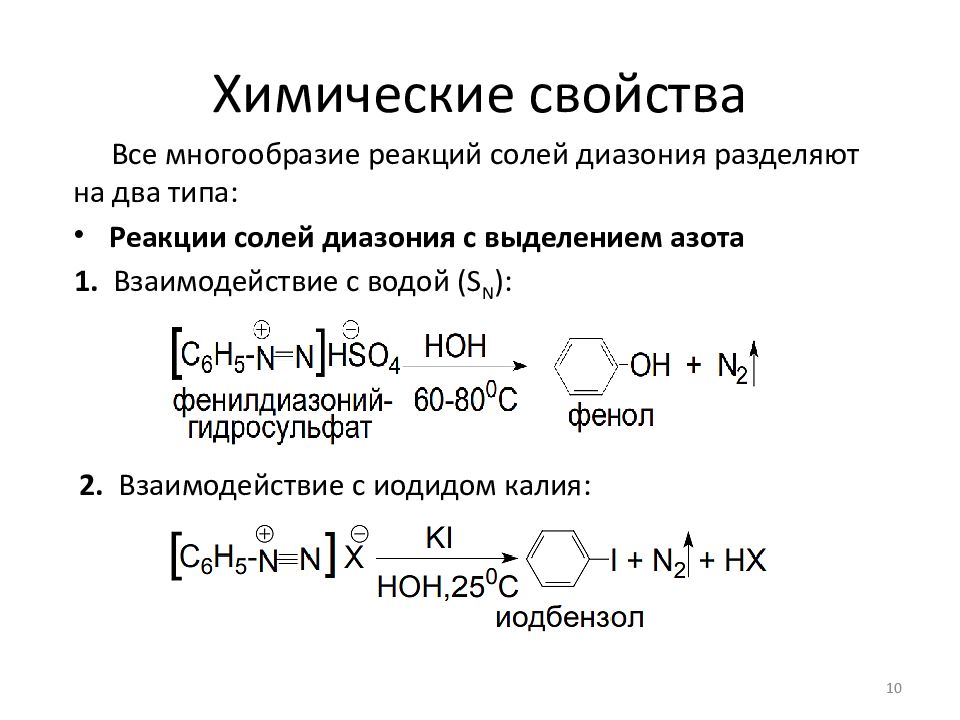
Слайд 10: Химические свойства
Все многообразие реакций солей диазония разделяют на два типа : Реакции солей диазония с выделением азота Реакции без выделения азота 10 1. Взаимодействие с водой ( S N ): 2. Взаимодействие с иодидом калия:
Слайд 11: Химические свойства
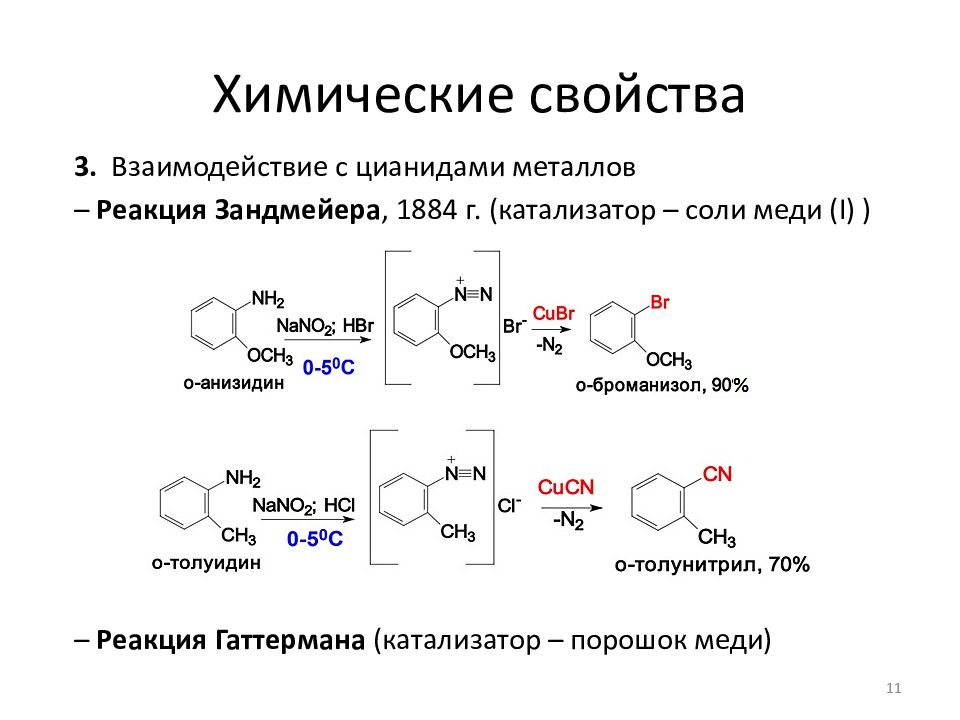
3. Взаимодействие с цианидами металлов – Реакция Зандмейера, 1884 г. (катализатор – соли меди ( I ) ) – Реакция Гаттермана (катализатор – порошок меди) 11
Слайд 12: Химические свойства
4. Взаимодействие с алкоголятами металлов [ Ar N N] + Cl – + C 2 H 5 ONa Ar O C 2 H 5 + NaCl + N 2 5. Взаимодействие с натриевой солью тетрафторборной кислоты ( реакция Шимана ) [ Ar N N ] + Cl – + NaBF 4 ArF + BF 3 + NaCl + N 2 6. Взаимодействие со спиртами ( реакция Грисса ) [ Ar –N N] + Cl – + CH 3 CH 2 OH ArH + CH 3 CHO + HCl + N 2 [ Ar –N N] + Cl – + CH 3 CH 2 OH Ar –O–CH 2 –CH 3 + HCl + N 2 12
Слайд 13: Химические свойства
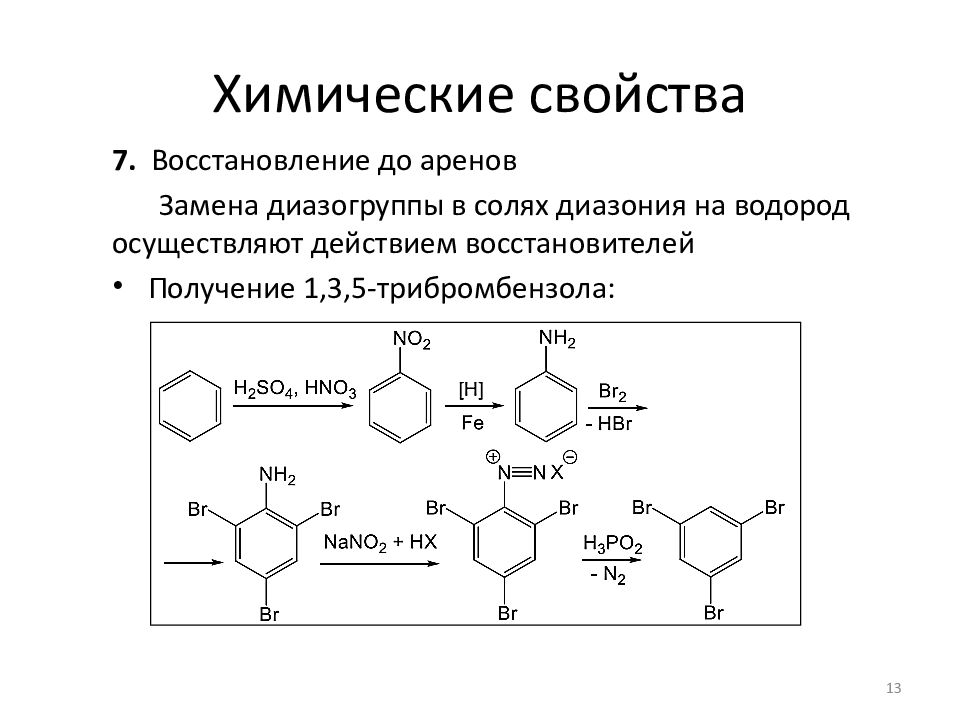
7. Восстановление до аренов Замена диазогруппы в солях диазония на водород осуществляют действием восстановителей Получение 1,3,5-трибромбензола: 13
Слайд 14: Химические свойства
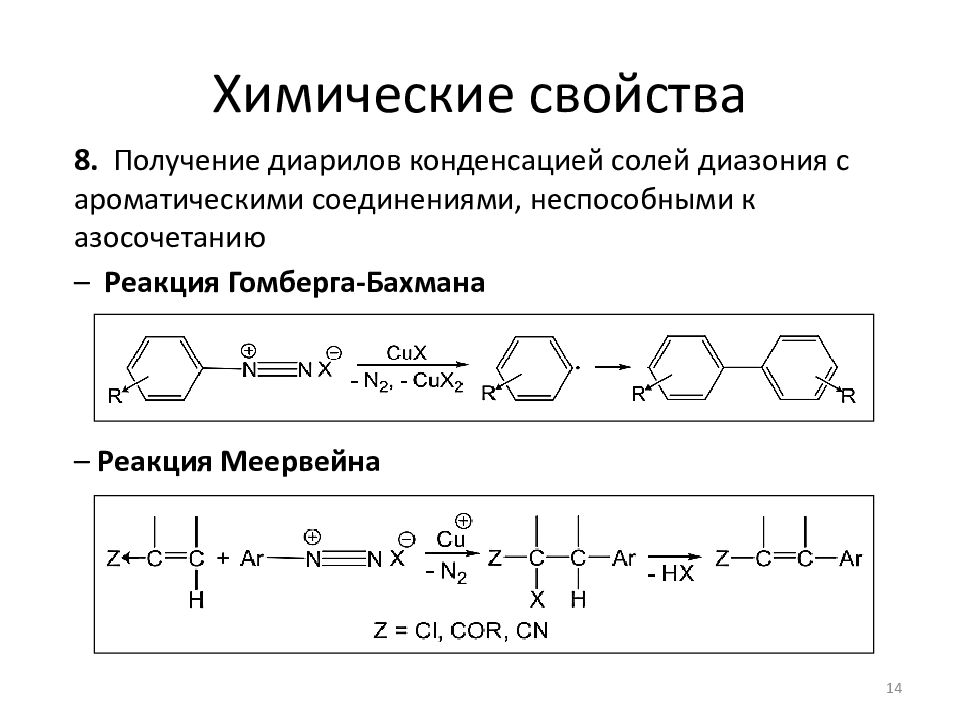
8. Получение диарилов конденсацией солей диазония с ароматическими соединениями, неспособными к азосочетанию – Р еакция Гомберга-Бахмана – Р еакция Меервейна 14
Слайд 15: Химические свойства
9. Получение металлорганических соединений действием металлических порошков на соли диазония Галогениды арилдиазония способны образовывать стабильные комплексные соли с галогенидами ртути, сурьмы, висмута, олова : – « Диазометод » А.Н. Несмеянова – реакции синтеза металлоорганических соединений 15
Слайд 16: Химические свойства
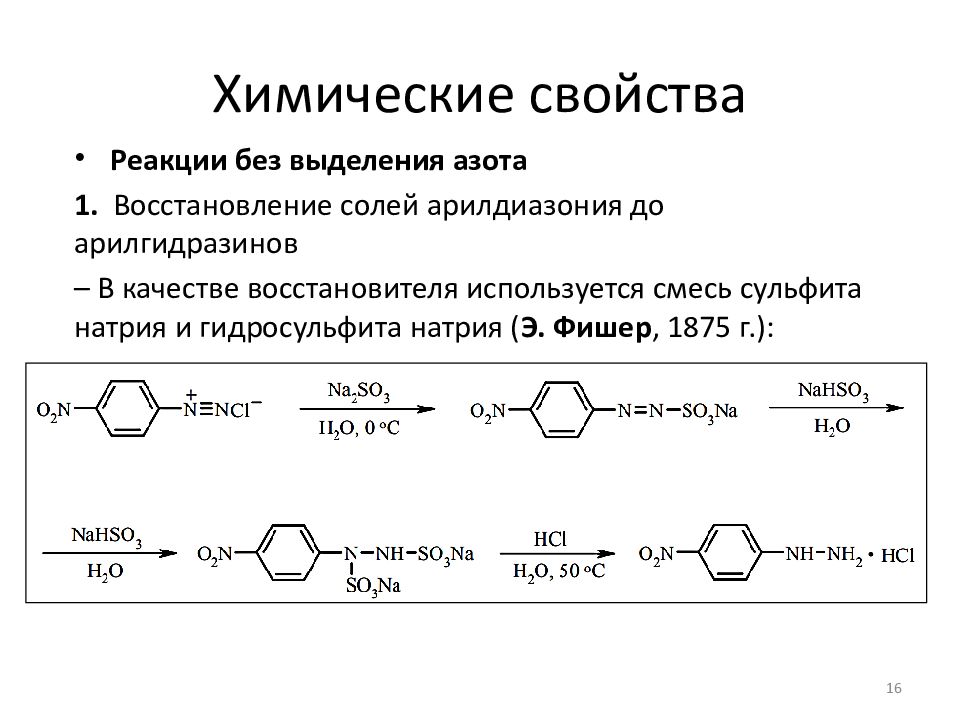
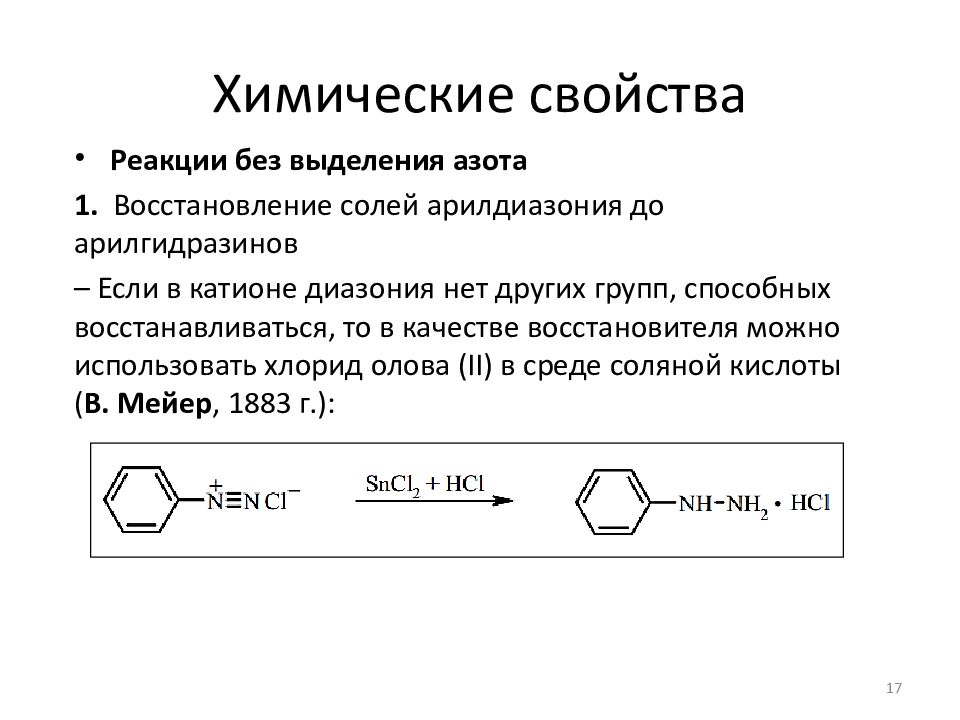
Реакции без выделения азота 1. Восстановление солей арилдиазония до арилгидразинов – В качестве восстановителя используется смесь сульфита натрия и гидросульфита натрия ( Э. Фишер, 1875 г.): 16
Слайд 17: Химические свойства
Реакции без выделения азота 1. Восстановление солей арилдиазония до арилгидразинов – Если в катионе диазония нет других групп, способных восстанавливаться, то в качестве восстановителя можно использовать хлорид олова (II) в среде соляной кислоты ( В. Мейер, 1883 г.): 17
Слайд 18: Химические свойства
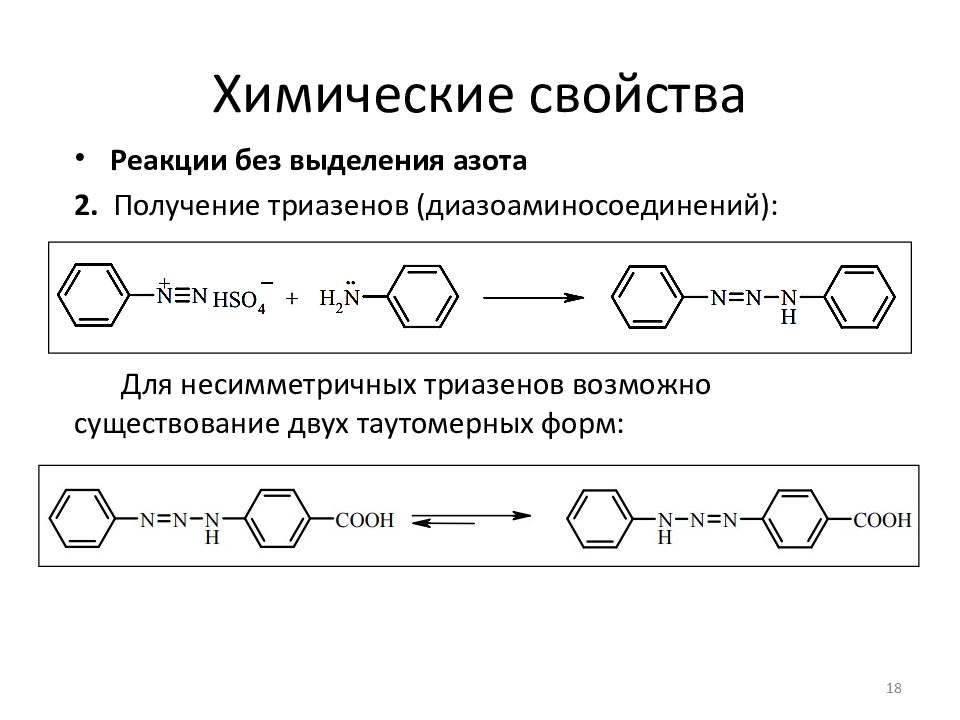
Реакции без выделения азота 2. Получение триазенов ( диазоаминосоединений ): Для несимметричных триазенов возможно существование двух таутомерных форм: 18
Слайд 19: Реакция азосочетания
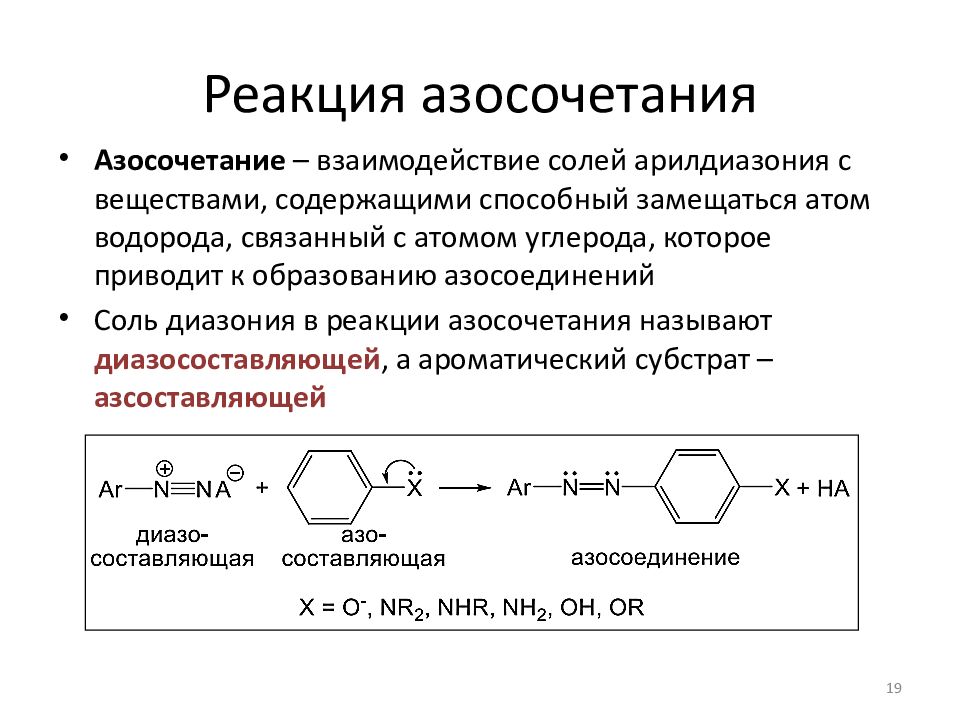
Азосочетание – взаимодействие солей арилдиазония с веществами, содержащими способный замещаться атом водорода, связанный с атомом углерода, которое приводит к образованию азосоединений Соль диазония в реакции азосочетания называют диазосоставляющей, а ароматический субстрат – азсоставляющей 19
Слайд 20: Реакция азосочетания
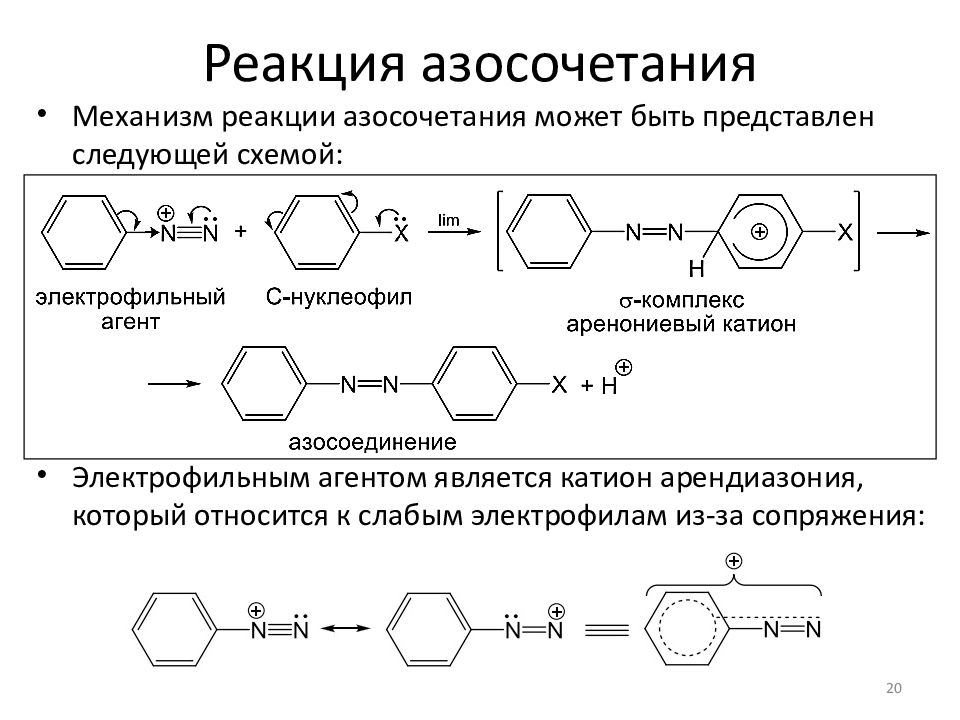
Механизм реакции азосочетания может быть представлен следующей схемой : Электрофильным агентом является катион арендиазония, который относится к слабым электрофилам из-за сопряжения : 20
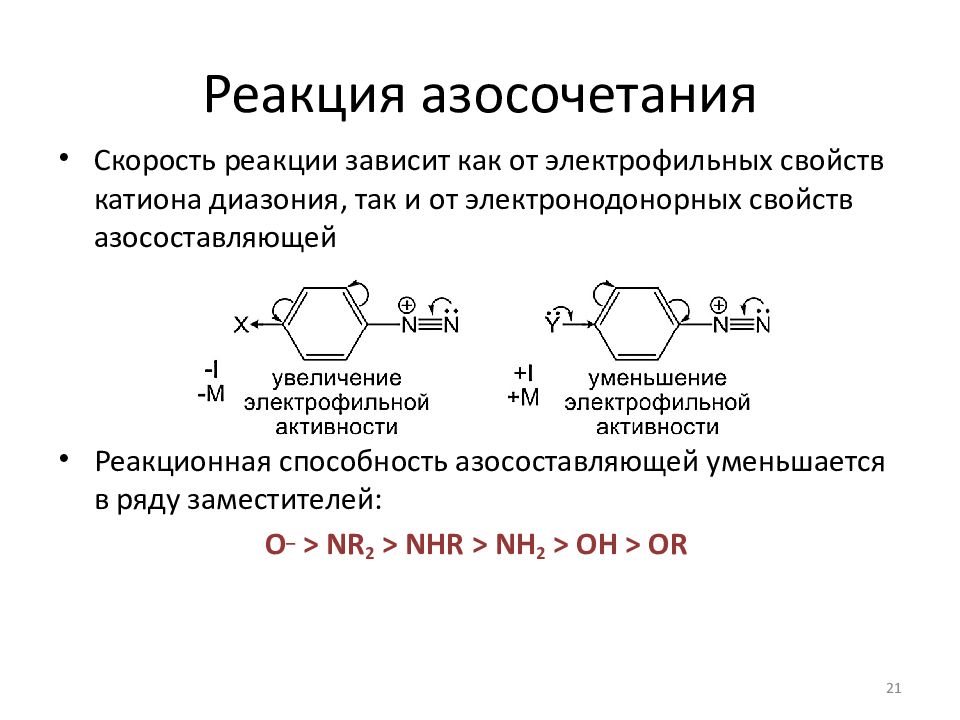
Слайд 21: Реакция азосочетания
Скорость реакции зависит как от электрофильных свойств катиона диазония, так и от электронодонорных свойств азосоставляющей Реакционная способность азосоставляющей уменьшается в ряду заместителей: O – > NR 2 > NHR > NH 2 > OH > OR 21
Слайд 22: Реакция азосочетания
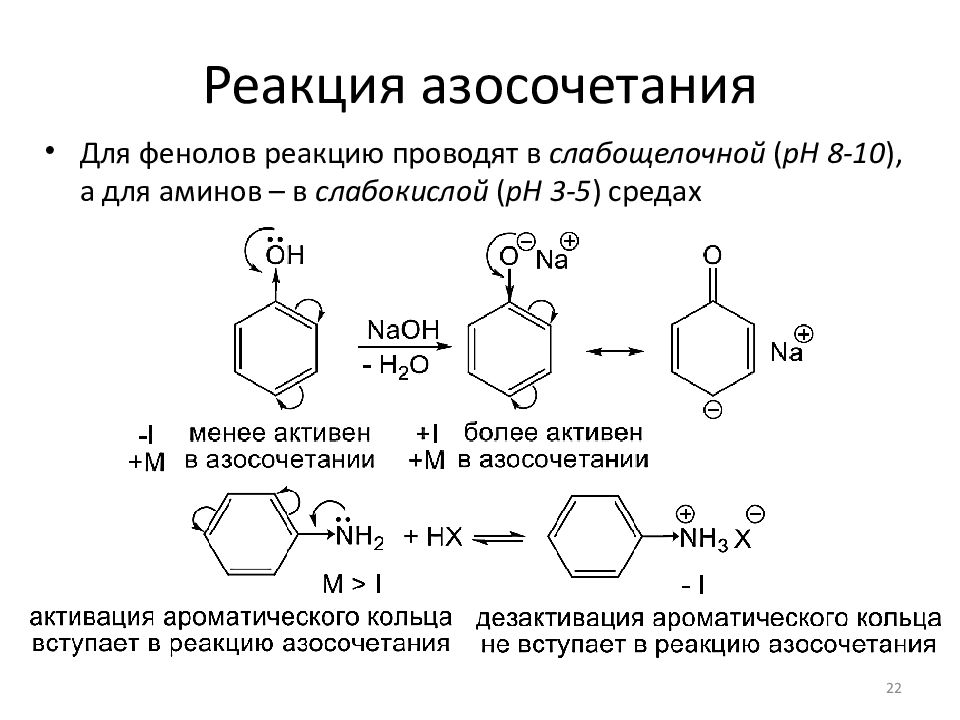
Для фенолов реакцию проводят в слабощелочной ( pH 8-10 ), а для аминов – в слабокислой ( pH 3-5 ) средах 22
Слайд 23: Реакция азосочетания
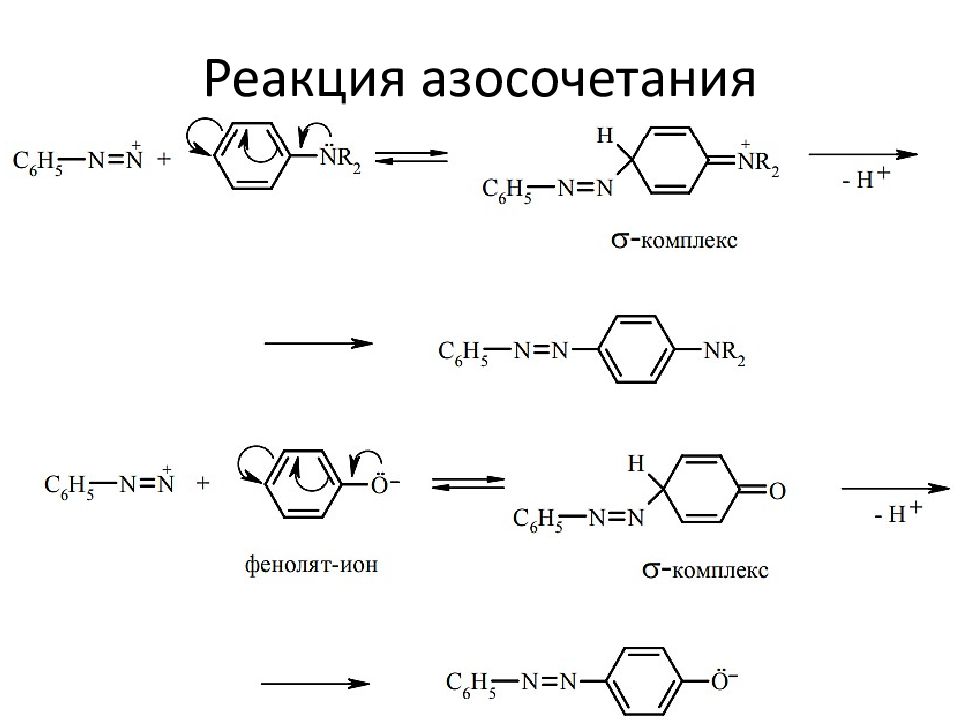
Реакции азосочетания с амином: Реакции азосочетания с фенолом: 23
Слайд 24: Реакция азосочетания
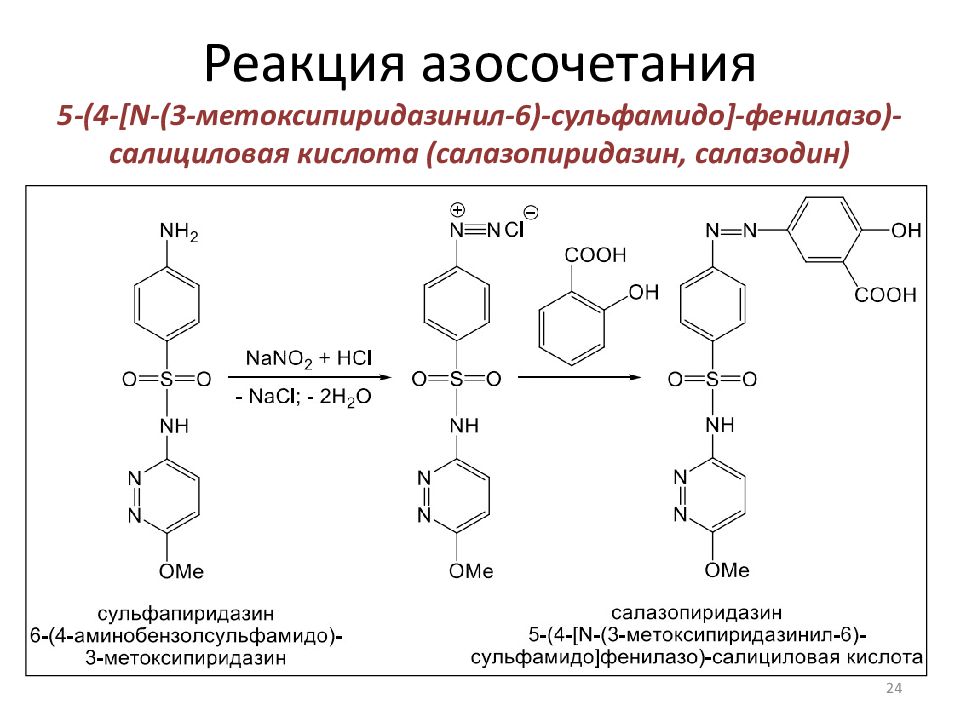
5-(4-[N-(3-метоксипиридазинил-6 )- сульфамидо ]- фенилазо )-салициловая кислота ( салазопиридазин, салазодин ) И спользуется в фармации Неспецифический язвенный колит – длительно-текущее воспалительное заболевание кишечника Ревматоидный артрит – это системное воспалительное заболевание соединительной ткани с преимущественным поражением мелких суставов О казываете антибактериальное и противовоспалительное действие 24
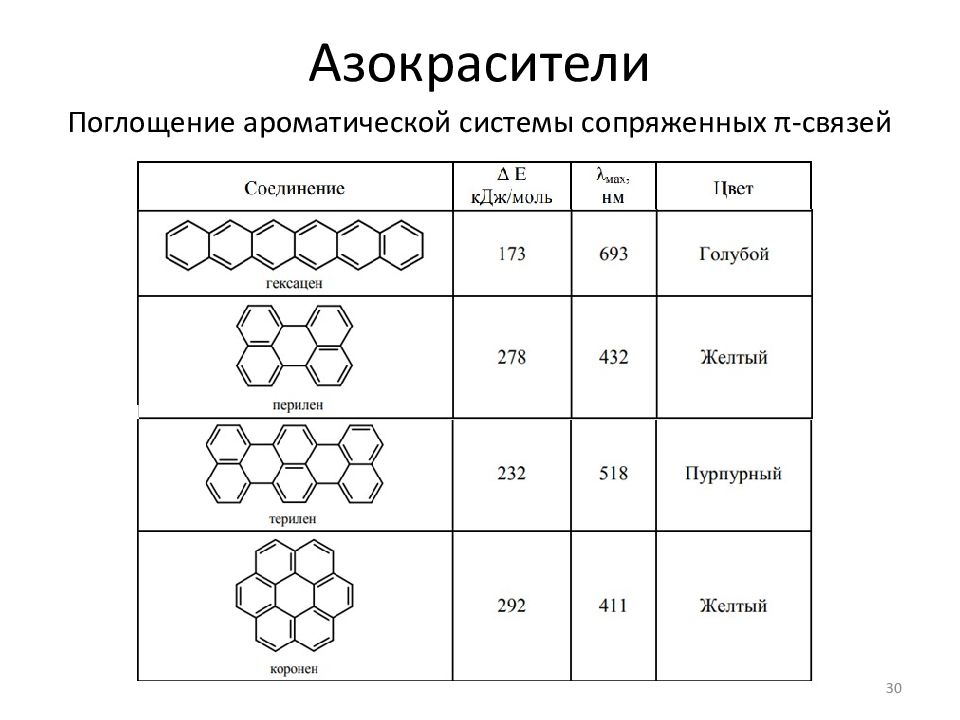
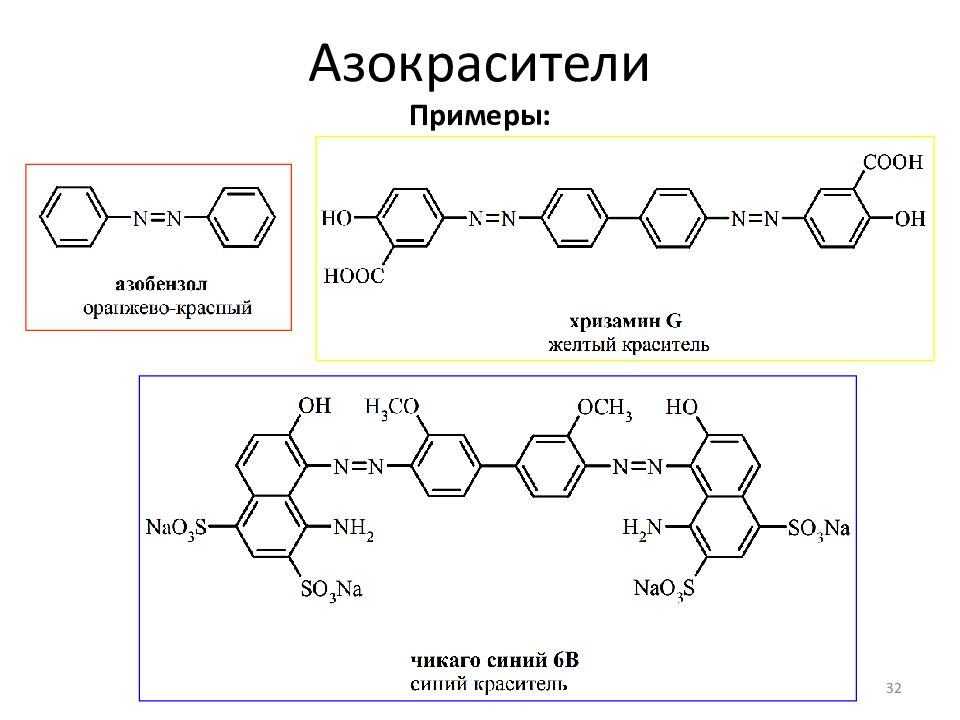
Слайд 25: Азокрасители
Азоарены окрашены; глубина окраски зависит от длины сопряженной системы и степени делокализации электронов 25 Порошковые пигменты для красок
Слайд 26: Азокрасители
Ощущение цвета возникает в результате воздействия на зрительный нерв электромагнитного излучения с частотами ν в пределах 3,8 10 14 – 7,6 10 14 Гц, т.е. с длинами волн λ от 380 до 760 нм (видимая часть спектра) Энергия Е электромагнитного излучения определяется уравнением Планка : E = hν = hc /λ Для того чтобы соединение было окрашенным, энергия возбуждения его молекулы ΔЕ = Е' - Е 0 должна лежать в этих пределах (при ΔЕ > 300 кДж/моль поглощение происходит в УФ, при ΔЕ < 158 кДж/моль – в ИК частях спектра) Указанным значениям энергии возбуждения отвечают переходы между различными электронными уровнями энергии молекул 26
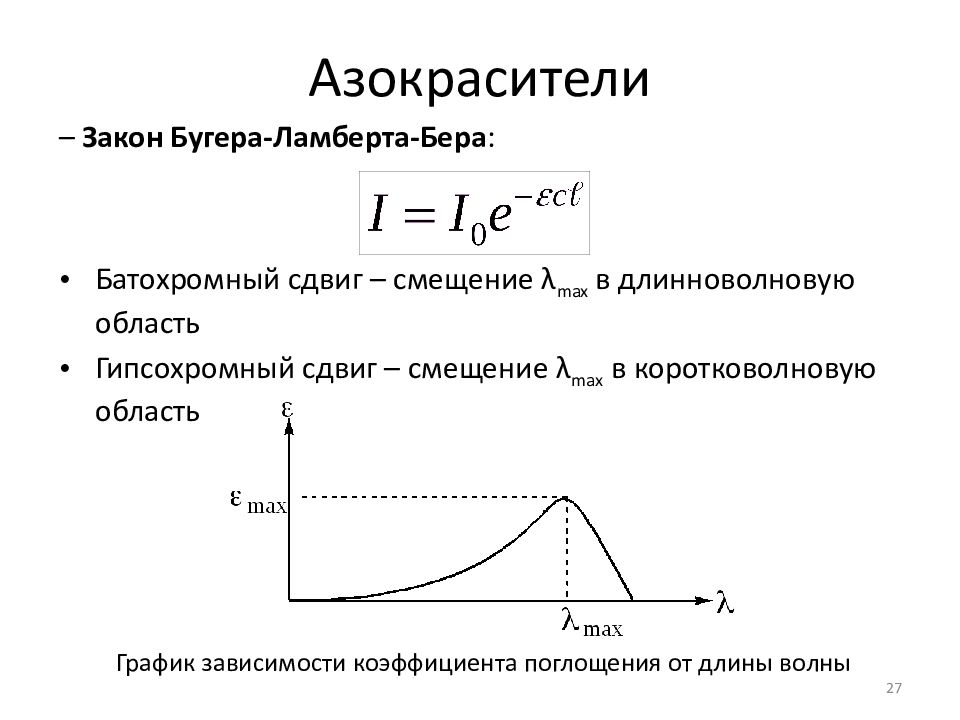
Слайд 27: Азокрасители
– Закон Бугера -Ламберта- Бера : Батохромный сдвиг – смещение λ max в длинноволновую область Гипсохромный сдвиг – смещение λ max в коротковолновую область 27 График зависимости коэффициента поглощения от длины волны
Слайд 28: Азокрасители
Для молекул углеводородов с изолированными π-связями появляется возможность π π * - перехода (при этом энергия возбуждения снижается) Для этилена энергия возбуждения 739 кДж/моль, что соответствует поглощению в дальней УФ области ( λ max = 162,5 нм ) Такие соединения бесцветны 28 Схема энергетического перехода уровней этилена
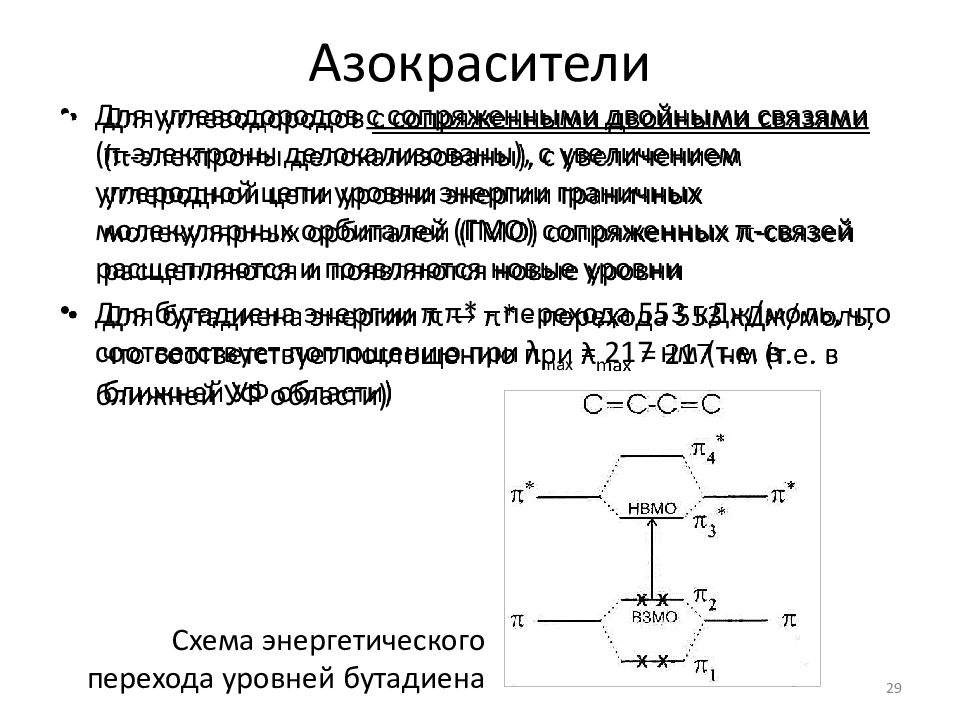
Слайд 29: Азокрасители
Для углеводородов с сопряженными двойными связями (π-электроны делокализованы ), с увеличением углеродной цепи уровни энергии граничных молекулярных орбиталей (ГМО) сопряженных π-связей расщепляются и появляются новые уровни Для бутадиена энергии π π * - перехода 553 кДж/моль, что соответствует поглощению при λ max = 217 нм (т.е. в ближней УФ области ) 29 Схема энергетического перехода уровней бутадиена
Слайд 31: Азокрасители
Электронной теории цветности предшествовали более ранние теории – Хромофорно-ауксохромная теория Витта Причина окраски соединений – наличие протяженной системы сопряжения; интенсивность цвета обусловлена присутствием в молекуле определённых групп атомов, называемых хромофорами и ауксохромами Хромофоры – группы атомов, содержащие кратные связи и обуславливающие окраску соединения Основные хромофоры : -N=O, - NO 2, -N=N-, -С=N-, -C=C-, - C=O Ауксохромны не являются окрашенными и не вызывают появление окраски, но в присутствии хромофора способствуют углублению окраски Ауксохромные группы: - OCH 3, - NH 2, - NR 2, -SH, -OH, - Hal 31
Слайд 33: Азокрасители
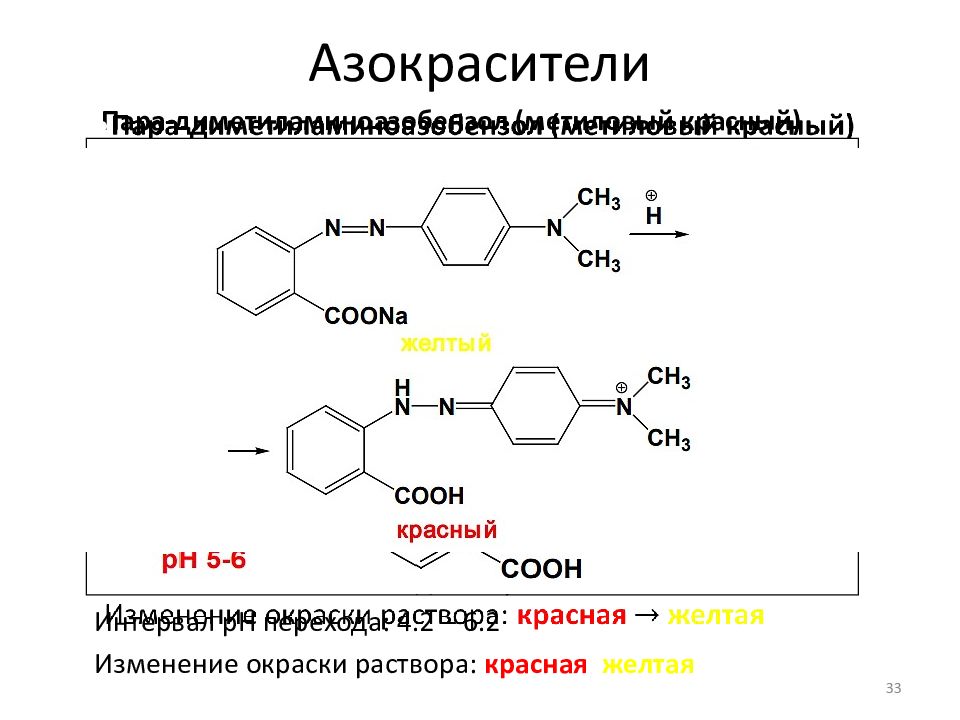
Пара- диметиламиноазобензол (метиловый красный) Область применения: с интетический анилиновый краситель кислотно-основный индикатор Интервал pH перехода: 4.2 – 6.2 Изменение окраски раствора: красная желтая 33 Диметиланилин Антраниловая кислота
Слайд 34: Азокрасители
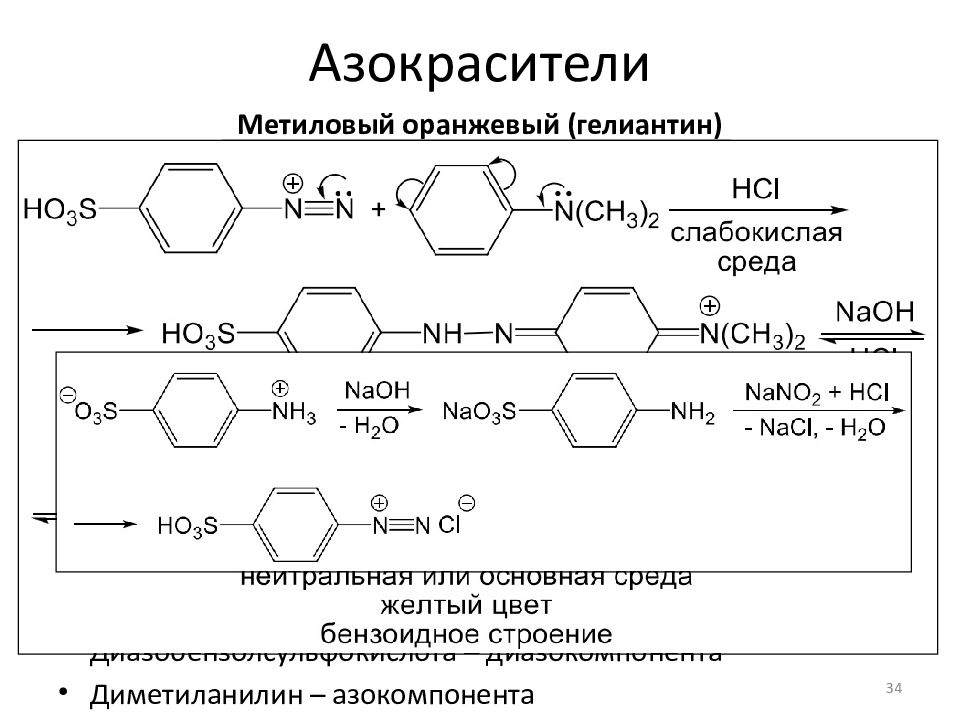
Метиловый оранжевый (гелиантин ) Область применения: кислотно-основный индикатор: при рН<5 протонируется и изменяет цвет Спектральные характеристики: в нейтральной и щелочной среде желтый ( λ мах = 464 нм ) в кислой среде красный ( λ мах = 522 нм ) Исходные вещества: Диазобензолсульфокислота – диазокомпонента Диметиланилин – азокомпонента 34
Слайд 35: Азокрасители
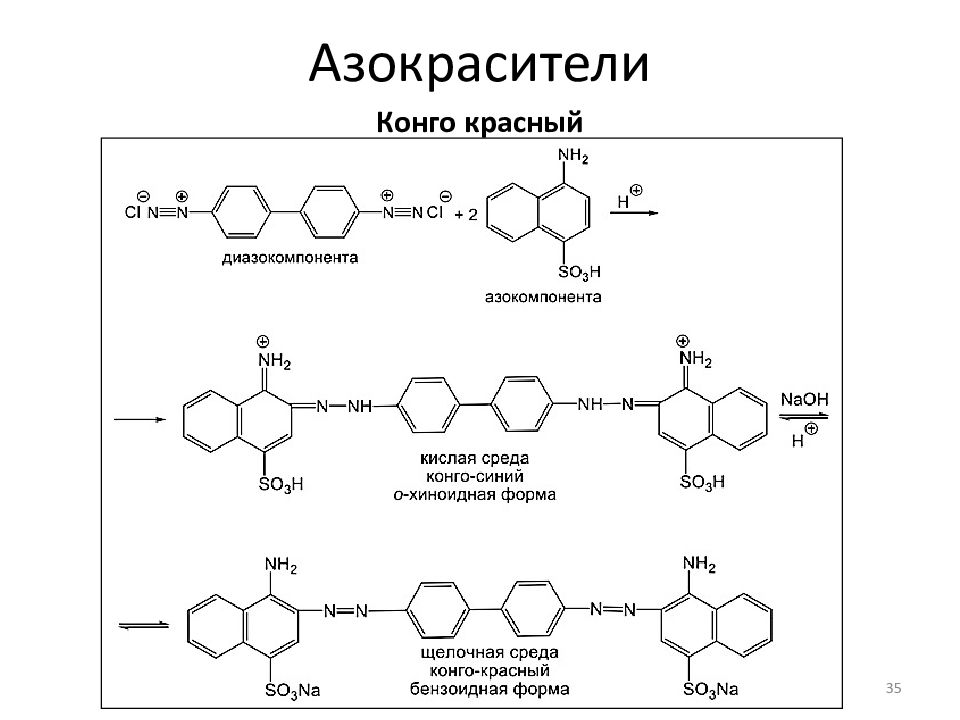
Конго красный Область применения: краситель щерсти, шелка, индикатор Спектральные характеристики: рН > 5.2 красный ( λ мах = 497 нм ) рН 3.0 – 5.2 сине-фиолетовый ( λ мах = 585 нм ) Исходные вещества: Бензидин – диазокомпонента, Нафтионовая кислота – азокомпонента 35
Слайд 36: Азокрасители
По технологическому оформлению различают следующие методы крашения: Крашение в процессе формирования волокна Прямое крашение Набивное крашение Ледяное крашение 36 Тканепечатающие машины