Первый слайд презентации
Қазақстан Республикасы Білім және ғылым министрлігі Е.А.Бөкетов атындағы Қарағанды мемлекеттік университеті Химия факультеті Дәрілік заттарды тіркеу ережелері Орындаған: Рашитқызы А.ТФП-318 Қабылдаған: Садвакасова Л.Е Қарағанды 2021 ж
Слайд 2: Жоспар
Кіріспе Негізгі бөлім: ДЗ тіркеу: жалпы ережелер Біртұтас Экономикалық Кеңістікке (БЭК) қатысушы мемлекеттерде дәрілік заттарды тіркеу ерекшеліктері ДЗ-тың сапасын стандартизациялау Клиникалық зерттеулер / сынақтар Қорытынды Қолданылған әдебиеттер
Слайд 3: Кіріспе
Қазіргі таңда, ДЗ мемлекеттік тіркеу жұмыстарын Денсаулық Сақтау Министрлігінің (ДСМ) ведомствосы – Фармация Комитеті РМК « Дәрілік заттарды, медициналық мақсаттағы бұйымдарды және медицина техникасын сараптау ұлттық О рталығының» ДЗ-ты ң қауіпсіздігі, тиімділігі және сапасы туралы қорытындысы негізінде жүргізеді. 2003 жылы қаңтарда «Дәрілік заттар туралы» Заңын (күші жойылған) қабылдаудан бастап ДЗ мемлекеттік тіркеу жүйесін құруда заң базалар жасалынды. Қазіргі кезде клиникаға дейінгі және клиникалық зерттеулер, ДЗ жанама әсерлерінің мониторинг тәртіптері бекітілді, ДЗ туралы ақпараттар реттеліп жатыр.
ДЗ тіркеу бұл — белгілі бір мемлекет аясында ДЗ тауарайналымға (қолданысқа) түсуіне рұқсат ету (жіберу) мен оның қауіпсіздігін, тиімділігін және сапасын қолданыстағы нормативті құжаттарға сәйкес растау мақсатымен жүргізілетін процедура. Дәрілік затқа тіркеу куәлігін (ТК) беру дәрілік затты тіркеудің оң нәтижесі болып табылады.
Мемлекеттік тіркеу және қайта тіркеуге Қазақстан Республикасында өндірілген, сонымен қатар осы аумаққа әкелінген дәрілік заттар жатады, олар: 1) саудалық атауын қоса дәрілік түрі, мөлшері, түптелуі көрсетілген дәрілік препараттардан; 2) Қазақстан Республикасына әкелінетін балк-өнімдерден; 3) Қазақстан Республикасында бұрын тіркелген дәрілік түрі, мөлшері, қаттауы көрсетілген дәрілік заттардың жаңа комбинацияларын; 4 ) Қазақстан Республикасында бұрын тіркелген бірақ басқа өндіруші мекемемен басқа дәрілік түрде жаңа мөлшерімен, жаңа түптелуімен, жаңа қаптамамен, қосалқы заттардың басқа құрамдағы дәрілік заттардан тұрады. Қазақстан Республикасында мемлекеттік тіркеуге өндіруші-елде тіркелген дәрілік заттар жатады.
Дәріханаларда дайындалған дәрілік препараттар Тиісті өндірістік тәжірибе жағдайларында жасалған дәрілік субстанциялар мемлекеттік тіркеуге жатпайды. Бір атауы бар бірақ құрамы әртүрлі белсенді заттардан тұратын дәрілік препараттарды мемлекеттік тіркеуге тыйым салынады.
Қазақстан Республикасында дәрілік заттарды мемлекеттік тіркеуге, қайта тіркеуге өтініш немесе Қазақстан Республикасында мемлекеттік тіркеуден (қайта тіркеуден) өткен дәрілік заттардың тіркеу деректеріне өзгерістер енгізуіне өтініш Қазақстан Республикасында дәрілік заттарды мемлекеттік тіркеу, қайта тіркеу кезінде ұсынылатын тіркеу деректерінің тізбесі Жалпы техникалық құжат форматында ( тиісті өндірістік практика жағдайында өндірілген дәрілік заттар үшін) Қазақстан Республикасында дәрілік заттарды мемлекеттік тіркеу, қайта тіркеу кезінде ұсынылатын тіркеу деректерінің тізбесі
Слайд 8: Қазақстан Республикасында дәрілік заттарды мемлекеттік тіркеу, қайта тіркеу кезінде ұсынылатын тіркеу деректерінің тізбесі
I бөлім Жалпы құжаттама II бөлім Химиялық, фармацевтикалық және биологиялық құжаттама III бөлім. Фармакологиялық және уыттану құжаттамалары IV бөлім Клиникалық құжаттама
Слайд 9: Жалпы техникалық құжат форматында (тиісті өндірістік практика жағдайында өндірілген дәрілік заттар үшін) Қазақстан Республикасында дәрілік заттарды мемлекеттік тіркеу, қайта тіркеу кезінде ұсынылатын тіркеу деректерінің тізбесі
1 модуль Әкімшілік ақпараттар 2 модуль ЖТҚ түйіндемесі 3 модуль Сапасы 4 модуль Клиникаға дейінгі зерттеулер туралы есептер 5 модуль Клиникалық зерттеулер туралы есептер
Слайд 11: Тіркеу мерзімдері
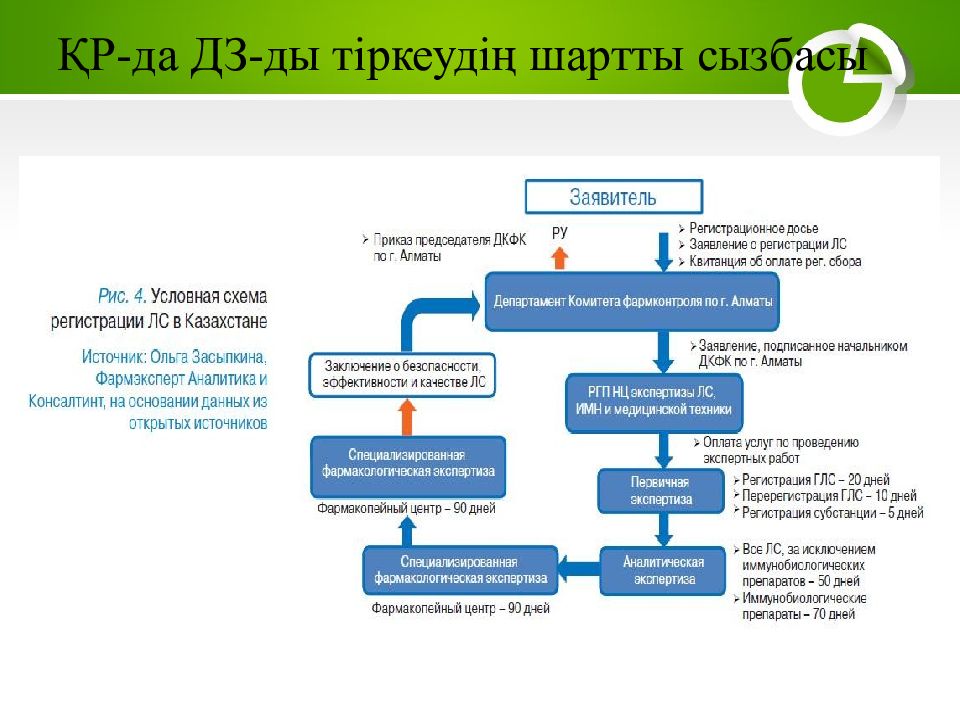
БЭК-ке қатысушы мемлекеттердің әрқайсысында ДЗ-ты тіркеу мерзімі, сонымен қатар осы процедураның құны, ең алдымен, ДЗ-тың түрімен және сараптама жүргізу жұмыстарының көлемімен
Слайд 12: Қорытынды
БЭК-ке қатысушы-мемлекеттерінде ДЗ-ды тіркеу процедуралары, сонымен бірге олардың құны мен мерзімі бір-бірінен айтарлықтай ерекшелінеді. Бірақ барлық жағдайларда отандық өндірушілерге демеушілік байқалады (процедуралырды қарапайымдандыру, құнын төмендету немесе мерзімін қысқарту түрінде). Бұл мемлекеттер мен бүкіл әдемде де, шынайы және инновациондық препараттарды тіркеуге қарағанда дженерикті препараттарды тіркеу едәуір қарапайымдырақ.
Последний слайд презентации: Қазақстан Республикасы Білім және ғылым министрлігі Е.А.Бөкетов атындағы: Қолданылған әдебиеттер
Қазақстан Республикасы Денсаулық сақтау министрінің 2009 жылғы 18 қарашадағы N 735 Бұйрығы http://www.pharmexpert.ru/analytics/5/2398/ http://www.e-apteka.kz/content/pages/post/217