Первый слайд презентации: Современные методы исследования БАС
Методы выделения и анализа. Лекция 2
Слайд 2: Буферные растворы
Буферные растворы - это растворы, концентрация ионов водорода (рН) которых не изменяется от прибавления ограниченных количеств сильной кислоты или щелочи. Основные типы : Слабая кислота и ее анион А- /НА Слабое основание и его катион В/ВН+ Анионы кислой и средней соли или двух кислых солей Ионы и молекулы амфолитов
Слайд 3: pH – водородный показатель
pH (произносится «пэ аш», английское произношение англ. pH — piː'eɪtʃ «Пи эйч») - мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр: pH = - lg[H + ] В чистой воде при 22 °C концентрации ионов водорода ([H+]) и гидроксид-ионов ([OH−]) одинаковы и составляют 10−7 моль/л, это напрямую следует из определения ионного произведения воды, которое равно [H+] · [OH−] и составляет 10−14 моль²/л² (при 22 °C). Вопреки распространённому мнению, pH может изменяться не только в интервале от 0 до 14, а может и выходить за эти пределы. Например, при концентрации ионов водорода [H+] = 10−15 моль /л, pH = 15, при концентрации ионов гидроксида 10 моль /л pOH = −1.
Слайд 6
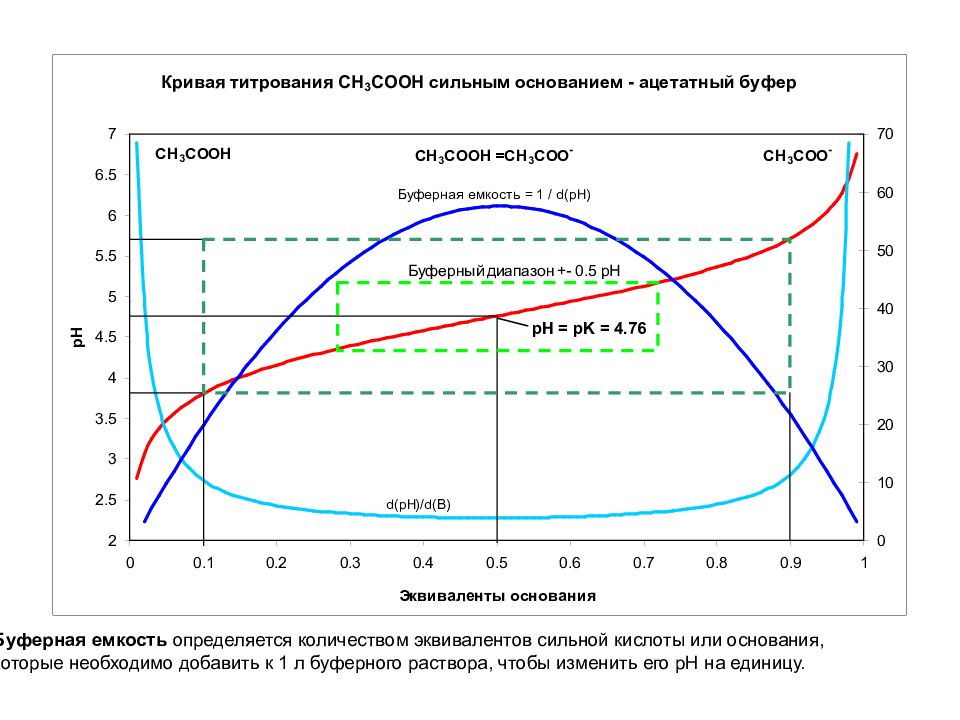
Буферная емкость определяется количеством эквивалентов сильной кислоты или основания, которые необходимо добавить к 1 л буферного раствора, чтобы изменить его pH на единицу.
Слайд 7: Буферная емкость
Что происходит с pH при разбавлении буфера? Буферная емкость максимальна при соотношении кислоты и соли 1:1 = > pH = pK. Хорошая – при [pK+0.5, pK-0.5] Достаточная – при [pK+ 1, pK- 1 ] Что происходит с буферной емкостью при разбавлении буфера?
Слайд 8: Буферная емкость
Буферная емкость максимальна при соотношении кислоты и соли 1:1 = > pH = pK. Хорошая – при [pK+0.5, pK-0.5] Достаточная – при [pK+ 1, pK- 1 ] Чем выше концентрация раствора, тем больше его буферная емкость. Концентрация кислоты и соли в буферных растворах обычно бывает порядка 0,05—0,20 М.
Слайд 9: Требования к буферным растворам
Обладать достаточной буферной емкостью в требуемом диапазоне значений рН. Обладать высокой степенью чистоты. Хорошо растворяться в воде и не проникать через биологические мембраны. Обладать устойчивостью к действию ферментов и гидролизу. рН буферных растворов должен как можно меньше зависеть от их концентрации, температуры и ионного или солевого состава среды. Не оказывать токсического или ингибирующего действия. Комплексы буфера с катионами должны быть растворимыми. Не поглощать свет в видимой или ультрафиолетовой областях спектра.
Слайд 10: Буферные растворы
Ацетатный, цитратный, боратный Аммиачный, ТРИС Фосфатный, гидрокарбонатный
Слайд 11: ТРИС
Трис ( tris ) — сокращённое название трис (гидроксиметил) аминометана. Является главным компонентом буферных растворов, широко применяющихся в биохимии и молекулярной биологии. Наиболее распространённые буферы на основе триса — TAE (трис — ацетат — ЭДТА) и TBE (трис — борат — ЭДТА). Трис биологически инертен и не вступает в реакции, катализируемые большинством ферментов. pKa = 8,6, что позволяет готовить на его основе буферы в диапазоне pH от 7,0 до 9,2. Физиологические значения pH (7,35—7,45) попадают в этот диапазон.
Между измерениями рабочая часть электрода должна находиться в буфере для заполнения электрода (обычно: {насыщенный KCl}, {4M KCl насыщенный AgCl}, {1M KCl насыщенный AgCl} и т.п.). Ни в коем случае - не "сухой" и не "в дистилляте"! Электрод портится не только из-за измерения в грязных/белковых растворах. Проблемы может вызвать и его высушивание. О проблемах с электродом может свидетельствовать медленная установка pH (достижение 95% величины измерения более, чем за 45сек.)
Слайд 13: Центрифугирование
Центрифугирование (от центр и лат. fuga — бегство, бег), разделение неоднородных систем под действием центробежных сил. Мы имеем дело с жидкостными системами – суспензиями и эмульсиями.
Слайд 14: Термины и определения
Диспе́рсная систе́ма — это образования из двух или более числа фаз (тел), которые совершенно или практически не смешиваются и не реагируют друг с другом химически. Первое из веществ ( дисперсная фаза ) мелко распределено во втором ( дисперсионная среда ). Если фаз несколько, их можно отделить друг от друга физическим способом (центрифугировать, сепарировать и т. д.). Эму́льсия (новолат. emulsio, от лат. emulgeo — дою, выдаиваю) — дисперсная система с жидкой дисперсионной средой и жидкой дисперсной фазой. Эмульсии состоят из несмешиваемых жидкостей. Суспе́нзия, или взвесь (лат. suspensio, буквально — подвешивание, от лат. suspendo — подвешиваю) — смесь веществ, где твёрдое вещество распределено в виде мельчайших частичек в жидком веществе во взвешенном (неосевшем) состоянии. Обычно размер частиц > 10 мкм
Слайд 15: Термины и определения
Коллоидные системы ( коллоиды, др.-греч. κόλλα — клей и εἶδος — вид; «клеевидные») — дисперсные системы, промежуточные между истинными растворами и грубодисперс-ными системами — взвесями. Коллоидные частицы не препятствуют прохождению света. В прозрачных коллоидах наблюдается рассеивание светового луча (эффект Тиндаля). Дисперсные частицы не выпадают в осадок за счёт броуновского движения. Золи (нем. sole от лат. solutio — раствор) = коллоидные растворы Ге́ли (от лат. gelo — «застываю») — структурированные дисперсные системы, состоящие из высокомолекулярных и низкомолекулярных веществ. Наличие трёхмерного полимерного каркаса (сетки) сообщает гелям механические свойства твёрдых тел - отсутствие текучести, способность сохранять форму, прочность и способность к деформации (пластичность и упругость). «гель» — химия, химическая технология, косметические и бытовые средства; «желе» — в кулинарии сладкие фруктовые или ягодные студенистые блюда; «студень» — в кулинарии мясное или рыбное блюдо из охлажденного мясного (или рыбного) бульона с кусочками мяса (или рыбы)
Слайд 16: Центрифугирование
Скорость осаждения, или седиментации,зависит от центробежного ускорения (G), прямо пропорционального угловой скорости ротора ( ω,в рад/с) и расстоянию между частицей и осью вращения ( R, в см): G = ω 2 * R. Угловая скорость ротора в оборотах в минуту N (об./мин) ω = 2 π N /60 = π N / 3 0 Центробежное ускорение: G = π 2 * N 2 * R / 900 (об./мин) Центробежное ускорение обычно выражается в единицах g и называется относительным центробежным, ускорением ОЦУ= G / 980 = 1,11 * 10 -5 * N 2 * R Что такое g ? Чему равно?
Слайд 17: Закон Стокса, видоизмененный Сведбергом и Никольсом
время, необходимое для осаждения гомогенных сфери-ческих частиц, обратно пропорционально квадрату их радиусов и разности плотностей частиц и среды и прямо пропорционально вязкости среды!
Слайд 18: Центрифугирование
Препаративное Аналог фильтрования Разделение объектов Аналитическое Молекулярные веса Изучение конформаций макромолекул
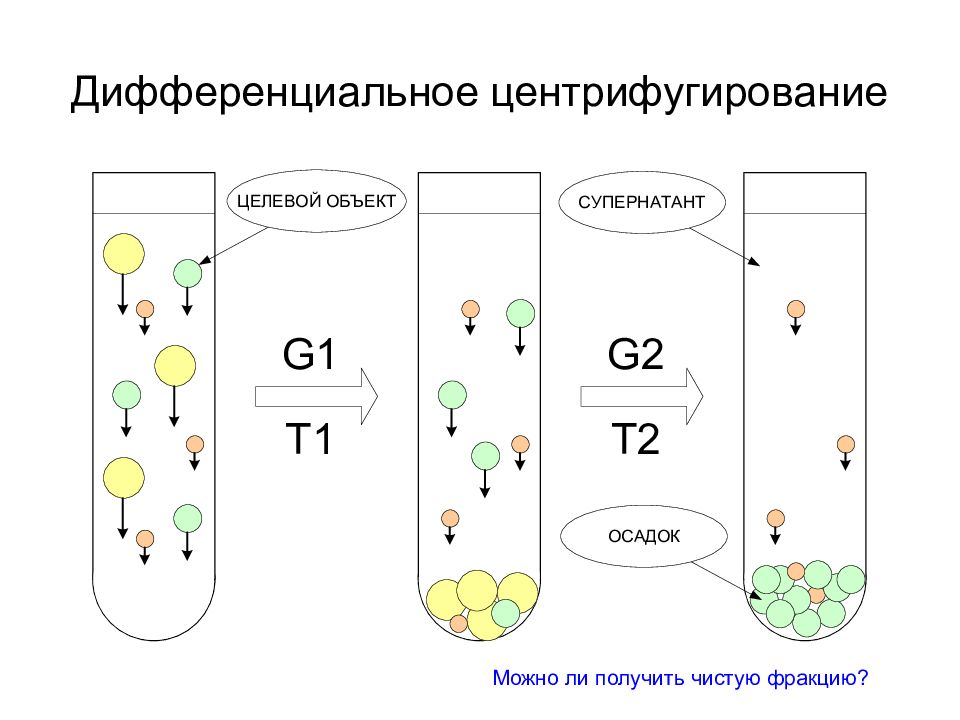
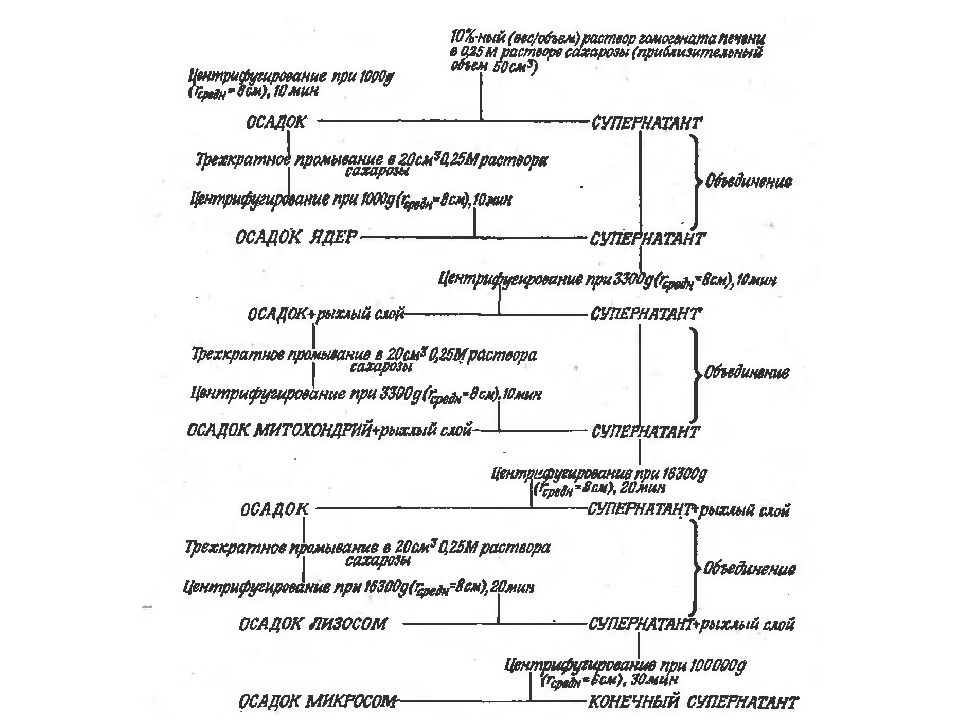
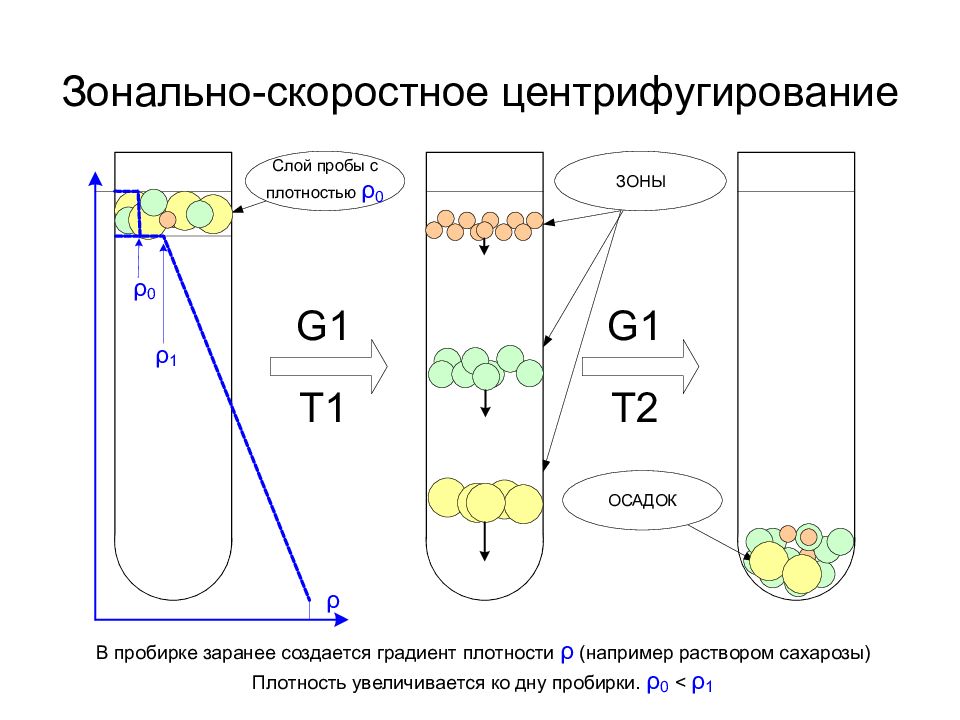
Слайд 19: Методы центрифугирования
Дифференциальное Зонально-скоростное Изопикническое
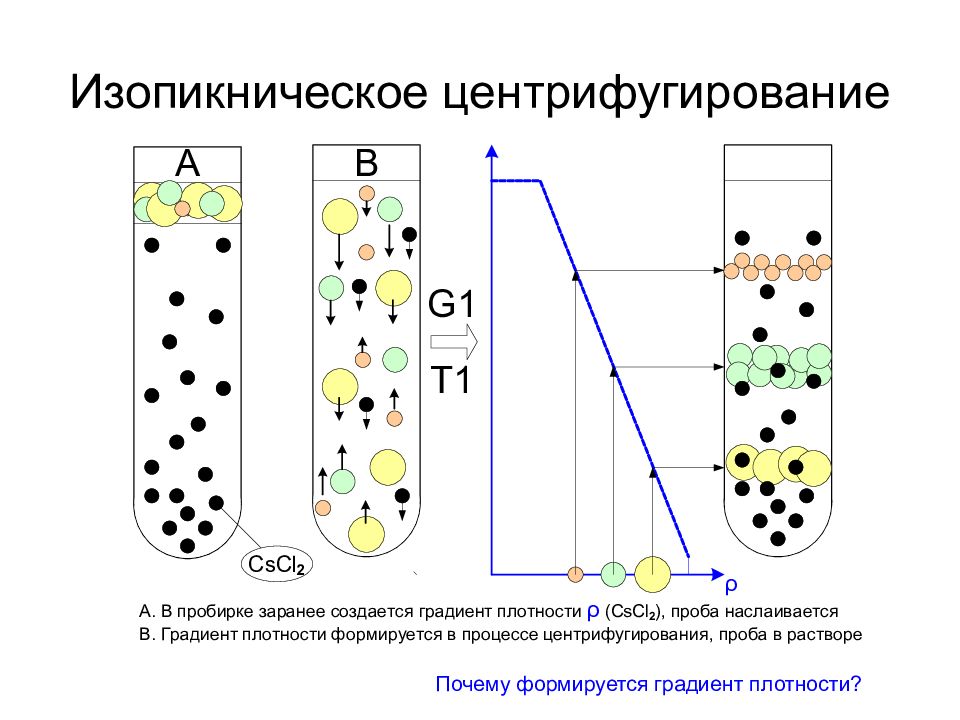
Слайд 23: Изопикническое центрифугирование
Почему формируется градиент плотности?
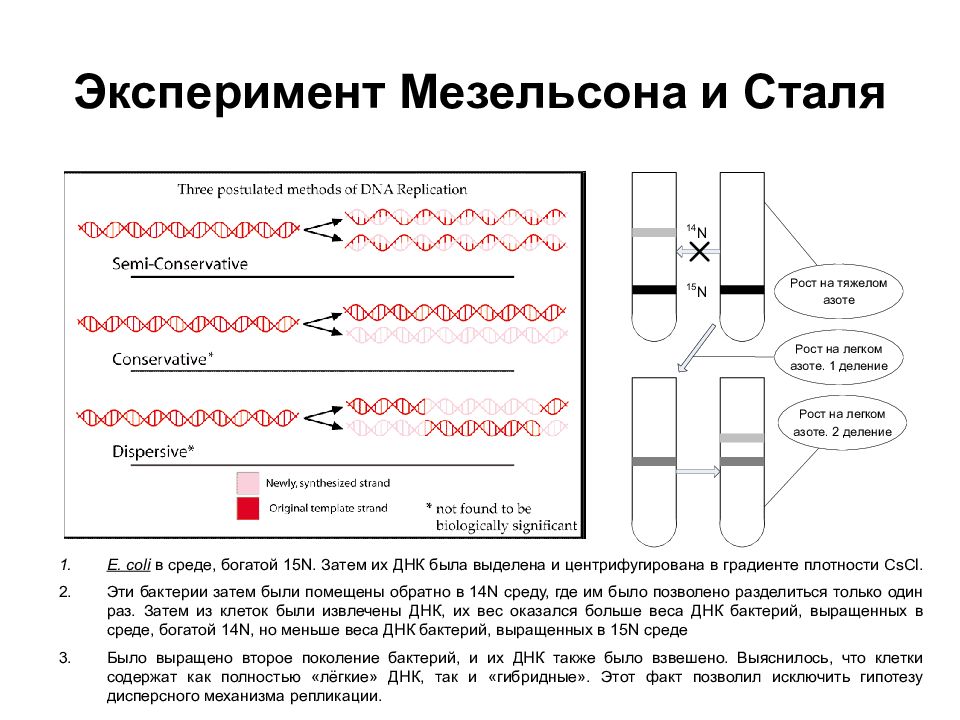
Слайд 24: Эксперимент Мезельсона и Сталя
E. coli в среде, богатой 15N. Затем их ДНК была выделена и центрифугирована в градиенте плотности CsCl. Эти бактерии затем были помещены обратно в 14N среду, где им было позволено разделиться только один раз. Затем из клеток были извлечены ДНК, их вес оказался больше веса ДНК бактерий, выращенных в среде, богатой 14N, но меньше веса ДНК бактерий, выращенных в 15N среде Было выращено второе поколение бактерий, и их ДНК также было взвешено. Выяснилось, что клетки содержат как полностью «лёгкие» ДНК, так и «гибридные». Этот факт позволил исключить гипотезу дисперсного механизма репликации.
Слайд 25: Препаративные центрифуги
Центрифуги общего назначения 8000 об./мин ОЦУ до 6000 g. Скоростные центрифуги 25 000 об/мин ОЦУ до 89 000 g Препаративные ультрацентрифуги 75 000 об./мин ОЦУ до 510 000 g
Слайд 26: Центрифуги общего назначения
Угловые роторы и роторы с подвесными стаканами УРАВНОВЕШИВАНИЕ И СИММЕТРИЯ!
Слайд 27: Скоростные центрифуги
Роторы обоих типов, но! Обязательно охлаждение Броня Гибкая подвеска ротора Автоматика
Слайд 28: Ультрацентрифуги
Угловые роторы Обязательно охлаждение Вакуум Броня Гибкая или струнная подвес-ка ротора Автоматика
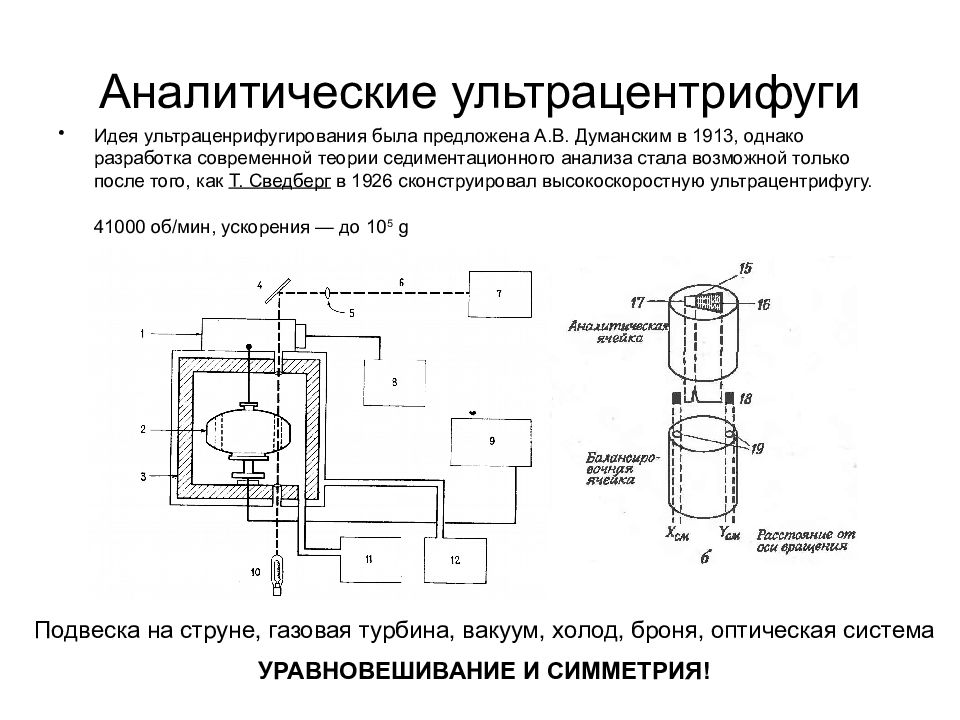
Слайд 29: Аналитические ультрацентрифуги
Идея ультраценрифугирования была предложена А.В. Думанским в 1913, однако разработка современной теории седиментационного анализа стала возможной только после того, как Т. Сведберг в 1926 сконструировал высокоскоростную ультрацентрифугу. 41000 об/мин, ускорения — до 10 5 g Подвеска на струне, газовая турбина, вакуум, холод, броня, оптическая система УРАВНОВЕШИВАНИЕ И СИММЕТРИЯ!
Слайд 30: Определение молекулярных весов
По скорости седиментации Метод седиментационного равновесия Метод приближения к седиментацион-ному равновесию
Слайд 31: По скорости седиментации
Константа седиментации это скорость, отнесенная к еди¬нице ускорения, имеет размерность времени (ее выражают в секундах). Величина константы седиментации, равная 1•10 –13 с, условно принята за единицу и названа сведбергом (S). Значения констант седиментации большинства белков лежат в пределах 1–50 S, хотя в ряде случаев эти значения превышают 100 S. Молекулярный вес молекул определяют по уравнению Сведберга М — молекулярный вес молекулы, R — газовая постоянная, Т — абсолютная температура, s — коэффициент седиментации молекулы, D — коэффициент диффузии молекулы, v — парциальный удельный объем, который можно рассматривать как объем, занимаемый одним граммом растворенного вещества, р — плотность растворителя.
Слайд 32: Метод седиментационного равновесия
Ультрацентрифугирование проводят вплоть до достижения частицами равновесия, устанавливающегося под действием центробежных сил, с одной стороны, и диффузионных — с другой, т. е. до тех пор, пока частицы не перестанут перемещаться. Затем по образовавшемуся градиенту концентрации рассчитывают молекулярный вес вещества 'согласно формуле R — газовая постоянная, Т — абсолютная температура, ю — угловая скорость, р — плотность растворителя, v — парциальный удельный объем, сх и с2— концентрация растворенного вещества на расстояниях гг и г2 от оси вращения Недостатком данного метода является то, что для достижения седиментациоиного равновесия необходимо длительное время — от нескольких дней до нескольких недель при непрерывной работе центрифуги.
Слайд 33: Метод приближения к седиментационному равновесию
Этот метод был разработан для того, чтобы избавиться от недостатков предыдущего метода, связанных с большими затратами времени, необходимого для установления равновесия. С помощью него можно определять молекулярные веса, когда центрифугируемый раствор находится в состоянии приближения к равновесию. Вначале макромолекулы распределяются по всему объему аналитической ячейки равномерно; затем по мере центрифугирования молекулы оседают, и плотность раствора в области мениска постепенно уменьшается. Изменение плотности тщательно регистрируют, а затем путем сложных расчетов, включающих большое число переменных, определяют молекулярный вес данного соединения по формулам.
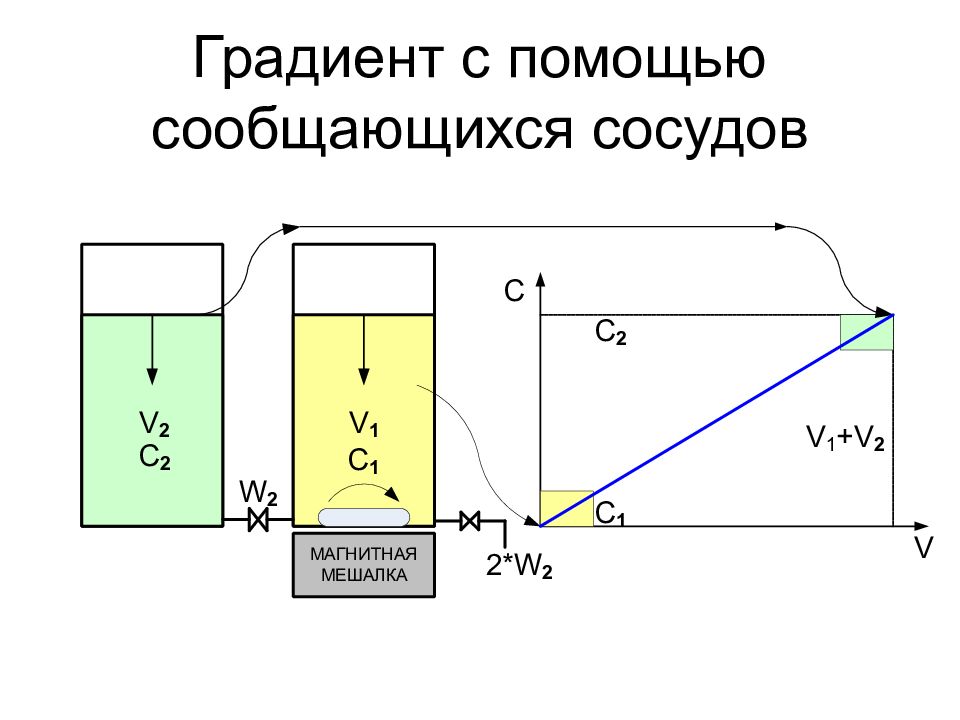
Слайд 34: Методы формирования градиента
Ступенчатый градиент Сообщающиеся сосуды Перистальтический насос Системы формирования градиента
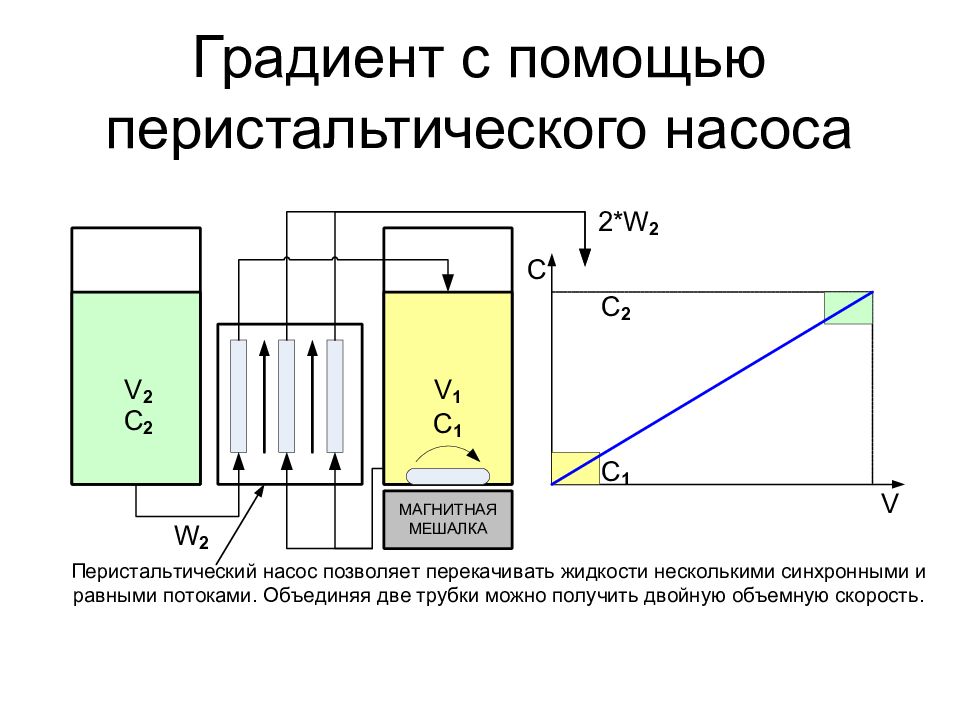
Слайд 37: Перистальтический насос
Насос для перекачки жидкостей, текущих по гибким трубкам. Принцип действия основан на том, что ролики передавливают трубку с жидкостью, и двигаясь вдоль трубки, проталкивают жидкость вперёд. Обычно состоит из гибкой трубки, нескольких роликов, и поверхности (трека), к которой ролики прижимают трубку
Слайд 38: Перистальтические насосы - достоинства
Среда и насос не взаимодействуют Агрессивная среда Чувствительные объекты Точность и неизменность дозирования ± 0,5 % Отсутствие пульсаций Широкий диапазон скоростей – зависит от трубки Параллельная перекачка Простота конструкции
Слайд 39: Перистальтические насосы - недостатки
Низкое рабочее давление Иногда трудно подобрать материал трубок
Слайд 41: Как извлечь продукты разделения?
Центрифужную пробирку прокалывают у основания и в нижнюю ее часть медленно вводят очень плотную среду, например 60—70%-ный раствор сахарозы (весовые %). Находящийся сверху раствор вытесняется, и фракции отбирают при помощи шприца, пипетки или специального приспособления, соединенного через трубочку с коллектором фракций. Если пробирки изготовлены из целлулоида или нитроцеллю-лозы, фракции извлекают, надрезав пробирку специальным лезвием. Для этого центрифужную пробирку, закрепленную в штативе, надрезают непосредственно под нужной зоной и отсасывают фракцию шприцом или пипеткой. Сбор фракций осуществляют также, проколов основание пробирки тонкой полой иглой. Капли, вытекающие из пробирки через иглу, собирают в коллектор фракций для дальнейшего анализа.
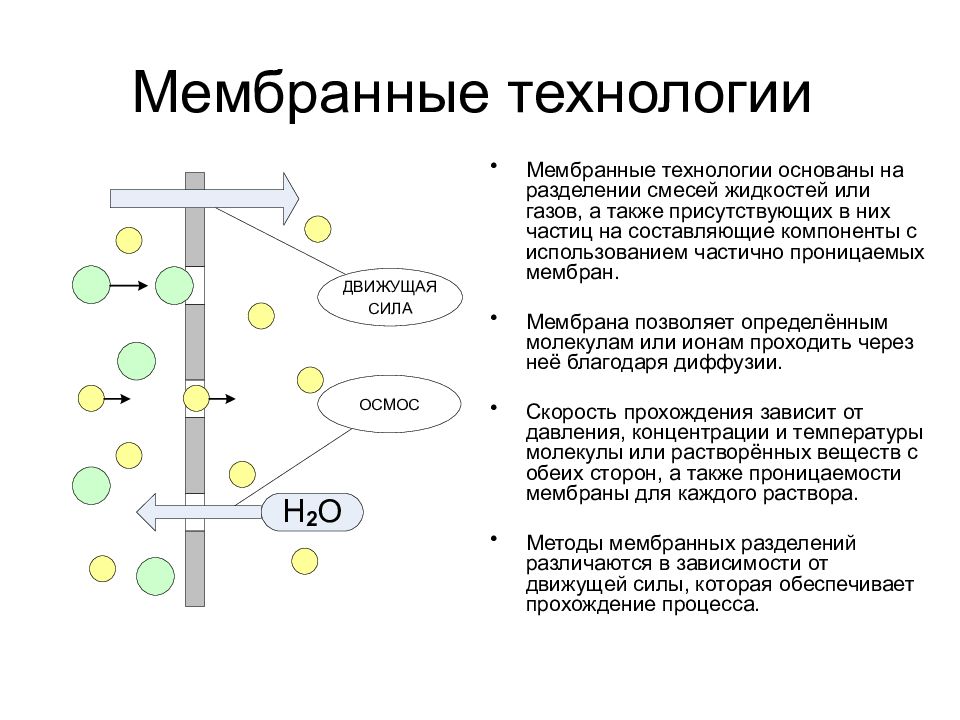
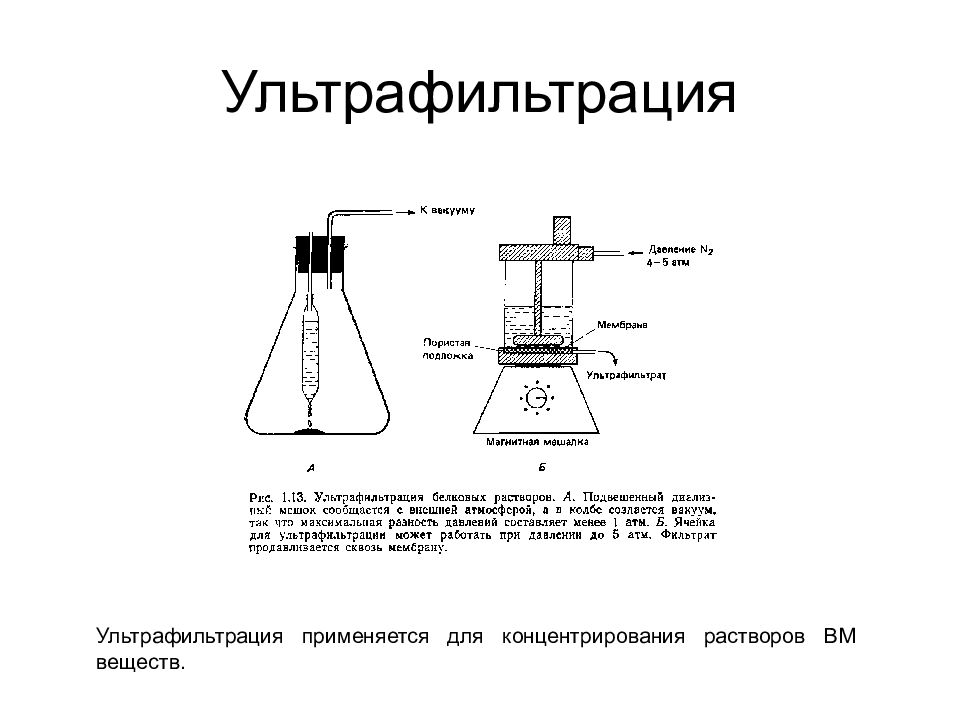
Слайд 42: Мембранные технологии
Мембранные технологии основаны на разделении смесей жидкостей или газов, а также присутствующих в них частиц на составляющие компоненты с использованием частично проницаемых мембран. Мембрана позволяет определённым молекулам или ионам проходить через неё благодаря диффузии. Скорость прохождения зависит от давления, концентрации и температуры молекулы или растворённых веществ с обеих сторон, а также проницаемости мембраны для каждого раствора. Методы мембранных разделений различаются в зависимости от движущей силы, которая обеспечивает прохождение процесса.
Слайд 43: Мембранные технологии
Градиент химических потенциалов = > ДИАЛИЗ Электрическое поле = > ЭЛЕКТРОДИАЛИЗ Градиент давлений = > УЛЬТРАФИЛЬТРАЦИЯ Градиент давлений = > ОБРАТНЫЙ ОСМОС
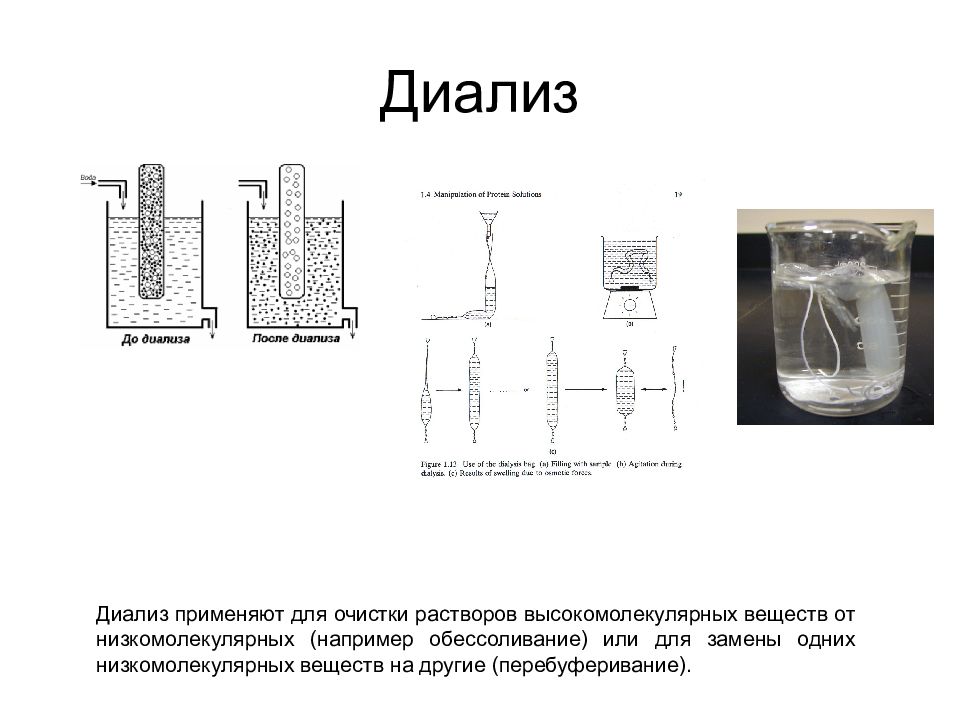
Слайд 44: Диализ
Диализ применяют для очистки растворов высокомолекулярных веществ от низкомолекулярных (например обессоливание) или для замены одних низкомолекулярных веществ на другие (перебуферивание).
Слайд 45: Электродиализ
Электродиализ применяют для обессоливания. Например, для опреснения морской воды.