Первый слайд презентации: Сульфаниламиды
IV курс осенний семестр 4.09.2012 Сульфаниламиды
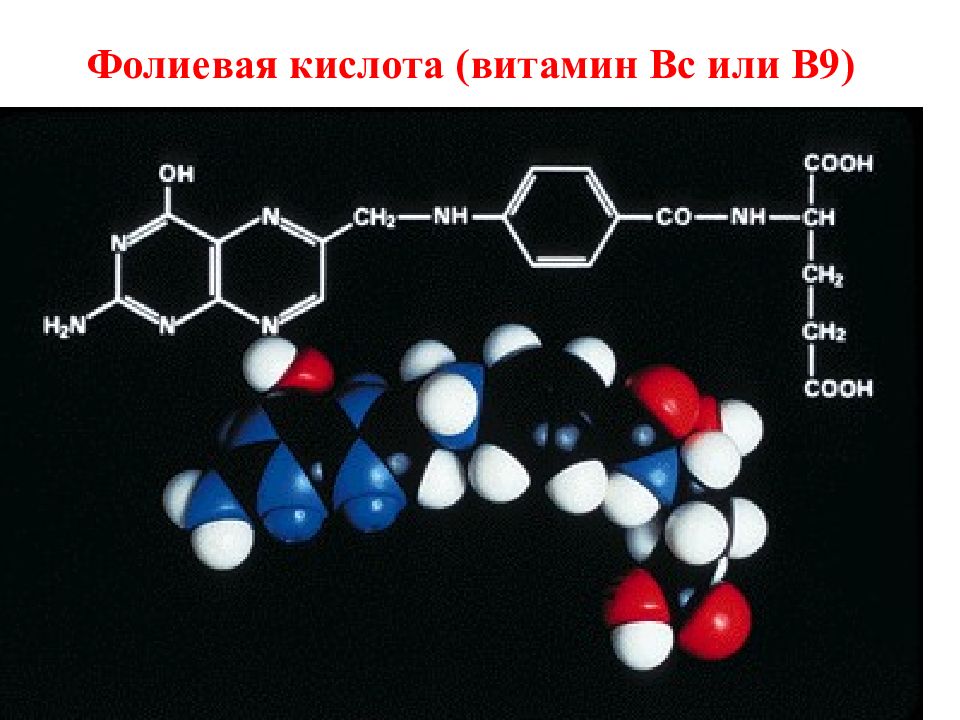
Слайд 2: Месалазин (Mesalazine). 5-Аминосалициловая кислота
По структуре близок к п-амино-салициловой кислоте ( ПАСК ). Отличается положением NH 2 -группы. Противотуберкулезной активностью не обладает, применяется для лечения неспецифического язвенного колита и болезни Крона. Является составной частью молекул салазосульфапиридина и его аналогов, также применяемых при язвенном колите и болезни Крона. Подобно другим салицилатам, месалазин является ингибитором синтеза простагландинов и обладает противовоспалительной активностью. Возможно, что это играет определённую роль в его специфическом действии. В организме месалазин метаболизируется, образуя N-ацетил-5-аминосалициловую кислоту. Назначают месалазин внутрь в виде таблеток по 0,4 г (400 мг) 3—6 раз в день. При применении препарата возможны тошнота, диарея, боли в области желудка. Месалазин можно применять при недостаточной эффективности и плохой переносимости салазосульфапиридина (сульфасалазина). Месалазин усиливает сахаропонижающее действие сульфаниламидов, эффекты кумаринов, метотрексата, спиронолактона, сульфинпиразона, фуросемида, рифампицина. Усиливает ульцерогенное влияние глюкокортикоидов на слизистую оболочку желудка. Беременным назначают только по жизненным показаниям. Не следует назначать кормящим матерям и детям.
Слайд 3: 1. Перечень программных ЛС
Антибактериальные ЛС - Сульфацил-натрий, Бисептол, Сульфадиметоксин, Сульфален Фталазол, Салазопиридазин. Диуретики - Фуросемид, Гидрохлоротиазид (Дихлотиазид, Гипотиазид), Буметанид (Буфенокс). Противодиабетические ЛС - Карбутамид, Глибенкламид, Глипизид, Гликвидон, Гликлазидан. Бигуаниды: метформин. Антисептики – Хлорамин, Пантоцид. 1. Перечень программных ЛС
Раздел 12. Противомикробные, противопазитарные и противоглистные средства 12.2. Антисептики и дезинфицирующие средства ( Галазон/Пантоцид ) 12.8. Синтетические антибактериальные средства 12.8.1. Сульфаниламиды
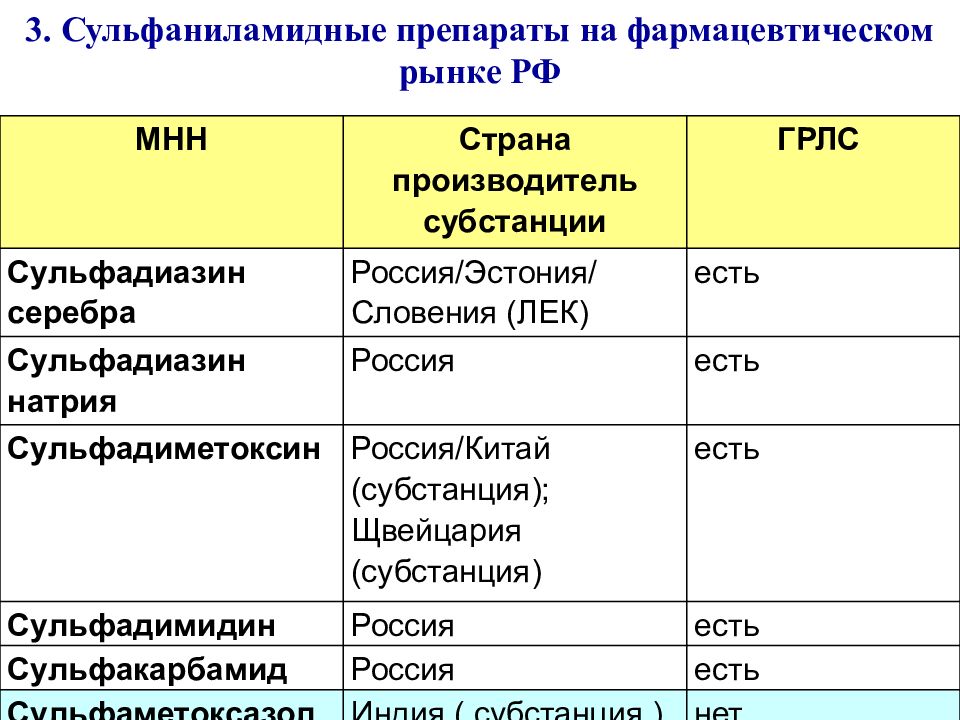
МНН Страна производитель субстанции ГРЛС Сульфадиазин серебра Россия/Эстония/Словения (ЛЕК) есть Сульфадиазин натрия Россия есть Сульфадиметоксин Россия/Китай (субстанция); Щвейцария (субстанция) есть Сульфадимидин Россия есть Сульфакарбамид Россия есть Сульфаметоксазол Индия ( субстанция ) нет
Слайд 6
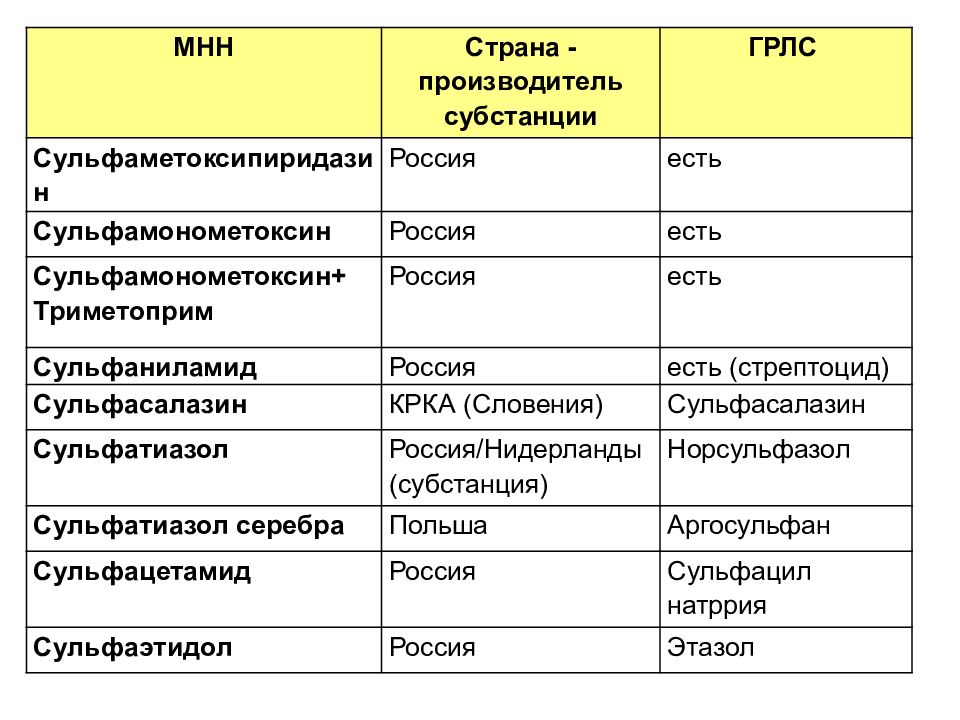
МНН Страна - производитель субстанции ГРЛС Сульфаметоксипиридазин Россия есть Сульфамонометоксин Россия есть Сульфамонометоксин+ Триметоприм Россия есть Сульфаниламид Россия есть (стрептоцид) Сульфасалазин КРКА (Словения) Сульфасалазин Сульфатиазол Россия/Нидерланды (субстанция) Норсульфазол Сульфатиазол серебра Польша Аргосульфан Сульфацетамид Россия Сульфацил натррия Сульфаэтидол Россия Этазол
По данным 2010 года сульфаниламиды составляют 0,16% от общего рынка ЛС в России в денежном выражении в натуральном (упаковки ) - 0,85%
Слайд 8
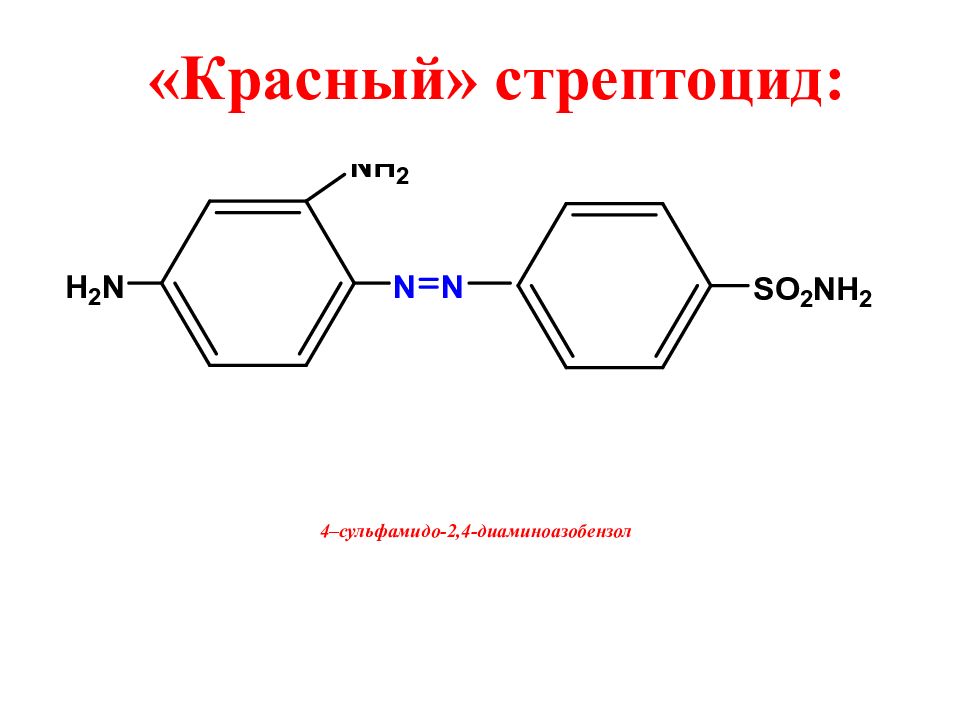
1935 год - немецкий (венгерский) ученый Генрих Домагк ( Нобелевский лауреат! ) в опытах на мышах, зараженных гемолитическим стрептококком, обнаружил химиотерапевтическое действие красителя пронтозила - «красного» стрептоцида Domagk, Gerhard, 1895-1964 4. История открытия
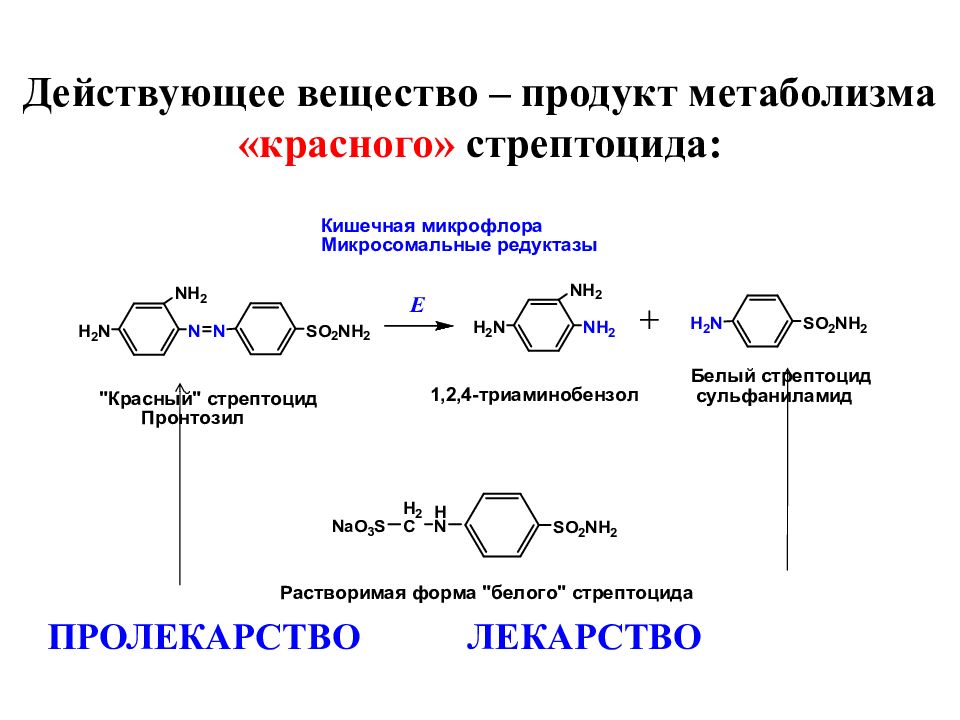
Слайд 10: Действующее вещество – продукт метаболизма «красного» стрептоцида:
ПРОЛЕКАРСТВО ЛЕКАРСТВО
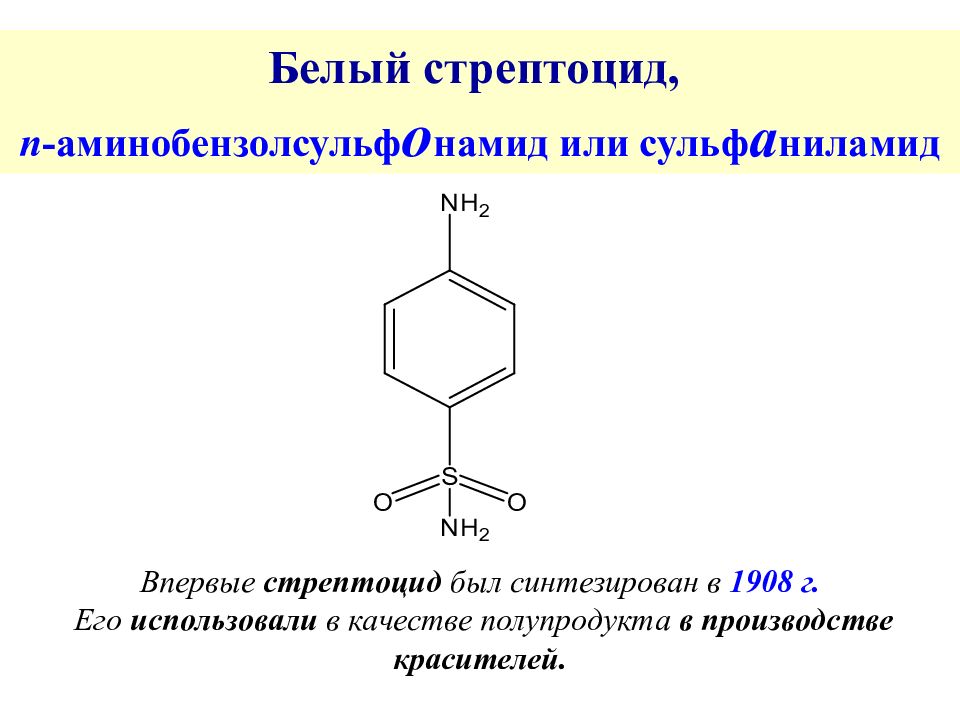
Слайд 11: Белый стрептоцид, n - аминобензолсульф о намид или сульф а ниламид
Впервые стрептоцид был синтезирован в 1908 г. Его использовали в качестве полупродукта в производстве красителей.
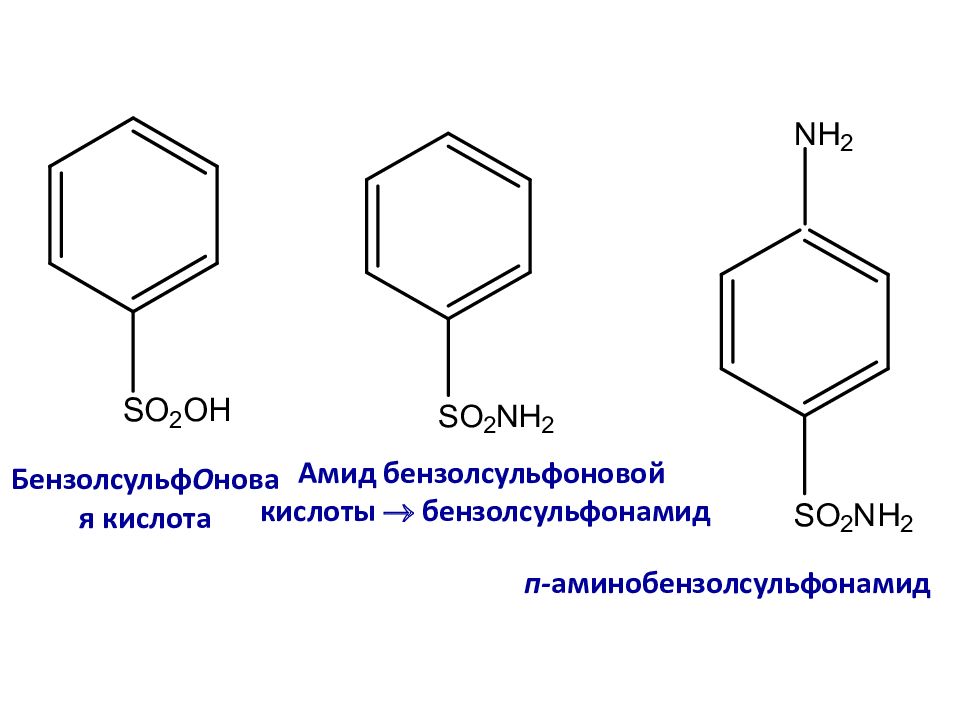
Слайд 13: Бензолсульф О новая кислота
Амид бензолсульфоновой кислоты бензолсульфонамид п- аминобензолсульфонамид
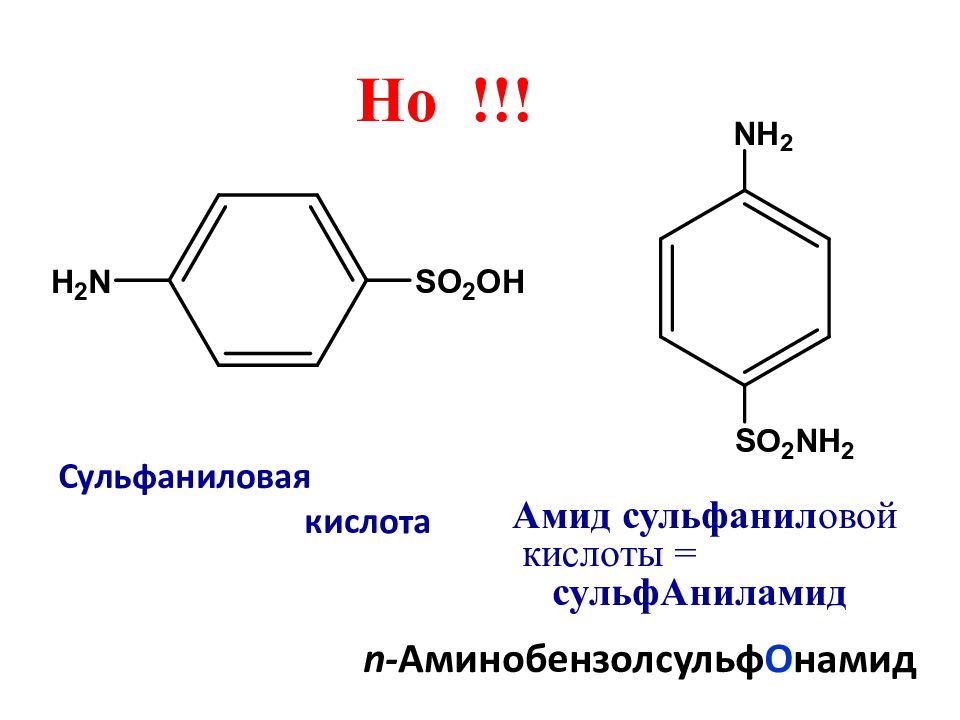
Слайд 14: Сульфаниловая кислота
Но !!! Амид сульфанил овой кислоты = сульфАниламид n- Аминобензолсульф О намид
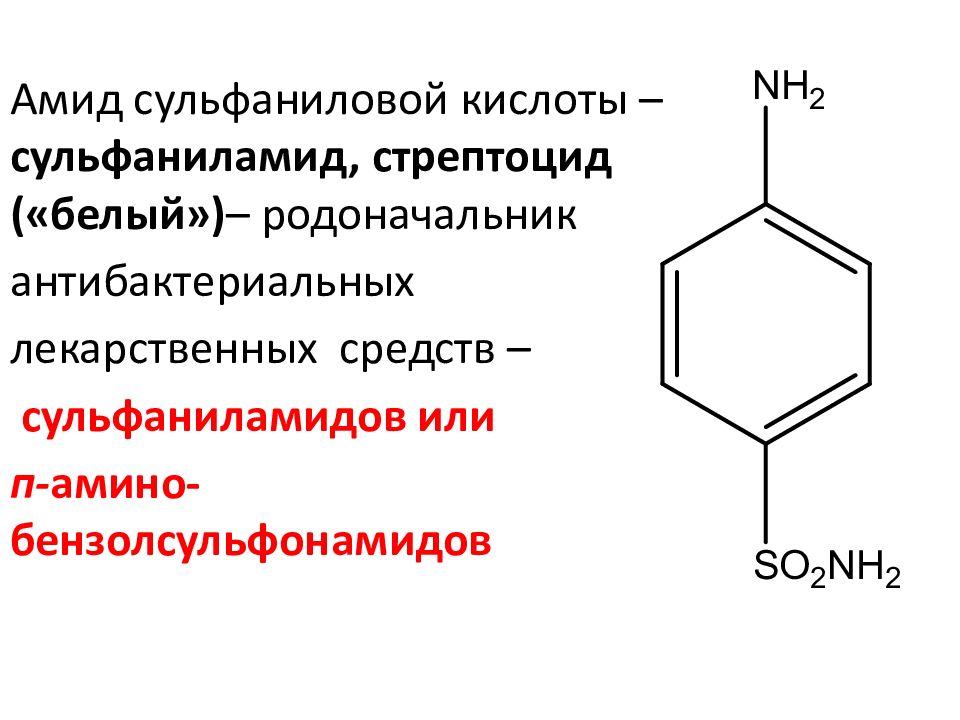
Слайд 15
Амид сульфаниловой кислоты – сульфаниламид, стрептоцид («белый») – родоначальник антибактериальных лекарственных средств – сульфаниламидов или п- амино-бензолсульфонамидов
Слайд 16: 5. Механизмы антибактериального действия сульфаниламидов
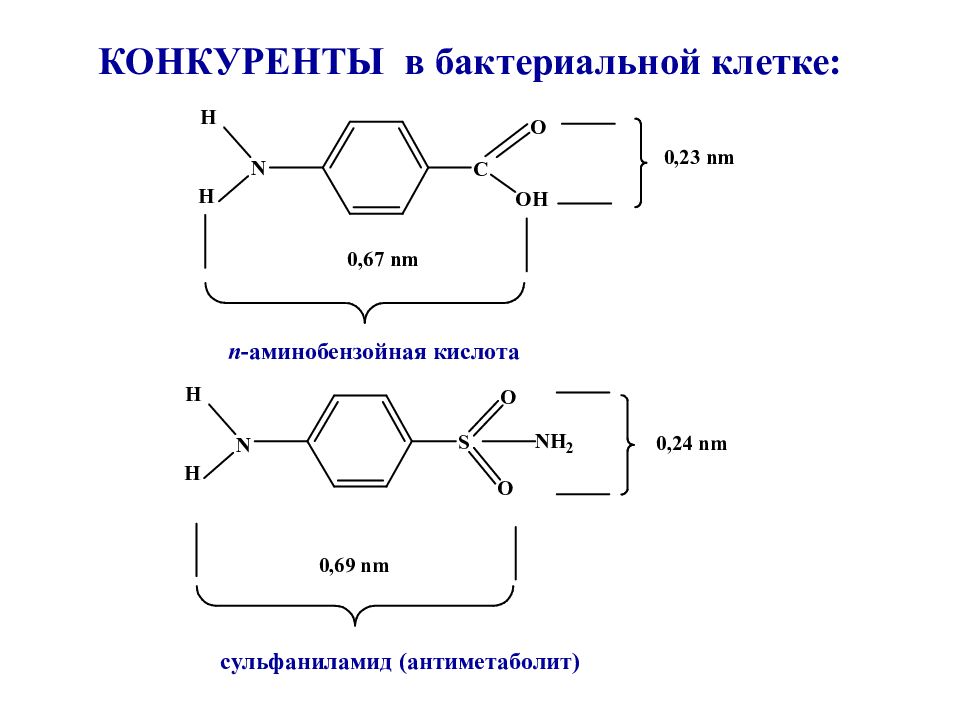
Сульфаниламиды являются антиметаболитами n -аминобензойной кислоты (ПАБК), участвующей в образовании фолиевой кислоты. Сульфаниламиды нарушают образование микроорганизмами необходимых для их роста и развития фолатов - ростовых факторов бактерий.
Слайд 18: КОНКУРЕНТЫ в бактериальной клетке:
n -аминобензойная кислота сульфаниламид (антиметаболит)
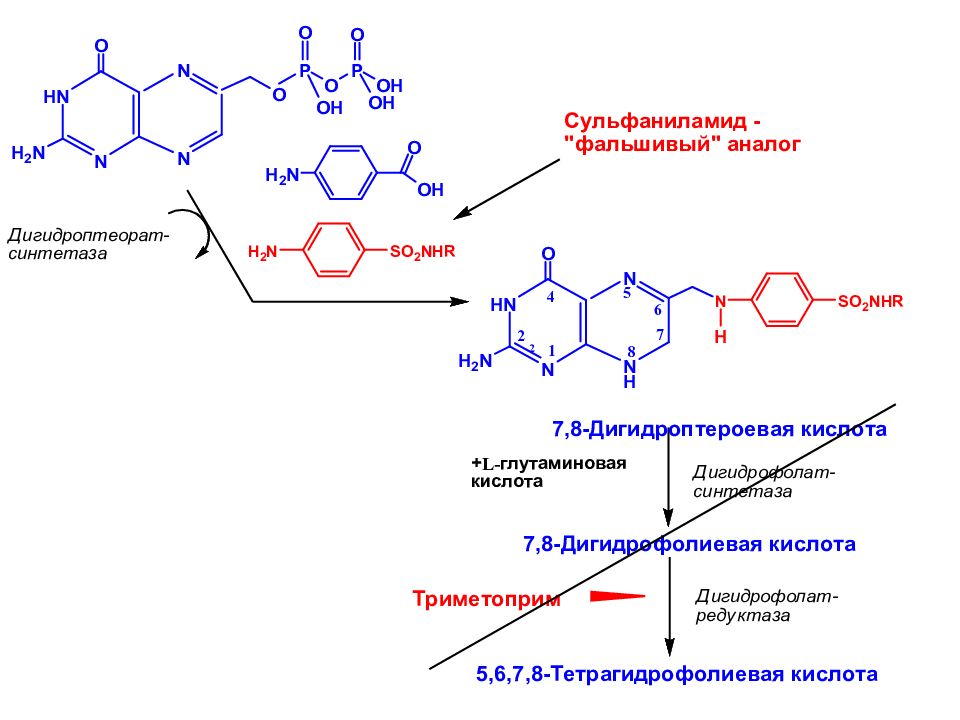
Слайд 20: Почему наблюдается бактериостатическое действие?
► Присоединение сульфаниламида к птерину блокирует синтез птероевой кислоты, и «фальшивый» метаболит не способен присоединить глутаминовую кислоту с образованием фолиевой кислоты. ► Нарушается синтез фолата - фактора роста бактерий (пневмококков, стрептококков и др.). Это приводит к нарушению синтеза пуринов и пиримидинов нуклеиновых кислот и клеточных белков бактерий.
Слайд 21: Важно!!! Избирательность антибактериального действия:
Сульфаниламиды не оказывают подобного действия на клетки человека, так как синтез фолиевой кислоты в организме человека не происходит. В организм человека фолиевая кислота поступает с пищей.
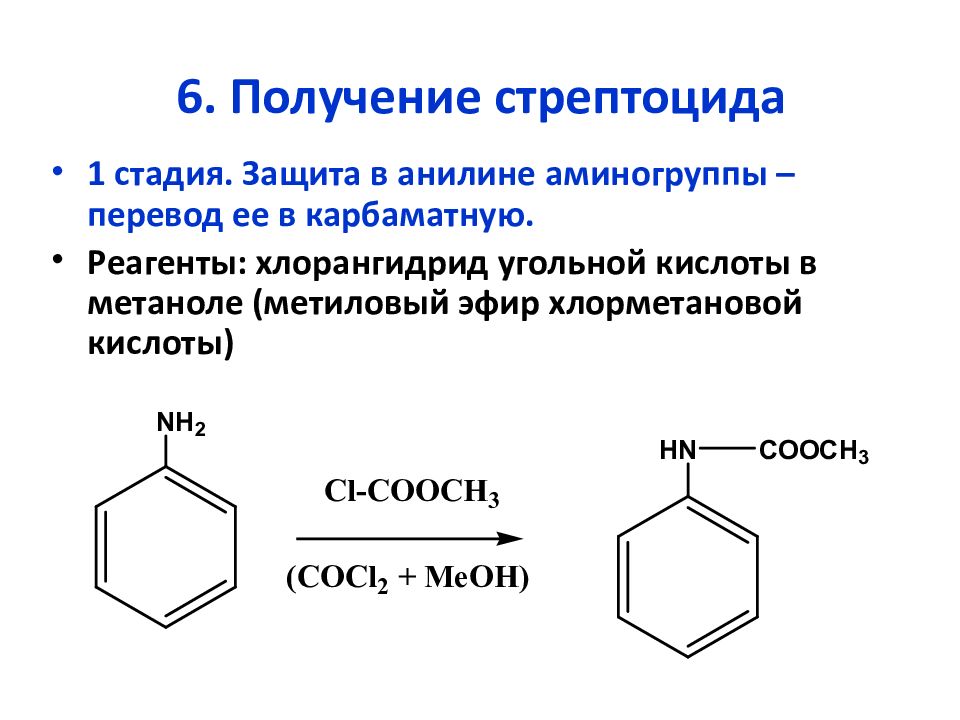
Слайд 22: 6. Получение стрептоцида
1 стадия. Защита в анилине аминогруппы – перевод ее в карбаматную. Реагенты: хлорангидрид угольной кислоты в метаноле (метиловый эфир хлорметановой кислоты)
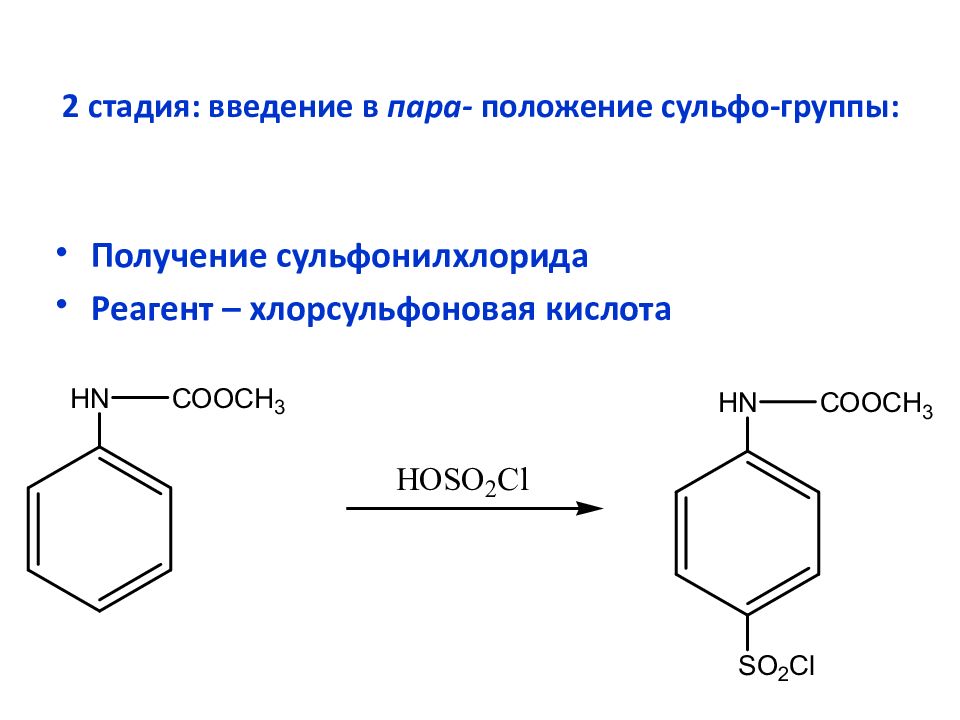
Слайд 23: 2 стадия: введение в пара- положение сульфо-группы :
Получение сульфонилхлорида Реагент – хлорсульфоновая кислота
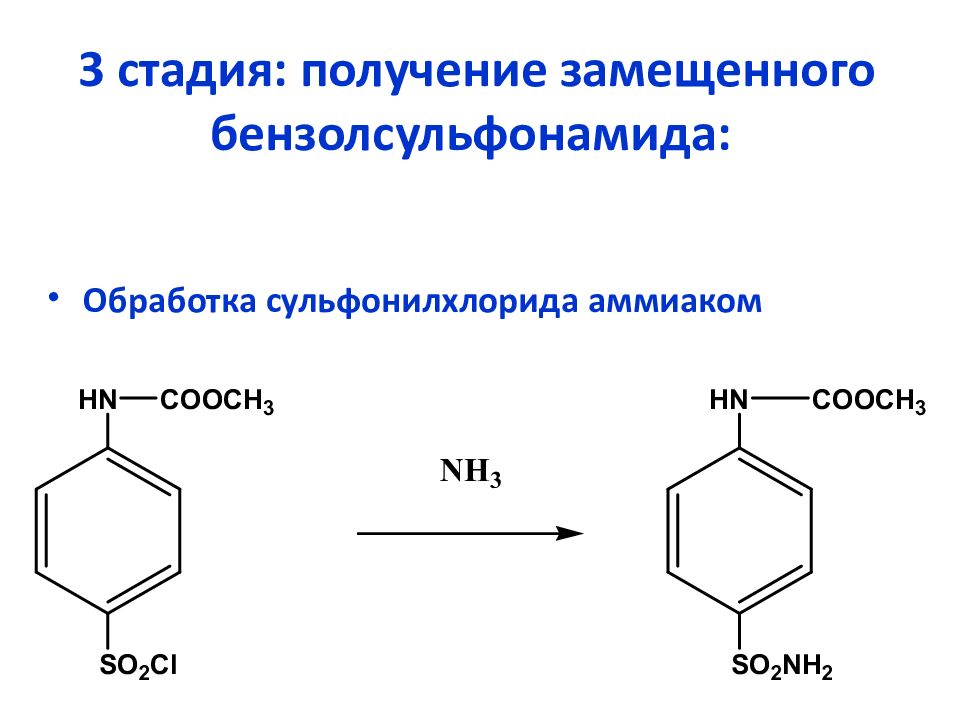
Слайд 24: 3 стадия: получение замещенного бензолсульфонамида:
Обработка сульфонилхлорида аммиаком
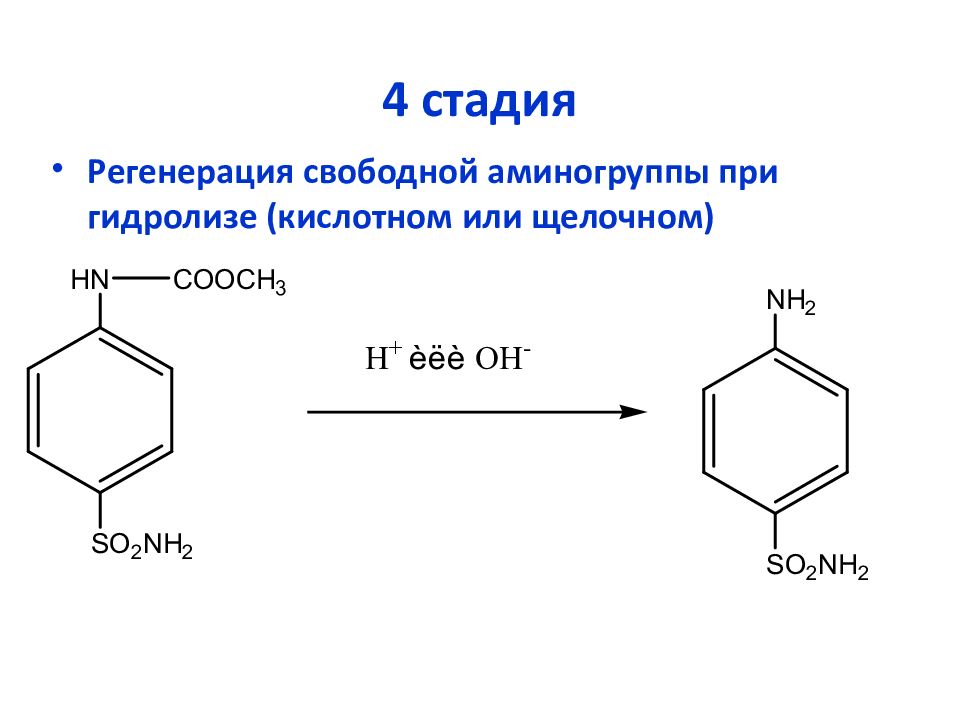
Слайд 25: 4 стадия
Регенерация свободной аминогруппы при гидролизе (кислотном или щелочном)
Слайд 26: 7. Разработка и создание ЛС группы бензолсульфонамидов
Во ВНИХФИ Всесоюзный научно-исследовательский химико-фармацевтический институт (Москва) и в его Свердловском (Екатеринбургском) филиале в поисках более эффективных антибактериальных средств было синтезировано более 80 соединений группы сульфаниламида. Всего известно несколько десятков тысяч производных сульфаниламида, но лишь около 30 из них нашли практическое применение в медицине.
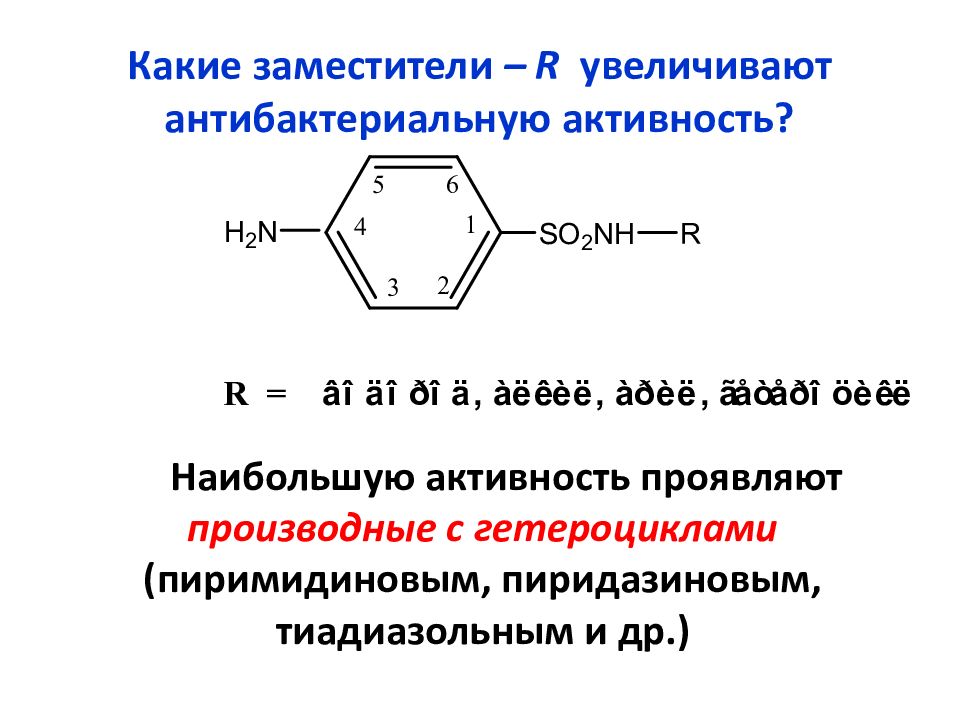
Слайд 27: Какие заместители – R увеличивают антибактериальную активность?
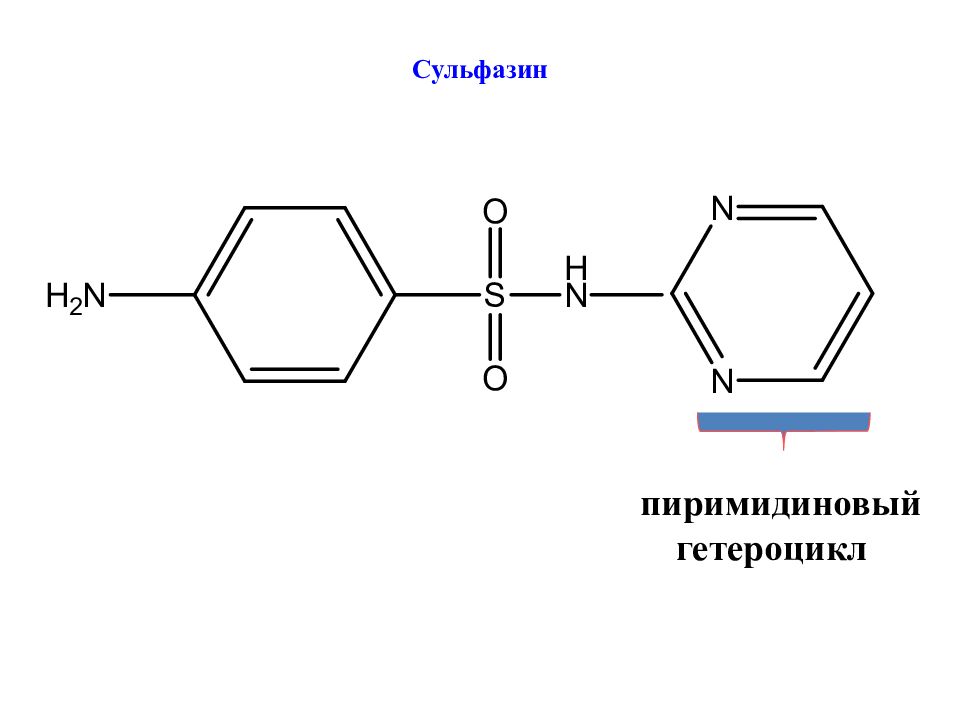
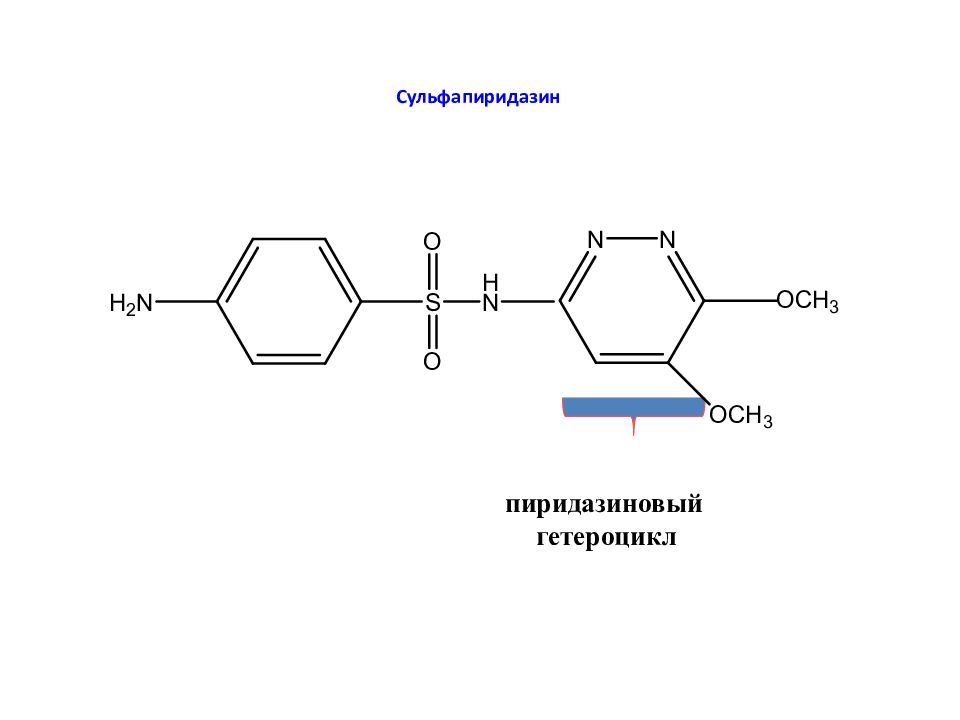
Наибольшую активность проявляют производные с гетероциклами (пиримидиновым, пиридазиновым, тиадиазольным и др.)
Слайд 30: Введение заместителей позволило:
1. Улучшить всасывание (проникновение в биожидкости, ткани- и органы-мишени, преодоление мембранных барьеров). 2. Изменить кинетику распределения ( k d, V d, CL). 3. Пролонгировать действие ЛС. 4. Конкретизировать мишени действия (ЖКТ, мочевые пути, глаза…).
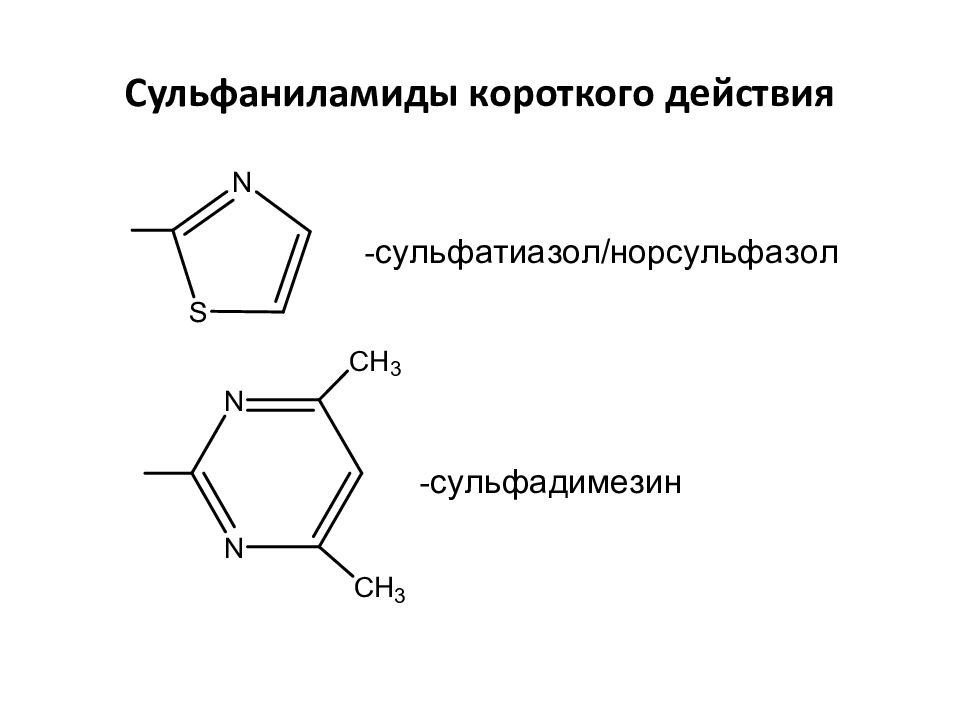
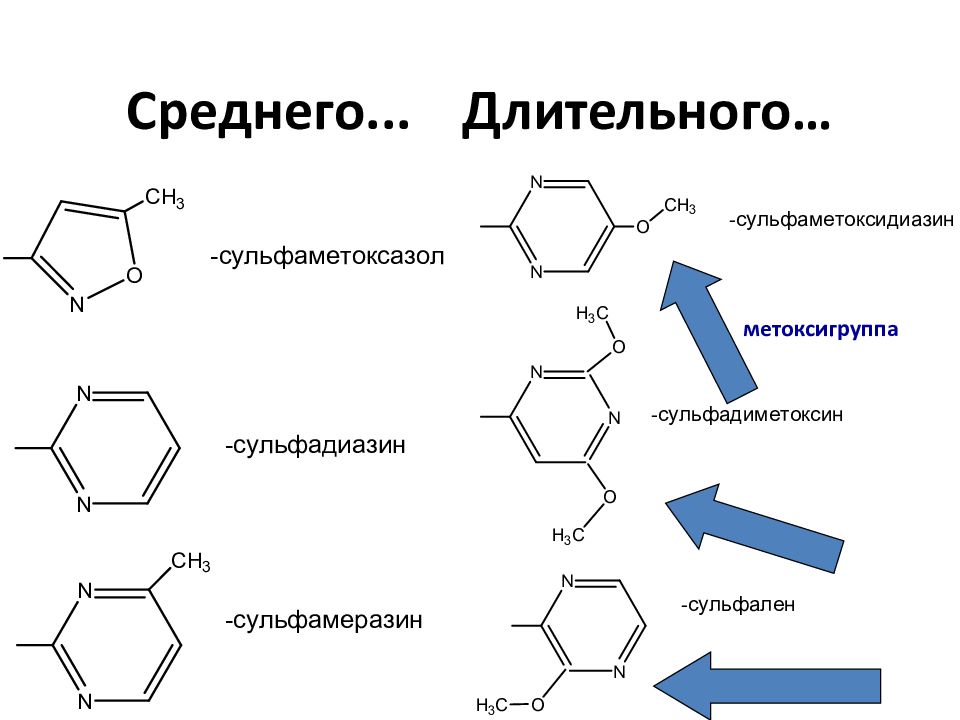
Слайд 31: Длительность действия и структура заместителя - R
Сульфаниламиды короткого (2-6 ч), среднего (10-24 ч), длительного (36-65 ч) действия
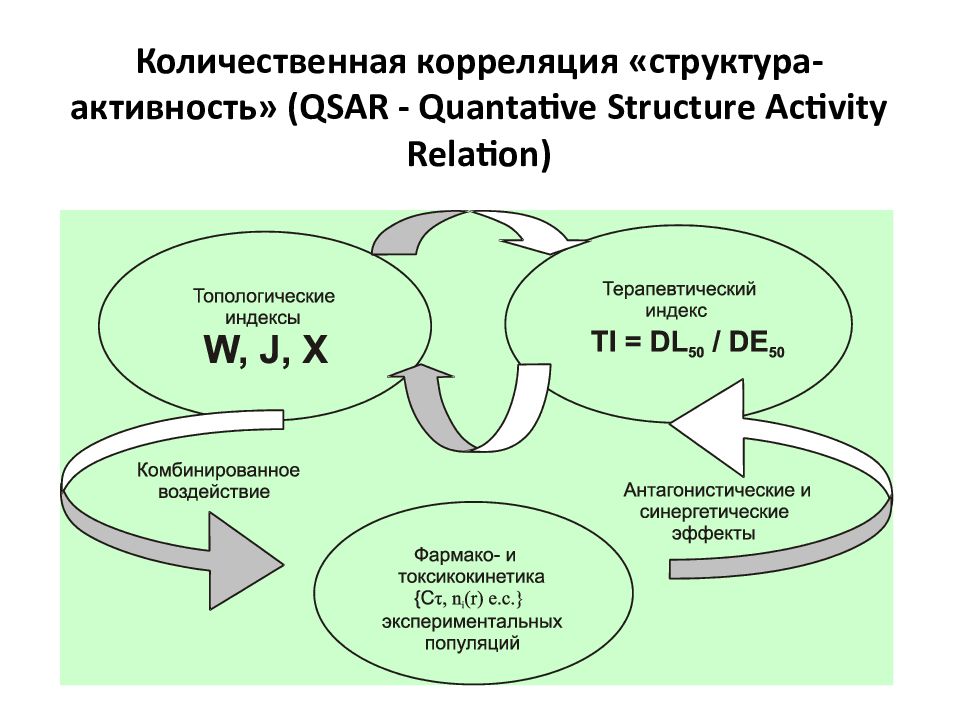
Слайд 34: Количественная корреляция «структура-активность» ( QSAR - Quantative Structure Activity Relation)
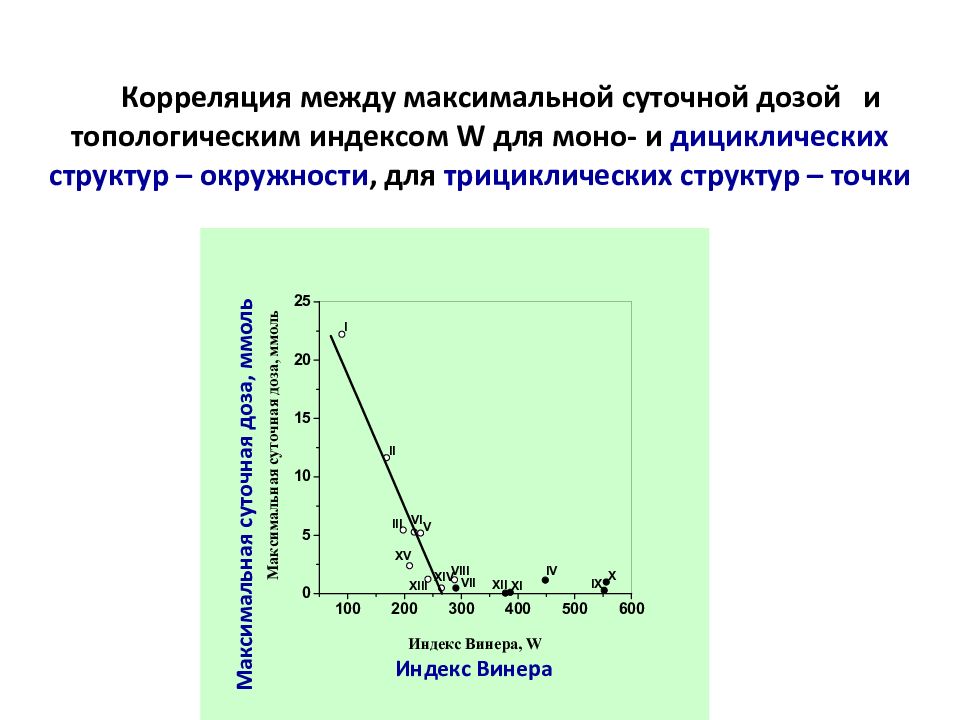
Слайд 35: Корреляция между максимальной суточной дозой и топологическим индексом W для моно- и дициклических структур – окружности, для трициклических структур – точки
Максимальная суточная доза, ммоль Индекс Винера
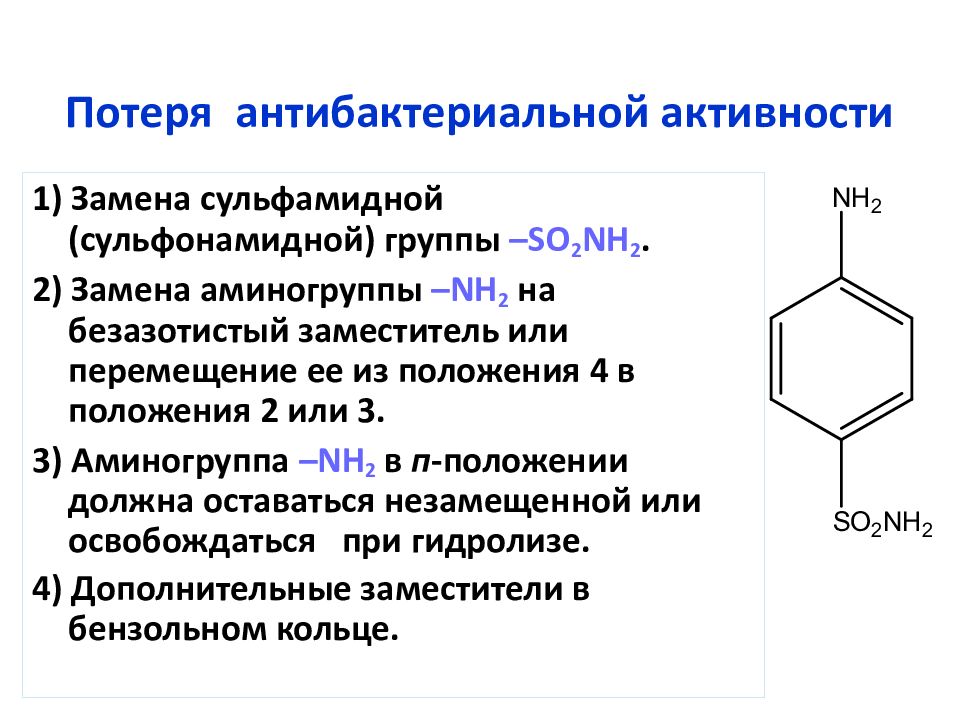
Слайд 36: Потеря антибактериальной активности
1) Замена сульфамидной ( сульфонамидной ) группы – SO 2 NH 2. 2) Замена аминогруппы –NH 2 на безазотистый заместитель или перемещение ее из положения 4 в положения 2 или 3. 3) Аминогруппа –NH 2 в п -положении должна оставаться незамещенной или освобождаться при гидролизе. 4) Дополнительные заместители в бензольном кольце.
Слайд 37: Нужны ли заместители в ароматической аминогруппе?
Антибактериальная активность сохраняется, если замещенные по аминогруппе соединения способны гидролизоваться с ее высвобождением. Нет смысла их вводить?!... Но: изменение растворимости, скорости всасывания и распределения…
Слайд 38: Программные ЛС группы бензолсульфонамидов – в ЕФ/ USP / JP
1.Антибактериальные средства ЛС с заместителем только по сульфаниламидной группе сульфацетамид-натрий (Сульфацил-натрий) сульфаметоксазол + триметоприм (ко-тримоксазол, Бисептол, Бактрим) сульфадиметоксин сульфален
Слайд 39: Сульфаниламиды (ПРОДОЛЖЕНИЕ)
IV курс осенний семестр 11.09.2012 Сульфаниламиды (ПРОДОЛЖЕНИЕ)
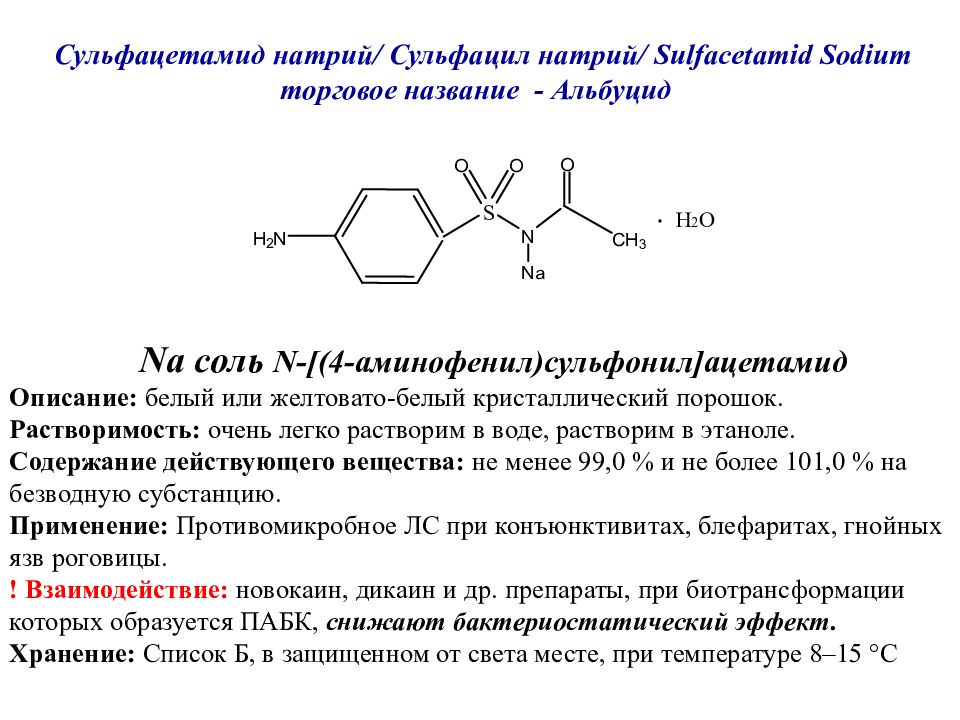
Слайд 40: Сульфацетамид натрий/ Сульфацил натрий / Sulfacetamid Sodium торговое название - Альбуцид
Na соль N-[ (4-аминофенил)сульфонил ] ацетамид Описание: белый или желтовато-белый кристаллический порошок. Растворимость: очень легко растворим в воде, растворим в этаноле. Содержание действующего вещества: не менее 99,0 % и не более 101,0 % на безводную субстанцию. Применение: Противомикробное ЛС при конъюнктивитах, блефаритах, гнойных язв роговицы. ! Взаимодействие: новокаин, дикаин и др. препараты, при биотрансформации которых образуется ПАБК, снижают бактериостатический эффект. Хранение: Список Б, в защищенном от света месте, при температуре 8–15 °C
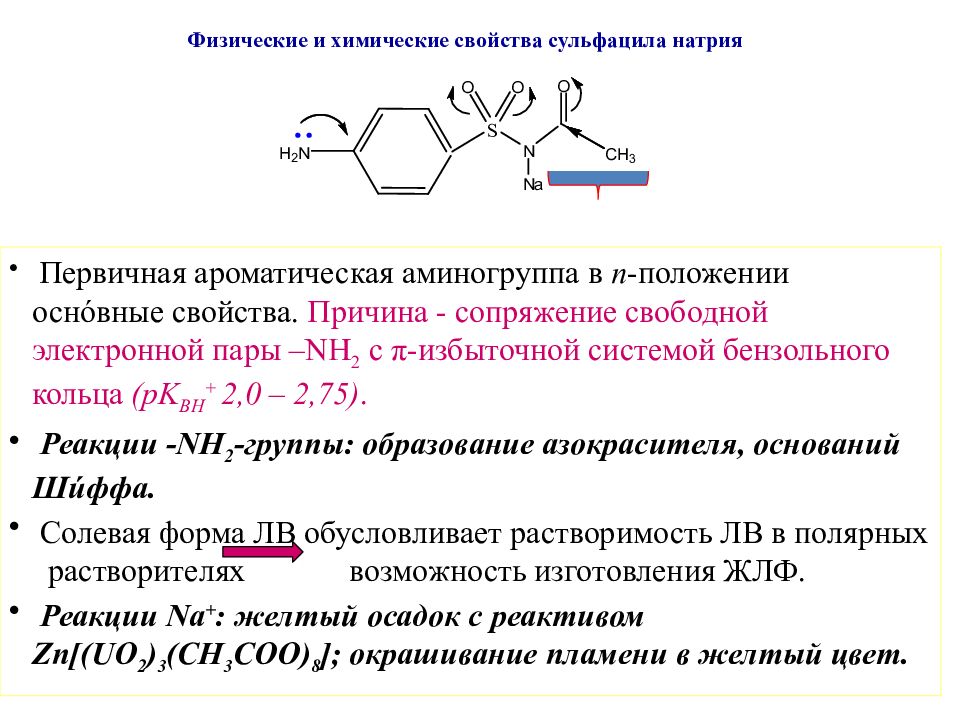
Слайд 41: Физические и химические свойства сульфацила натрия
Первичная ароматическая аминогруппа в п -положении осн ó вные свойства. Причина - сопряжение свободной электронной пары – NH 2 с π - избыточной системой бензольного кольца ( pK BH + 2,0 – 2,75). Реакции - NH 2 -группы: образование азокрасителя, оснований Ш ú ффа. Солевая форма ЛВ обусловливает растворимость ЛВ в полярных растворителях возможность изготовления ЖЛФ. Реакции Na + : желтый осадок с реактивом Zn[(UO 2 ) 3 (CH 3 COO) 8 ] ; окрашивание пламени в желтый цвет.
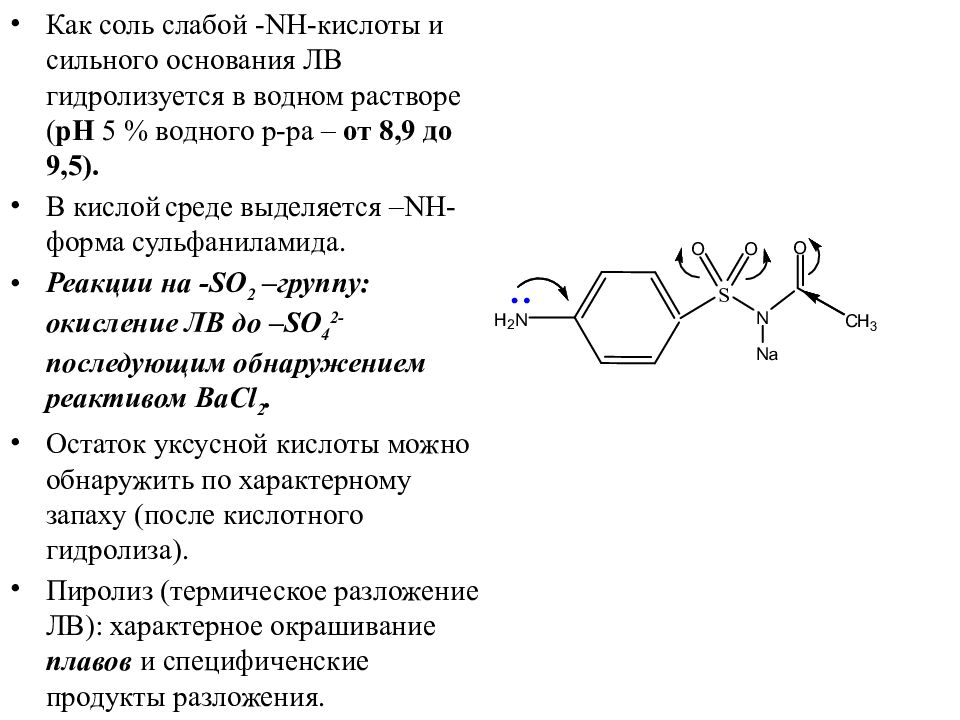
Слайд 42
Как соль слабой - NH- кислоты и сильного основания ЛВ гидролизуется в водном растворе ( рН 5 % водного р-ра – от 8,9 до 9,5). В кислой среде выделяется – NH - форма сульфаниламида. Реакции на - SO 2 – группу: окисление ЛВ до – SO 4 2- последующим обнаружением реактивом BaCl 2. Остаток уксусной кислоты можно обнаружить по характерному запаху (после кислотного гидролиза). Пиролиз (термическое разложение ЛВ): характерное окрашивание плавов и специфиченские продукты разложения.
Слайд 43: Идентификация (Р h.Eur. )
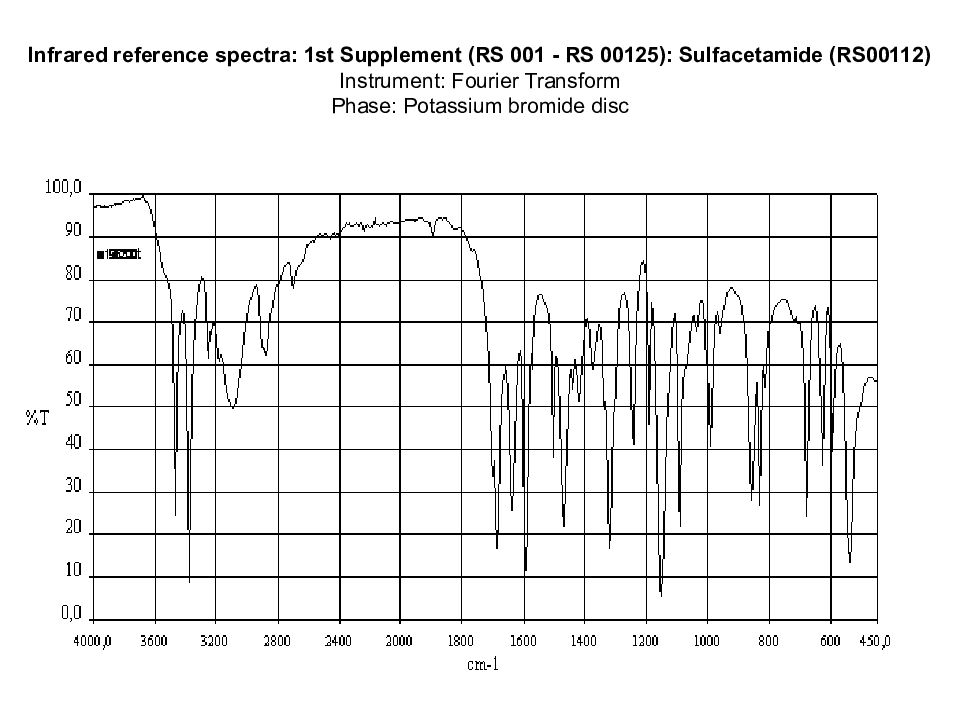
First identification : B, F. Second identification : A,C, D, E, F. А. УФ-спектрометрия 0,001 % раствора в фосфатном буфере (рН 7,0): А max при 255 нм; E 1см 1% от 660 до 720. В. ИК-спектроскопия: проводят сравнение спектра испытуемого образца со спектром сульфацетамид натрия – стандарта ( CRS ). С. Растворить ЛВ в воде, добавить CH 3 COOH разв., смесь отфильтровать. Осадок, промытый небольшим количеством воды и высушенный при Т 100 0 С – 105 0 С, имеет Тпл от 181 0 С до 185 0 С.
Слайд 45
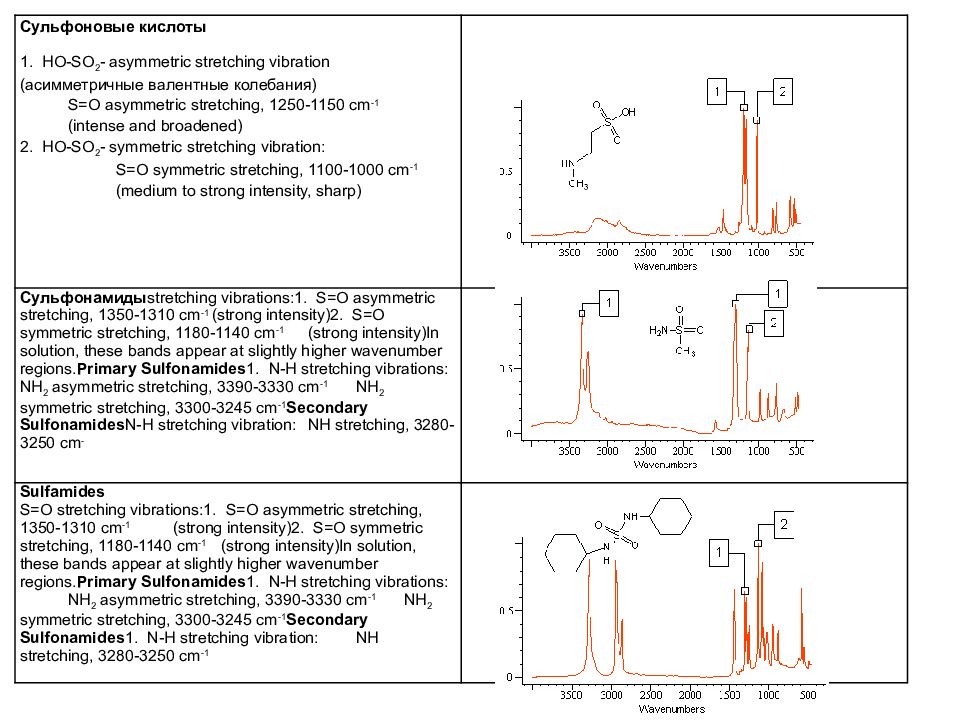
Сульфоновые кислоты 1. HO-SO 2 - asymmetric stretching vibration ( асимметричные валентные колебания ) S=O asymmetric stretching, 1250-1150 cm -1 (intense and broadened) 2. HO-SO 2 - symmetric stretching vibration: S=O symmetric stretching, 1100-1000 cm -1 (medium to strong intensity, sharp) Сульфонамиды stretching vibrations:1. S=O asymmetric stretching, 1350-1310 cm -1 (strong intensity)2. S=O symmetric stretching, 1180-1140 cm -1 (strong intensity)In solution, these bands appear at slightly higher wavenumber regions. Primary Sulfonamides 1. N-H stretching vibrations: NH 2 asymmetric stretching, 3390-3330 cm -1 NH 2 symmetric stretching, 3300-3245 cm -1 Secondary Sulfonamides N-H stretching vibration: NH stretching, 3280-3250 cm - Sulfamides S=O stretching vibrations:1. S=O asymmetric stretching, 1350-1310 cm -1 (strong intensity)2. S=O symmetric stretching, 1180-1140 cm -1 (strong intensity)In solution, these bands appear at slightly higher wavenumber regions. Primary Sulfonamides 1. N-H stretching vibrations: NH 2 asymmetric stretching, 3390-3330 cm -1 NH 2 symmetric stretching, 3300-3245 cm -1 Secondary Sulfonamides 1. N-H stretching vibration: NH stretching, 3280-3250 cm -1
Слайд 46: Infrared reference spectra: 1st Supplement (RS 001 - RS 00125): Sulfacetamide (RS00112) Instrument: Fourier Transform Phase: Potassium bromide disc
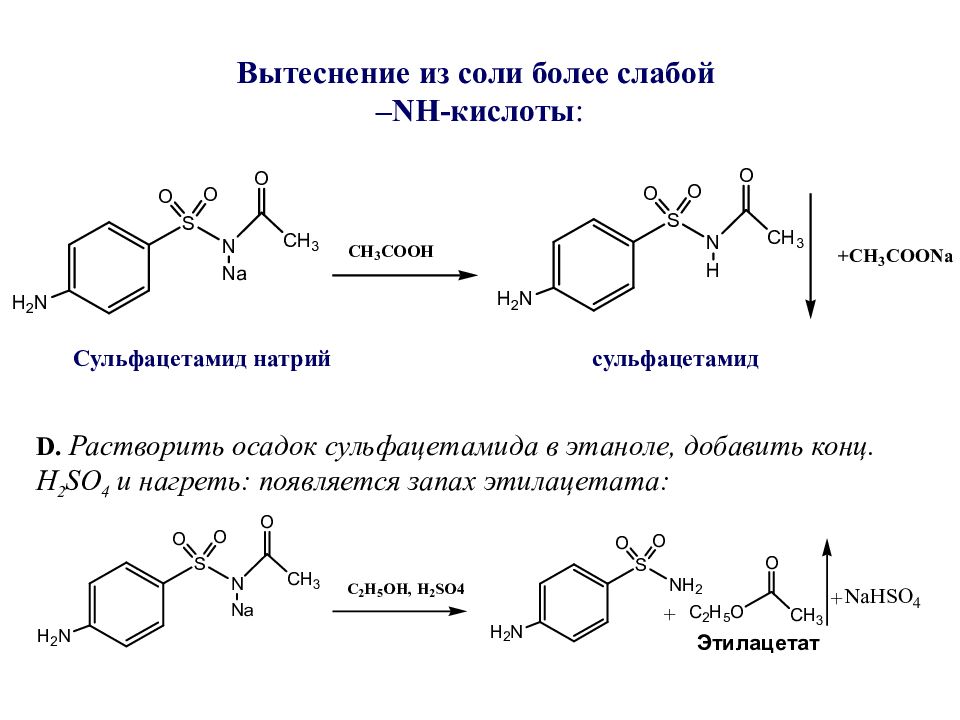
Слайд 47: Вытеснение из соли более слабой – NH -кислоты :
Сульфацетамид натрий сульфацетамид D. Растворить осадок сульфацетамида в этаноле, добавить конц. H 2 SO 4 и нагреть: появляется запах этилацетата:
Последний слайд презентации: Сульфаниламиды
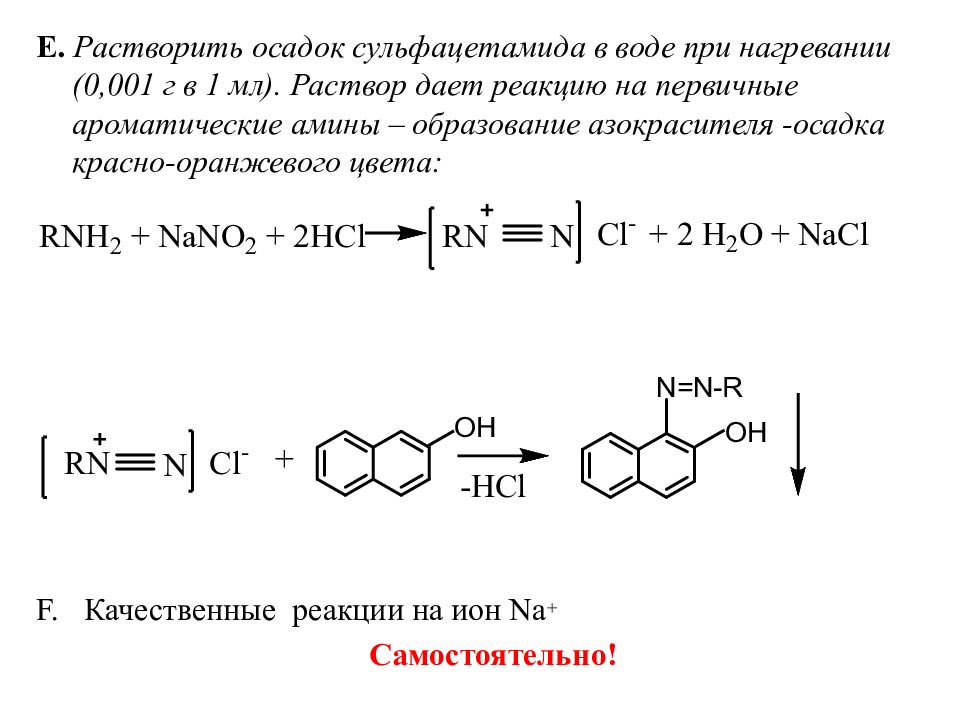
Е. Растворить осадок сульфацетамида в воде при нагревании (0,001 г в 1 мл). Раствор дает реакцию на первичные ароматические амины – образование азокрасителя -осадка красно-оранжевого цвета: Качественные реакции на ион Na + Самостоятельно!