Слайд 2
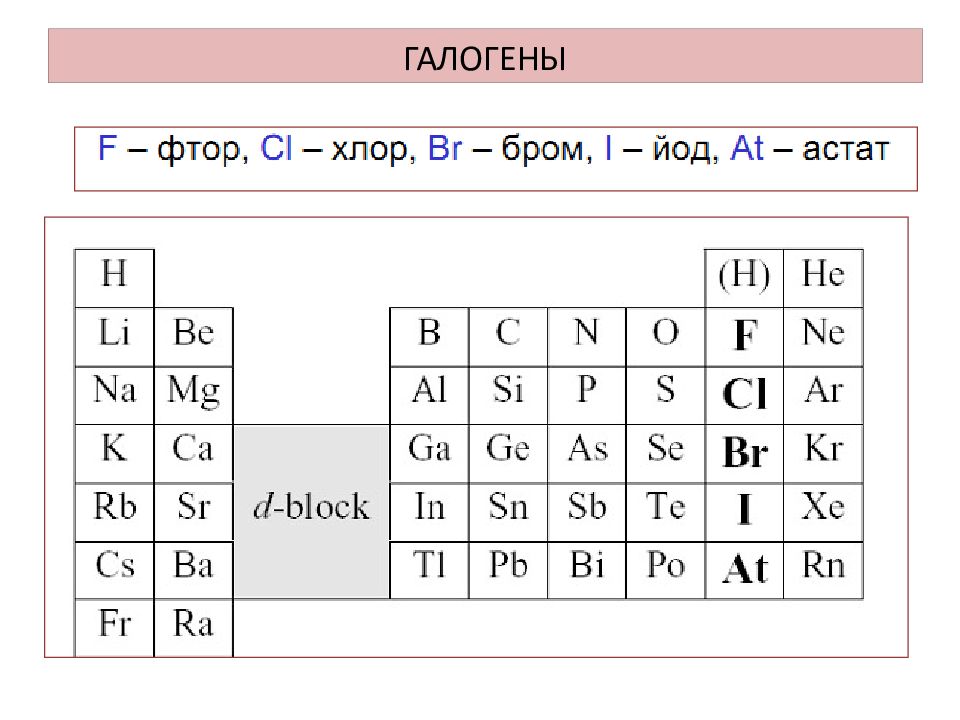
К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат At Общее название - галогены ( греч. «солеобразующие» ) - большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).
Слайд 6
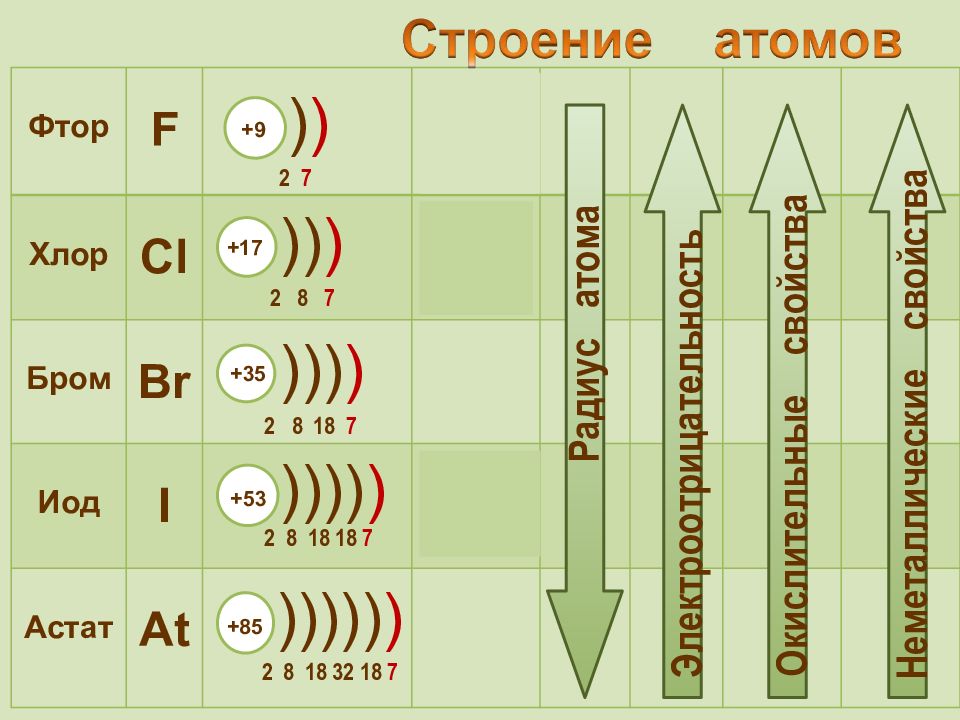
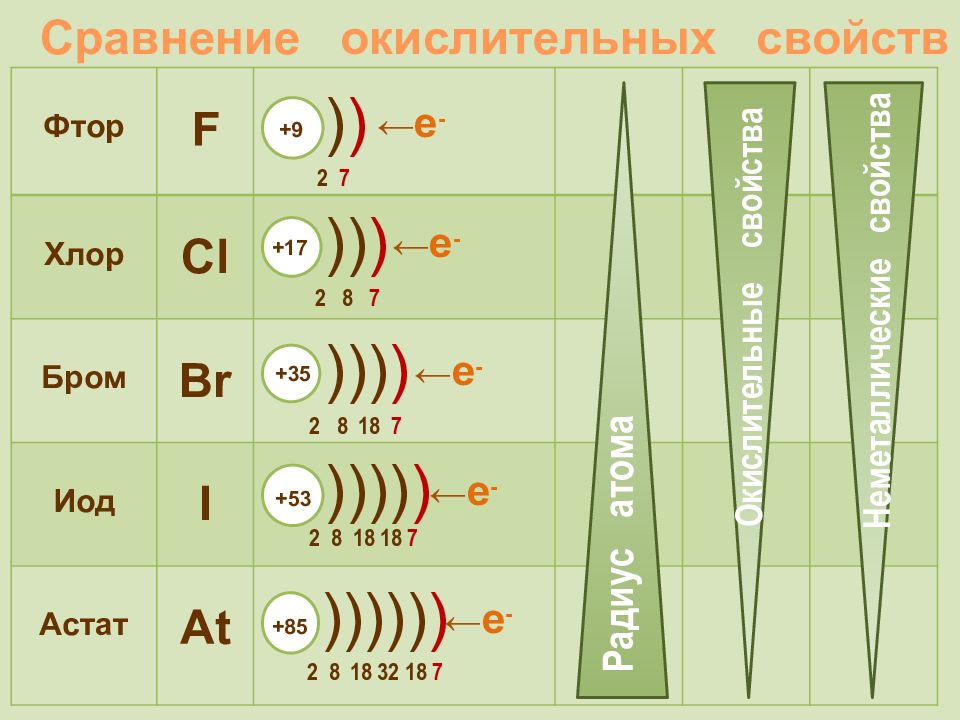
Фтор F 2 s 2 2р 5 Хлор Cl 3 s 2 3 p 5 Бром Br 4 s 2 4 p 5 Иод I 5 s 2 5 p 5 Астат At 6 s 2 6 p 5 + 9 2 7 ) ) +85 2 8 18 32 18 7 ))))) ) +17 2 8 7 )) ) +35 2 8 18 7 ))) ) +53 2 8 18 18 7 )))) ) Радиус атома Электроотрицательность Окислительные свойства Неметаллические свойства
Слайд 7
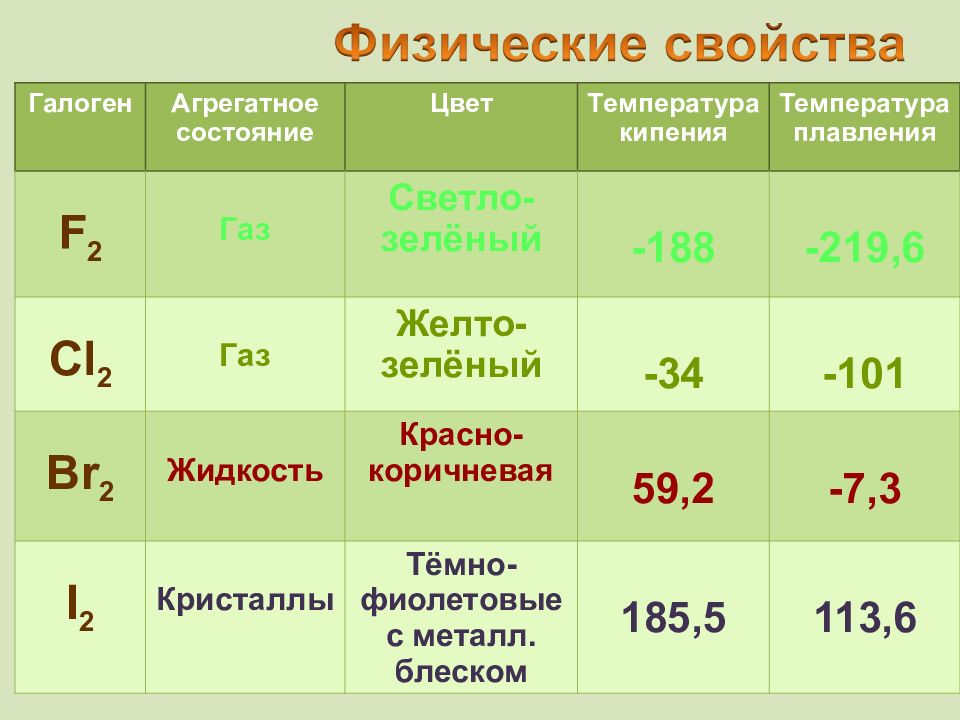
Галоген Агрегатное состояние Цвет T емпература кипения Температура плавления F 2 Газ Светло-зелёный -188 -219,6 Cl 2 Газ Желто-зелёный -34 -101 Br 2 Жидкость Красно-коричневая 59,2 -7,3 I 2 Кристаллы Тёмно-фиолетовые с металл. блеском 185,5 113,6
Слайд 8
Молекулы галогенов состоят из двух атомов. Cl + Cl → Cl Cl Связь – ковалентная неполярная
Слайд 9
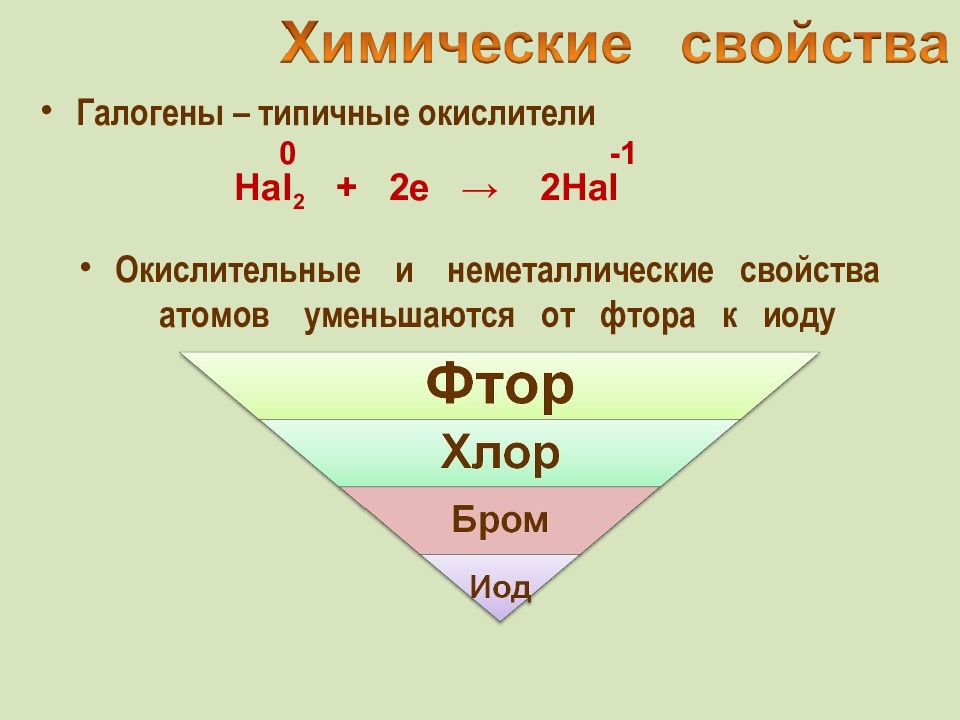
Галогены – типичные окислители Hal 2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются от фтора к иоду 0
Слайд 10: Сравнение окислительных свойств
Фтор F Хлор Cl Бром Br Иод I Астат At Сравнение окислительных свойств + 9 2 7 ) ) +85 2 8 18 32 18 7 ))))) ) +17 2 8 7 )) ) +35 2 8 18 7 ))) ) +53 2 8 18 18 7 )))) ) Окислительные свойства Неметаллические свойства Радиус атома ← е - ← е - ← е - ← е - ← е -
Слайд 11
1. Взаимодействие с металлами Хлор непосредственно реагирует почти со всеми металлами (с некоторыми только в присутствии влаги или при нагревании): 2. Взаимодействие с неметаллами C неметаллами (кроме углерода, азота, кислорода и инертных газов), образует соответствующие хлориды. 2Na + Cl 2 → 2NaCl 2Fe + 3Cl 2 → 2FeCl 3 -1 -1 Cl 2 + H 2 → 2HCl 5Cl 2 + 2P → 2PCl 5 -1 -1
Слайд 12
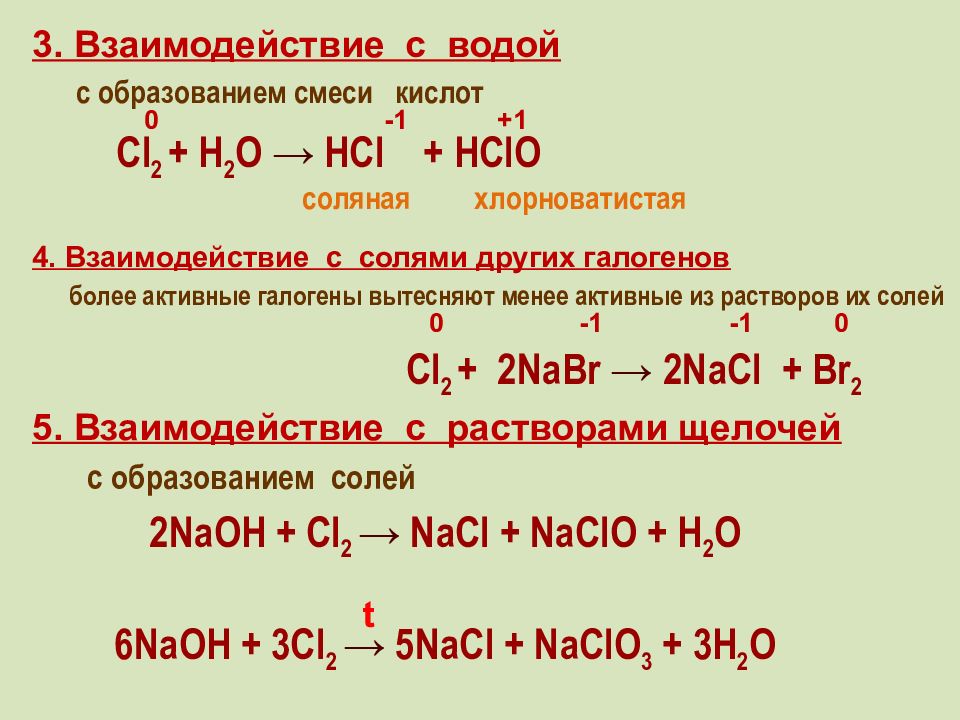
3. Взаимодействие с водой с образованием смеси кислот Cl 2 + H 2 О → HCl + HClO -1 0 + 1 хлорноватистая соляная 4. Взаимодействие с солями других галогенов более активные галогены вытесняют менее активные из растворов их солей Cl 2 + 2 Na Br → 2NaCl + Br 2 -1 -1 0 0 5. Взаимодействие с растворами щелочей с образованием солей 2NaOH + Cl 2 → NaCl + NaClO + H 2 O 6 NaOH + 3 Cl 2 → 5 NaCl + NaClO 3 + 3 H 2 O t
Слайд 13
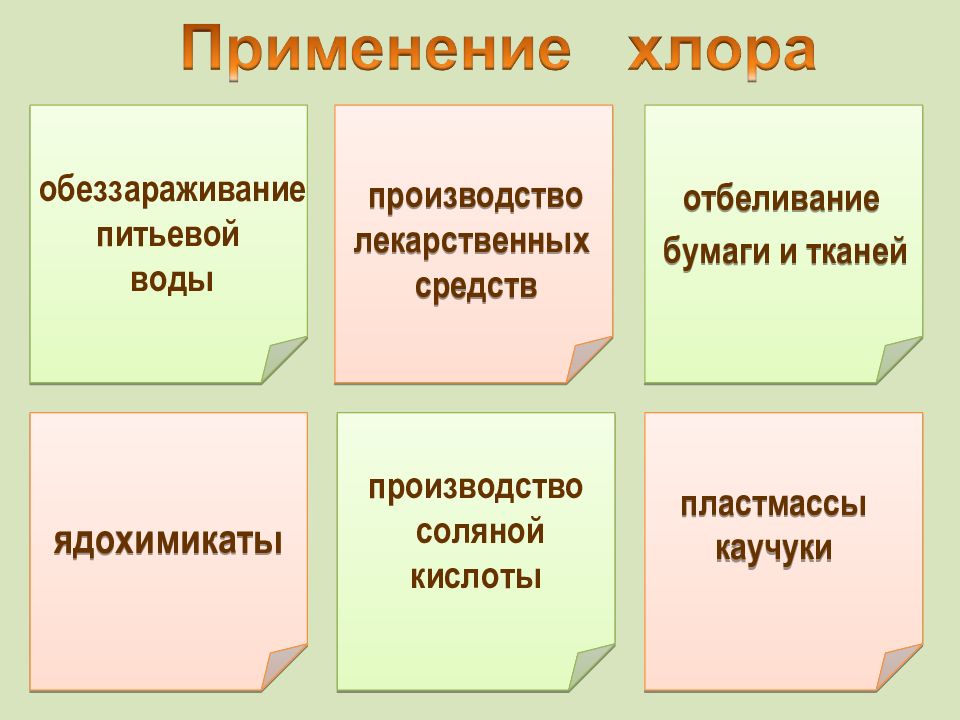
ядохимикаты обеззараживание питьевой воды отбеливание бумаги и тканей производство соляной кислоты производство лекарственных средств пластмассы каучуки
Слайд 14
- 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения - В рентгенологических и томографических исследованиях применяются йодсодержащие контрастные препараты - Галоге́нная ла́мпа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода) - Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах В технике В медицине