Первый слайд презентации
«Общая характеристика галогенов на основе положения химических элементов в периодической системе »
Слайд 2
К элементам VII группы, главной подгруппы относятся фтор F, хлор Cl, бром Br, иод I, астат At Общее название - галогены ( греч. «солеобразующие» ) - большинство их соединений с металлами представляют собой типичные соли (KCl, NaCl и т.д.).
Слайд 7
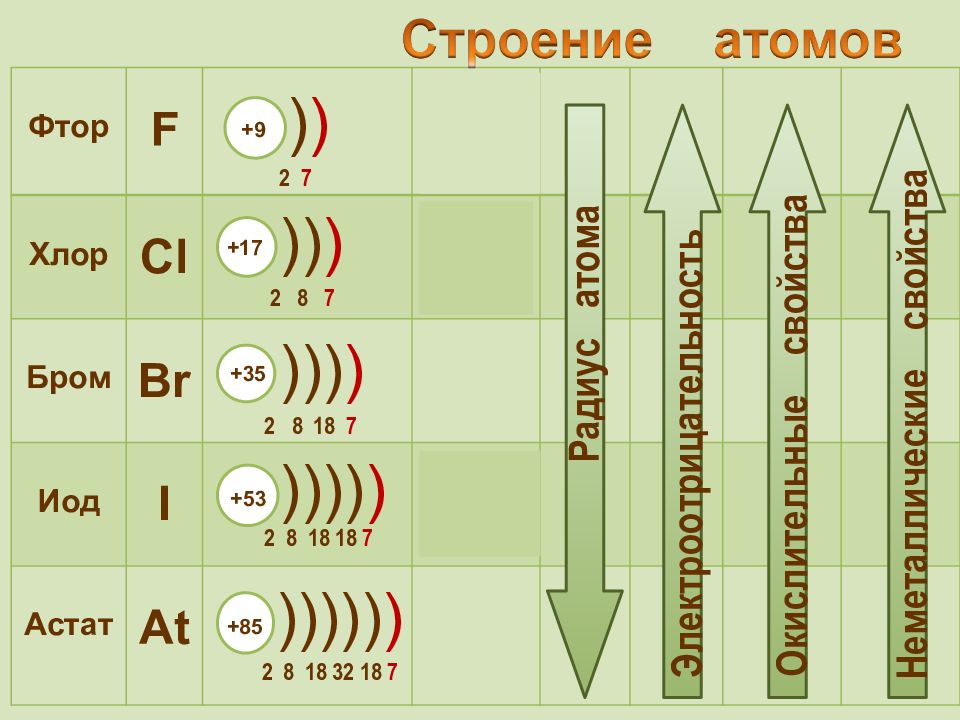
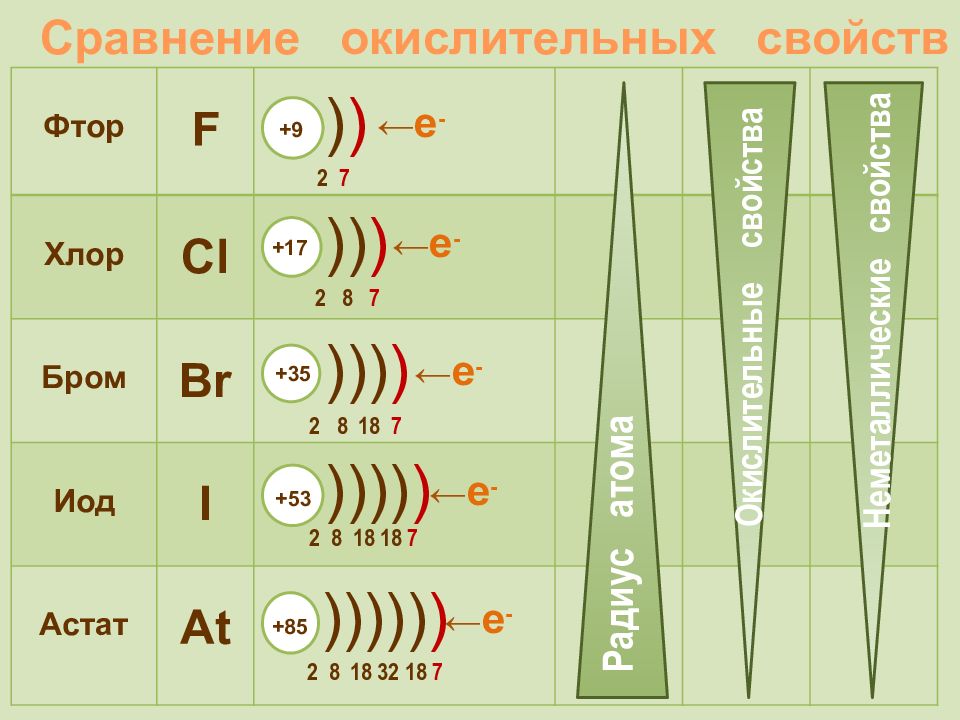
Фтор F 2 s 2 2р 5 Хлор Cl 3 s 2 3 p 5 Бром Br 4 s 2 4 p 5 Иод I 5 s 2 5 p 5 Астат At 6 s 2 6 p 5 + 9 2 7 ) ) +85 2 8 18 32 18 7 ))))) ) +17 2 8 7 )) ) +35 2 8 18 7 ))) ) +53 2 8 18 18 7 )))) ) Радиус атома Электроотрицательность Окислительные свойства Неметаллические свойства
Слайд 8
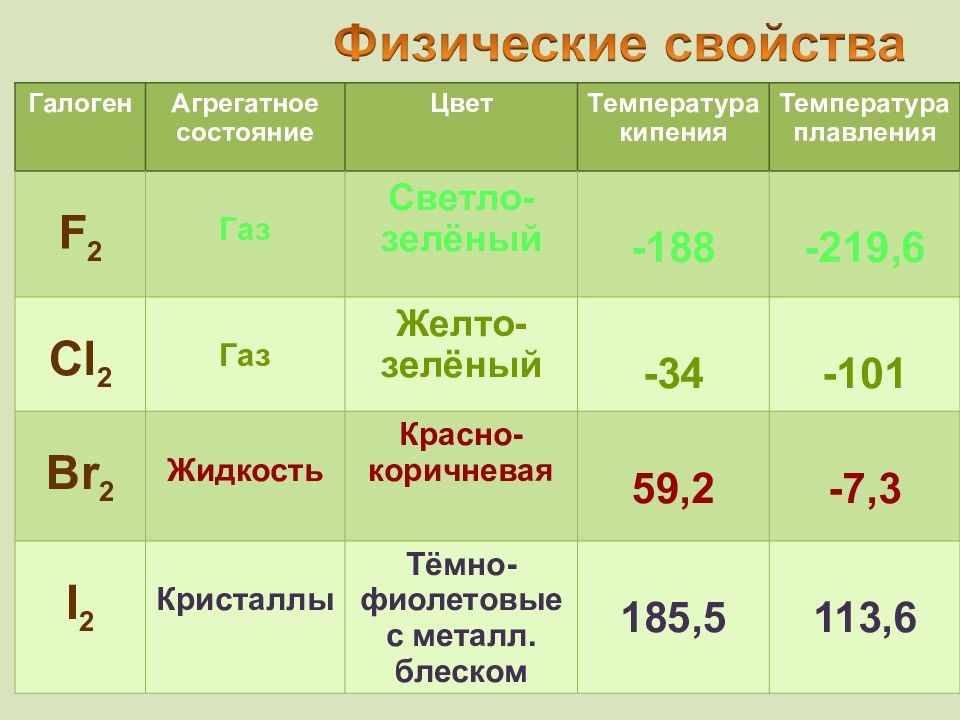
Галоген Агрегатное состояние Цвет T емпература кипения Температура плавления F 2 Газ Светло-зелёный -188 -219,6 Cl 2 Газ Желто-зелёный -34 -101 Br 2 Жидкость Красно-коричневая 59,2 -7,3 I 2 Кристаллы Тёмно-фиолетовые с металл. блеском 185,5 113,6
Слайд 9
Название "фтор" (от греческого phthoros - разрушение, гибель) 18,998 9 7 2 Ни один из химических элементов не принес химикам столько трагических событий, как фтор. Это зеленовато-желтый газ, немного тяжелее воздуха, с характерным запахом и необыкновенной химической активностью. В свободном состоянии фтор был получен 26 июня 1886 г. французским химиком Муассаном.
Слайд 10
Хлор был открыт шведским химиком Карлом Шееле в 1774 г. 35,453 17 7 82 Газ желто-зеленого цвета с резким запахом, ядовит в 2,5 раза тяжелее воздуха в 1 объеме воды при 20 °С растворяется около 2 объемов хлора в 1810 году сэр Гемфри Дэви назвал газ "хлорином"(Chlorine), от греческого "зелёный". Этот термин используется в английском языке, а в других языках закрепилось название "хлор".
Слайд 11
от греч. bromos – зловоние единственный неметалл, жидкий при комнатной температуре 79,9 35 7 188 2 79 Вr ( 50,56% ) 81 Вr ( 49,44% ) пары брома имеют желто-бурый цвет при температуре –7,25° C бром затвердевает, превращаясь в красно-коричневые игольчатые кристаллы со слабым металлическим блеском тяжелая красно-бурая жидкость с неприятным запахом
Слайд 12
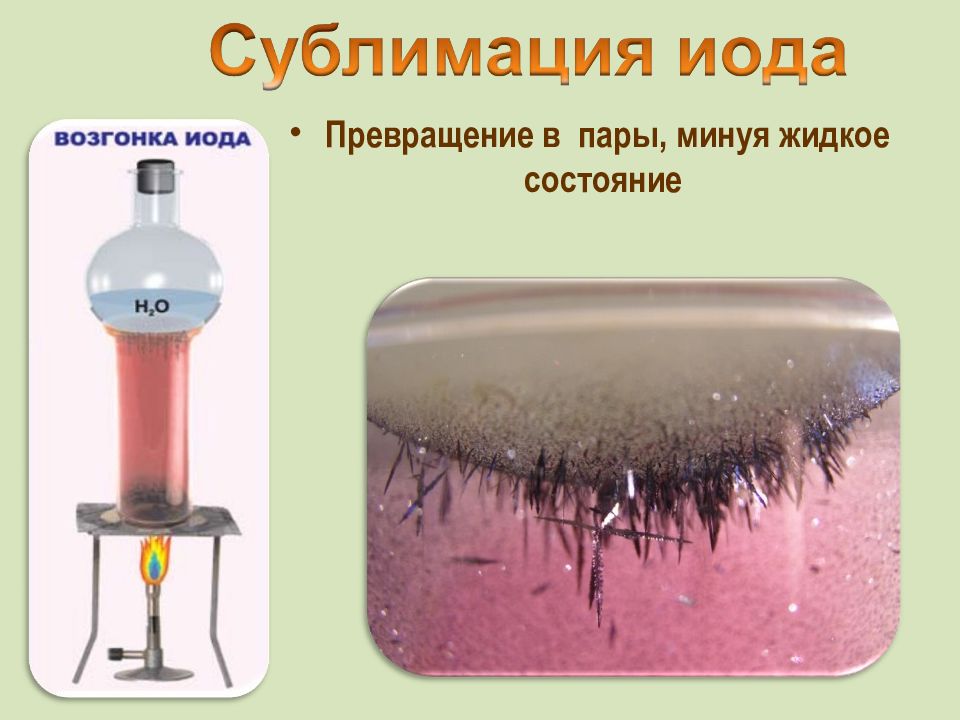
от греч. iodes—имеющий фиалковый цвет в парообразное состояние переходит при комнатной t°, не плавясь (сублимация); пары -фиолетового цвета 12 6,9 53 7 18 188 2 Иод был открыт в 1811 г. Куртуа в золе морских водорослей, а с 1815 г. Гей-Люссак стал рассматривать его как химический элемент Известны 37 изотопов иода с массовыми числами от 108 до 144.
Слайд 14
Молекулы галогенов состоят из двух атомов. Cl + Cl → Cl Cl Связь – ковалентная неполярная
Слайд 15
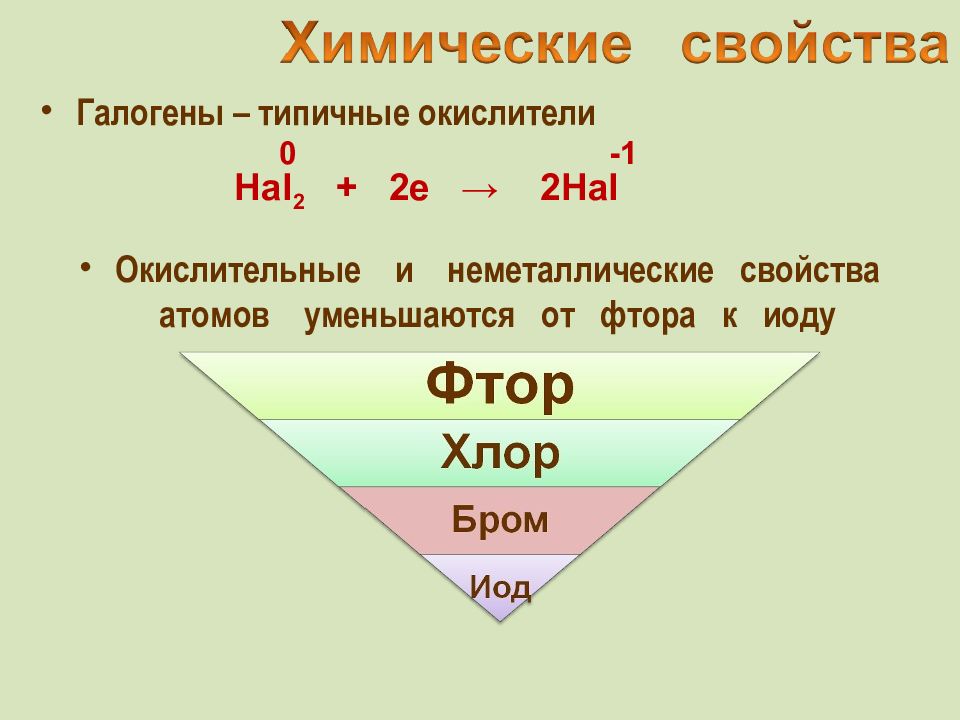
Галогены – типичные окислители Hal 2 + 2e → 2Hal -1 Окислительные и неметаллические свойства атомов уменьшаются от фтора к иоду 0
Слайд 16: Сравнение окислительных свойств
Фтор F Хлор Cl Бром Br Иод I Астат At Сравнение окислительных свойств + 9 2 7 ) ) +85 2 8 18 32 18 7 ))))) ) +17 2 8 7 )) ) +35 2 8 18 7 ))) ) +53 2 8 18 18 7 )))) ) Окислительные свойства Неметаллические свойства Радиус атома ← е - ← е - ← е - ← е - ← е -
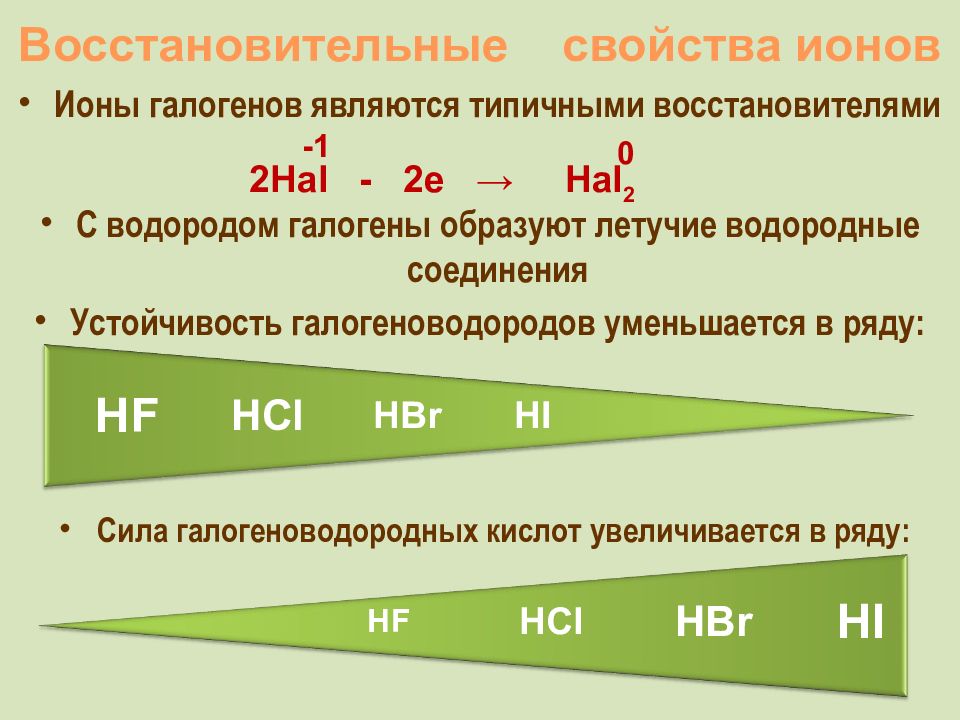
Слайд 17: Восстановительные свойства ионов
Ионы галогенов являются типичными восстановителями 2Hal - 2e → Hal 2 -1 0 С водородом галогены образуют летучие водородные соединения Устойчивость галогеноводородов уменьшается в ряду: HCl HF HBr HI C ила галогеноводородных кислот увеличивается в ряду: HCl HF HBr HI
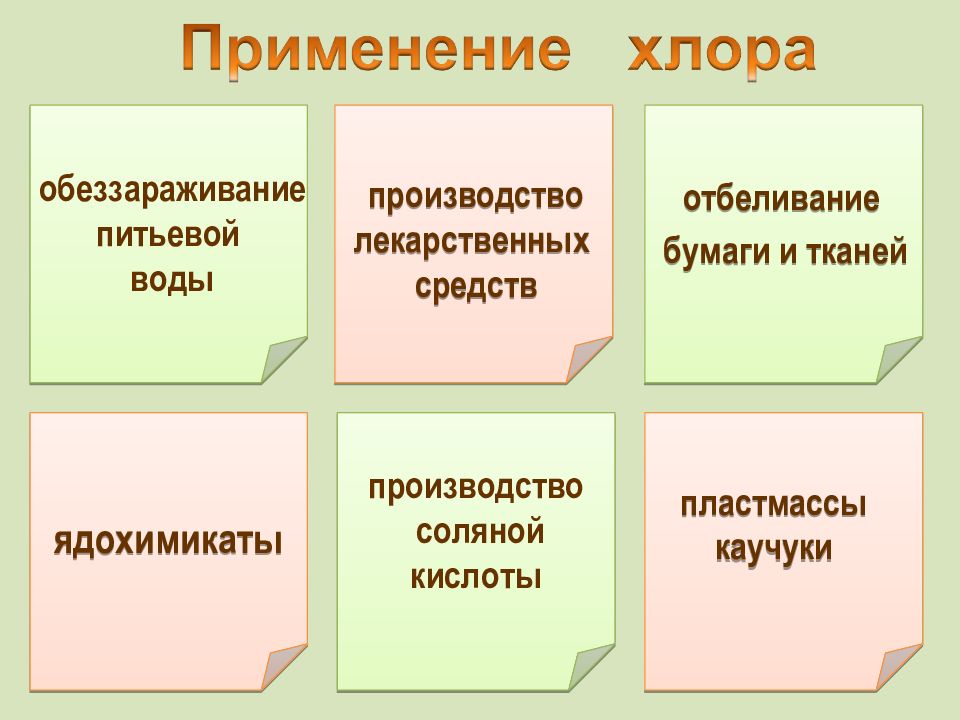
Слайд 18
ядохимикаты обеззараживание питьевой воды отбеливание бумаги и тканей производство соляной кислоты производство лекарственных средств пластмассы каучуки
Слайд 19
- 5 % спиртовой раствор йода используется для дезинфекции кожи вокруг повреждения - В рентгенологических и томографических исследованиях применяются йодсодержащие контрастные препараты - Галоге́нная ла́мпа — лампа накаливания, в баллон которой добавлены пары галогенов (брома или йода) - Лазерный термоядерный синтез - иодорганические соединения применяются для производства сверхмощных газовых лазеров на возбужденных атомах В технике В медицине
Последний слайд презентации: Общая характеристика галогенов на основе положения химических элементов в
Что значит название «Галогены»? В чём сходство электронного строения этих элементов? Какие свойства в окислительно-восстановительном плане проявляют галогены? Какой галоген наиболее химически активен? Как изменяется активность галогенов вниз по группе?