Первый слайд презентации: Типы химических реакций на примере свойств воды
Слайд 2
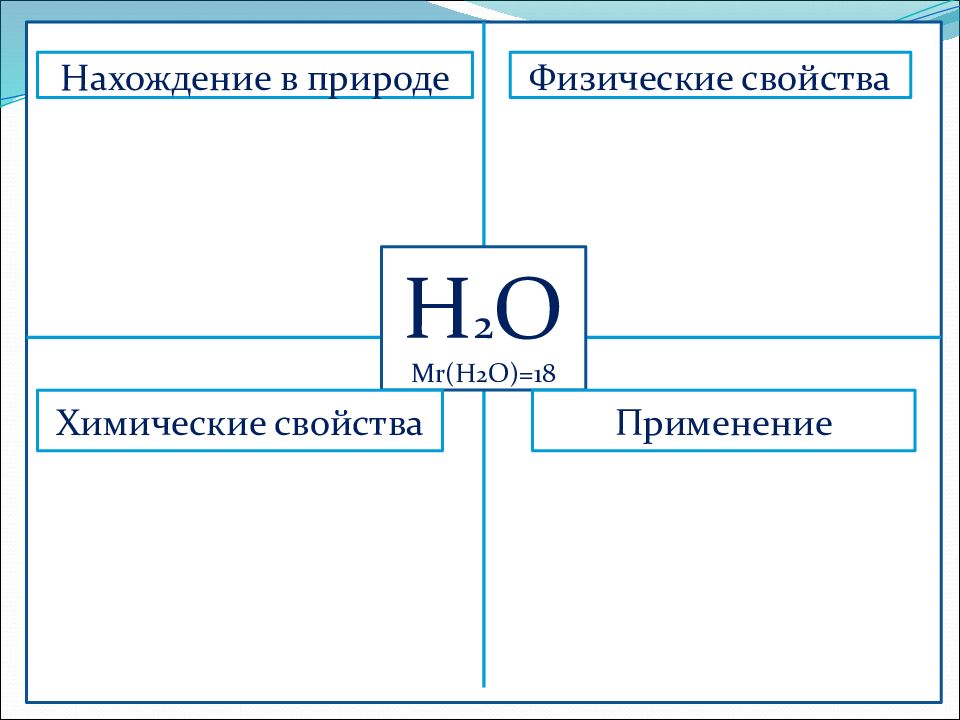
Н 2 О М r (Н 2 О)=18 Физические свойства Нахождение в природе Химические свойства Применение
Слайд 3
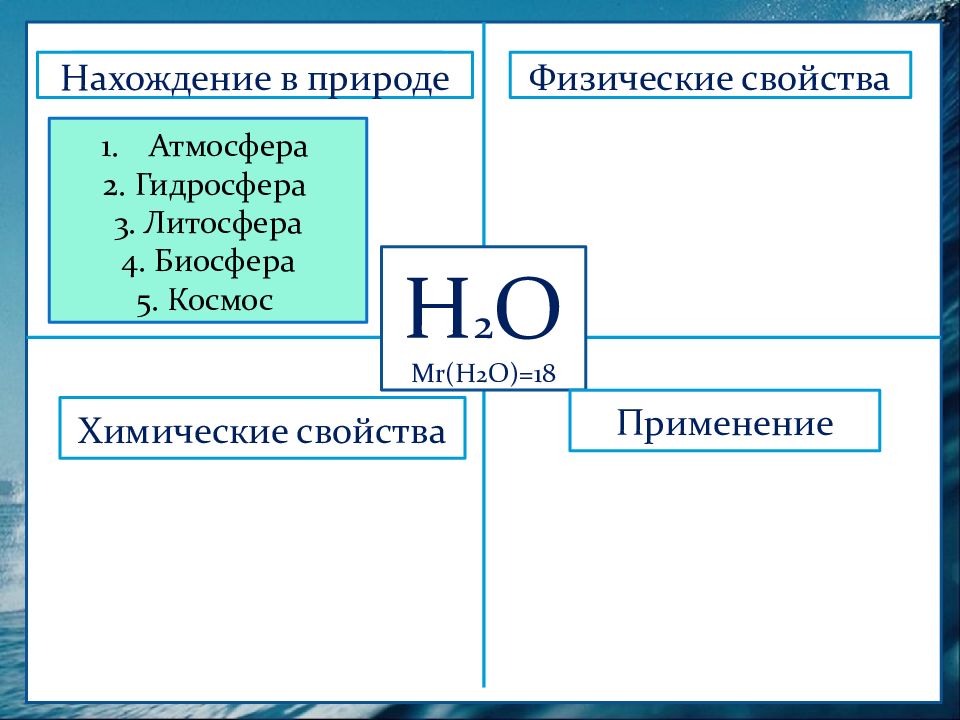
Н 2 О М r (Н 2 О)=18 Физические свойства Нахождение в природе Химические свойства Применение Атмосфера 2. Гидросфера 3. Литосфера 4. Биосфера 5. Космос Нахождение в природе
Слайд 4
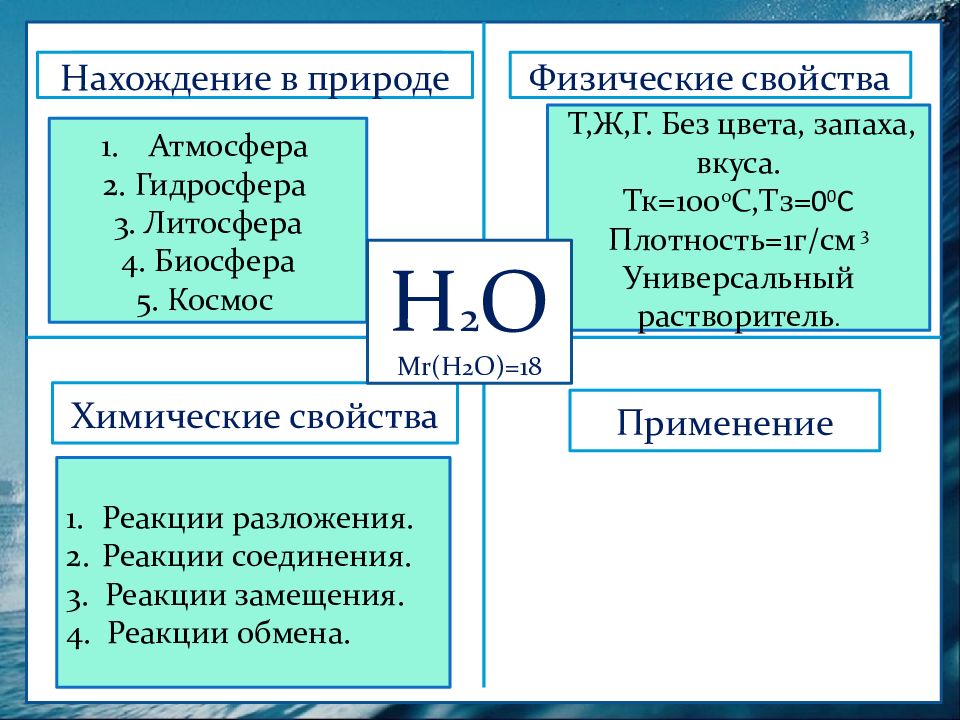
Физические свойства Нахождение в природе Химические свойства Применение Атмосфера 2. Гидросфера 3. Литосфера 4. Биосфера 5. Космос Нахождение в природе Т,Ж,Г. Без цвета, запаха, вкуса. Тк =100 0 С,Тз= 0 0 С Плотность=1г/см 3 Универсальный растворитель. Н 2 О М r (Н 2 О)=18 Реакции разложения. Реакции соединения. 3. Реакции замещения. 4. Реакции обмена.
Слайд 6: Реакции соединения:
А) С оксидами металлов: С оксидами щелочных металлов ( Li, K, Na ); C оксидами щелочноземельных металлов (Ca, Sr, Ba ) MeO + H 2 O → Me +n (OH) n Пример: СаО + H 2 O → Са + 2 (OH) 2 негашеная известь гашеная известь Na 2 O + H 2 O → Na +1 OH
Слайд 7: Реакции соединения:
А) С оксидами металлов: С оксидами щелочных металлов ( Li, K, Na ); C оксидами щелочноземельных металлов (Ca, Sr, Ba ) MeO + H 2 O → Me +n (OH) n Пример: СаО + H 2 O → Са + 2 (OH) 2 негашеная известь гашеная известь Na 2 O + H 2 O → 2 Na +1 OH
Слайд 8: Реакции соединения:
Б) С оксидами неметаллов: НеМеО + Н 2 О → Н n ( КО ) -n (кислородсодержащая кислота) N 2 O 3 + H 2 O → 2 HNO 2 N 2 O 5 + H 2 O → 2 HNO 3 Ст. ок. элемента, образующего оксид остается неизменной. Основания и кислородсодержащие кислоты называются общим словом – гидроксиды.
Слайд 9: Правило:
Вода реагирует с оксидами металлов и оксидами неметаллов в том случае, если образуется растворимый гидроксид (щелочь или кислородсодержащая кислота).
Слайд 10: Реакции замещения:
Щелочные и щелочноземельные металлы реагируют с водой по схеме: Me + H 2 O → Me +n (OH) n + H 2 ↑ K + H 2 O → K + OH+ H 2 ↑ Ca + H 2 O → Ca +2 (OH) 2 + H 2 ↑
Слайд 11: Реакции обмена:
Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al 2 S 3 + HOH → Al(OH) 3 ↓ + H 2 S ↑ СаС 2 + Н 2 О → Са(ОН) 2 + С 2 Н 2
Слайд 12: Реакции обмена:
Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al 2 S 3 + HOH → 2Al(OH) 3 + H 2 S СаС 2 + Н 2 О → Са(ОН) 2 + С 2 Н 2
Слайд 13: Реакции обмена:
Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al 2 S 3 + HOH → 2Al(OH) 3 + 3H 2 S СаС 2 + Н 2 О → Са(ОН) 2 + С 2 Н 2
Слайд 14: Реакции обмена:
Обменное взаимодействие веществ с водой, приводящее к их разложению, называют гидролизом. Al 2 S 3 + 6HOH → 2Al(OH) 3 + 3H 2 S СаС 2 + Н 2 О → Са(ОН) 2 + С 2 Н 2
Слайд 15
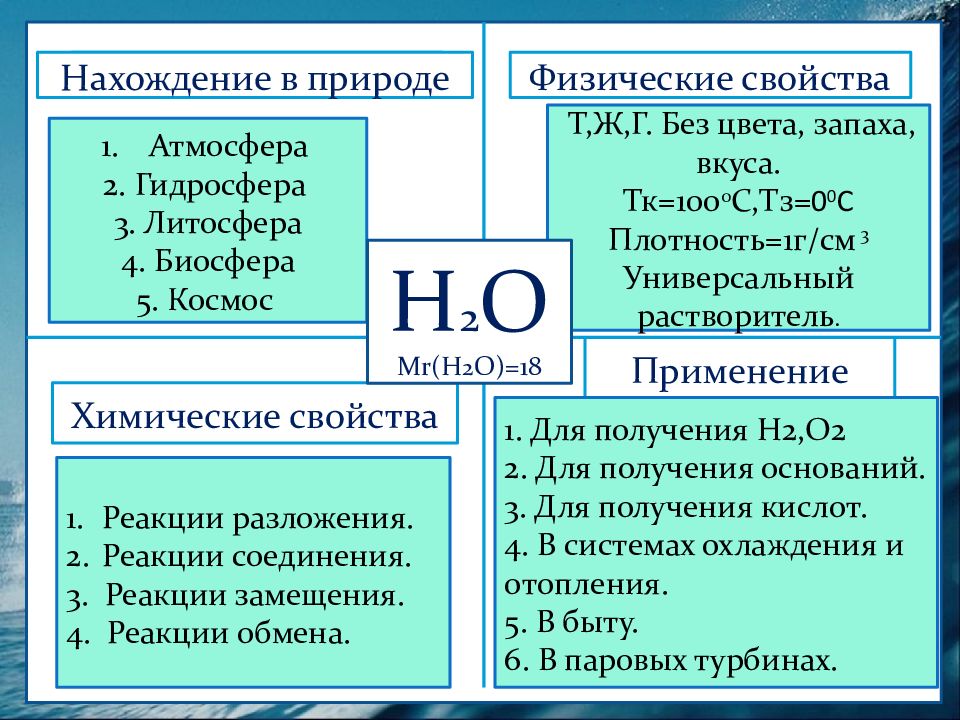
Физические свойства Нахождение в природе Химические свойства Применение Атмосфера 2. Гидросфера 3. Литосфера 4. Биосфера 5. Космос Нахождение в природе Т,Ж,Г. Без цвета, запаха, вкуса. Тк =100 0 С,Тз= 0 0 С Плотность=1г/см 3 Универсальный растворитель. Н 2 О М r (Н 2 О)=18 Реакции разложения. Реакции соединения. 3. Реакции замещения. 4. Реакции обмена. 1. Для получения Н2,О2 2. Для получения оснований. 3. Для получения кислот. 4. В системах охлаждения и отопления. 5. В быту. 6. В паровых турбинах.
Слайд 16
Вариант № 1 1) 2) Напишите уравнение реакции взаимодействия кальция с кислородом и водой. 3) Вариант № 2 1) 2) Напишите уравнение реакции взаимодействия железа с хлором и лития с водой. 3)