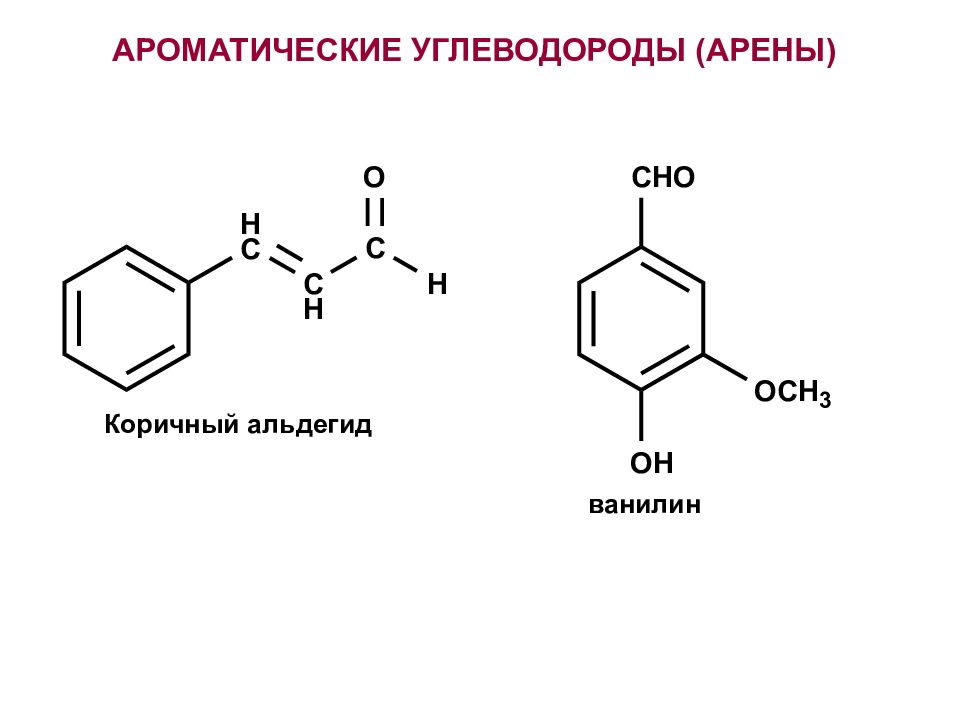
Первый слайд презентации: Лекция №1 Ароматические и гетероциклические соединения. Электронная спектроскопия
1 Лекция №1 Ароматические и гетероциклические соединения. Электронная спектроскопия Кафедра общей и медицинской химии
Слайд 2
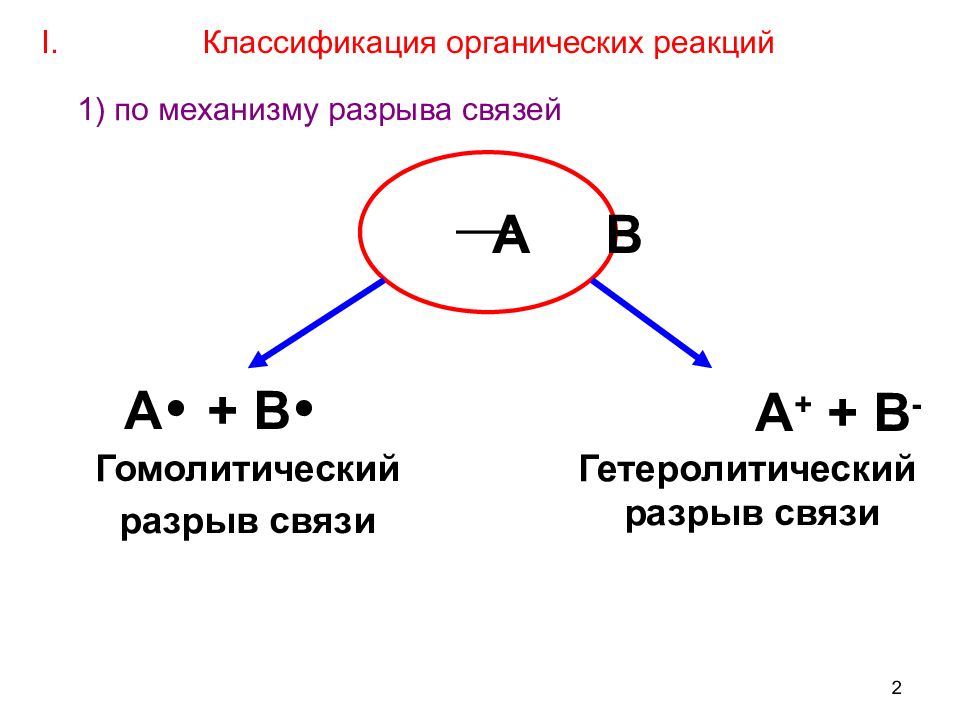
2 А В А + + В - Гомолитический разрыв связи А + В Гетеролитический разрыв связи I. Классификация органических реакций 1) по механизму разрыва связей
Слайд 3
3 3 а) Радикальные реакции: гомолитический разрыв связи: А· + В· - свободные радикалы (R) - очень активные частицы, стремятся к образованию связей Н·, Cl ·, O:, ·OH Условия: газовая фаза, свет, неполярный растворитель
Слайд 4
4 4 Н.Н. Семенов (1896-1986г.) Лауреат Нобелевской премии (1956 г.) Создатель теории механизма свободно-радикальных(цепных ) реакций
Слайд 5
5 б) Ионные реакции: гетеролитический разрыв связи образуются положительные частицы- электрофилы Е ( ) (Н +, NO 2 +, Br +, SO 3 и т.д.) отрицательные частицы – нуклеофилы – Nu ( H –, OH –, NH 2, H 2 O и т.д.) Условия протекания ионных реакций: полярные растворители
Слайд 6
6 6 в) Синхронные реакции – разрыв старых и образование новых связей происходят одновременно.
Слайд 7
7 S: ( реакции замещения, англ. Substitution ) S R - алканы S E - арены S N - галогенпроизводные, спирты, карбоновые кислоты A: (реакции присоединения, англ. Addition ) A R – алкены, алкины A E – алкены, алкины A N – альдегиды, кетоны E (реакции отщепления, англ. Elimination ) OBР (окислительно-восстановительные) 2) По конечному результату:
Слайд 8
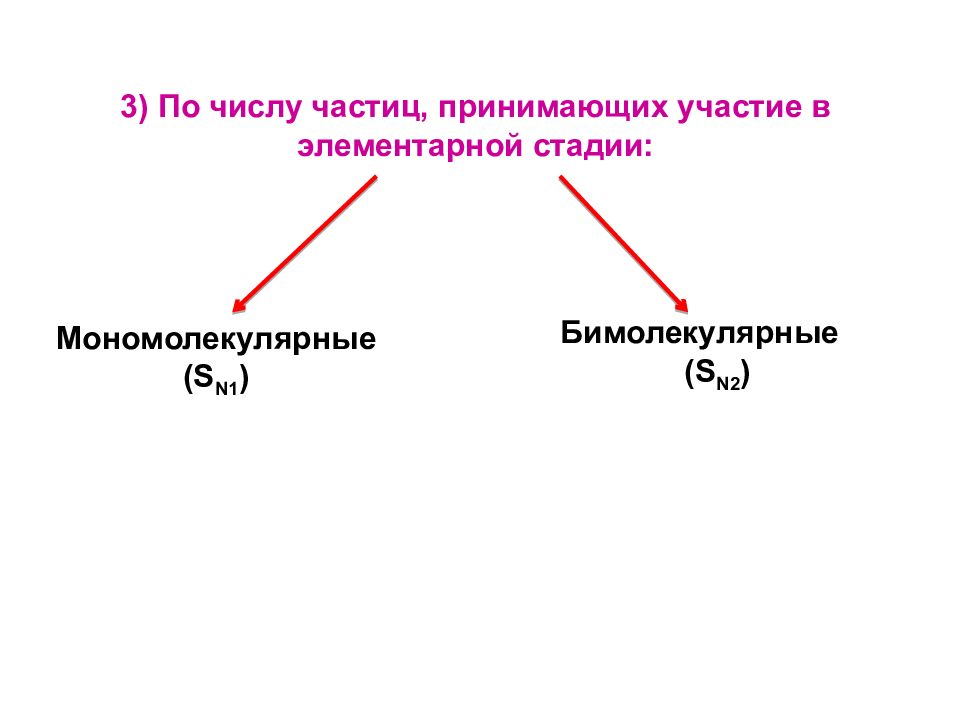
8 8 Мономолекулярные (S N1 ) Бимолекулярные (S N2 ) 3) По числу частиц, принимающих участие в элементарной стадии:
Слайд 9
9 I I. Электронные эффекты заместителей. Участок молекулы, где ē - плотность максимальная или минимальная является самым реакционноспособным. На реакционную способность влияют: электронные эффекты заместителей наличие сопряжения пространственные факторы
Слайд 10
10 Электронные эффекты заместителей. Любой атом или группа атомов, замещающая H в исходном соединении, называется заместителем. Влияние заместителей определяется электронными эффектами: индуктивным (I) и мезомерным (M).
Слайд 11
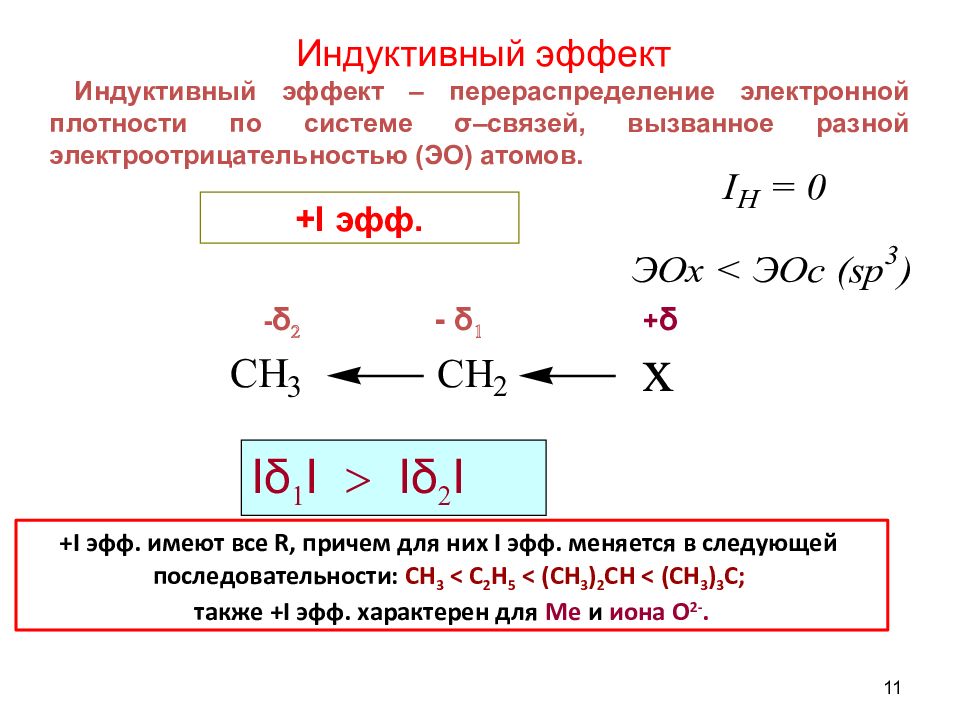
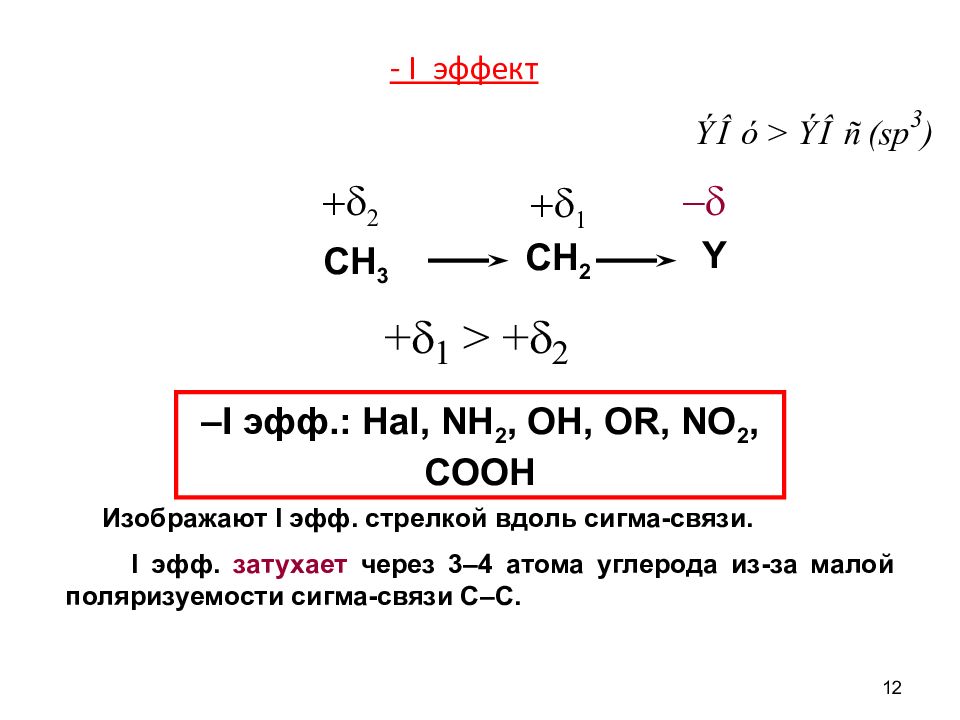
11 Индуктивный эффект Индуктивный эффект – перераспределение электронной плотности по системе σ –связей, вызванное разной электроотрицательностью (ЭО) атомов. - δ 2 - δ 1 + δ +I эфф. имеют все R, причем для них I эфф. меняется в следующей последовательности: CH 3 < C 2 H 5 < (CH 3 ) 2 CH < (CH 3 ) 3 C; также +I эфф. характерен для Мe и иона О 2-. І δ 1 І > І δ 2 І + I эфф.
Слайд 12
12 Изображают I эфф. стрелкой вдоль сигма-связи. I эфф. затухает через 3–4 атома углерода из-за малой поляризуемости сигма-связи С–С. –I эфф.: Hal, NH 2, OH, OR, NO 2, COOH CH 3 CH 2 Y + d 2 + d 1 - d - I эффект
Слайд 13
13 МЕЗОМЕРНЫЙ ЭФФЕКТ (ЭФФЕКТ СОПРЯЖЕНИЯ) Мезомерный эффект (М) – перераспределение электронной плотности по системе p –связей. М эфф., в отличие от I эфф., возникает лишь там, где появляется сопряжение. Сопряжение – это выравнивание связей и зарядов в реальной молекуле по сравнению с идеальной. Сопряжение возникает в результате образования единого –делокализованного облака, принадлежащего более чем двум атомам.
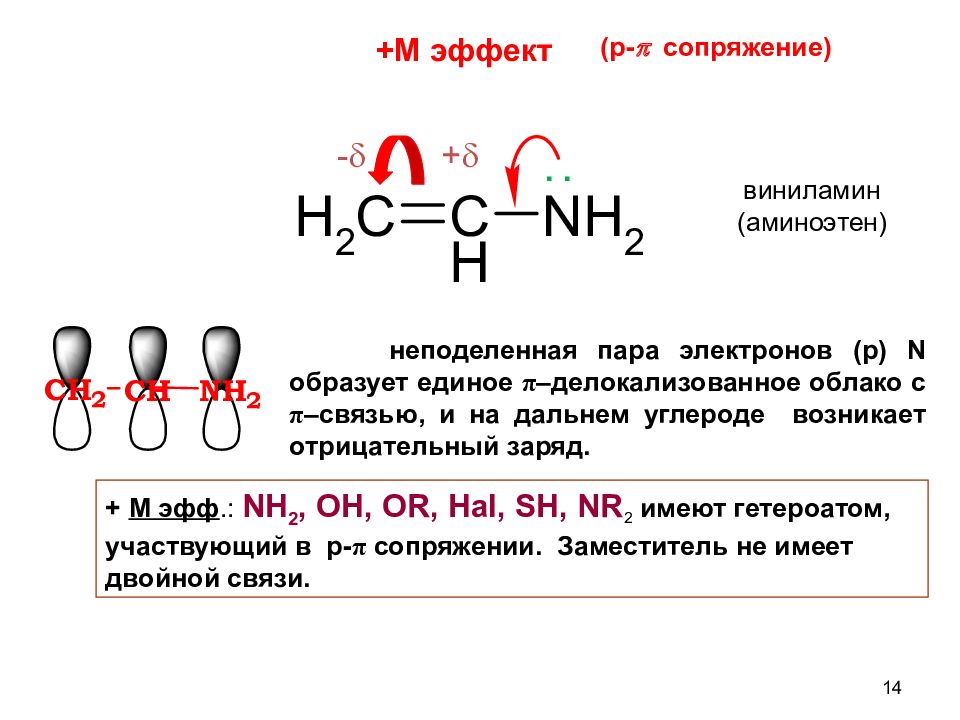
Слайд 14
14 неподеленная пара электронов (р) N образует единое π –делокализованное облако с π –связью, и на дальнем углероде возникает отрицательный заряд. + - + М эфф.: NH 2, OH, OR, Hal, SH, NR 2 имеют гетероатом, участвующий в p - π сопряжении. Заместитель не имеет двойной связи. +М эффект ( p- p сопряжение) виниламин (аминоэтен) ..
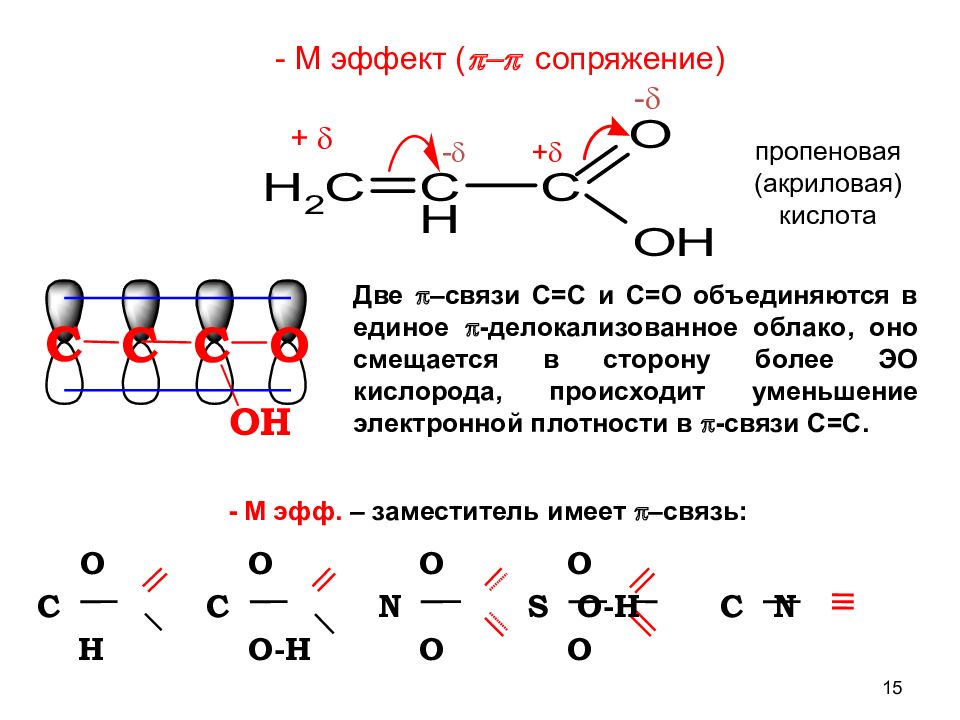
Слайд 15
15 - М эфф. – заместитель имеет p –связь: Две p –связи С=С и С=О объединяются в единое p -делокализованное облако, оно смещается в сторону более ЭО кислорода, происходит уменьшение электронной плотности в p -связи С=С. - + C C O O- H N O O S O O- H C N O H O - + - М эффект ( p-p сопряжение) пропеновая (акриловая) кислота
Слайд 16
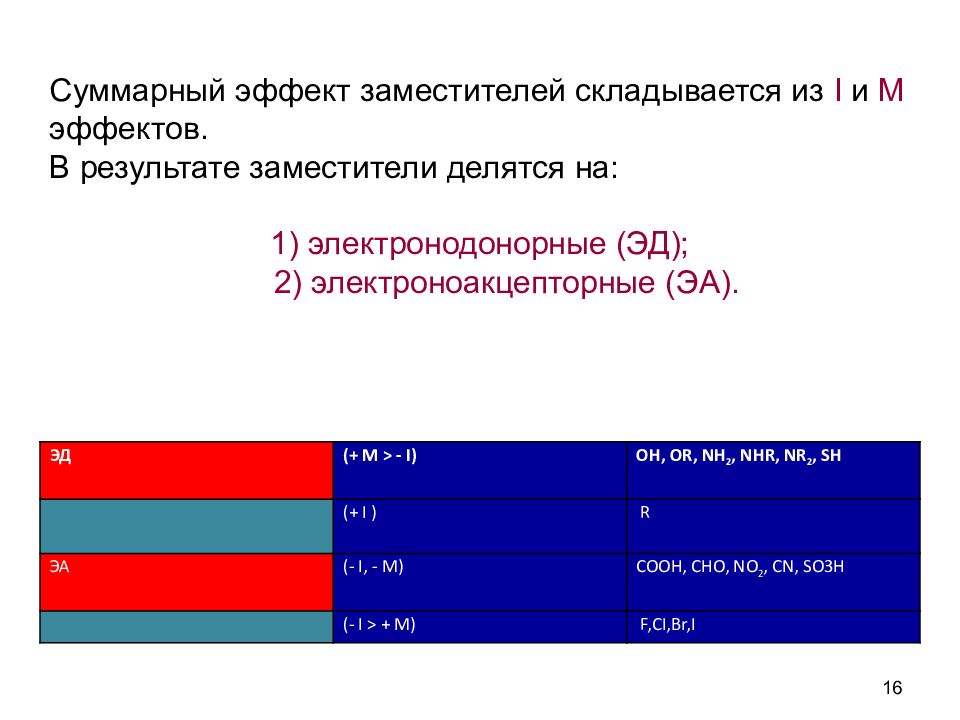
16 Суммарный эффект заместителей складывается из I и М эффектов. В результате заместители делятся на: 1) электронодонорные (ЭД); 2) электроноакцепторные (ЭА). ЭД (+ М > - I) OH, OR, NH 2, NHR, NR 2, SH (+ I ) R ЭА (- I, - M) COOH, CHO, NO 2, CN, SO3 Н (- I > + M) F,CI,Br,I
Слайд 17
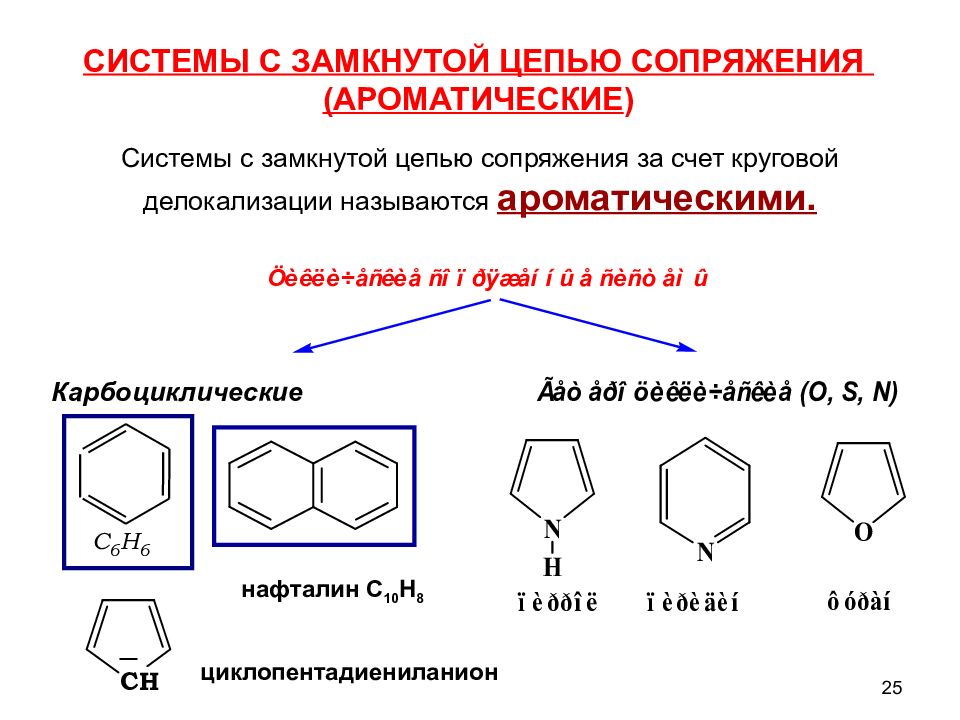
Сопряженные системы С открытой цепью сопряжения имеют начало и конец сопряжения Представители: - бутадиен-1,3 - изопрен - циклопентадиен - (1, 3) - сорбиновая кислота - β -каротин С замкнутой цепью сопряжения циклическое сопряжение Представители: - арены - гетероциклические соединения 17
Слайд 18
18 Системы с открытой цепью сопряжения СОПРЯЖЕНИЕ – это выравнивание связи по энергии и по длине, вызванное образованием p –единого делокализованного облака. ЭНЕРГИЯ СОПРЯЖЕНИЯ – понижение энергии реальной молекулы, по сравнению с молекулами с изолированными связями. В результате сопряжения молекула становится более термодинамически устойчивой. NB! Чем больше энергия сопряжения, тем устойчивее молекула!
Слайд 19
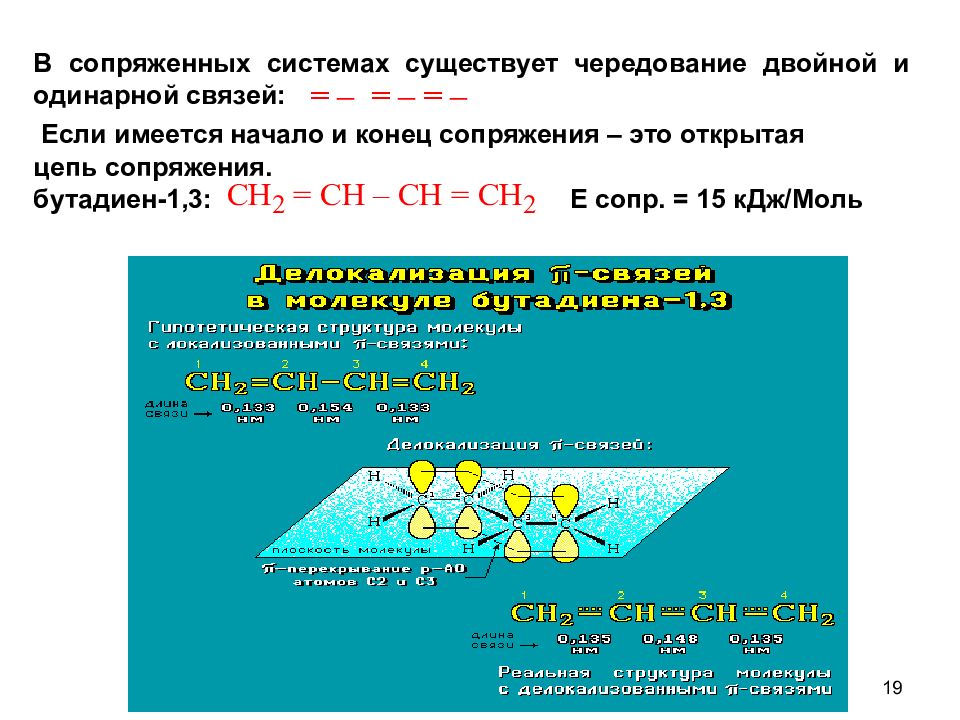
19 В сопряженных системах существует чередование двойной и одинарной связей: Если имеется начало и конец сопряжения – это открытая цепь сопряжения. бутадиен-1,3: Е сопр. = 15 кДж/Моль
Слайд 21
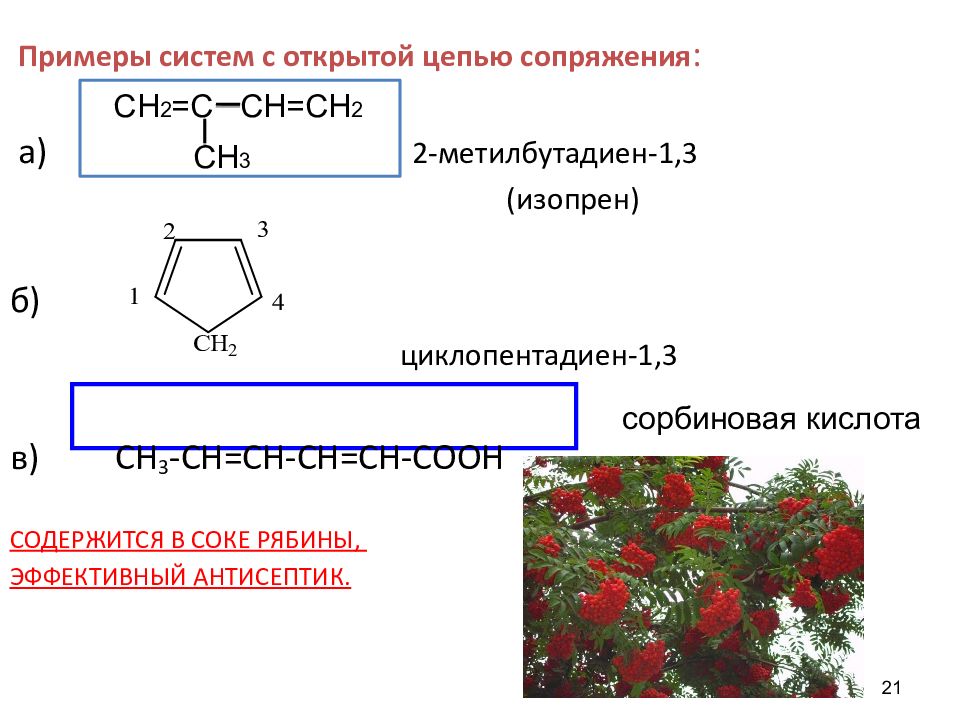
21 Примеры систем с открытой цепью сопряжения : а) 2- метилбутадиен-1,3 (изопрен) б ) циклопентадиен-1,3 в) CH 3 -CH =CH-CH=CH-COOH СОДЕРЖИТСЯ В СОКЕ РЯБИНЫ, ЭФФЕКТИВНЫЙ АНТИСЕПТИК. сорбиновая кислота СН 2 =С СН=СН 2 СН 3
Слайд 22
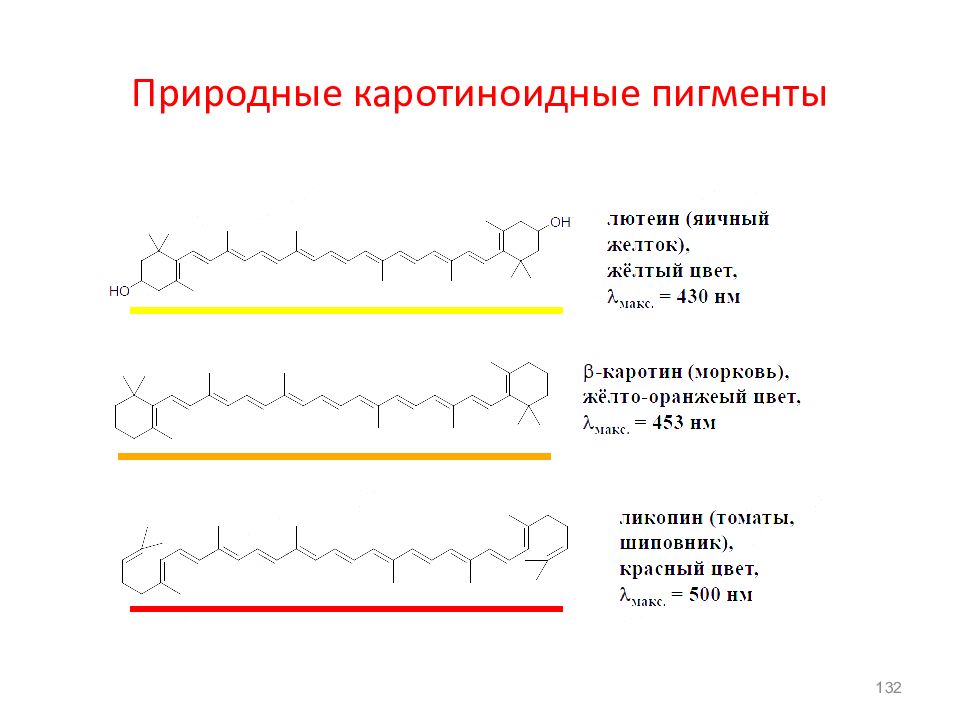
β–каротин – провитамин А, обуславливает окраску моркови,томатов, масла; имеет сопряженную систему из 11двойных (=) связей. В организме при его расщеплении образуется ретинол – витамин А – ( 5 = ) : витамин роста, его недостаток понижает сопротивление к инфекционным заболеваниям; и ретиналь ( 6 = ): отвечает за поглощение света в зрительном нерве. Чем длиннее цепь сопряжения, тем устойчивее молекула к внешним воздействиям! 22
23 ОСОБЕННОСТИ РЕАКЦИОННОЙ СПОСОБНОСТИ СОПРЯЖЕННЫХ СИСТЕМ С ОТКРЫТОЙ ЦЕПЬЮ СОПРЯЖЕНИЯ Химическое поведение молекулы обусловлено природой химической связи, распределением электронной плотности. Особенности химической связи в сопряженных системах: Образование p -делокализованного облака, единого для всей молекулы Выравнивание длины связи Легкая поляризуемость p -облака NB!
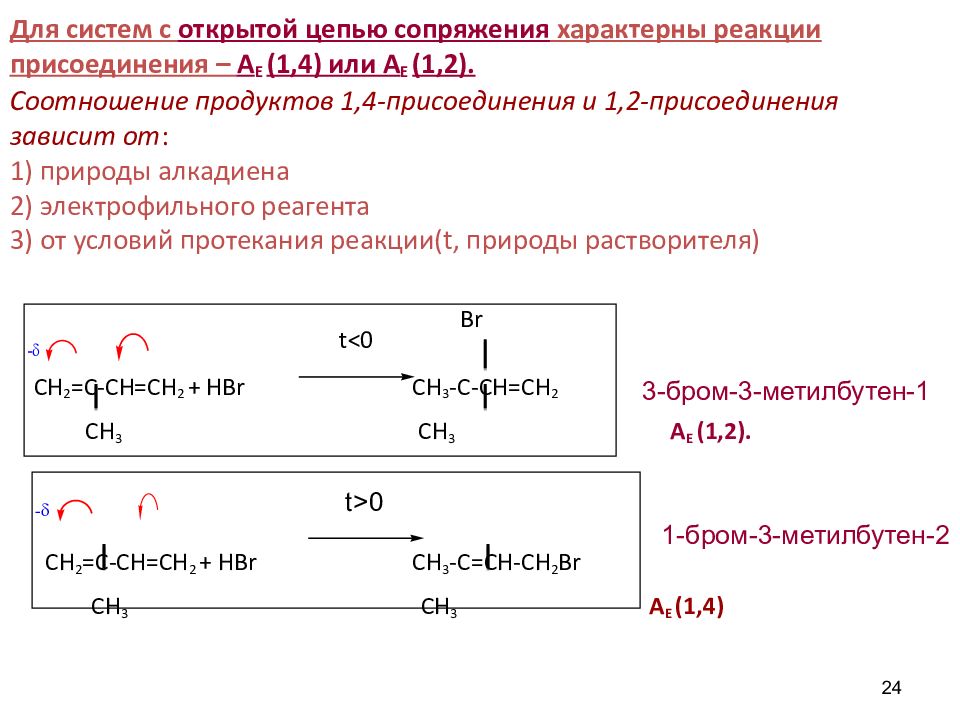
24 Br t < 0 С H 2 =C-CH=CH 2 + HBr С H 3 -C-CH=CH 2 CH 3 CH 3 А Е (1,2). С H 2 =C-CH=CH 2 + HBr С H 3 -C=CH - CH 2 Br CH 3 CH 3 А Е (1,4) Для систем с открытой цепью сопряжения характерны реакции присоединения – А Е (1,4) или А Е (1,2). Соотношение продуктов 1,4-присоединения и 1,2-присоединения зависит от : 1) природы алкадиена 2) электрофильного реагента 3) от условий протекания реакции( t, природы растворителя) 3 - бром-3-метилбутен-1 1- бром-3-метилбутен-2 t > 0
Слайд 25
25 циклопентадиениланион Системы с замкнутой цепью сопряжения за счет круговой делокализации называются ароматическими. СИСТЕМЫ С ЗАМКНУТОЙ ЦЕПЬЮ СОПРЯЖЕНИЯ (АРОМАТИЧЕСКИЕ ) C 6 H 6 нафталин C 10 H 8 Карбоциклические
Слайд 26
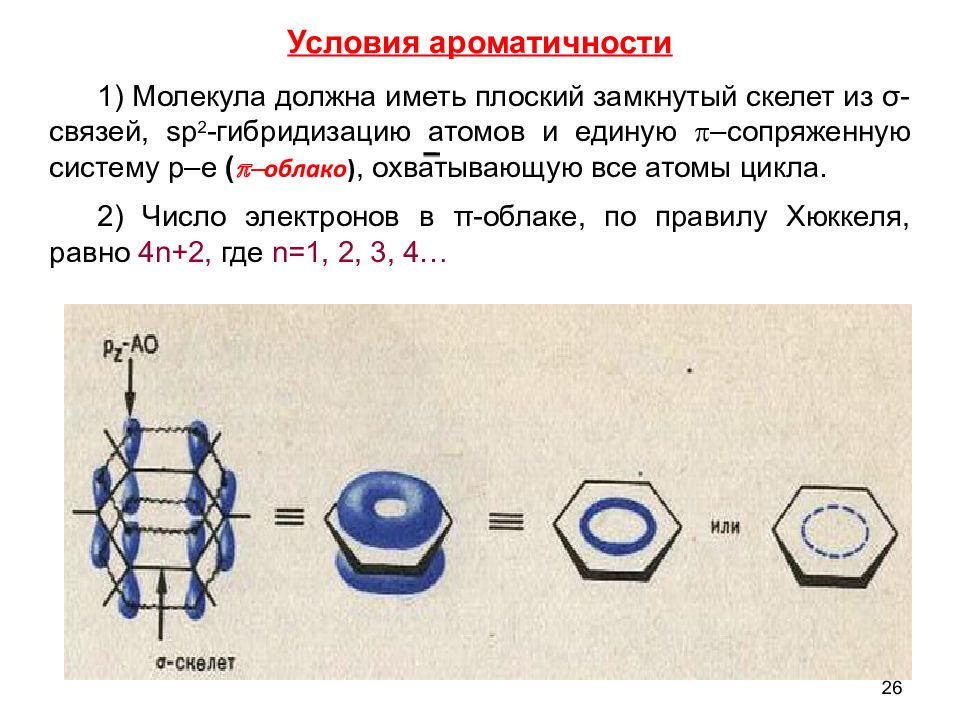
26 1) Молекула должна иметь плоский замкнутый скелет из σ-связей, sp 2 -гибридизацию атомов и единую p –сопряженную систему р –е ( p - облако ), охватывающую все атомы цикла. 2) Число электронов в π-облаке, по правилу Хюккеля, равно 4n+2, где n=1, 2, 3, 4… Условия ароматичности
Слайд 28
28 Для ароматических УВ характерны реакции, обусловленные замкнутой цепью сопряжения. Устойчивость к окислению (энергия сопряжения =150 кДж / моль) ; Способность к реакциям S Е (сохраняющим ароматичность) Относительная устойчивость к реакциям присоединения А (жесткие условия).
Слайд 29
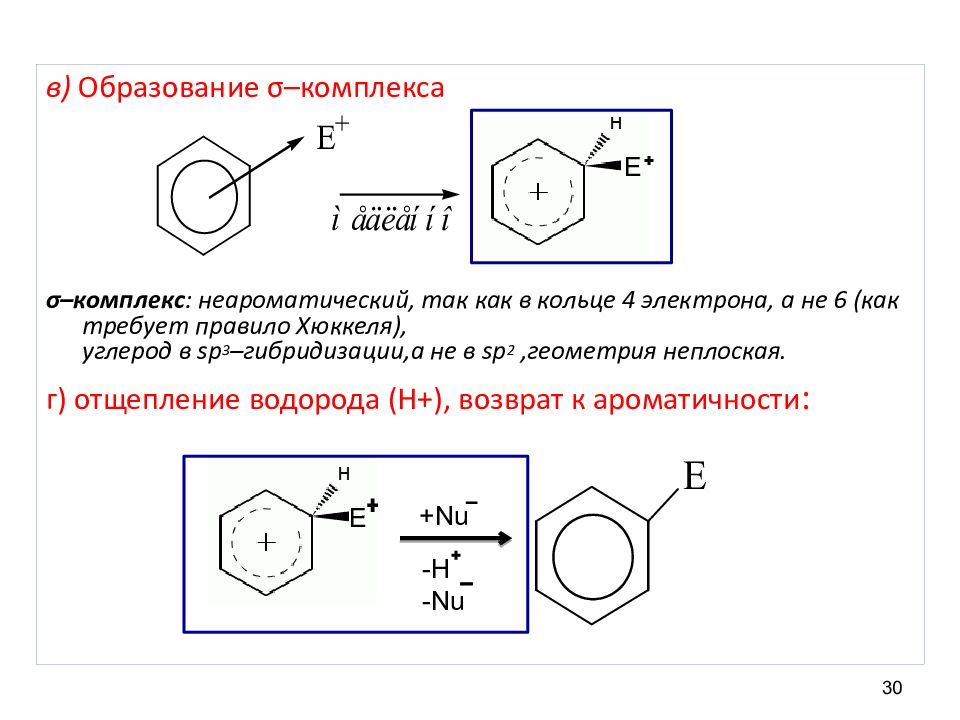
29 Общая схема S E а) Образование электрофильной частицы под действием катализатора: б) Образование π - комплекса π – комплекс : нехимическое соединение, π – облако содержит 6 электронов, ароматический характер не нарушен.
Слайд 30
30 в) Образование σ –комплекса σ –комплекс : неароматический, так как в кольце 4 электрона, а не 6 (как требует правило Хюккеля), углерод в sp 3 – гибридизации,а не в sp 2,геометрия неплоская. г) отщепление водорода (Н+), возврат к ароматичности : Е Е + Nu -H -Nu
Слайд 31
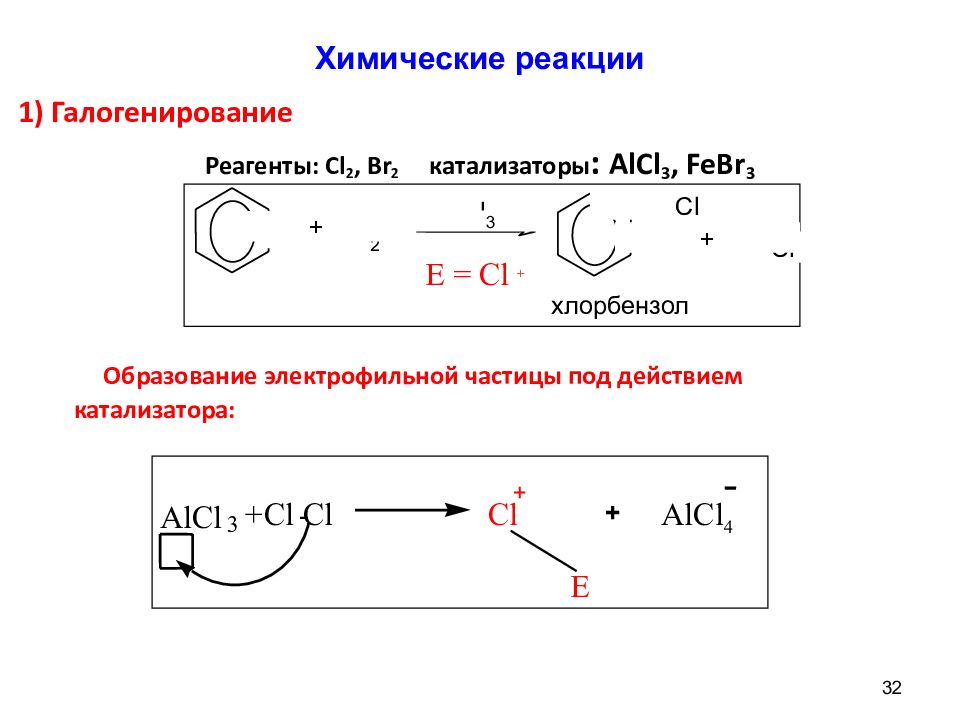
31 1) Галогенирование : Реагенты : Cl 2, Br 2 ; катализаторы : AlCl 3,FeBr 3 2) Нитрование: Реагент : HNO 3 ( конц.) ; УСЛОВИЯ: H 2 SO 4 ( конц.) 3) Сульфирование: Реагент: H 2 SO 4 конц. ( SO 3 ) 4) Алкилирование – образование гомологов бензола (реакция Фриделя-Крафтса ): Реагент: R- Г (Г- CI, Br, I), катализатор: AlCl 3, FeCl 3, FeBr 3 5) Ацилирование - образование кетонов (реакция Фриделя-Крафтса ) Реагент: RCOCl, катализаторы : AlCl 3,FeBr 3 Химические реакции
Слайд 32
32 1 ) Галогенирование Реагенты: Cl 2, Br 2 катализаторы : AlCl 3, FeBr 3 Образование электрофильной частицы под действием катализатора: Химические реакции E AlCl 3 + Cl - Cl Cl + AlCl 4 + C l 2 Al C l 3 Cl H Cl + + хлорбензол E = Cl +
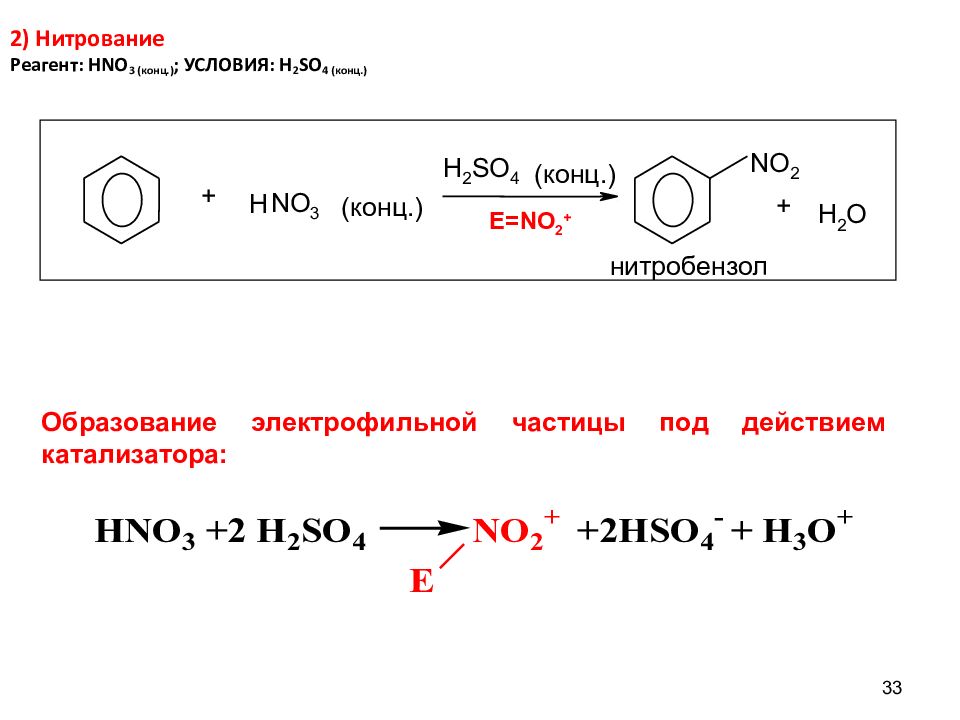
Слайд 33: 2) Нитрование Реагент: HNO 3 ( конц.) ; УСЛОВИЯ: H 2 SO 4 (конц.)
33 2) Нитрование Реагент: HNO 3 ( конц.) ; УСЛОВИЯ: H 2 SO 4 (конц.) E=NO 2 + H N О 3 H 2 S O 4 N О 2 H 2 О + (конц.) (конц.) + нитробензол Образование электрофильной частицы под действием катализатора:
Слайд 34
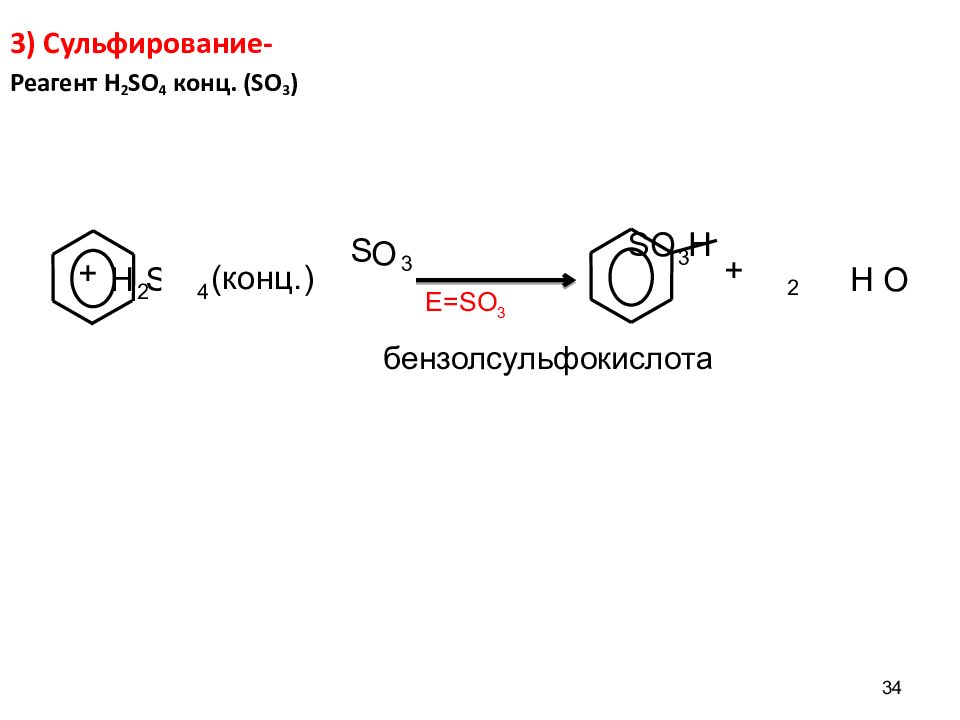
34 3) Сульфирование- Реагент H 2 SO 4 конц. ( SO 3 ) E=SO 3 H 2 S O 4 S О 3 S O 3 H 2 H О + (конц.) + бензолсульфокислота
Слайд 35
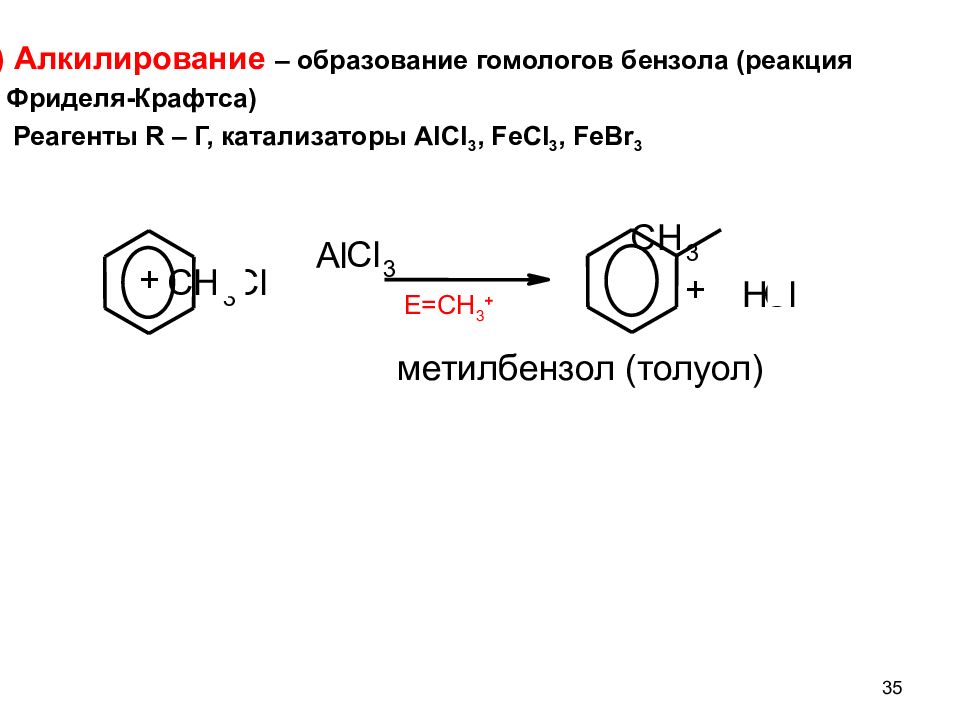
35 4) Алкилирование – образование гомологов бензола (реакция Фриделя-Крафтса) Реагенты R – Г, катализаторы AlCl 3, FeCl 3, FeBr 3 E=CH 3 + C H 3 C l Al C l 3 C H 3 H Cl + + метилбензол (толуол)
Слайд 36
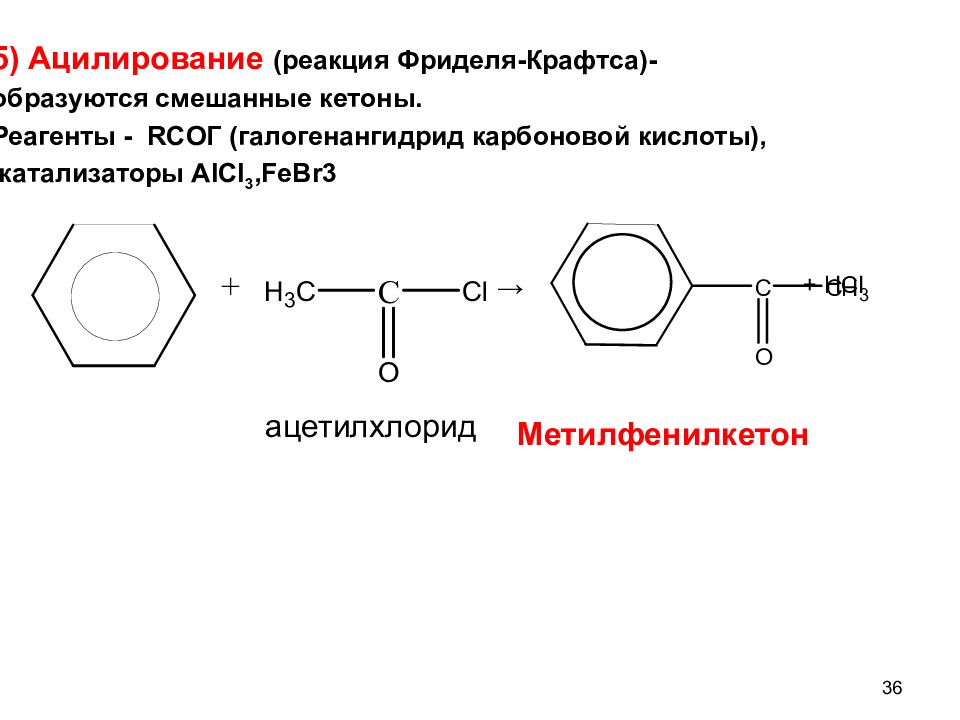
5) Ацилирование (реакция Фриделя-Крафтса)- образуются смешанные кетоны. Реагенты - RCO Г (галогенангидрид карбоновой кислоты), катализаторы AICI 3, FeBr3 → Метилфенилкетон + HCI 36 ацетилхлорид
Слайд 37
37 ПРАВИЛА ЗАМЕЩЕНИЯ В БЕНЗОЛЬНОМ КОЛЬЦЕ Первый заместитель встает в любое положение и влияет на распределение электронной плотности в кольце. 2. По влиянию на распределение электронной плотности заместители делятся на два рода. NB!
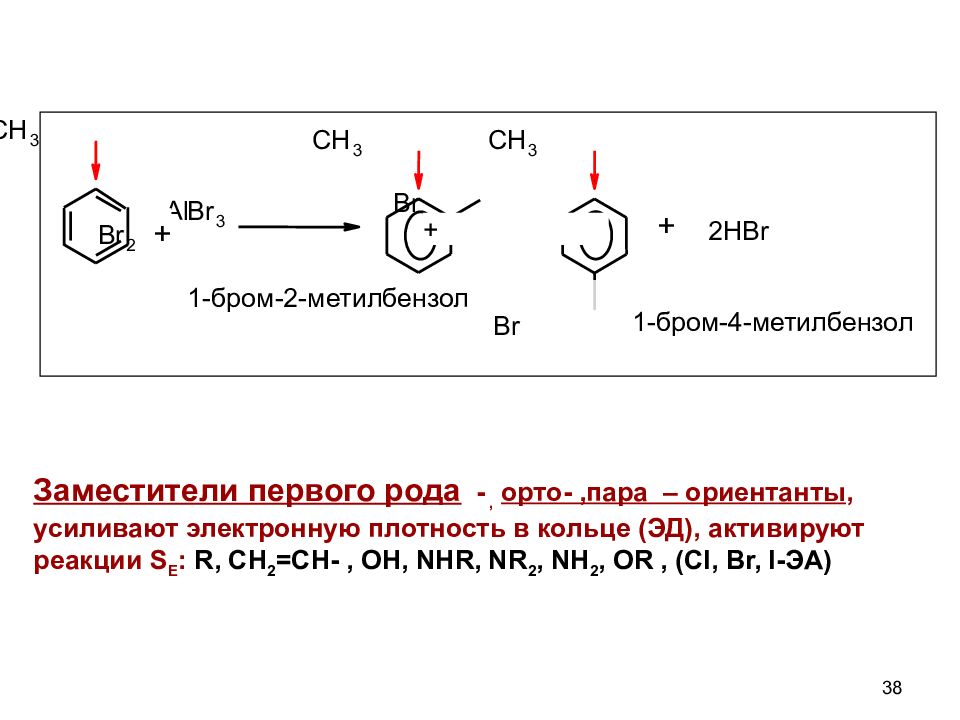
Слайд 38
38 C H 3 B r 2 Al B r 3 C H 3 C H 3 Br Br + 2HBr 1-бром-2-метилбензол 1-бром-4-метилбензол Заместители первого рода -, орто -,пара – ориентанты, усиливают электронную плотность в кольце (ЭД), активируют реакции S Е : R, CH 2 =CH-, OH, NHR, NR 2, NH 2, OR, ( Cl, Br, I -ЭА ) + +
Слайд 39
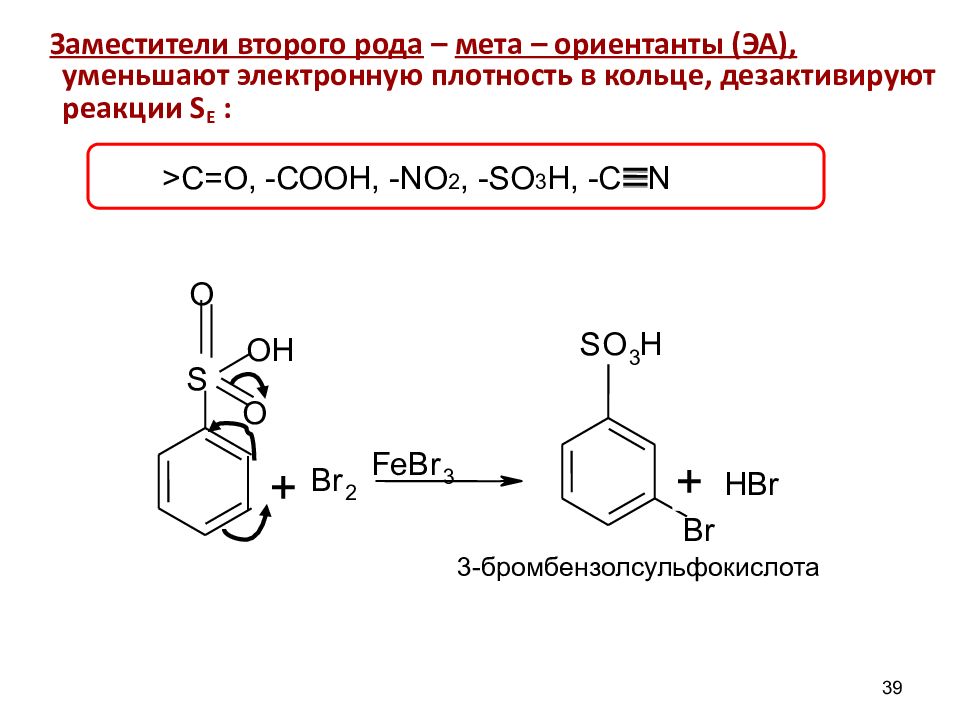
S O H O O B r 2 F e B r 3 Br S O 3 H + + HBr 39 Заместители второго рода – мета – ориентанты (ЭА), уменьшают электронную плотность в кольце, дезактивируют реакции S E : 3- бромбензолсульфокислота >C= О, -СООН, - NO 2, - SO 3 H, -С N
Слайд 41
Фенолокислоты Фенолокислоты — это ароматические кислоты, в молекуле которых одновременно с карбоксильной группой имеется фенольный гидроксил. Наибольшую физиологическую активность проявляет - о-гидроксибензойная, или салициловая, 2- гидроксибензойная кислота (салициловая) 41
Слайд 42
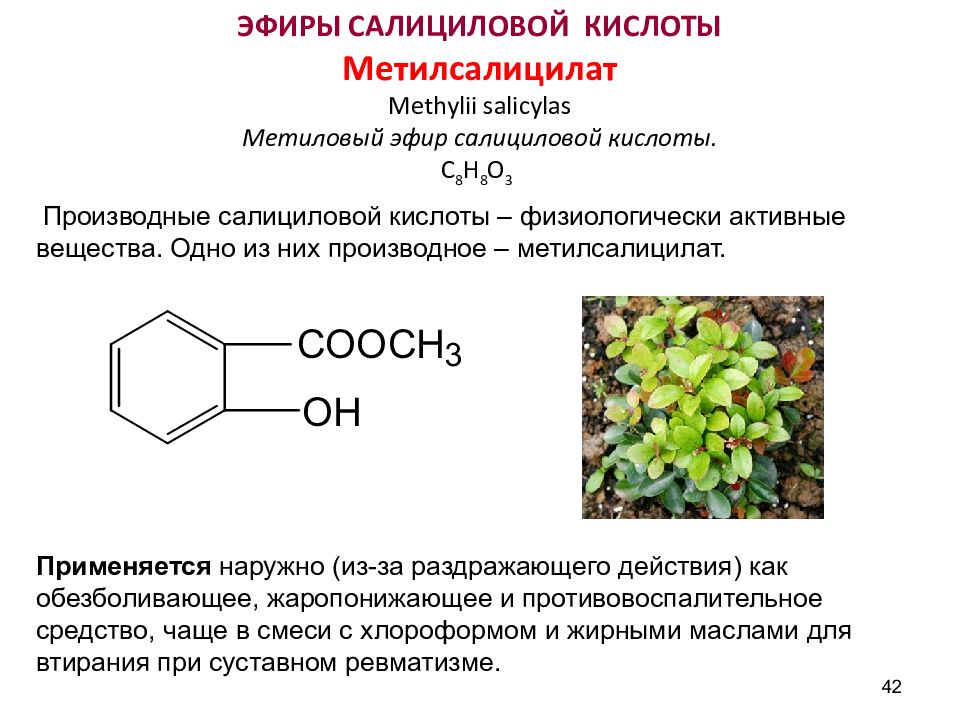
42 ЭФИРЫ САЛИЦИЛОВОЙ КИСЛОТЫ Метилсалицилат Methylii salicylas Метиловый эфир салициловой кислоты. С 8 Н 8 О 3 Производные салициловой кислоты – физиологически активные вещества. Одно из них производное – метилсалицилат. Применяется наружно (из-за раздражающего действия) как обезболивающее, жаропонижающее и противовоспалительное средство, чаще в смеси с хлороформом и жирными маслами для втирания при суставном ревматизме.
Слайд 43
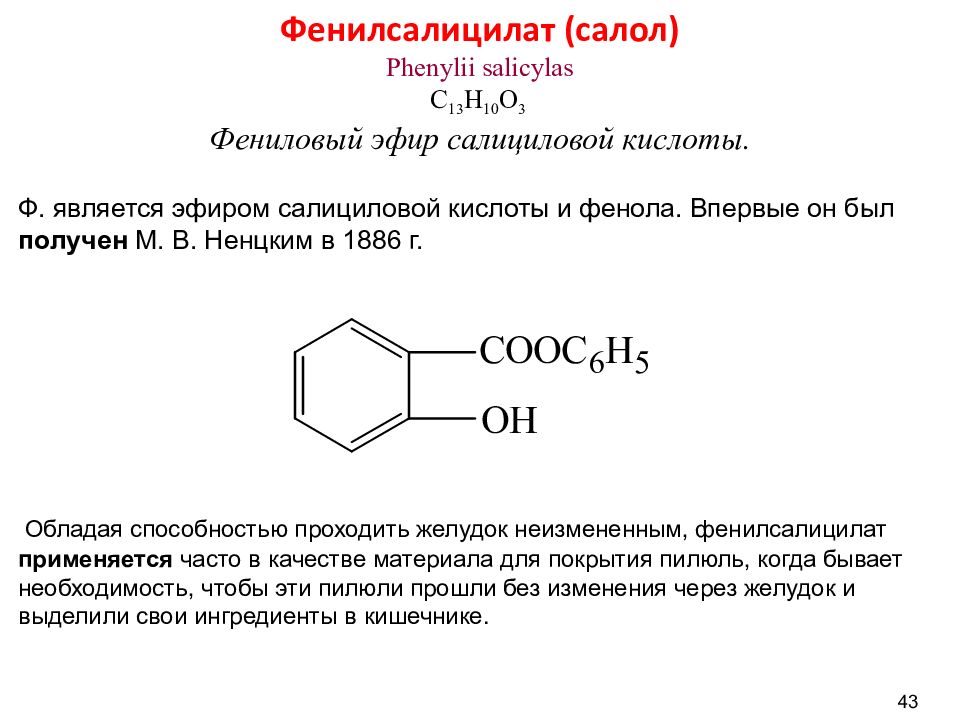
43 Фенилсалицилат ( салол) Phenylii salicylas C 13 H 10 O 3 Фениловый эфир салициловой кислоты. Ф. является эфиром салициловой кислоты и фенола. Впервые он был получен М. В. Ненцким в 1886 г. Обладая способностью проходить желудок неизмененным, фенилсалицилат применяется часто в качестве материала для покрытия пилюль, когда бывает необходимость, чтобы эти пилюли прошли без изменения через желудок и выделили свои ингредиенты в кишечнике.
Слайд 44
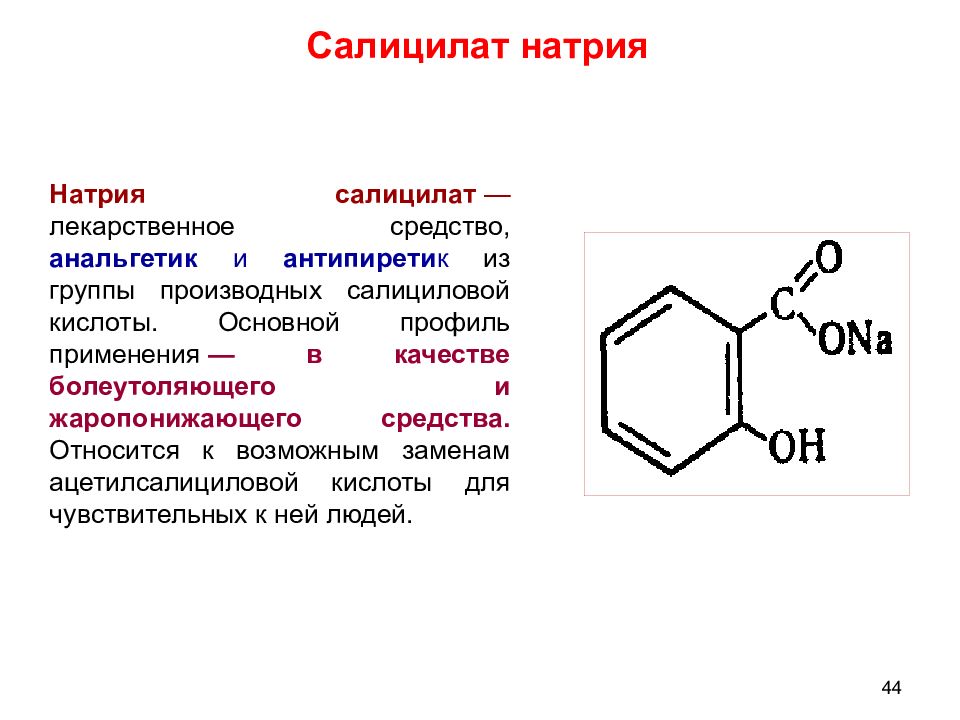
Натрия салицилат — лекарственное средство, анальгетик и антипирети к из группы производных салициловой кислоты. Основной профиль применения — в качестве болеутоляющего и жаропонижающего средства. Относится к возможным заменам ацетилсалициловой кислоты для чувствительных к ней людей. Салицилат натрия 44
Слайд 45
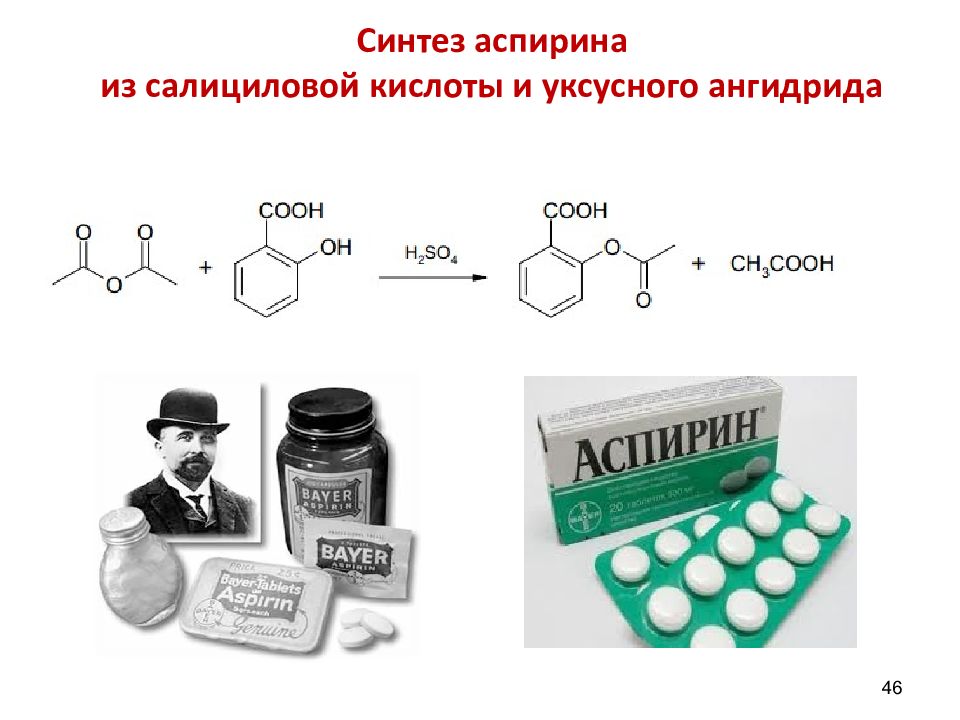
45 Ацетилсалициловая кислота (аспирин) Acidum acetylsalicylicum C 9 H 8 O 4 2-( ацетилокси )-бензойная кислота. Салициловая кислота впервые была получена путем окисления салицилового альдегида, содержавшегося в растении Таволге (род Spireae ). Отсюда её первоначальное название – спировая кислота, с которым связано название аспирин («а» обозначает ацетил). Ацетилсалициловая кислота в природе не найдена.
Слайд 47
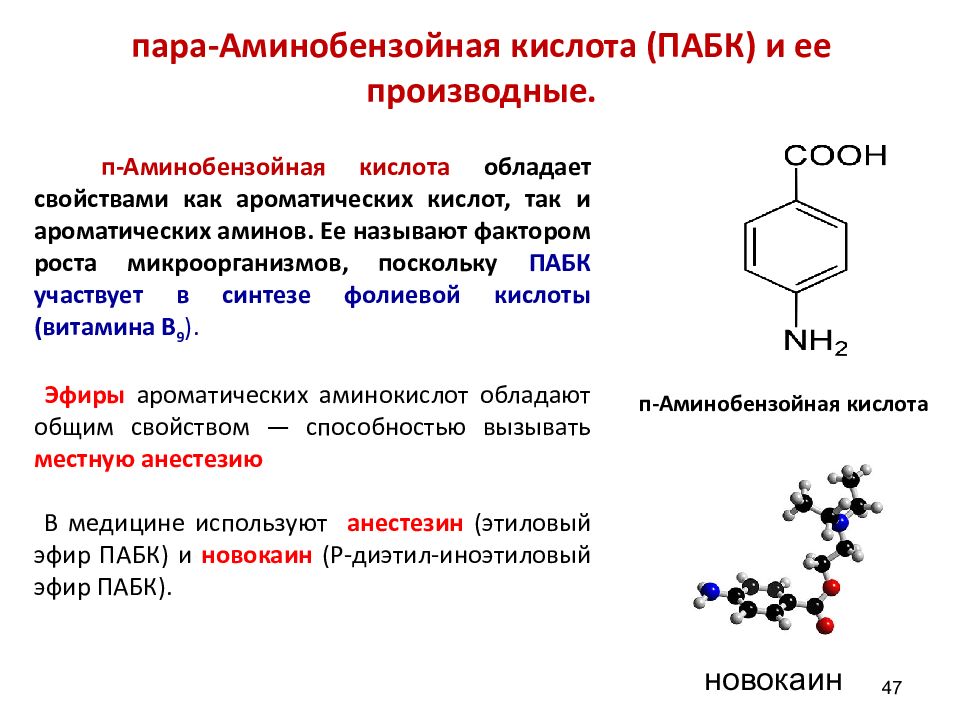
47 п-Аминобензойная кислота обладает свойствами как ароматических кислот, так и ароматических аминов. Ее называют фактором роста микроорганизмов, поскольку ПАБК участвует в синтезе фолиевой кислоты (витамина В 9 ). Эфиры ароматических аминокислот обладают общим свойством — способностью вызывать местную анестезию В медицине используют анестезин (этиловый эфир ПАБК) и новокаин ( Р-диэтил-иноэтиловый эфир ПАБК). пара-Аминобензойная кислота (ПАБК) и ее производные. новокаин п-Аминобензойная кислота
Слайд 48
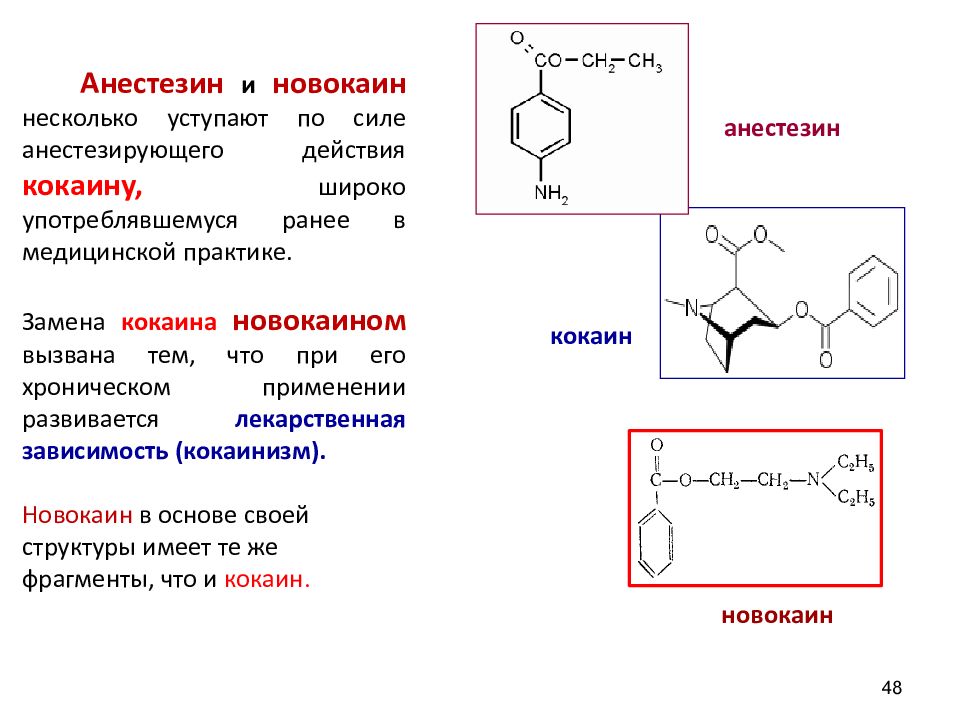
48 Анестезин и новокаин несколько уступают по силе анестезирующего действия кокаину, широко употреблявшемуся ранее в медицинской практике. Замена кокаина новокаином вызвана тем, что при его хроническом применении развивается лекарственная зависимость (кокаинизм). Новокаин в основе своей структуры имеет те же фрагменты, что и кокаин. кокаин новокаин анестезин
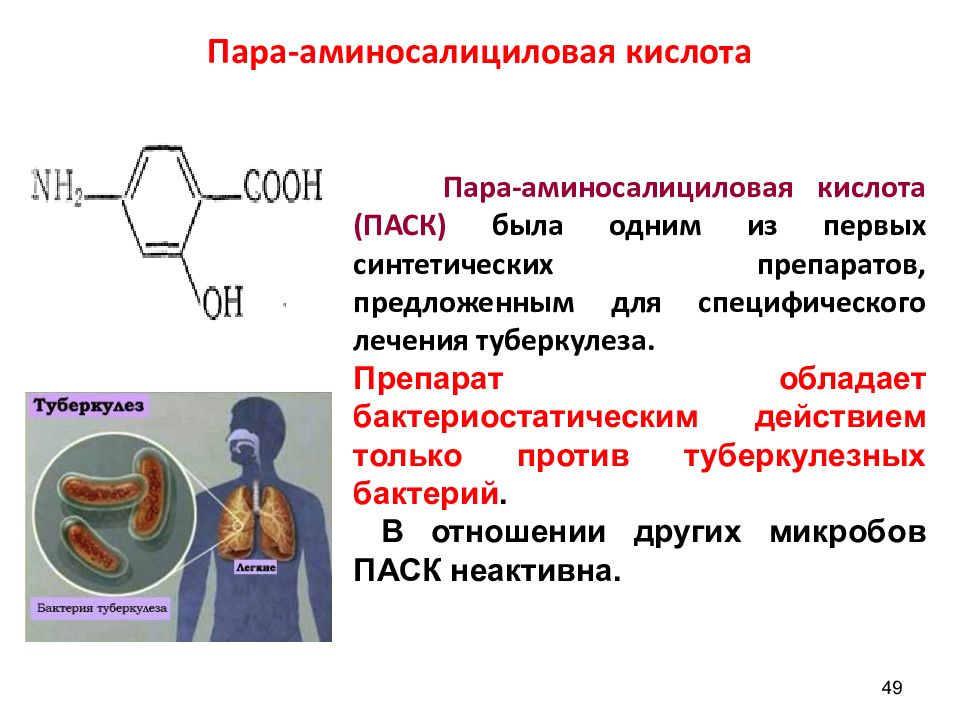
Слайд 49: Пара-аминосалициловая кислота
49 Пара-аминосалициловая кислота (ПАСК) была одним из первых синтетических препаратов, предложенным для специфического лечения туберкулеза. Препарат обладает бактериостатическим действием только против туберкулезных бактерий. В отношении других микробов ПАСК неактивна.
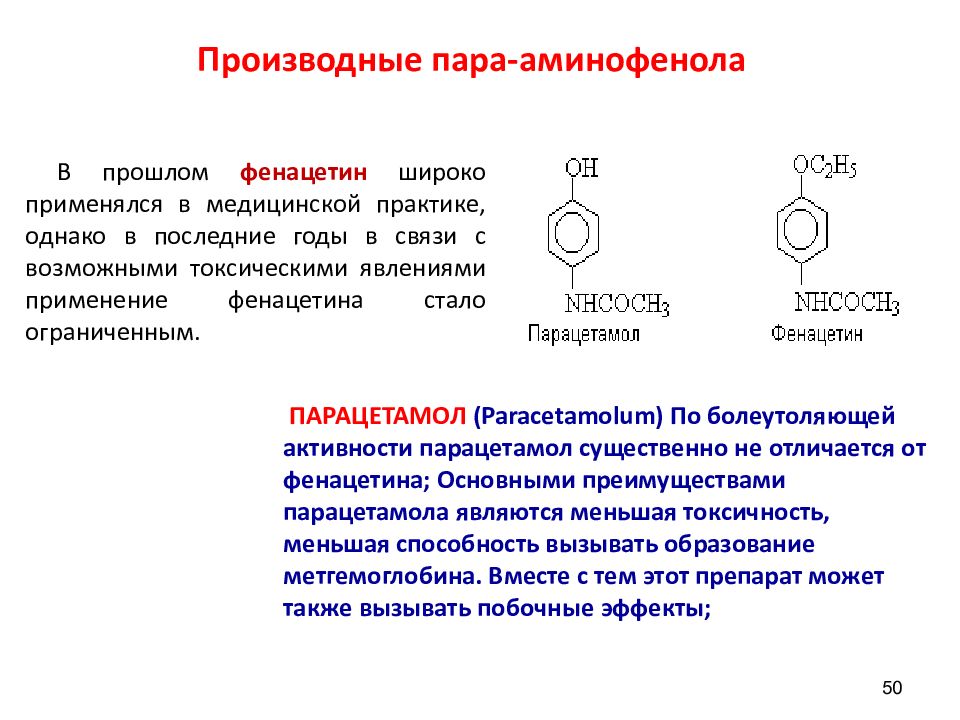
Слайд 50: Производные пара-аминофенола
50 В прошлом фенацетин широко применялся в медицинской практике, однако в последние годы в связи с возможными токсическими явлениями применение фенацетина стало ограниченным. ПАРАЦЕТАМОЛ ( Paracetamolum ) По болеутоляющей активности парацетамол существенно не отличается от фенацетина; Основными преимуществами парацетамола являются меньшая токсичность, меньшая способность вызывать образование метгемоглобина. Вместе с тем этот препарат может также вызывать побочные эффекты;
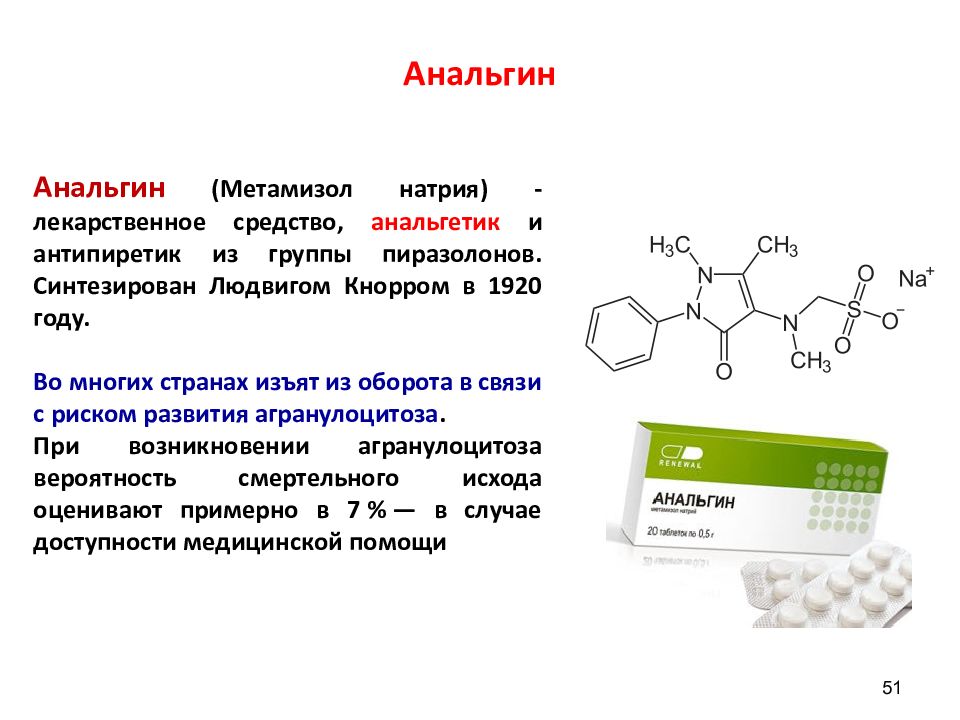
Слайд 51: Анальгин
51 Анальгин ( Метамизол натрия ) -лекарственное средство, анальгетик и антипиретик из группы пиразолонов. Синтезирован Людвигом Кнорром в 1920 году. Во многих странах изъят из оборота в связи с риском развития агранулоцитоза. При возникновении агранулоцитоза вероятность смертельного исхода оценивают примерно в 7 % — в случае доступности медицинской помощи
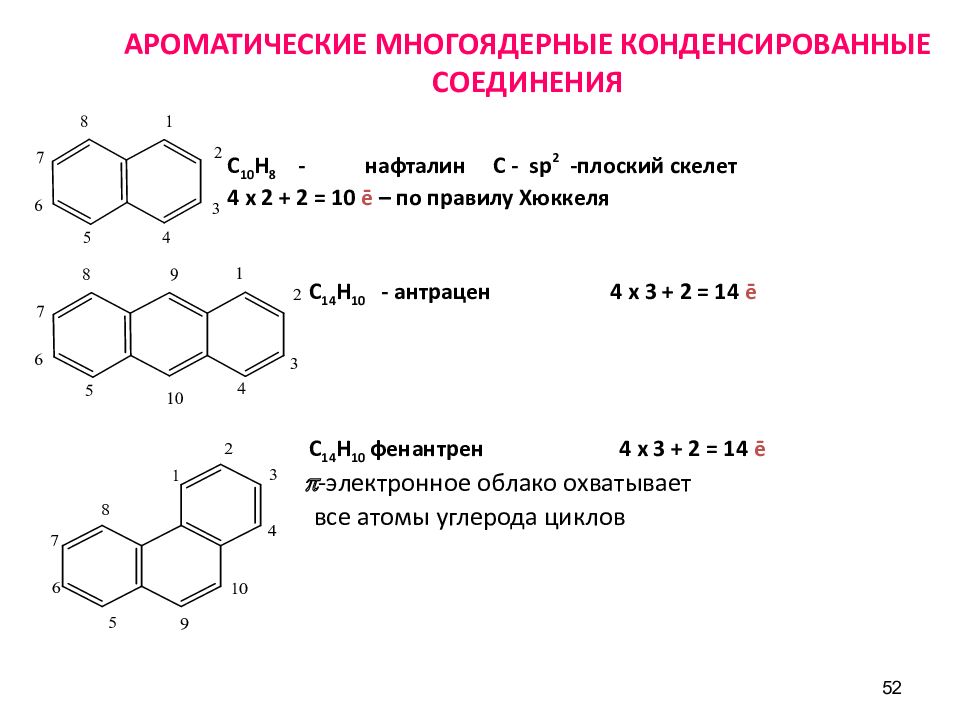
Слайд 52: АРОМАТИЧЕСКИЕ МНОГОЯДЕРНЫЕ КОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ
52 АРОМАТИЧЕСКИЕ МНОГОЯДЕРНЫЕ КОНДЕНСИРОВАННЫЕ СОЕДИНЕНИЯ С 10 Н 8 - нафталин С - sp 2 -плоский скелет 4 х 2 + 2 = 10 ē – по правилу Хюккеля С 14 Н 10 - антрацен 4 х 3 + 2 = 14 ē С 14 Н 10 фенантрен 4 х 3 + 2 = 14 ē p -электронное облако охватывает все атомы углерода циклов
Слайд 53
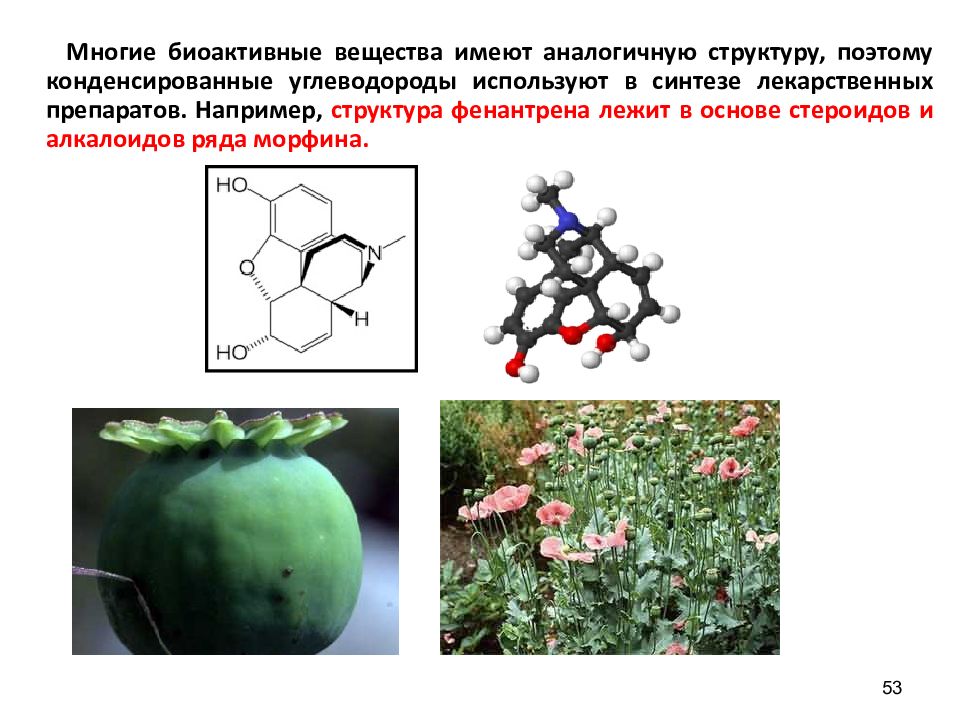
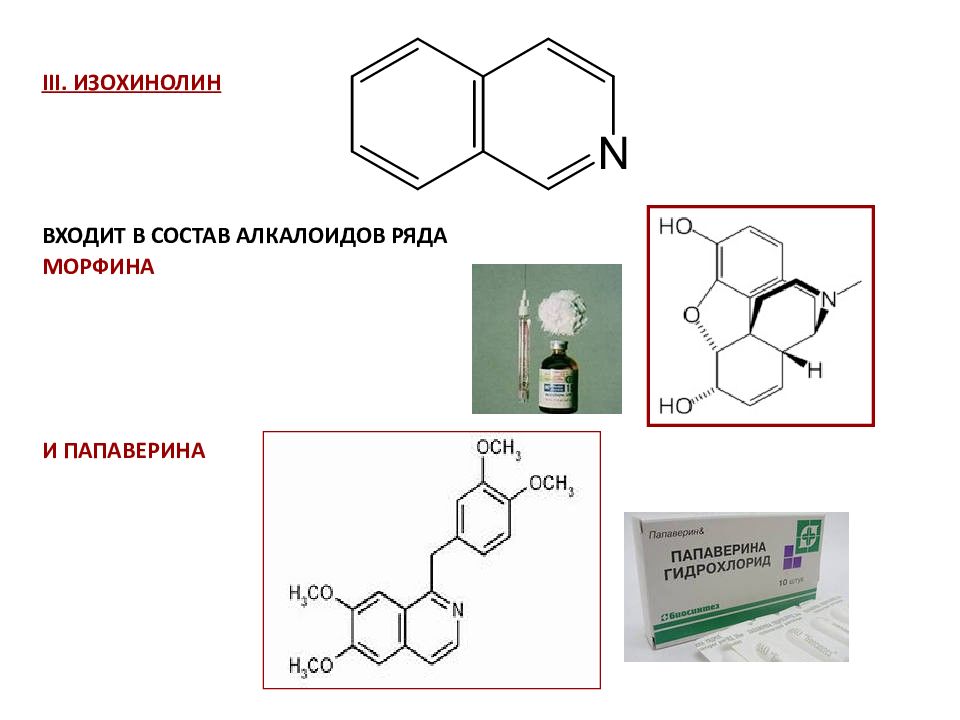
53 Многие биоактивные вещества имеют аналогичную структуру, поэтому конденсированные углеводороды используют в синтезе лекарственных препаратов. Например, структура фенантрена лежит в основе стероидов и алкалоидов ряда морфина.
Слайд 54
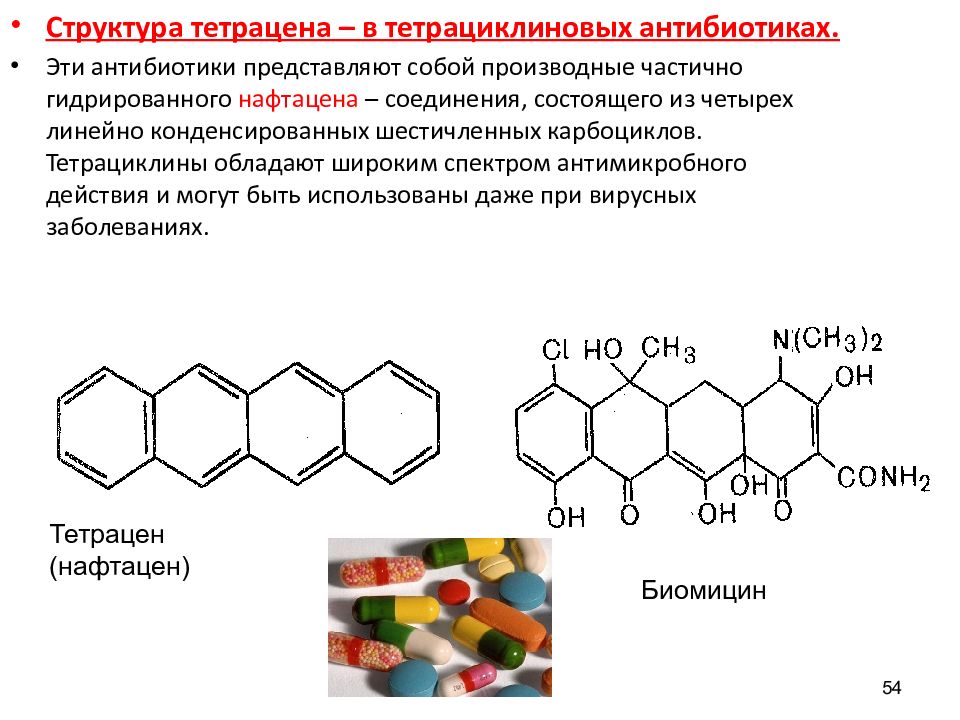
54 Структура тетрацена – в тетрациклиновых антибиотиках. Эти антибиотики представляют собой производные частично гидрированного нафтацена – соединения, состоящего из четырех линейно конденсированных шестичленных карбоциклов. Тетрациклины обладают широким спектром антимикробного действия и могут быть использованы даже при вирусных заболеваниях. Тетрацен (нафтацен) Биомицин
Слайд 55
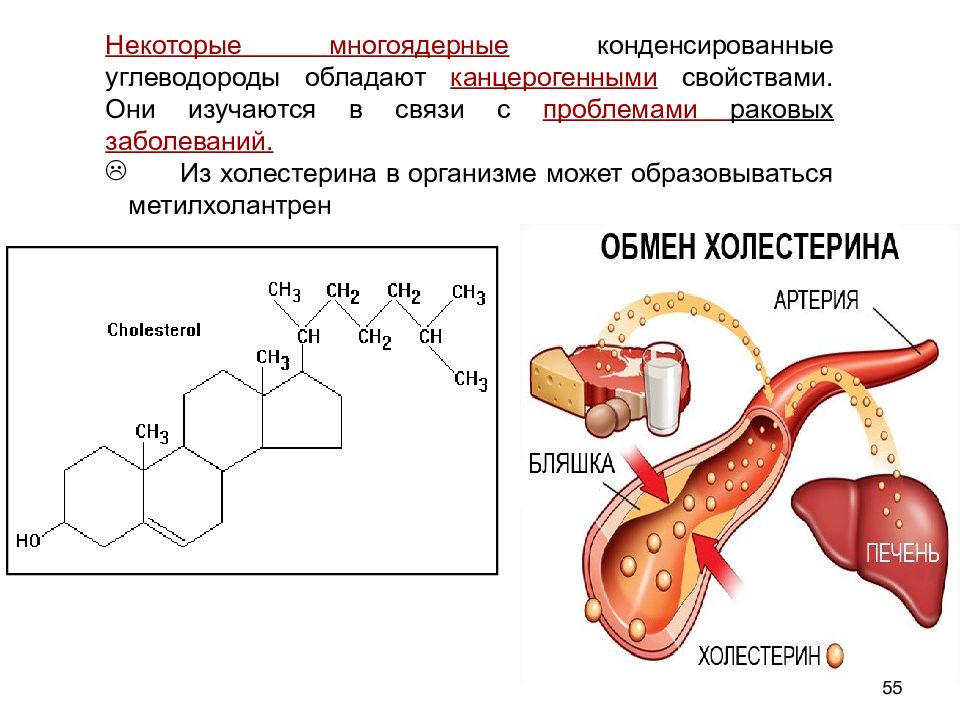
Некоторые многоядерные конденсированные углеводороды обладают канцерогенными свойствами. Они изучаются в связи с проблемами раковых заболеваний. Из холестерина в организме может образовываться метилхолантрен 55
Слайд 56
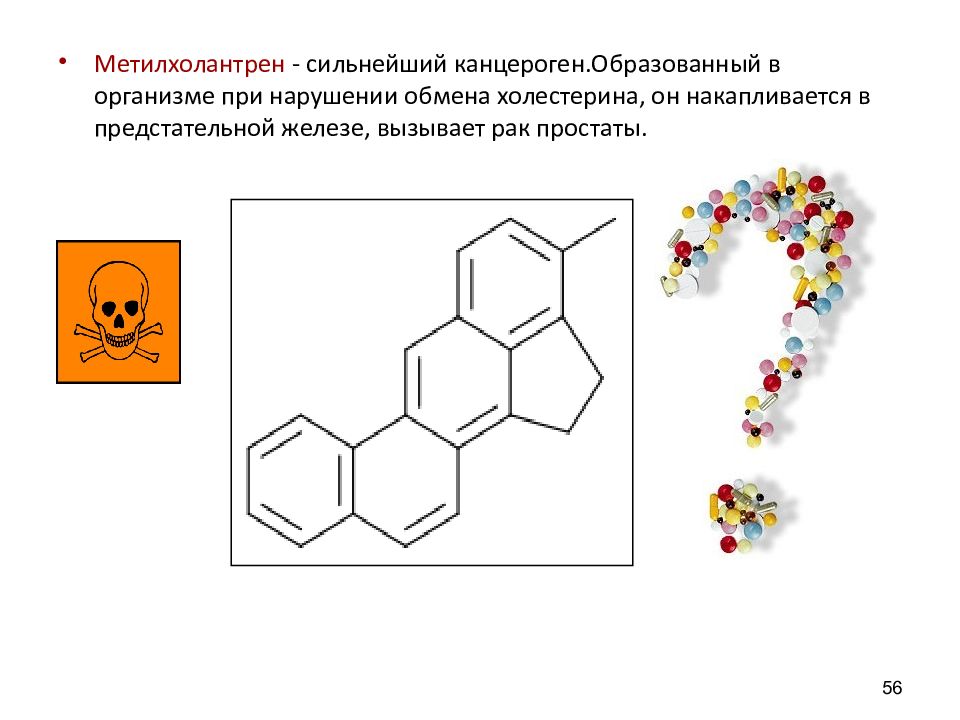
Метилхолантрен - сильнейший канцероген.Образованный в организме при нарушении обмена холестерина, он накапливается в предстательной железе, вызывает рак простаты. 56
Слайд 57
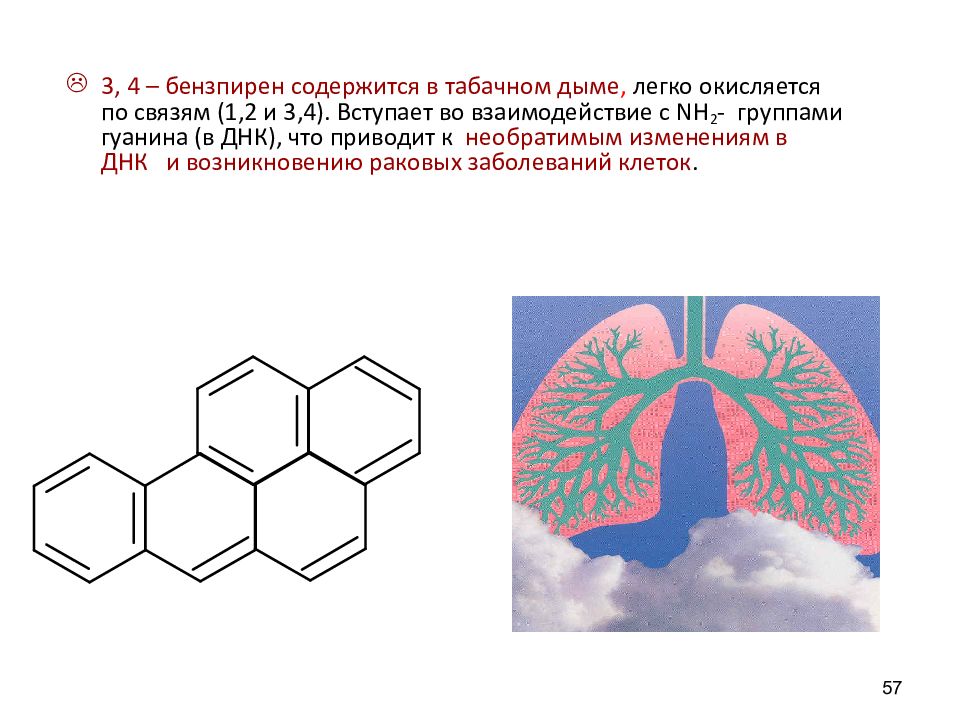
3, 4 – бензпирен содержится в табачн o м дыме, легко окисляется по связям (1,2 и 3,4). Вступает во взаимодействие с NH 2 - группами гуанина (в ДНК), что приводит к необратимым изменениям в ДНК и возникновению раковых заболеваний клеток. 57
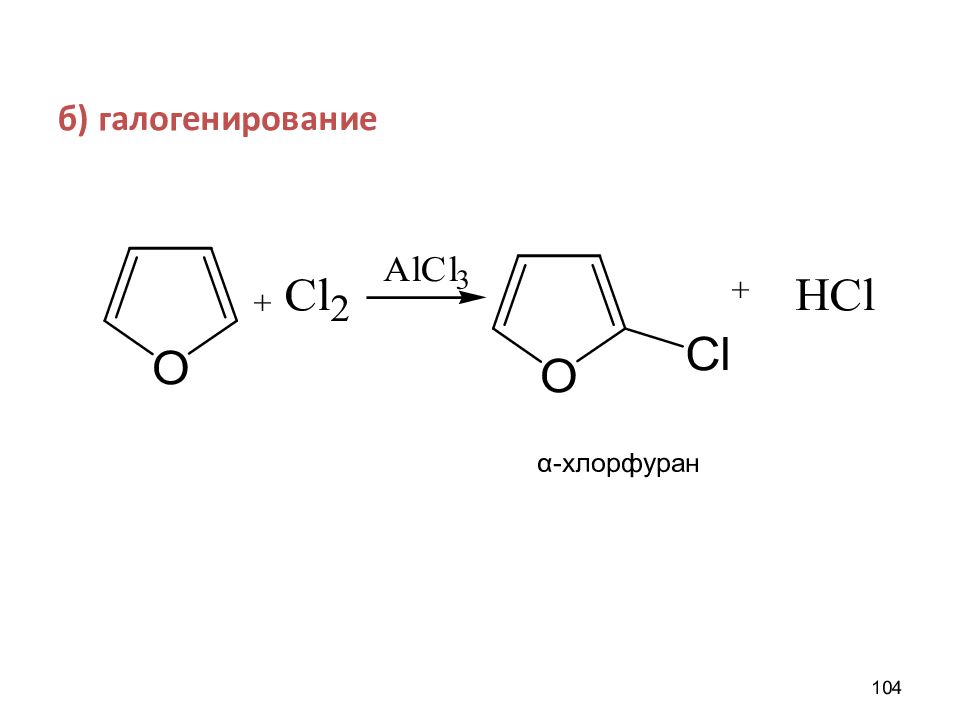
Слайд 58
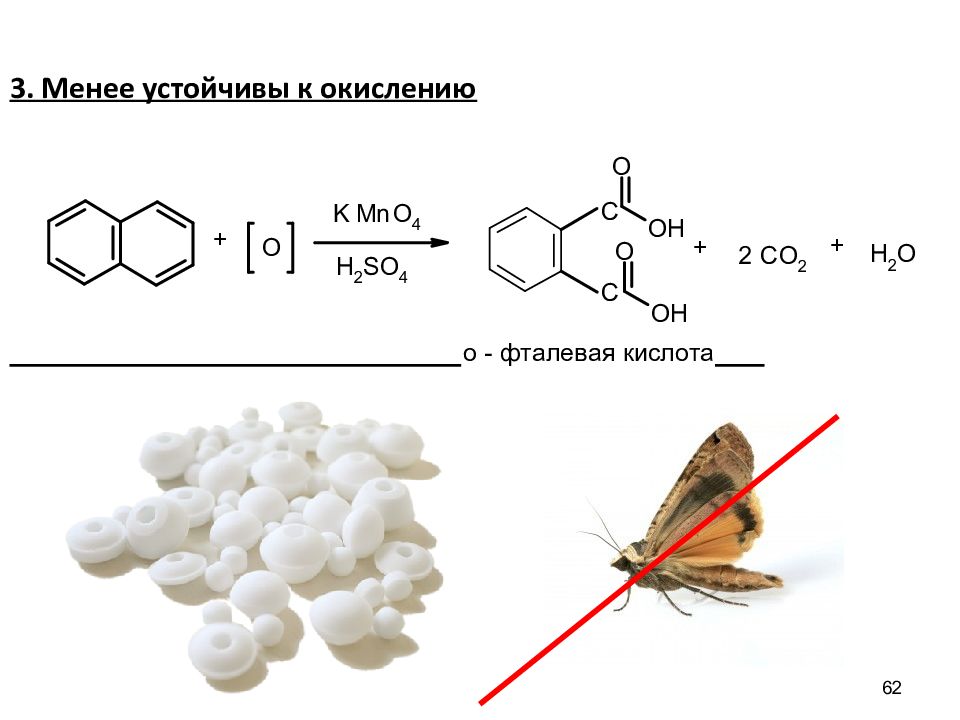
58 Химические свойства конденсированных систем Химические свойства подобны свойствам бензола, но в связи с неполной выравненностью электронной плотности имеют особенности: а) S Е протекают легче, чем в бензоле б) достаточно активны в реакциях присоединения и окисления
Слайд 59
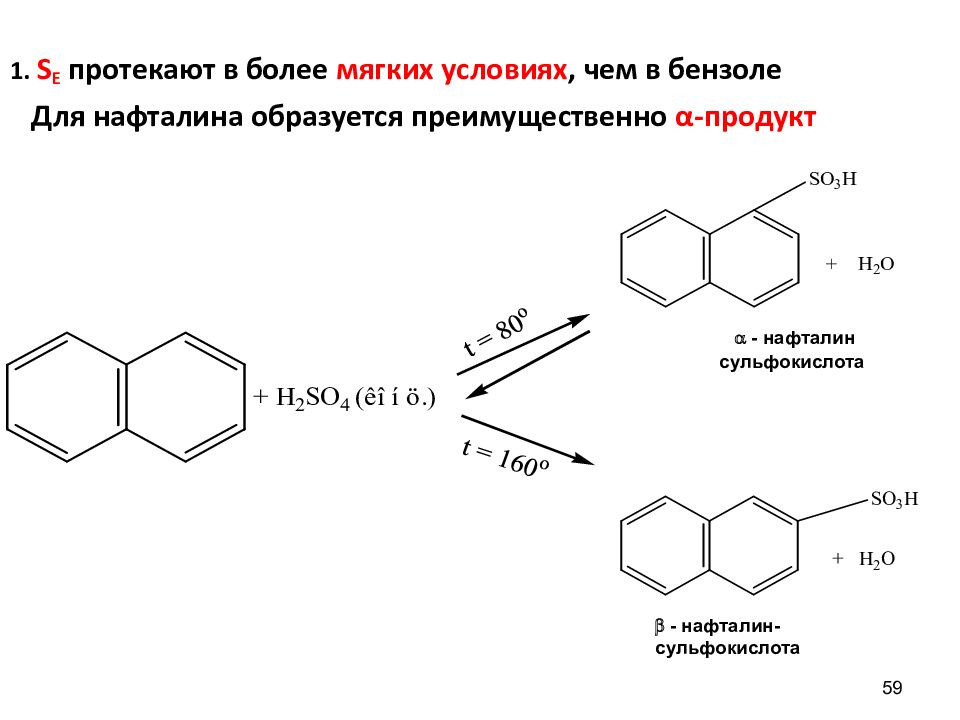
59 1. S Е протекают в более мягких условиях, чем в бензоле Для нафталина образуется преимущественно α -продукт - нафталин- сульфокислота - нафталин сульфокислота
Слайд 60: Замена сульфогруппы на гидроксильную в β – нафталинсульфокислоте приводит к образованию β – нафтола, который используется в медицине как дезинфицирующее средство
60 Замена сульфогруппы на гидроксильную в β – нафталинсульфокислоте приводит к образованию β – нафтола, который используется в медицине как дезинфицирующее средство.
Слайд 61
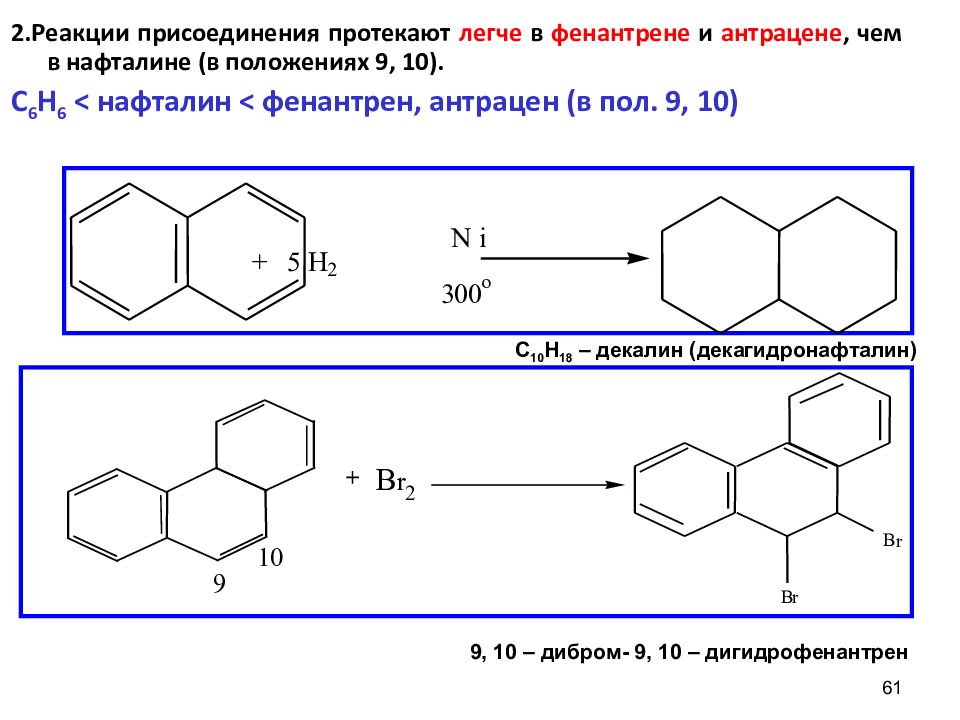
61 2. Реакции присоединения протекают легче в фенантрене и антрацене, чем в нафталине (в положениях 9, 10). C 6 H 6 < нафталин < фенантрен, антрацен (в пол. 9, 10) + 5 H 2 N i 3 0 0 o 9 10 + B r 2 B r B r C 10 H 18 – декалин (декагидронафталин) 9, 10 – дибром- 9, 10 – дигидрофенантрен
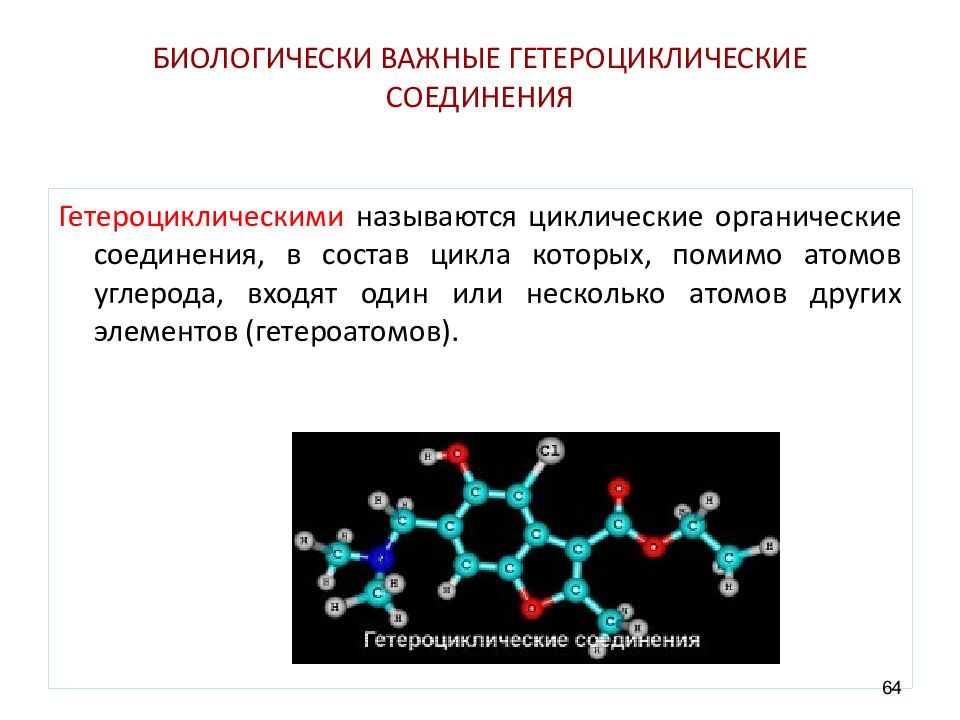
Слайд 64: БИОЛОГИЧЕСКИ ВАЖНЫЕ ГЕТЕРОЦИКЛИЧЕСКИЕ СОЕДИНЕНИЯ
Гетероциклическими называются циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов). 64
Слайд 65
Гетероциклические соединения Пятичленные гетероциклы ( p -избыточные) - С одним гетероатомом - С двумя гетероатомами Шестичленные гетероциклы ( p -недостаточные) - С одним гетероатомом - С двумя гетероатомами 65
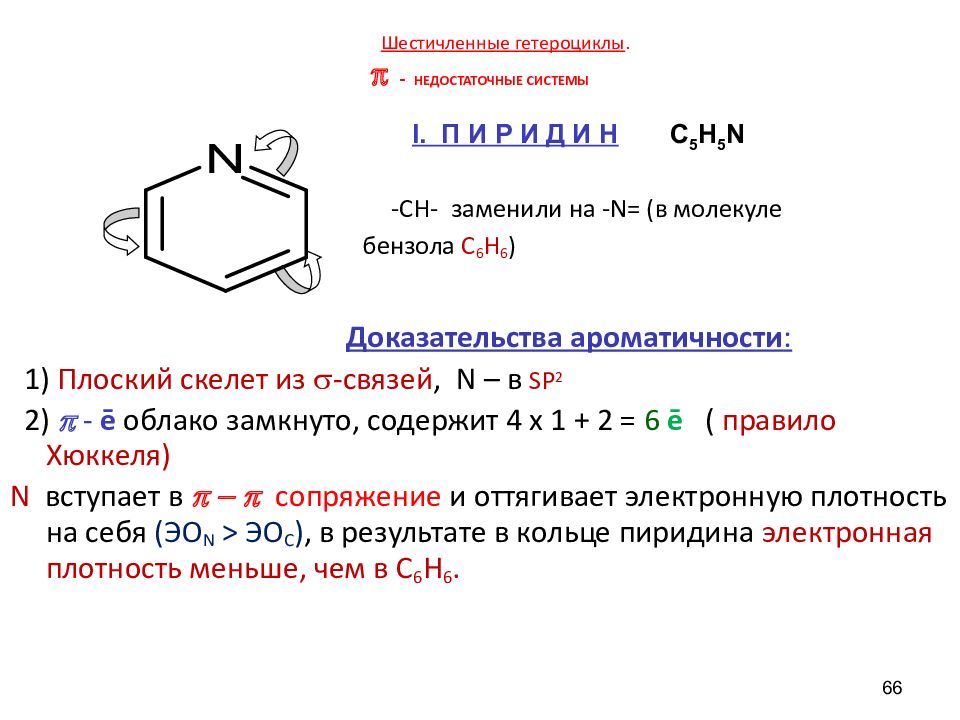
Слайд 66: Шестичленные гетероциклы. π - НЕДОСТАТОЧНЫЕ СИСТЕМЫ
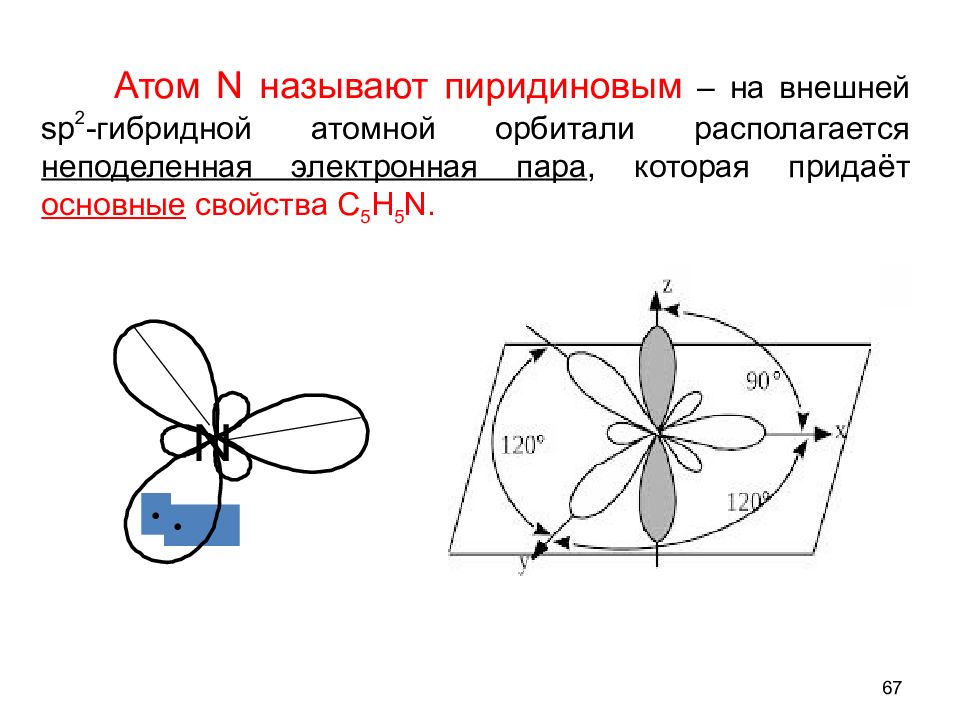
-СН- заменили на - N= (в молекуле бензола С 6 Н 6 ) Доказательства ароматичности : 1) Плоский скелет из -связей, N – в SP 2 2) p - ē облако замкнуто, содержит 4 х 1 + 2 = 6 ē ( правило Хюккеля) N вступает в p - p сопряжение и оттягивает электронную плотность на себя ( ЭО N > ЭО C ), в результате в кольце пиридина электронная плотность меньше, чем в С 6 Н 6. 66 I. П И Р И Д И Н C 5 H 5 N
Слайд 67
• • Атом N называют пиридиновым – на внешней sp 2 -гибридной атомной орбитали располагается неподеленная электронная пара, которая придаёт основные свойства С 5 Н 5 N. 67
Слайд 68
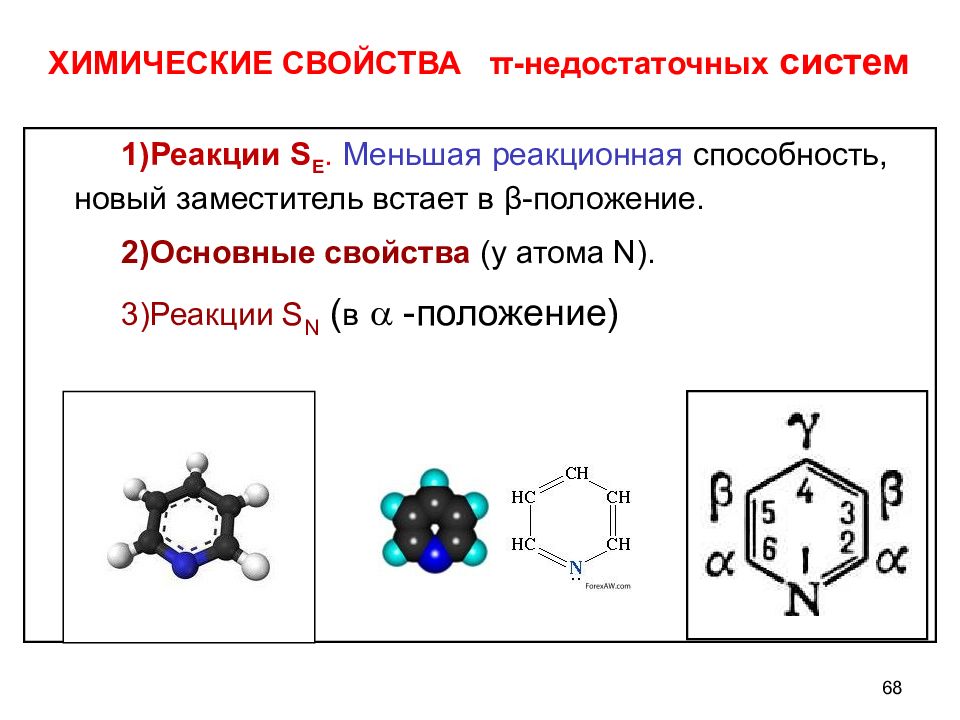
ХИМИЧЕСКИЕ СВОЙСТВА π -недостаточных систем Реакции S Е. Меньшая реакционная способность, новый заместитель встает в β -положение. Основные свойства (у атома N ). Реакции S N ( в -положение) 68
Слайд 69
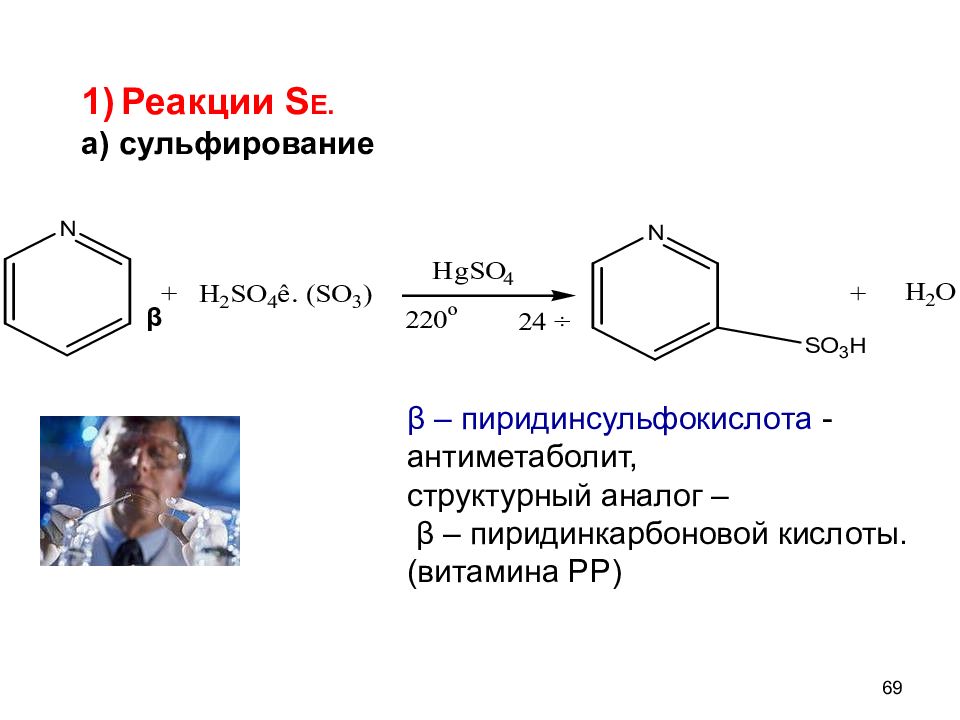
β β – пиридинсульфокислота - антиметаболит, структурный аналог – β – пиридинкарбоновой кислоты. (витамина РР) Реакции S Е. а) сульфирование 69
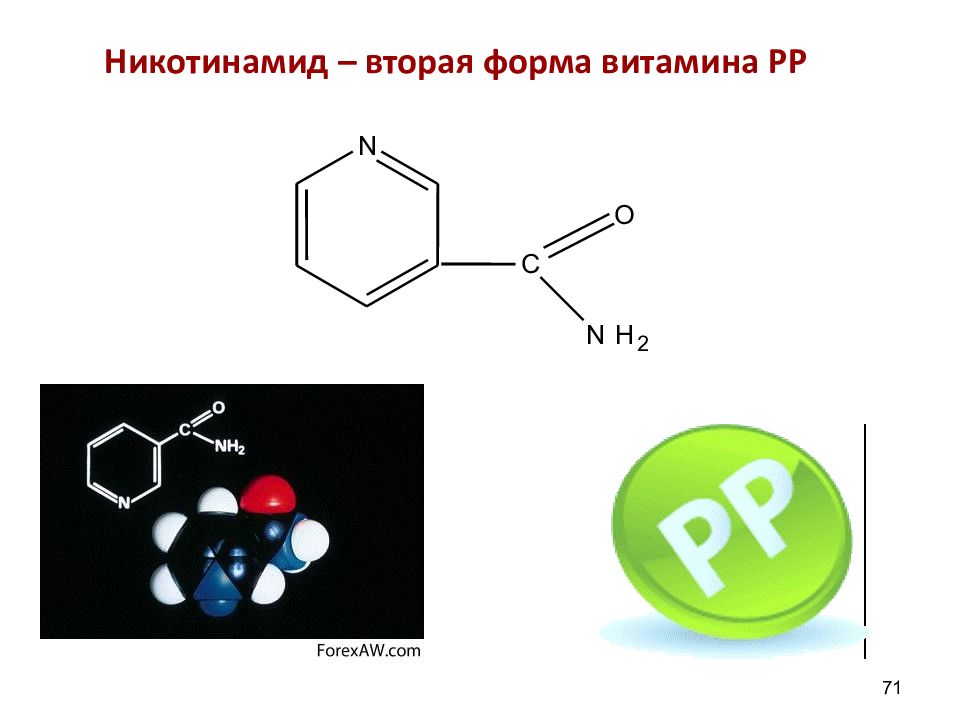
Слайд 70: β – пиридинкарбоновая кислота (Никотиновая к-та или витамин РР)
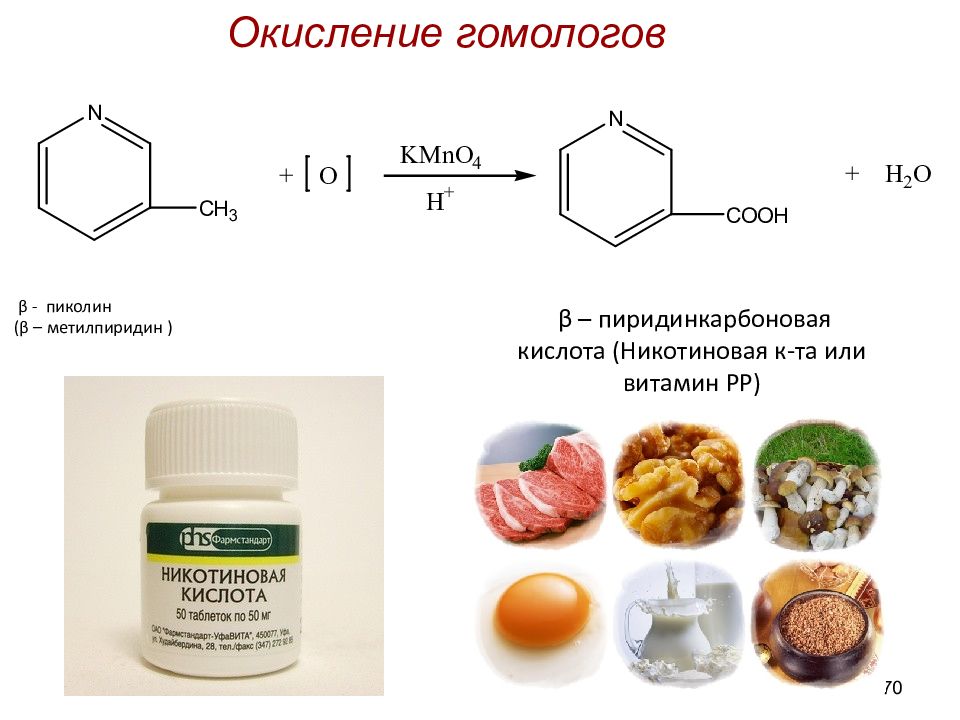
β - пиколин ( β – метилпиридин ) 70 Окисление гомологов
Слайд 72
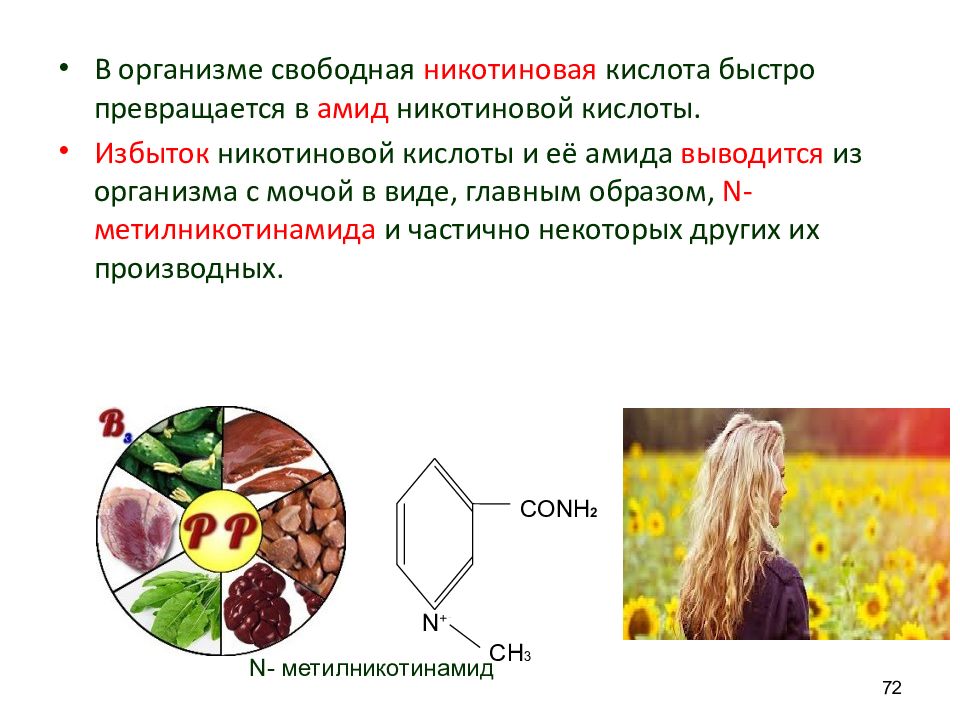
В организме свободная никотиновая кислота быстро превращается в амид никотиновой кислоты. Избыток никотиновой кислоты и её амида выводится из организма с мочой в виде, главным образом, N - метилникотинамида и частично некоторых других их производных. 72 N + CONH 2 CH 3 N - метилникотинамид
Слайд 73
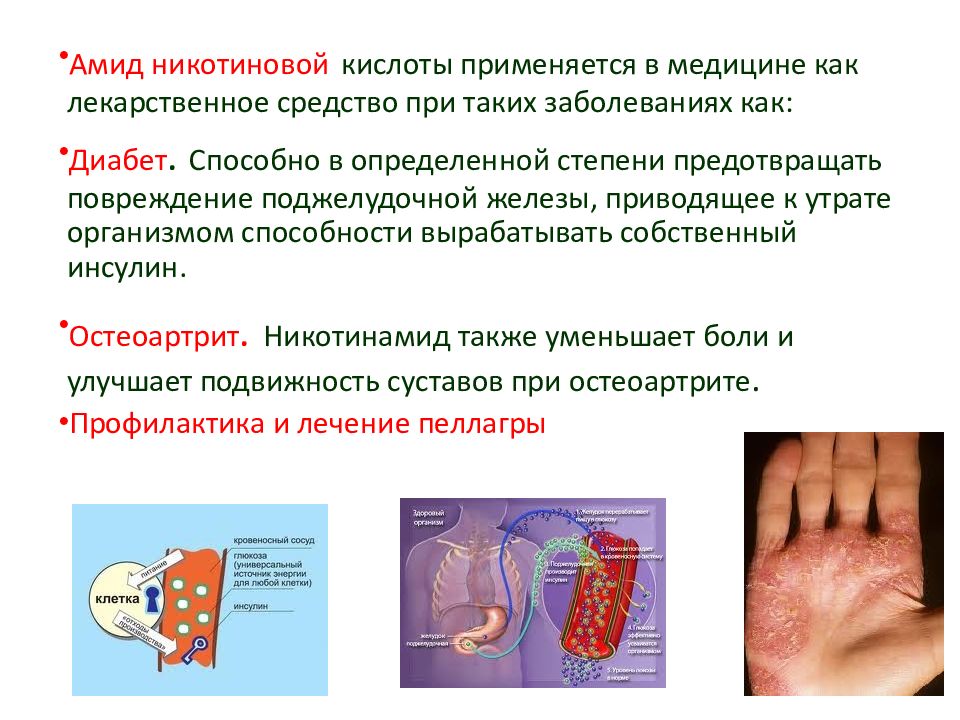
Амид никотиновой кислоты применяется в медицине как лекарственное средство при таких заболеваниях как: Диабет. Способно в определенной степени предотвращать повреждение поджелудочной железы, приводящее к утрате организмом способности вырабатывать собственный инсулин. Остеоартрит. Никотинамид также уменьшает боли и улучшает подвижность суставов при остеоартрите. Профилактика и лечение пеллагры 73
Слайд 74
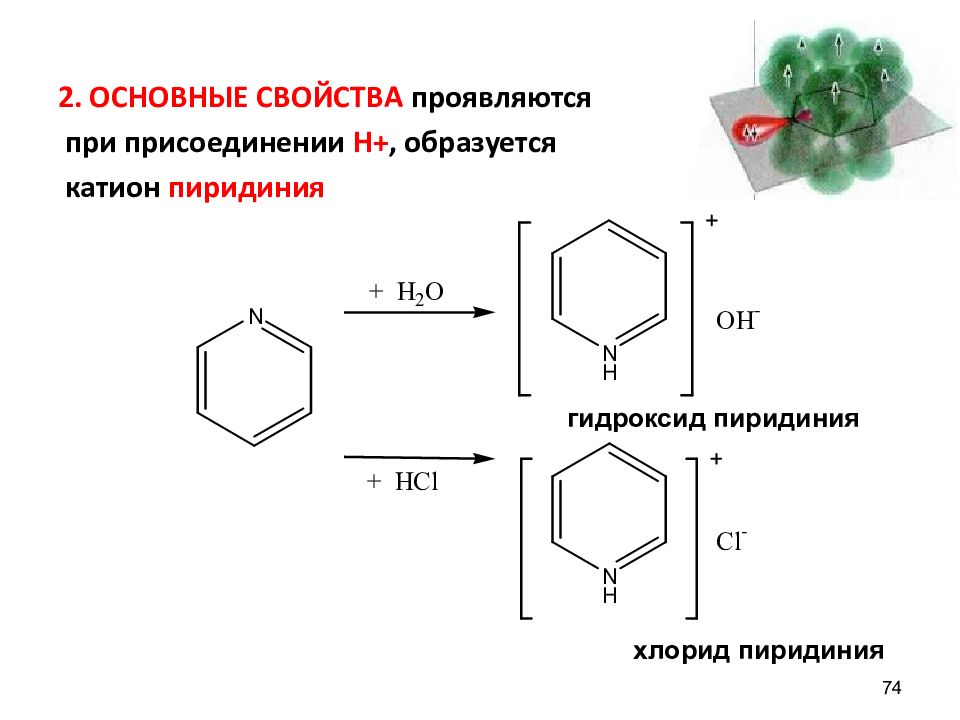
2. ОСНОВНЫЕ СВОЙСТВА проявляются при присоединении Н+, образуется катион пиридиния 74 гидроксид пиридиния хлорид пиридиния
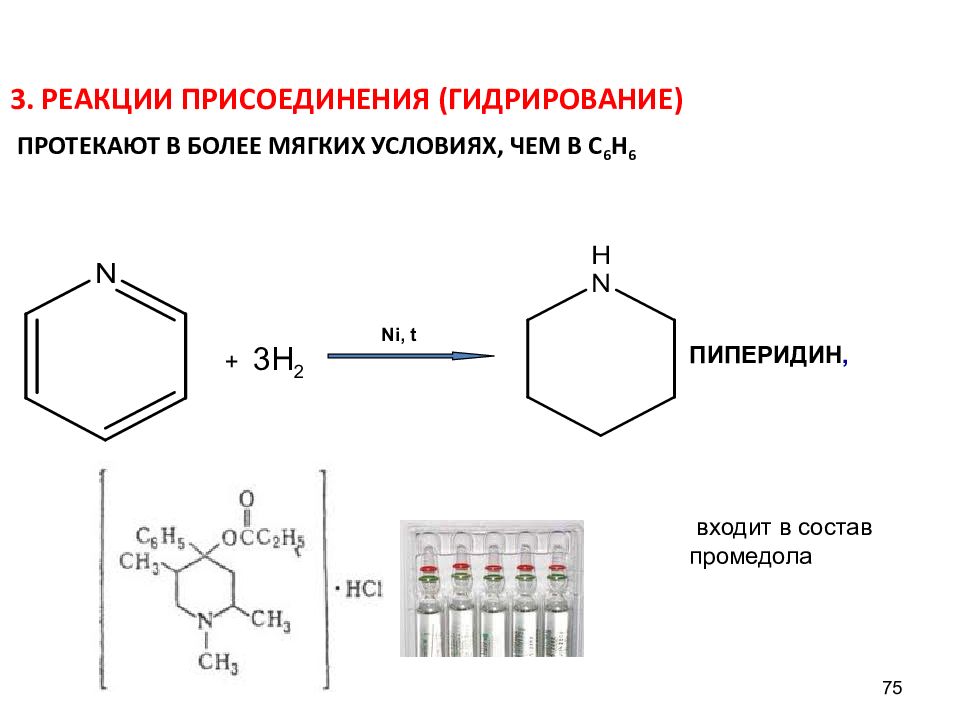
Слайд 75
3. РЕАКЦИИ ПРИСОЕДИНЕНИЯ (ГИДРИРОВАНИЕ) ПРОТЕКАЮТ В БОЛЕЕ МЯГКИХ УСЛОВИЯХ, ЧЕМ В С 6 Н 6 75 ПИПЕРИДИН, входит в состав промедола Ni, t + 3Н 2
Слайд 76: Пиперидин и пиридин
Встречаются во многих алкалоидах: никотин, кониин Алкалоиды – гетероциклические азотсодержащие основания растительного происхождения, обладающие выраженным физиологическим действием 76
Слайд 77: Кониин -производное пиперидина
77 Кониин -производное пиперидина яд, выделенный из болиголова: этим веществом был отравлен Сократ
Слайд 78
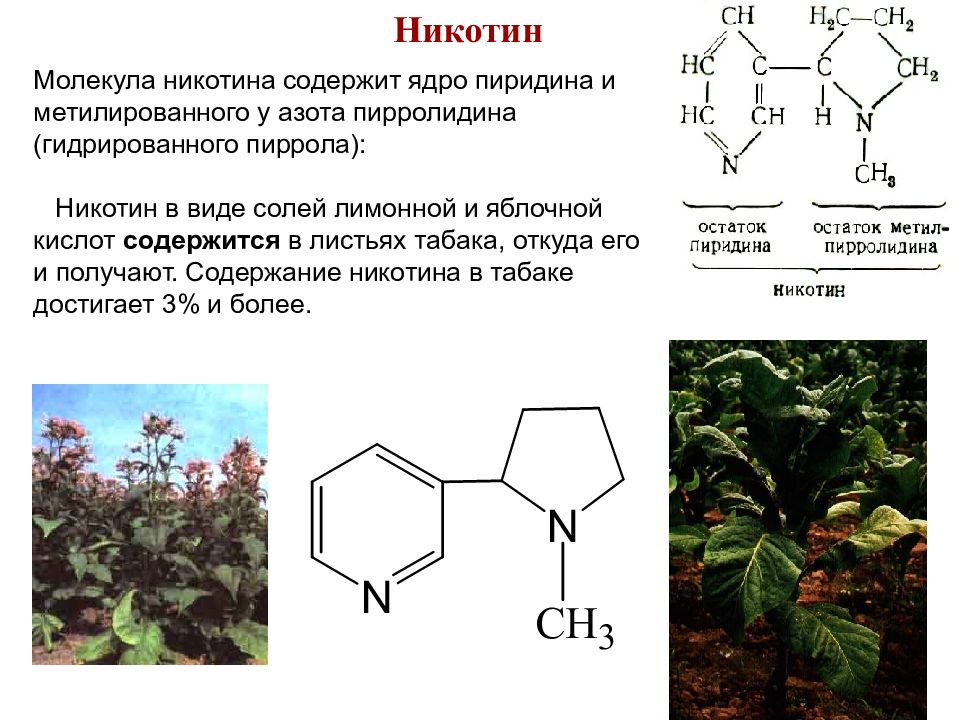
Никотин Молекула никотина содержит ядро пиридина и метилированного у азота пирролидина (гидрированного пиррола): Никотин в виде солей лимонной и яблочной кислот содержится в листьях табака, откуда его и получают. Содержание никотина в табаке достигает 3% и более. 78
Слайд 79
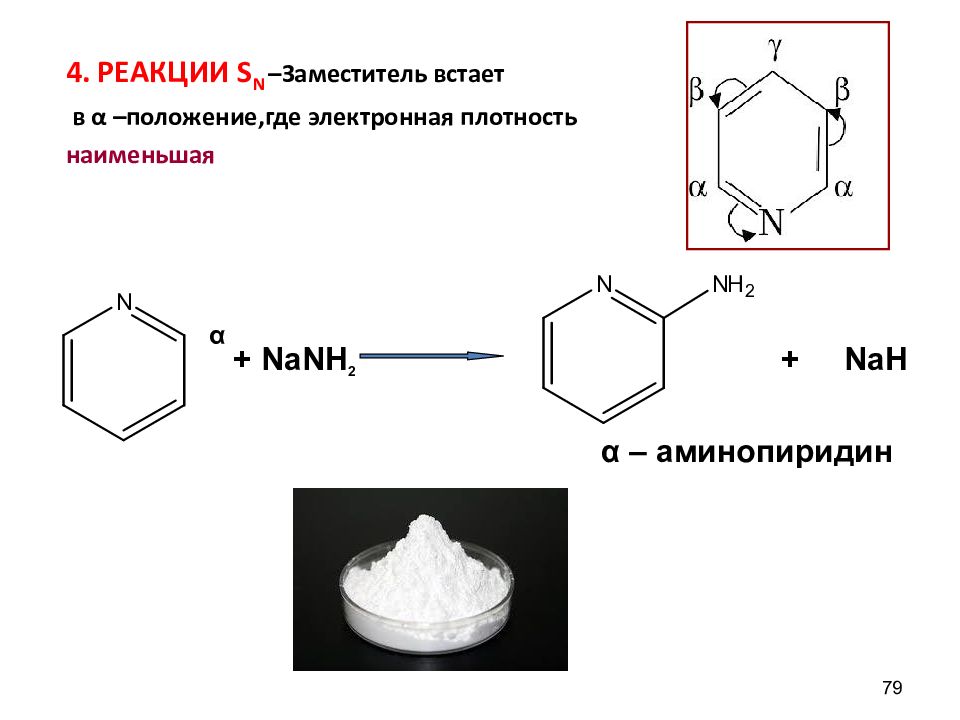
4. РЕАКЦИИ S N –Заместитель встает в α –положение,где электронная плотность наименьшая 79 α + NaNH 2 + NaH α – аминопиридин
Слайд 80: МЕДИКО-БИОЛОГИЧЕСКОЕ ЗНАЧЕНИЕ
ВДЫХАНИЕ ПАРОВ ПИРИДИНА МОЖЕТ ПРИВЕСТИ К ТЯЖЕЛОМУ ПОРАЖЕНИЮ НЕРВНОЙ СИСТЕМЫ ГОМОЛОГ ПИРИДИНА β – ПИКОЛИН ПРЕВРАЩАЕТСЯ В НИКОТИНОВУЮ КИСЛОТУ, НИКОТИНАМИД, КОТОРЫЕ ИЗВЕСТНЫ КАК ДВЕ ФОРМЫ ВИТАМИНА РР, ДИЭТИЛАМИД НИКОТИНОВОЙ КИСЛОТЫ – КОРДИАМИН – ЭФФЕКТИВНЫЙ СТИМУЛЯТОР ЦНС ПИПЕРИДИН ВХОДИТ В СОСТАВ ПРОМЕДОЛА, ВСТРЕЧАЕТСЯ ВО МНОГИХ алкалоидах. 80
Слайд 81
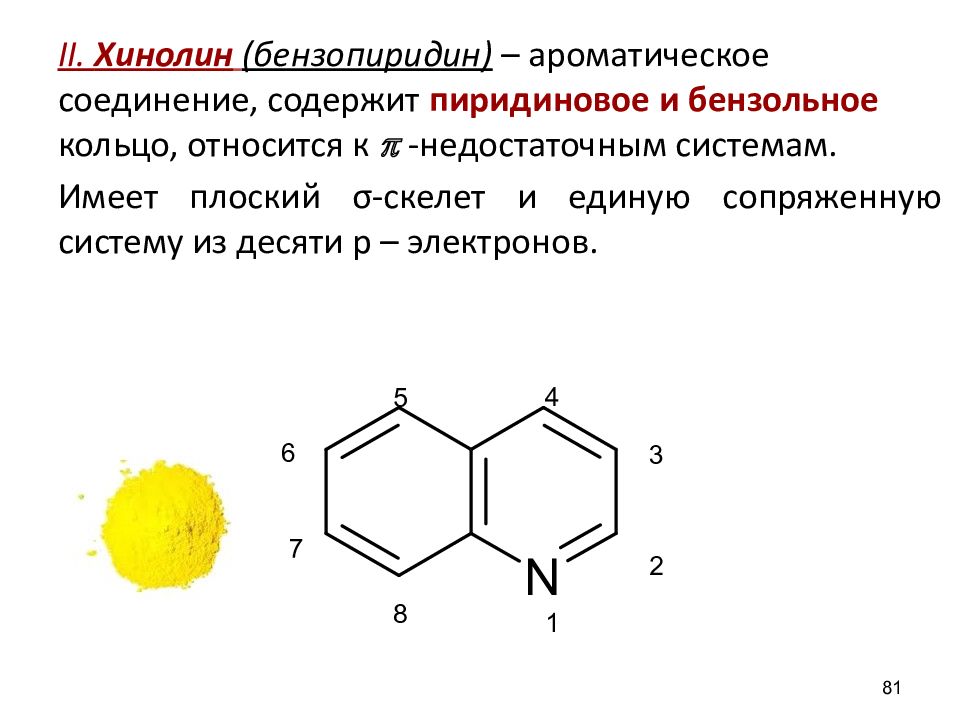
II. Хинолин ( бензопириди н ) – ароматическое соединение, содержит пиридиновое и бензольное кольцо, относится к p -недостаточным системам. Имеет плоский σ-скелет и единую сопряженную систему из десяти p – электронов. 81 1 2 3 4 5 6 7 8
Слайд 82: ОСОБЕННОСТИ ХИМИЧЕСКОГО ПОВЕДЕНИЯ ХИНОЛИНА
В реакциях S E атаке подвергается бензольное кольцо ( кольцо пиридина является p – недостаточным ). Замещение протекает в положении 5 или 8. 2) В реакции S N может вступать только p – недостаточное пиридиновое кольцо (положения 2 и 4 ). 82
Слайд 83
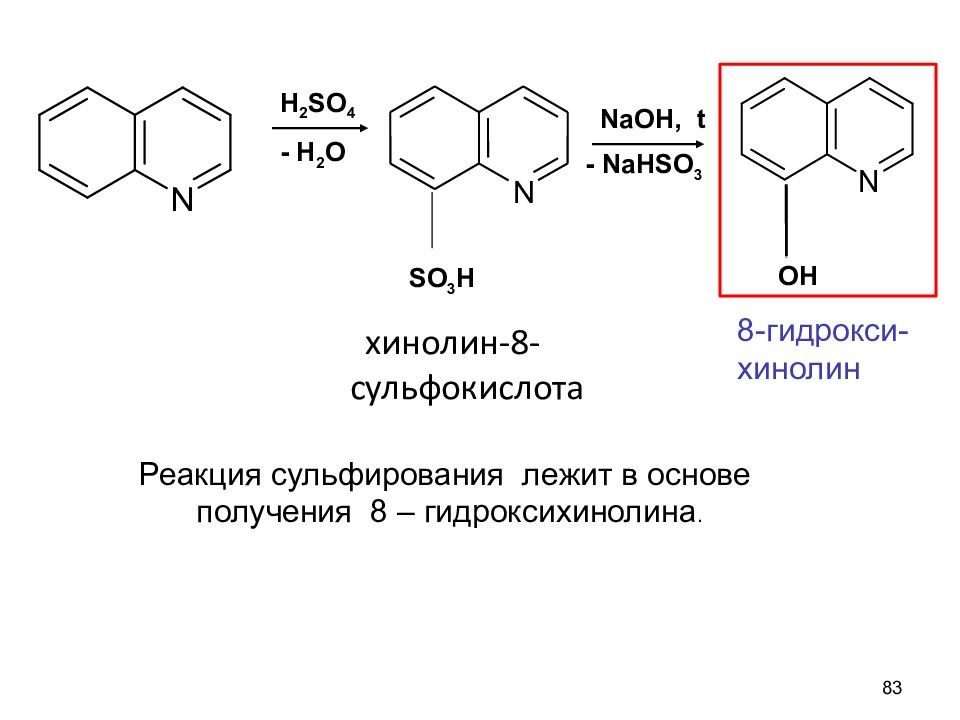
хинолин-8-сульфокислота 83 H 2 SO 4 - H 2 O NaOH, t - NaHSO 3 OH SO 3 H N Реакция сульфирования лежит в основе получения 8 – гидроксихинолина. 8-гидрокси-хинолин
Слайд 84
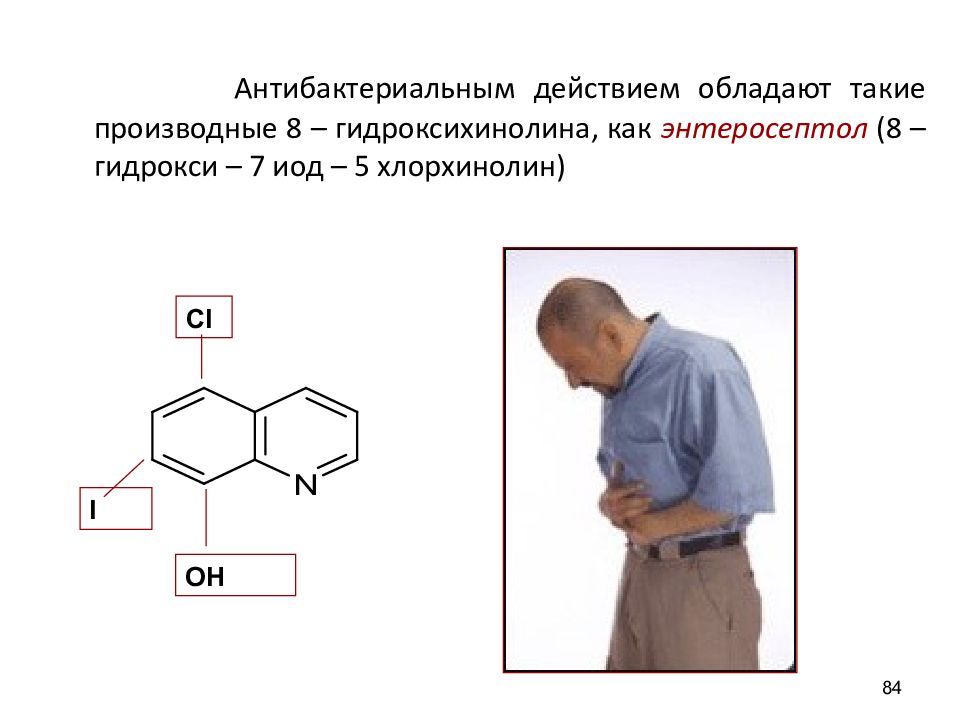
Антибактериальным действием обладают такие производные 8 – гидроксихинолина, как энтеросептол (8 – гидрокси – 7 иод – 5 хлорхинолин ) 84 OH I Cl
Слайд 85
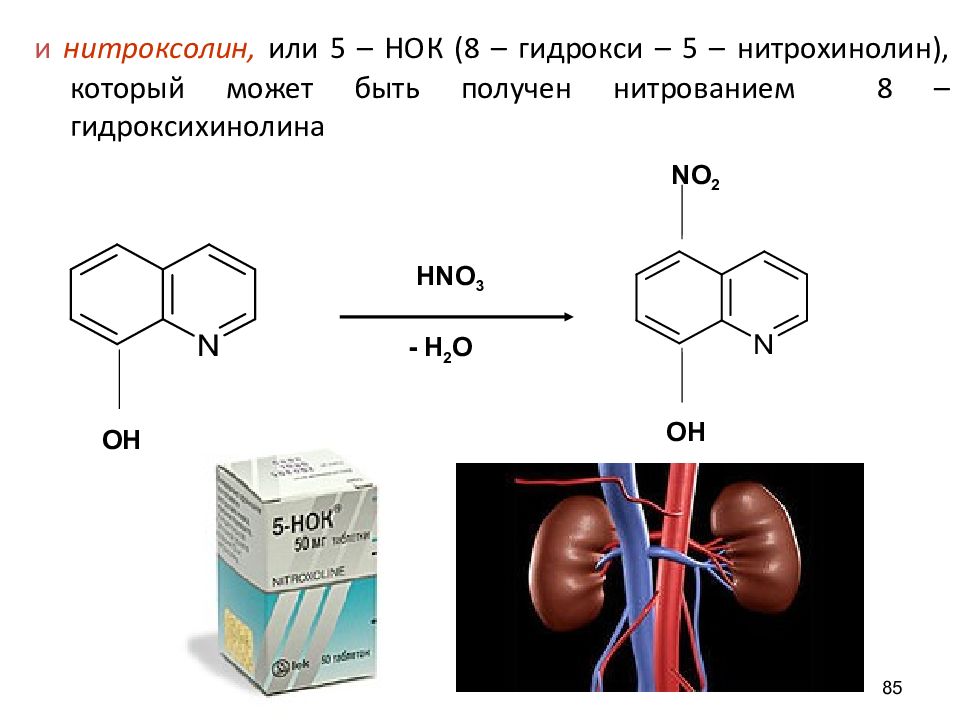
и нитроксолин, или 5 – НОК (8 – гидрокси – 5 – нитрохинолин ), который может быть получен нитрованием 8 – гидроксихинолина 85 OH OH NO 2 HNO 3 - H 2 O
Слайд 86
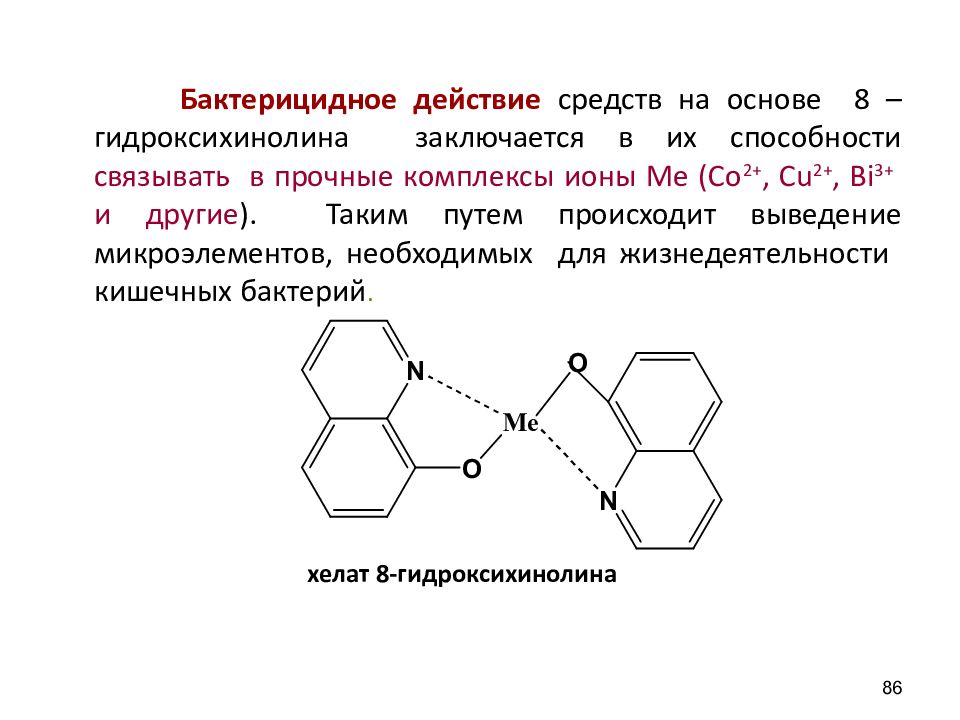
Бактерицидное действие средств на основе 8 – гидроксихинолина заключается в их способности связывать в прочные комплексы ионы Ме (Со 2+, С u 2+, Bi 3+ и другие ). Таким путем происходит выведение микроэлементов, необходимых для жизнедеятельности кишечных бактерий. хелат 8-гидроксихинолина 86
Слайд 88
Применяют морфин как болеутоляющее средство при травмах и различных заболеваниях, сопровождающихся сильными болевыми ощущениями. 88
Слайд 89
А так же при подготовке к операции, при бессоннице, иногда при сильном кашле. 89
Слайд 90
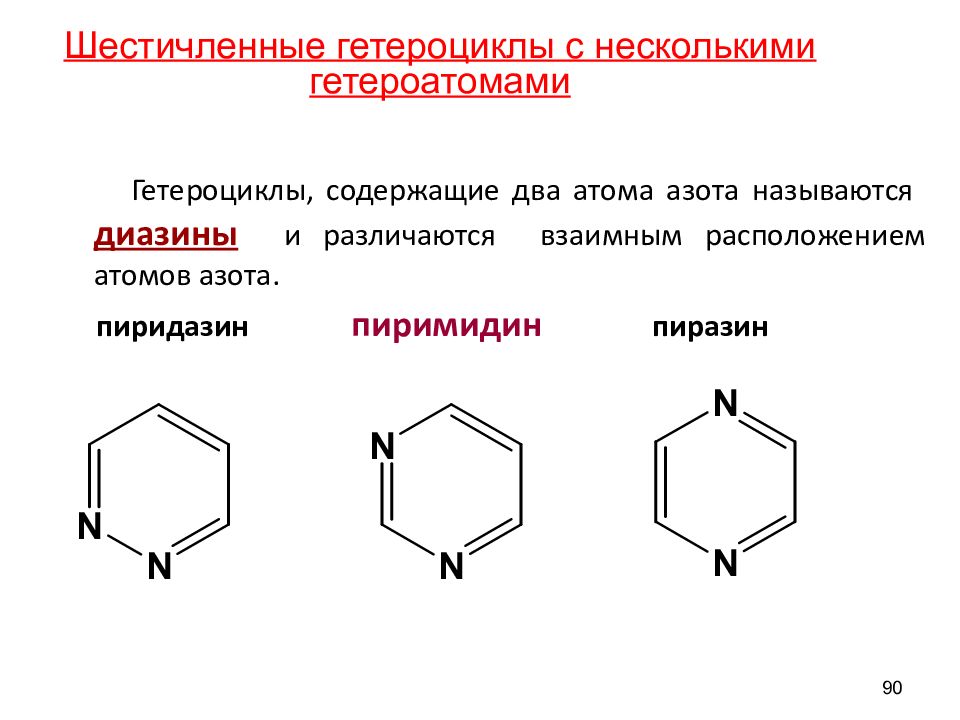
Гетероциклы, содержащие два атома азота называются диазины и различаются взаимным расположением атомов азота. пиридазин пиримидин пиразин 90 Шестичленные гетероциклы с несколькими гетероатомами
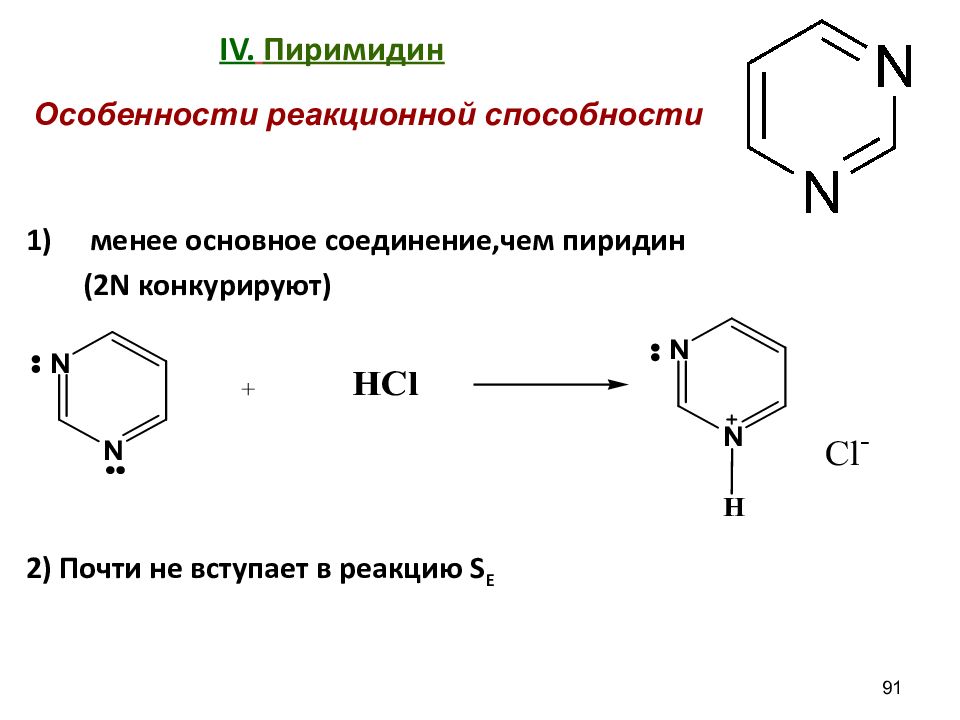
Слайд 91: IV. Пиримидин
менее основное соединение,чем пиридин (2 N конкурируют) 2) Почти не вступает в реакцию S E 91 Особенности реакционной способности
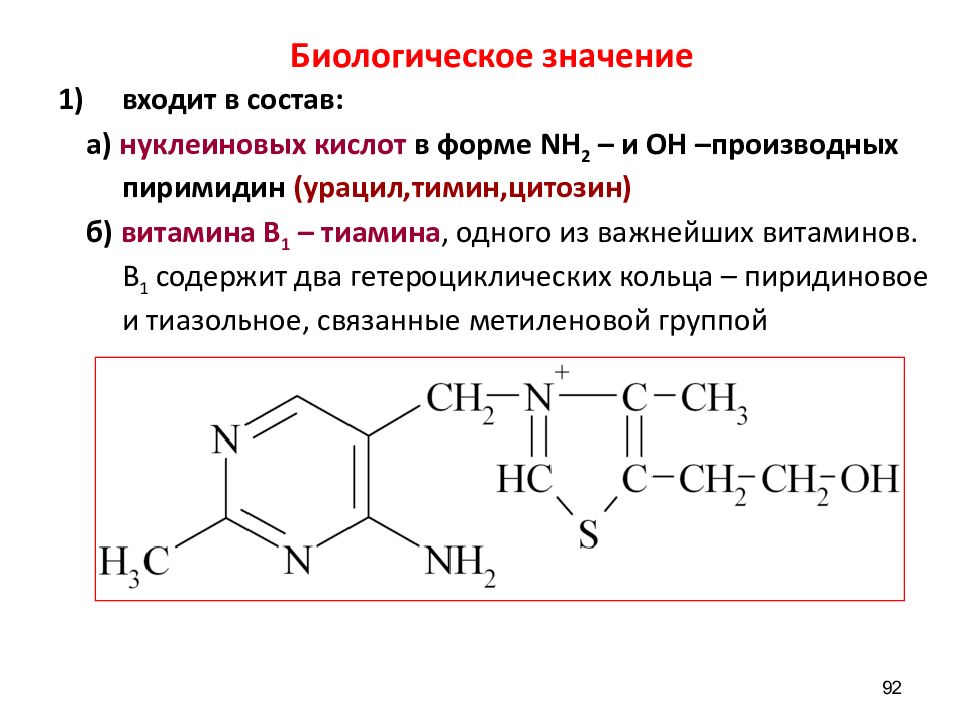
Слайд 92: Биологическое значение
входит в состав: а) нуклеиновых кислот в форме NH 2 – и ОН –производных пиримидин (урацил,тимин,цитозин) б) витамина В 1 – тиамина, одного из важнейших витаминов. В 1 содержит два гетероциклических кольца – пиридиновое и тиазольное, связанные метиленовой группой 92
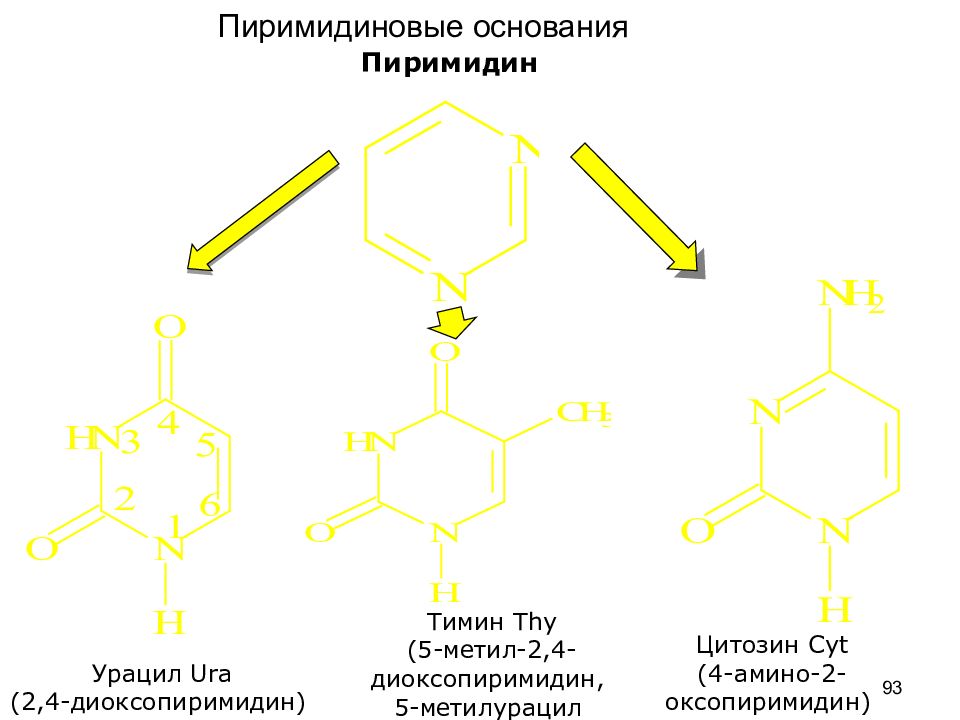
Слайд 93
Пиримидин Урацил Ura (2,4-диоксопиримидин) Тимин Th y (5-метил-2,4-диоксопиримидин, 5-метилурацил Цитозин Cyt (4-амино-2-оксопиримидин) 93 Пиримидиновые основания
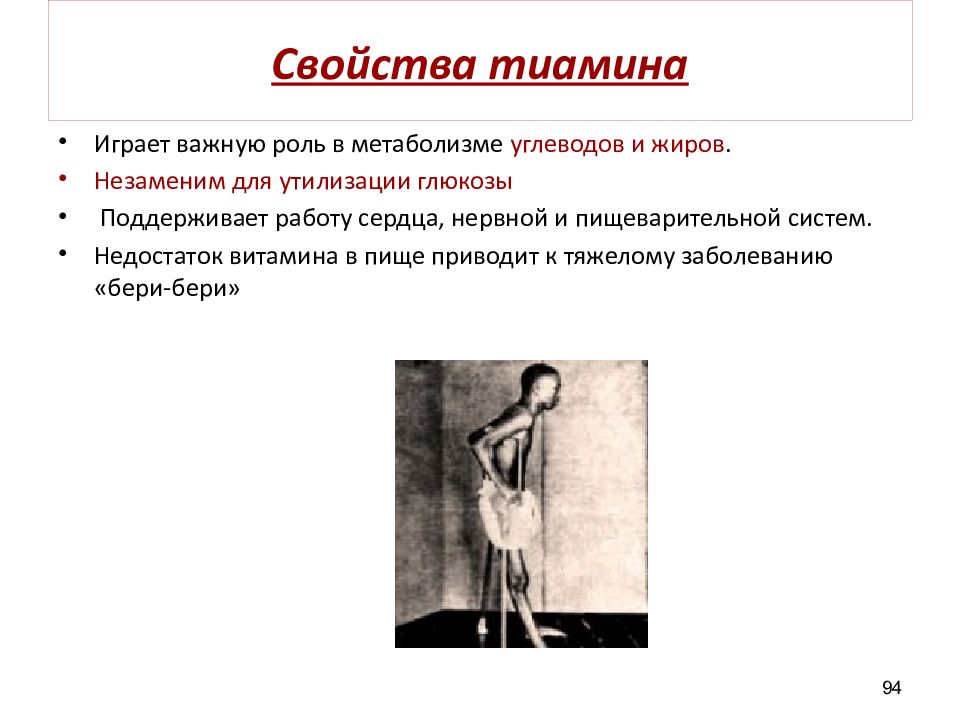
Слайд 94: Свойства тиамина
Играет важную роль в метаболизме углеводов и жиров. Незаменим для утилизации глюкозы Поддерживает работу сердца, нервной и пищеварительной систем. Недостаток витамина в пище приводит к тяжелому заболеванию «бери-бери » 94
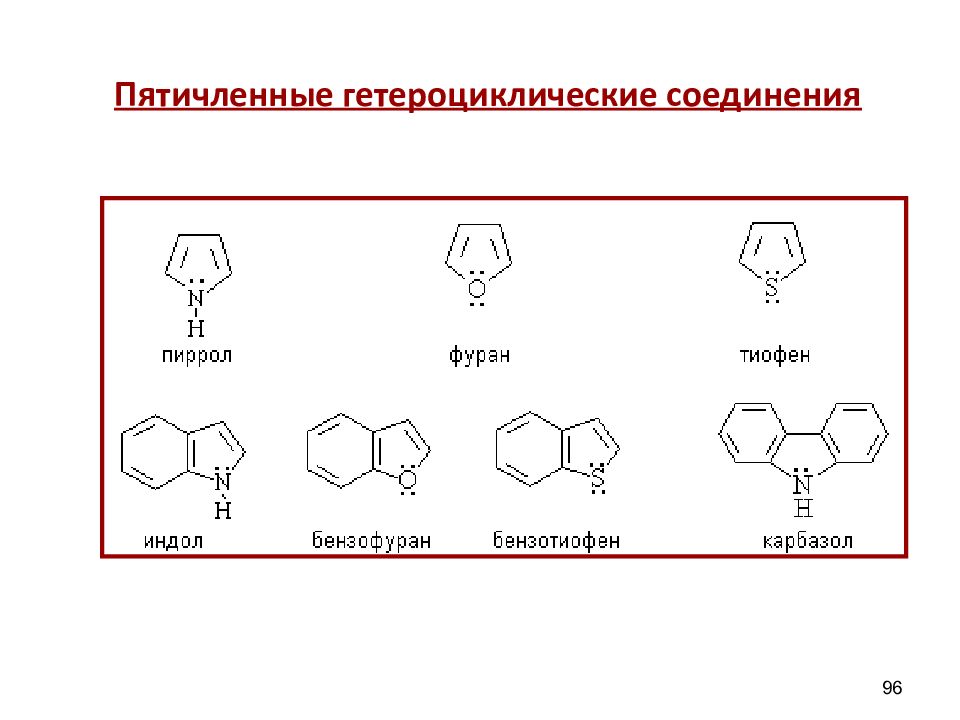
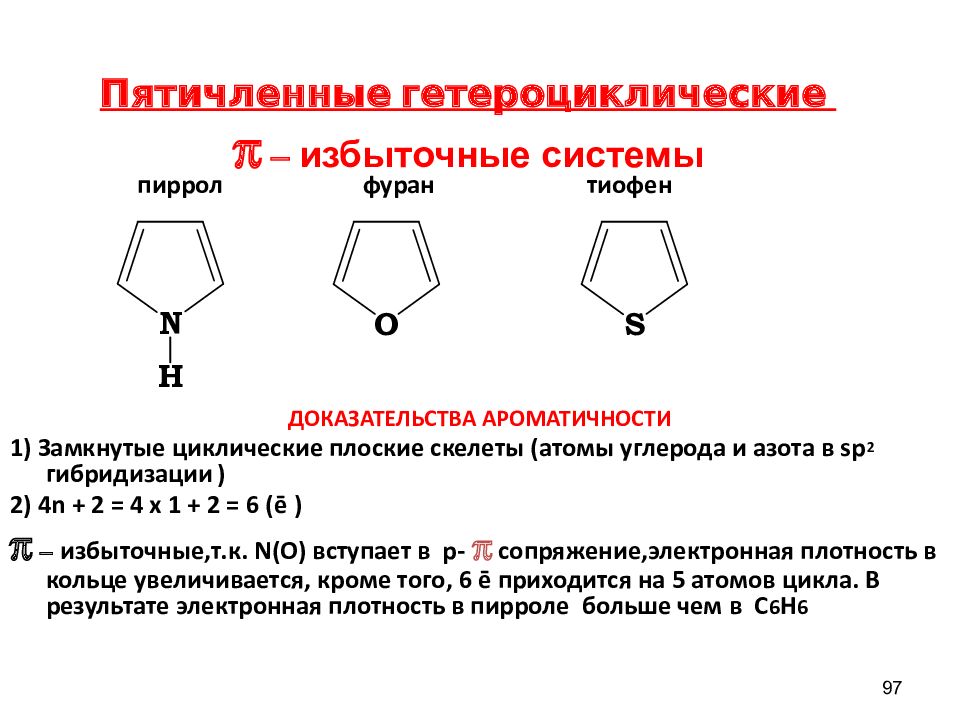
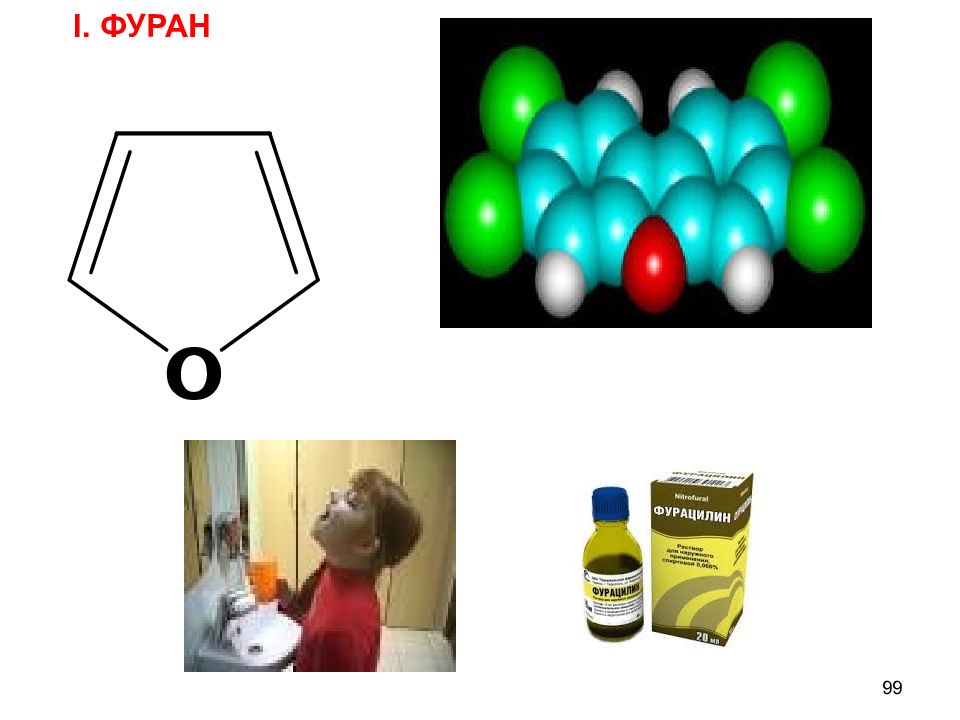
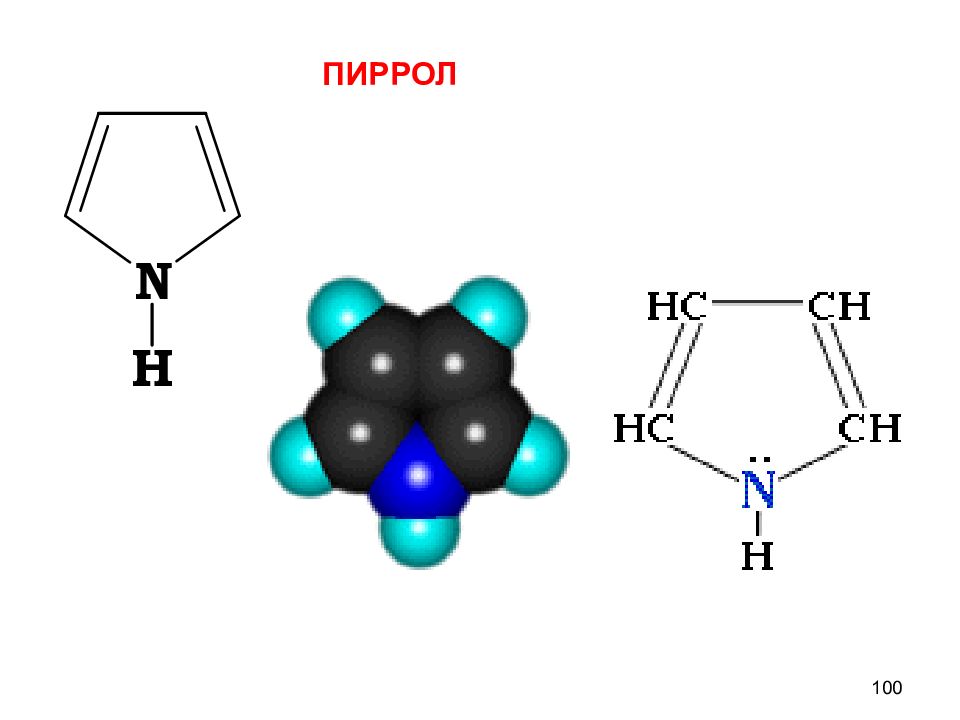
Слайд 97
пиррол фуран тиофен ДОКАЗАТЕЛЬСТВА АРОМАТИЧНОСТИ 1) Замкнутые циклические плоские скелеты (атомы углерода и азота в sp 2 гибридизации ) 2) 4n + 2 = 4 х 1 + 2 = 6 ( ē ) π – избыточные,т.к. N ( O ) вступает в р - π сопряжение,электронная плотность в кольце увеличивается, кроме того, 6 ē приходится на 5 атомов цикла. В результате электронная плотность в пирроле больше чем в C 6 H 6 97 Пятичленные гетероциклические π – избыточные системы
Слайд 101
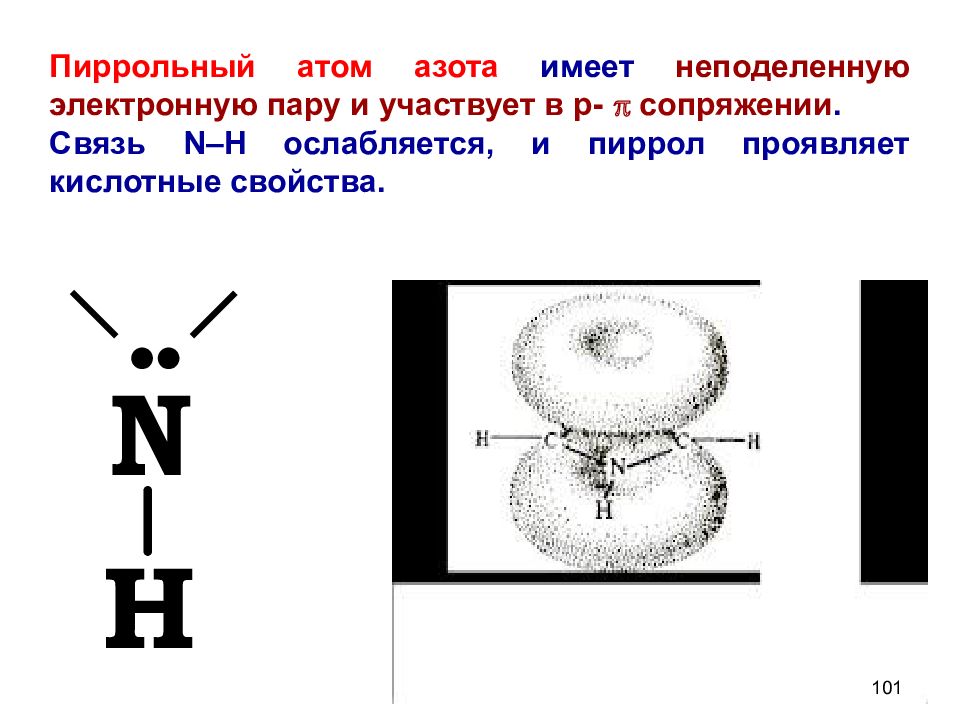
Пиррольный атом азота имеет неподеленную электронную пару и участвует в р- p сопряжении. Связь N –Н ослабляется, и пиррол проявляет кислотные свойства. 101
Слайд 102
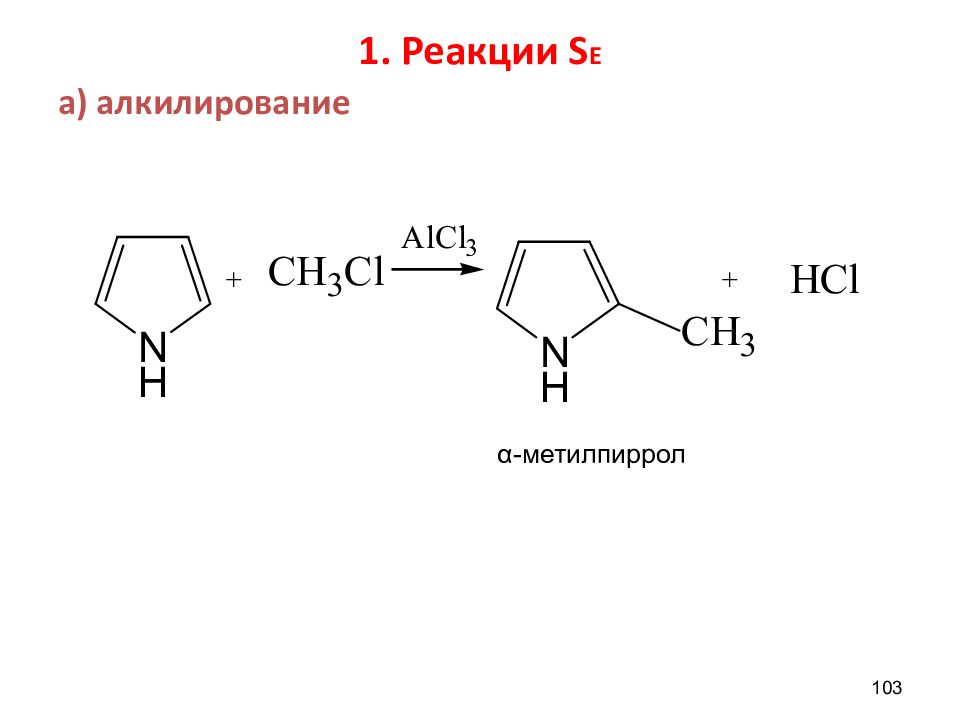
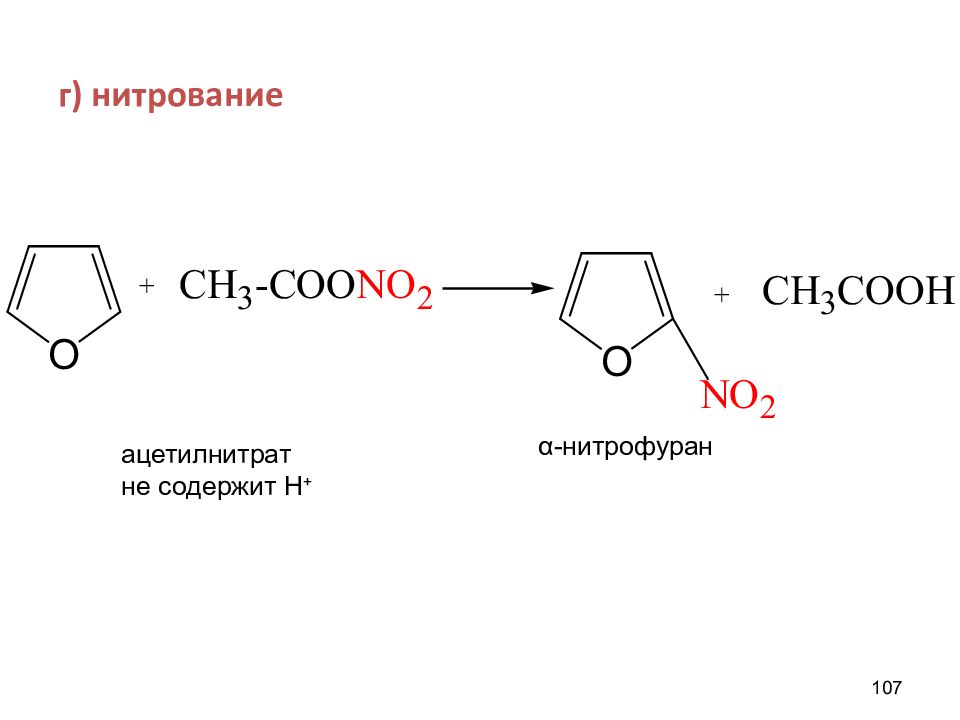
ХИМИЧЕСКИЕ СВОЙСТВА π -избыточных систем 1 ) Реакции S Е. Большая реакционная способность, чем у С 6 Н 6, заместитель встает в α –положение,где сосредоточена большая электронная плотность: а) алкилирование б) галогенирование в) ацилирование г) сульфирование д) нитрование 2) Слабокислые свойства - образование солей. 102
Слайд 105
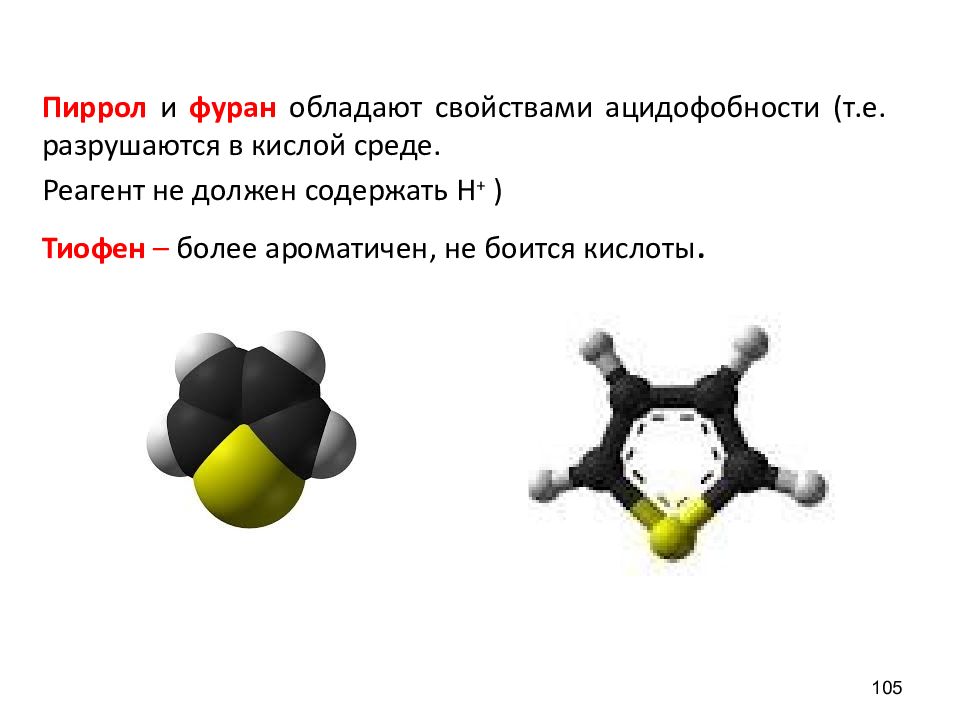
Пиррол и фуран обладают свойствами ацидофобности (т.е. разрушаются в кислой среде. Реагент не должен содержать Н + ) Тиофен – более ароматичен, не боится кислоты. 105
Слайд 106
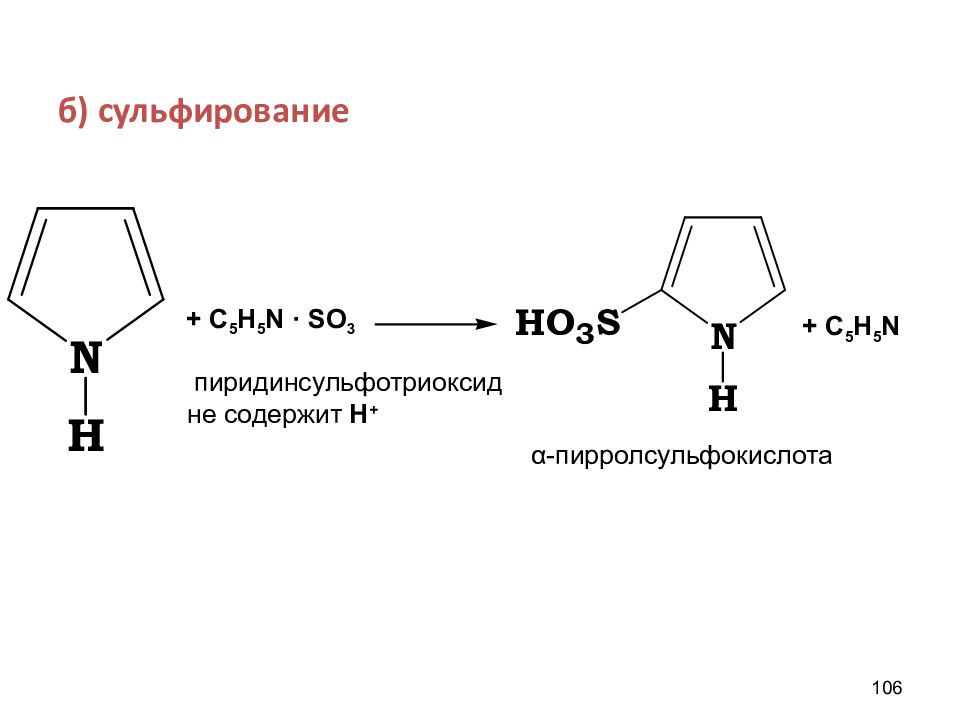
б) сульфирование 106 + С 5 Н 5 N · SO 3 + С 5 H 5 N пиридинсульфотриоксид не содержит Н + α -пирролсульфокислота
Слайд 108
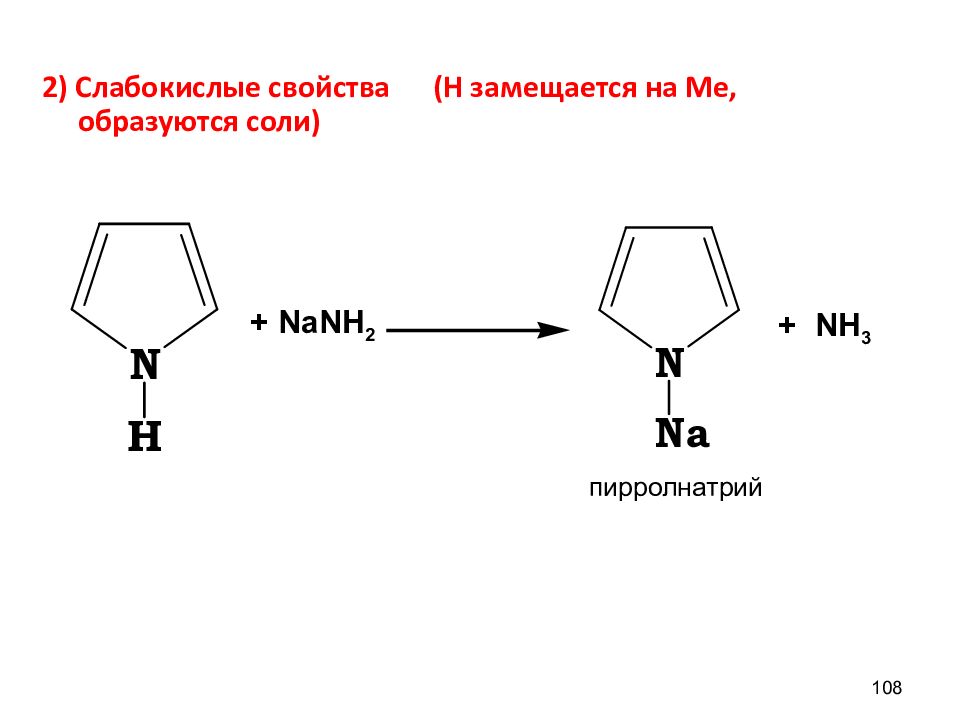
2) Слабокислые свойства (Н замещается на Ме, образуются соли) 108 + NaNH 2 + NH 3 пирролнатрий
Слайд 109
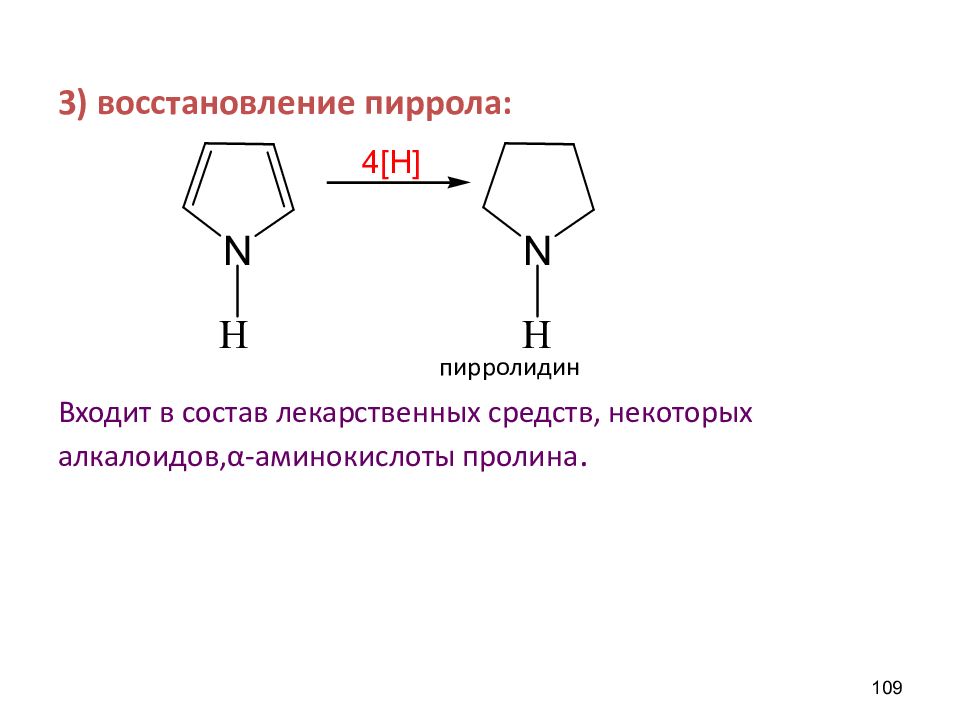
3) восстановление пиррола: пирролидин Входит в состав лекарственных средств, некоторых алкалоидов, α -аминокислоты пролина. 109 4 [H]
Слайд 110
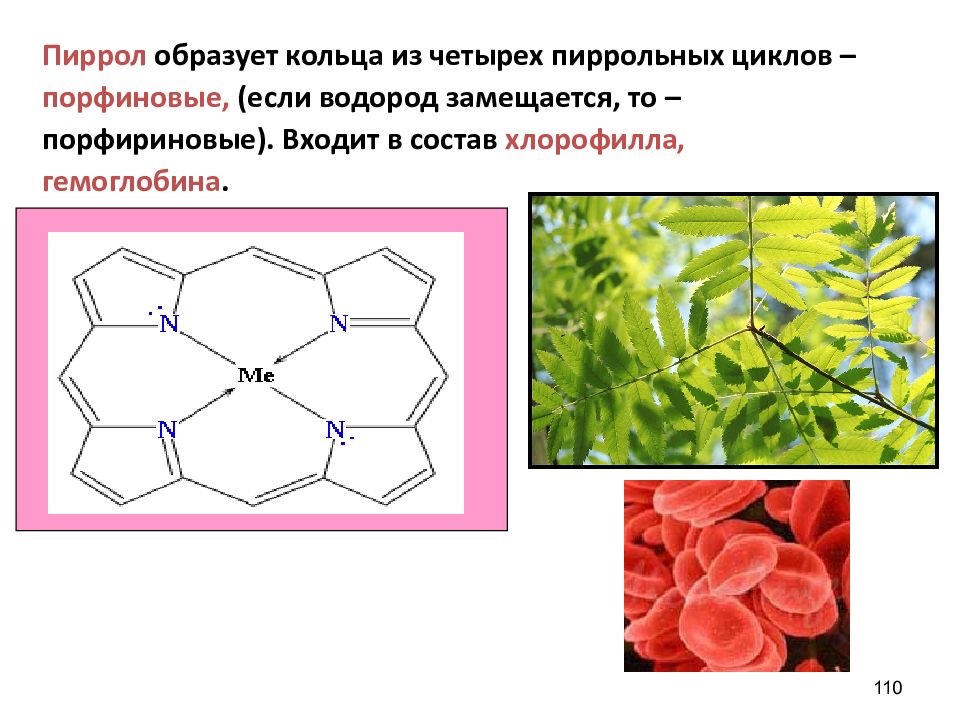
Пиррол образует кольца из четырех пиррольных циклов – порфиновые, (если водород замещается, то – порфириновые). Входит в состав хлорофилла, гемоглобина. 110
Слайд 111
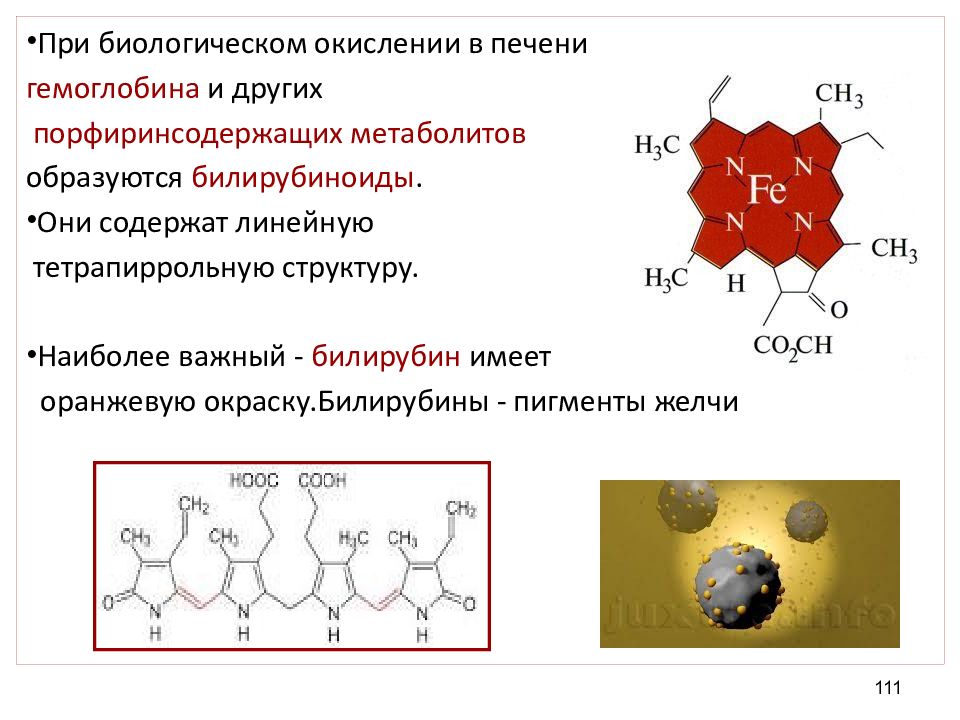
При биологическом окислении в печени гемоглобина и других порфиринсодержащих метаболитов образуются билирубиноиды. Они содержат линейную тетрапиррольную структуру. Наиболее важный - билирубин имеет оранжевую окраску.Билирубины - пигменты желчи 111
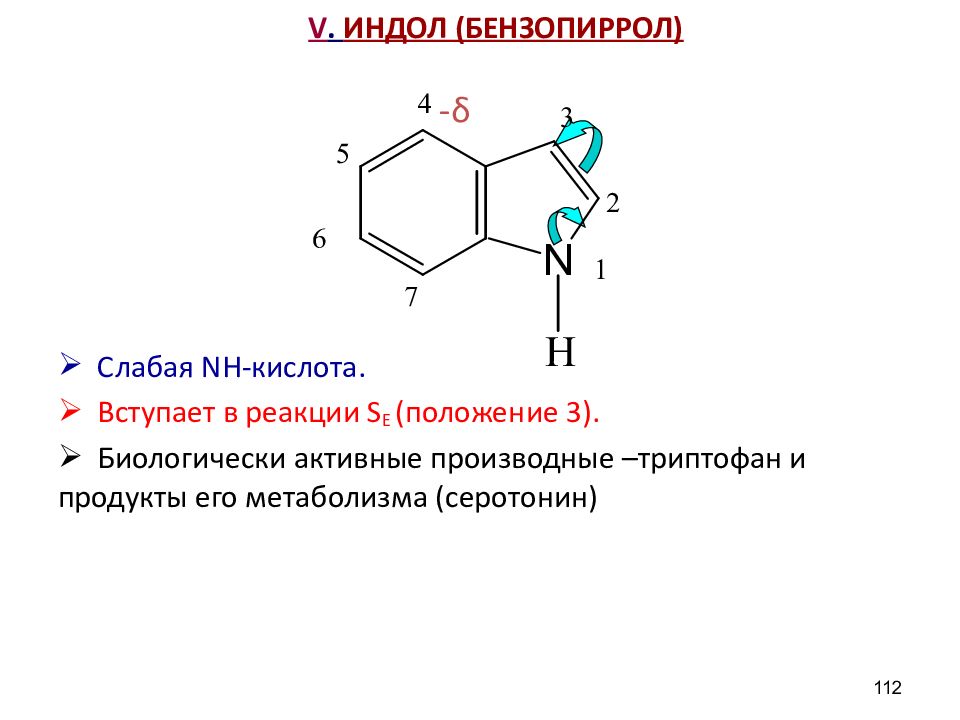
Слайд 112: V. ИНДОЛ (БЕНЗОПИРРОЛ)
- δ Слабая NH- кислота. Вступает в реакции S E (положение 3 ). Биологически активные производные –триптофан и продукты его метаболизма (серотонин) 112
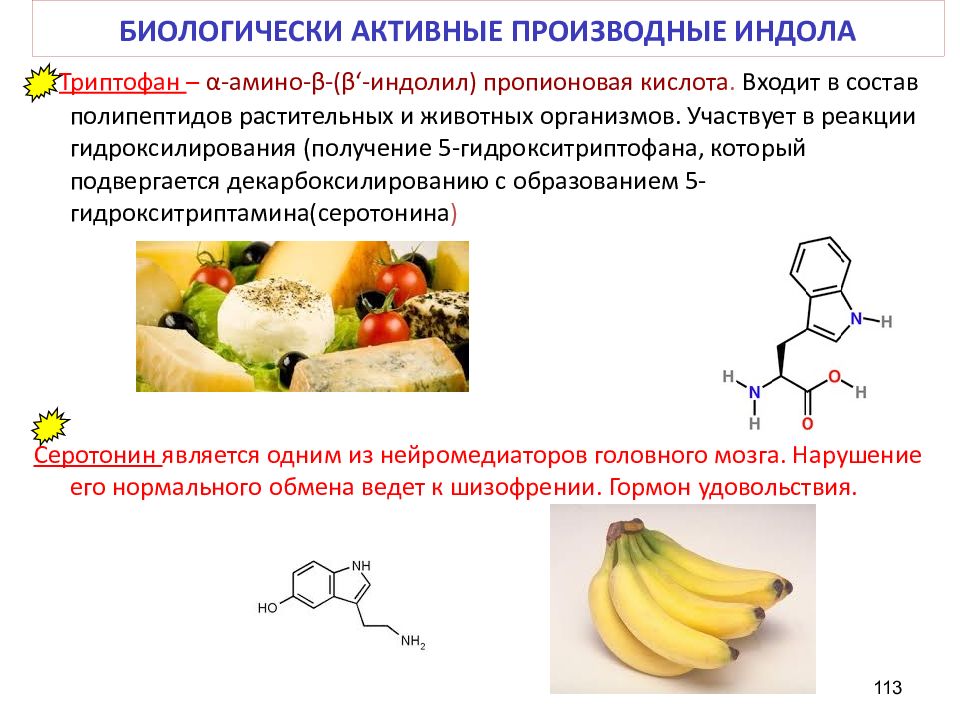
Слайд 113: БИОЛОГИЧЕСКИ АКТИВНЫЕ ПРОИЗВОДНЫЕ ИНДОЛА
Триптофан – α - амино - β -( β ‘ - индолил ) пропионовая кислота. Входит в состав полипептидов растительных и животных организмов. Участвует в реакции гидроксилирования (получение 5-гидрокситриптофана, который подвергается декарбоксилированию с образованием 5-гидрокситриптамина( серотонина ) Серотонин является одним из нейромедиаторов головного мозга. Нарушение его нормального обмена ведет к шизофрении. Гормон удовольствия. 113
Слайд 115
Имидазол - амфотерное соединение 1. Проявляет слабокислотные свойства за счет пиррольного N 2. Слабоосновные – за счет пиридинового N образует соли с сильными кислотами и щелочными металлами NH кислотная группа и – N= основная образуют межмолекулярные водородные связи 115
Слайд 116: Биологически активные производные имидазола
Гистидин - 116 α - амино - β -(4 (5)‘ - имидазолил ) пропионовая кислота. Входит в состав многих белков-глобина Участвует в ферментативных реакциях ( кислотный и основной катализ ) Гистамин – биогенный амин, продукт декарбоксилирования гистидина, имеет отношение к аллергическим реакциям организма
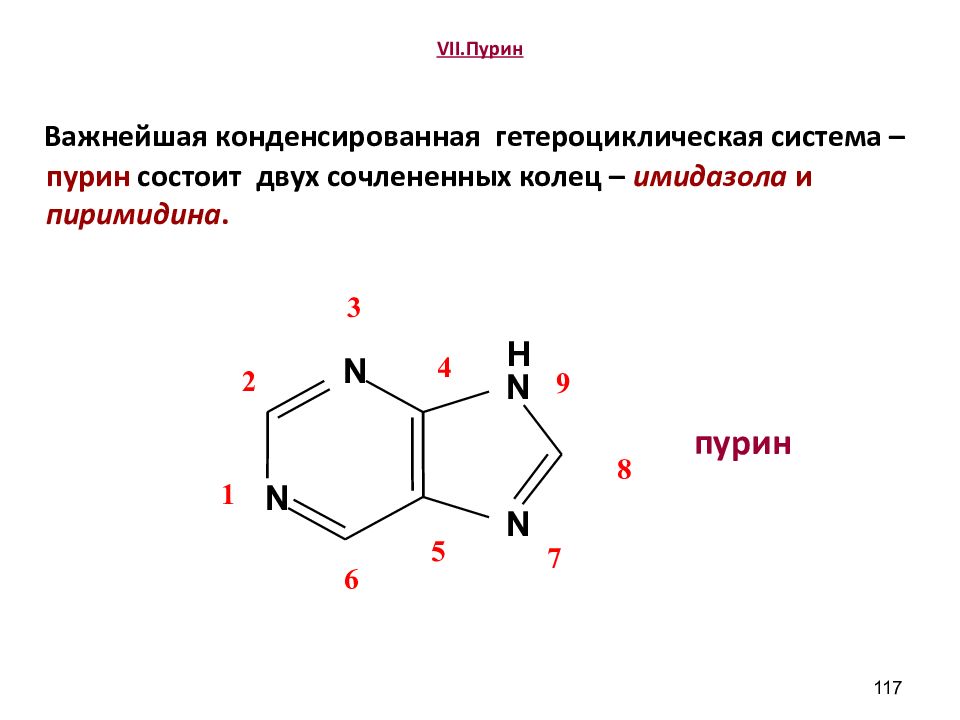
Слайд 117: VII.Пурин
Важнейшая конденсированная гетероциклическая система – пурин состоит двух сочлененных колец – имид a зола и пиримидина. пурин 117 N N H N N 1 3 4 5 6 7 8 9 2
Слайд 118: Свойства пурина
Устойчив к действию окислителей Хорошо растворяется в воде Амфотерен, образует соли не только с сильными кислотами, но (благодаря наличию NH – группы) и со щелочными Ме. ! Наиболее важны гидрокси – и аминопурины, принимающие активное участие в процессах жизнедеятельности. 118
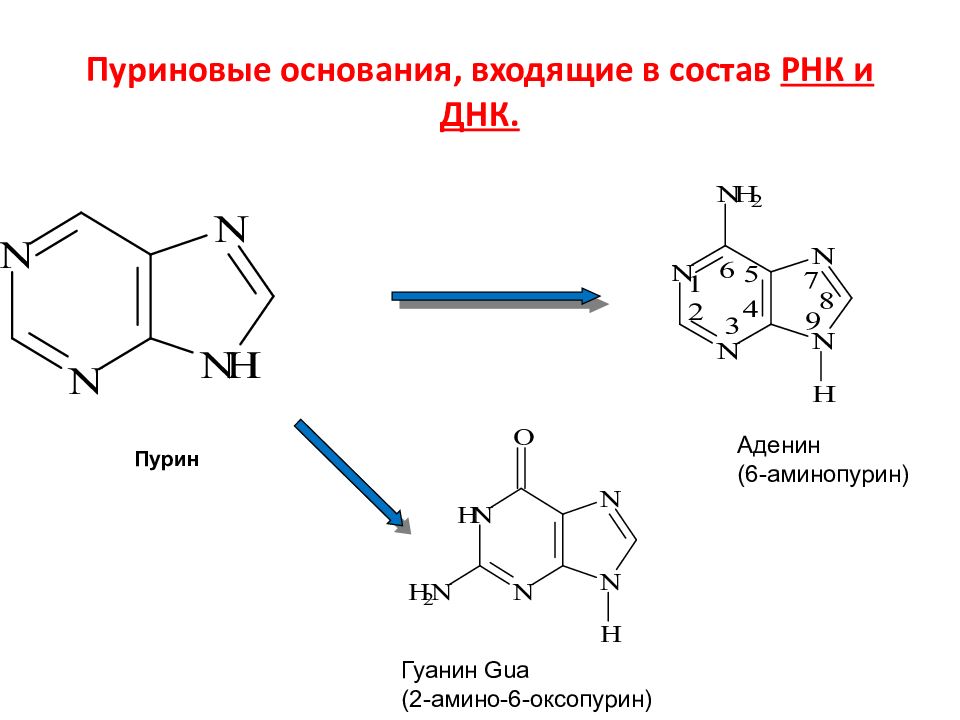
Слайд 119: Пуриновые основания, входящие в состав РНК и ДНК
Аденин (6-аминопурин) Гуанин Gua (2-амино-6-оксопурин) Пурин
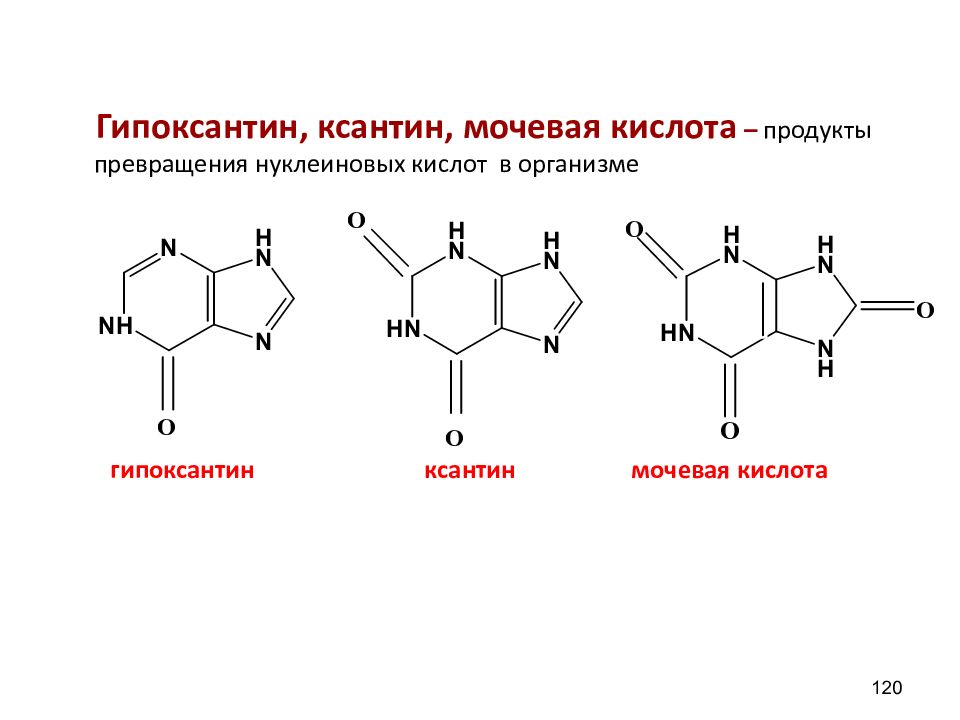
Слайд 120
Гипоксантин, ксантин, мочевая кислота – продукты превращения нуклеиновых кислот в организме гипоксантин ксантин мочевая кислота 120
Слайд 121
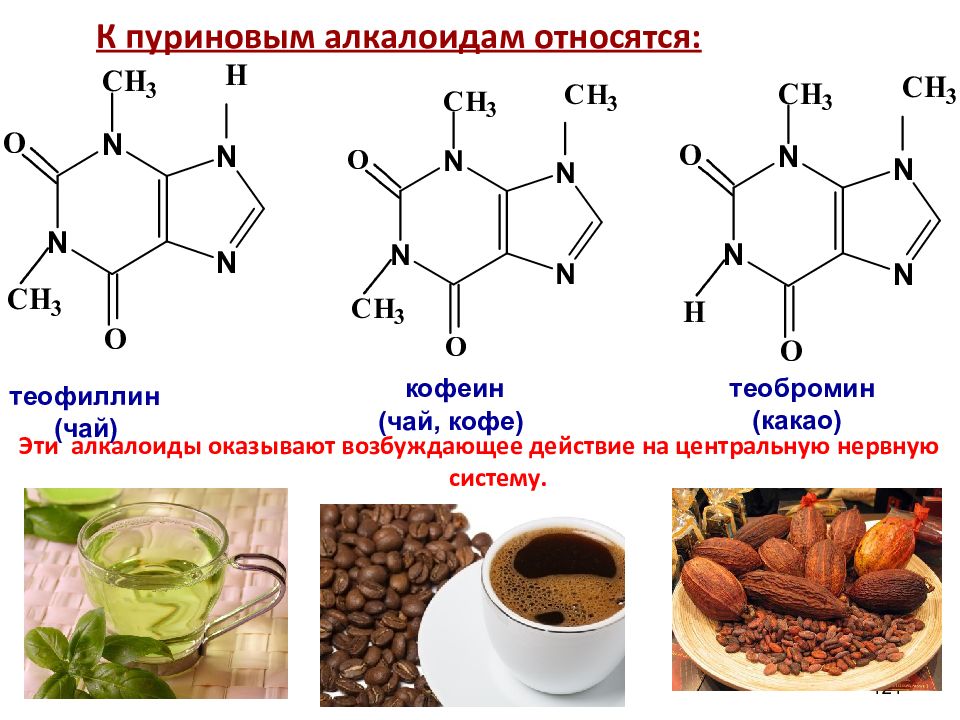
К пуриновым алкалоидам относятся: Эти алкалоиды оказывают возбуждающее действие на центральную нервную систему. 121 теофиллин (чай) кофеин (чай, кофе) теобромин (какао)
Слайд 123
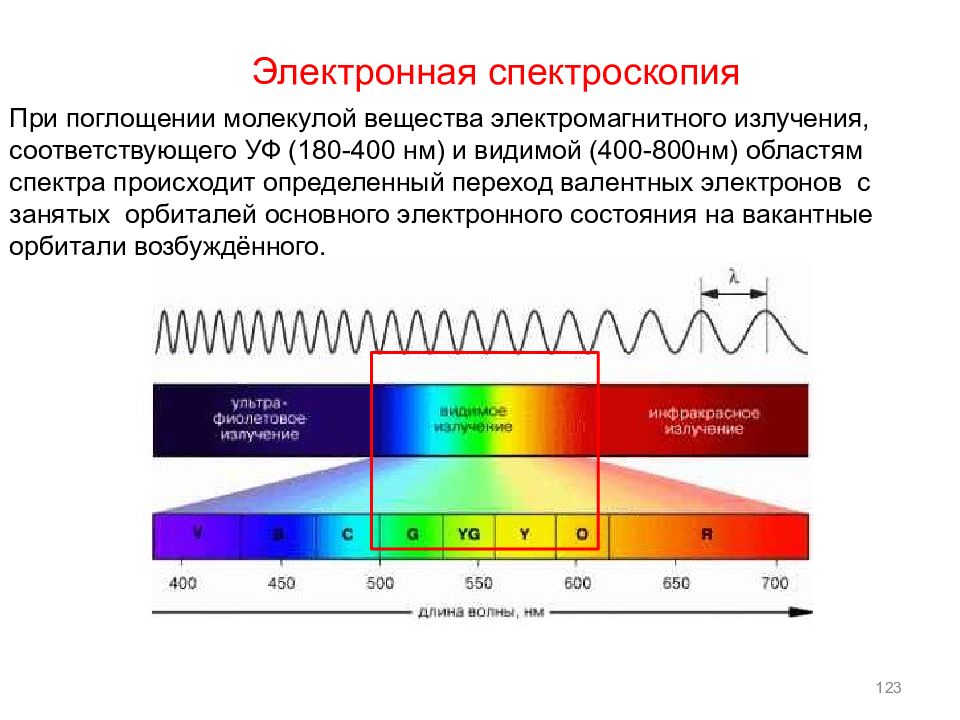
123 При поглощении молекулой вещества электромагнитного излучения, соответствующего УФ (180-400 нм) и видимой (400-800нм) областям спектра происходит определенный переход валентных электронов с занятых орбиталей основного электронного состояния на вакантные орбитали возбуждённого. Электронная спектроскопия
Слайд 124
Большинство электронных переходов в молекулах проявляются в диапазоне 200-750 нм, который подразделяется на два поддиапазона 200-400 нм — ближняя ультрафиолетовая область ; Ультрафиолетовая(УФ) спектроскопия изучает поглощение органическими веществами света в ультрафиолетовой области спектра (длина волны от 200 до 400 нм). Излучение с такой длиной волны поглощают только соединения, содержащие Π - связи ( С=С,С=О и др.). 400-750 нм — область видимого света ( область чувствительности человеческого глаза.)
Слайд 125: Энергия электронного перехода Δ Е связана с частотой электромагнитного излучения ν и длиной волны λ соотношением Δ Е= h ν = hc / λ, где h -постоянная Планка, а с -скорость света
Возможны четыре типа электронных переходов со связывающих и несвязывающих орбиталей основного состояния на разрыхляющие орбитали возбуждённого состояния: 125 Для этих переходов характерны разные значения Δ Е
Слайд 126
σ, σ * - уровни простых σ -связей: О-Н, N-Н, С-Н, С-С, С-О, С-N, С-На I и др. π, π * - уровни кратных π -связей: С=С, N=N, С=N, С=О и др. n - уровень несвязывающих неспаренных электронов, не участвующих в образовании химических связей: О:, N, S :, На I : и др. Используемые обозначения σ, σ * π, π *, n означают следующее: Наиболее информативны полосы поглощения, обусловленные π- π * и n - π * переходами, особенно в сопряженных системах.
Слайд 127
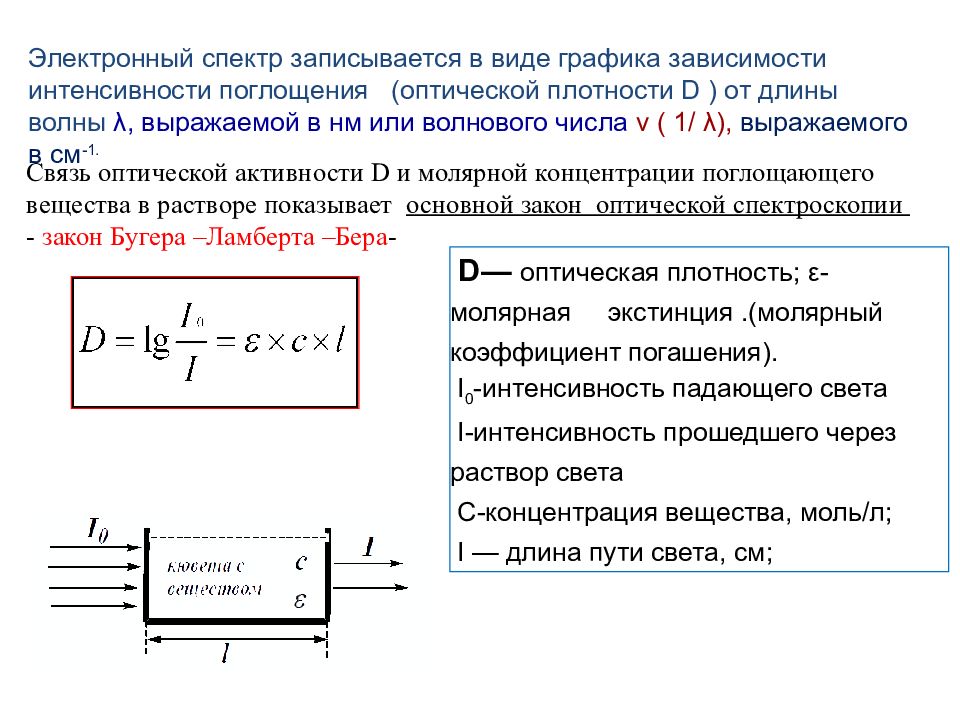
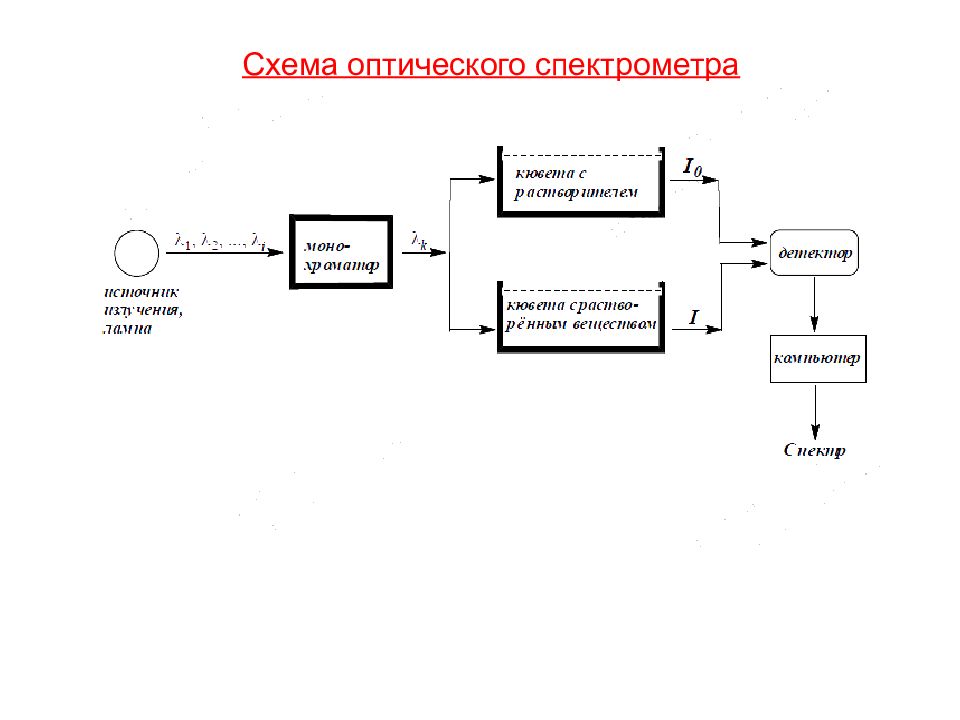
Электронный спектр записывается в виде графика зависимости интенсивности поглощения (оптической плотности D ) от длины волны λ, выражаемой в нм или волнового числа ν ( 1 / λ ), выражаемого в см -1. Связь оптической активности D и молярной концентрации поглощающего вещества в растворе показывает основной закон оптической спектроскопии - закон Бугера –Ламберта –Бера - D — оптическая плотность; ε -молярная экстинция.(молярный коэффициент погашения). I 0 - интенсивность падающего света I- интенсивность прошедшего через раствор света С-концентрация вещества, моль/л; I — длина пути света, см;
Слайд 128
Электронные спектры поглощения в УФ- и видимой областях (называемые просто УФ-спектрами ) характеризуются графиком в координатах D (или lg D) и λ (или ν ). При описании веществ обычно приводят только значения длины волны и интенсивности в максимуме полосы поглощения ( λ макс и D или ( ε ) 128
Слайд 129: Связь УФ-спектров со строением молекул
129 Положение полос поглощения в УФ- спектре зависит от строения молекул Структурные группы (кратные связи, ароматические фрагменты),обусловливающие избирательное поглощение УФ-света, называются хромофорами,. Ауксохромы - группы,вступающие в р, π -сопряжение с хромофорами ( NH 2, OH, SH и др.) Поглощение изолированных хромофоров обусловлено π – π * и (или n -π ) электронными переходами, особенно в сопряженных системах
Слайд 130
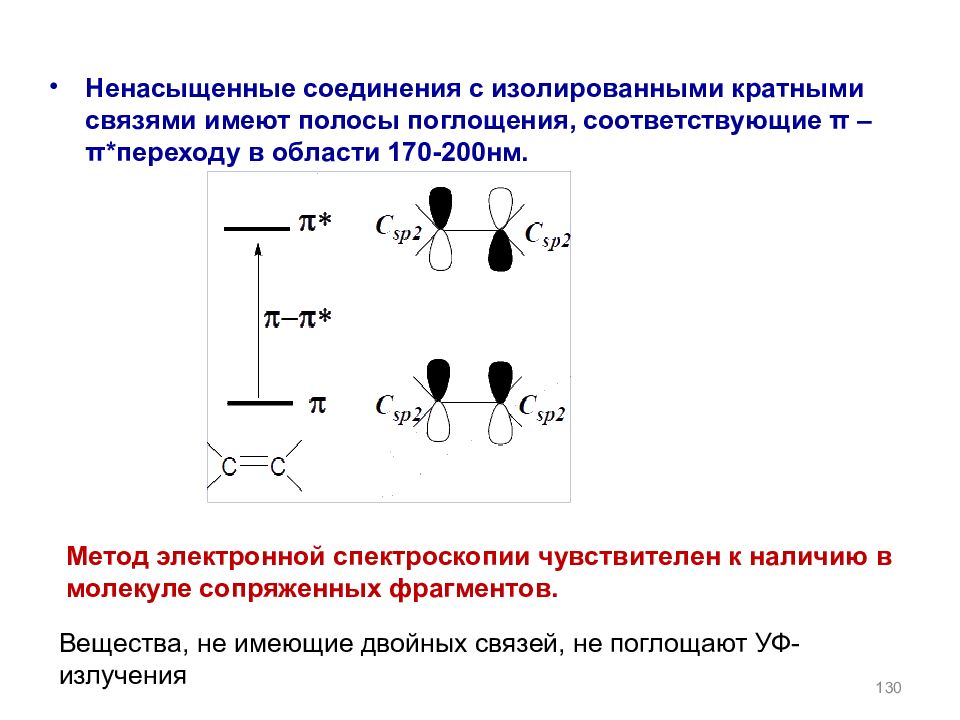
Ненасыщенные соединения с изолированными кратными связями имеют полосы поглощения, соответствующие π – π *переходу в области 170-200нм. Вещества, не имеющие двойных связей, не поглощают УФ- излучения Метод электронной спектроскопии чувствителен к наличию в молекуле сопряженных фрагментов. 130
Слайд 131
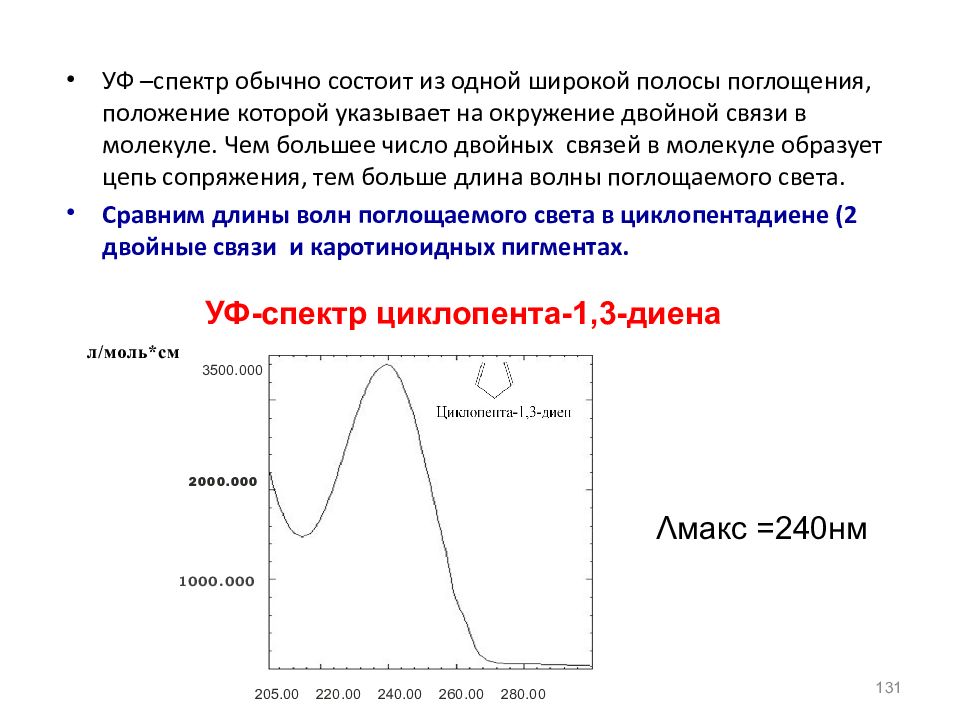
УФ –спектр обычно состоит из одной широкой полосы поглощения, положение которой указывает на окружение двойной связи в молекуле. Чем большее число двойных связей в молекуле образует цепь сопряжения, тем больше длина волны поглощаемого света. Сравним длины волн поглощаемого света в циклопентадиене (2 двойные связи и каротиноидных пигментах. 131 УФ-спектр циклопента-1,3-диена 1000.000 2000.000 3500.000 л/моль*см 205.00 220.00 240.00 260.00 280.00 Λ макс =240нм
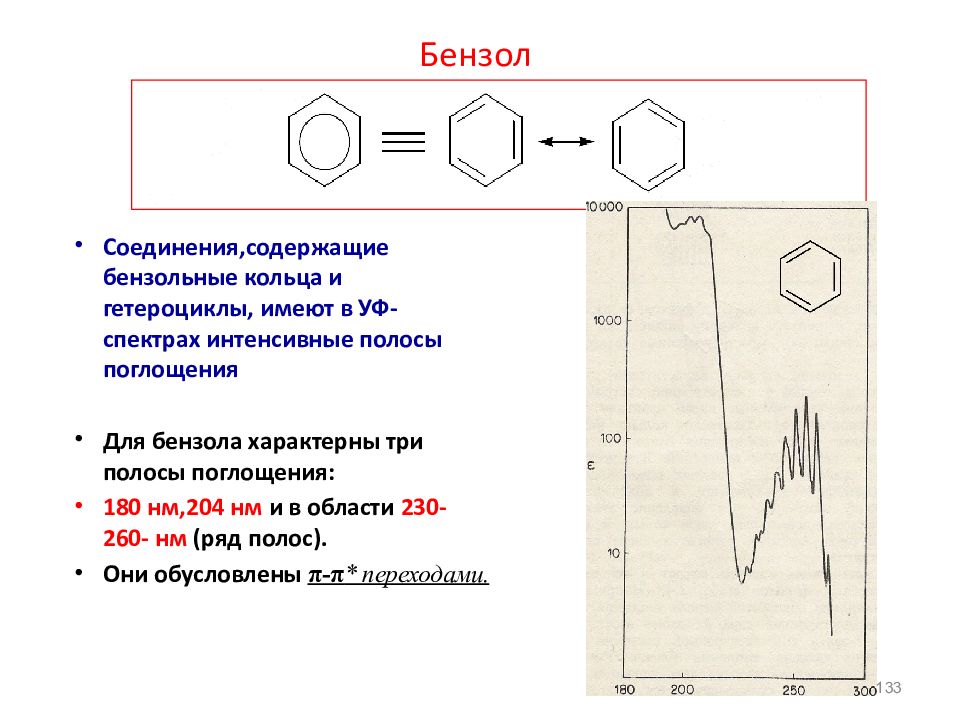
Слайд 133: Бензол
Соединения,содержащие бензольные кольца и гетероциклы, имеют в УФ-спектрах интенсивные полосы поглощения Для бензола характерны три полосы поглощения: 180 нм,204 нм и в области 230-260- нм (ряд полос). Они обусловлены π - π * переходами. 133
Слайд 134
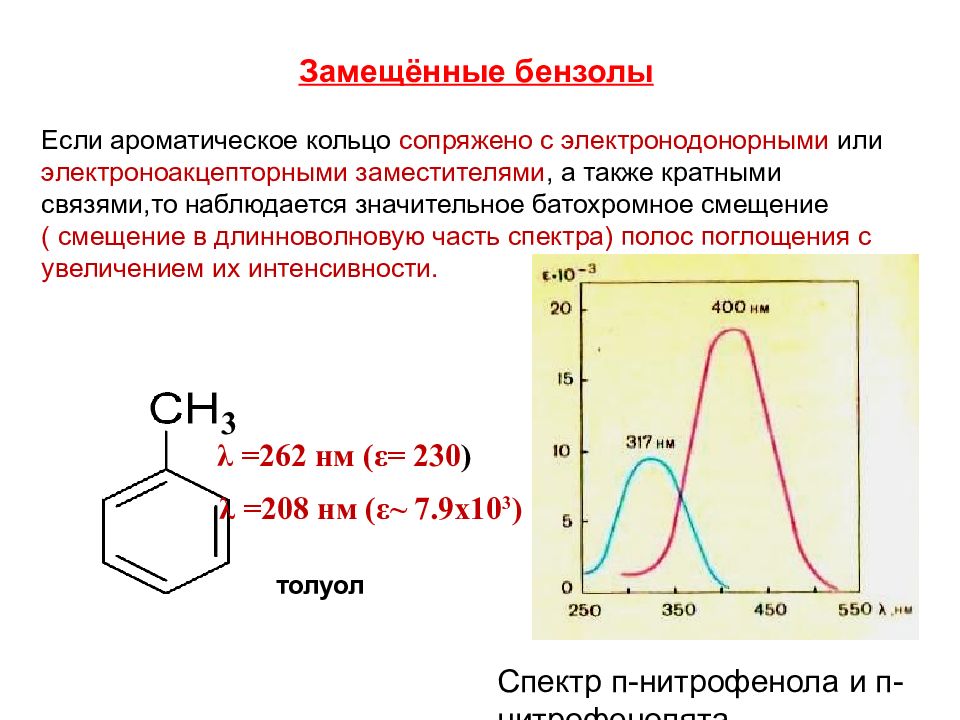
Замещённые бензолы Если ароматическое кольцо сопряжено с электронодонорными или электроноакцепторными заместителями, а также кратными связями,то наблюдается значительное батохромное смещение ( смещение в длинноволновую часть спектра) полос поглощения с увеличением их интенсивности. 3 толуол λ =262 нм ( ε = 230 ) λ =208 нм ( ε ~ 7.9х10 3 ) Спектр п-нитрофенола и п-нитрофенолята
Слайд 135
Кроме того, возможно появление полос поглощения, обусловленных электронным переходом с вкладом внутримолекулярного переноса заряда (ВПЗ). В этих случаях происходит уменьшение электронной плотности в одном фрагменте молекулы с увеличением её- в другом. Полосы поглощения соединений, содержащих в бензольном кольце одновременно электронодорные и электроноакцепторные заместители (например нитроанилин), имеют сложное происхождение 135
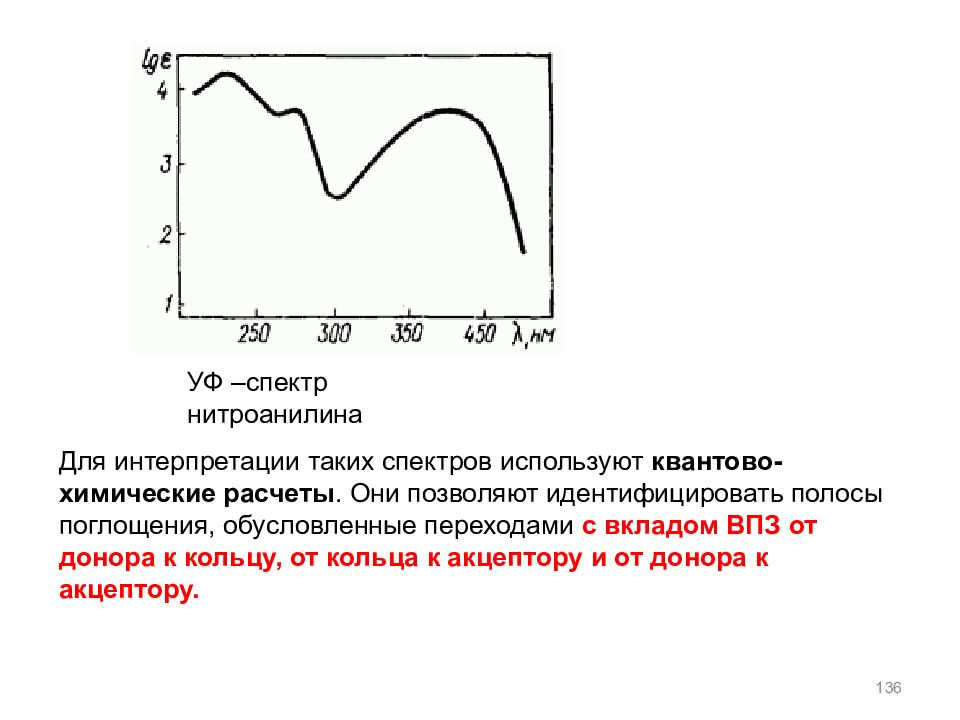
Слайд 136
136 УФ –спектр нитроанилина Для интерпретации таких спектров используют квантово-химические расчеты. Они позволяют идентифицировать полосы поглощения, обусловленные переходами с вкладом ВПЗ от донора к кольцу, от кольца к акцептору и от донора к акцептору.
Слайд 138
138 УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США) УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США) УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США) УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США) Спектрофотометры серии DU 800 УФ- спектрофотометры УФ-спектрофотометр “Lambda 35” (Perkin-Elmer, США
Слайд 140
Регистрация электронных спектров Рабочий диапазон спектрометров 200-750 нм. Можно регистрировать спектры газов, жидкостей и твердых тел. Для получения спектра необходимо — 0.1-1 мг вещества. Спектры обычно регистрируют в виде растворов в гексане, этаноле, воде и др. растворителях в кюветах их кварца (прозрачен до 180 нм). Источники излучения — дейтериевые (180-400 нм), вольфрамогалогенные (400-800 нм) лампы.
Слайд 141
Применение метода электронной спектроскопии Идентификация органических соединений-сравнение спектра исследуемого соединения со спектрами соединений известной структуры. Изучение кинетики и контроль за ходом реакции. Изучение пространственного строения. Количественный анализ содержания действующих компонентов в составе лекарственной формы 141