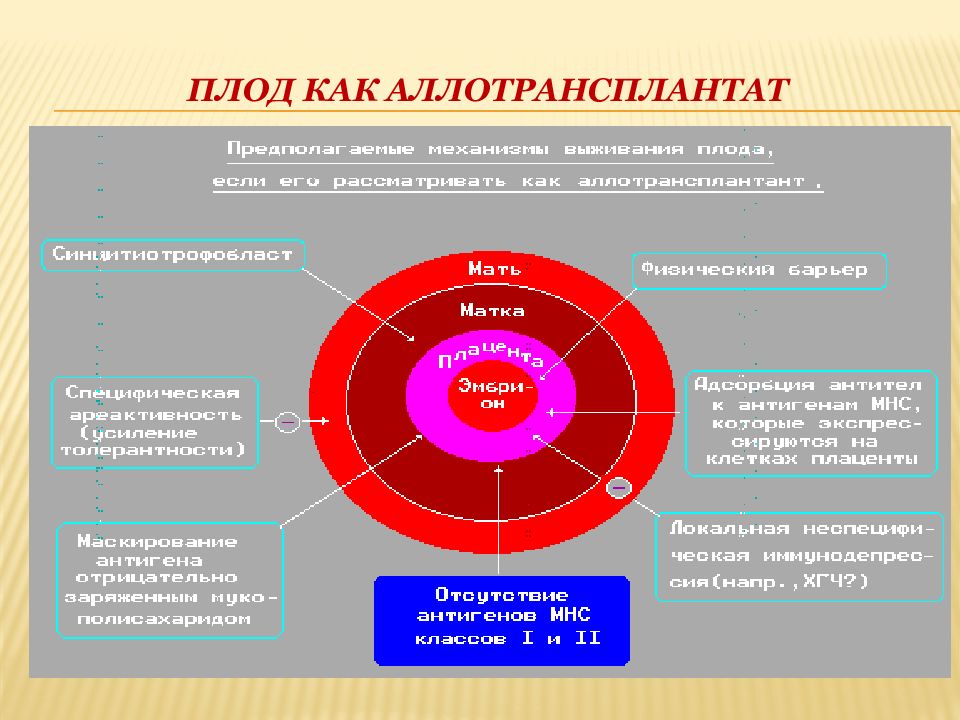
Слайд 2: Плод как аллотрансплантат
Вынашивание плода с полным набором чужеродных антигенов в течение длительного времени является иммунологическим парадоксом. У млекопитающих срок жизни аллогенных трансплантатов, не совместимых по сильным антигенам системы HLA, составляет в среднем 10—15 дней.
Слайд 3: Плод как аллотрансплантат
Эмбрион, у которого HLA-антигены появляются уже через 96 ч после оплодотворения (8 клеточных делений), несущий полный набор антигенов отца, не только не отторгается, но и полноценно развивается в течение нужного времени.
Слайд 4: Плод как аллотрансплантат
Повторные беременности от того же отца не только не индуцируют отторжения плода, но и не влияют на сроки беременности. Полностью не работают законы трансплантационного иммунитета
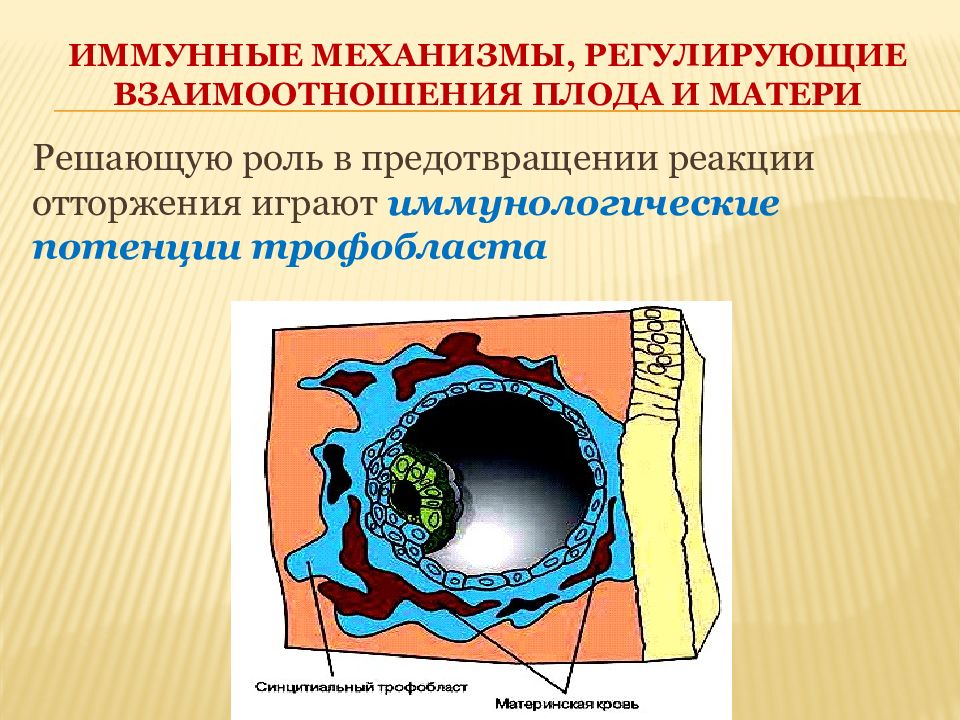
Решающую роль в предотвращении реакции отторжения играют иммунологические потенции трофобласта
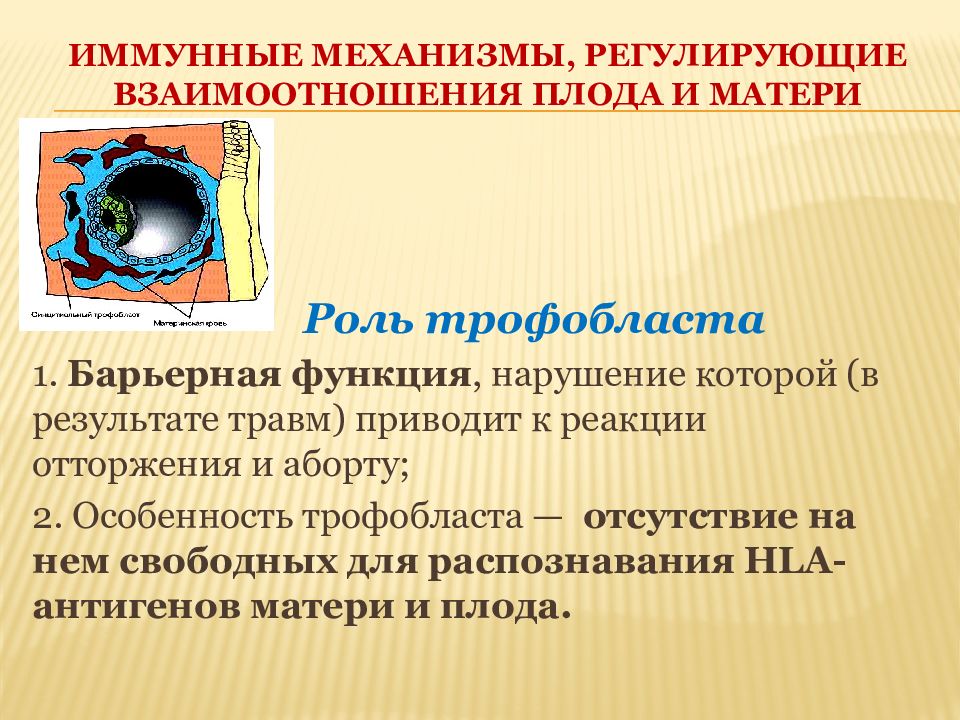
Роль трофобласта 1. Барьерная функция, нарушение которой (в результате травм) приводит к реакции отторжения и аборту; 2. Особенность трофобласта — отсутствие на нем свободных для распознавания HLA- антигенов матери и плода.
Роль трофобласта 3. Феномен специфической блокады антигенов с помощью антител. Эти антитела представляют собой местно синтезируемые в матке и плаценте lgG против HLA-антигенов на клетках плода и лимфоцитах матери. 4. Специфическая роль отрицательно заряженного мукополисахарида, обладающего способностью маскировать антигены плаценты.
Слайд 9: Иммунные механизмы, регулирующие взаимоотношения плода и матери
В организме матери все же синтезируется некоторое число антител и сенсибилизированных лимфоцитов против антигенов плода, но они не оказывают своего патогенного действия.
Слайд 10: Иммунные механизмы, регулирующие взаимоотношения плода и матери
В основе развития нефропатий при беременности, осложненной поздним токсикозом, лежит нарушение способности материнского организма вырабатывать антитела, блокирующие антигенные маркеры плаценты.
Слайд 11: Иммунные механизмы, регулирующие взаимоотношения плода и матери
В норме в организме матери вырабатываются супрессирующие факторы (антитела и «отрицательно заряженный мукополисахарид »), содержание которых нарастает с увеличением срока беременности.
Слайд 12: Иммунные механизмы, регулирующие взаимоотношения плода и матери
В организме матери возрастает более чем в 2 раза активность Т-лимфоцитов, обладающих супрессорной функцией, что поддерживает специфическое иммунодепрессивное состояние. Большинство Т-супрессоров находится непосредственно в лимфатических узлах, дренирующих матку.
Слайд 13: Иммунные механизмы, регулирующие взаимоотношения плода и матери
Второй клеточный механизм иммуносупрессии — макрофагальный, осуществляемый местно расположенными макрофагами с большим числом Fc IgG-рецепторов.
Слайд 14: Иммунные механизмы, регулирующие взаимоотношения плода и матери
Кроме механизмов, создающихся материнской иммунной системой, в процессе эмбриогенеза начинают синтезироваться (на 12— 16-й неделе) фетальные антигены - фетопротеины (например, альфафетопротеин).
Слайд 15: Иммунные механизмы, регулирующие взаимоотношения плода и матери
Группа фетопротеинов, включающая примерно 10 антигенов, получила название раковоэмбриональных антигенов, поскольку они синтезируются и эмбрионом, и клетками опухолей печени. Синтез этих антигенов оказывает дополнительное иммуносупрессивное действие.
Слайд 16: Иммунитет и беременность
В организме матери при нормально протекающей беременности всегда специально создается состояние временного частичного иммунодефицита, непосредственно обеспечивающее вынашивание плода. В иммунном статусе организма матери наблюдается: 1. Снижение уровня IgG в сыворотке крови, возможно, вследствие переноса IgG через плаценту (начиная с 13—16-й недели беременности);
Слайд 17: Иммунитет и беременность
В иммунном статусе организма матери наблюдается: 2. Временное, на период беременности, изменение механизмов регуляции синтеза IgG ; 3. Компенсаторное умеренное увеличение уровня IgA и IgM; 4. Значительное угнетение функционального состояния фагоцитарных нейтрофилов крови, а также синтеза ферментов макрофагами ;
Слайд 18: Иммунитет и беременность
В иммунном статусе организма матери наблюдается: 5. Увеличение числа Т-супрессоров, но без значительных изменений соотношения Т- и В-лимфоцитов. При задержке в матке остатков трофобласта (после выкидышей или патологических родов) наблюдается реверсия соотношения Т- и В-клеток в количественном содержании данных клеток в сыворотке крови.
Слайд 19: Иммунитет и беременность
Сформировавшийся при беременности иммунный статус (дефицит IgG, угнетение фагоцитоза нейтрофилов и макрофагов, гиперфункция Т-супрессоров ) приводит к повышенной восприимчивости к вирусной (грипп, гепатит, полиомиелит, краснуха, ветряная оспа) и бактериальной (особенно стрептококковая) инфекции.
Слайд 20: Иммунитет и беременность
Любые попытки воздействия на иммунную систему беременных могут существенно осложнить беременность или стимулировать выкидыш и, следовательно, нецелесообразны и даже опасны.
Слайд 21: Иммунитет и беременность
Важной проблемой взаимоотношения иммунной и репродуктивной функции организма является бесплодие. Известно, что значительная часть (20—25%) всех случаев бесплодия относится к аутоиммунным формам. Суть аутоиммунного бесплодия заключается в продукции антител против антигенов сперматозоидов, при этом последние блокируются или погибают.
Слайд 22: Иммунитет и беременность
У мужчин продукция аутоантител к сперматозоидам (иммунологически изолированная ткань) возможна лишь при травмах или инфекциях наружных половых органов. В подобных случаях в несколько раз увеличивается число спермальных антител. Наиболее точным методом диагностики этих нарушений является иммуноферментный анализ (ИФА).
Слайд 23: Гемолитическая болезнь новорожденных (Rh-конфликт)
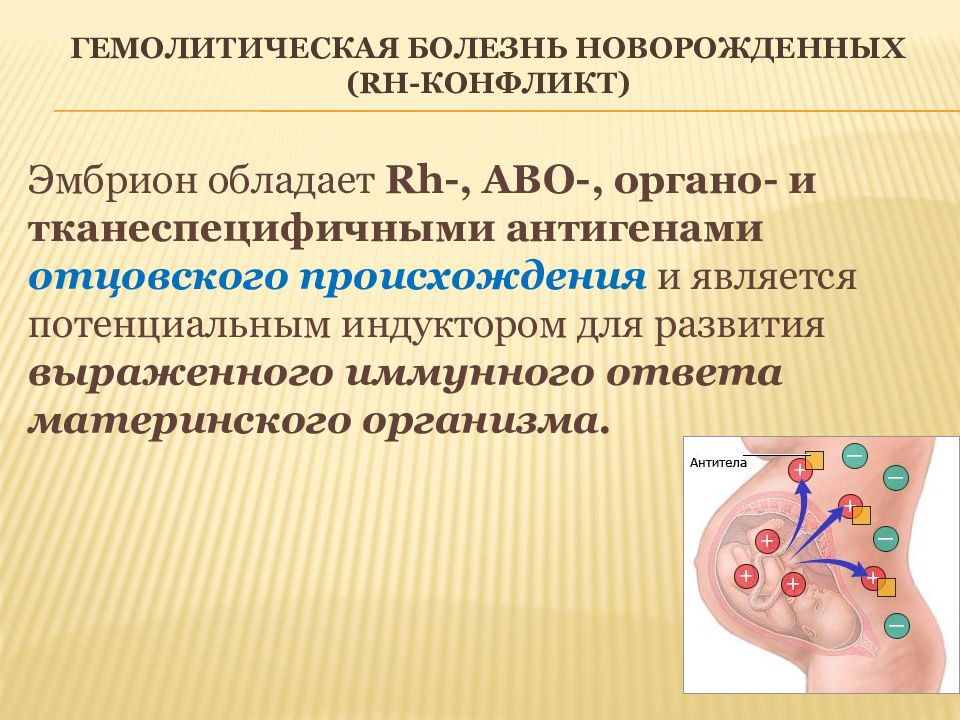
Эмбрион обладает Rh -, ABО-, органо - и тканеспецифичными антигенами отцовского происхождения и является потенциальным индуктором для развития выраженного иммунного ответа материнского организма.
Слайд 24: Гемолитическая болезнь новорожденных (Rh-конфликт)
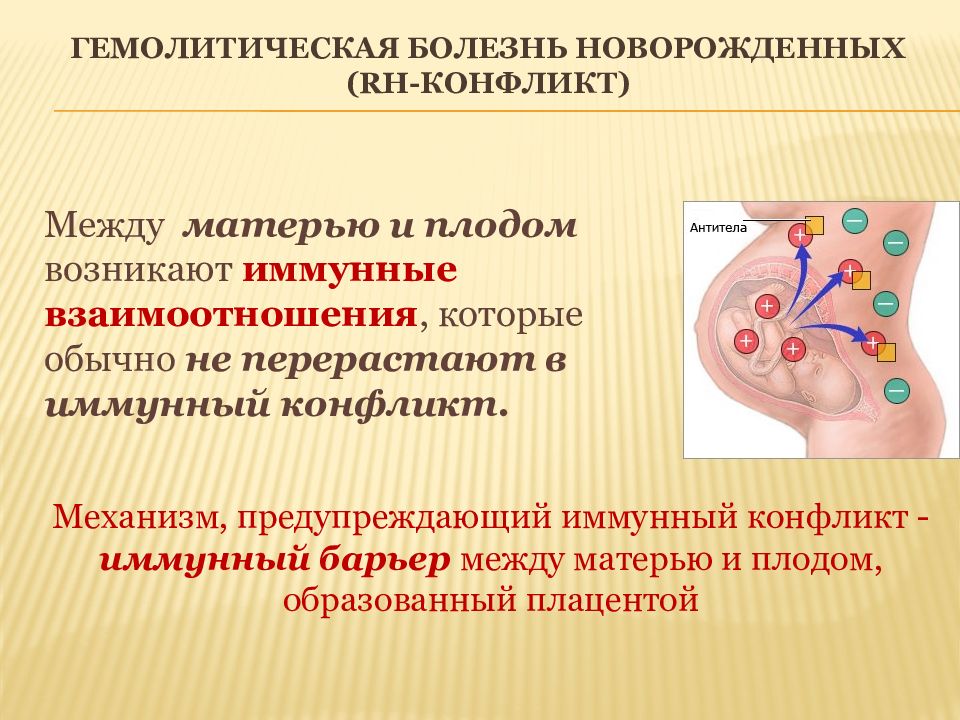
Между матерью и плодом возникают иммунные взаимоотношения, которые обычно не перерастают в иммунный конфликт. Механизм, предупреждающий иммунный конфликт - иммунный барьер между матерью и плодом, образованный плацентой
Слайд 25: Гемолитическая болезнь новорожденных (Rh-конфликт)
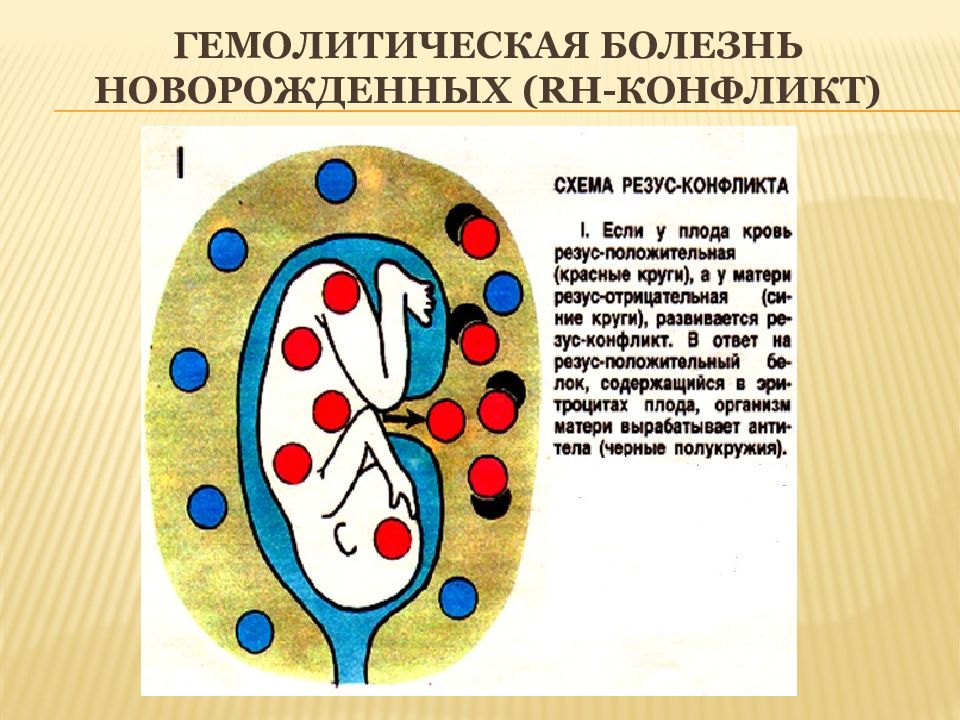
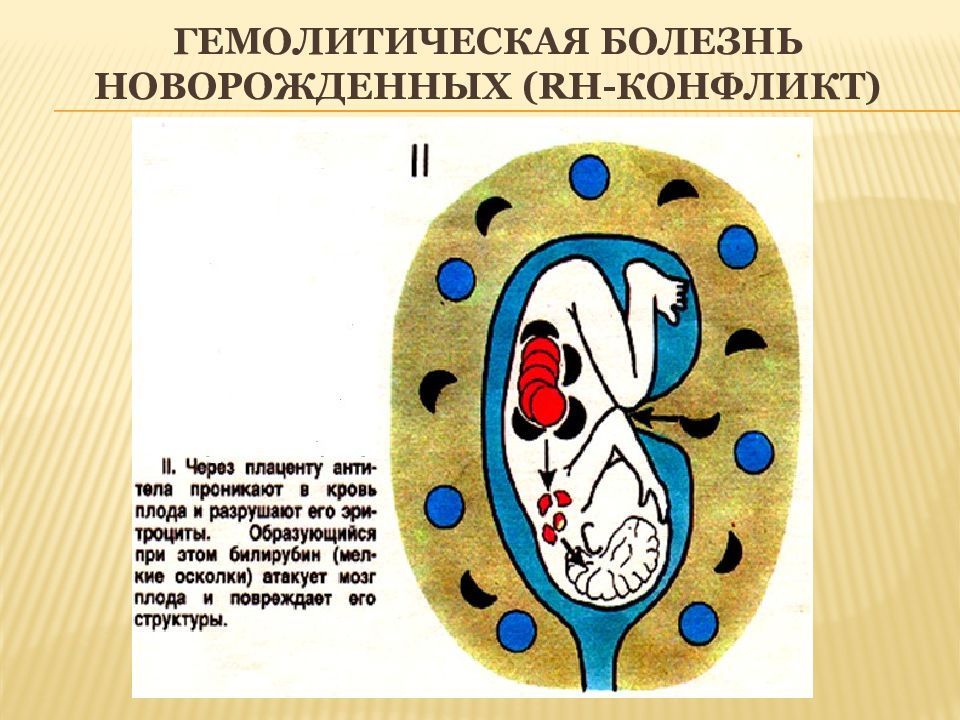
Суть феномена состоит в том, что гемолиз эритроцитов происходит у Rh(+) плодов, вынашиваемых Rh(-) матерями. Сенсибилизация у Rh (-) матерей может развиться в результате родов или абортов, поэтому частота абортов и родов усугубляет тяжесть Rh-конфликта и повышает интенсивность гемолиза. Антигены Rh-системы расположены на поверхности эритроцитов и повторная беременность протекает при развитии иммуноагрессии по отношению эритроцитов плода с их гемолизом.
Слайд 26: Гемолитическая болезнь новорожденных (Rh-конфликт)
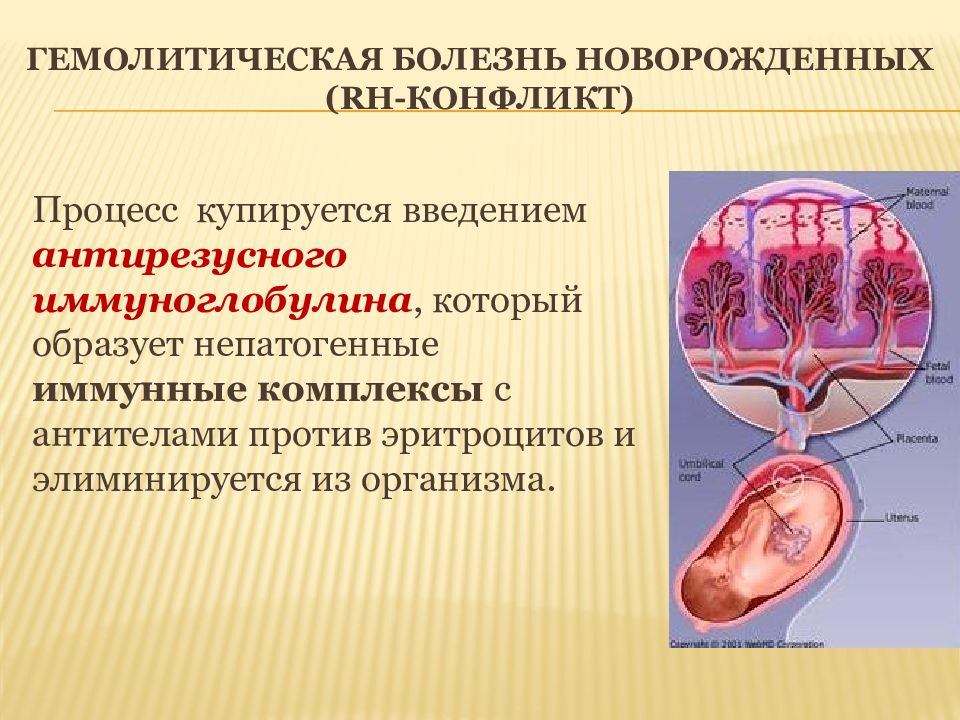
Процесс купируется введением антирезусного иммуноглобулина, который образует непатогенные иммунные комплексы с антителами против эритроцитов и элиминируется из организма.
Слайд 27: Гемолитическая болезнь новорожденных (Rh-конфликт)
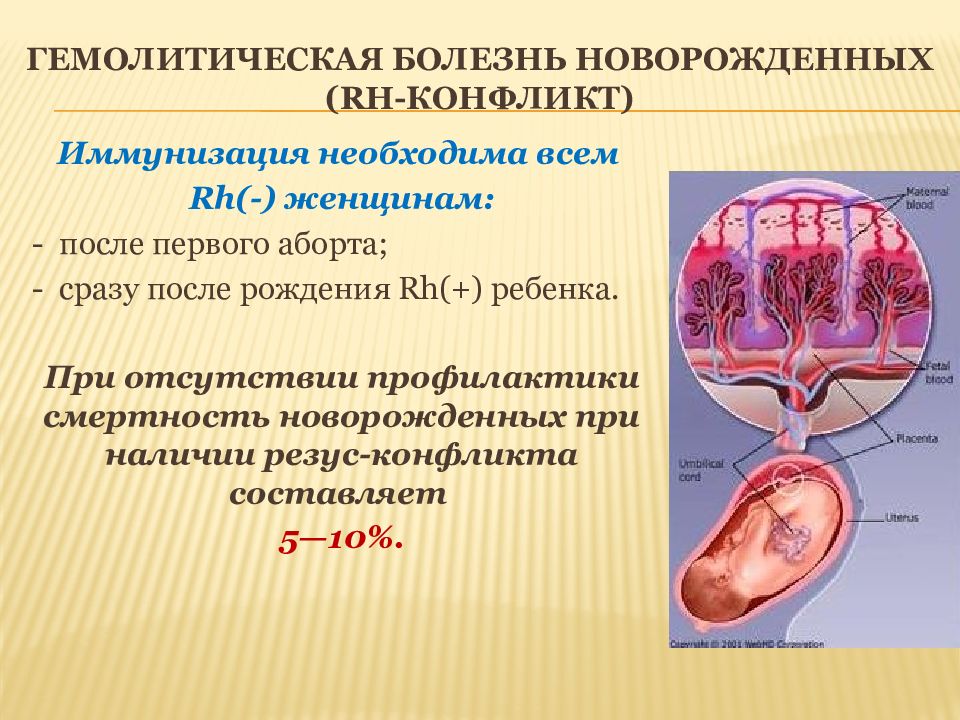
Иммунизация необходима всем Rh(-) женщинам: - после первого аборта; - сразу после рождения Rh(+) ребенка. При отсутствии профилактики смертность новорожденных при наличии резус-конфликта составляет 5—10%.
Слайд 30: Возрастные особенности иммунологической реактивности
Возрастные особенности онтогенеза иммунной системы новорожденных определяются как физиологическое иммунодефицитное состояние. В создании пассивного иммунитета в этот период большую роль играет IgG, проникший через плаценту из организма матери. Концентрация IgG у новорожденных в норме значительно превышает показатели взрослого человека, однако у них присутствует недостаток IgA - и IgM-антител.
Слайд 31: Возрастные особенности иммунологической реактивности
В раннем постнатальном периоде основные факторы иммунитета ребенок получает от матери через молозиво и молоко.
Слайд 32: Возрастные особенности иммунологической реактивности
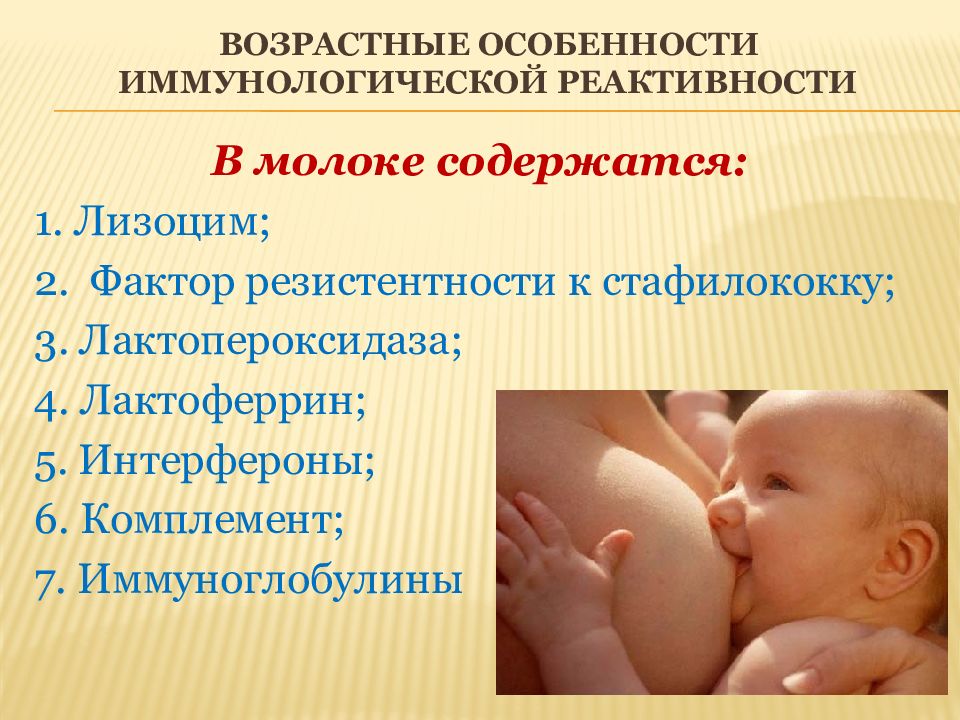
В молоке содержатся: 1. Лизоцим; 2. Фактор резистентности к стафилококку; 3. Лактопероксидаза ; 4. Лактоферрин ; 5. Интерфероны; 6. Комплемент; 7. Иммуноглобулины
Слайд 33: Возрастные особенности иммунологической реактивности
Иммуноглобулины молока IgM и IgG в форме сывороточных иммуноглобулинов, а IgA в основном в виде секреторного S-IgA, причем в молозиве S-IgA в 15—40 раз больше, чем в молоке.
Слайд 34: Возрастные особенности иммунологической реактивности
В молоке высокое содержание S-IgA восполняет недостаточность местного иммунитета кишечника ребенка и препятствует развитию инфекций, обусловленных Е.coli, пневмококками, стрептококками, холерным вибрионом и вирусом полиомиелита, к которым S-IgA имеет особое сродство.
Слайд 35: Возрастные особенности иммунологической реактивности
Период новорожденности характеризуется чрезвычайно большим диапазоном колебания содержания лимфоцитов в сыворотке крови (от 1,5 до 14,0х109 кл /л). Уровень Т-лимфоцитов значительно выше, чем в норме у взрослого (до 6,0х109 кл /л), а содержание В-лимфоцитов является достаточно низким. Функциональные особенности данных клеток к моменту рождения являются практически полностью сформированными
Слайд 36: Возрастные особенности иммунологической реактивности
Все лимфоциты детей первого года жизни можно разделить на 3 группы: 1 группа - функционально активные (18%); 2 группа - неактивные (54%); 3 группа - переходные формы (28%). Иммунная система новорожденных имеет высокие потенциальные возможности
Слайд 37: Возрастные особенности иммунологической реактивности
У новорожденных IgG на 80% имеют материнское происхождение, физиологическое снижение его концентрации обычно можно наблюдать к концу периода лактации.
Слайд 38: Возрастные особенности иммунологической реактивности
Активизация синтеза IgG и IgM начинается со 2-й недели жизни ребенка и уровня взрослого достигает в среднем к 5-6 годам, так же как и синтез Ig A и IgD.
Последний слайд презентации: Особенности функционирования иммунной системы при беременности, лактации и: Возрастные особенности иммунологической реактивности
IgE синтезируется уже в течение первого месяца жизни, его концентрация: - резко увеличивается к 1 году (с 0,01 г/л до 0,5 г/л), - постепенно нарастает до 10 лет (до 1,0-1,2 г/л) - к периоду полового созревания снижается до физиологических показателей взрослого человека.