Первый слайд презентации: Пространственная изомерия органических соединений
Лекция 4
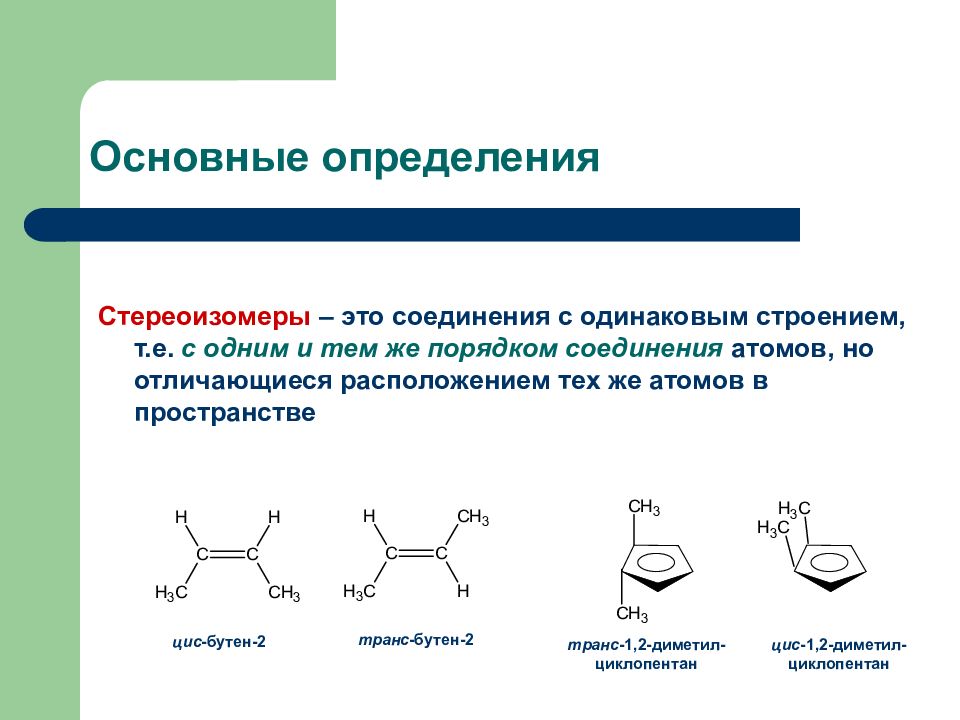
Слайд 2: Основные определения
Стереоизомеры – это соединения с одинаковым строением, т.е. с одним и тем же порядком соединения атомов, но отличающиеся расположением тех же атомов в пространстве цис -бутен-2 транс -бутен-2 цис -1,2-диметил-циклопентан транс -1,2-диметил-циклопентан
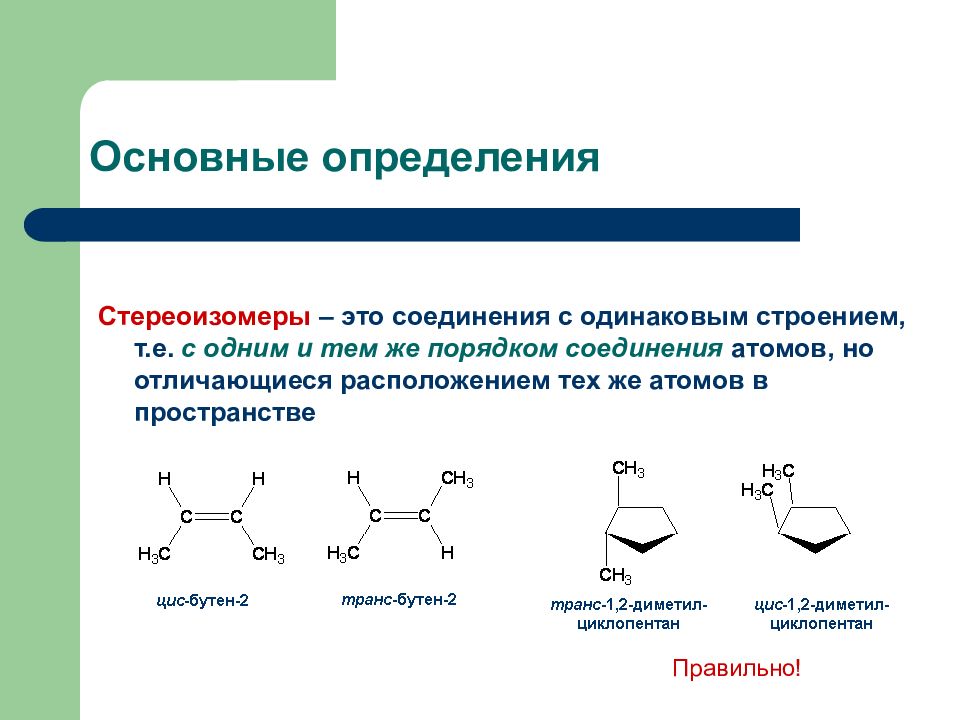
Слайд 3: Основные определения
Стереоизомеры – это соединения с одинаковым строением, т.е. с одним и тем же порядком соединения атомов, но отличающиеся расположением тех же атомов в пространстве Правильно!
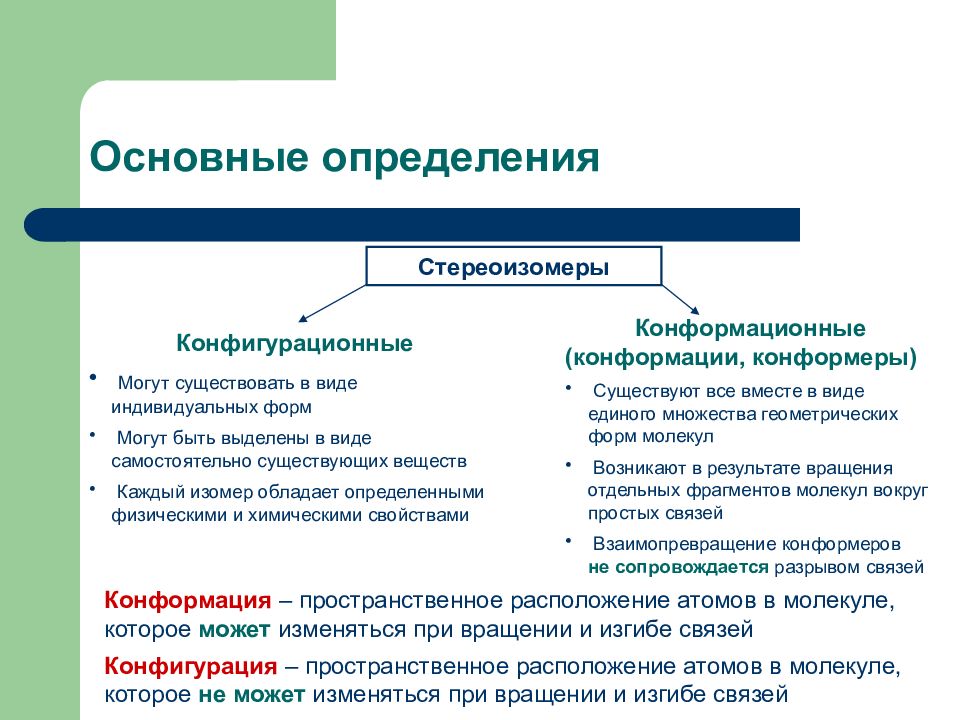
Слайд 4: Основные определения
Стереоизомеры Конфигурационные Могут существовать в виде индивидуальных форм Могут быть выделены в виде самостоятельно существующих веществ Каждый изомер обладает определенными физическими и химическими свойствами Конформационные (конформации, конформеры) Существуют все вместе в виде единого множества геометрических форм молекул Возникают в результате вращения отдельных фрагментов молекул вокруг простых связей Взаимопревращение конформеров не сопровождается разрывом связей Конформация – пространственное расположение атомов в молекуле, которое может изменяться при вращении и изгибе связей Конфигурация – пространственное расположение атомов в молекуле, которое не может изменяться при вращении и изгибе связей
Слайд 5: Внутримолекулярное вращение по σ -связям
http:// www.chemistry.ssu.samara.ru
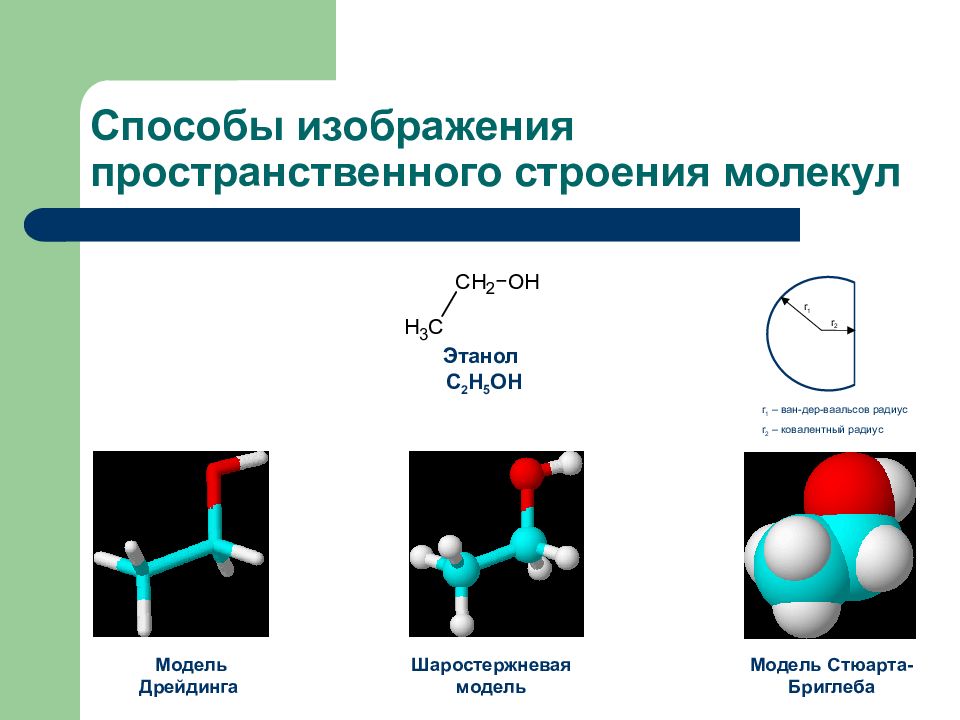
Этанол С 2 Н 5 ОН Шаростержневая модель Модель Дрейдинга Модель Стюарта-Бриглеба r 1 r 2 r 1 – ван-дер-ваальсов радиус r 2 – ковалентный радиус
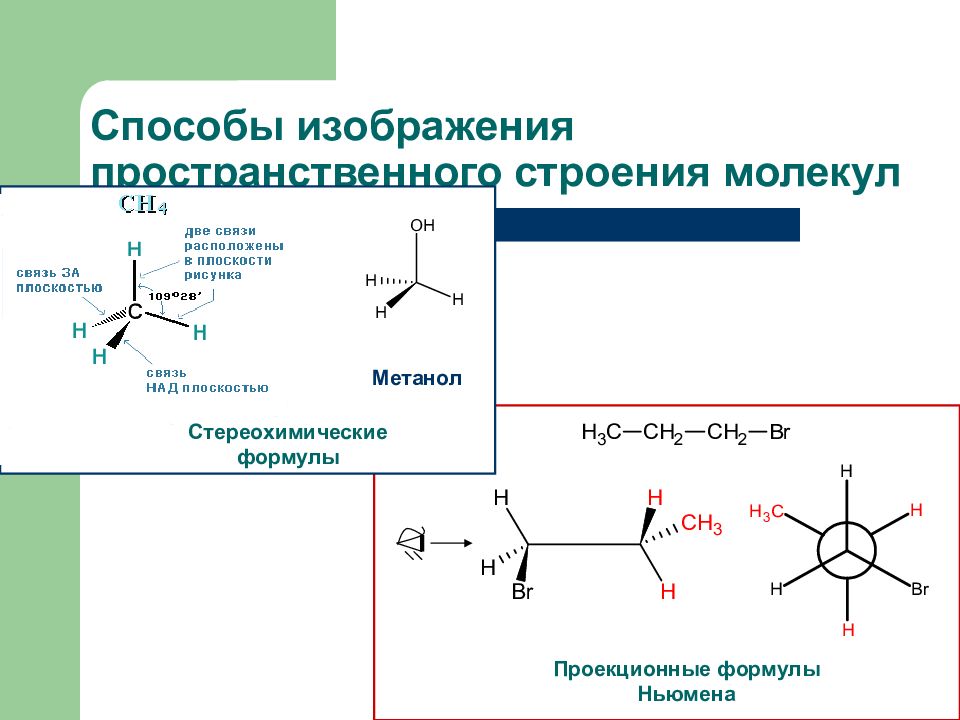
Слайд 7: Способы изображения пространственного строения молекул
Проекционные формулы Ньюмена Стереохимические формулы Метанол
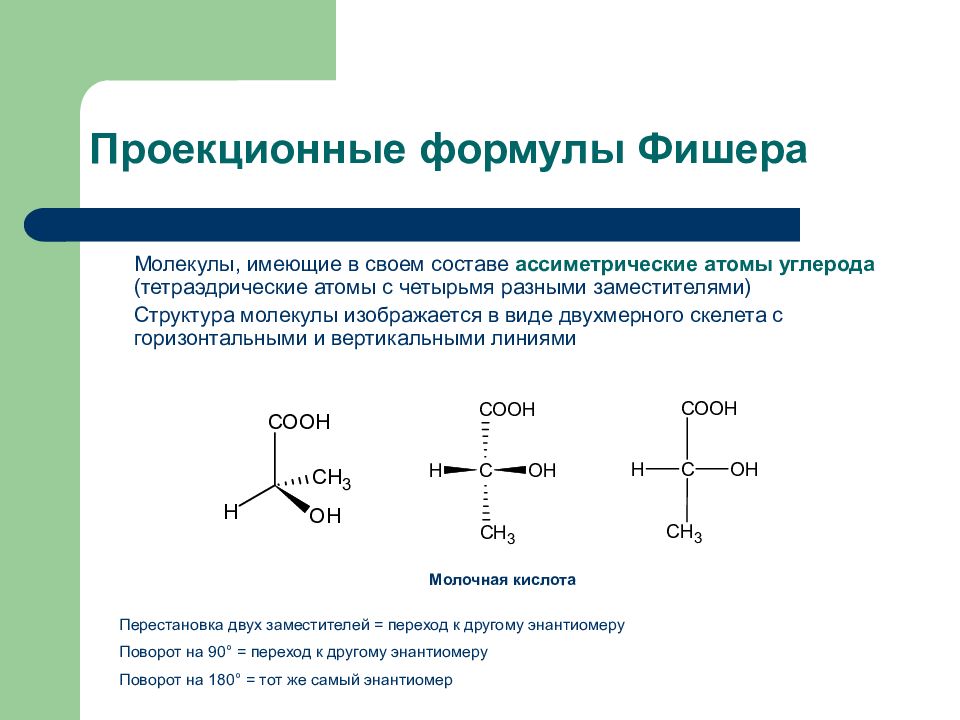
Слайд 8: Проекционные формулы Фишера
Молекулы, имеющие в своем составе ассиметрические атомы углерода (тетраэдрические атомы с четырьмя разными заместителями) Структура молекулы изображается в виде двухмерного скелета с горизонтальными и вертикальными линиями Молочная кислота Перестановка двух заместителей = переход к другому энантиомеру Поворот на 90 ° = переход к другому энантиомеру Поворот на 180 ° = тот же самый энантиомер
Правила последовательности Кана-Ингольда-Прелога – определение старшинства заместителей 2-гидроксипропановая кислота Старшинство заместителей убывает по часовой стрелке (лат. rectus – правый) Старшинство заместителей убывает против часовой стрелки (лат. sinister – левый) Младший заместитель (Н) направлен за плоскость рисунка, от нас
Слайд 10: Правила старшинства заместителей Кана-Прелога-Ингольда
Учитывается: Атомный номер Атомная масса (в случае изотопов) Неподеленная электронная пара – самый младший заместитель Если у ближайшего атома показатели совпадают, старшинство определяют по второму, третьему и т.д. слоям атомов Наличие кратных связей Стереохимия заместителей и пр.
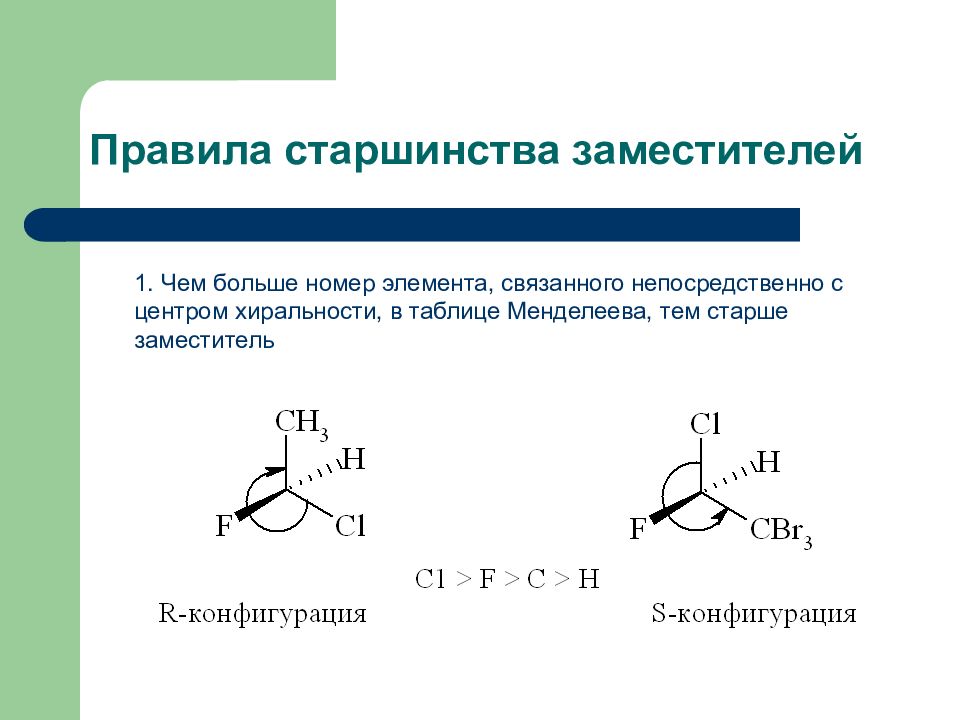
Слайд 11: Правила старшинства заместителей
1. Чем больше номер элемента, связанного непосредственно с центром хиральности, в таблице Менделеева, тем старше заместитель
Слайд 12: Правила старшинства заместителей
2. Неподеленная пара электронов (НПЭ) - самый младший заместитель Правила старшинства заместителей
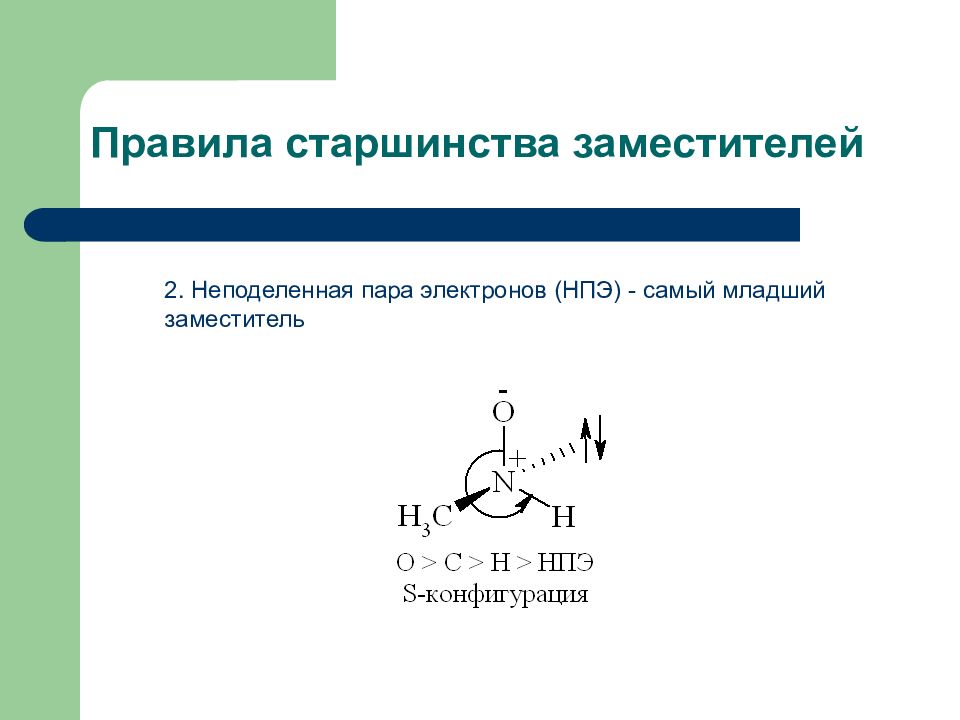
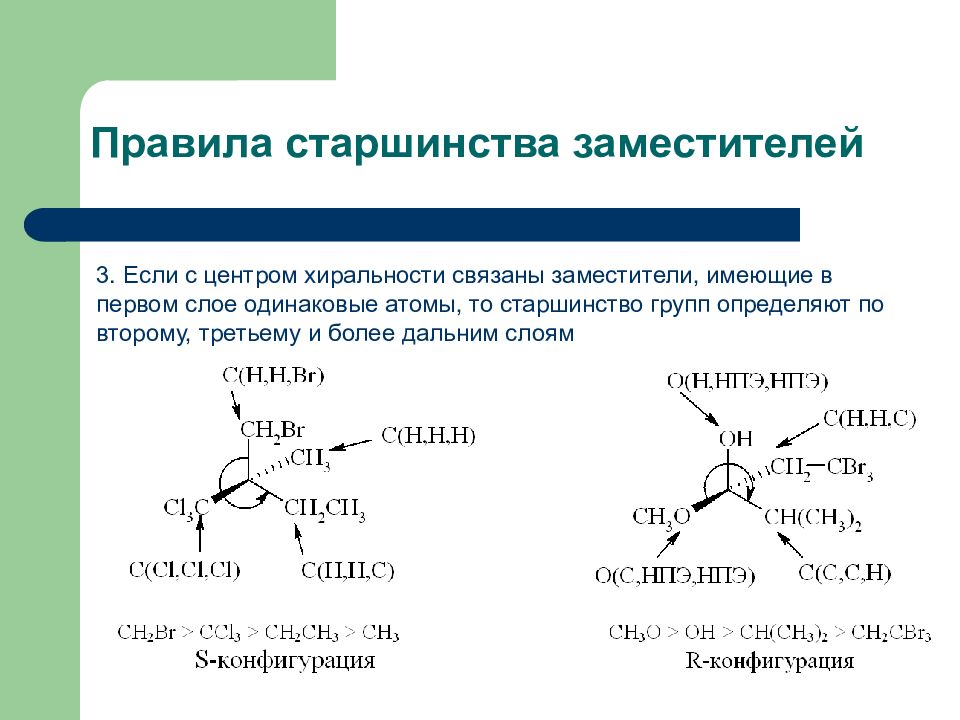
Слайд 13: Правила старшинства заместителей
3. Если с центром хиральности связаны заместители, имеющие в первом слое одинаковые атомы, то старшинство групп определяют по второму, третьему и более дальним слоям
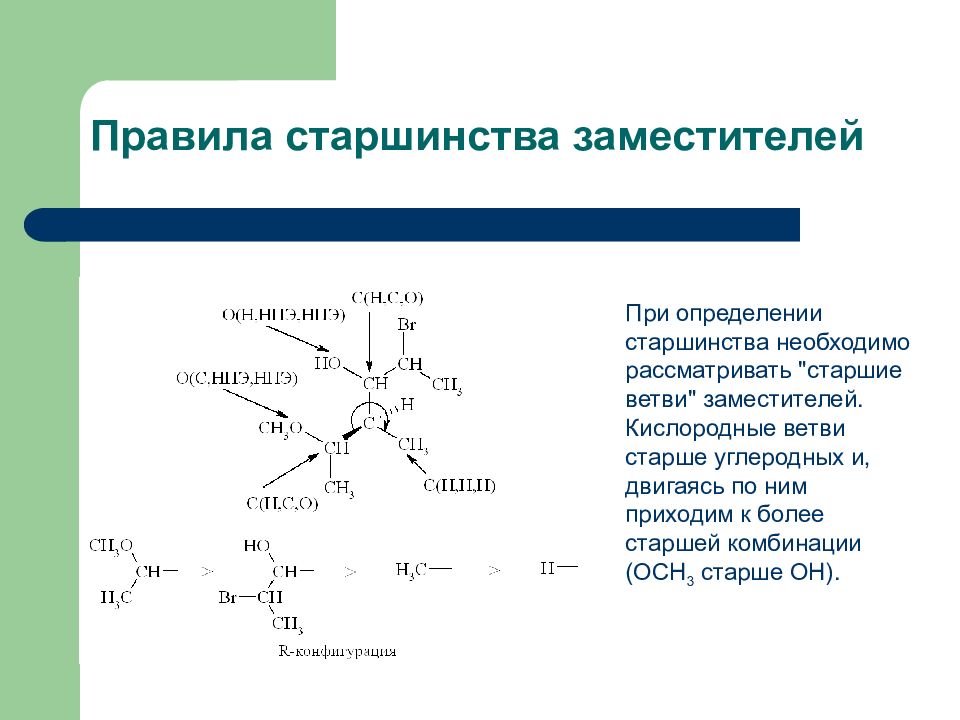
Слайд 14: Правила старшинства заместителей
При определении старшинства необходимо рассматривать "старшие ветви" заместителей. Кислородные ветви старше углеродных и, двигаясь по ним приходим к более старшей комбинации (ОСН 3 старше ОН).
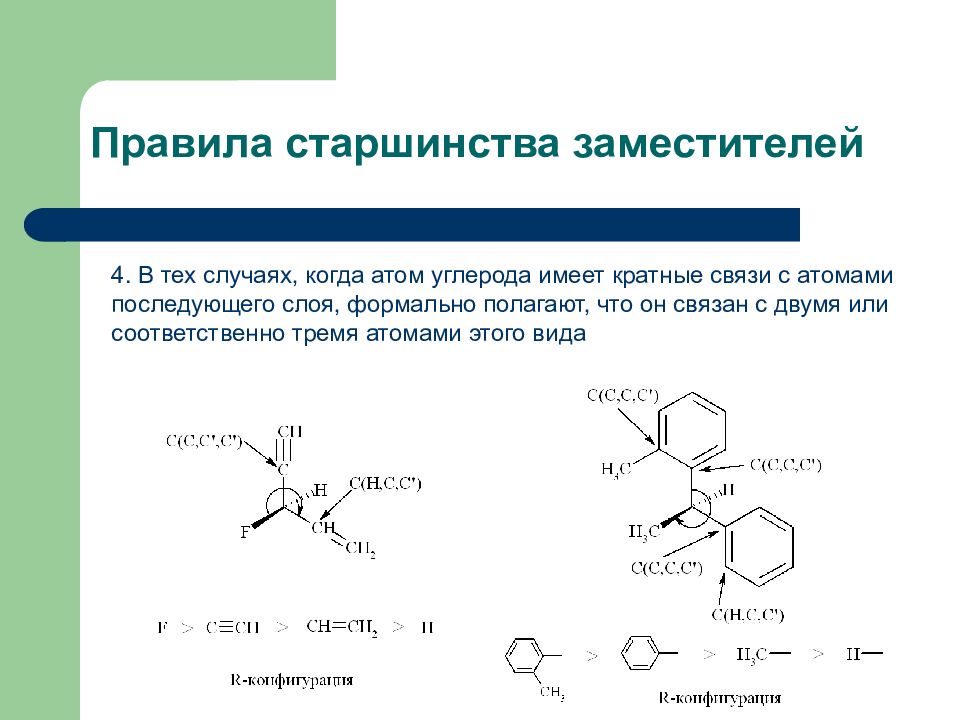
Слайд 15: Правила старшинства заместителей
4. В тех случаях, когда атом углерода имеет кратные связи с атомами последующего слоя, формально полагают, что он связан с двумя или соответственно тремя атомами этого вида
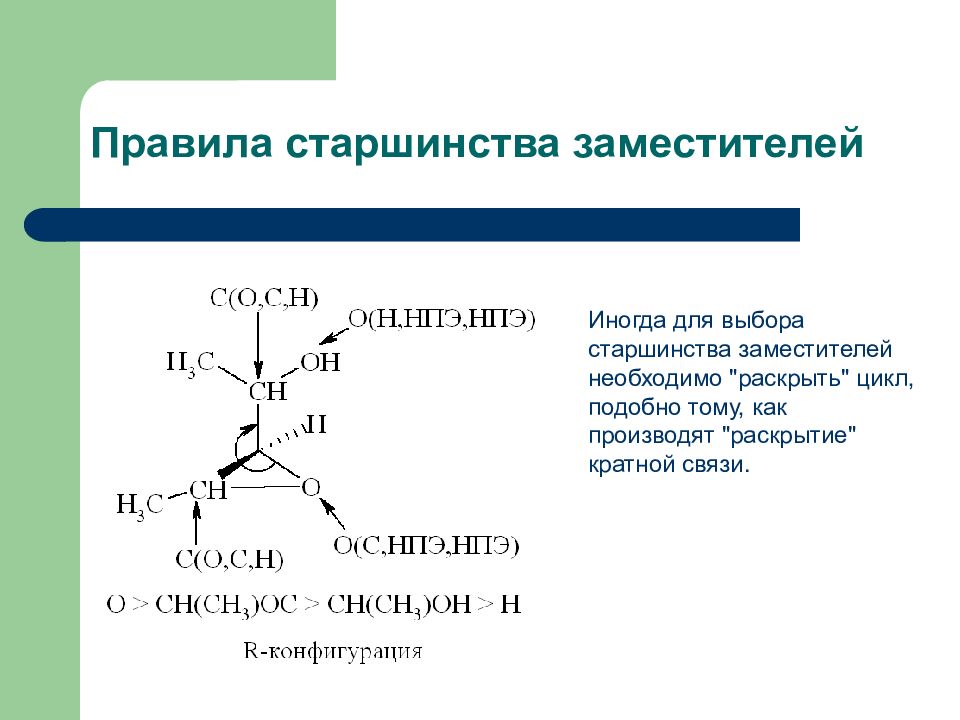
Слайд 16: Правила старшинства заместителей
Иногда для выбора старшинства заместителей необходимо "раскрыть" цикл, подобно тому, как производят "раскрытие" кратной связи.
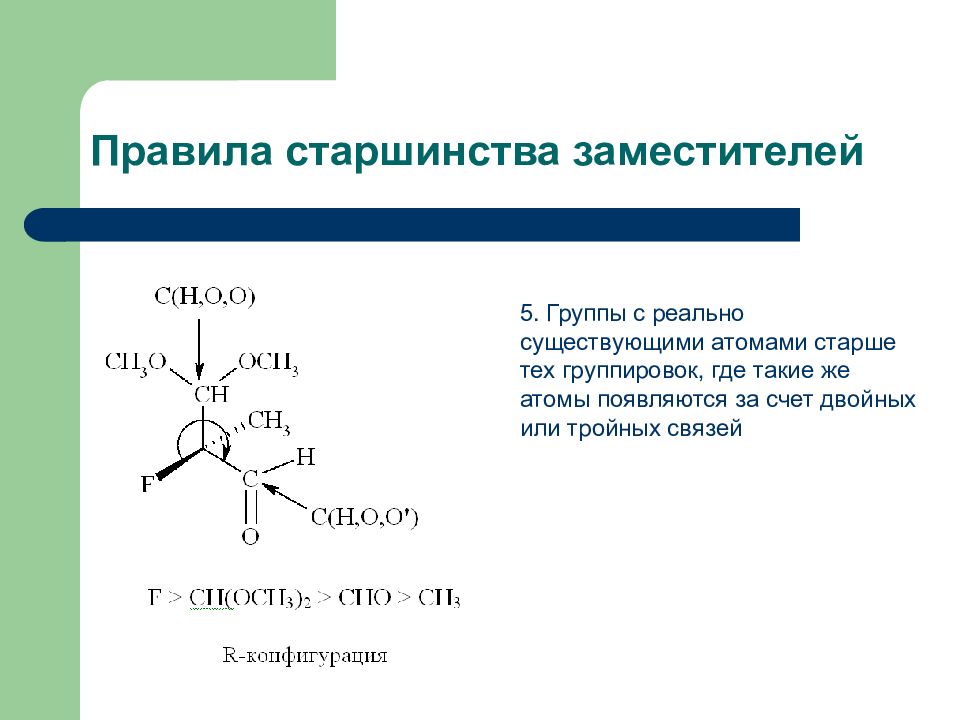
Слайд 17: Правила старшинства заместителей
5. Группы с реально существующими атомами старше тех группировок, где такие же атомы появляются за счет двойных или тройных связей
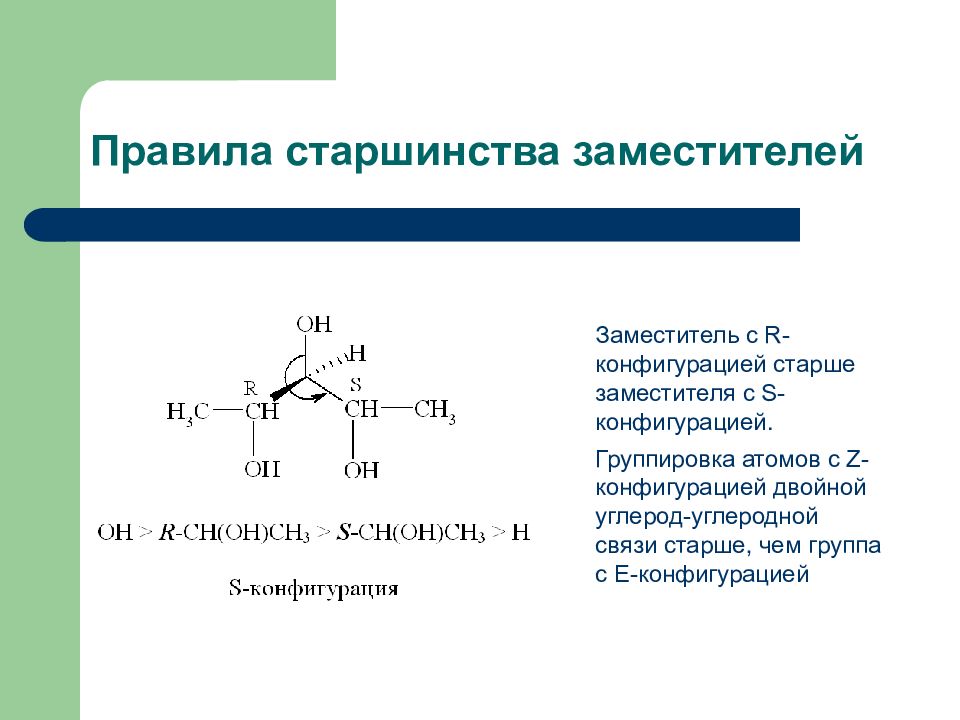
Слайд 18: Правила старшинства заместителей
Заместитель с R -конфигурацией старше заместителя с S -конфигурацией. Группировка атомов с Z -конфигурацией двойной углерод-углеродной связи старше, чем группа с Е-конфигурацией
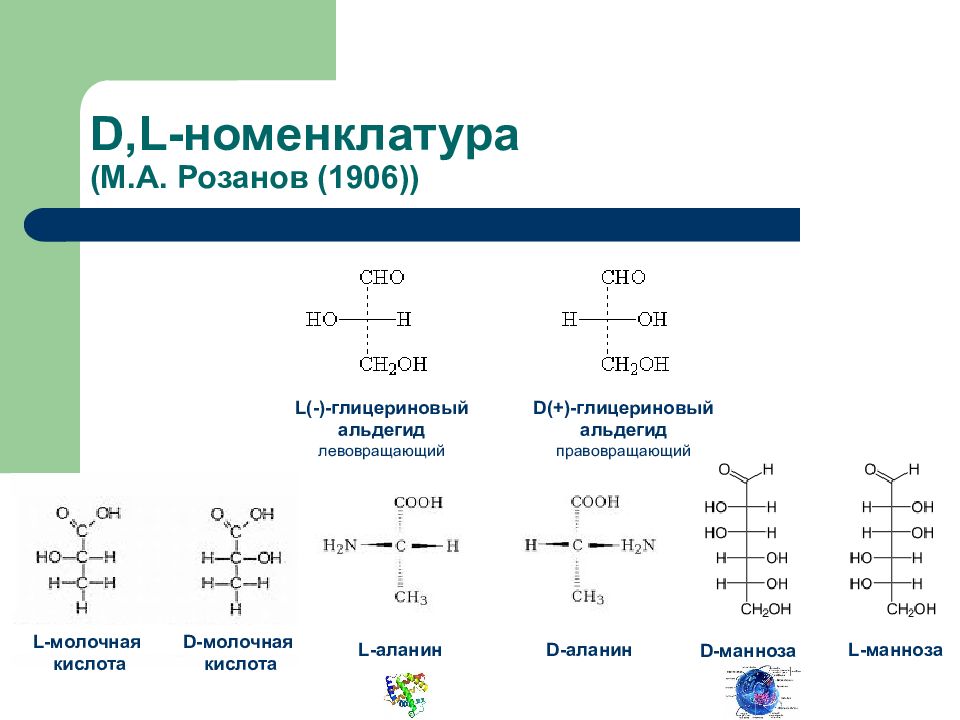
Слайд 19: D,L -номенклатура (М.А. Розанов (1906))
L(-)- глицериновый альдегид левовращающий D(+)- глицериновый альдегид правовращающий L -молочная кислота D -молочная кислота D- аланин L- аланин D- манноза L- манноза
Слайд 20: Хиральность
Хиральность - отсутствие симметрии относительно правой и левой стороны. если отражение объекта в идеальном плоском зеркале отличается от самого объекта, то объекту присуща хиральность:
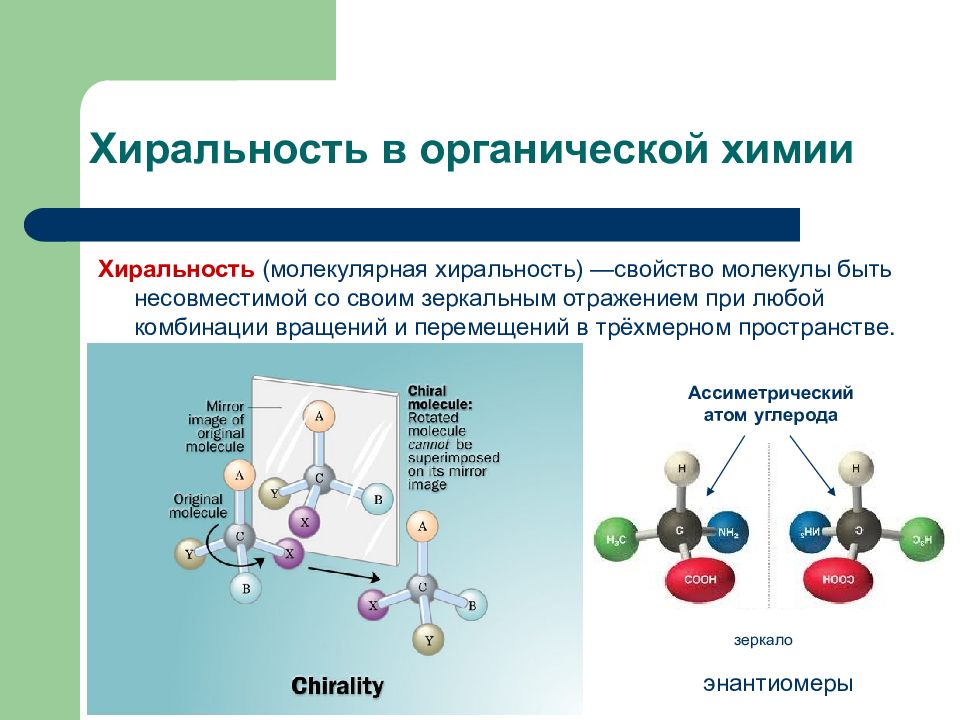
Слайд 21: Хиральность в органической химии
Хиральность (молекулярная хиральность) —свойство молекулы быть несовместимой со своим зеркальным отражением при любой комбинации вращений и перемещений в трёхмерном пространстве. зеркало Ассиметрический атом углерода энантиомеры
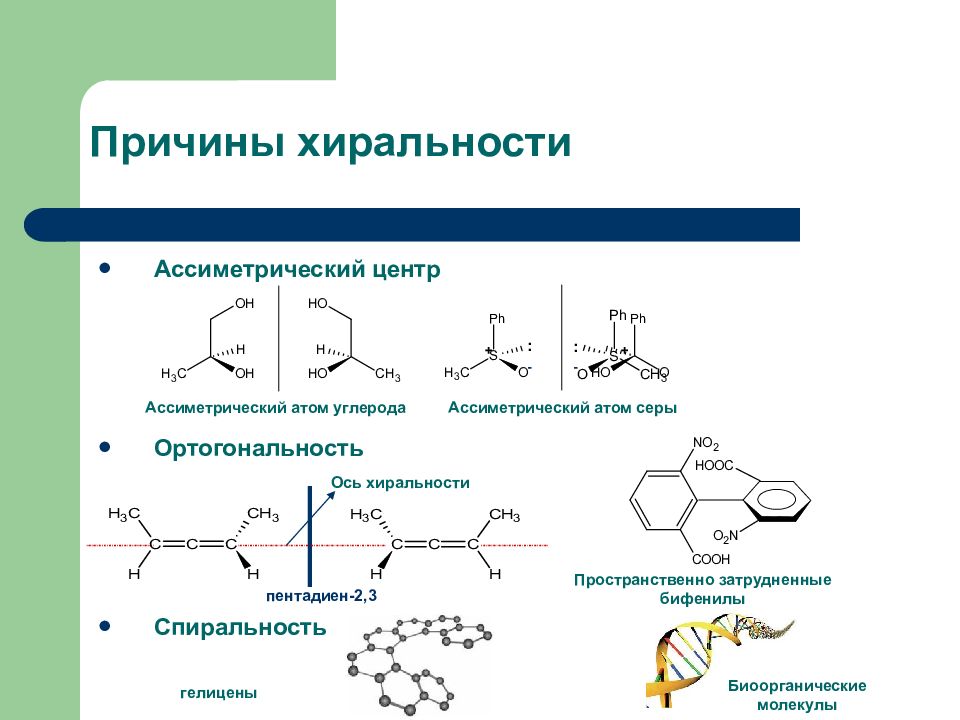
Слайд 22: Причины хиральности
Ассиметрический центр Ортогональность Спиральность : + - - : + Ассиметрический атом углерода Ассиметрический атом серы Пространственно затрудненные бифенилы гелицены Биоорганические молекулы Ось хиральности пентадиен-2,3
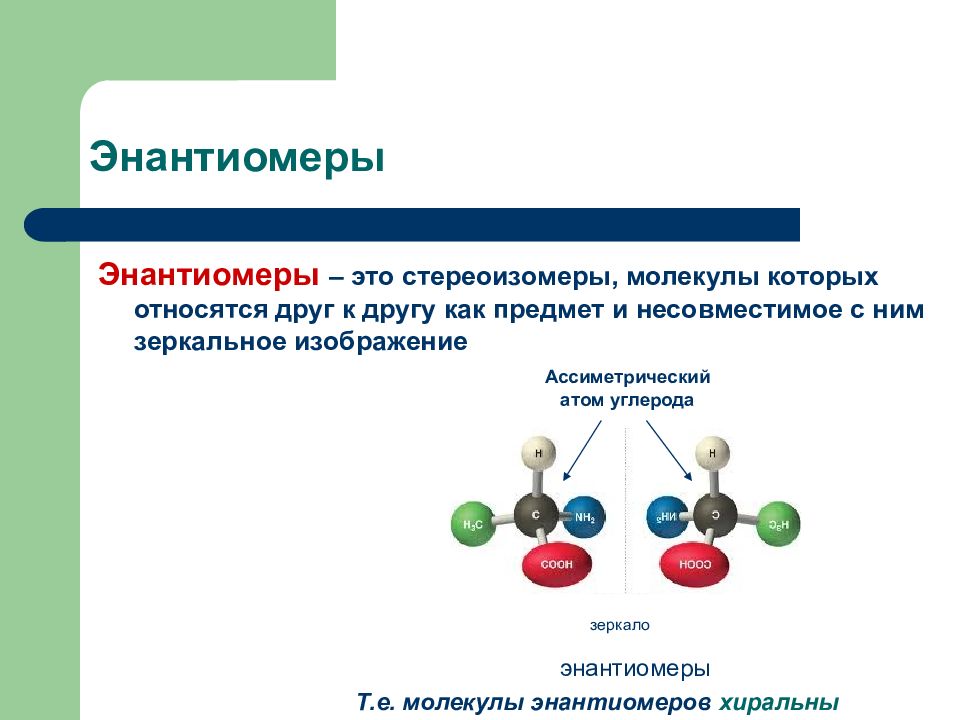
Слайд 23: Энантиомеры
Энантиомеры – это стереоизомеры, молекулы которых относятся друг к другу как предмет и несовместимое с ним зеркальное изображение зеркало Ассиметрический атом углерода энантиомеры Т.е. молекулы энантиомеров хиральны
Слайд 24: Свойства энантиомеров
Одинаковые физические свойства - температура плавления, температура кипения - плотность - растворимость (в ахиральной среде ) - показатель преломления Одинаковые химические свойства в ахиральном окружении Различная оптическая активность (способность отклонять плоскость плоскополяризованного света) - правовращающие (+) - левовращающие (-) Свойства энантиомеров
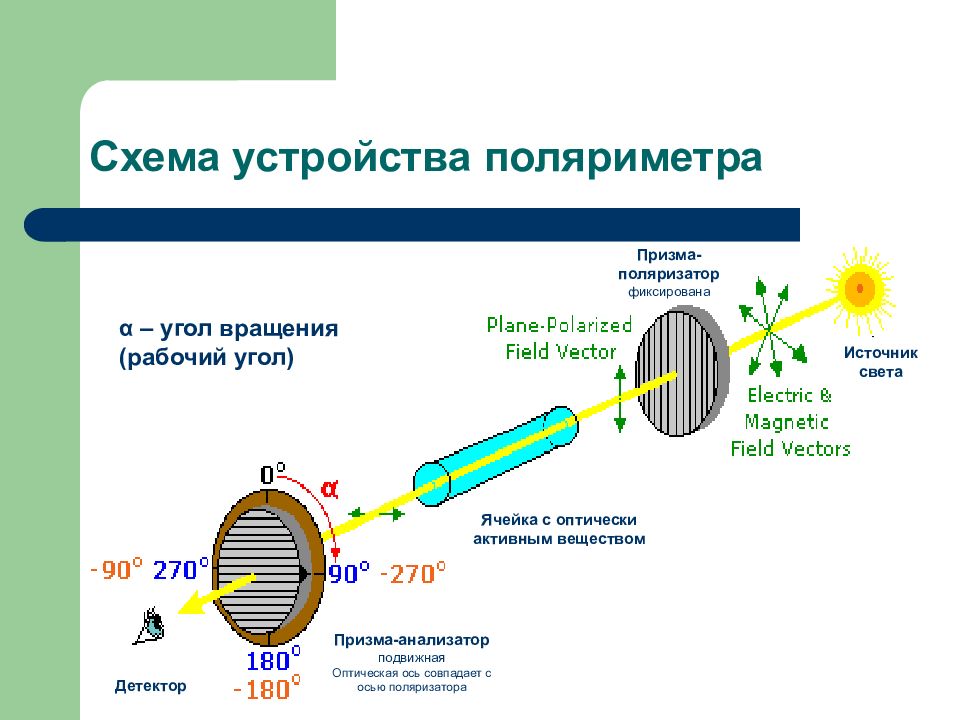
Слайд 25: Схема устройства поляриметра
Источник света Призма-поляризатор фиксирована Ячейка с оптически активным веществом Призма-анализатор подвижная Оптическая ось совпадает с осью поляризатора Детектор α – угол вращения (рабочий угол)
Слайд 26: Удельное вращение [ α ]
Сравнение оптической активности образцов Определение ЭИ Показатель качества природных компонентов (например, эфирных масел) Удельное вращение: Энантиомерный избыток: α – наблюдаемое вращение образца, град С – концентрация l – длина кюветы, дм При температуре t ºC и λ = 589,3 нм %
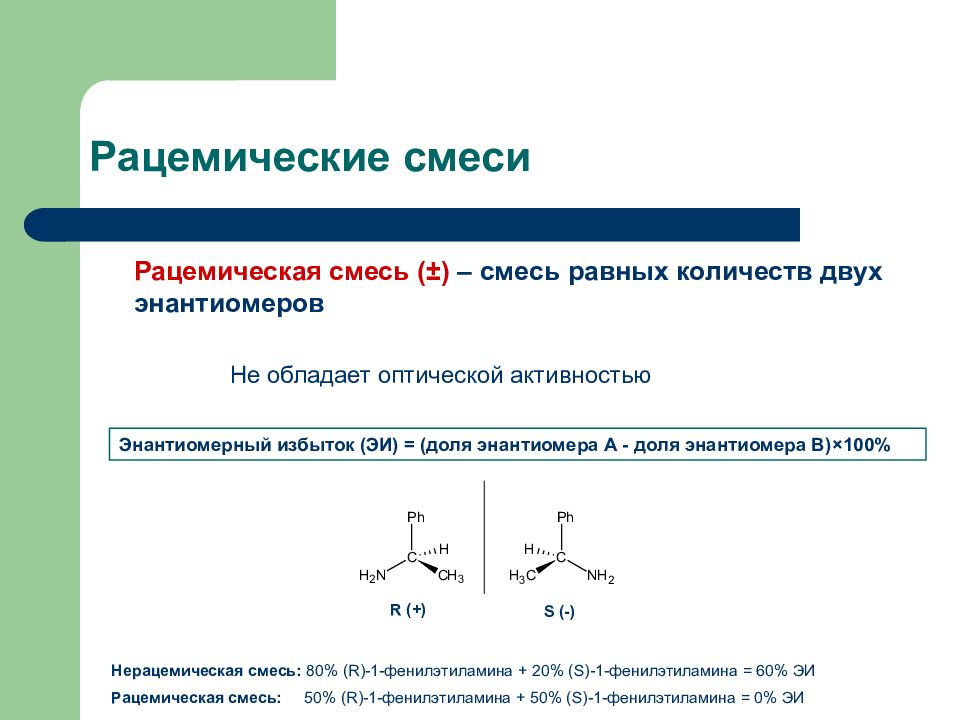
Слайд 27: Рацемические смеси
Рацемическая смесь ( ± ) – смесь равных количеств двух энантиомеров Не обладает оптической активностью Энантиомерный избыток (ЭИ) = (доля энантиомера А - доля энантиомера В) × 100% R (+) S (-) Нерацемическая смесь: 80% ( R )-1-фенилэтиламина + 20% ( S )-1-фенилэтиламина = 60% ЭИ Рацемическая смесь: 5 0% ( R )-1-фенилэтиламина + 5 0% ( S )-1-фенилэтиламина = 0% ЭИ
Слайд 28: Диастереомеры
Диастереомеры – это стереоизомеры, молекулы которых не относятся друг к другу как предмет и несовместимое с ним зеркальное отражение Диастереомеры различаются по физико-химическим свойствам (температуры плавления, растворимость, теплоты образования, реакционная способность) Соединения, молекулы которых имеют два и более центра хиральности
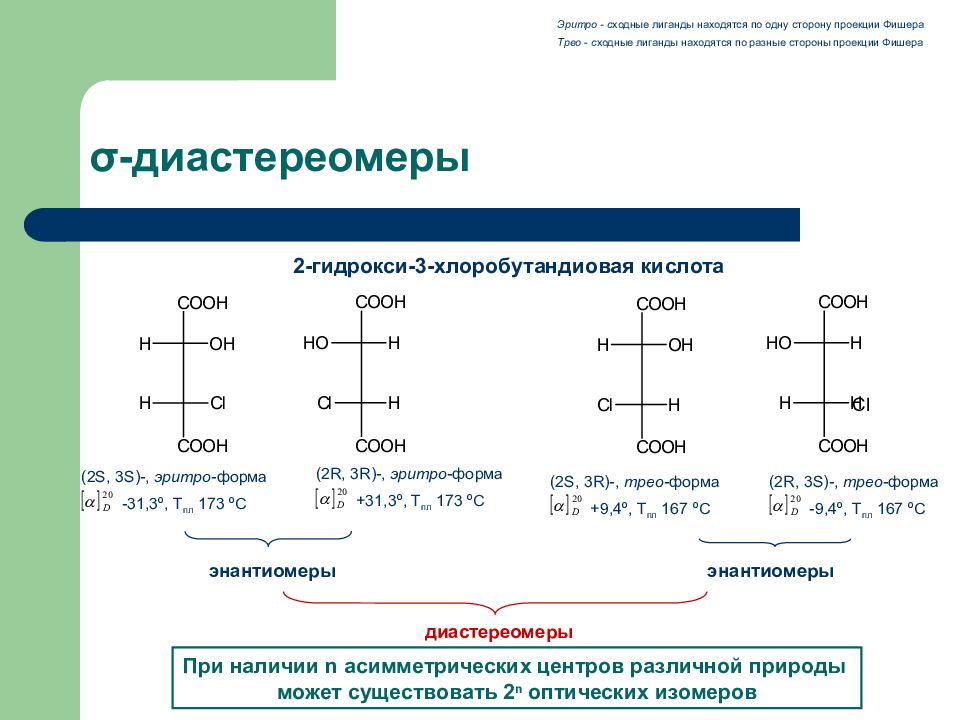
Слайд 29: σ -диастереомеры
(2 R, 3S)-, трео -форма - 9,4 º, Т пл 167 º С 2-гидрокси-3-хлоробутандиовая кислота Эритро - с ходные лиганды находятся по одну сторону проекции Фишера Трео - с ходные лиганды находятся по разные стороны проекции Фишера (2 S, 3S)-, эритро -форма -31,3 º, Т пл 173 º С (2 R, 3R)-, эритро -форма +31,3 º, Т пл 173 º С (2 S, 3R)-, трео -форма +9, 4 º, Т пл 167 º С энантиомеры энантиомеры диастереомеры Cl При наличии n асимметрических центров различной природы может существовать 2 n оптических изомеров
Слайд 30: мезо -Формы
мезовинная кислота 0 º, Т пл 140 º С (2R,3R)- винная кислота +12 º, Т пл 170 º С (2S,3S)- винная кислота - 12 º, Т пл 170 º С (2R,3S)- винная кислота (2S,3R)- винная кислота Оптически неактивна (ассиметрические атомы углерода обладают противоположной конфигурацией) Если возможно существование мезо -форм, то число стереоизомеров равно (2 n /2 -1)(2 n /2 +1), если n – четное и 2 n-1, если n – нечетное число; n – число ассиметрических атомов углерода
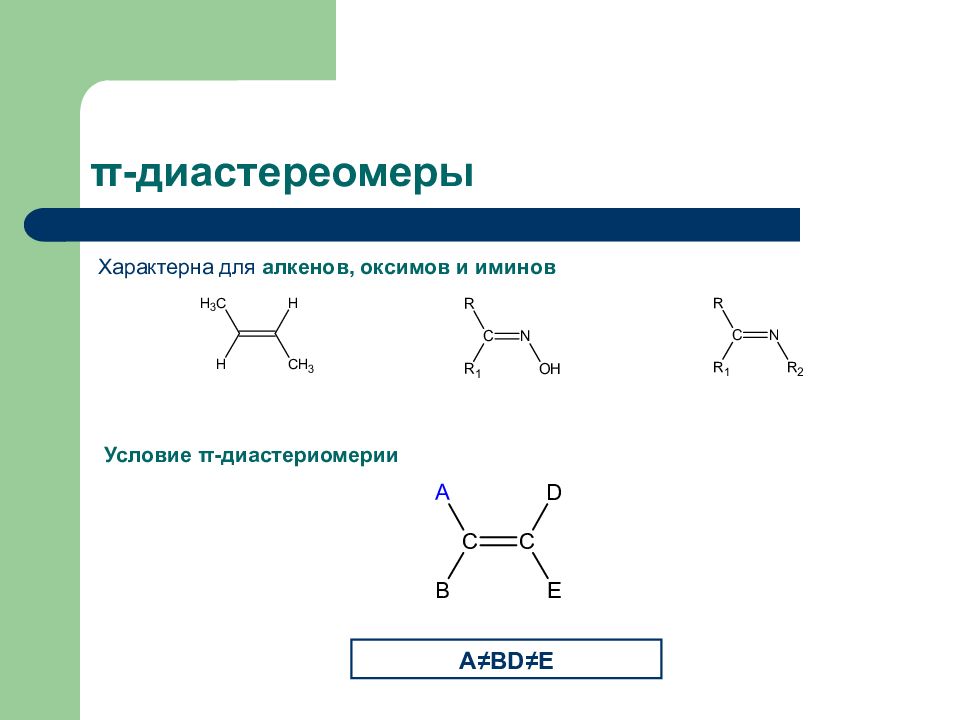
Слайд 31: π -диастереомеры
Характерна для алкенов, оксимов и иминов Условие π -диастериомерии A ≠B D≠E
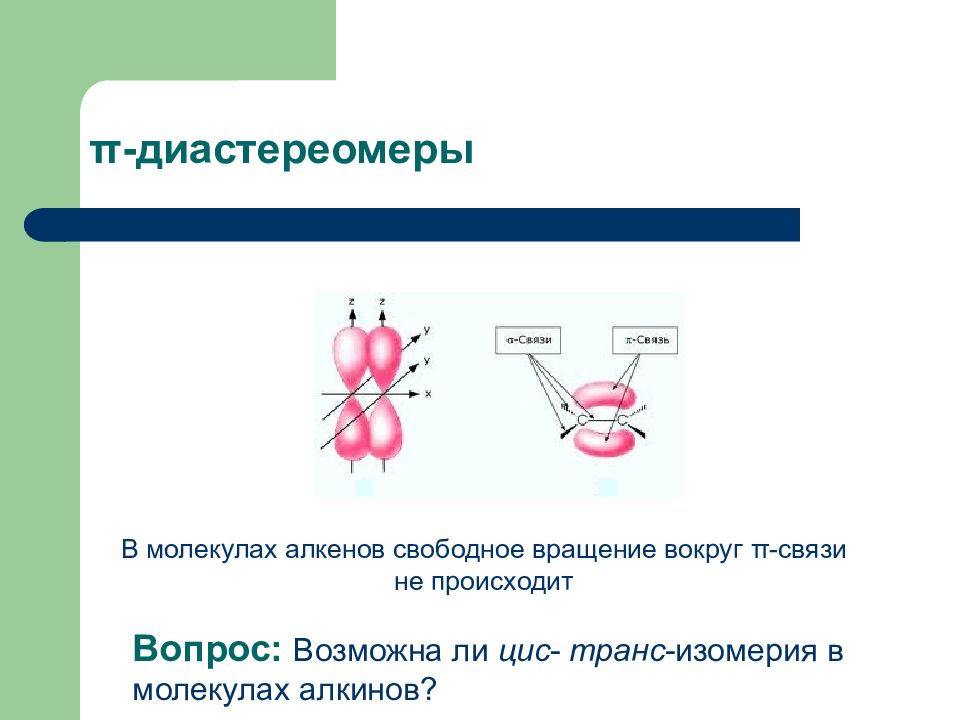
Слайд 32: π -диастереомеры
Вопрос: Возможна ли цис - транс -изомерия в молекулах алкинов? В молекулах алкенов свободное вращение вокруг π -связи не происходит π -диастереомеры
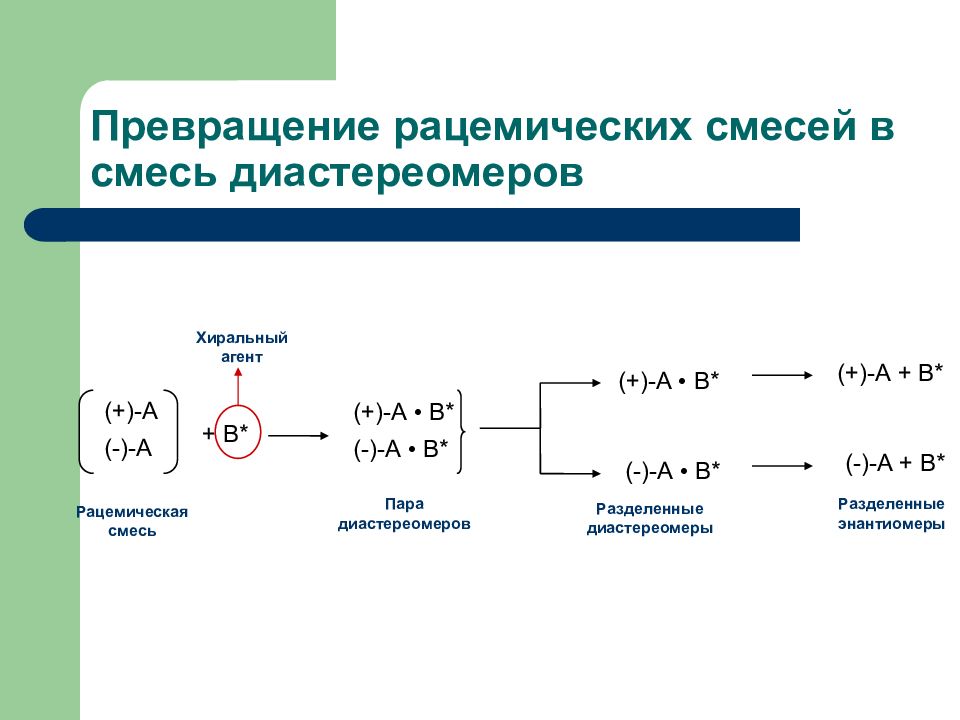
Слайд 33: Превращение рацемических смесей в смесь диастереомеров
(+)-А (-)-А + В* (+)-А • В* (-)-А • В* (+)-А • В* (-)-А • В* (+)-А + В* (-)-А + В* Рацемическая смесь Пара диастереомеров Разделенные диастереомеры Разделенные энантиомеры Хиральный агент
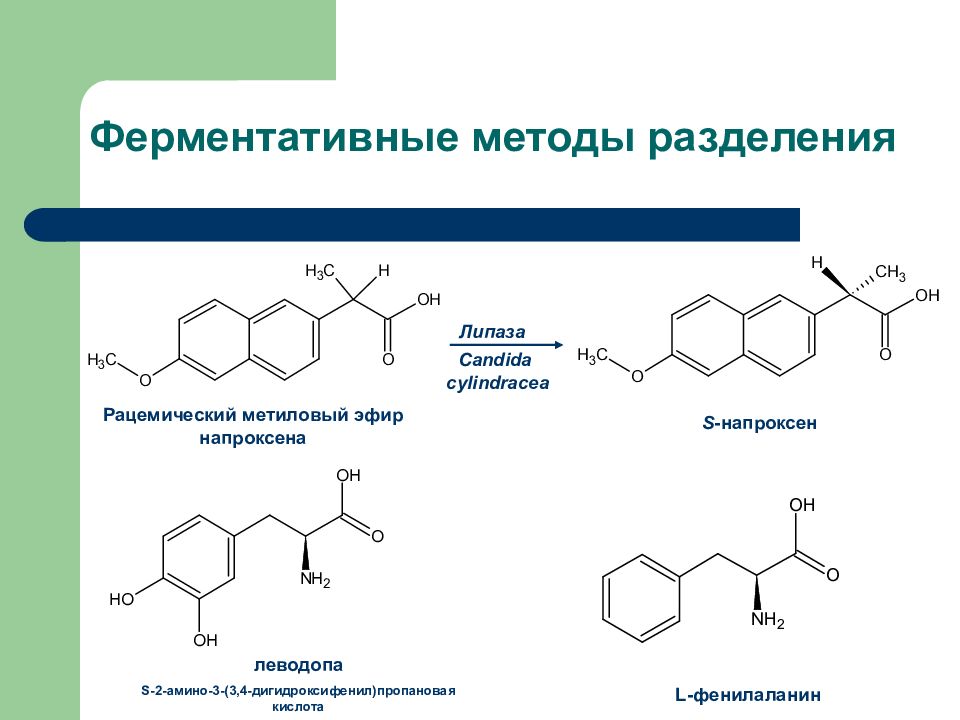
Слайд 34: Ферментативные методы разделения
Рацемический метиловый эфир напроксена S - напроксен Липаза Candida cylindracea леводопа S -2-амино-3-(3,4-дигидроксифенил)пропановая кислота L -фенилаланин






![Пространственная изомерия органических соединений Удельное вращение [ α ]](https://s1.showslide.ru/s_slide/c244a12a256f2958e2b8b02744bd4850/c966334e-9f53-441b-98b2-1deb44f08e19.jpeg)