Слайд 2
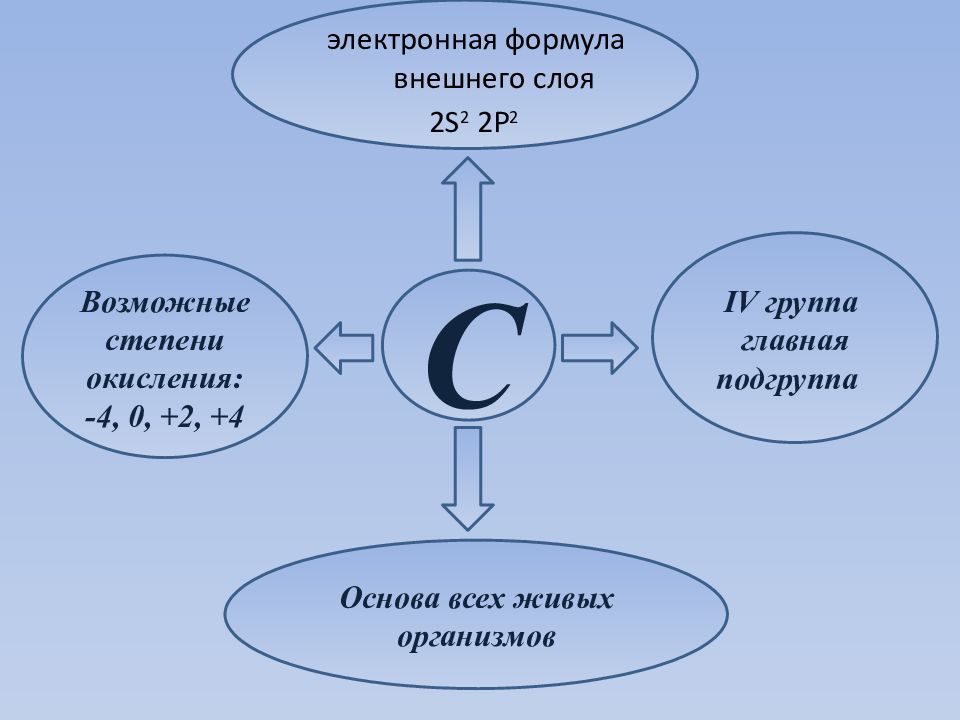
C IV группа главная подгруппа Возможные степени окисления: -4, 0, +2, +4 Основа всех живых организмов электронная формула внешнего слоя 2 S 2 2 P 2
Слайд 3
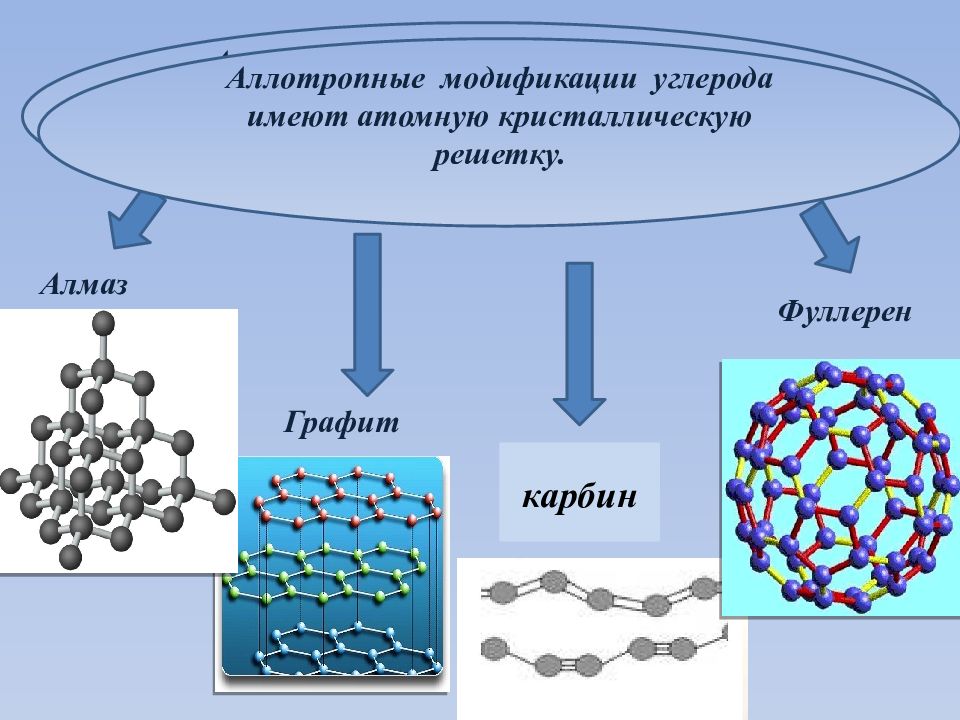
Аллотропные модификации углерода имеют атомную кристаллическую решетку. Алмаз Графит Фуллерен Аллотропные модификации углерода имеют атомную кристаллическую решетку. карбин
Слайд 4
Алмаз Применяется в: Обрабатывающей промышленности Электротехнике Горной промышленности Ювелирном производстве …это самое твердое вещество на Земле, тугоплавкое с высоким показателем преломления
Слайд 5
Графит …это мягкое серо-черное вещество, тугоплавкое, являющееся полупроводником со слоистой структурой. Применяется в: Графитовых стержнях-электродах Производстве теплозащитного материала для головных частей ракет (термостойкость) Получении тиглей Изготовлении минеральных красок Карандашной промышленности
Слайд 6: Карбин
Карбин — аллотропная форма углерода, состоит из углеродных фрагментов с тройной –С≡С–С≡С–, или двойной кумулированной =С=С=С=С= связью. Может быть линейным или образовывать циклические структуры. Карбин представляет собой мелкокристаллический порошок чёрного цвета (плотность 1,9÷2 г/см³), обладает полупроводниковыми свойствами. Получен в искусственных условиях из длинных цепочек атомов углерода, уложенных параллельно друг другу. Карбин — линейный полимер углерода
Слайд 7
Фуллерен Фуллерены планируют использовать: 1. Для создания фотоприемников 2. Для создания сверхпроводящих материалов 3. В качестве красителей для копировальных машин 4. В качестве основы для аккумуляторных батарей 5. Для создания оптоэлектронных устройств 6. В медицине и фармакологии … это новая аллотропная форма углерода, молекула которого состоит из 60-70 атомов, образующих сферу.
Стеклоуглерод состоит из чистого углерода с небольшой примесью высокомолекулярных углеводородов. Его структура сложна и сходна с фуллеренами. Благодаря этому он химически нейтрален и устойчив к коррозии при воздействии кислот, щелочей и растворителей. В нейтральном газе или в вакууме стеклоуглерод не разрушается и не плавится при нагревании до 3000 °C.
Слайд 9
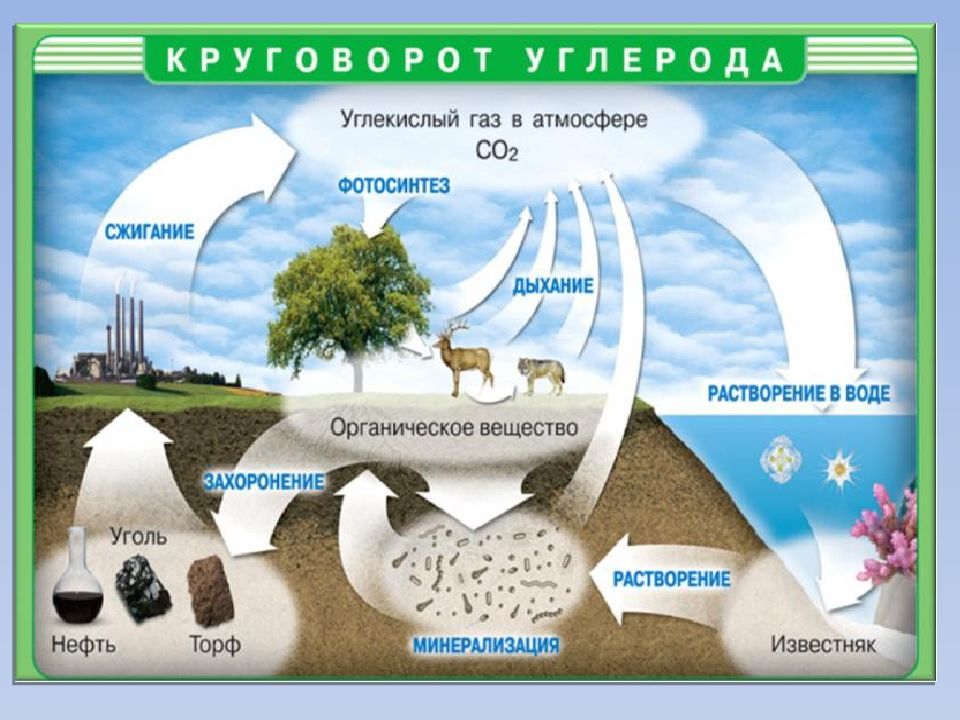
Нахождение в природе Мел, известняк, мрамор CaCO 3 Магнезит MgCO 3 Сидерит FeCO 3 В самородном виде: алмаз и графит В виде солей: Содержание углерода в земной коре 0,1 % по массе
Слайд 11
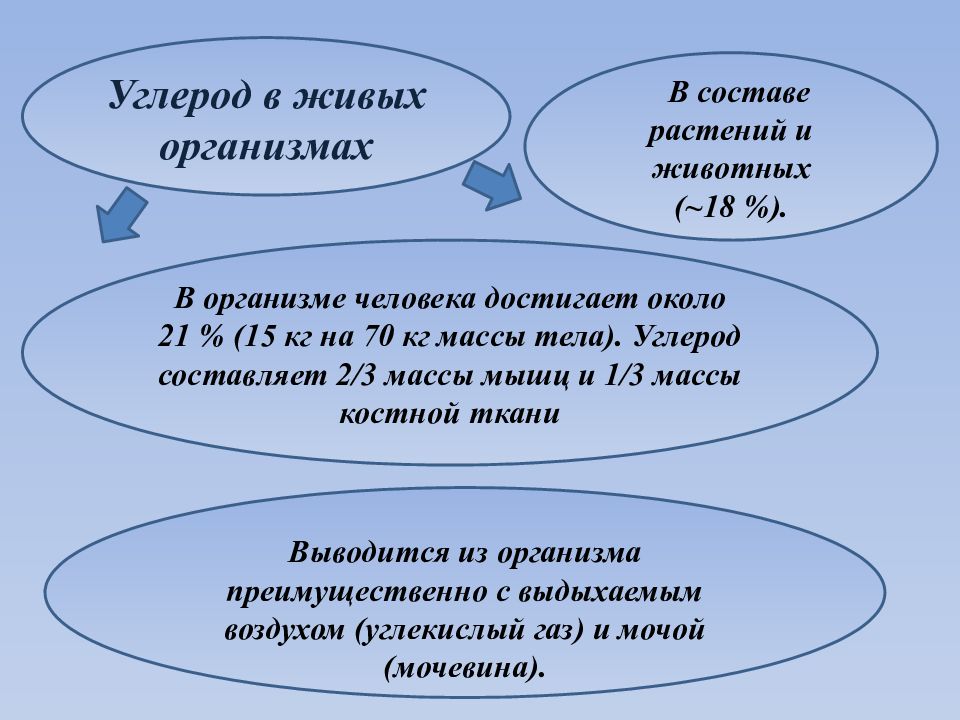
В составе растений и животных (~18 %). В организме человека достигает около 21 % (15 кг на 70 кг массы тела). Углерод составляет 2/3 массы мышц и 1/3 массы костной ткани Выводится из организма преимущественно с выдыхаемым воздухом (углекислый газ) и мочой (мочевина). Углерод в живых организмах
Слайд 12
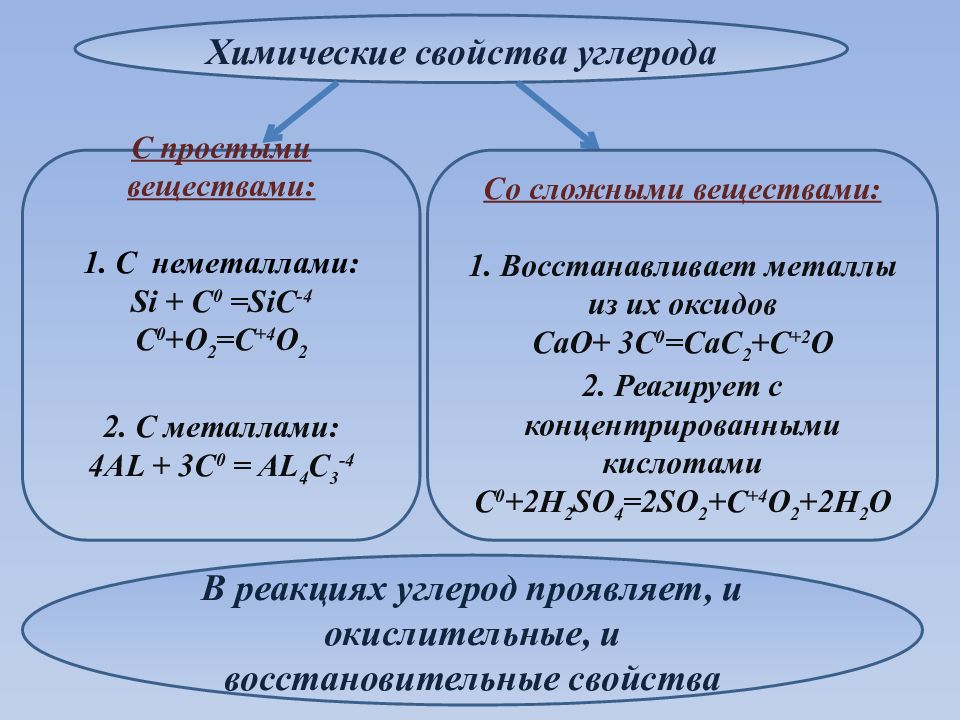
Химические свойства углерода Со сложными веществами: 1. Восстанавливает металлы из их оксидов CaO + 3C 0 =CaC 2 +C +2 O 2. Реагирует с концентрированными кислотам и С 0 + 2H 2 SO 4 =2SO 2 +C +4 O 2 +2H 2 O С простыми веществами: 1. С неметаллами: Si + C 0 =SiC -4 C 0 +O 2 =C +4 O 2 2. С металлами: 4AL + 3C 0 = AL 4 C 3 -4 В реакциях углерод проявляет, и окислительные, и восстановительные свойства
Слайд 13
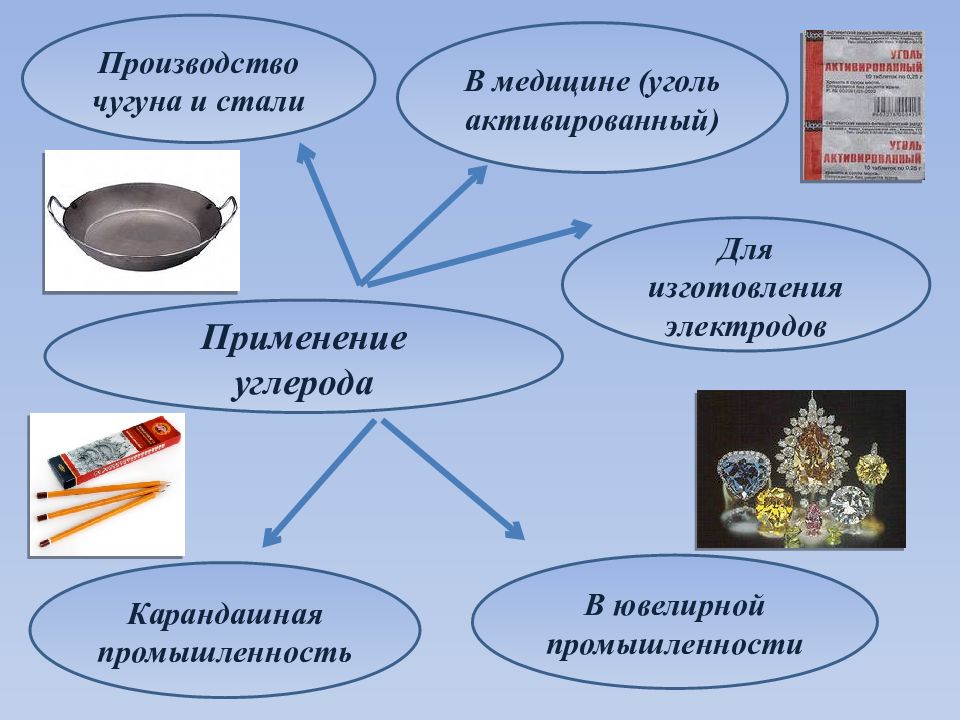
Применение углерода Производство чугуна и стали В медицине (уголь активированный) Карандашная промышленность Для изготовления электродов В ювелирной промышленности
Слайд 14
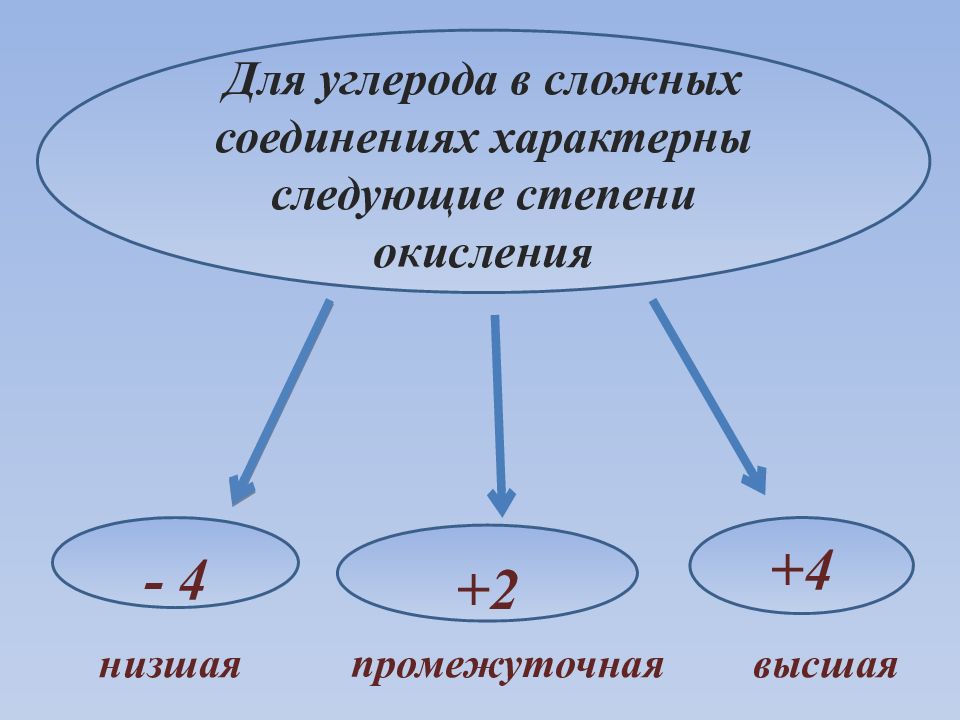
Для углерода в сложных соединениях характерны следующие степени окисления - 4 +4 +2 низшая промежуточная высшая
Слайд 15
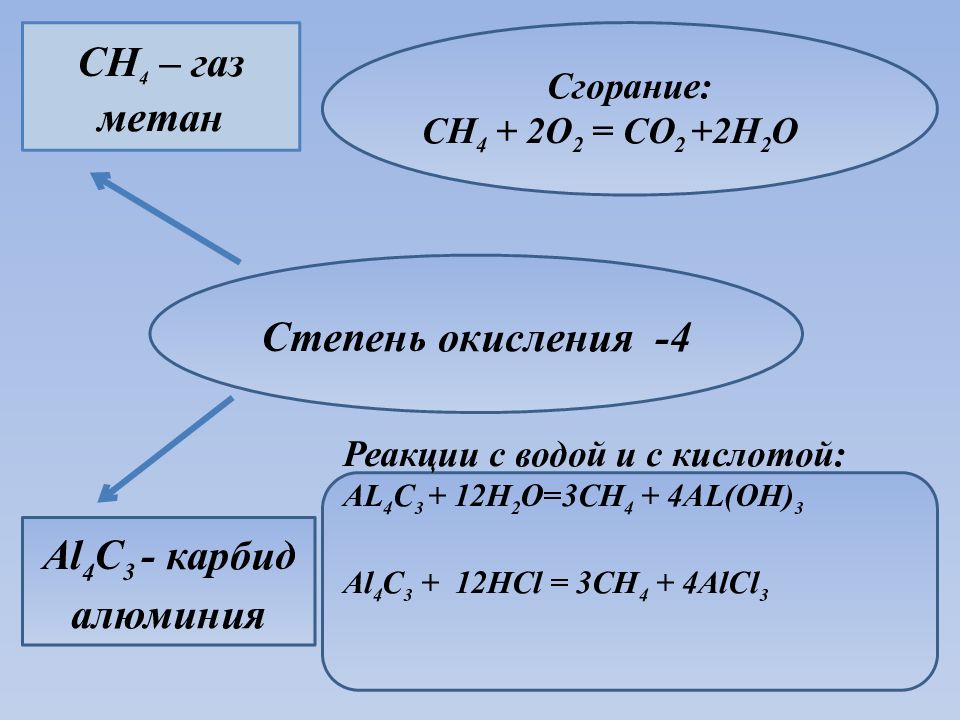
Степень окисления -4 CH 4 – газ метан Al 4 C 3 - карбид алюминия Сгорание: CH 4 + 2O 2 = CO 2 +2H 2 O Реакции с водой и с кислотой: AL 4 C 3 + 12H 2 O=3CH 4 + 4AL(OH) 3 Al 4 C 3 + 12HCl = 3CH 4 + 4AlCl 3
Слайд 16
Степень окисления +2 CO - угарный газ сильный яд, опасный для жизни и здоровья человека (несолеобразующий оксид)
Слайд 17
Степень окисления +4 H 2 CO 3 - угольная кислота Соли угольной кислоты ( например, K 2 CO 3 - карбонат калия) CO 2 - углекислый газ
Слайд 18
1.Реагирует с кислородом 2CO + O 2 =CO 2 2. Является восстановителем металлов из их оксидов ZnO + CO = Zn + CO 2 Химические свойства CO
Слайд 19
Химические свойства CO 2 - ( кислотный оксид ) 1.Реагирует с водой CO 2 + H 2 O = H 2 CO 3 2.Реагирует с основными оксидами CO 2 + CaO = CaCO 3 3. Реагирует с щелочами CO 2 + 2KOH = K 2 CO 3 + H 2 O 4.Реагирует с углеродом CO 2 + C = 2CO
Слайд 20
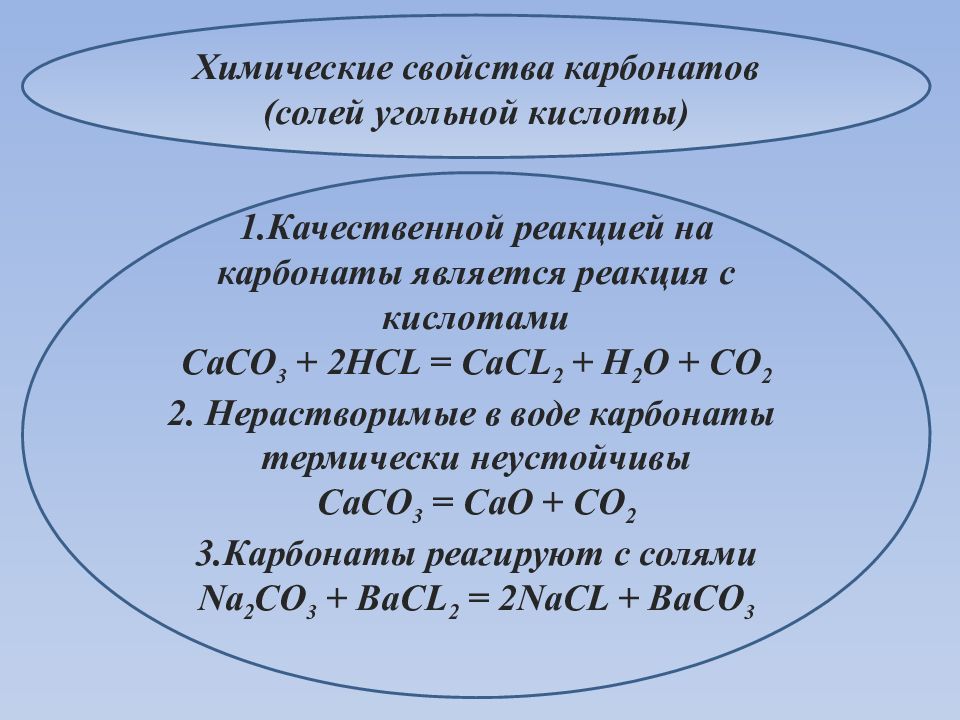
Химические свойства карбонатов ( солей угольной кислоты) 1.Качественной реакцией на карбонаты является реакция с кислотами CaCO 3 + 2HCL = CaCL 2 + H 2 O + CO 2 2. Нерастворимые в воде карбонаты термически неустойчивы CaCO 3 = CaO + CO 2 3. Карбонаты реагируют с солями Na 2 CO 3 + BaCL 2 = 2NaCL + BaCO 3
Слайд 21
Углекислотный огнетушитель Сухой лед (хладагент) Сода Моющие средства Лимонады Соединения углерода вокруг нас
Слайд 22
1. Конфигурация внешнего электронного уровня элементов подгруппы углерода: а) ns 2 np 2 б ) ns 2 np 3 в ) ns 2 np 4 г ) ns 1 np 2 2. Наиболее характерная валентность элементов подгруппы углерода: а) II б ) III в ) IV г ) V 3. Неметаллические свойства элементов подгруппы углерода в группе сверху вниз: а) уменьшаются б ) уменьшаются, затем возрастают в) возрастают г ) не изменяются
Последний слайд презентации: Углерод и его соединения
4. Углерод является: а) восстановителем б) восстановителем и окислителем в) окислителем г) не проявляет окислительно -восстановительных свойств 5. Атомную слоистую кристаллическую решетку имеет: а) алмаз б ) фуллерен в ) графит г) карбин 6. Наибольшей прочностью отличается кристаллическая решетка: а) атомная б ) ионная в) атомная слоистая г ) молекулярная 7. Наиболее химически активна аллотропная модификация углерода: а) алмаз б ) фуллерен в ) графит г ) карбин